
图1 SPI/MD 复合体系游离氨基含量(FAG)和接枝度(DG)
Fig.1 Free amino groups content and degree of graft for SPI/MD conjugate systems
蛋白质与多糖之间通过非酶缩合反应形成共价复合物,即美拉德反应,这种反应由于能增进产品的香气、 风味和颜色而对食品加工起重要作用[1]。美拉德反应是由蛋白质的非质子化氨基与还原糖的羰基缩合形成席夫碱,然后生成糖基胺重排产物[2]。接下来通过聚合反应、环化反应、烯醇化反应形成混合产物,在反应晚期阶段出现的深色聚合物即为类黑精。
蛋白质作为人体必需的营养物质,具有溶解性、发泡性、乳化性及凝胶性等多种功能特性,这对于食品加工非常重要[3]。通过美拉德反应发生糖基化作用是改善蛋白质功能性的一种有效途径,蛋白质与多糖通过糖基化作用形成的复合物具有良好的理化性质和功能特性,由于该反应不需要催化剂,并在可控的条件下获得所需的反应产物,所以作为新功能性材料应用于食品工业、 生物材料及医药科学等领域[4]。
近年来,关于糖基化复合物性质的研究很多,美拉德反应早期阶段形成的蛋白质/多糖复合物具有较好的乳化性、发泡性、溶解性和热稳定性,而晚期阶段形成的复合物具有良好抗氧化性、抗癌及抗诱变性[5]。然而,关于美拉德反应形成的蛋白质糖基化复合物酸诱导凝胶流变性和微观结构的研究较少。本试验采用湿热法通过美拉德反应制备大豆分离蛋白/麦芽糊精糖基化复合物,研究糖基化反应对大豆分离蛋白酸诱导凝胶流变性的影响,同时比较大豆分离蛋白/麦芽糊精复合体系和混合体系凝胶流变性及微观结构,为进一步了解蛋白质和多糖的相互作用及凝胶机制提供理论依据。
大豆分离蛋白(SPI),哈高科食品有限责任公司;麦芽糊精(MD),美国Sigma 公司。邻苯二甲醛(OPA)、β-巯基乙醇、十二烷基硫酸钠,美国Sigma公司;葡萄糖酸内酯(GDL),北京沃海环球科技有限公司;无水乙醇、四硼酸钠、盐酸等化学试剂均为分析纯级。
电热恒温水浴锅,余姚市东方电工仪器厂;pHS-3C 型酸度计,上海鹏顺科学仪器有限公司;LGJ-1 冷冻干燥机,上海医用离心机厂;紫外可见分光光度计,上海精密科学仪器有限公司;PE Pyris 6 差示扫描量热仪,美国PULUS TA.XT 公司;马尔文流变仪,英国马尔文仪器有限公司;S-3400N 型扫描电镜,日本日立公司。
1.3.1 SPI/MD 复合体系和混合体系的制备 基于美拉德反应原理,采用湿热法制备SPI/MD 复合体系。将SPI 分散到磷酸盐缓冲液(0.1 mol/L,pH 7.0)中,配制成60 mg/mL 的蛋白溶液,然后加入20 mg/mL 的MD,混合均匀配成SPI/MD 混合液。将混合液在室温下磁力搅拌2 h,然后在95 ℃水浴加热10,20,30,40,50 min,冰浴冷却至室温得SPI/MD 复合体系,分别用SPI/MD-C10、SPI/MDC20、SPI/MD-C30、SPI/MD-C40、SPI/MD-C50 表示。
将60 mg/mL 的SPI 溶液室温下磁力搅拌2 h,然后95 ℃水浴加热20,30,40 min,冰浴冷却后加入20 mg/mL 的MD,混匀后即得SPI/MD 混合体 系,分 别 用SPI/MD-M20、SPI/MD-M30、SPI/MD-M40 表示。对照组为不含MD 的SPI,进行同样的热处理 (95 ℃加热20,30,40 min),分别用SPI-20、SPI-30、SPI-40 表示。
1.3.2 游离氨基含量(FAG)和接枝度(DG)的测定 将80 mg 的OPA 溶解在2 mL 95%的乙醇中,并与50 mL 10 mmol/L 的四硼酸钠缓冲液(pH 9.7)、5 mL 20%(w/w)的SDS 以及200 μL 的β-巯基乙醇混合,充分混匀后用蒸馏水稀释至100 mL配成OPA 试剂。将200 μL 的复合体系样品溶液(2 mg/mL)与4 mL 的OPA 试剂在室温下反应5 min,然后采用紫外可见分光光度计测定340 nm下的吸光度,以天然SPI 作为对照样 (FAG 为100%),样品的FAG 和DG 的计算公式如下:
FAG(%)=As/Ac×100%
DG(%)=(Ac-As)/Ac×100%
式中:Ac——对照样的吸光度;As——样品的吸光度。
1.3.3 热性质的测定 采用PE Pyris 6 差示扫描量热仪对样品的热性质进行分析。取10 μL 样品溶液放入铝盒中密封,以5 ℃/min 的升温速率由20 ℃加热到120 ℃,采用空铝盒作为对照。记录此过程的吸热峰温度(Tp)和热焓值(ΔH)。
1.3.4 酸诱导凝胶的制备 向制得的SPI/MD 复合体系或混合体系中添加质量分数0.6%的GDL,25 ℃下酸化5 h,然后4 ℃冷藏过夜得到酸诱导凝胶。对照组为不含MD 的SPI 酸诱导凝胶。
1.3.5 pH 的测定 在不同的酸化时间下,采用pHS-3C 型酸度计对样品溶液的pH 进行测定。
1.3.6 凝胶流变性的测定 采用马尔文流变仪对凝胶流变性进行测定。向SPI/MD 复合体系或混合体系中添加质量分数0.6%的GDL,混匀后置于流变仪平板间,设定平板间距为1 000 μm,频率为1 Hz,应变为0.1%,25 ℃下酸化5 h,进行时间扫描,记录整个酸化过程中样品储能模量(G′)及损耗模量(G″)的变化。初始应变扫描试验显示流变性的测定在凝胶线性黏弹区域内。时间扫描后再对凝胶进行频率扫描,扫描范围0.01~10 Hz,记录储能模量(G′)随频率变化趋势。
1.3.7 凝胶微观结构观察 取一定量的凝胶样品,加入戊二醛溶液固定后冷冻,用磷酸缓冲液冲洗,然后分别用30%,50%,70%,90%,100%的乙醇进行脱水10 min,按100%乙醇∶叔丁醇=1∶1 脱水10 min,纯叔丁醇脱水10 min,然后冻干。将冻干样进行离子溅射喷金镀膜后置于扫描电镜观察台上进行微观结构观察。电镜加速电压为10 kV,放大倍数为3 000 倍。
1.3.8 统计分析 采用统计学软件SPSS17.0 对试验数据进行统计分析,采用Origin8.5 软件作图。
美拉德反应发生在蛋白质的ε-氨基和多糖的还原羰基之间,游离氨基的量化分析能够评价美拉德反应进程。图1为SPI/MD 复合体系游离氨基含量(FAG)和接枝度(DG),与对照组天然SPI(FAG 为100%)相比,加入MD 后,复合体系的FAG 显著降低。多糖的还原羰基和蛋白质的游离氨基之间通过共价结合的方式发生美拉德反应,能够降低FAG[6],这表明蛋白质和多糖之间发生了糖基化反应。随着热处理时间的延长,SPI/MD 复合体系的FAG 逐渐降低,DG 逐渐升高,这表明长时间反应会使SPI 与更多的MD 发生糖基化反应,进而提高美拉德反应进程。当热处理时间超过40 min 后,SPI/MD 复合体系的DG 略有降低,这可能与复合物的结构变化或降解有关[7]。因此,选择热处理时间为20~40 min 进行后续试验。
差示扫描量热法(DSC)可以直接测量在一定温度升高或降低过程中所引起的糖复合物的热量变化[8],这包括热转变点处的吸热峰温度(Tp)和热变性引起的焓变(ΔH)。
表1为SPI 和SPI/MD 复合体系热力学参数。由表1可以看出,与天然SPI 相比,热处理SPI 的Tp 几乎没有改变,但SPI/MD 复合体系的Tp 显著增加,这表明热处理不会改变SPI 的变性温度,而SPI 与MD 发生糖基化反应后会提高蛋白质的变性温度,使复合体系的热稳定性增加,Medrano 等[9]在对β-乳球蛋白/葡萄糖或乳糖复合体系的研究中也得到了相似的结果。随着热处理时间的延长,SPI/MD 复合体系的Tp 进一步增加,这表明延长热处理时间会进一步提高复合体系的热稳定性,这可能与较高的接枝度有关(图1)。

图1 SPI/MD 复合体系游离氨基含量(FAG)和接枝度(DG)
Fig.1 Free amino groups content and degree of graft for SPI/MD conjugate systems
在95 ℃热处理条件下,SPI 的ΔH 随着热处理时间的延长而降低,SPI/MD 复合体系的ΔH 与热处理SPI 的变化趋势相似,这可能与SPI 的折叠或聚集状态有关。ΔH 的降低表明95 ℃热处理20~40 min 会使SPI 和SPI/MD 复合体系中蛋白质变性。此外,SPI 与MD 发生共价结合,可能使SPI/MD 复合体系丢失部分二级结构,如α-螺旋含量降低,这也是导致ΔH 降低的原因[10]。
表1 SPI 和SPI/MD 复合体系热力学参数
Table 1 Thermodynamic parameters for SPI and SPI/MD conjugate systems

样品7S 11S Tp/℃ ΔH/J·g-1 Tp/℃ ΔH/J·g-1天然SPI 73.21±2.16b 2.54±0.28a 89.64±2.86b 5.64±0.42a SPI-20 72.66±1.89ab 1.64±0.31b 88.96±1.99ab 3.87±0.30b SPI-30 73.30±2.34b 1.12±0.19c 89.78±3.14b 2.14±0.35c SPI-40 71.93±2.23a 1.07±0.20c 88.24±2.50a 1.89±0.28cd SPI/MD-C20 75.64±2.13c 1.50±0.25b 91.27±3.14c 3.24±0.26b SPI/MD-C30 77.88±1.68d 1.18±0.21c 92.89±3.14d 2.20±0.31c SPI/MD-C40 78.04±2.45d 1.03±0.16c 93.14±3.14d 1.67±0.24d
图2为60 mg/mL SPI 溶液95 ℃热处理30 min 后的酸诱导凝胶曲线。由图2可以看出,随着酸化时间的延长,在最初的1 h 内pH 急剧下降,在3 h 后pH 的变化趋于稳定,最终达到大豆蛋白的等电点4.46(±0.03)。SPI/MD 复合体系和混合体系(数据未给出)与SPI 体系的酸化过程中pH 下降的趋势相似,Lazaridou 等[11]对脱脂乳/β-葡聚糖体系的研究中也得到了同样的结果。此外,在酸化过程中,起始G′<G″,随着酸化时间的延长,G′和G″快速增加,且G′比G″增加得快,当G′=G″时到达了凝胶点;随后G′和G″进一步增加且G′>G″,最终G′和G″曲线趋于稳定。这表明随着体系pH值逐渐下降至蛋白质等电点,分子结构发生重排,通过蛋白质分子间的相互作用使结合加剧,最终形成一个稳定的弹性凝胶结构[12]。
图3为SPI/MD 复合体系和混合体系酸诱导凝胶储能模量G′的变化。由图3可以看出,SPI/MD 复合体系和混合体系凝胶G′的变化趋势与SPI 凝胶非常相似,都是随着酸化时间的延长,先快速增加,然后平稳到达一定数值。然而,混合体系凝胶的G′高于SPI 凝胶,而复合体系凝胶的G′低于SPI 凝胶。此外,与SPI 凝胶相比,复合体系凝胶的G′增加得较晚,而混合体系凝胶G′增加得较早,这说明SPI/MD 混合体系凝胶形成得最快,而复合体系凝胶形成得最慢,即延长凝胶时间,这可能与SPI 结合MD 后引起变性温度的上升有关[13],DSC 的研究结果(表1)也证实了SPI 与MD共价结合后会导致变性温度上升。
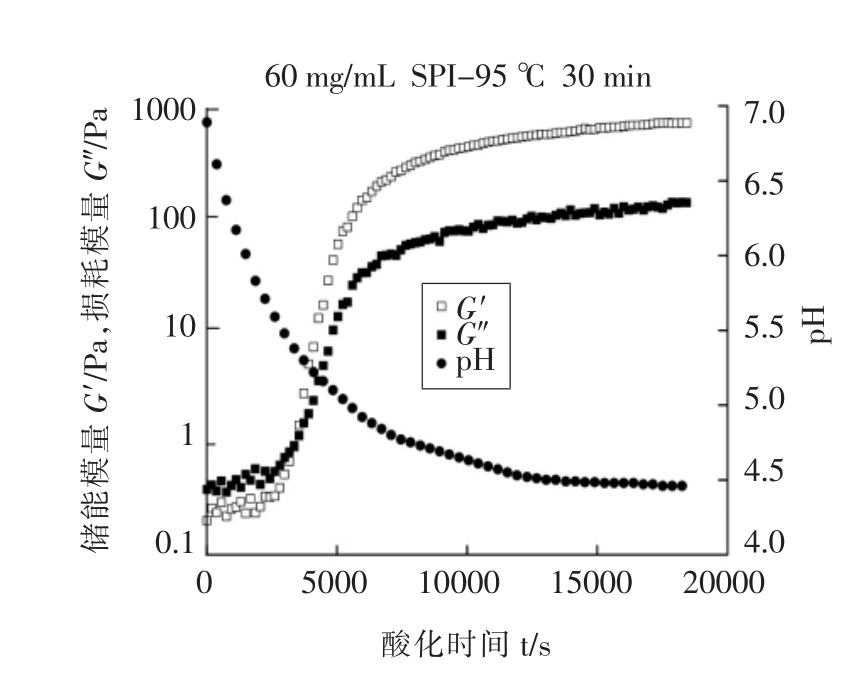
图2 SPI 酸诱导凝胶曲线
Fig.2 SPI acid-induced gel curve
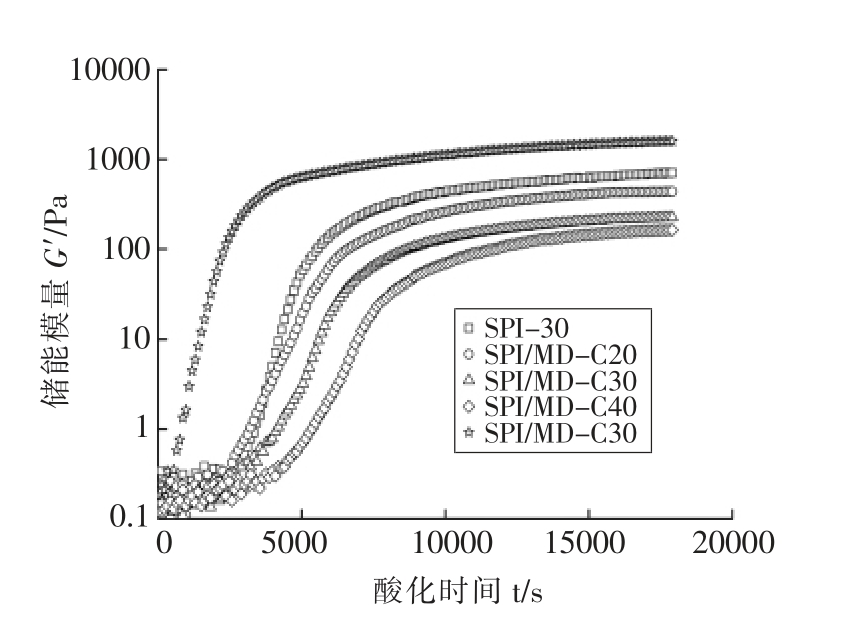
图3 SPI/MD 复合体系和混合体系酸诱导凝胶储能模量G′的变化
Fig.3 Changes for storage modulus G′ of acid-induced gel of SPI/MD conjugate and mixture systems
图4为SPI/MD 复合体系和混合体系酸化5 h 后储能模量G′。由图4可以看出,SPI 酸诱导凝胶的G′不受热处理时间的影响,这是由于95 ℃下热处理已经使SPI 完全变性(表1),热处理时间不会影响变性蛋白的凝胶G′,这与Martinez 等[14]的研究结果一致。SPI/MD 混合体系凝胶的G′随着热处理时间的变化趋势与SPI 凝胶相似,这说明MD的混入不会影响SPI 的变性程度。
对于SPI/MD 混合体系凝胶来说,其G′值明显高于SPI 体系凝胶和SPI/MD 复合体系凝胶,这表明MD 能够增强凝胶网络,这意味着添加MD可以提高蛋白质的胶凝作用,这与Pan 等[15]在对大豆分离蛋白/海藻酸钠混合凝胶研究中得到的结果相似。Spotti 等[16]对凝胶的机械性能进行研究,发现乳清蛋白/葡聚糖混合凝胶的破裂压力比未添加葡聚糖的乳清蛋白凝胶大,这可能与两种聚合物之间发生相分离作用有关,由于混合分离现象引起的熵值降低,通常导致蛋白质和多糖混合体系凝胶G′的增加。此外,蛋白质形成的连续相可以容纳多糖链来填充蛋白质网络,这也是导致凝胶强度增加的一个原因[17]。
对于SPI/MD 复合体系凝胶来说,其G′最小,表现为弱凝胶性。SPI/MD 复合体系凝胶G′的降低可能是由于聚合动力学的改变,从根本上改变了胶凝机制[18]。很多因素会导致复合体系凝胶的弱化,MD 的共价结合与热处理会影响SPI 的天然结构(表1),由于蛋白质的二级结构和巯基含量发生改变,导致共价相互作用不能起到很好的支撑凝胶网络的作用。此外,美拉德反应晚期阶段形成的聚合物可能会阻碍SPI/MD 复合体系的凝胶形成[19]。
随着热处理时间的增加,SPI/MD 复合体系凝胶G′逐渐降低,这可能是由于延长热处理时间会促进美拉德反应,提高接枝度(图1),使体系结构进一步改变,同时加强复合体系的热稳定性(表1),导致凝胶网络的弱化,这与Spotti 等[20]的研究结果一致,即提高糖基化反应程度会弱化复合体系凝胶结构。
图5为SPI、SPI/MD 复合体系和混合体系酸诱导凝胶的扫描电镜图。由图5可以看出,SPI 酸诱导凝胶的空间结构不均一,有不规则的孔洞,这与Hu 等[21]在SPI 酸诱导凝胶微结构研究中观察到的现象相似。与SPI 酸诱导凝胶相比,SPI/MD复合体系形成的酸凝胶空间结构更加疏松,孔洞更大;而SPI/MD 混合体系形成的酸凝胶空间结构更加致密、均一,孔洞明显变小,蛋白质间的交联度明显增大。有研究显示,与多糖接枝后,由于亲水性的增加,会减少蛋白质加热过程中疏水残基的暴露[22],这不利于通过分子间疏水相互作用而形成更加致密和均匀的凝胶结构。凝胶微观结构分析与本文中凝胶流变性的研究结果一致,再次印证了糖基化会降低SPI 酸诱导凝胶的强度,而SPI 与多糖混合体系能够形成高强度、均匀、致密的凝胶网络。
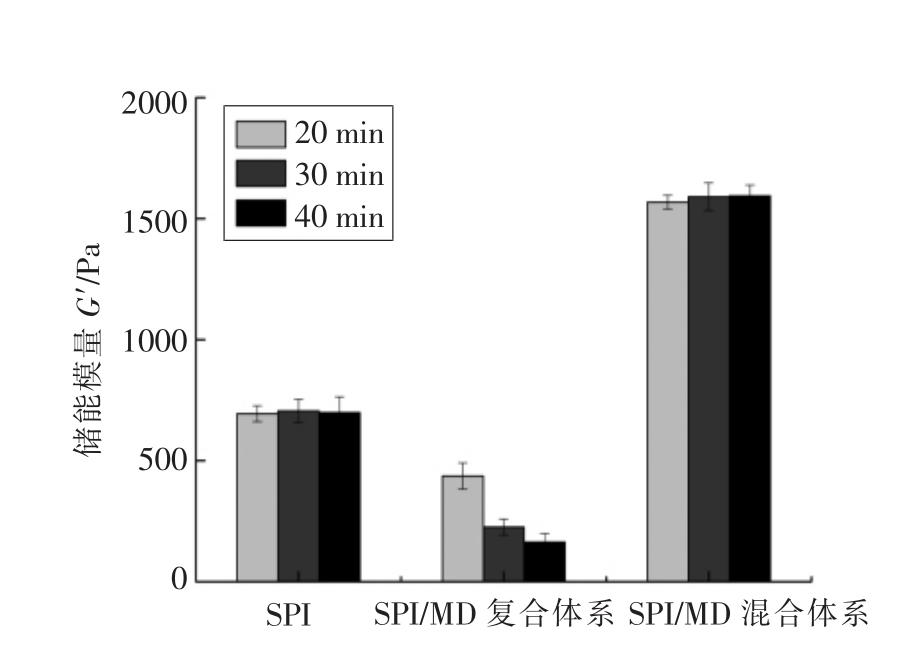
图4 SPI/MD 复合体系和混合体系酸化5 h 后储能模量G′
Fig.4 Storage modulus G′ of SPI/MD conjugate and mixture systems after acidification for 5 h

图5 SPI、SPI/MD 复合体系和混合体系酸诱导凝胶的扫描电镜图
Fig.5 Scanning electron micrographs of acid-induced gel for SPI,SPI/MD conjugate and mixture systems
大豆分离蛋白(SPI)与麦芽糊精(MD)通过湿热法制成SPI/MD 复合体系,研究了糖基化反应时间对SPI 酸诱导凝胶流变性的影响,同时对SPI/MD 复合体系和混合体系凝胶流变性和微观结构进行比较。游离氨基含量和接枝度测定结果表明,蛋白质和多糖之间发生了糖基化反应,长时间热处理会使SPI 与更多的MD 发生糖基化反应。热性质分析结果显示,SPI 与MD 共价结合会使体系结构发生明显改变,SPI/MD 复合体系的Tp 增加且ΔH 降低,表明体系的热稳定性增加。凝胶流变性结果表明,SPI/MD 复合体系凝胶时间显著增加,凝胶G′显著降低,随着热处理时间的延长,凝胶G′的降低趋势越明显,这可能是由于MD 的共价结合引起SPI 结构的改变,使共价相互作用不能够很好地支撑凝胶网络,导致SPI/MD 复合体系凝胶的弱化。SPI/MD 混合体系凝胶G′显著增加,这是由于两种高分子聚合物之间的相分离作用导致的。凝胶微观结构结果再次印证了糖基化会降低SPI 酸诱导凝胶的强度,而SPI 与多糖混合体系能够形成高强度、均匀、致密的凝胶网络。
[1]GOLOBERG T,CAI W,PEPPA M,et al.Advanced glycoxidation end products in commonly consumed foods[J].Journal of the American Dietetic Association,2004,104(8):1287-1291.
[2]MILLER A,GERRARD J.The Maillard reaction and food protein crosslinking[J].Progress in Food Biopolymer Research,2005,1(5):69-86.
[3]布冠好,张楠,陈复生.大豆蛋白-木糖复合物的抗原性、 致敏性及结构特性研究[J].现代食品科技,2015,31(11):33-38.
[4]OLIVER C M,MELTON L D,STANLEY R A.Creating protein with novel functionality via the Maillard reaction:a review[J].Critical Review in Food Science and Nutrition,2006,46(4):337-350.
[5]EINHORN-STOLL U,ULBRICH M,SEVER S,et al.Formation of milk protein pectin conjugates with improved emulsifying properties by controlled dry heating[J].Food Hydrocolloids,2005,19(2):329-340.
[6]HILLER B,LORENZEN P C.Functional properties of milk proteins as affected by Maillard reaction induced oligomerisation[J].Food Research International,2010,43(4):1155-1166.
[7]NIU L Y,JIANG S T,PAN L J,et al.Characteristics and functionalproperties of wheat germ protein glycated with saccharides through Maillardreaction[J].International Journal of Food Science & Technology,2011,46(10):2197-2203.
[8]LIU J,RU Q,DING Y.Glycation a promising method for food protein modification:physicochemical properties and structure,a review[J].Food Research International,2012,49(1):170-183.
[9]MEDRANO A,ABIRACHED C,PANIZZOLO L,et al.The effect of glycation on foam and structural properties of β-lactoglobulin[J].Food Chemistry,2009,113(1):127-133.
[10]HATTORI M,NAGASAWA K,AMETANI A,et al.Functional changes in β-lactoglobulin by conjugation with carboxymethyl dextran[J].Journal of Agricultural and Food Chemistry,1994,42(10):2120-2125.
[11]LAZARIDOU A,VAIKOUSI H,BILIADERIS C G.Impact of mixed-linkage (1-3,1-4)β-glucans on physical properties of acid-set skim milk gels[J].International Dairy Journal,2008,18(3):312-322.
[12]ROEFS S P F M,DE GROOT-MOSTERT A E A,VAN VLIET T.Structure of acid casein gels.1.Formation and model of gel network[J].Colloids and Surfaces,1990,50(11):141-159.
[13]ZHU D,DAMODARAN S,LUCEY J A.Physicochemical and emulsifying properties of whey protein isolate (WPI)-dextran conjugates produced in aqueous solution [J].Journal of Agricultural and Food Chemistry,2010,58(5):2988-2994.
[14]MARTINEZ M J,FARÍAS M E,PILOSOF A M R.The dynamics of heat gelation of casein glycomacropeptide-β-lactoglobulin mixtures as affected by interactions in the aqueous phase[J].International Dairy Journal,2010,20(9):580-588.
[15]PAN H,XU X,TIAN Y,et al.Impact of phase separation of soy protein isolate/sodium alginate coblending mixtures on gelation dynamics and gels properties[J].Carbohydrate Polymers,2015,125(7):169-179.
[16]SPOTTI M J,PERDUCA M,PIAGENTINI A,et al.Gel mechanical properties of milk whey proteinedextran conjugates obtained by Maillard reaction[J].Food Hydrocolloids,2013,31(1):26-32.
[17]TAVARES C,MONTEIRO S R,MORENO N,et al.Does the branching degree of galactomannans influence their effect on whey protein gelation[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects,2005,270(12):213-219.
[18]SUN W,YU S,YANG X,et al.Study on the rheological properties of heat-induced whey protein isolateedextran conjugate gel[J].Food Research International,2011,44(10):3259-3263.
[19]XU C,YANG X,YU J,et al.The effect of glycosylation with dextran chains of differing lengths on the thermal aggregation of β-conglycinin and glycinin[J].Food Research International,2010,43(9):2270-2276.
[20]SPOTTI M J,MARTINEZ M J,PILOSOF A M R,et al.Rheological properties of whey protein and dextran conjugates at different reaction times[J].Food Hydrocolloids,2014,38(7):76-84.
[21]HU H,FAN X,ZHOU Z,et al.Acid-induced gelation behavior of soybean protein isolate with high intensity ultrasonic pre -treatments [J].Ultrasonics Sonochemistry,2013,20(1):187-195.
[22]MU L,ZHAO M,YANG B,et al.Effect of ultrasonic treatment on the graft reaction between soy protein isolate and gum acacia and on the physicochemical properties of conjugates[J].Journal of Agri cultural and Food Chemistry,2010,58(7):4494-4499.
Effect of Glycation Reaction on Rheological Property and Microstructure of Acid-Induced Gels Formed by Soybean Protein Isolate/Maltodextrin Systems