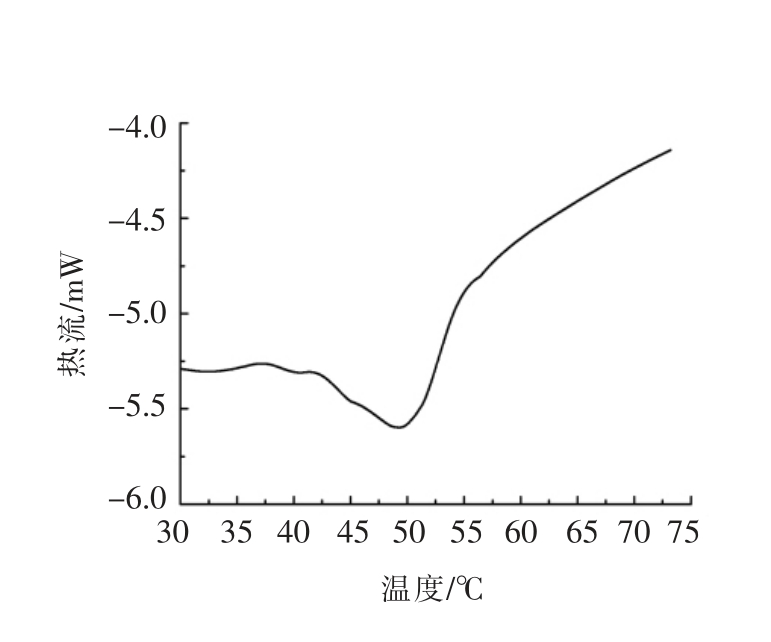
图1 羊骨胶原蛋白热稳定性
Fig.1 Thermostability of sheep bone collagen
胶原蛋白是细胞外基质的主要结构蛋白,主要存在于动物皮、骨、软骨和肌腱等结缔组织中,约占动物总蛋白的30%左右[1-2]。胶原蛋白由3 条各自呈左手螺旋的α 链组成,相互之间通过氢键结合成右手超螺旋结构。在三螺旋结构域内,氨基酸序列呈(Gly-X-Y)n 周期性排列,其中X、Y 位置多为脯氨酸 (Pro,28%)和羟脯氨酸(Hyp,38%)[1,3]。
胶原蛋白三螺旋结构对热敏感,加热时螺旋区解旋,3 条肽链彼此分开,其理化和生物学特性随之改变。胶原蛋白的热稳定性是影响其开发与应用的主要因素,也是一直以来的研究热点和难点。研究人员利用红外光谱、圆二色谱、差示扫描量热仪和原子力显微镜等手段,从多个结构层次上对胶原蛋白的热稳定性进行研究[1,4-6],并结合相关光谱技术对脱水加热下胶原蛋白的结构变化规律进行阐释。Tian 等[7]利用二维红外光谱研究发现戊二醛交联胶原蛋白的热稳定性显著提高。肖和兰等[8]采用二维红外相关分析发现,升温过程中胶原蛋白的二级结构变化顺序为:-CH->酰胺I>酰胺II>酰胺III>-CH2-。Anna Pielesz[9]利用红外光谱分峰拟合研究发现岩藻多糖对其热稳定性具有保护作用。
食品中,胶原蛋白主要应用于溶液环境下,与水分子结合产生胶凝、保水等效果。然而,溶液状态下热处理对胶原蛋白结构变化规律的影响尚缺乏研究报道。本文以羊骨胶原蛋白为原料,采用傅里叶变换红外光谱,结合分峰拟合和二维相关分析,对不同温度处理后水溶液中的胶原蛋白结构变化进行分析。
羊骨购买自内蒙古锡林郭勒盟额尔敦肉类食品有限公司;胃蛋白酶购自美国Amresco 公司;所用化学试剂均为分析纯。
冻干机,北京四环科学仪器厂有限公司LGJ-25 型;差示扫描量热仪,美国Inc TA InstrumentsQ-200 Series;烘箱,宁波江南仪器厂;水浴锅,上海精宏实验设备有限公司;红外光谱仪,德国Bruker Tensor 27。
骨胶原蛋白提取方法参考Li 等人[2]的方法,稍作修改。新鲜乌珠穆沁羊骨购买自内蒙古锡林郭勒盟,-20 ℃保存。清洗破碎后,进行除杂蛋白、脱脂和脱钙处理。采用胃蛋白酶-乙酸法提取羊骨胶原蛋白,通过盐析和透析纯化并冻干得到酶溶性羊骨胶原蛋白。
准确称取一定量胶原蛋白放于差示扫描量热仪(DSC)坩埚中,从25 ℃加热至75 ℃,升温速率为5 ℃/min。
脱水干燥加热。将胶原蛋白冻干品分成9 组,每组3 份。每组分别置于25~105 ℃烘箱中加热30 min,ΔT=10 ℃。室温冷却后,采用红外光谱ATR 法进行测定,扫描波数范围为4 000~500 cm-1,分辨率为2 cm-1,扫描信号累加32 次,以空气为空白。
水溶液中加热。将胶原蛋白冻干品溶于蒸馏水中,质量浓度为4 mg/mL,搅拌均匀,分成8 组,每组3 份。每组分别置于25~95 ℃水浴中加热30 min,ΔT=10 ℃。室温冷却后,采用红外光谱ATR法进行测定,以蒸馏水为空白。
参考倪娜[10]、Andreas Barth[11]、Shudong He[12]等人的研究,使用Peaktit 4.12 软件对胶原蛋白在1 600~1 700 cm-1(酰胺I 带)波长范围内的图谱进行分峰拟合,根据各子峰的峰位归属,计算各二级结构(α-螺旋、β-折叠、β-转角、无规则卷曲)的相对百分含量。
采用2D Shige 软件(KwanseiGakuin)绘制以等高线表征的二维相关图谱。根据二维相关分析读谱规则[7]确定各基团响应顺序。
天然胶原蛋白分子呈棒状,具有典型的三螺旋结构。胶原蛋白的三螺旋结构对热敏感,加热易导致三螺旋结构域内的氢键断裂,三肽链解旋,天然构象被破坏[5]。胶原蛋白热变性温度是指三螺旋结构解旋50%时的温度,是反映其天然螺旋结构的一项重要指标。如图1所示,本研究提取的胶原蛋白热变性温度为49.97 ℃,说明其保留了完整的三螺旋结构。
2.2.1 脱水加热下羊骨胶原蛋白二级结构变化如图2所示,羊骨胶原蛋白具有I 型胶原蛋白红外光谱的特征吸收峰,即酰胺I、II 和III 吸收峰。酰胺I 区域(1 600~1 700 cm-1)是多肽骨架上C=O伸缩振动导致的,并且很难被侧链构象所影响,因此,酰胺I 区域常被用来分析蛋白质的二级结构组成[11-12]。酰胺II 区域(1 550~1 600 cm-1)为N-H弯曲振动(40%~60%)和C-N 伸缩(18%~40%)[11]。酰胺III 区域(1 200~1 400 cm-1)的构成相对复杂,与胶原蛋白分子间的相互作用有关,涉及C-N 伸缩振动、酰胺键中N-H 键的面内弯曲以及甘氨酸主链和脯氨酸侧链上CH2 基团的摇摆振动[1]。随温度升高,胶原蛋白的主要红外吸收峰均向短波方向迁移,酰胺I 变化最为显著。25~95 ℃,酰胺I 向短波方向迁移8 cm-1,表明加热破坏了羊骨胶原蛋白的二级结构。此外,1 454 cm-1 处的吸收峰蓝移至1 452 cm-1 处。当温度继续升高至105 ℃时,1 454,1 338,1 238 cm-1 处的吸收峰分别蓝移至1 448,1 336,1 236 cm-1 处,这可能是由于升温至105 ℃时胶原蛋白发生了交联[13]。表1为胶原蛋白在波长1 234 和1 452 cm-1 处吸收峰吸光度的比值。通常当两处吸收峰的吸光度比值接近于1.0时,说明胶原蛋白的三螺旋结构保持完整[7]。随着温度升高,胶原蛋白在波长1 234 和1 452 cm-1 处吸收峰吸光度的比值从1.04 逐渐降低到0.87,说明随着温度升高,胶原蛋白的三螺旋结构的完整性被破坏、三螺旋结构发生解旋。

图1 羊骨胶原蛋白热稳定性
Fig.1 Thermostability of sheep bone collagen
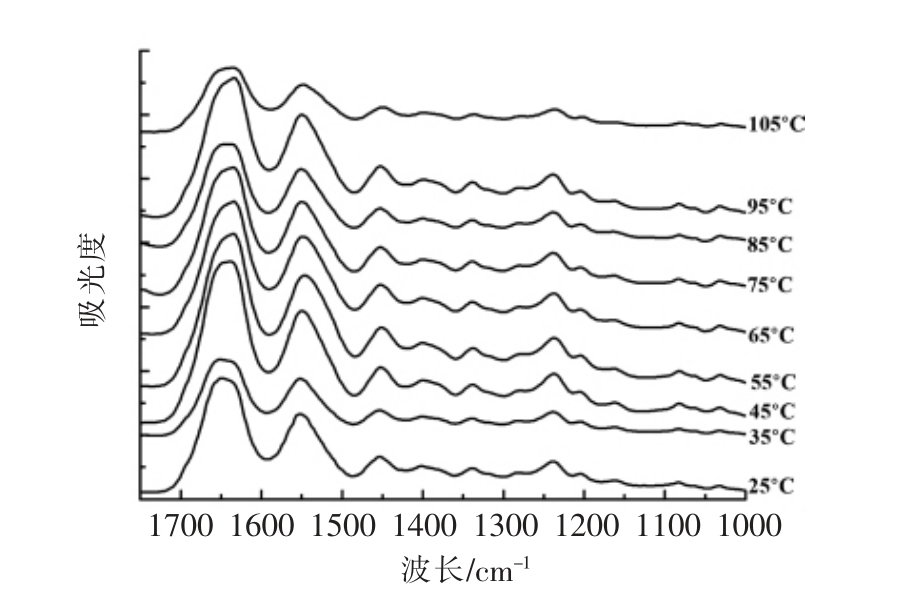
图2 脱水加热下羊骨胶原蛋白在1000~1700 cm-1波长范围内的红外吸收光谱
Fig.2 Temperature-dependent FTIR spectra in the region of 1700-1000 cm-1 of sheep bone collagen by dehydrothermal treatment
表1 加热对羊骨胶原蛋白I(1234/1452)的影响
Table 1 The effect of heat treatment on I(1234/1452) of sheep bone collagen
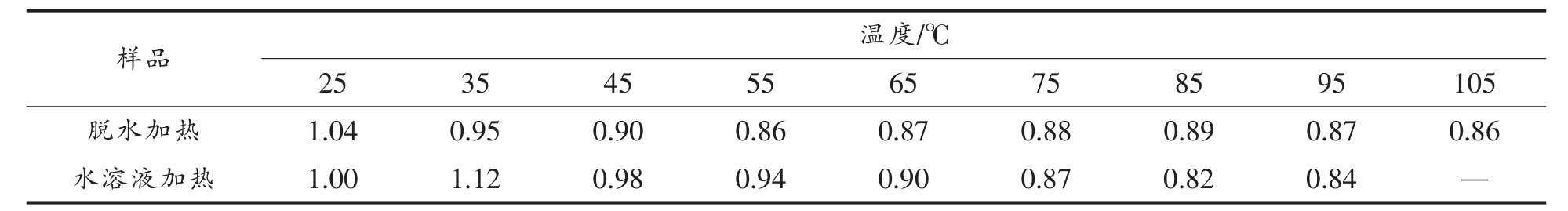
样品 温度/℃25 35 45 55 65 75 85 95 105脱水加热 1.04 0.95 0.90 0.86 0.87 0.88 0.89 0.87 0.86水溶液加热 1.00 1.12 0.98 0.94 0.90 0.87 0.82 0.84 —
如图3所示,随温度升高,胶原蛋白酰胺I 区域的主要子吸收峰(1 660 cm-1)吸收强度减小,分裂成多个子吸收峰,表明1 660 cm-1 处对应的α-螺旋结构逐渐减少。当温度升高至55 ℃时,波长1 644 cm-1 处出现子吸收峰,并随温度继续升高,吸收强度逐渐增强,表明1 644 cm-1 处对应的无规则卷曲结构逐渐增加,这与钟朝辉等人[14]的研究结果一致。如图4所示,随温度升高,胶原蛋白二级结构中α-螺旋(1 650~1 660 cm-1)相对百分含量从 63.75% 降低到20.38%,β-折叠(1 600~1 640 cm-1 和1 680~1 699 cm-1)从36.12% 增加到46.66%,β-转角(1 660~1680 cm-1)从0.13% 增加到9.95%,无规则卷曲(1 640~1 650 cm-1)从0%增加到23.01%。α-螺旋含量逐渐降低,β-折叠和β-转角含量先增加后减少,无规则卷曲含量逐渐增加,说明胶原蛋白分子结构逐渐舒展,α-螺旋首先转变为β-折叠和β-转角,进而变成无规则卷曲,分子无序性增大。

图3 脱水加热下羊骨胶原蛋白酰胺I 区域分峰拟合
Fig.3 Curve-fitting results of amide I band of sheep bone collagen by dehydrothermal treatment
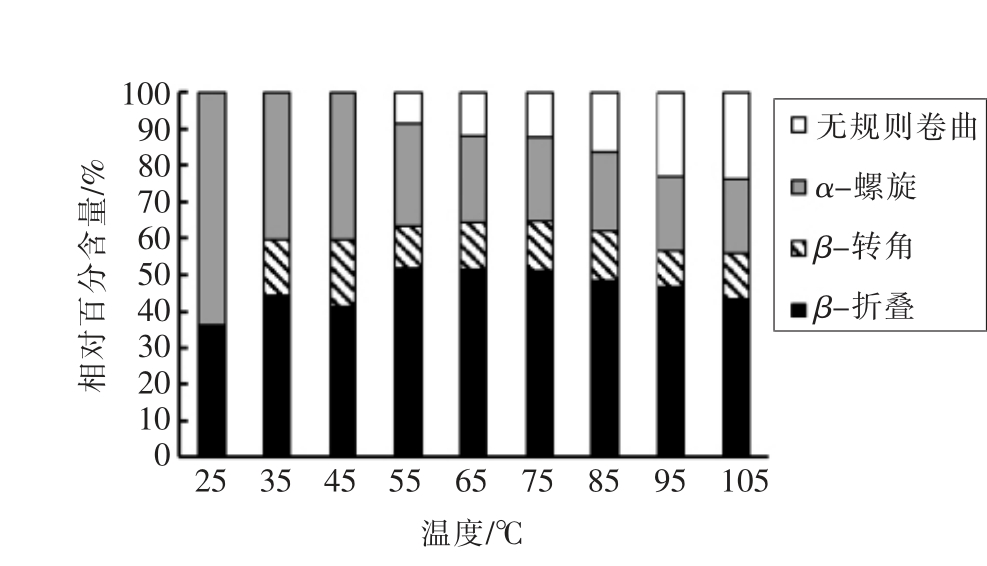
图4 脱水加热下羊骨胶原蛋白二级结构相对
百分含量变化
Fig.4 Changes of secondary structure of sheep bone
collagen by dehydrothermal treatment
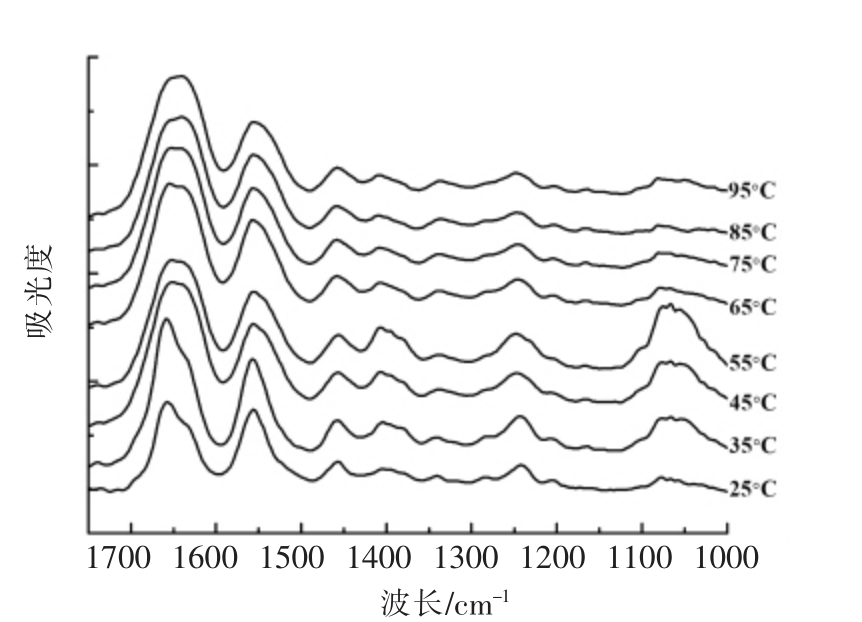
图5 水溶液加热下胶原蛋白在1 700~1 000 cm-1波长范围内的红外吸收光谱
Fig.5 Temperature-dependent FTIR spectra in the region of 1 700-1 000 cm-1 of collagen by aqueous heating
2.2.2 水溶液加热下羊骨胶原蛋白二级结构变化 图5所示为水溶液加热下羊骨胶原蛋白红外吸收光谱图。与脱水加热类似,随温度升高,胶原蛋白的主要红外吸收峰发生迁移。随温度升高,水溶液中胶原蛋白酰胺I 区域最大吸收峰从1 660 cm-1蓝移至1 641 cm-1,波长减小19 cm-1,1 340 cm-1 处最大吸收峰蓝移至1 336 cm-1,波长减小4 cm-1。然而,酰胺III 区域最大吸收峰红移了5 cm-1,迁移至1 247 cm-1,波长1 076,1 404 和1 456 cm-1 处吸收峰红移至1 080,1 407 和1 458 cm-1。与脱水加热相比,水溶液加热下胶原蛋白主要吸收峰的迁移幅度更大,说明水溶液状态下胶原蛋白更容易发生变性。如表1所示,随温度升高,水溶液加热下胶原蛋白在1 240 cm-1 和1 455 cm-1 处最大吸收峰吸光度的比值从1.00 逐渐降低到0.84,说明随温度升高,胶原蛋白的三螺旋结构被破坏。
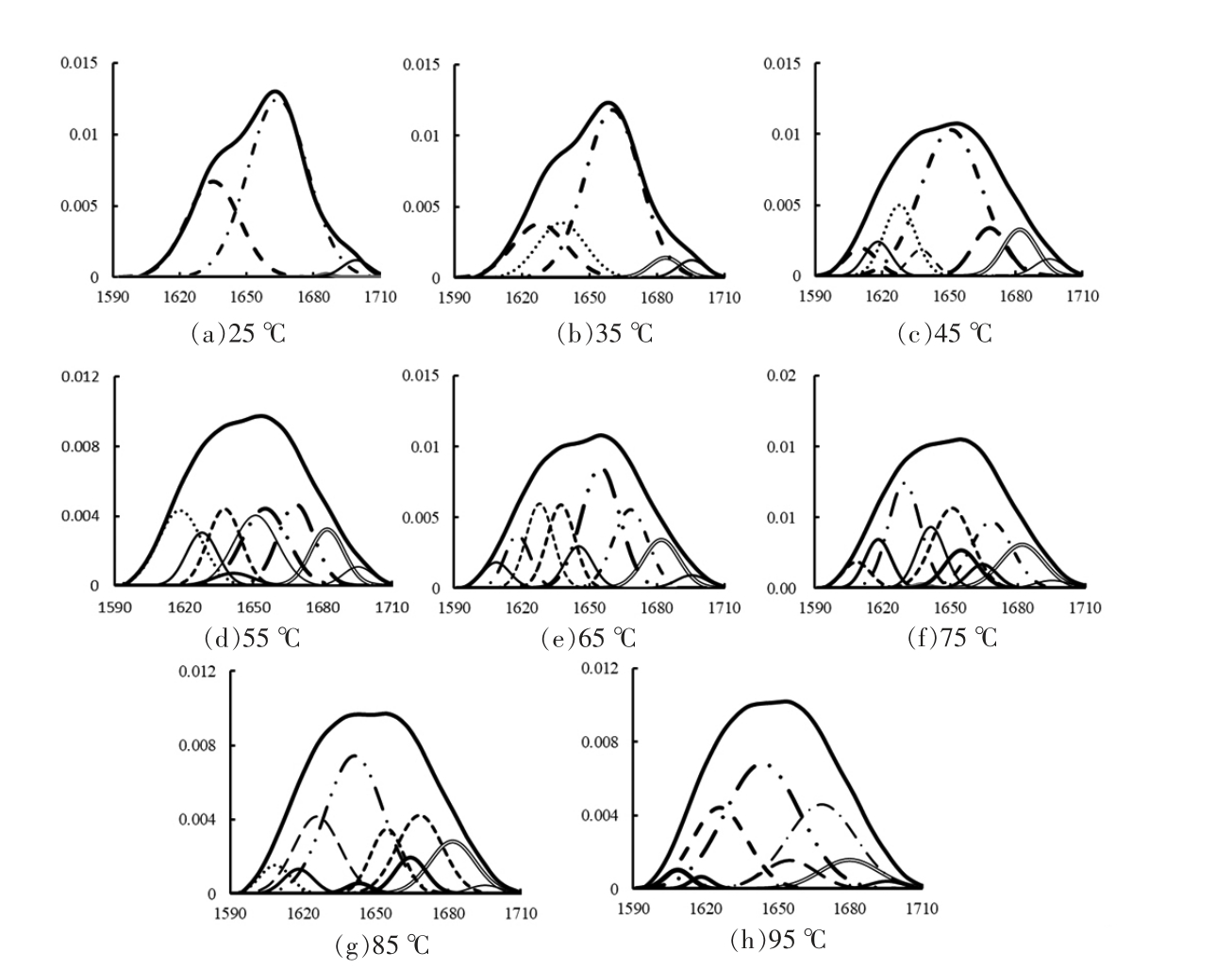
图6 水溶液加热下胶原蛋白酰胺I 区域分峰拟合
Fig.6 Curve-fitting results of amide I band of collagen by aqueous heating
如图6所示,与脱水加热下类似,随温度升高,水溶液加热下胶原蛋白在酰胺I 区域的主要子吸收峰(1 660 cm-1)吸收强度减小,逐步分裂成多个子吸收峰。如图7所示,水溶液加热下,胶原蛋白的α-螺旋相对百分含量从65.67%降低到6.28%%,β-折叠从33.51%减小到22.88%,β-转角从0.82%增加到31.47%,无规则卷曲从0%增加到39.37%。胶原蛋白二级结构相对百分含量的变化趋势与脱水加热下相同:α-螺旋含量逐渐降低,β-折叠和β-转角含量先增加后减少,无规则卷曲含量逐渐增加,说明胶原蛋白分子结构逐渐舒展,α-螺旋首先转变为β-折叠和β-转角,进而变成无规则卷曲,分子无序性增大。
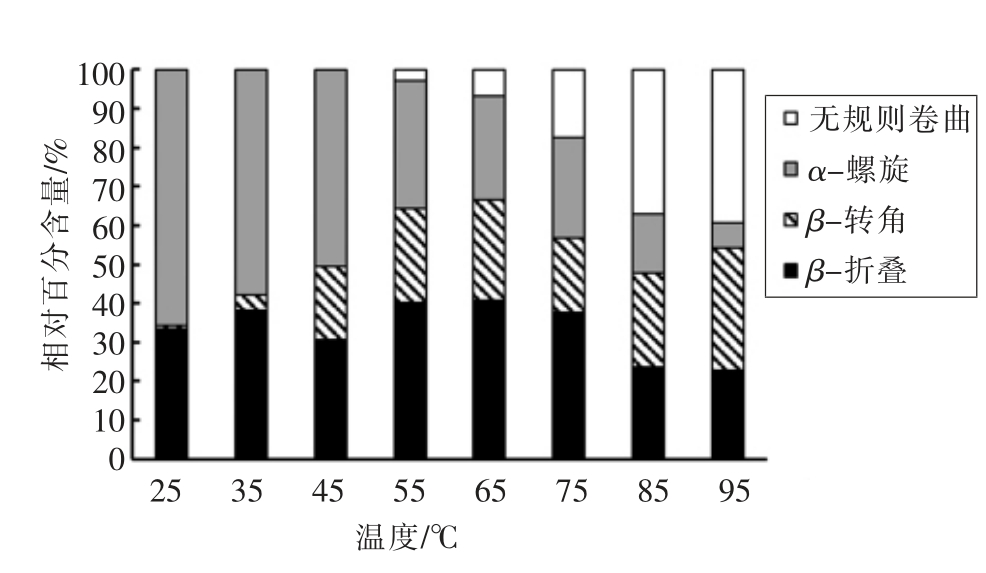
图7 水溶液加热下胶原蛋白二级结构相对百分含量变化
Fig.7 Changes of secondary structure of collagen by aqueous heating
为获得加热对胶原蛋白结构影响的详细信息,以温度为外扰,对胶原蛋白在1 200~1 750 cm-1和950~1 450 cm-1 波长范围内的红外光谱进行二维相关分析,根据二维相关光谱读谱规则[7,15-16],确定各基团对温度的响应顺序。
2.3.1 脱水加热下胶原蛋白二维红外光谱分析如图8所示,为脱水加热下胶原蛋白在1 000~1 700 cm-1 波长范围内的二维红外相关光谱。同步光谱中,自相干峰的强度大小代表在相关周期中光强度动态涨落的总程度,说明这些振动峰对应的基团随温度的升高而发生变化[15]。异步光谱可以为同步光谱提供一些补充信息,并且判断波长ν1 和ν2 的变化顺序。图8a和图8c中共有10 个自动峰,分别位于1 633,1 589,1 541,1 481,1 450,1 338,1 238,1 205,1 080 和1 032 cm-1 处,说明这些吸收峰随升温的进程而发生变化,并对变温扰动比较敏感。如图8b和图8d,所有交叉峰都 是正交叉峰,如Ф(1 544,1 633)、Ф(1 452,1 544)和Ф(1 338,1 544),表明1 633,1 544,1 452,1 402 和1 338 cm-1 处的吸收峰同时减少或增加。根据二维相关光谱读谱规则,脱水加热下胶原蛋白各吸收峰对温度的响应顺序如表2所示。因此,胶原蛋白红吸收峰对温度的响应顺序为:1 033>1 338>1 238>1 452>1 544>1 633 cm-1。根据Payne & Veis[17]和Zhong-Rui Li[2]等人研究,对红外光谱中各吸收峰进行谱峰指认,如表3所示。因此,胶原蛋白各基团对温度的响应顺序为:脯氨酸CH3 基团摇摆振动>CH2 摇摆振动>N-H 弯曲振动>CH2 弯曲振动>C-N 伸缩>C=O 伸缩振动。

图8 脱水加热下胶原蛋白在1 200~1 750 cm-1(a)、(b)和950~1 450 cm-1(c)、(d)范围内二维红外相关光谱
Fig.8 Two-dimensional infrared dcorrelation spectra in the region of 1 200-1 750 cm-1 (a)and (b)and 950-1450 cm-1 (c)and (d)of collagen by dehydrothermal treatment
表2 脱水加热下胶原蛋白基团对温度的响应顺序
Table 2 The order of band intensity variations of collagen response to dehydrothermal treatment

同步光谱 异步光谱 顺序特征Φ(1 544,1 633)>0 Ψ(1 544,1 633)>0 1 544 先于1 633 变化Φ(1 452,1 544)>0 Ψ(1 452,1 544)>0 1 452 先于1 544 变化Φ(1 338,1 544)>0 Ψ(1 338,1 544)>0 1 338 先于1 544 变化Φ(1 238,1 338)>0 Ψ(1 238,1 338)<0 1 338 先于1 238 变化Φ(1 234,1 452)>0 Ψ(1 234,1 452)>0 1 234 先于1 452 变化Φ(1 033,1 338)>0 Ψ(1 033,1 338)>0 1 033 先于1 338 变化
表3 胶原蛋白红外光谱吸收峰指认
Table 3 Assignments of the major absorption bands of collagen in FTIR spectra

波数/cm-1 特征 波数/cm-1 特征1 633 C=O 伸缩 1 338 CH2 摇摆1 587 COO- 1 238 N-H 弯曲1 544 N-H 弯曲,C-N 伸缩 1 082 C-O 伸缩/C-N-C 伸缩1 452 CH2 弯曲 1 033 脯氨酸1 402 COO-对称伸缩 877 羟脯氨酸环C-C 伸缩
2.3.2 水溶液加热下胶原蛋白二维红外光谱分析 图9所示为水溶液加热下胶原蛋白二维红外相关光谱。与脱水加热相比,水溶液下胶原蛋白对温度的响应存在差异。图9a、9c 中共7 个自动峰,分别位于1 678,1 618,1 558,1 406,1 247,1 076,1 055 cm-1 处。其中,1 678,1 618 cm-1 处自动峰均属于酰胺I 区域。根据表4所示,胶原蛋白基团对温度的响应顺序为:1 055>1 247>1 406>1 678>1 618>1 558 cm-1。参照表3谱峰指认结果,水溶液加热下胶原蛋白基团对温度的响应顺序为:N-H弯曲>COO-对称伸缩>C=O 伸缩振动>C-N 伸缩。
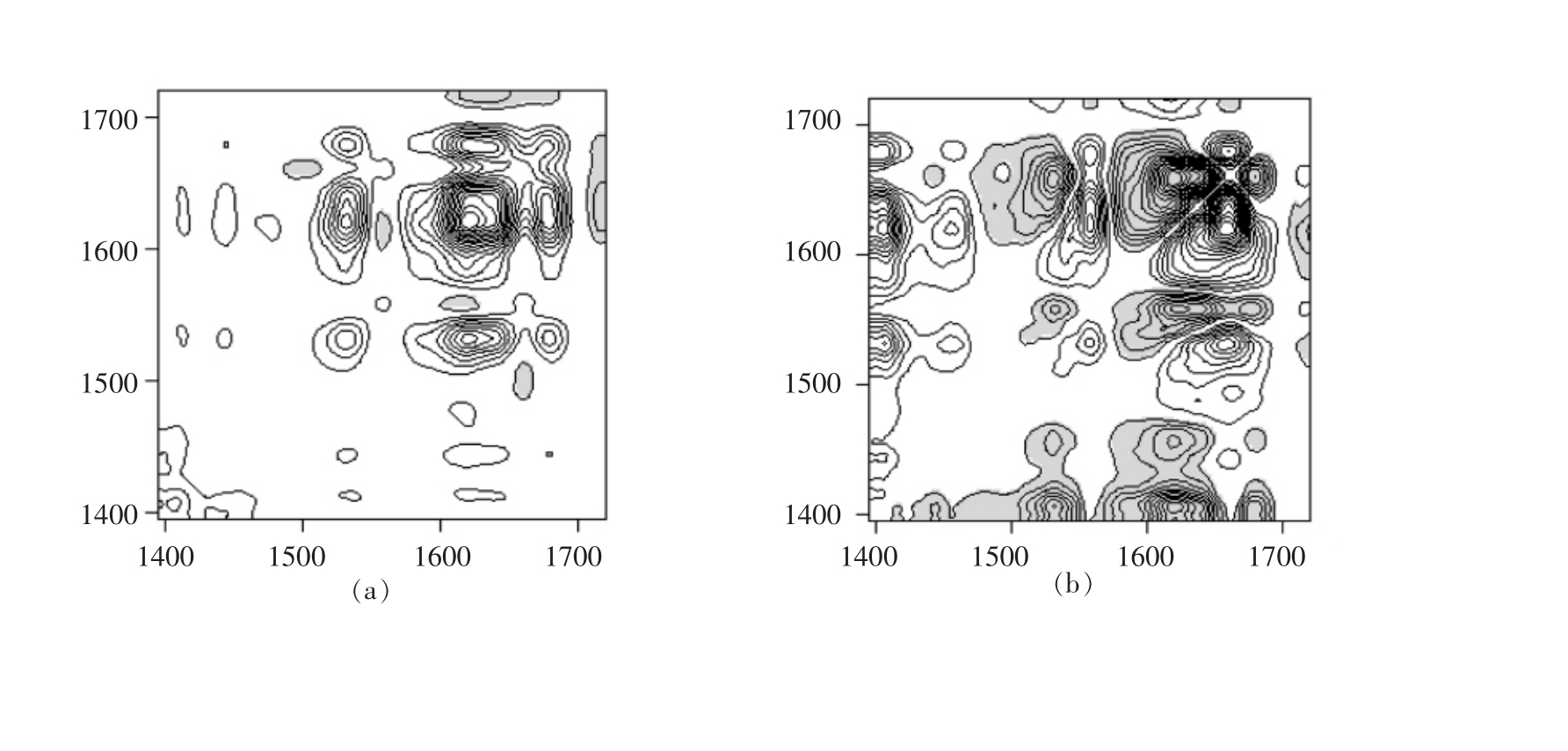
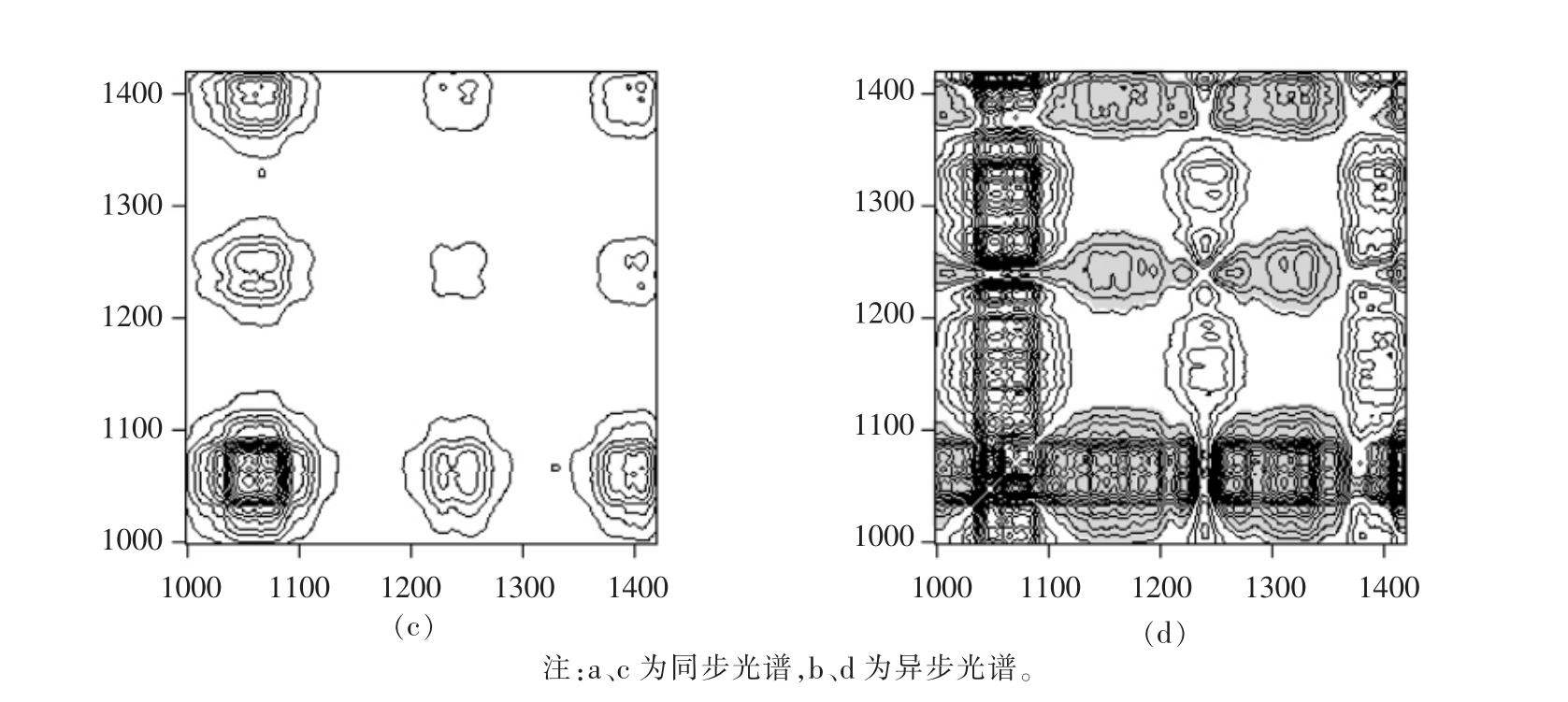
图9 水溶液加热下胶原蛋白在1 200~1 750 cm-1(a)、(b)和950~1 450 cm-1(c)、(d)范围内二维红外相关光谱
Fig.9 Two-dimensional infrared correlation spectra in the region of 1 200-1 750 cm-1 (a and b)and 950-1450 cm-1 (c and d)of collagen by aqueous heating
表4 水溶液加热下胶原蛋白基团对温度的响应顺序
Table 4 The order of band intensity variations of collagen response to aqueous heating

同步光谱 异步光谱 顺序特征Φ(1 618,1 678)>0 Ψ(1 618,1 678)<0 1 678 先于1 618 变化Φ(1 558,1 618)<0 Ψ(1 558,1 618)>0 1 618 先于1 558 变化Φ(1 406,1 618)>0 Ψ(1 406,1 618)>0 1 406 先于1 618 变化Φ(1 247,1 406)>0 Ψ(1 247,1 406)>0 1 247 先于1 406 变化Φ(1 055,1 247)>0 Ψ(1 055,1 247)>0 1 055 先于1 247 变化
两种加热环境下,羊骨胶原蛋白的结构变化规律相同,即随着温度升高,胶原蛋白三螺旋区域解旋形成3 条单肽链,α-螺旋含量逐渐降低,无规则卷曲含量逐渐增加,分子结构逐渐舒展,无序性增大。但胶原蛋白基团对温度的响应顺序不同:脱水加热下,胶原蛋白基团对温度的响应顺序为脯氨酸CH3 基团摇摆振动>CH2 摇摆振动>N-H 弯曲振动>CH2 弯曲振动>C-N 伸缩>C=O 伸缩振动;水溶液加热下的响应顺序为N-H 弯曲>COO-对称伸缩>C=O 伸缩振动>C-N 伸缩。
[1]ENGEL J,BÄCHINGER H P.Structure,stability and folding of the collagen triple helix[J].Topics in Current Chemistry,2005,247:7-33.
[2]LI Z R,WANG B,CHI C F,et al.Isolation and characterization of acid soluble collagens and pepsin soluble collagens from the skin and bone of Spanish mackerel (Scomberomorous niphonius)[J].Food Hydrocolloids,2013,31(1):103-113.
[3]SHOULDERS M D,RAINES R T.Collagen structure and stability[J].Annual Review of Biochemistry,2009,78:929-958.
[4]李国英,刘文涛.胶原化学[M].北京:中国轻工业出版社,2013.
[5]LIU W T,TIAN Z H,LI C H,et al.Thermal denaturation of fish collagen in solution:A calorimetric and kinetic analysis [J].Thermochimica Acta,2014,581:32-40.
[6]BOZEC L,ODLYHA M.Thermal denaturation studies of collagen by microthermal analysis and atomic force microscopy[J].Biophysical Journal,2011,101(1):228-236.
[7]TIAN Z H,WU K,LIU W T,et al.Two-dimensional infrared spectroscopic study on the thermally induced structural changes of glutaraldehyde -crosslinked collagen[J].Spectrochimica Acta Part AMolecular and Biomolecular Spectroscopy,2015,140:356-363.
[8]肖和兰,孙素琴,周群,等.温度对胶原蛋白结构影响的二维红外相关光谱的研究[J].原子与分子物理学报,2003,20(2):211-218.
[9]PIELESZ A.Temperature-dependent FTIR spectra of collagen and protective effect of partially hydrolysed fucoidan[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy,2014,118:287-293.
[10]倪娜.羊血浆蛋白-肌原纤维蛋白复合凝胶形成的作用力分析[D].北京:中国农业科学院,2014.
[11]BARTH A,ZSCHERP C.What vibrations tell about proteins[J].Quarterly Reviews of Biophysics,2002,35(4):369-430.
[12]SHUDONG H,JOHN S,ELFALLEH W,et al.Reverse micellar extraction of lectin from black turtle bean (Phaseolus vulgaris):Optimisation of extraction conditions by response surface methodology[J].Food Chemistry,2015,166:93-100.
[13]WANG W H,ZHANG Y,YE R,et al.Physical crosslinkings of edible collagen casing[J].International Journal of Biological Macromolecules,2015,81:920-925.
[14]钟朝辉,李春美,顾海峰,等.温度对鱼鳞胶原蛋白二级结构的影响[J].光谱学与光谱分析,2007,27(10):1970-1976.
[15]陈以会,田荟琳,李季衡,等.二维红外相关光谱法研究温度对交联胶原结构的影响[J].光谱学与光谱分析,2012,32(6):1500-1506.
[16]NODA I.Advances in two-dimensional correlation spectroscopy[J].Vibrational Spectroscopy,2004,36(2):143-165.
[17]PAYNE K J,VEIS A.Fourier transform ir spectroscopy of collagen and gelatin solutions:Deconvolution of the amide I band for conformational studies[J].Biopolymers,1988,27(11):1749-1760.
The Effect of Heat Treatment on Collagen Structure from Sheep