我国淡水渔业资源丰富,2014年全国淡水养殖总产量2 935.76 万t,占全国水产品总量的45.43%[1]。鱼蛋白产品的开发与利用是大宗低值渔获物的有效利用途径,然而,目前低值鱼蛋白的利用形式仍以鱼粉和鱼糜制品为主。鱼粉的局限性在于其食用功能性差,只能用作动物饲料,产品附加值和利用率较低。鱼糜技术存在蛋白回收率低,生产过程中产生大量废水且处理难的问题。此外,鱼糜技术对原料蛋白质性质要求苛刻,在非传统原料,如中、上层鱼类方面的应用仍存在很多难题:产品凝胶特性差,脂质氧化及血红素蛋白导致的变色问题,这很大程度上限制了其对大部分低值鱼蛋白的加工利用[2]。如何高效利用低值鱼蛋白是目前水产品加工领域亟待解决的问题。
pH 调节法是一种基于等电点沉淀的蛋白分离技术,已被广泛应用于食品工业领域[3-5]。近年来,蛋白分离技术越来越多地用于开发水产蛋白源[6-8]。以鲤鱼为研究对象,探讨pH 调节法对大宗低值淡水鱼蛋白的分离特性。前期研究结果[9]表明pH 2.5 溶出-pH 5.5 沉淀可以回收76.30%的鲤肌肉蛋白,pH 12.5 溶出-pH 5.5 沉淀可以回收87.56%的鱼肉蛋白。该方法不仅能有效回收盐溶性肌原纤维蛋白,还能回收一部分水溶性蛋白。分离蛋白氨基酸组成合理,而且具有比鱼肉更好的消化特性,胰凝乳蛋白酶的消化速率提高了7~8倍。pH 调节过程中,极端的酸碱环境会导致鱼肉蛋白的空间结构发生变化,进而对功能性产生影响。Kristinsson 等[10]研究了0.6 mol/L KCl 条件下,pH 2.5 和pH 11 以及再调至pH 7.5 过程中鳕鱼肌球蛋白空间构象的变化。而对分离蛋白是先添加纯水再调节pH 制备的,该过程并未添加盐离子。本研究通过极低离子强度 (0.05 mol/L KCl)下,调节pH 过程中鲤肌球蛋白的Ca2+-ATPase 活性、α 螺旋含量、内源荧光强度、巯基含量、表面疏水性等指标的变化,探讨肌球蛋白空间构象改变规律,为大宗低值鱼蛋白制备技术体系的建立和新型功能性分离鱼蛋白的开发提供理论参考。
活鲤鱼购买于大连沃尔玛超市。运至实验室立刻速杀,去头、内脏、鳞、鳍、鳃,然后清洗、去皮、去骨、采肉、放入斩拌料理机中绞碎成肉泥状,放置于冰浴条件下备用。
三磷酸腺苷二钠,盐酸胍,8-苯胺基-1-萘磺酸,美国Sigma 公司;KCl,CuSO4,NaOH,Tris,三氯乙酸等,国药集团化学试剂有限公司;其他试剂均为分析纯。
Z326K 高速冷冻离心机,德国HERMLE 公司;J-715 荧光分光光度计,日本分光株式会社;AE-6500 平板电泳槽,日本ATTO 株式会社;HG-200 高速分散均质机,日本HSIANGTAI;J-725 圆二色谱仪,日本分光株式会社。
1.3.1 肌球蛋白的纯化 肌球蛋白的提取参照Kato 和Konno[11]的方法进行,绞碎的鲤鱼肉中加入10 倍体积预冷的0.1 mol/L KCl-20 mmol/L Tris-HCl(pH 7.5)搅匀,4 ℃,5 000 g 离心5 min,取沉淀重复上述操作3 次。将收集的沉淀悬浊于上述缓冲液中,13 000 r/min 组织均质2~3 次,每次间隔30 s。然后离心(5 000 g,10 min,4 ℃),收集沉淀。沉淀漂洗3 次后,悬浊于0.1 mol/L KCl,20 mmol/L Tris-HCl(pH 7.5)缓冲液中,经两层纱布过滤所得滤液为肌原纤维蛋白。用3 mol/L KCl 将肌原纤维蛋白溶液的盐浓度调至0.5 mol/L,加入2 mmol/L Mg-ATP,然后加入硫酸铵粉末至饱和度40%,静止30 min 离心收集上清,再将上清液中硫酸铵饱和度调至50%,离心所得沉淀溶解于0.5 mol/L KCl-20 mmol/L Tris-HCl (pH 7.5)中,透析除硫酸铵。最后离心(12 000 g,20 min,4 ℃)所得溶液即为鲤肌球蛋白。
1.3.2 鲤肌球蛋白的酸碱处理 加水调节肌球蛋白的盐浓度至0.05 mol/L。分别加入0.05 mol/L HCl 或者0.05 mol/L NaOH 调节肌球蛋白溶液的pH 至2.5,3.5,11.5,12.5,处理1 h 后用于后续分析。同时以溶解于0.5 mol/L KCl 20 mmol/L Tris-HCl(pH 7.5)缓冲溶液和经过6 mol/L 盐酸胍(变性剂)处理的肌球蛋白溶液作为对照。所有操作均在0 ℃下进行。
1.3.3 肌球蛋白溶解性变化 加水调节肌球蛋白盐浓度0.05 mol/L,蛋白质量浓度至3 mg/mL。经过上述pH 处理1 h 后,离心(10 000 g,10 min,4℃)收集上清液,用双缩脲法测定上清液中的蛋白质含量。另外pH 处理1 h-调回pH 7.5 后再次测定上清蛋白浓度。按照以下公式计算pH 调节过程中肌球蛋白溶解度变化。溶解度(%)=[(上清液蛋白浓度×体积)/(处理前体积×3 mg/mL)]×100
1.3.4 肌球蛋白 Ca2 +-ATPase 活性 按照THAVAROJ 等的方法[12] 测定ATPase 酶活,1.0 mg/mL 肌球蛋白样液经过上述酸碱处理后,取0.1 mL 加入到0.9 mL 反应液中(含有1 mmol/L ATP,5 mmol/L CaCl2 和25 mmol/L Tris-马 来 酸(pH 7.0)),在20 ℃反应0,2,5,10,15,20,25,30 min后,加入15%高氯酸溶液终止反应。采用钼酸铵法[9]测定反应中释放的无机磷(Pi)含量来确定Ca2+-ATPase 活性的变化,酶活性单位为:μmol Pi/mg·min。
1.3.5 圆二色谱(CD)分析 配制0.5 mg/mL 肌球蛋白样液(含0.05 mol/L KCl),在冰水浴中pH 处理1 h,然后经20 000 g,20 min 离心取上清进行圆二色谱分析。圆二色谱仪各参数设置为:温度4℃,波长扫描范围为190~250 nm,分辨率为0.2 nm,缝宽为4 nm,灵敏度为20 mdeg,扫描时间间隔和扫描速度分别为1 s 和100 mdeg/min。
1.3.6 色氨酸荧光分析 样品处理按照CD 分析进行同样处理,使用Jasco J-715 荧光分光光度计在激发波长297 nm,光谱范围为300~400 nm对各样品进行荧光扫描,狭缝宽度为5 nm。
1.3.7 表面疏水性测定 采用ANS (8-苯胺基-1-萘磺酸)探针[10]检测表面疏水性的变化。向鲤肌球蛋白溶液(0.5 mg/mL)中加入20 μL 的ANS 溶液 (8.0 mmol/L,0.1 mol/L 磷酸盐缓冲液,pH 7.4)振荡,静置15 min(避光),使用荧光分光光度计测定样品的荧光强度(FI)。试验中,ANS 荧光探针检测的激发波长和发射波长分别为390 nm 和470 nm,狭缝宽均为5 nm。减去各样品溶液未加探针时的荧光强度即为每种蛋白的相对荧光强度值(RFI)。以相对荧光强度对蛋白质浓度作图,其初始段的斜率作为蛋白质的表面疏水性指标。
1.3.8 总巯基含量测定 总巯基的测定参考Benjakul[13]的方法,分别取蛋白质量浓度为1 mg/mL(含0.05 mol/L KCl)的经酸碱处理的肌球蛋白样液0.5 mL,加入2 mL 20 mmol/L Tris-HCl (pH 7.5)缓冲液(含有8 mol/L 尿素,10 mmol/L EDTA,2% SDS),温度控制在4 ℃下。然后加入50 μL 0.1 mol/L 磷酸盐缓冲液 (10 mmol/L DNTB,pH 7.2),40 ℃反应25 min,412 nm 比色,空白用20 mmol/L 的含0.6 mol/L KCl 的磷酸盐缓冲液(pH 7.0)。巯基含量按下式计算:
巯基含量(mol·10-5·g-1)=![]() 式中:A——吸光值;D——释释倍数;B——蛋白质量浓度 (mg/mL);C——吸光系数13 600(mol-1·cm-1·L)。
式中:A——吸光值;D——释释倍数;B——蛋白质量浓度 (mg/mL);C——吸光系数13 600(mol-1·cm-1·L)。
1.3.9 肌球蛋白的胰凝乳蛋白酶消化特性 根据Kato 和Konno 方法[11],配制3 mg/mL(含0.05 mol/L KCl)酸碱处理的肌球蛋白样品,将pH 调解至7.0后,加入1 mmol/L EDTA 搅拌均匀并在20 ℃水浴条件下预热2 min,使用质量比1/500 胰凝乳蛋白酶在20 ℃水浴条件下分别消化0,5,10,20,40,60 min。然后取0.2 mL 分别加入1 mmol/L PMSF 和0.1 mL 电泳上样液,充分混匀后在100 ℃下煮沸5 min。用7.5% SDS-PAGE 进行分析。
通过图1的SDS-PAGE 结果可知,在200 ku出现的条带为肌球蛋白重链,在20.1~14.3 ku 出现的条带为肌球蛋白轻链。分子质量约44 ku 的肌动蛋白残留量很少,肌球蛋白的纯度可达85%。
pH 处理对鲤肌球蛋白溶解性的影响如图 2所示,在酸性pH(2.5 和3.5)和碱性pH(11.5 和12.5),肌球蛋白的溶解性较高,均达到90%左右。经pH 变换处理后再调至pH 7.5 时,溶解度显著下降,并且初始pH 值越高,溶解度下降越明显。肌球蛋白是盐溶性蛋白,在0.05 mol/L KCl 条件下溶解度很低,需要一定的离子强度才能促进其溶解[14]。蛋白质的溶解性与蛋白质分子大小和表面电荷有关[15]。在极端pH 条件下,肌球蛋白分子带有较多的净正电荷或净负电荷,分子由于静电排斥作用趋于解离,因而溶解度增加。并且愈是偏离等电点,蛋白分子表面净电荷愈多,蛋白溶解度愈高[16]。通过对肌球蛋白的溶解性的研究也进一步证实了在分离蛋白制备的过程中,极端pH 条件下肌球蛋白回收率很高。将极端pH 调回中性7.5 时,溶解度均显著下降,这是由于在低离子强度盐浓度下,靠近肌球蛋白的等电点,蛋白分子与水之间的作用被蛋白之间的作用力所取代,减少了分子间静电排斥作用,导致溶解度降低。同样的结果在其他鱼类如鳕鱼肌原纤维[17]、鲑鱼肌球蛋白[18]、岩鱼[19]等研究中也有报道,并与Park 等[20]研究不同离子强度和pH 对鲑鱼肌球蛋白的溶解性和构象变化的影响结果一致。
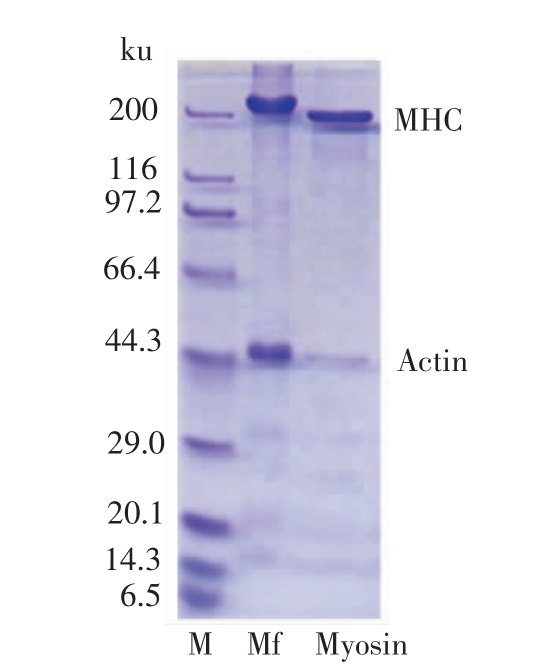
图1 鲤肌球蛋白的电泳分析
Fig.1 SDS-PAGE patterns of myosin from common carp muscle
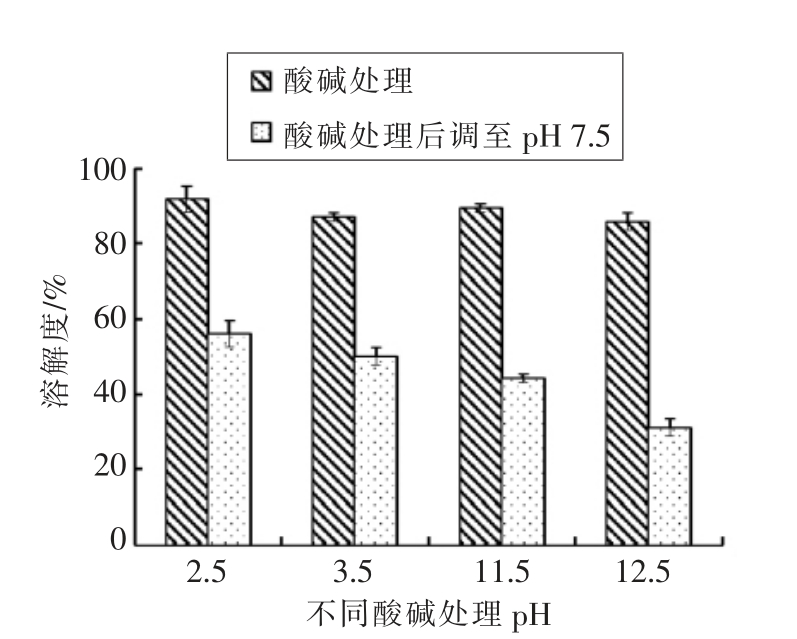
图2 pH 调节对鲤鱼肌球蛋白溶解性的影响
Fig.2 Effect of pH shift on solubility of myosin from common carp muscle
以0.5 mol/L KCl,pH 7.5 的条件下测定的肌球蛋白Ca2+-ATPase 作为100,在0.05 mol/L KCl,pH 2.5,3.5,11.5,12.5 进行酸碱处理后,未能检测到Ca2+-ATPase 活性。即使再调节到pH 7.5 也未能检测到Ca2+-ATPase 活性,结果如表1所示。由于肌球蛋白的球状头部具有ATPase 的活性,因此,可用Ca2+-ATPase 活性来评价肌球蛋白头部构象的变化[21]。肌球蛋白在极端酸性pH(2.5,3.5)和极端碱性pH(11.5,12.5),Ca2+-ATPase 活性为零,可能是由于经极端pH 处理后鲤肌球蛋白头部完全变性展开,空间构象发生了变化。调回pH 7.5后,Ca2+-ATPase 活性仍为零。由此推测经pH 处理后,肌球蛋白球状头部的构象并未得到恢复,空间构象的改变是不可逆的。
表1 pH 调节对鲤鱼肌球蛋白的Ca2+-ATPase活性的影响
Table 1 Effect of pH-shift on ATPase activity of common carp myosin

处理条件 ATP 酶活/%7.5 100 2.5/2.5→7.5 0/0 3.5/3.5→7.5 0/0 11.5/11.5→7.5 0/0 12.5/12.5→7.5 0/0
pH 处理对肌球蛋白α 螺旋结构的影响如图3所示,与肌球蛋白(pH 7.5)相比,经极端pH 处理的肌球蛋白在222 nm 处的负峰的大小基本没有变化。经过6 mol/L 盐酸胍变性处理的样品的负峰完全消失,由此推测α 螺旋的含量几乎没有发生变化。肌球蛋白的α 螺旋结构主要存在于棒状的尾部,因此可认为pH 调节未造成肌球蛋白尾部的二级结构的破坏。与Kristinsson 等[22]在对鳕鱼肌球蛋白进行pH 处理后二级结构并未发生改变的结论是一致的。Konno 等[12]研究认为肌球蛋白的溶解性主要与杆状尾部的结构有关,也证明了分离蛋白可保持良好溶解性。
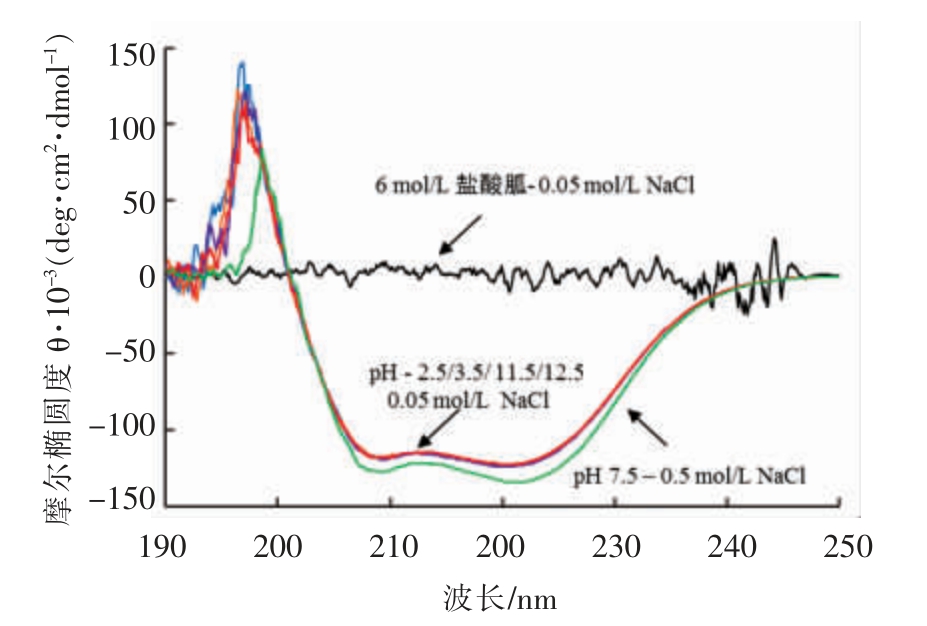
图3 pH 调节后肌球蛋白CD 图谱的变化
Fig.3 Effect of pH on Far-UV circular dichroism spectra
肌球蛋白是由两个球状头部和一个棒状尾部组成[21],且肌球蛋白头部和棒状尾部均含有大量的色氨酸残基。色氨酸、酪氨酸、苯丙氨酸为蛋白内源生色基团,当蛋白质结构发生变化时荧光强度发生降低或增强,最大吸收峰发生红移或蓝移,这种变化可用来衡量蛋白质分子发生去折叠的程度,进而反映蛋白的三级结构的变化。图4结果表明,pH 7.5 时色氨酸的最大荧光波长在340 nm 左右。经碱性pH 处理后,肌球蛋白色氨酸的荧光光谱发生了显著变化,色氨酸与溶剂分子发生荧光淬灭,且显著红移(349 nm)。而酸性条件下肌球蛋白无明显的荧光淬灭,最大荧光波长仍为340 nm。RAGHAVAN 等[22]报道了在6 mol/L 的胍盐酸中完全展开的肌球蛋白分子大部分色氨酸荧光淬灭且显著红移(350 nm)。据此推测碱性pH 处理后,肌球蛋白色氨酸残基暴露程度更高,肌球蛋白展开变性程度更大。而极端酸性pH 处理后,色氨酸残基暴露几乎没有发生变化。
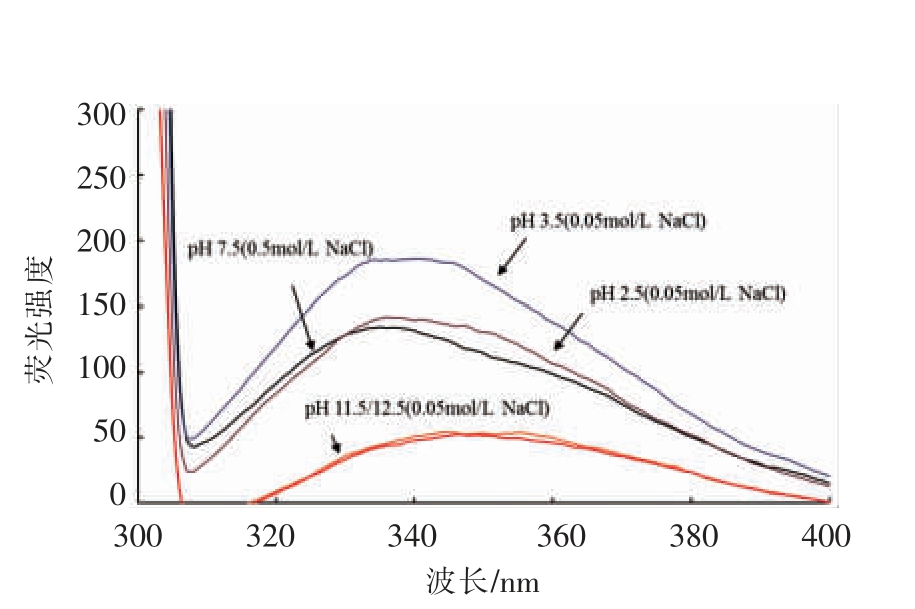
图4 肌球蛋白经pH 调节后的色氨酸荧光光谱
Fig.4 Effect of pH on emission fluorescence spectra of denaturation myosin
蛋白质的三级结构主要靠疏水键作用来维持。ANS 是一种对极性敏感的阴离子型荧光探针,在蛋白质疏水性测定中容易受到静电作用力的干扰。不仅与天然的或完全变性的蛋白质分子相互作用,且与不完全变性的蛋白质分子的疏水性基团产生更强的相互作用力,而使表面疏水性显著增加。图5结果表明,相比于pH 7.5 条件下,经酸处理的肌球蛋白ANS-S0 显著升高。而在碱性条件下,ANS-S0 几乎没有发生变化。肌球蛋白在酸、碱或高离子环境中,蛋白分子表面分别带净正电荷或净负电荷,在静电排斥作用下,蛋白质分子展开,使蛋白分子内部的疏水基团和残基暴露在蛋白质分子表面,从而使ANS-S0 提高。但酸性(pH 2.0,3.5)条件下肌球蛋白的表面疏水性明显高于碱性条件(pH 11.5,12.5)的。这可能是由于酸处理时用HCl 调节pH,这其中的阴离子Cl-能使肌球蛋白溶液产生促溶效应[22],使得肌球蛋白在HCl 的酸性环境中变性更加严重。由此推断,pH 调解法生产分离蛋白时,鱼肉经过酸碱处理后,会对肌球蛋白三级结构产生破坏,酸处理的影响可能更大。
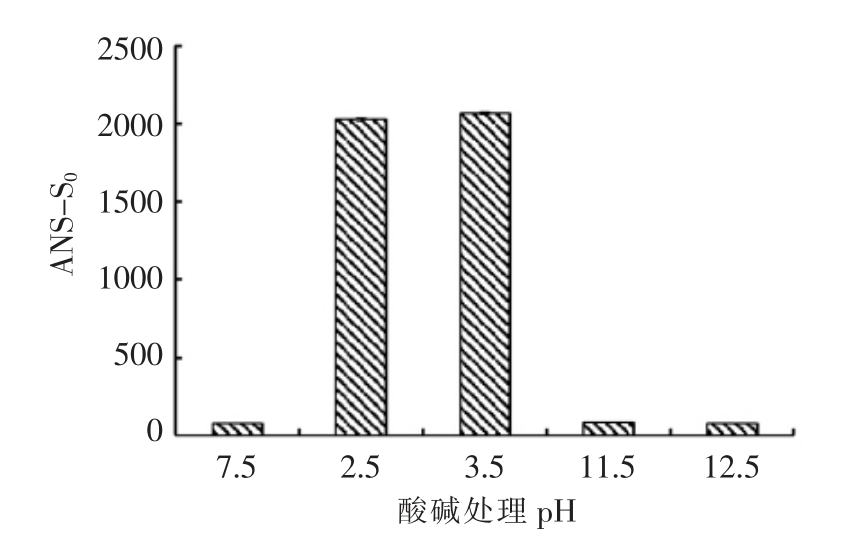
图5 肌球蛋白经pH 调节后的表面疏水性
Fig.5 Effect of pH on the surface hydrophobicity of myosin from common carp
二硫键对维持蛋白质分子的构象和稳定性有重要作用,也是蛋白质热处理形成凝胶过程中必不可少的过程[23]。巯基含量的多少反应二硫键形成情况。图6结果显示,pH 调节处理后,肌球蛋白巯基含量变化不大。肌球蛋白分子中有大约42 个巯基,约有24 或26 个在球状头部,每条碱性轻链中各有一个,每个DTNB 轻链中有2 个。其中一部分活性巯基基团存在于蛋白质分子表面,一部分包裹在肌球蛋白棒状尾部中[24]。与试验中的凝胶性结果一致,分离蛋白和新鲜鱼肉的凝胶性几乎没有差别。
pH 调节处理后肌球蛋白的消化模式发生了显著的变化,如图7所示,在pH 7.5(0.05 mol/L KCl,20 mmol/L Tris-HCl,1 mmol/L EDTA)的条件下,肌球蛋白的胰凝乳蛋白酶酶切位点主要发生在头部S-1 以及尾部rod[11]。而经过pH 调节后,无论酸性pH 处理还是碱性pH 都未观察到S-1 条带,说明酶切位点发生了变化。此外,经过酸处理之后,MHC 的消失效率比pH 7.5 提高了大约3 倍。碱处理后也略有提高,进一步说明了肌球蛋白的三级结构发生了变化。
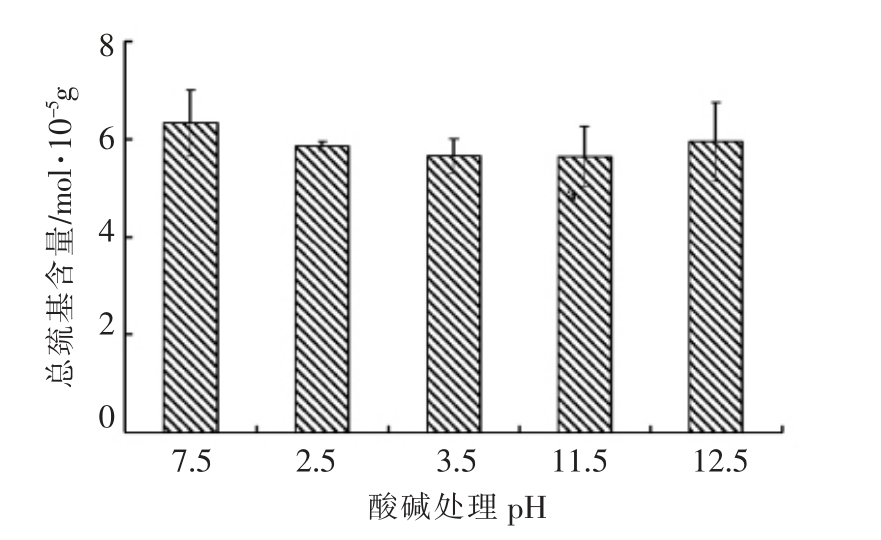
图6 肌球蛋白经pH 调节后的巯基含量
Fig.6 Effect of pH on the sulfhydryl group contents of myosin from common carp

图7 pH 调节对肌球蛋白的胰凝乳蛋白酶消化位点的影响
Fig.7 Effect of pH-shift on digestion site of myosin by α-chymotrypsin
在极低离子强度(0.05 mol/L KCl)条件下,鲤肌球蛋白经过pH 调节后,α 螺旋含量没有发生变化,说明pH 调节未引起二级结构的改变。球状头部的Ca2+-ATPase 活性丧失,胰凝乳蛋白酶酶切位点变化,均说明肌球蛋白三级结构遭到了破坏。但是,碱性pH 造成色氨酸残基暴露程度更高,酸性pH 导致疏水性基团暴露更多,也反映出酸碱pH调节导致的三级结构的改变存在差异。
[1]农业部渔业局.2015年中国渔业统计年鉴[M].北京:中国农业出版社,2015:30-31.
[2]MARTIN-SANCHEZ A M,NAVARRO C,PEREZALVAREZ J A,et al.Alternatives for efficient and sustainable production of surimi:a review[J].Comprehensive Reviews in Food Science and Food Safety,2009,8(4):359-374.
[3]WANG H N,WU J,BETTI M.Chemical,rheological and surface morphologic characterisation of spent hen proteins extracted by ph-shift processing with or without the presence of cryoprotectants[J].Food Chemistry,2013,139(1/4):710-719.
[4]OMANA D A.Alkali-aided protein extraction from chicken dark meat:textural properties and color characteristics of recovered proteins[J].Poultry Science,2010,89(5):1056-1064.
[5]CAVONIUS L R,ALBERS E,UNDELAND I.pHshift processing of nannochloropsis oculata,microalgal biomass to obtain a protein-enriched food or feed ingredient[J].Algal Research,2015,5(22):95-102.
[6]OTTO R A,BEAMER S,JACZYNSKI J,et al.The effect of using citric or acetic acid on survival of Listeria monocytogenes,during fish protein recovery by isoelectric solubilization and precipitation process[J].Journal of Food Science,2011,76(8):579-583.
[7]XU Y,XIA W,JIANG Q,et al.Acid-induced aggregation of actomyosinfrom silver carp (Hypophthalmichthys molitrix)[J].Food Hydrocolloids,2012,27(2):309-315.
[8]PAKER I,BEAMER S,JACZYNSKI J,et al.pH shift protein recovery with organic acids on texture and color of cooked gels[J].Journal of the Science of Food & Agriculture,2015,95(2):275-280.
[9]TIAN Y,WANG W,YUAN C,et al.Nutritional and digestive properties of protein isolates extracted from the muscle of the common carp using ph-shift processing[J].Journal of Food Processing & Preservation,2017,41(1):e12847.
[10]KRISTINSSON H G,HULTIN H O.Changes in conformation and subunit assembly of cod myosin at low and high pH and after subsequent refolding[J].Journal of Agricultural & Food Chemistry,2003,51(24):7187-7196.
[11]KATO S,KONNO K.Isolation of carp myosin rod and its structural stability[J].Nihon-suisan-gakkaishi,1993,59(3):539-544.
[12]THAVAROJ W,SAKAMOTO M,KONNO Y,et al.Preceding actin denaturation accelerates myosin denaturation in tilapia myofibrils in frozen storage[J].Fisheries Science,2016,82(5):843-850.
[13]BENJAKUL S,SEYMOUR T A,MORRISSEY M T,et al.Physicochemical changes in pacific whiting muscle proteins during iced storage[J].Journal of Food Science,1997,62(4):729-733.
[14]CHAU H F,WAN K Y,YAN K K,et al.Methods of testing protein functionality[M].Methods of Testing Protein Functionality.1996.
[15]TADPITCHAYANGKOON P,PARK J W,YONGSAWATDIGUL J.Conformational changes and dynamic rheological properties of fish sarcoplasmic proteins treated at various pHs[J].Food Chemistry,2010,121(4):1046-1052.
[16]HAMM R.Biochemistry of meat hydration[J].Advances in Food Research,1960,10(10):355-463.
[17]STEFANSSON G,HULTIN H O.On the solubility of cod muscle proteins in water[J].Journal of Agri cultural & Food Chemistry,2002,42(12):2656-2664.
[18]AND T M L,PARK J W.Solubility of salmon myosin as affected by conformational changes at various ionic strengths and pH[J].Journal of Food Science,1998,63(2):215-218.
[19]YONGSAWATDIGUL J,PARK J W.Effects of alkali and acid solubilization on gelation characteristics of rockfish muscle proteins[J].Journal of Food Science,2004,69(7):499-505.
[20]THAWORNCHINSOMBUT S,PARK J W.Role of ph in solubility and conformational changes of pacific whiting muscle proteins[J].Journal of Food Biochemistry,2004,28(28):135-154.
[21]SHARP A,GERALD OFFER.The mechanism of formation of gels from myosin molecules[J].Journal of the Science of Food & Agriculture,1992,58(1):63-73.
[22]RAGHAVAN S,KRISTINSSON H G.Conformational and rheological changes in catfish myosin during alkali-induced unfolding and refolding[J].Food Chemistry,2008,107(1):385-398.
[23]KIM Y S,PARK J W,CHOI Y J.New approaches for the effective recovery of fish proteins and their physicochemical characteristics[J].Fisheries Science,2003,69(6):1231-1239.
[24]HAMM R.Biochemistry of meat hydration[J].Advances in Food Research,1960,10(10):355-463.
Effect of Regulation pH on the Conformation of Myosin from Common Carp at Low Ionic Strength