仿刺参胶原蛋白多肽对Ⅱ型糖尿病小鼠肾脏的保护机制
韩姣姣1,2 李妍妍3 周 君1 芦晨阳1 李 晔1 张凌芷2 苏秀榕1*(1 宁波大学海洋学院 浙江宁波3152112 宁波大学食品与药学学院 浙江宁波3152113 阿卜杜拉国王科技大学 吉达,沙特阿拉伯王国)
摘要 目的:研究仿刺参胶原蛋白多肽对db/db 糖尿病小鼠的保护机制。方法:通过仿刺参多肽分组喂养糖尿病小鼠,测定小鼠血清中TC、TG、LDL-C 和HDL-C 含量及胰岛素浓度。采用双向电泳研究小鼠的肾脏蛋白,通过差异蛋白筛选,GO 功能注释,代谢通路等分析确定仿刺参多肽对糖尿病小鼠肾脏的保护机制。生化指标显示:仿刺参多肽可以降低血清中TC、TG、LDL-C 的含量和胰岛素浓度,提高HDL-C 水平。双向结果表明:相对于模型组,试验组共检测出上调蛋白81 个,下调蛋白51 个。GO 结果显示:差异蛋白的功能主要集中在蛋白转运和信号传导过程。KEGG 分析发现,差异蛋白主要富集在代谢途径、胰岛素抵抗和胰岛素信号传导过程。结论:喂养仿刺参多肽的小鼠体内视黄醇结合蛋白4 的表达下调,血糖水平下降,胰岛素信号通路恢复正常,可以有效缓解糖尿病的症状。
关键词 仿刺参多肽;II 型糖尿病;双向电泳;差异蛋白
仿刺参(Apostichopus joponicus),属棘皮动物门(Echinodermata)、海参纲(Holothuriodea)、盾手目动物(Aspidochirota)、刺参科(Stichopodidae)、仿刺参属(Apostichopus)[1]。近代科学研究表明,刺参体内含有丰富的营养物质,如胶原蛋白、多肽、皂苷以及微量元素等,具有多种生理功能[2-7]。仿刺参胶原蛋白和多糖主要存在于体壁中,对调控人的生理功能具有重要的意义,其主要的生理活性表现在抗氧化、抗肿瘤、抗血脂、抗血栓等。
糖尿病肾病(Diabeticnephropathy,DN)是糖尿病常见的慢性并发症之一,在糖尿病患者中20%~40%会发生肾病[8]。近年来,许多国内外的学者研究从海洋生物中提取活性成分来治疗糖尿病,如蒋鑫等[9]研究海参多糖降血脂功能,王霞等[10]研究金枪鱼胰脏酶解液对糖尿病大鼠血糖和血脂的作用。有关仿刺参多肽作为预防Ⅱ型糖尿病的研究,国内外未见报道。本文以糖尿病小鼠为对象,研究仿刺参多肽对小鼠肾脏的保护机制。
1 材料与方法
1.1 材料
仿刺参取自宁波奉化博望水产养殖公司。瘦素基因敲除雄性db/db 小鼠【(36±2.0)g】30 只,雄性Db/m【(25±1.0)g】10 只,购自上海斯莱克实验动物有限责任公司。合格证号:SCXK (沪)2007-0005(编号2007000528007),仿刺参多肽为实验室自制。总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、胰岛素浓度试剂盒,宁波美康生物科技有限公司;两性电解质、四甲基乙二胺(TEMED)、IPG 干胶条(pH 4-7)、十二烷基硫酸钠(SDS)、超纯脲,美国Bio-Rad 公司;CHAPS、30%丙烯酰胺、二硫苏糖醇(DTT)、碘乙酰胺、过硫酸铵(AP)、矿物油、非干扰型蛋白浓度试剂盒,索莱宝生物科技有限公司;2-D Clean-Up Kit,美国GE 公司。其它试剂为国产分析纯级。
1.2 方法
1.2.1 动物分组与饲养 10 只雄性Db/m 小鼠为空白对照组(C);雄性db/db 小鼠30 只,按体重随机分成模型组(M),阳性药组(甲基巴多索隆CDDO-Me,9.75 mg·kg-1·d-1,ig),仿刺参多肽试验组(S,50 mg·kg-1·d-1,ig),每组10 只。空白对照组与模型组灌以等量去离子水。在试验期间,所有动物自由进食、进水,室温保持23~25 ℃,光照昼夜间隔12 h,给药时间为10 周。每天观察和记录动物的行为活动,体重变化情况每隔3 d 测定1 次。
1.2.2 生理生化指标检测 试验期10 周后停食,将小鼠麻醉后进行腹主动脉取血,分离血清,采用微板法测定血清中TC,TG,HDL-C,LDL-C 含量。试验数据用SPSS 13.0 软件进行单因素方差分析。
1.2.3 差异表达蛋白的筛选及其功能分析
1.2.3.1 蛋白质的提取及纯化 取1.0g 小鼠肾脏组织剪碎后放在预冷的研钵中加入液氮研磨成粉末,加入LB 裂解液(Alklysis buffer),使用前加入蛋白酶抑制剂(PMSF)充分溶解粉末后转移到EP管中,600 W 超声10~15 min,12 000 r/min,4 ℃离心20 min。在上清液中加入丙酮,-20 ℃沉淀过夜,12 000 r/min,4 ℃离心20 min,弃上清液,沉淀采用非干扰型蛋白质浓度测定试剂盒进行蛋白定量。
1.2.3.2 双向电泳 选择蛋白总量在200~250 μg之间,加水化上样缓冲液(7 mol/L 尿素,3 mol/L硫脲,4% w/v CHAPS,64 mmol/L DTT,0.5% v/v Bio-lyte)定容至150 μL。先将胶条从-20 ℃冰箱取出并在室温下放置1 h,将处理好的样品加入泡胀槽中,胶条轻轻覆与其上并滴加矿物油覆盖。20 ℃水化和等电聚焦12 h,平衡15 min,进行SDS-PAGE 垂直电泳。考马斯亮蓝R-250 染色、脱色、扫描,图像用PDQuest 软件进行分析以及数据处理。选择差异倍数大于1.5 倍且P<0.05 的斑点为差异蛋白,胰蛋白酶酶切后利用Autoflex speedTM MALDI-TOF-TOF(Bruker Dalton)质谱仪进行分析。利用BioTools(Bruker Dalton)软件搜索NCBI 数据库,寻找匹配的相关蛋白质。
2 结果与分析
2.1 对糖尿病小鼠血脂的影响
同空白对照组比较,模型组血清TC、TG 含量显著升高 (P<0.01),LDL-C 含量升高 (P<0.05),HDL-C 含量降低(P<0.05),胰岛素浓度显著升高(P<0.01),说明本试验造模成功。相比于糖尿病模型组,阳性药组能够降低血清TC(P<0.01)、TG(P<0.01)、LDL-C 水平 (P<0.05),提高HDL-C 水平(P<0.05),胰岛素浓度显著降低(P<0.01)。试验组能降低血清TG(P<0.05)、LDL-C(P<0.05)水平,提高HDL-C 水平(P<0.05),胰岛素浓度降低(P<0.05),对TC 有降低的趋势,但无显著性差异。相比于糖尿病模型组,阳性药组和试验组均能显著降低LDL-C/HDL-C 比值(P<0.01)。
表1 仿刺参多肽对糖尿病小鼠血脂的影响
Table 1 Effect of Apostichopus joponicus polypeptide on serum lipids in db/db mice
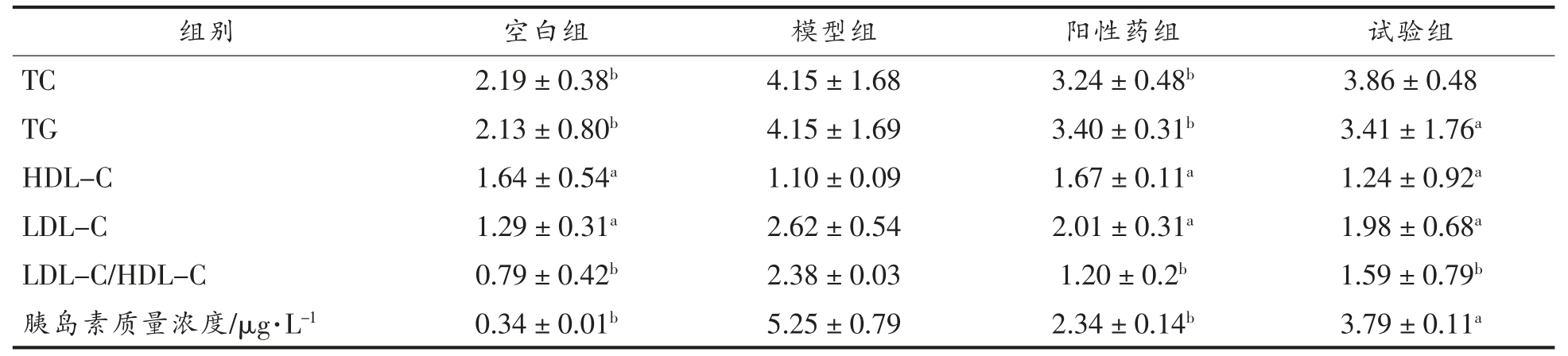
注:同模型组比较,a:0.01<P<0.05;b:P<0.01。
组别 空白组 模型组 阳性药组 试验组TC 2.19±0.38b 4.15±1.68 3.24±0.48b 3.86±0.48 TG 2.13±0.80b 4.15±1.69 3.40±0.31b 3.41±1.76a HDL-C 1.64±0.54a 1.10±0.09 1.67±0.11a 1.24±0.92a LDL-C 1.29±0.31a 2.62±0.54 2.01±0.31a 1.98±0.68a LDL-C/HDL-C 0.79±0.42b 2.38±0.03 1.20±0.2b 1.59±0.79b胰岛素质量浓度/μg·L-1 0.34±0.01b 5.25±0.79 2.34±0.14b 3.79±0.11a
2.2 差异蛋白表达的筛选及功能分析
利用双向电泳技术,分别对模型组、阳性药组和试验组的db/db 糖尿病小鼠的蛋白质表达进行了比较,其蛋白图谱如图1所示。
经双向电泳分析,共有472 个蛋白斑点可以匹配,其中对照组有150 个蛋白斑点,模型组有182 个蛋白斑点,试验组中也检测出140 个蛋白斑点。这些蛋白等电点主要集中在4~7,分子质量在10~130 ku 之间。将差异倍数大于1.5 倍以上(P<0.05)的蛋白点作为显著差异蛋白(见表2)。
表2 仿刺参多肽调控II 型糖尿病鼠肾的差异蛋白质分析
Table 2 The different expression proteins on kidney of type II diabetic mice by Apostichopus joponicus polypeptide
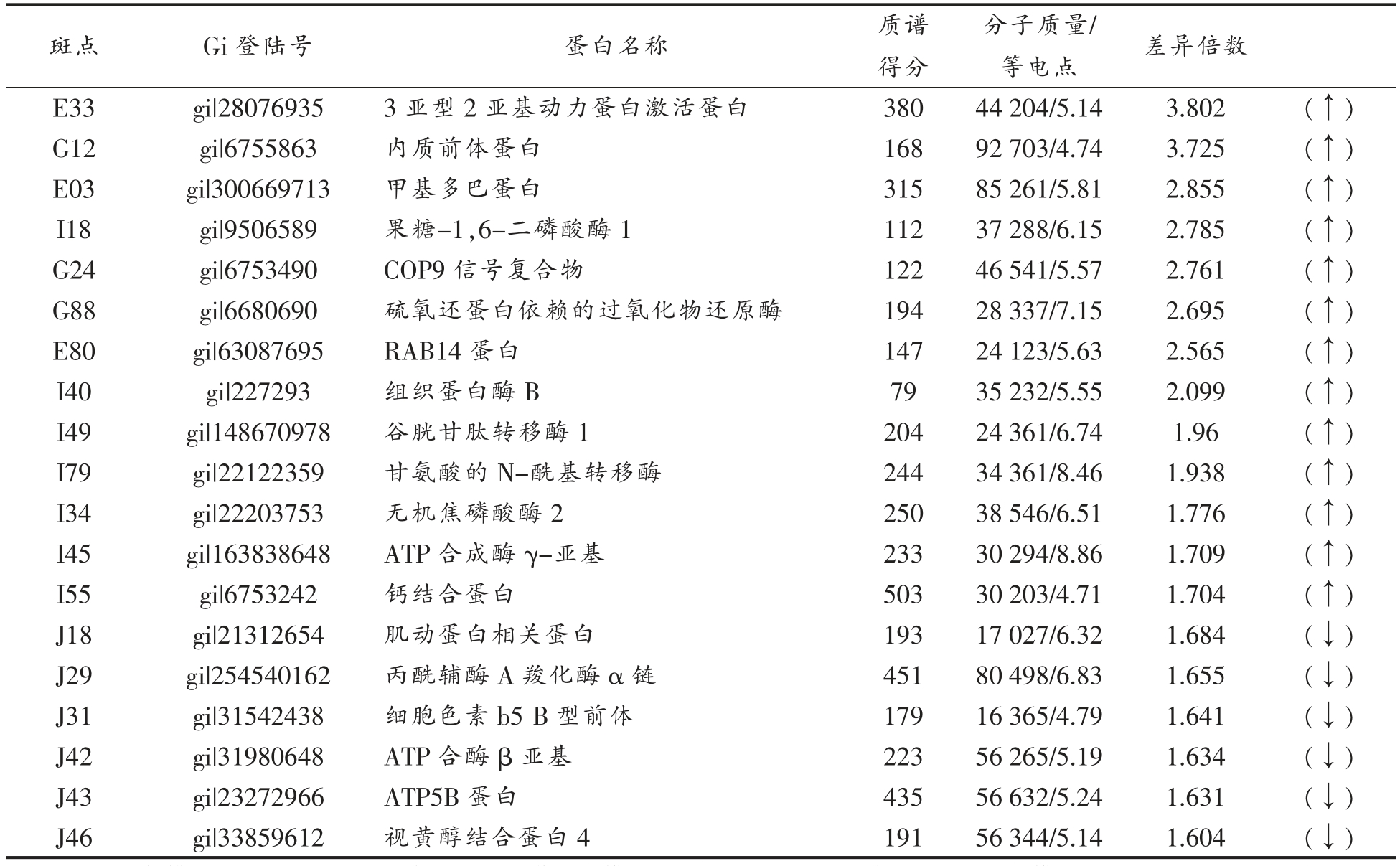
注:E:对照组与模型组比上调的差异蛋白;G:阳性药组与模型组比较上调的差异蛋白;I:试验组与模型组相比上调的差异蛋白;J:试验组与模型组相比下调的蛋白。
斑点 Gi 登陆号 蛋白名称 质谱得分分子质量/等电点 差异倍数E33 gi|28076935 3 亚型2 亚基动力蛋白激活蛋白 380 44 204/5.14 3.802 (↑)G12 gi|6755863 内质前体蛋白 168 92 703/4.74 3.725 (↑)E03 gi|300669713 甲基多巴蛋白 315 85 261/5.81 2.855 (↑)I18 gi|9506589 果糖-1,6-二磷酸酶1 112 37 288/6.15 2.785 (↑)G24 gi|6753490 COP9 信号复合物 122 46 541/5.57 2.761 (↑)G88 gi|6680690 硫氧还蛋白依赖的过氧化物还原酶 194 28 337/7.15 2.695 (↑)E80 gi|63087695 RAB14 蛋白 147 24 123/5.63 2.565 (↑)I40 gi|227293 组织蛋白酶B 79 35 232/5.55 2.099 (↑)I49 gi|148670978 谷胱甘肽转移酶1 204 24 361/6.74 1.96 (↑)I79 gi|22122359 甘氨酸的N-酰基转移酶 244 34 361/8.46 1.938 (↑)I34 gi|22203753 无机焦磷酸酶2 250 38 546/6.51 1.776 (↑)I45 gi|163838648 ATP 合成酶γ-亚基 233 30 294/8.86 1.709 (↑)I55 gi|6753242 钙结合蛋白 503 30 203/4.71 1.704 (↑)J18 gi|21312654 肌动蛋白相关蛋白 193 17 027/6.32 1.684 (↓)J29 gi|254540162 丙酰辅酶A 羧化酶α 链 451 80 498/6.83 1.655 (↓)J31 gi|31542438 细胞色素b5 B 型前体 179 16 365/4.79 1.641 (↓)J42 gi|31980648 ATP 合酶β 亚基 223 56 265/5.19 1.634 (↓)J43 gi|23272966 ATP5B 蛋白 435 56 632/5.24 1.631 (↓)J46 gi|33859612 视黄醇结合蛋白4 191 56 344/5.14 1.604 (↓)
2.3 差异蛋白的功能分析
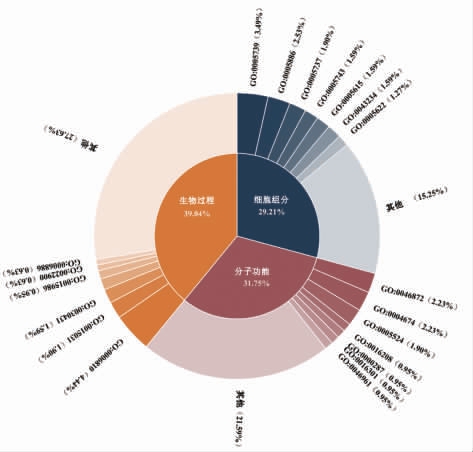
GO 分析发现,试验组中差异表达基因富集显著的生物过程主要与蛋白转运、 激酶活性以及电子传递有关,蛋白转运过程与糖尿病之间存在某些作用,这些过程往往可以控制生物过程中关键蛋白的作用,从而影响整个生物过程。差异基因富集的分子功能过程主要与能量代谢以及激酶活性有关。糖尿病与许多基因之间存在广泛的作用,这些基因中包含一些关键代谢酶的编码序列,可以控制新陈代谢途径中关键酶的表达,从而影响整个新陈代谢[11]。差异基因富集的细胞组分中与非膜结合细胞器、大分子复合物、包外区组分相关。
2.4 差异蛋白的代谢通路分析
差异蛋白的KEGG 分析发现:这些蛋白共涉及12 条代谢通路,主要包括代谢途径、药物代谢及胰岛素抵抗等。糖尿病是一种全身代谢紊乱性疾病,一方面影响糖类代谢,导致高血糖,一方面影响脂质和蛋白质的代谢。胰岛素抵抗是导致糖尿病的重要因素,胰岛素信号通路也和糖尿病息息相关。
3 讨论
3.1 调节糖代谢
自20 世纪70年代以来,人们从海洋生物中分离出多种新型化合物,包括蛋白质类、肽类、多糖类、生物碱类等等。生物活性肽治疗效果好、副作用小,比蛋白质稳定,因此受到越来越多的关注[12]。生物活性肽不仅能为机体提供营养物质,还具有多种功能,如抗氧化、抗辐射、抗衰老、降血糖、抗菌消炎、参与机体的免疫调节等[13],还可以降低体内血压和血糖水平[14]。徐军等[15]研究苦瓜多肽降血糖的功能。王茵等[16]研究从鱼皮中提取胶原蛋白降压肽。顾伟等[17]从大海马蛋白中提取降压肽。多肽调节血糖和血压的作用主要表现在以下几个方面,通过抗氧化、受体调节酶活性和糖代谢激素水平以及提高机体免疫力等增加糖的利用,抑制糖异生,以此来改善糖代谢和胰岛素紊乱的症状。本文的研究结果显示:仿刺参多肽能够调节糖尿病小鼠胰岛素信号通路中关键蛋白-视黄醇结合蛋白4 的表达,它一方面影响肝脏中肝糖的合成和输出,调节机体的糖代谢,一方面调节胰岛素信号通路中激酶活性和受体底物磷酸化,从而达到改善糖代谢和胰岛素紊乱的症状。
3.2 调节脂代谢
研究表明,糖尿病与血脂代谢紊乱密切相关,一般会导致血清TG、TC、LDL-C 升高同时HDL-C降低[18],由此可引发高血压、动脉粥样化和冠心病等多种并发症[19]。本论文中的糖尿病模型组小鼠的脂代谢紊乱现象,其TC、TG、LDL-C 含量均明显高于正常对照组,HDL-C 水平显著降低。而试验组TG、LDL-C 水平均显著降低,HDL-C 水平显著升高,说明仿刺参多肽对糖尿病小鼠有调节血脂紊乱的作用。
3.3 调节胰岛素信号通路
胰岛素是调节能量代谢、 糖代谢和脂代谢的重要激素,当体内葡萄糖多余时,胰岛素通过抑制肝脏葡萄糖生成,并且促进葡萄糖分解成非糖物质,这种特异性反应使得血糖水平降低、体内葡萄糖水平保持在一个狭窄的范围内。这种稳态的机制遭到破坏后就可能导致胰岛素抵抗(IR)[20]。为了调节血糖的正常水平,机体分泌过多胰岛素,从而导致机体一系列病理变化[21]。自2005年视黄醇结合蛋白4(RBP4)被哈佛大学医学院发现以来,许多人就开始研究RBP4 在机体内的作用机制,它是一种单一肽链的蛋白质,属于Lipocalin 超家族成员,相对分子质量约为21 ku,包括181 个氨基酸残基。人类RBP4 基因为单拷贝,大小约10 kb,位于与糖尿病发生有着密切联系的染色体10 q23.3 上[22]。梁琳琅等[23]发现代谢综合征患者血清RBP4 的含量较高;Choi S[24]等研究发现妊娠期糖尿病(pGDM)妇女产后糖耐量减低的严重程度与高RBP4 水平和低脂联素水平有关。Frey S K 等[25]证实慢性肾脏疾病者血清RBP4 明显高于正常对照者。近年来研究发现RBP4 是一种新型的、特殊的循环性脂肪因子,对于胰岛素的合成与聚集具有重要作用[26]。它能够抑制肌肉组织中胰岛信号通路,并且能够促进糖异生的进行,肝糖原输出增加,导致胰岛素抵抗,进而导致糖尿病的发生[27]。本文研究结果显示,喂养仿刺参多肽的糖尿病体内葡萄糖转运蛋白表达增加,视黄醇结合蛋白4的表达下调,磷脂酰肌醇3 激酶的活性和胰岛素受体底物的酪氨酸磷酸化恢复正常,血糖水平也恢复正常,胰岛素通路正常,改善糖尿病的症状。
4 结论
仿刺参多肽可以降低糖尿病小鼠血清TC、TG、LDL-C 水平和胰岛素浓度,提高HDL-C 水平,改善糖尿病小鼠血脂紊乱的现象。同时仿刺参多肽可以使糖尿病小鼠体内视黄醇结合蛋白4 表达下调,使胰岛素信号通路恢复正常,从而达到改善糖尿病的症状。
参 考 文 献
[1]费来华,李赟,陈家鑫.10 种海参16SrDNA 序列多样性及其亲缘关系分析[J].中国水产科学,2008,15(5):755-765.
[2]向怡卉,苏秀榕,董明敏.海参体壁及消化道的氨基酸和脂肪酸分 析[J].水 产科学,2006,25(6):280-282.
[3]苏秀榕,娄永江,常亚青,等. 海参的营养成分及海参多糖的抗肿瘤活性的研究[J]. 营养学报,2003,25(2):181-182.
[4]苏秀榕,向怡卉,郑卫星,等. 刺参消化道多糖的研究[C]// 2007年全国生化与生物技术药物学术年会论文集. 济南:中国药学会,2007.
[5]张悦容,刘文,夏长革,等. 南北人工养殖仿刺参挥发性物质的比较研究[J]. 中国食品学报,2013,13(10):222-230.
[6]侯付景,李妍妍,金春华,等. 白肛海地瓜和刺参体壁的比较分析[J]. 食品科学,2010,31(11):38-41.
[7]穆琳,赵晓玥,高岳,等. 刺参多糖的提取纯化及其组分的分析[J]. 食品安全质量检测学报,2016,7(1):314-321.
[8]吕晶晶,王彩霞,魏娜,等. 自发性2 型糖尿病小鼠db/db 的生物学特性[J]. 沈阳药科大学学报,2013,30(6):455-459.
[9]蒋鑫,徐静,李妍妍,等. 海参消化道多糖降血脂功能的研究[J].中国食品学报,2011,11(7):46-49.
[10]王霞,李妍妍,苏秀榕,等. 金枪鱼胰脏酶解液对糖尿病大鼠血糖和血脂的作用[J].中国食品学报,2012,12(7):24-28.
[11]麻仕利,王伟,梁蓉. 同型半胱氨酸代谢关键酶基因多态性与单纯收缩期高血压关系的初步研究[J].天津医科大学学报,2016,22(2):93-96.
[12]于荣敏,严春艳,曲红艳,等. 近年来海洋生物活性多肽的研究概况与展望[J].海洋通报,2004,23(3):87-93.
[13]王志远,李霞,王斌,等. 仿刺参肠多糖对免疫功能的影响及抗肿瘤研究[J]. 农业生物技术学报,2012,20(5):560-567.
[14]刘雪峰,李磊,闫文亮,等. 杏仁多肽的降血糖活性研究[J]. 内蒙古农业大学学报 (自然科学版),2010,31(2):204-208.
[15]徐军,吴鹏,韩琳,等. 苦瓜中植物降糖多肽的分离及其降糖作用的研究[J].中国医药导报,2007,2(4):148-150.
[16]王茵,吴靖娜,苏捷,等. 鱼皮胶原多肽的降血压效果研究[J]. 中国海洋药物,2014,33(2):39-44.
[17]顾伟,徐永健. 大海马ACE 抑制肽制备及其抗氧化能力的测定[J]. 食品工业科技,2016,37(5):201-211.
[18]KASETTI R B,RAJASEKHAR M D,KONDETI V K,et al.Antihyperglycemic and antihyperlipidemic activities of methanol:water (4∶1)fraction isolated from aqueous extract of Syzygium alternifolium seeds in streptozotocin induced diabetic rats[J].Food and Chemical Toxicology,2010,48(4):1078-1084.
[19]TOYE A A,LEE M,ALISON H,et al.A new mouse model of type 2 diabetes,produced by N -Ethyl-Nitrosourea mutagenesis,is the result of a missense mutation in the glucokinase gene[J].Diabetes,2004,53(6):1577-1583.
[20]谢利芳,许志华,郭凯霞. 2 型糖尿病胰岛素抵抗研究进展[J]. 科学技术与工程,2010,10(15):3664-3669.
[21]RITZ E,BERGIS K,FLISER D.The metabolic syndrome[J].Medical Clinics of North America,1995,88 (4):181-183.
[22]程灿,赵芳芳,王季猛. 视黄醇结合蛋白4 与2 型糖尿病微血管病变的研究进展[J]. 现代生物医学进展,2011,11(2):384-386.
[23]梁琳琅,张杰,周文平,等. 代谢综合征患者血清视黄醇结合蛋白4 的变化及其影响因素[J]. 中国实用内科杂志,2008,28(4):267-270.
[24]CHOI S,KWAK S B,LIM S,et al.High plasma retinol binding protein-4 and low plasma adiponectin concentrations are associated with severity of glucose intolerance in women with previous gestational diabetes mellitus[J].Journal of Clinical Endocrinology &Metabolism,2008,93(8):3142-3148.
[25]FREY S K,NAGL B,HENZE A,et al.Isoforms of Retinol binding protein 4(RBP4)are increased in chronic diseases of the kidney but not of the liver[J].Lipids in Health & Disease,2007,7(1):1-9.
[26]蒋礼,张玲. 视黄醇结合蛋白测定在肾脏疾病中的研究进展[J]. 国外医学(泌尿系统分册),2003,23(5):597-599.
[27]汪明东,孙立山,郑慧雅,等. 血清视黄醇结合蛋白对评价早期肾损伤的诊断价值[J]. 国际检验医学杂志,2011,32(21):2448-2449.
Regulation of Apostichopus joponicus Polypeptide on Kidney of Type ⅡDiabetic Mice
Han Jiaojiao1,2 Li Yanyan3 Zhou Jun1 Lu Chenyang1 Li Ye1 Choeng Lingzhi2 Su Xiurong1*
(1School of Marine Sciences,Ningbo University,Ningbo 315211,Zhejiang2College of Food and Pharmaceutical Sciences,Ningbo University,Ningbo 315211,Zhejiang3King Abdullah University of Science and Technology,Jeddah,Saudi Arabia)
Abstract The purpose of this paper is to study the protection mechanism of Apostichopus joponicus polypeptide toⅡdiabetic mouse (db/db diabetic mouse)kidney.By animal experiments,db/db mice are fed in different groups.Then determinati the content of TC,TG,LDL-C,HDL-C and insulin concentration in mouse serum.The regulation of db/db diabetic mouse kidney is studied by two-dimensional electrophoresis.Then detecting differential proteins of db/db mice kidneys,differential protein expression,GO functional analysis and KEGG pathway analysis.Apostichopus joponicus polypeptide can reduce the levels of serum TC,TG,LDL and insulin concentration,increased HDL-C levels in diabetic mouse.Two-dimensional electrophoresis results showed that compared with the model group,the number of up-regulated protein is 81,and down-regulated protein is 51 in the experimental group.GO results showed that the function of the differential protein mainly focused on protein transport and signal transduction.KEGG analysis revealed that the differential proteins were mainly enriched in metabolic pathways,insulin resistance and insulin signaling processes.The expression of retinol-binding protein 4 in mice fed with polypeptides was reduced,the blood glucose level was decreased,and the insulin signal pathway returned to normal,which could relieve the symptoms of diabetes mellitus.
Keywords Apostichopus joponicus polypeptide;type II diabetes;two-dimensional electrophoresis;differential protein
文章编号 1009-7848(2019)03-0108-07
doi:10.16429/j.1009-7848.2019.03.013
收稿日期:2018-03-03
基金项目:国家农业科技成果转化项目(2007C22030520);浙江省重大科技专项重大农业项目(2008C02009-Ⅱ-2)
作者简介:韩姣姣,女,1993年出生,博士生
通讯作者:苏秀榕 E-mail:suxiurong@nbu.edu.cn