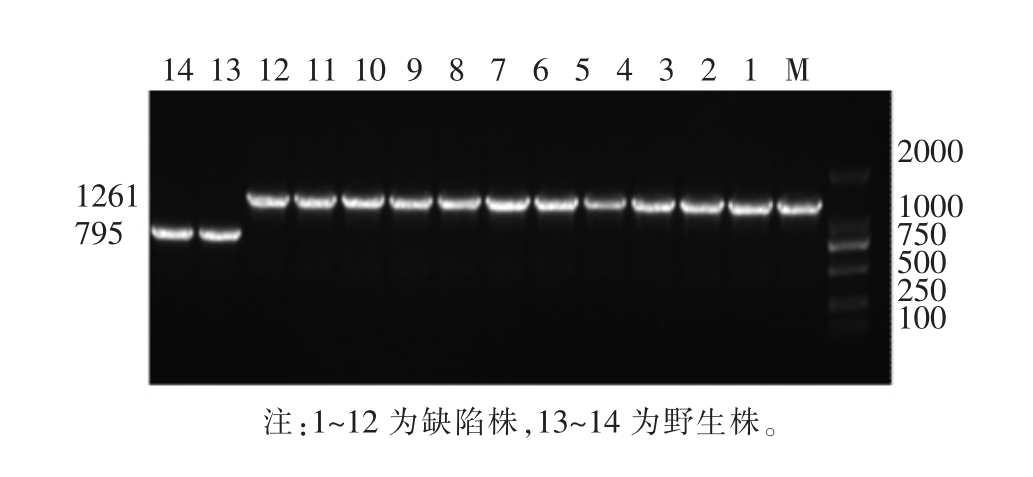
图1 繁殖10 代后野生株和缺陷株凝胶电泳鉴定
Fig.1 Verification of the wild and mutant strain after 10 generations of reproduction
甲型副伤寒沙门氏菌是一种无荚膜的革兰氏阴性杆菌,能够引起伤寒症。据统计,伤寒症导致每年217 000 人死亡,其中中南亚和东南亚是主要的疾病暴发地。已报道的几乎80%伤寒病例来自于8 个南亚国家(孟加拉国、中国、印度、印度尼西亚、老挝、尼泊尔、巴基斯坦和越南),发病以儿童,青少年较多[1]。目前,伤寒肠热病仍是全球的重大公共卫生问题之一,尤其是在亚洲。食品中杀菌的方法很多,包括物理、化学和生物等。热处理是商业应用的标准方法,它是食品工业最经济、最简便和使用最广泛的杀菌方法。为了减少高温对肉制品的风味、营养成分的破坏,许多肉制品加工都采用巴氏杀菌的方法来减少细菌病原体[2-3]。然而,肉类产品的物理和化学特性都可以影响热加工对微生物的杀伤力,因此研究甲型副伤寒沙门氏菌在肉制品加工过程中热响应特性机理是必要的。
σ 因子是原核生物生命活动中的重要调节因子,尤其在响应各种不同环境应激时发挥重要作用[4]。RpoE 调节因子是由rpoE 基因编码,是肠杆菌科中重要的σ 因子[5]。目前rpoE 基因功能研究主要集中于大肠杆菌,功能集中以下方面:温度胁迫、营养胁迫、高渗胁迫、氧化胁迫、其它胁迫和致病过程。而对rpoE 在鼠伤寒沙门氏菌、肠炎沙门氏菌的作用也有初步研究,rpoE 对甲型副伤寒沙门氏菌在肉制品加工过程的复杂的环境条件下的作用尚不清楚。
要确定rpoE 基因功能,需使该基因在甲型副伤寒沙门氏菌中缺失,然后比较缺陷株和野生株的差异,来确定其在肉制品加工过程的复杂环境下的功能。本研究用缺陷株是前期试验中利用Red 同源重组技术对甲型副伤寒沙门氏菌rpoE基因敲除获得的。
为研究甲型副伤寒沙门氏菌rpoE 作为σ 因子在肉制品加工过程的复杂外界环境下的作用,首先通过PCR 检验△rpoE 缺陷株缺陷并稳定表达,然后比较缺陷株和野生株在肉制品加工条件下的致死情况,并在接近加工的不同温度下重复试验,明确rpoE 对甲型副伤寒的影响,进一步研究甲型副伤寒沙门氏菌在不同环境下的应激反应。
1.1.1 菌株 试验所用甲型副伤寒沙门氏菌是从肉中分离的经过国标法生化鉴定、Vitek 测定以及测序鉴定的。缺陷株△rpoE 是前期试验利用此株甲型副伤寒通过Red 同源重组构建的。
1.1.2 试剂 营养肉汤 (Nutrient Broth,NB),青岛高科园海博生物技术有限公司;木糖赖氨酸脱氧 胆 盐 (Xylose Lysine deoxycholate Salt Agar,XLD)琼脂,青岛高科园海博生物技术有限公司;氯化钠(分析纯),天津市瑞金特化学有限公司;Ezup 柱式基因组DNA 抽提试剂盒(细菌),上海生物工程有限公司;引物由上海生物工程有限公司合成。
1.1.3 仪器与设备 HVE-50 高压蒸汽灭菌锅,日本HIRAYAMA 公司;SPX-1505H-Ⅱ生化培养箱,上海新苗医疗器械公司;SW-CJ-2F 超级工作台,苏州安泰空气计数有限公司;THZ-C 台式恒温振荡器,太仓市华美生化仪器厂;EasyMix 均质机,法国AES 公司;THZ-82 水浴锅,金坛市杰瑞尔电器有限公司。
1.2.1 缺陷株△rpoE 鉴定 试验所用甲型副伤寒沙门氏菌是从肉中分离的经过国标法生化鉴定、Vitek 测定以及测序鉴定的。缺陷株△rpoE 是前期试验利用此株甲型副伤寒通过Red 同源重组构建的。将野生株和缺陷株从冰箱里取出,复苏,分别接种于营养肉汤(NB)中,置于37 ℃过夜培养,检查生长情况。采用Ezup 柱式基因组DNA 抽提试剂盒(细菌)提取野生株和缺陷株的基因组DNA。根据NCBI 沙门氏菌rpoE 基因序列用Primer Premier 5.0 软 件 设 计 引 物 F:GAATCGCGGATCAGGT,R:TGCGGCTTATGGAGTG,缺陷株和野生株在繁殖10 代后进行PCR 鉴定,所扩增片段大小分别为1 261,795 bp,对比野生株和缺陷株PCR 产物,确定缺陷株稳定性。
1.2.2 野生株和缺陷株在最适温度37 ℃条件下的生长能力 分别挑取野生株和缺陷株单菌落,接种于NB 液体培养基中37 ℃过夜培养。然后按1∶100 比例接入新鲜NB 液体培养基中,调整OD600值相等后37 ℃培养,每隔2 h 采用涂布法测定菌落数,考察野生株和缺陷株的生长能力。
1.2.3 甲型副伤寒沙门氏菌野生株和缺陷株在介质中的热处理 挑取野生株和缺陷株甲型副伤寒沙门氏菌单菌落,分别接种于100 mL NB 液体培养基中37 ℃摇床培养16 h,达到稳定期。用纯瘦肉灌肠作为介质,采用注射法进行人工污染,人工污染的菌液浓度为108 CFU/mL,样品搅碎称取25 g 注射2.5 mL 菌液[6],放入真空袋中压成片状,用真空包装机抽真空,并封口,37 ℃培养16 h。水浴锅温度设为55,63,72 ℃,加热时间从0~180 min不等。加热时,将样品完全浸没热水中,按照预先设定的时间间隔,定时取出样品进行测定。热处理后的样品应立即放入预先准备好的冰水中阻止其继续进行热失活过程。从设定的温度冷却至室温的时间小于10 s。
1.2.4 活菌计数 采用稀释涂布XLD 培养基进行活菌计数,37 ℃条件下培养18~24 h。
1.2.5 数据处理 数据均以平均值±标准差表示,采用SPSS17.0 进行数据处理与统计分析,所有数据均为3 个平行样品测定3 次。D 值是指在某温度下,活菌数死亡90%所需要的时间,即细菌残存曲线经一个对数周期所需的时间。D 值是细菌死亡率的倒数,D 值越大死亡速度越慢,该菌的耐热性越强。用Linear 模型拟合热致死曲线式中,x 表示加热时间,y 表示细菌活细胞的对数值,可得出该函数的斜率的负倒数为所求的D 值,即D=-1/k。
繁殖10 代后,提取缺陷株和野生株的DNA,然后进行PCR 扩增,可看出野生株可以扩增出大小约795 bp 基因片段,而突变株扩增出1 261 bp的基因片段(red 重组敲除工作中未进行抗性基因无痕敲除,因此缺陷株的片段比野生株长),不过从结果看出缺陷株无法正常表达rpoE (图1),证实了缺陷株△rpoE 的基因稳定性。
通过对最适温度37 ℃下缺陷株和野生株24 h 的生长情况的测定,绘制生长曲线,通过菌液浓度差异来比较两株菌生长情况(图2)。经统计学分析可得,37 ℃时,Mann-Whitney U test 非参数检验得P>0.05,野生株和缺陷株的生长数据没有显著性差异,可以得出两者生长的情况几乎没有差别,说明在非应激条件下,rpoE 基因的活性可能被抑制而不发挥作用。

图1 繁殖10 代后野生株和缺陷株凝胶电泳鉴定
Fig.1 Verification of the wild and mutant strain after 10 generations of reproduction
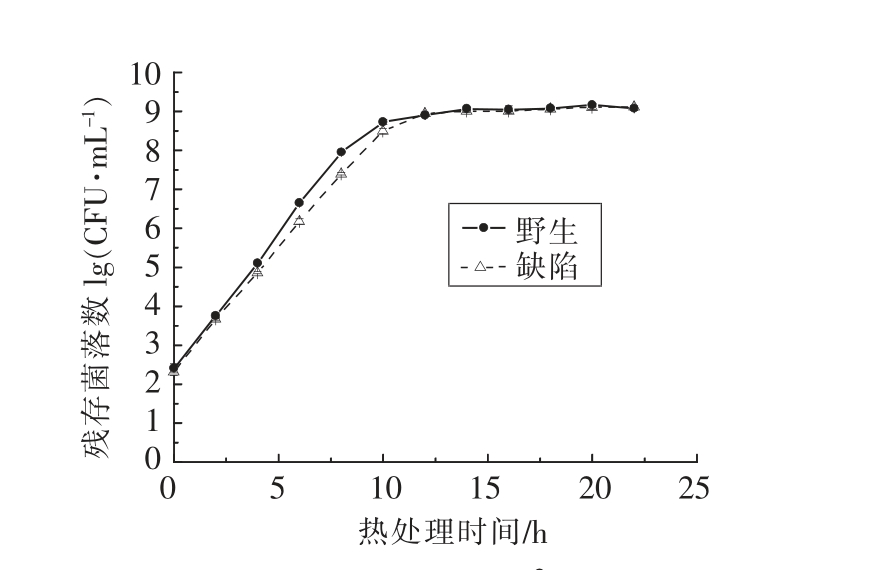
图2 野生株和缺陷株37 ℃生长曲线
Fig.2 The growth curve of wild strains and mutant strains at 37 ℃
通过模拟肉制品加工过程中近似巴氏杀菌的条件,本试验选择了55,63,72 ℃3 个温度进行对纯瘦肉灌肠进行热处理。研究结果如图3所示,甲型副伤寒沙门氏菌缺陷株和野生株的热失活情况有所不同,缺陷株的耐热能力弱于野生株,并且随着样品进行热处理的时间越长,缺陷株的耐热能力越弱于野生株,直至全部死亡。
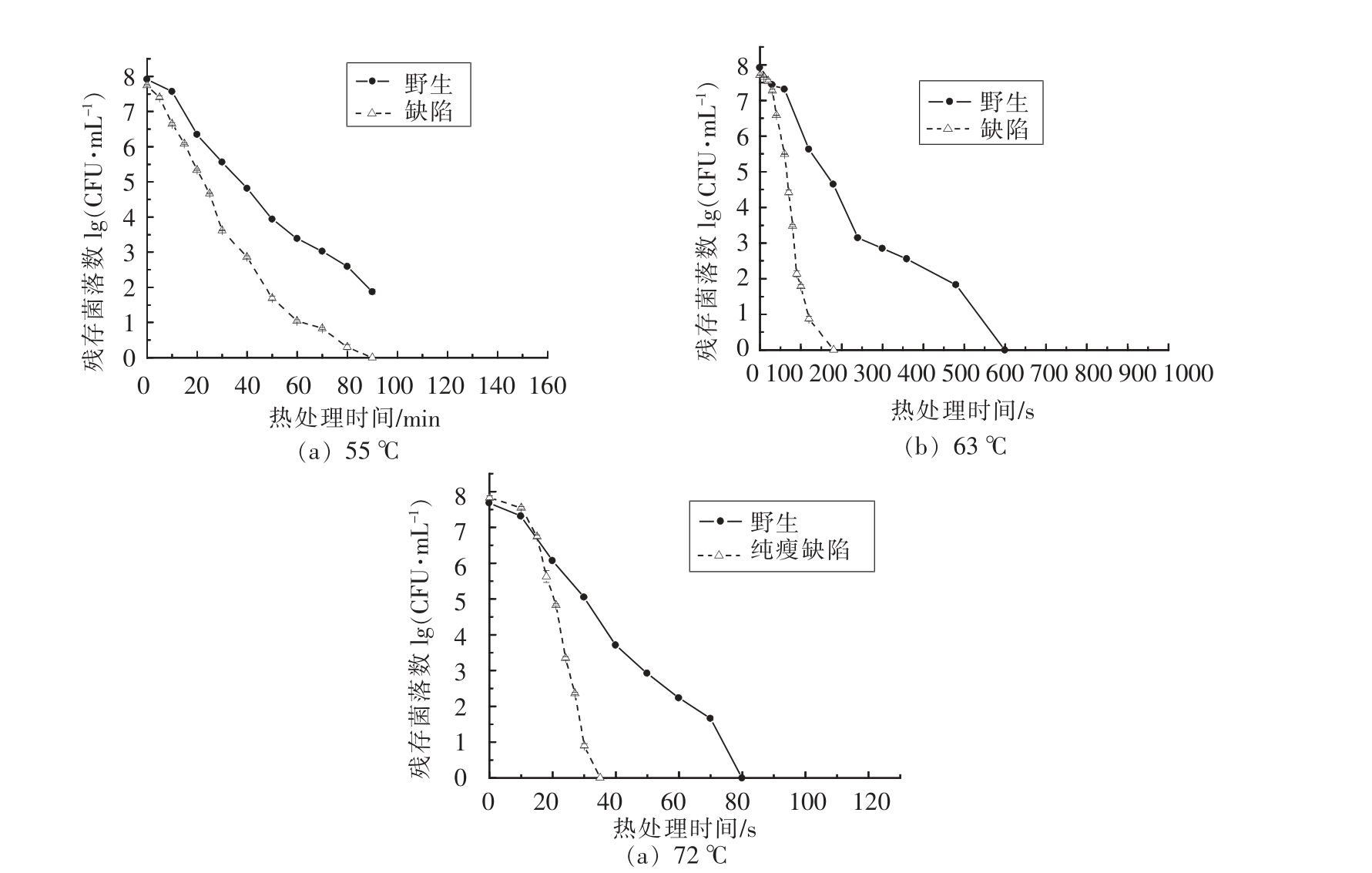
图3 野生株和缺陷株的热失活曲线
Fig.3 The survival curves of wild strains and mutant strains
残存菌落数的对数值随着加热时间的延长而降低。如表1所示,利用Linear 方程求得的甲型副伤寒沙门氏菌野生株和缺陷株的热失活模型的判定系数R2 都大于0.9,并且野生株和缺陷株在55℃的D 值分别为14.0980,10.8933 min,在63 ℃的D 值分别为1.3078,0.3147 min,在72 ℃的D 值分别为0.9885,0.9135 min。3 个温度下甲型副伤寒沙门氏菌缺陷株和野生株的D 值之间有显著性差异(t<0.05)。随着温度的升高,缺陷株和野生株的D 值都随之降低,并且3 个温度下,甲型副伤寒沙门氏菌缺陷株的D 值都明显低于野生株,缺陷株相对于野生株对高温更加敏感,证明rpoE 对甲型副伤寒沙门氏菌在高温下耐热性发挥特定作用,rpoE 缺失会导致甲型副伤寒沙门氏菌对高温的抵抗能力明显下降。
表1 甲型副伤寒沙门氏菌缺陷株和野生株热处理D 值
Table 1 D-values of Salmonella paratyphi A mutant strains and wild strains
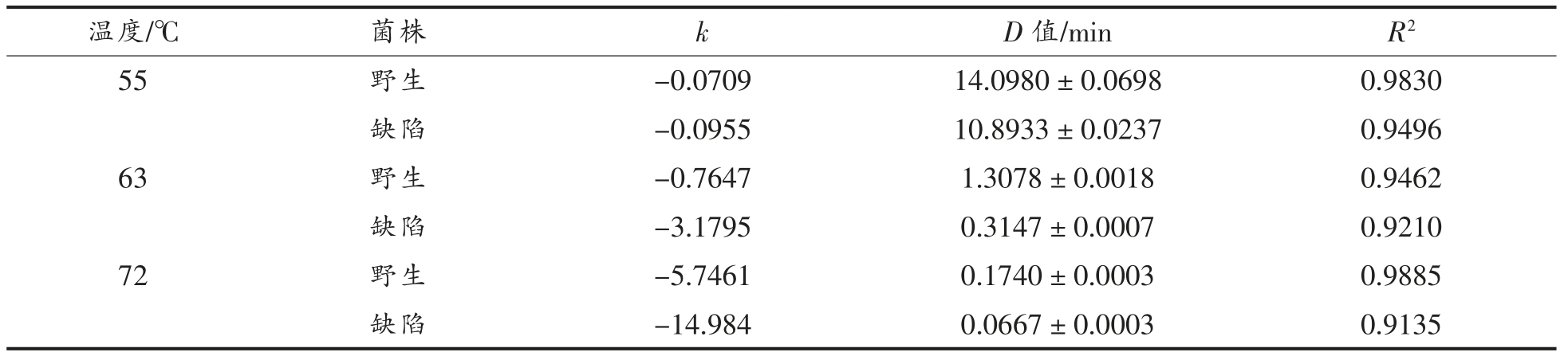
注:k 为Linear 方程拟合的斜率,D 值=-1/k。
温度/℃ 菌株 k D 值/min R2 55 野生 -0.0709 14.0980±0.0698 0.9830缺陷 -0.0955 10.8933±0.0237 0.9496 63 野生 -0.7647 1.3078±0.0018 0.9462缺陷 -3.1795 0.3147±0.0007 0.9210 72 野生 -5.7461 0.1740±0.0003 0.9885缺陷 -14.984 0.0667±0.0003 0.9135
本研究采用的敲除方法是Baudin 等[7]提出的一种后人称为短侧翼同源区PCR 介导基因敲除的方法,是一种近年兴起的体内同源重组的新型遗传工程技术[8-11]。该技术仅需要35~60 bp 的同源序列就可以完成对目的基因的精确敲除,并且重组效率极高[12]。试验发现,此方法也适用于甲型副伤寒沙门氏菌基因的敲除,并且其稳定性极好。
有研究表明,rpoE 对大肠杆菌的生存是必不可少的[13],如大肠杆菌rpoE 的缺失会导致菌株立即死亡[14]。然而对于其他细菌,如鼠伤寒沙门氏菌等和具有和大肠杆菌同源性较高的细菌的生存的影响并不显著。本研究结果显示,从△rpoE 的传代稳定性和最适温度下的生长情况,可以看出rpoE的缺失并不影响甲型副伤寒沙门氏菌的生存能力,并且在最适温度下,rpoE 基因的活性可能在没有受到外界环境的胁迫下并不会发挥作用。
比较不同温度下缺陷株和野生株致死情况,证明rpoE 基因对甲型副伤寒沙门氏菌的耐热能力具有重要作用。进一步阐明了rpoE 基因作为σ因子在甲型副伤寒沙门氏菌响应环境胁迫过程中的生物学功能,为进一步探讨甲型副伤寒沙门氏菌耐热机理及其相关分子调控机制提供了新的依据和有意义的尝试。
[1]CHAU T T,CAMPBELL J I,GALINDO C M,et al.Antimicrobial drug resistance of Salmonella enterica serovar typhi in asia and molecular mechanism of reduced susceptibility to the fluoroquinolones[J].Antimicrobial Agents & Chemotherapy,2008,51(12):4315-4323.
[2]HEIR E,HOLCK A L,OMER M K,et al.Effects of post-processing treatments on sensory quality and Shiga toxigenic Escherichia coli,reductions in dryfermented sausages[J].Meat Science,2013,94(1):47-54.
[3]DUCIC M,KLISARA N,MARKOV S,et al.The fate and pasteurization -based inactivation of Escherichia coli,O157,Salmonella,Typhimurium and Listeria monocytogenes,in dry,fermented sausages[J].Food Control,2016,59:400-406.
[4]ZHANG S.Dental caries and vaccination strategy against the major cariogenic pathogen,Streptococcus mutans[J].Current Pharmaceutical Biotechnology,2013,14(11):960-966.
[5]BUSBY S,EBRIGHT R H.Promoter structure,promoter recognition,and transcription activation in prokaryotes[J].Cell,1994,79(5):743-746.
[6]HEIN I,FLEKNA G,KRASSNIG M,et al.Realtime PCR for the detection of Salmonella spp.in food:An alternative approach to a conventional PCR system suggested by the FOOD-PCR project[J].Journal of Microbiological Methods,2006,66(3):538-547.
[7]BAUDIN A,OZIER-KALOGEROPOULOS O,DENOUEL A,et al.A simple and efficient method for direct gene deletion in Saccharomyces cerevisiae[J].Nucleic Acids Research,1993,21(14):3329-3330.
[8]DATSENKO K A,WANNER B L.One-step inactivation of chromosomal genes in Escherichia coli K-12 using PCR products[J].Proceedings of the National Academy of Sciences of the United States of America,2000,97(12):6640-6645.
[9]SOLANO C,GARCÍA B,VALLE J,et al.Genetic analysis of Salmonella enteritidis,biofilm formation:critical role of cellulose[J].Molecular Microbiology,2002,43(3):793-808.
[10]MUYRERS J P,ZHANG Y,TESTA G,et al.Rapid modification of bacterial artificial chromosomes by ET-recombination[J].Nucleic Acids Research,1999,27(6):1555-1557.
[11]YU D,ELLIS H M,LEE E C,et al.An efficient recombination system for chromosome engineering in Escherichia coli[J].Proceedings of the National Academy of Sciences,2000,97(11):5978-5983.
[12]白光兴,孙志伟,黄莺,等.利用Red 重组系统对大肠杆菌ClpP 基因的敲除[J].中国生物化学与分子生物学报,2005,21(1):35-38.
[13]PEÑAS A D L,CONNOLLY L,GROSS C A.SigmaE is an essential sigma factor in Escherichia coli[J].Journal of Bacteriology,1997,179(21):6862-6864.
[14]ROLHION N,CARVALHO F A,DARFEUILLEMICHAUD A.OmpC and the σ E,regulatory pathway are involved in adhesion and invasion of the Crohn’s disease-associated Escherichia coli,strain LF82[J].Molecular Microbiology,2007,63(6):1684-1700.
Effect of RpoE Deffect on Characterization of Heat Shock Response of Salmonella paratyphi A during the Meat Products Processing