
图1 核桃蛋白组分分离提取工艺流程图
Fig.1 Flow chart of walnut protein fractionation
核桃除部分出口和国内鲜食销售外,加工成核桃油、核桃粉、核桃乳等产品比较普遍。蛋白质不仅是核桃油生产副产物——脱脂粕的主要成分,也是加工核桃粉和核桃乳产品良好的原料。随着我国人民生活水平的提高及人们对具有医疗保健功能的核桃食品认识的提高,研究工作主要集中在核桃提油后的脱脂粕的研究。全面了解核桃蛋白质组成是有效利用核桃脱脂粕这一核桃加工副产物的前提和基础。
核桃蛋白质,不仅是核桃油生产副产物——脱脂粕的主要成分,也是加工核桃粉和核桃乳产品良好的原料。由于各地核桃提油方法的不同,所以造成脱脂粕的成分复杂,蛋白质功能性差异比较大,致核桃蛋白质很难广泛地应用到食品加工中。对核桃蛋白的分离提取研究,不仅有利于进一步了解核桃蛋白质的性质,也能得到制备高纯度蛋白的方法。
根据核桃蛋白组成和性质的研究报道[1-6],核桃蛋白分离提取的方法普遍采用碱溶酸沉的方法制备核桃分离蛋白[7-9]。采用的不同核桃原料和处理方法,提取碱溶蛋白时的pH 值有一定差异,酸沉点有差异,使核桃分离蛋白的纯度有一定差异,产品的功能性也有差异。本文研究获得较高纯度的核桃分离蛋白的最优提取工艺,为进一步研究核桃蛋白质的功能性奠定基础。
核桃(Juglans Legia L.)购于新疆石河子市农贸市场,属新疆和田薄皮核桃。正己烷,氢氧化钠,盐酸,95%乙醇,85%磷酸等购于上海化学试剂公司。考马斯亮蓝G-250,牛血清白蛋白购于上海生化试剂公司。氢氧化钠,氢氧化钙,碳酸钠,均为国产化学纯试剂。
DS-1 高速组织捣碎机,上海标本模型厂;J6大容量冷冻离心机,美国贝克曼公司;UV-2100紫外可见分光光度计,尤尼科上海有限公司;CR21G 高速冷冻离心机,日本日立公司;90-1 恒温磁力搅拌器,上海沪西分析仪器厂;HH-S 数显恒温水浴锅,江苏金坛市医疗仪器厂;WH-1 微型漩涡混合仪,上海沪西分析仪器厂;PHS 一3C pH计,上海精密科学仪器有限公司。
1.3.1 核桃仁及脱脂粉基本成分的测定 蛋白质含量的测定参照AOAC 950.48 的方法[10],采用微量凯式定氮法测定,核桃蛋白质的转换系数为5.30。脂肪含量的测定参照AOAC 984.22 的方法测定[11],样品置于索氏提取器中,用石油醚来提取脂肪。灰分含量的测定参照AOAC 920.15 的方法[12]测定,将样品置于525 ℃下煅烧4 h,称量残渣的质量。水分含量的测定参照AOAC 925.40[13]的方法测定,将样品在105 ℃±1 ℃的烘箱中干燥至恒重。碳水化合物含量的测定参照Zhu[14]的方法测定,碳水化合物含量的计算按照100%减去样品的水分含量,灰分含量,脂肪含量及蛋白质含量的总合。
1.3.2 蛋白质氮溶解指数(NSI)的测定 将一定量的核桃蛋白样品分散于去离子水中,于室温下磁力搅拌1 h 后离心(10 000 g,30 min)。收集上清液,上清液中可溶解氮含量用微量凯氏定氮法[10]测定,以可溶解氮与样品中总氮的百分比表示溶解度。
1.3.3 蛋白质非蛋白氮(NPN)的测定 参考Wolf[15]和Wolf 等人[16]的方法,略改。称取1.0 g 核桃脱脂粉,加入15 mL 10%(w/v)三氯乙酸溶液,在室温下进行磁力搅拌1 h,然后在室温下于15 000 g 离心30 min。收集上清液,用微量凯氏定氮法测定上清液中的氮含量。NPN 含量用上清液含氮量与脱脂粉中总氮含量之比(百分数)表示。
1.3.4 蛋白质在不同溶剂中可溶解蛋白含量的测定 参考Venkatachalam[4]的方法,略改。称取核桃脱脂粉1.0 g,加入溶剂10 mL,在室温下磁力搅拌1 h。溶剂(最终提取液的pH)分别为:去离子水(pH 6.50),1.0 mol/L NaCl(pH 6.31),0.1 mol/L 磷酸钠缓冲液 (pH 7.52),0.1 mol/L NaOH(pH 12.56),70%(V/V)乙醇溶液 (pH 6.28)0.1 mol/L Tris-HCl(pH 8.02)。不同溶剂提取后离心(15 000 g,30 min,室温),收集上清液用微量凯氏定氮法[10]测定溶解蛋白质的含量,不同溶剂溶解蛋白的含量单位为mg 蛋白质/100 mg 脱脂粉。
1.3.5 核桃脱脂粉的制备 参照Sze-Tao 的方法[1],略改。核桃仁用2% NaOH 浸泡4min(之前将核桃仁浸泡在水中0.5 h)的方法去除核桃仁皮后进行烘干(45~48 ℃)、粉碎等工序,采用正己烷以1∶5(w/v)的料液比提取1 h,然后进行抽滤,收集残渣再进行提取,以滤液为无色透明时,收集残渣,置于通风橱挥干溶剂。将残渣用粉碎机粉碎后过150 目筛,即为核桃脱脂粉,置于冰箱4 ℃冷藏备用。
1.3.6 核桃蛋白组分的分离提取 参考Osborne[17]关于植物蛋白4 种蛋白的分离方法,以及参照Sze-Tao[1]关于核桃蛋白组分的分离方法,略改。以核桃脱脂粉为原料,按照图1的流程进行清蛋白、球蛋白、谷蛋白、醇溶蛋白的分离提取,每步提取重复2 次,以利于蛋白组分的充分提取,收集不同组分的上清液,在4 ℃下透析48 h 后冻干,置于冰箱4 ℃冷藏备用。

图1 核桃蛋白组分分离提取工艺流程图
Fig.1 Flow chart of walnut protein fractionation
1.3.7 蛋白质提取率的计算
蛋白质提取率%=
1.3.8 核桃蛋白分离提取工艺的优化
1)pH 对核桃蛋白质提取效果的影响 以溶出蛋白质为指标,称取1.0 g 脱脂粉,加入20 mL的去离子水(即料液比为1∶20,w/v),在室温下进行磁力搅拌,分别调节溶液的pH 为1~12,待溶液的pH 恒定后再进行磁力搅拌浸提1 h,然后在室温下以10 000 g 离心10 min,取一定量的上清液用考马斯亮蓝法测定提取液的蛋白质含量,计算不同pH 条件下蛋白质的提取率,确定最佳提取pH。
2)提取时间对核桃蛋白质提取效果的影响以溶出蛋白质为指标,称取1.0 g 脱脂粉,加入20 mL 的去离子水(即料液比为1∶20,w/v),在室温下进行磁力搅拌,调节溶液的pH 为11.0,待溶液的pH 恒定后分别进行磁力搅拌0.5,1,1.5,2,2.5,3,3.5 h,然后在室温下以10 000 g 离心10 min,取一定量的上清液用考马斯亮蓝法测定提取液的蛋白质含量,计算不同提取时间下蛋白质的提取率,确定最佳提取时间。
3)料液比对核桃蛋白质提取效果的影响以溶出蛋白质为指标,称取1.0 g 脱脂粉,分别按料液比为1∶5,1∶10,1∶20,1∶30,1∶40,1∶50,1∶60(w/v),在室温下进行磁力搅拌,调节溶液的pH 为11.0,待溶液的pH 恒定后进行磁力搅拌1 h,然后在室温下以10 000 g 离心10 min,取一定量的上清液用考马斯亮蓝法测定提取液的蛋白质含量,计算不同料液比下蛋白质的提取率,确定最佳料液比。
4)提取温度对核桃蛋白质提取效果的影响以溶出蛋白质为指标,称取1.0 g 脱脂粉,加入20 mL 的去离子水[即料液比为1 ∶20(m/V)],在室温下进行磁力搅拌,调节溶液的pH 为11.0,待溶液的pH 恒定后分别调节溶液的温度为:30,35,40,45,50,55,60,65 ℃进行磁力搅拌1 h,然后在室温下以10 000 g 离心10 min,取一定量的上清液用考马斯亮蓝法测定提取液的蛋白质含量,计算不同提取温度下蛋白质的提取率,确定最佳提取温度。
5)响应面分析法优化核桃蛋白质提取条件综合pH、提取时间、料液比、提取温度等对核桃蛋白质提取效果的单因素试验结果,由于pH 对核桃蛋白质的提取率有很大影响,此外也影响提取蛋白质的色泽,因此,固定提取pH 11,确定对核桃蛋白质提取效果影响比较显著的其他三因素为:料液比、提取温度、提取时间,采用响应面法(RSM)(Box-Behnken 中心组合)对提取条件进行响应面分析,以蛋白质提取率为响应值。因素与水平见表1。
表1 响应面分析因素与水平
Table 1 Levels and codes of variables chosen for response surface analysis
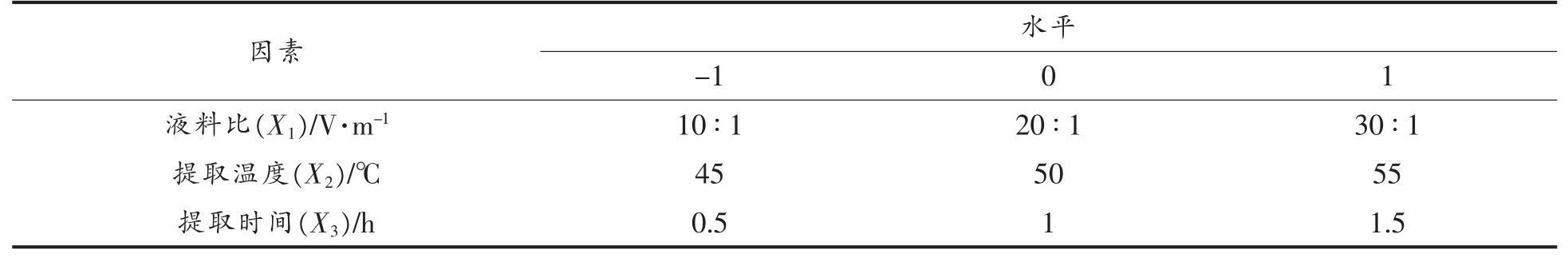
因素 水平-1 0 1液料比(X1)/V·m-1 10 ∶1 20 ∶1 30 ∶1提取温度(X2)/℃ 45 50 55提取时间(X3)/h 0.5 1 1.5
1.3.9 核桃碱溶蛋白酸沉点的确定 通过碱提得到核桃蛋白提取液后,要制备分离蛋白,需要将蛋白质溶液沉淀下来,一般选择酸沉工艺,即将蛋白质提取液pH 调整到等电点。根据响应面分析优化得到的核桃蛋白提取最佳条件参数,即提取pH 11,料液比1∶26,提取温度53 ℃,提取1.5 h,得到的蛋白质提取液,在室温下以10 000 g 离心10 min,收集上清液,用0.1 mol/L HCl 调节上清液的pH 分别为3,3.5,4,4.5,5,5.5,6。待蛋白液的pH稳定后进行磁力搅拌1 h,然后在室温下以10 000 g 离心10 min,取一定量的上清液用Bradford 法[18]测定蛋白质含量,以上清液中可溶性蛋白质含量(mg/100 mg 脱脂粉)最低为核桃碱溶蛋白酸沉点。
1.3.10 数据处理与分析 试验数据以均值±标准误差的形式表示,数据采用SPSS 11.0 (Chicago,Illinois)统计软件进行方差分析和显著性检验(LSD,P<0.05)。
新疆薄皮核桃仁主要成分见表2。结果显示,新疆薄皮核桃仁蛋白质含量高达17.66%,蛋白质含量高于我国其它地区的核桃,如:云南大姚核桃(16.2%),小油笼核桃(13.6%)等[19]。此外,粗脂肪含量达60.84%,低于我国其它地区的核桃,如云南大姚核桃(73.88%),山东核桃(68.89%)[20]。与国外的核桃相比,新疆薄皮核桃蛋白质含量高于美国核桃(16.66%),而粗脂肪含量低于美国核桃(66.90%)[1],分析新疆薄皮核桃仁蛋白质含量较高而粗脂肪含量较低的原因,可能由于新疆特殊的地理环境和气候对核桃的生长和发育产生了一定的影响。
对新疆薄皮核桃仁进行脱脂处理后得到的核桃脱脂粉的基本成分见表2。结果显示,脱脂后的核桃粉粗脂肪降至1.80%,蛋白质含量为52.51%,水分含量变化比较大,为9.20%,灰分降至0.54%。核桃脱脂粉的NPN 为3.74%,NSI 为7.64%,相比较脱脂大豆蛋白的NSI (75.3%)[21]要低得多。新疆薄皮核桃脱脂粉较低的NSI 会增加核桃蛋白产品的溶解难度,因此,通过一定的工艺处理制备核桃蛋白产品将有助于核桃蛋白质的溶解度的增加。
表2 核桃仁及核桃脱脂粉的主要成分
Table 2 Components of walnut kernel and defatted walnut flour

原料 蛋白质/% 粗脂肪/% 灰分/% 水分/% 碳水化合物/% NSI/% NPN/%核桃仁 17.66±0.42 60.84±1.04 1.94±0.02 3.20±0.01 16.36±0.12 - -核桃脱脂粉 52.51±0.33 1.80±0.12 0.54±0.02 9.20±0.02 35.95±0.16 7.64±0.12 3.74±0.15
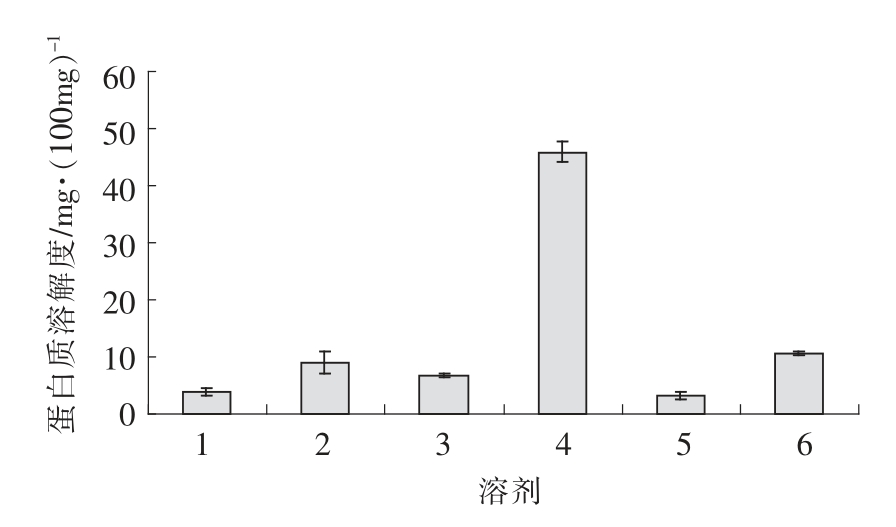
图2 不同溶剂对核桃脱脂粉蛋白溶解度的影响
Fig.2 Influence of solubilising agent on defatted walnut flour protein solubility
注:溶剂(提取液的pH 值)分别为:1.去离子水(pH 6.50);2.1.0 mol/L NaCl (pH 6.31);3.0.1 mol/L 磷酸钠缓冲液(pH 7.52);4.0.1 mol/L NaOH(pH 12.56);5.70%(v/v)乙醇溶液(pH 6.28);6.0.1 mol/L Tris-HCl(pH 8.02)。
用微量凯氏定氮法测定不同溶剂提取核桃脱脂粉中可溶性蛋白质的含量,结果见图2。6 种不同的溶剂中,0.1 mol/L NaOH 溶液溶解蛋白量最高,溶解蛋白质可达45.89 mg/100 mg 脱脂粉;70%乙醇溶液溶解蛋白量最低,溶解蛋白质仅为3.23 mg/100 mg 脱脂粉;0.1 mol/L Tris-HCl 溶解蛋白质量与1 mol/L NaCl 溶液溶解蛋白量比较相似,分别为10.67 mg/100 mg 脱脂粉和8.98 mg/100 mg脱脂粉。上述研究结果与Sze-Tao 等[1]的研究结果比较相似,但溶解蛋白含量均比Sze-Tao 的研究结果低,可能是微量凯氏定氮法测定[3]结果比Lowry 法[22]测定结果偏低的原因。Venkatachalam等人[4]比较了Lowry 法和微量凯氏定氮法测定美国山核桃的蛋白质的含量,结果发现,微量凯氏定氮法测定结果普遍比Lowry 法测定结果低。以上结果表明,核桃蛋白质在碱性溶液中蛋白质溶出率比较高,而在70%乙醇溶液和去离子水中蛋白质溶出率比较低,这说明碱液是核桃蛋白质比较好的溶剂。
以核桃脱脂粉为原料,按照核桃蛋白组分分离工艺流程图(见图1)的步骤进行分离得到核桃蛋白组成为:谷蛋白、清蛋白、球蛋白、醇溶蛋白。4种核桃蛋白质组分在核桃总蛋白质中所占的比例即含量见图3。结果显示,清蛋白、醇溶蛋白、谷蛋白、 球蛋白的含量分别是7.54%,4.73%,72.06%,15.67%。由此可以看出,谷蛋白是构成核桃蛋白组成的主要部分,含量超过了70%,这与Sze-Tao 等[1]研究的美国核桃(Juglans Legia L.)结果基本一致,同时与Venkatachalam 等[4] 研究的山核桃(Carya illinoinensis)结果相似,这主要是因为研究对象都属于核桃科胡桃属植物。球蛋白排第二,占核桃蛋白的14.08%,其次清蛋白占7.54%,含量最少的是醇溶蛋白,占4.73%。核桃蛋白质的组成与巴旦杏[23]、腰果[24-25]和开心果[26]等坚果的蛋白组成有一定差异,巴旦杏、腰果和开心果等坚果的蛋白组成中含有大量的球蛋白和清蛋白,其中,球蛋白含量占总蛋白的40%以上。此外,核桃蛋白的组成与豆科类蛋白组成明显不同,豆类蛋白质没有醇溶蛋白,以球蛋白为主,占60%~70%,其次还包括清蛋白(15%~21%)、谷蛋白(10%~15%),其中大豆中球蛋白占60%~90%[27-28],花生含90%球蛋白和10%的清蛋白[29]。谷物中,大米蛋白由75%~79%谷蛋白,13%~15%球蛋白,4.5%~6%清蛋白,小于3%的醇溶蛋白构成[30-31],相比之下,核桃蛋白的组成与大米蛋白比较相似。由于谷蛋白是构成核桃蛋白的主要组成,核桃蛋白的NSI 较豆科类蛋白低很多。

图3 核桃蛋白组分及含量
Fig.3 Content of walnut protein fractions
2.4.1 pH 对核桃蛋白质提取效果的影响 pH 对核桃蛋白质提取效果的影响见图4。由图4可以看出,pH 对核桃脱脂粉中蛋白质的提取率有显著的影响(P<0.05)。核桃蛋白质在中性和酸性pH 中提取率比较低,尤其在酸性条件下,如pH 3~7 之间,核桃蛋白质的提取率最低,低于10%以下,这与Sze-Tao 等人[1]的研究结果一致。在pH 1~2 之间,蛋白质的提取率在15%~18%,在碱性条件下,随着pH 的升高,蛋白质的提取率逐渐提高。pH 8以后,随着pH 的升高,提取率显著增加,到pH 11时,提取率达71.12%,随后提取率增加缓慢,到pH 12 时,提取率达75.23%。上述研究结果与本论文第二章中核桃蛋白质的组分研究结果刚好吻合,由于谷蛋白是核桃蛋白的主要组成成分,占核桃总蛋白的70%以上,因此,在碱性条件下,由于大部分谷蛋白和少量球蛋白和清蛋白溶出,所以核桃蛋白的提取率较高。Venkatachalam 等人[4]也得到相似的研究结果。由于pH 11 以后,核桃蛋白质的提取率提高不显著,且核桃蛋白质提取液的颜色开始发生褐变,可能由于核桃蛋白质含有单宁。Osborne 和Campbell[32]报道了英国核桃蛋白质包含3.5%(w/w)的球蛋白,之后在核桃仁除去单宁后核桃蛋白质中的球蛋白的得率提高到20%[33]。这些早期的研究结果表明,核桃仁中单宁物质的存在能极大的影响核桃球蛋白的溶解度。综合考虑提取率和提取蛋白的色泽,选取pH11为核桃蛋白质最佳提取pH。
2.4.2 提取时间对核桃蛋白质提取效果的影响
提取时间对核桃蛋白质提取率的影响见图5。由图5可以看出,随着提取时间的延长,核桃蛋白的提取率逐渐提高。提取时间从0.5 h 增加到1 h,核桃蛋白质的提取率显著提高,从62.23%提高到71.02%,随后,随着提取时间的延长,核桃蛋白质提取率增加缓慢。在提取初期,核桃蛋白质没有完全溶解,随着提取时间的延长,核桃蛋白质的溶出量不断增加。当核桃蛋白质的溶出量增加到一定程度后,在固定的条件下,由于核桃蛋白质大部分已经溶解出来,即使再增加提取时间,也只能有很少的蛋白质继续溶出,因此,随着提取时间的延长,核桃蛋白质的提取率增加缓慢。综合考虑节约能源和蛋白质提取率等因素,提取时间为1 h 为核桃蛋白的最佳提取时间。
2.4.3 料液比对核桃蛋白质提取效果的影响 料液比对核桃蛋白质提取效果的影响见图6。由图6可以看出,随着料液比的不断增加,核桃蛋白的提取率逐渐增加。Venkatachalam 等人[4]和刘淼[34]也得到了相似的研究结果。当料液比从1∶5(m/V)增加到1 ∶20 (m/V)时,核桃蛋白质的提取率显著提高,从52.76%提高到71.89%,随后,随着料液比的继续增加,当料液比从1∶20 (m/V)增加到1∶50(m/V)时,核桃蛋白质的提取率增加缓慢,从71.89%增加到78.12%。当料液比较小的时候,蛋白质没有完全溶出,随着料液比的增加,增加了水分子与蛋白质分子的相互接触,从而促进了蛋白质的溶解,因此,蛋白质提取率显著提高。当蛋白质基本已完全溶出,在现有的条件下,即使继续增加料液比,对蛋白质的溶解无显著提高作用。综合考虑蛋白质的提取工艺和提取率,以料液比为1∶20(m/V)为最佳提取蛋白料液比。
2.4.4 提取温度对核桃蛋白质提取效果的影响提取温度对核桃蛋白提取效果的影响见图7。由图7可以看出,随着提取温度的升高,核桃蛋白提取率逐渐提高,当提取温度达50 ℃时,蛋白质提取率为77.98%。当温度升至55 ℃时,蛋白质提取率有少量增加,随后,蛋白质提取率随温度的升高不断下降,当温度达70 ℃时,蛋白质提取率为64.67%。刘淼[34]和姜荣庆[9]也得到了相似的研究结果。当提取温度较低时,水分子和蛋白质分子不能充分进行相互作用,因而蛋白质提取率较低,当提取温度逐渐升高时,对水分子和蛋白质分子的相互作用有一定的促进作用,有利于蛋白质溶解度的提高,因而,升高温度对于核桃蛋白质的提取率有一定提高作用。当提取温度升高到一定值时,这时高温可能引起部分蛋白质发生变性而发生聚集,从而使蛋白质溶出量减少,此外,高温可能引起核桃脱脂粉中其他成分如碳水化合物黏度增大而与蛋白质发生粘合[35],从而使核桃蛋白质的提取率下降。综合考虑蛋白质提取率和蛋白提取工艺,以50 ℃为核桃蛋白质最佳提取温度。
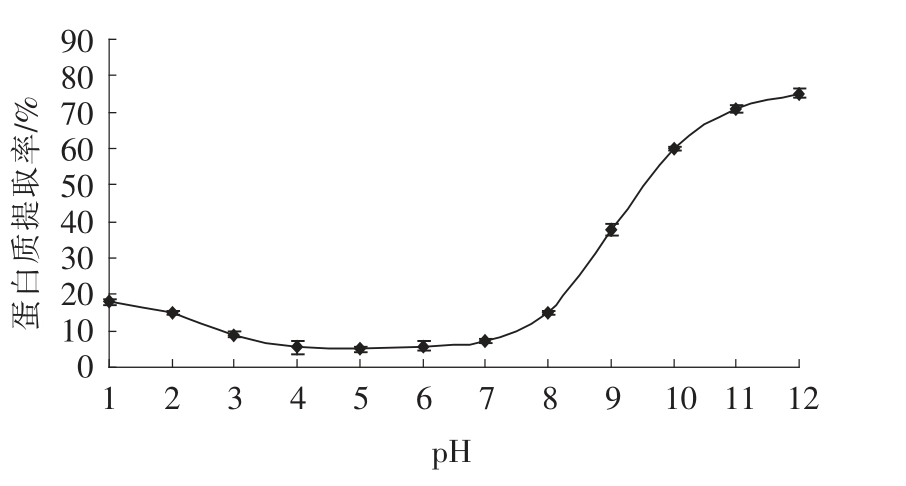
图4 pH 对核桃蛋白质提取效果的影响
Fig.4 Effect of pH on walnut protein extraction
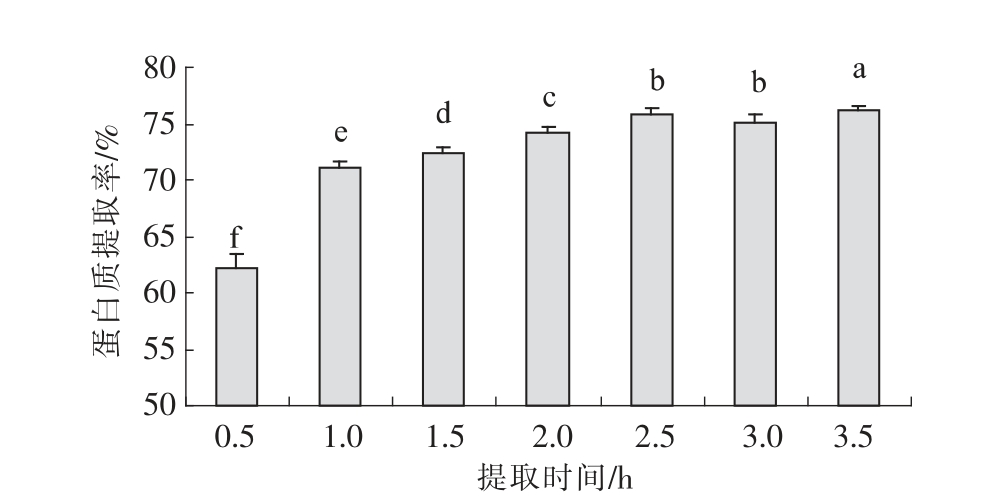
图5 提取时间对核桃蛋白质提取效果的影响
Fig.5 Effect of extraction time on walnut protein extraction
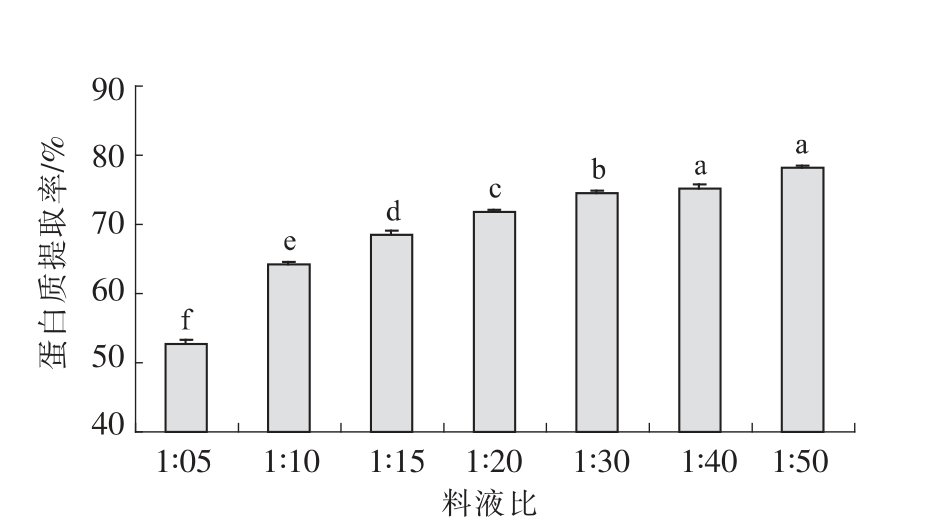
图6 料液比对核桃蛋白质提取效果的影响
Fig.6 Effect of flour-to-solvent ratio on walnut protein extraction
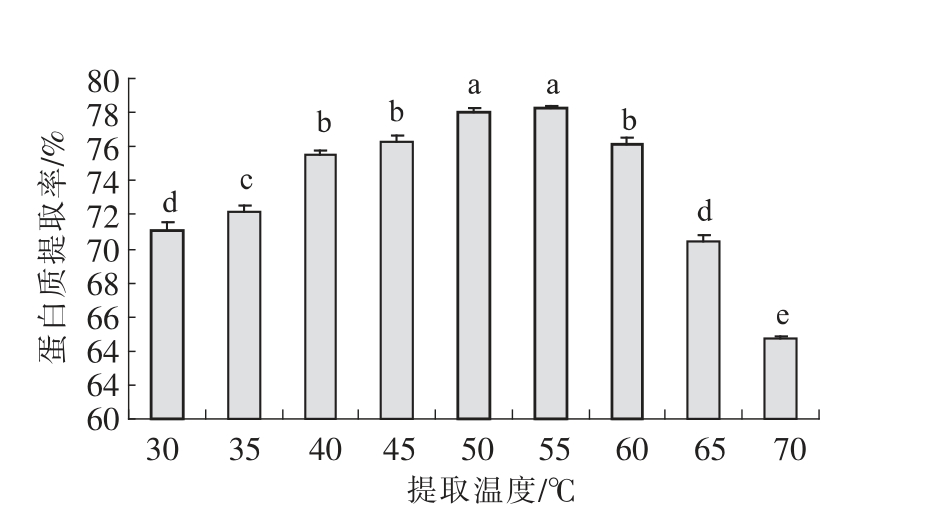
图7 提取温度对核桃蛋白质提取效果的影响
Fig.7 Effect of extraction temperature on walnut protein extraction
2.4.5 响应面分析法优化核桃蛋白质提取条件综合单因素试验结果,以蛋白质的提取率为响应值,作响应面分析试验(3 因素3 水平)。其中,以液料比(X1)、提取温度(X2)、提取时间(X3)为自变量。方案与结果见表3。
通过对响应值与各因素进行回归拟合后,得到回归方程:Y=78.48+4.95X1+0.35X2+1.14X3+0.082X1X2+0.90X1X3+0.52X2X3-4.89X12-0.75X22-0.59X32,通过方差分析及相关系数来考察模型的可靠性,见表4。
表3 方案及结果
Table 3 Program and results of response surface analysis
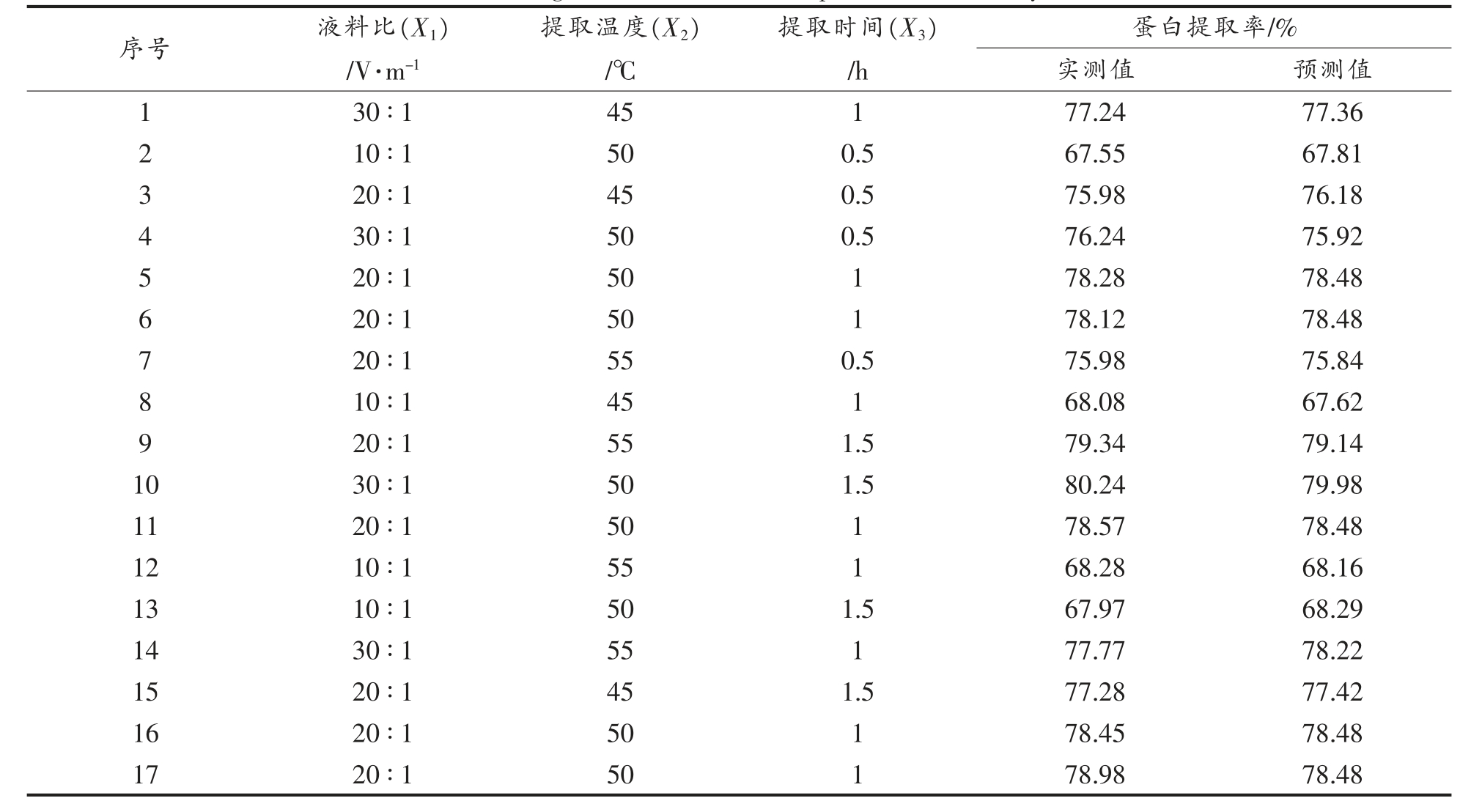
序号 液料比(X1)/V·m-1提取温度(X2)/℃提取时间(X3)/h蛋白提取率/%实测值 预测值30 ∶1 45 1 77.24 77.36 2 10 ∶1 50 0.5 67.55 67.81 3 20 ∶1 45 0.5 75.98 76.18 4 30 ∶1 50 0.5 76.24 75.92 5 20 ∶1 50 1 78.28 78.48 6 20 ∶1 50 1 78.12 78.48 7 20 ∶1 55 0.5 75.98 75.84 8 10 ∶1 45 1 68.08 67.62 9 20 ∶1 55 1.5 79.34 79.14 10 30 ∶1 50 1.5 80.24 79.98 11 20 ∶1 50 1 78.57 78.48 12 10 ∶1 55 1 68.28 68.16 13 10 ∶1 50 1.5 67.97 68.29 14 30 ∶1 55 1 77.77 78.22 15 20 ∶1 45 1.5 77.28 77.42 16 20 ∶1 50 1 78.45 78.48 17 20 ∶1 50 1 78.98 78.48 1
表4 方差分析表
Table 4 Analysis of variance
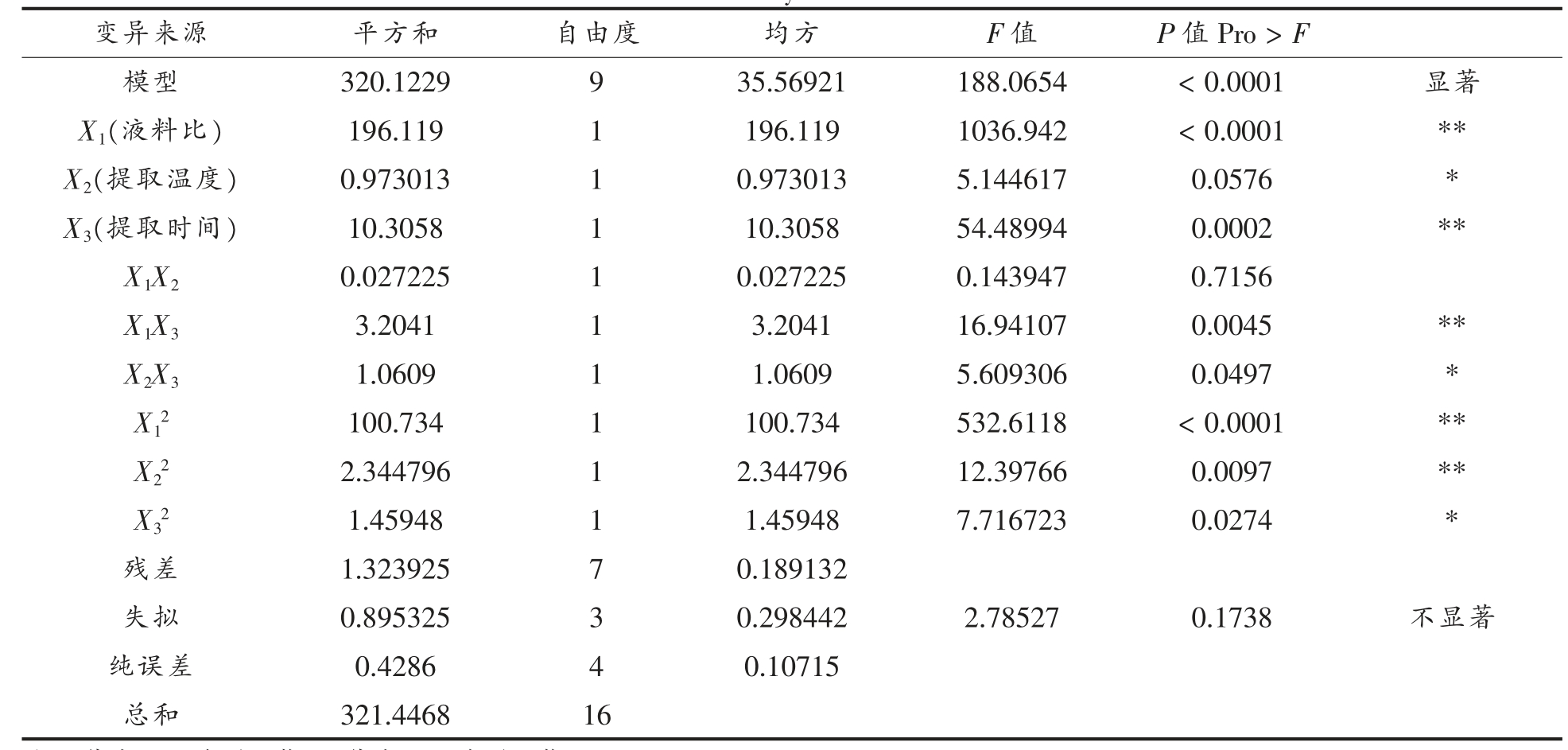
注:* 代表0.05 水平显著;** 代表0.01 水平显著。
变异来源 平方和 自由度 均方 F 值 P 值Pro >F模型 320.1229 9 35.56921 188.0654 <0.0001 显著X1(液料比) 196.119 1 196.119 1036.942 <0.0001 **X2(提取温度) 0.973013 1 0.973013 5.144617 0.0576 *X3(提取时间) 10.3058 1 10.3058 54.48994 0.0002 **X1X2 0.027225 1 0.027225 0.143947 0.7156 X1X3 3.2041 1 3.2041 16.94107 0.0045 **X2X3 1.0609 1 1.0609 5.609306 0.0497 *X12 100.734 1 100.734 532.6118 <0.0001 **X22 2.344796 1 2.344796 12.39766 0.0097 **X32 1.45948 1 1.45948 7.716723 0.0274 *残差 1.323925 7 0.189132失拟 0.895325 3 0.298442 2.78527 0.1738 不显著纯误差 0.4286 4 0.10715总和 321.4468 16
由表4可知,模型P<0.0001,表明回归模型极显著,失拟项F=2.78527<(F0.05(9,3)=8.81),P=0.1738>0.05,在P=0.05 水平上影响不显著,因变量与所有自变量之间的线性关系显著(R2=0.9959)。模型的调整确定系数RAdj2 =0.9906,说明该模型拟合程度良好,试验误差小,可用此模型来分析和预测核桃蛋白提取条件。
由表4可知,三因素中,液料比与提取时间,提取温度与提取时间有交互作用,液料比X1、提取时间X3 达到极显著程度,核桃蛋白提取率的影响因素主次为液料比>提取时间>提取温度。
由图8的等高线可以看出,在提取温度为50℃时,液料比和提取时间对蛋白质提取率的交互作用显著。随着液料比和提取时间的增加,蛋白质提取率呈现出先快速增加后趋于稳定的趋势。单因素结果与优化试验结果一致,因此,适当的增加料液比和提取时间,有利于蛋白质的溶出,使蛋白质提取率提高。
由图9的等高线可以看出,液液比为20∶1(v/w)时,提取温度和提取时间对蛋白质提取率的交互作用显著。随着提取温度的升高,蛋白质提取率呈现先增加后稍有减少的趋势,随着提取时间的延长,蛋白质提取率呈现先增加后趋于稳定的趋势。优化试验结果与单因素结果基本一致,由此可见,适当延长提取时间,升高提取温度有利于蛋白质的溶出,从而提高了蛋白质的提取率。
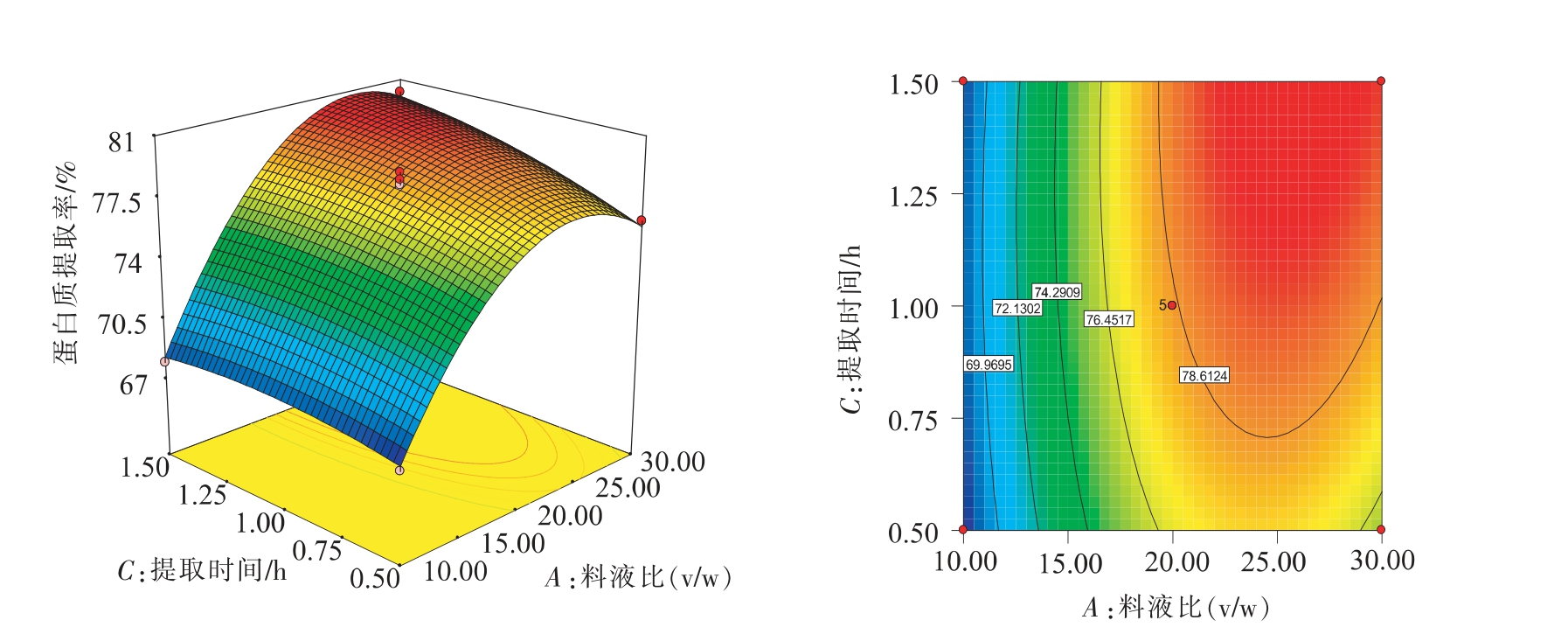
图8 Y=f(X1,X3,50 ℃)的响应面和等高线图
Fig.8 Responsive surfaces of Y=f(X1,X3,50 ℃)
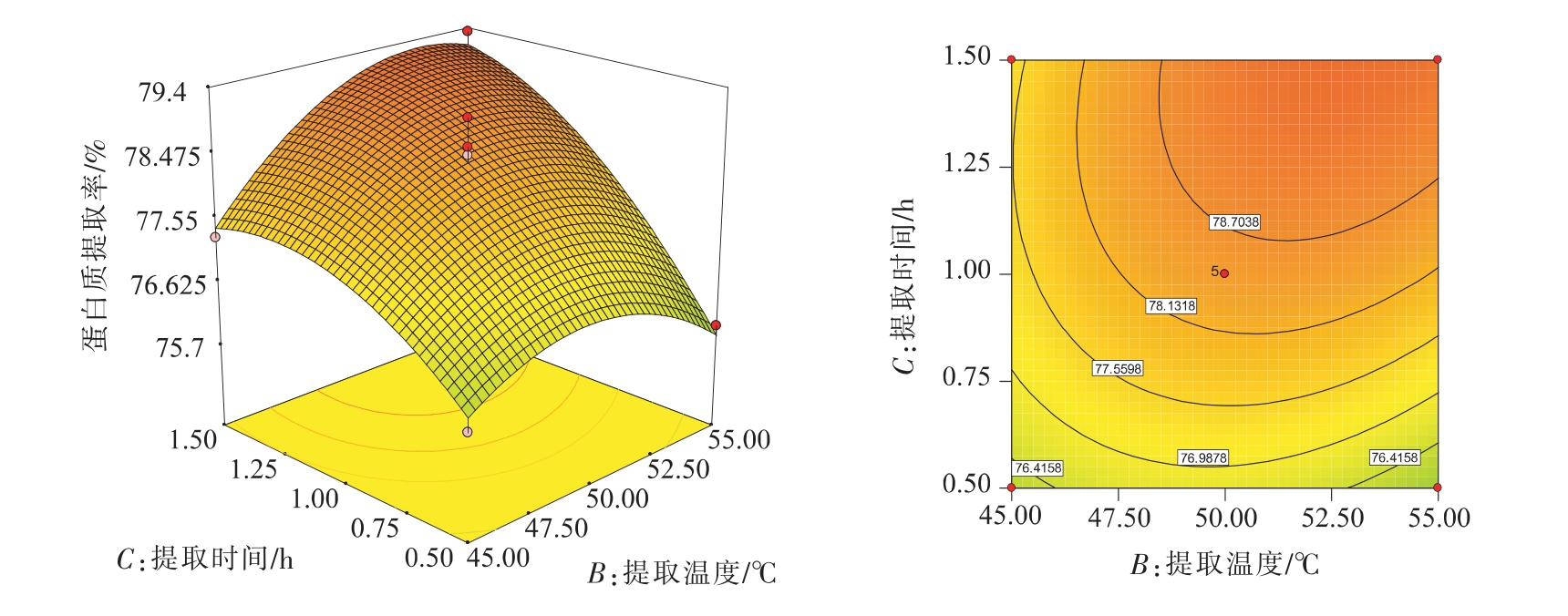
图9 Y=f(X2,X3,20∶1 v/w)的响应面和等高线图
Fig.9 Responsive surfaces of Y=f (X2,X3,20∶1 v/w)
通过响应面分析并优化,得到了提取pH 11,液料比26.03 ∶1、提取温度53.07 ℃、提取时间1.5 h,为最优核桃蛋白提取条件,预测蛋白质提取率为81.05%。
采用数学模型优化蛋白质提取条件,从而验证响应面分析法优化结果,且取整数即:pH 11,液料比26 ∶1(v/w),提取时间1.5 h,提取温度53 ℃,进行6 次重复验证试验,测得蛋白质提取率为82.68%±0.29%。因此,采用响应面分析法优化得到的核桃蛋白提取条件准确可靠。
由pH 对核桃蛋白提取率的影响结果可以看出,核桃蛋白在碱性条件下的提取率比在酸性条件下高,且在碱性条件下,随着pH 的升高,蛋白质提取率迅速增加。在确定为pH 11 的条件下,结合响应面优化核桃蛋白提取条件,即料液比26∶1(v/w),提取温度53 ℃,提取时间1.5 h,得到的蛋白提取液为碱溶蛋白,其经过离心,酸沉可以将其分离从而得到核桃分离蛋白。图10为核桃碱溶蛋白在不同的pH 条件下酸沉、 离心后上清液的可溶性蛋白含量(mg/100 mg 脱脂粉)。由图10可以看出,在pH 4~5 之间,核桃碱溶蛋白的酸沉量是比较大的。在pH 4.5 条件下酸沉后上清液可溶性蛋白含量最低,说明大部分核桃碱溶蛋白在pH 4.5 可以酸沉下来。这一结果与Sze-Tao K W C等人[1]和姜莉[8]、崔莉[7]的研究结果略有些差异。Sze-Tao K W C 等人用0.1 mol/L NaOH(pH 12)溶解核桃脱脂粉,得到的核桃蛋白提取液在不同pH 条件下的蛋白质溶解度结果表明,pH 4 时蛋白质溶解度最低。姜莉和崔莉都采用pH 8.5 的条件下提取核桃蛋白,并测定了蛋白液的等电点分别为pH 4.5 和pH 5。结果产生差异的原因可能是提取蛋白质溶液pH 不同以及酸沉点pH 的划分不同,但结果表明,核桃碱溶蛋白的等电点基本为pH 4~5。
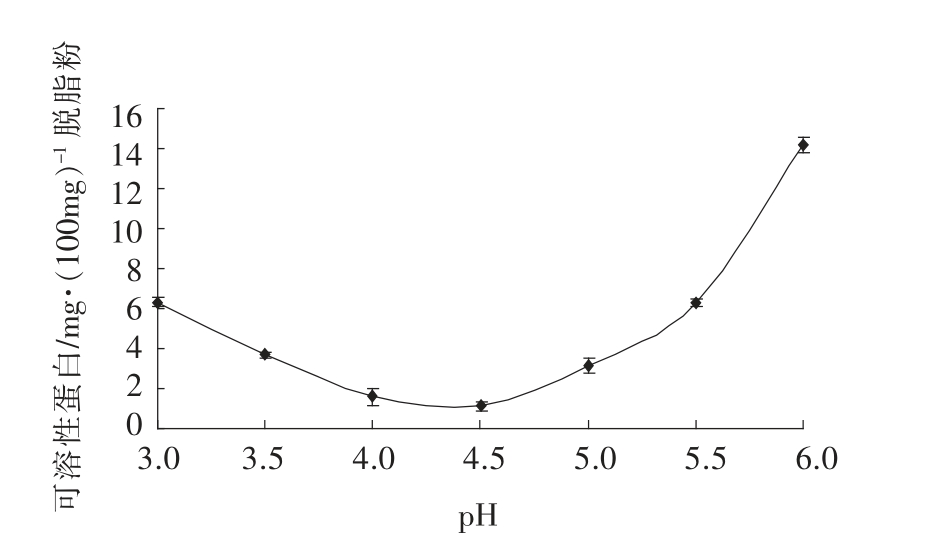
图10 不同pH 对上清液的可溶性蛋白的影响
Fig.10 Effect of pH on soluble protein of supperents
参照Wolf[36]制备大豆分离蛋白的方法,根据响应面优化核桃蛋白提取条件以及核桃碱溶蛋白酸沉点的结果,本试验采用核桃脱脂粉为原料,按照以下工艺制备核桃分离蛋白,得到的核桃分离蛋白,纯度为90.5%,得率为43.15%。此法制备的核桃蛋白纯度比姜荣庆[9]和姜莉[8]分别采用碱提法提取制备出的核桃蛋白质纯度 (分别为82.46%、83%)高。由此结果可以看出,按照以下碱溶酸沉工艺制备的核桃分离蛋白基本达到分离蛋白纯度的要求。
核桃脱脂粉→95%醇洗(1∶10,w/v)→过滤得滤饼→挥干溶剂→蛋白质溶液 (1∶26(w/v))→调蛋白液pH 11 →搅拌1.5 h (53 ℃)→离心(7 000 g,15 min,25 ℃)→上清液 →调pH 为4.5 →搅拌1 h →离心 (7 000 g,15 min,25 ℃)→沉淀→水洗至中性→冻干。
通过对核桃及核桃蛋白的组成分析研究,发现核桃蛋白4 种组成蛋白谷蛋白、 清蛋白、 球蛋白、醇溶蛋白中,谷蛋白含量最高,达72.06%。正是基于核桃蛋白的组成,采用碱性条件溶解核桃蛋白,通过响应面优化核桃蛋白分离提取工艺,得到核桃分离蛋白纯度为90.5%,得率为43.15%。说明碱溶酸沉的方法是核桃蛋白比较有效的分离提取方法。
但是,由于谷蛋白是构成核桃蛋白的主要组成,核桃蛋白的NSI 较豆科类蛋白低很多。这也为核桃蛋白产品的开发和应用提高了难度。这就需要采用一定安全的方法对核桃蛋白进行适度处理改性,以提高其NSI,有助于提高产品品质,例如适度酶解可以提高其NSI。关于核桃蛋白的适度酶解提高其溶解度有待于进一步研究。
[1]SZE-TAO K W C,SATHE S K.Walnuts (Juglans regia L):proximate composition,protein solubility,protein amino acid composition and protein in vitro digestibility[J].Journal of the Science of Food and Agriculture,2000,80(9):1393-1401.
[2]SAVAGE G.Chemical composition of walnuts(Juglans regia L.)grown in New Zealand[J].Plant Foods for Human Nutrition (Formerly Qualitas Plantarum),2001,56(1):75-82.
[3]PEREIRA J A,OLIVEIRA I,SOUSA A,et al.Bioactive properties and chemical composition of six walnut (Juglans regia L.)cultivars[J].Food Chem Toxicol,2008,46(6):2103-2111.
[4]VENKATACHALAM M,ROUX K H,SATHE S K.Biochemical characterization of soluble proteins in pecan [Carya illinoinensis (Wangenh.)K.Koch][J].Journal of Agricultural and Food Chemistry,2008,56(17):8103-8110.
[5]FURUUCHI Y,ASANO M,SHIBASAKI K.Extraction of protein form walnut,‘Shinano -Gurumi’(Juglans regia L.)and properties of the protein[J].Nippon Shokuhin Kogyo Gakkaishi,1981,28(10):548-553.
[6]SATHE S K,VENKATACHALAM M,SHARMA G M,et al.Solubilization and electrophoretic characterization of select edible nut seed proteins[J].Journal of Agricultural and Food Chemistry,2009,57(17):7846-7856.
[7]崔莉,葛文光.核桃蛋白质功能性质的研究[J].食品科学,2000,21(1):13-16.
[8]姜莉.核桃渣制备核桃蛋白和多肽的研究[D].杨凌:西北农林科技大学,2007.
[9]姜荣庆.复合酶提取山核桃油及副产物综合利用的研究[D].长春:吉林农业大学食品科学与工程学院,2011.
[10]AOAC.AOAC Offical Method 950.48.Protein(Crude)in Nuts and Nut Products Improved Kjeldahl Method First Action 1950.Association of Official Analytical Chemists,1995.
[11]AOAC.AOAC Official Method 948.22 Fat (Crude)in Nuts and Nut Products Gravimetric Methods First Action 1948.Association of Official Analytical Chemists,1995.
[12]AOAC.AOAC Official Method 950.49.Ash of Nuts and Nut Products Gravimetric Method First Action 1950.Association of Official Analytical Chemists,1995.
[13]AOAC.AOAC Official Method 925.40 Moisture in Nuts and Nut Products First Action 1925 Association of Official Analytical Chemists,1995.
[14]ZHU K X,ZHOU H M,QIAN H-F.Proteins extracted from defatted wheat germ:nutritional and structural properties[J].Cereal Chemistry,2006,83(1):69-75.
[15]WOLF W J.Gel electrophoresis and amino acid analysis of the nonprotein nitrogen fractions of defatted soybean and almond meals[J].Cereal Chemistry,1995,72(1):115-121.
[16]WOLF W J,SCHAER M L,ABBOTT T P.Nonprotein nitrogen content of defatted jojoba meals[J].Journal of the Science of Food and Agriculture,1994,65(3):277-288.
[17]OSBORNE T.The vegetable protein[M].New York:Longmans Green & Co,1924:154-156.
[18]BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein -dye binding [J].Analytical Biochemistry,1976,72(1/2):248-254.
[19]严佩峰,邢淑婕,刘开华,等.核桃仁去皮技术的研究[J].食品科学,2002,23(1):86-88.
[20]荣瑞芬,吴雪疆,李鸿玉,等.核桃仁去皮工艺的研究[J].食品工业科技,2004,25(2):100-101.
[21]陈树俊,刘亚斌,张海英,等.核桃仁去皮方法的对比研究[J].食品工程,2009,(4):30-33.
[22]LOWRY O H,ROSEBROUGH N J,FARR A L,et al.Protein measurement with the Folin phenol reagent[J].J Biol Chem,1951,193(1):265-275.
[23]SATHE S.Solubilization,electrophoretic characterization and in vitro digestibility of almond (Prunus amygdalus)proteins[J].Journal of Food Biochemistry,1992,16(4):249-264.
[24]DAMODARAN M,SIVASWAMY T G.A new globulin from the cashew nut (Anacardium occidentale)[J].Biochemical Journal,1936,30(4):604-608.
[25]SATHE S.Solubilization and electrophoretic characterization of cashew nut (Anacardium occidentale)proteins[J].Food Chemistry,1994,51(3):319-324.
[26]SHOKRAII E H,ESEN A.Composition,solubility and electrophoretic patterns of proteins isolated from Kerman pistachio nuts (Pistacia vera L.)[J].Journal of Agricultural and Food Chemistry,1988,36(3):425-429.
[27]陈海敏,华欲飞.大豆蛋白组成与功能关系研究[J].西部粮油科技,2001,26(3):36-38.
[28]CHERRY J P.Food protein deterioration:mechanism and functionality [M].Washington,DC:American Chemical Society,1982:1-30.
[29]王章存,康艳玲.花生蛋白研究进展[J].粮食与油脂,2007,(7):12-13.
[30]KOHNHORST A L,SMITH D M,UEBERSAX M A,et al.Compositional,nutritional and functional properties of meals,flours and concentrates from navy and kidney beans (Phaseolus vulgaris)1[J].Journal of Food Quality,1990,13(6):435-446.
[31]SAMSON A,DARREN N,DOMINIC M.Characterisation and functional properties of Australian rice protein isolates[J].Journal of Cereal Science,2005,41(3):283-290.
[32]OSBORNE T B,CAMPBELL G F.Conglutin and vitellin[J].Journal of the American Chemical Society,1896,18(7):609-623.
[33]OSBORNE T B,HARRIS I F.The globulin of the English walnut,the American black walnut and the butternut[J].Journal of the American Chemical Society,1903,25(8):848-853.
[34]刘淼.核桃仁水剂法取油工艺及核桃乳的研究[D].无锡:江南大学,2004.
[35]杨立宾.红松种子蛋白提取与生理功能研究[D].哈尔滨:东北林业大学,2008.
[36]WOLF W J.Soybean proteins.Their functional,chemical,and physical properties[J].Journal of Agricultural and Food Chemistry,1970,18(6):969-976.
The Composition Analyses of Walnut Protein and Optimization of Extraction Process