厚皮甜瓜 (Cucumismelo)属葫芦科(Cucurbitaceae)黄瓜属(Cucumis L.),因其风味极佳且富含类胡萝卜素、番茄红素、维生素等多种功能成分而深受世界范围内消费者喜爱[1]。FAO 统计数据显示,每年亚洲国家甜瓜产量占世界总产量的50%以上,而中国以年均2 500 万t 的产量位居亚洲各国之首。厚皮甜瓜已成为我国,尤其是新疆、甘肃、宁夏地区的重要经济作物。厚皮甜瓜种类繁多,仅新疆厚皮甜瓜就有4 个类群,7 个亚群,120 余个地方产品[2]。根据采后生理特性不同,可将甜瓜划分为呼吸跃变型和非呼吸跃变型两大类[3]。不同种类的甜瓜由于贮藏期间呼吸特性不同,导致其挥发性成分发生较大变化。在影响甜瓜汁感官品质的众多因素中,风味直接决定其商业价值,是影响消费者购买行为的最重要评判指标[4-6]。甜瓜属于代表性热敏性水果,在短暂的热加工后香气品质会发生严重劣变[7]。分析不同类型甜瓜的特征指纹图谱,对识别不同类型的甜瓜及合理评价甜瓜风味品质具有重要意义,同时也是研究甜瓜汁热加工香气变化的基础。
目前,已有关于甜瓜风味的报道,包括不同成熟度甜瓜挥发性成分差异,不同品种或产地甜瓜挥发性成分差异等[8]。然而,对比国内外不同呼吸跃变类型厚皮甜瓜的风味指纹图谱及其香气轮廓的报道却较少。对于挥发性成分的定性目前多采用质谱库、 单一色谱柱的保留时间及保留指数[9],而定量则采用面积百分比或内标粗略估算[10]。不同挥发性成分的极性及与色谱柱的响应程度不同,初步定性与粗略定量的结果与真实值间误差较大,测定结果并不能准确反映甜瓜中挥发性成分的种类与含量。针对该现象,有报道采用极性和非极性色谱柱提高对挥发性成分分离与鉴定的准确度[11],并用挥发性成分标准品验证鉴定结果,对甜瓜挥发性成分准确定性。继而采用已知挥发性成分标准品与内标结合特征离子对挥发性成分精确定量。通过感官试验,首次描述出两种类型甜瓜汁的风味轮廓。试验所得不同呼吸跃变类型甜瓜的指纹图谱是甜瓜品质评价的重要参考,也是区分不同类型甜瓜的重要依据。同时,为甜瓜香气强度测定及香气劣变研究提供基础数据,也对其它类型果蔬汁挥发性成分鉴定,含量测定及品质分析具有重要借鉴意义。
伽师瓜(非呼吸跃变型,产地为新疆)和网纹瓜(呼吸跃变型,产地为伊利诺伊州),均购自沃尔玛超市(美国伊利诺伊州香槟市)。原料新鲜饱满,成熟度均匀,购买后于室温放置4 d 使其后熟。榨汁前,冰浴处理以减少处理过程中香气损失。榨汁后,与饱和CaCl2 溶液1∶4(V/V)混合,分装于70 mL 带有聚四氟乙烯衬里酚醛螺旋盖的培养管(PYREXTM,O.D.*L:25×200 mm)中,液氮速冻后放入-80 ℃冰箱备用。
甲醇(色谱级),美国Sigma-Aldrich 公司;C5-C26,28,30 系列烷烃(纯度≥99.99%),美国Sigma-Aldrich 公司;1-庚醇、庚酸甲酯、2-乙基丁酸、44 种香气标准品,纯度≥99.5%,美国Sigma-Aldrich 公司;闻香纸(155 mm×7 mm×0.6 mm 长×宽×厚),美国Fisher Scientific 公司;无香去离子蒸馏水(二次蒸馏水),实验室自制。
气相色谱-质谱联用仪 (6890-5973),美国Agilent Technologies 公司;三相(PDMS/DVB/CAR)微萃取头(57329-U),美国Sigma-Aldrich 公司;电子分析天平(BT124S),德国Sartorios 科学仪器公司;榨汁机(CL-003AP),美国Jack LaLanne公司;pH 计(868 型),美国Orion 公司;全自动台式折射仪(RFM300 型),英国Bellingham+Stanley 公司;除去虹吸管的Nalgene TeflonTM FEP 嗅闻瓶(2403-0125 125 mL),美国Fisher Scientific公司。
1.4.1 甜瓜滋味指标测定
1.4.1.1 酸度测定 在25 ℃条件下,采用酸度计测定甜瓜汁样品pH,以表示酸度大小。
1.4.1.2 糖度测定 在25 ℃条件下,采用台式全自动数显折射仪测定甜瓜汁样品可溶性固形物含量,以评估糖度高低,结果以白利糖度表示(°Brix)。
1.4.2 甜瓜挥发性成分鉴定
1.4.2.1 配制混合内标溶液 分别称量0.030,0.020 和0.020 g 的1-庚醇、庚酸甲酯和2-乙基丁酸,采用甲醇定容至1 L,存放于4 ℃冰箱备用。
1.4.2.2 手动固相微萃取富集(HP-SPME)挥发性成分 取10 mL 甜瓜汁,2.4 g 氯化钠和5 μL 混合内标液,混合后倒入顶空萃取瓶,置于40 ℃水浴中平衡20 min。采用SPME 萃取头,磁力搅拌萃取20 min。将萃取头插入气相色谱仪进样口,在250 ℃下热解析3 min。
1.4.2.3 气相质谱联用仪(GC-MS)分析挥发性成分 采用配置强极性色谱柱Stabilwax(30 m×0.25 mm×0.25 μm)和非极性色谱柱SAC-5(30 m×0.25 mm×0.25 μm)的GC-MS 鉴定挥发性成分[10-11]。气相色谱的温控程序:Stabilwax 和Sac-5 色谱柱均为35 ℃保持5 min,然后以4 ℃/min 升至225 ℃,保持20 min。进样口温度为250 ℃,载气(氦气)流速为1.2 mL/min,不分流进样模式。质谱条件:全扫描模式,电离方式EI,电子轰击能量为70 eV;接口温度为280 ℃;离子源温度为230 ℃;四级杆温度为150 ℃;扫描质量范围为35~350 amu;扫描速度为5.2 次/s。
通过对比待测成分和标准物质在不同色谱柱上的线性保留指数(LRI)对待测成分准确定性。参照van Den Dool 等人[12]的方法,采用正构系列烷烃混合标准样品计算待测成分和标准物质的LRI,其中LRI 的计算公式如下:
LRI=100N+100n(tRa-tRN)/(tR(N+n)-tRN)
式中,N——保留时间小于(紧邻)待测成分的正构烷烃的碳原子数;n——保留时间紧邻待测成分的正构烷烃的碳分子数之差;tRa,tRN 和tR(N+n)分别是待测成分,保留时间小于(紧邻)待测成分的正构烷烃和保留时间大于(紧邻)待测成分的正构烷烃的保留时间。
1.4.3 甜瓜挥发性成分含量测定
1.4.3.1 相对定量校正因子 采用待测组分标准物质和特征离子对各成分相对校正因子精确测定[13]。取10 mL 甜瓜汁,2.4 g 氯化钠,5 μL 混合内标液和20 μL 已知浓度的待测成分混合标准液于顶空萃取瓶,依据1.4.2.3 节的挥发性成分定性方法,采用NIST08 标准质谱库提取每种挥发性成分的特征离子(见表3)。以未加待测成分混合标准液的甜瓜汁(含混合内标)为空白对照,分析加入待测成分混合标准液后,待测成分定量离子峰面积变化值和待测成分质量浓度及所对应内标物质(各成分对应内标的选取以结构相似为依据)的定量离子峰面积和质量浓度。相对定量校正因子计算公式如下:
其中,fi′——待测成分i 的相对定量校正因子;fwi——待测成分i 的绝对定量校正因子;fws——内标的绝对定量校正因子;mi——添加到甜瓜汁中成分i 标准品质量浓度;ms——瓜汁中待测成分i 所对应的内标物质的质量浓度;As——成分i 所选取的内标物质的定量离子峰面积;ΔAi--添加待测成分混合标准液前后待测成分i 的定量离子峰面积变化值。
1.4.3.2 挥发性成分定量分析 采用选择离子扫描模式测定甜瓜汁中各成分含量,样品制备与含量测定方法同1.4.2.3 节,计算公式如下:
式中mi——待测成分i 的质量浓度(ng·mL-1);fi——待测成分i 的相对定量校正因子;Ai——待测成分i 定量离子的峰面积;ms——对应内标物质的质量浓度 (ng·mL-1),As——对应内标物质的定量离子峰面积。
1.4.4 甜瓜香气轮廓剖面分析 采用风味剖面描述法对两类甜瓜汁香气轮廓定性与定量分析,参照Ni 等人[14]方法,并适当修改。感官评价小组由10 名成员组成(6 名女性,4 名男性,年龄20~40岁)。首先,每一小组成员按照甜瓜汁主体香气贡献大小,给出至少7 个能够慨括两类甜瓜汁香气属性的描述词;其次,小组集体讨论,统计出认可度最高或频率最高的香气属性描述词,通过讨论给出描述词的准确定义并找出相应标准参比物质(表1)。最后,以香气属性为评价指标,参照Pang等人[15]的方法,采用5 点强度法(5-很强,4-中等偏强,3-中等强度,2-中等偏弱,1-弱,0-几乎不能觉察到)对两类甜瓜汁的整体香气特征定性与定量评价。
取40 mL 甜瓜汁样品于125 mL 铝箔纸包裹的嗅闻瓶中,用3 位数字对溴闻瓶随机编号后呈送给感官评价室(21 ℃±1 ℃)的每一感官评价员,评价员以各属性参比物质强度为标尺,采用鼻前嗅闻法对样品评价。每一样品重复3 次,两次评价间需休息20 min,取3 次感官属性测定的平均值绘制香气轮廓雷达图。
表1 甜瓜汁样品风味剖面香气特征感官描述词汇
Table 1 Aroma descriptors generated for flavor profile test of muskmelon juice,definiation and reference standard

香气属性 定义 参比实物a 参比强度整体香气 样品呈献给评价者的整体气味强弱,不分好坏果香 与新鲜成熟水果相关联的混合香气 德尔蒙特混合水果(黄桃、菠萝和雪梨)罐头 3甜香 与蜂蜜、焦糖和棉花糖关联的香气 焦糖布丁 3花香 与玫瑰、月季等关联香气 切碎的玫瑰、月季等混合花瓣 3清鲜香气 与黄瓜西瓜等相关联的清新香气 切碎的西瓜内皮 3青草气息 与新鲜切割青草相关的气息 新鲜割碎的青草 3
以上试验均重复3 次。采用Origin 9.0 进行主成分分析和显著水平方差分析,通过SPSS (v.20)对感官评价结果采用独立样本t 检验,并绘制雷达图。
糖度和酸度与果蔬制品的滋味品质紧密相关,影响产品的食用性和贮藏期。甜瓜汁的pH 值由甜瓜中的有机酸决定,是评价酸度的重要依据;而TSS 主要由葡萄糖、 果糖和蔗糖等糖类构成[16],可用于评估甜瓜汁甜度[17]。由表2可知,两类甜瓜汁在pH 值和TSS 含量方面存在显著性差异,这表明两类甜瓜汁在酸度和甜度方面存在一定的差异。伽师瓜的TSS 含量略高于网纹瓜,但两样品均在11°Brix 左右,高于常见水果如苹果、梨、芒果等。而伽师瓜的pH 低于网纹瓜,不过两类甜瓜汁pH 均接近中性,属于低酸食品[18],这与多数文献报道相一致[19-21]。由此可知,尽管不同类型的甜瓜汁在糖度与酸度方面存在差异,但均属于高甜度、低酸度食品。因此,高糖、低酸是衡量甜瓜汁的滋味品质的一个重要指标,同时也表明甜瓜汁具有较差贮藏性[22-23]。
如表3所示,两类甜瓜中共鉴定出47 种香气组分,除碳酸二乙酯、异氟尔酮、薄荷醇、α-松油醇4 种组分外,试验鉴定出的甜瓜挥发性组分都在先前的报道出现过[24-26]。然而,对文献中已报道的桉树脑、百里香酚、呋喃醛以及少量的含硫酯类成分试验却未检出,这可能是由于原料品种差异、产地、 成熟度以及所用挥发性成分提取方式不同所致。表3显示,两类甜瓜中存在35 种共有组分,12种特有成分,其中2-甲基丙酸甲酯、乙酸丙酯、甲苯、顺-3-己烯-1-醇4 种成分仅存在伽师瓜中,而碳酸二乙基酯、丁酸乙酯、乙酸丁酯、3-己烯-1-醇乙酸酯、乙酸己酯、乙酸苯甲酯、薄荷醇、α-松油醇8 种成分为网纹瓜特有组分。这与前人关于甜瓜香气成分构成具有品种依赖性及乙酸苯甲酯是区别非跃变型和跃变型甜瓜品种的主要香气成分的结论一致[25-27]。
表2 两类甜瓜中可溶性固形物与pH 值
Table 2 Total soluble solids and pH value in muskmelon fruits of two cultivars

注:a 与b 表示差异性显著(α=0.05)。
种类 TSS(°Brix) pH伽师瓜 11.00±0.02b 6.20±0.01a网纹瓜 10.94±0.01a 6.29±0.02b
表3 两类甜瓜挥发性成分定性与定量分析结果
Table 3 Volatile components identified and quantified in the muskmelon cruits of two cultivars by HS-SPME-GC-MS
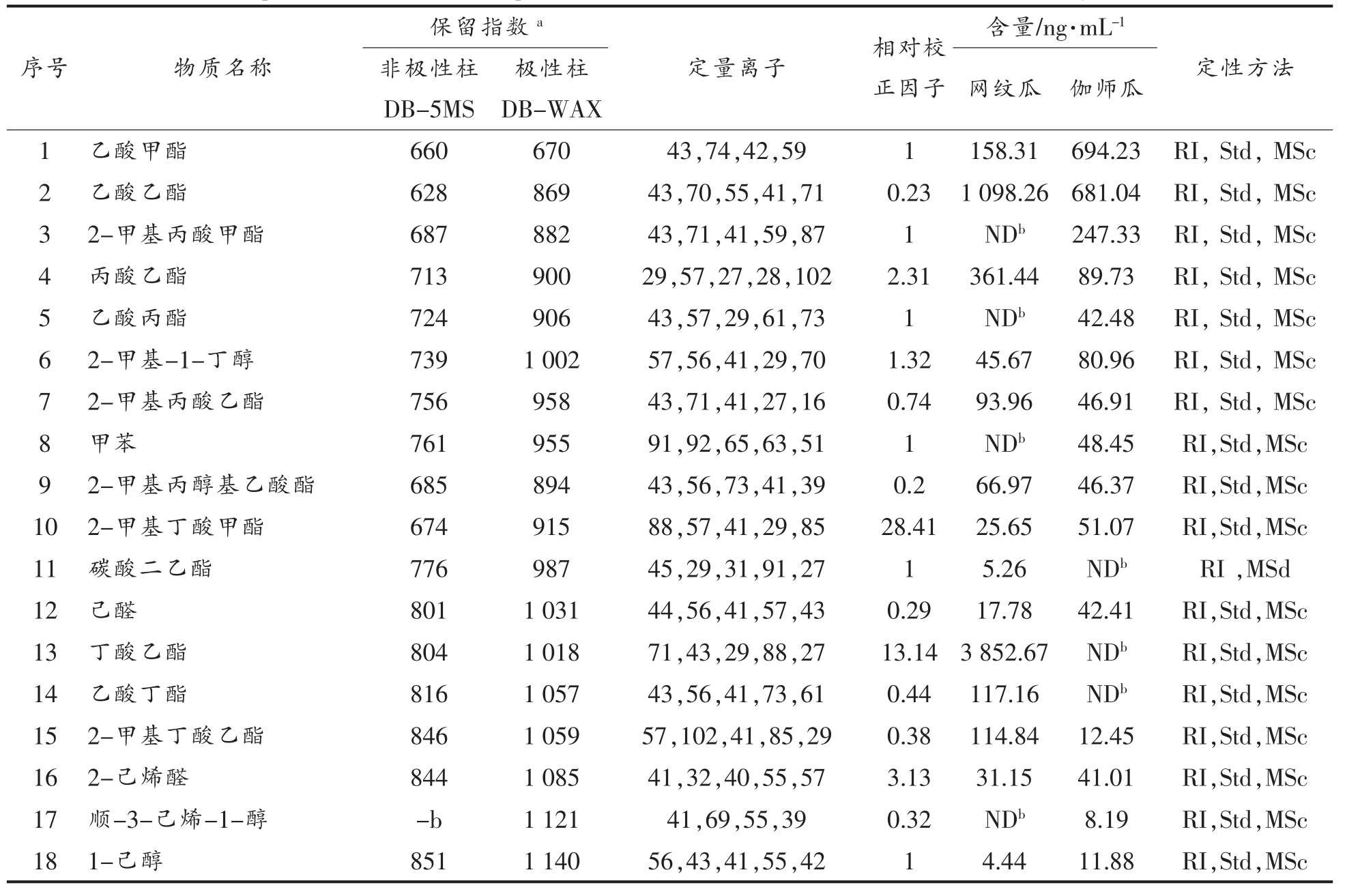
序号 物质名称保留指数a 含量/ng·mL-1非极性柱DB-5MS定量离子 相对校正因子极性柱DB-WAX 网纹瓜 伽师瓜定性方法1 乙酸甲酯 660 670 43,74,42,59 1 158.31 694.23 RI,Std,MSc 2 乙酸乙酯 628 869 43,70,55,41,71 0.23 1 098.26 681.04 RI,Std,MSc 3 2-甲基丙酸甲酯 687 882 43,71,41,59,87 1 NDb 247.33 RI,Std,MSc 4 丙酸乙酯 713 900 29,57,27,28,102 2.31 361.44 89.73 RI,Std,MSc 5 乙酸丙酯 724 906 43,57,29,61,73 1 NDb 42.48 RI,Std,MSc 6 2-甲基-1-丁醇 739 1 002 57,56,41,29,70 1.32 45.67 80.96 RI,Std,MSc 7 2-甲基丙酸乙酯 756 958 43,71,41,27,16 0.74 93.96 46.91 RI,Std,MSc 8 甲苯 761 955 91,92,65,63,51 1 NDb 48.45 RI,Std,MSc 9 2-甲基丙醇基乙酸酯 685 894 43,56,73,41,39 0.2 66.97 46.37 RI,Std,MSc 10 2-甲基丁酸甲酯 674 915 88,57,41,29,85 28.41 25.65 51.07 RI,Std,MSc 11 碳酸二乙酯 776 987 45,29,31,91,27 1 5.26 NDb RI ,MSd 12 己醛 801 1 031 44,56,41,57,43 0.29 17.78 42.41 RI,Std,MSc 13 丁酸乙酯 804 1 018 71,43,29,88,27 13.14 3 852.67 NDb RI,Std,MSc 14 乙酸丁酯 816 1 057 43,56,41,73,61 0.44 117.16 NDb RI,Std,MSc 15 2-甲基丁酸乙酯 846 1 059 57,102,41,85,29 0.38 114.84 12.45 RI,Std,MSc 16 2-己烯醛 844 1 085 41,32,40,55,57 3.13 31.15 41.01 RI,Std,MSc 17 顺-3-己烯-1-醇 -b 1 121 41,69,55,39 0.32 NDb 8.19 RI,Std,MSc 18 1-己醇 851 1 140 56,43,41,55,42 1 4.44 11.88 RI,Std,MSc
(续表3)
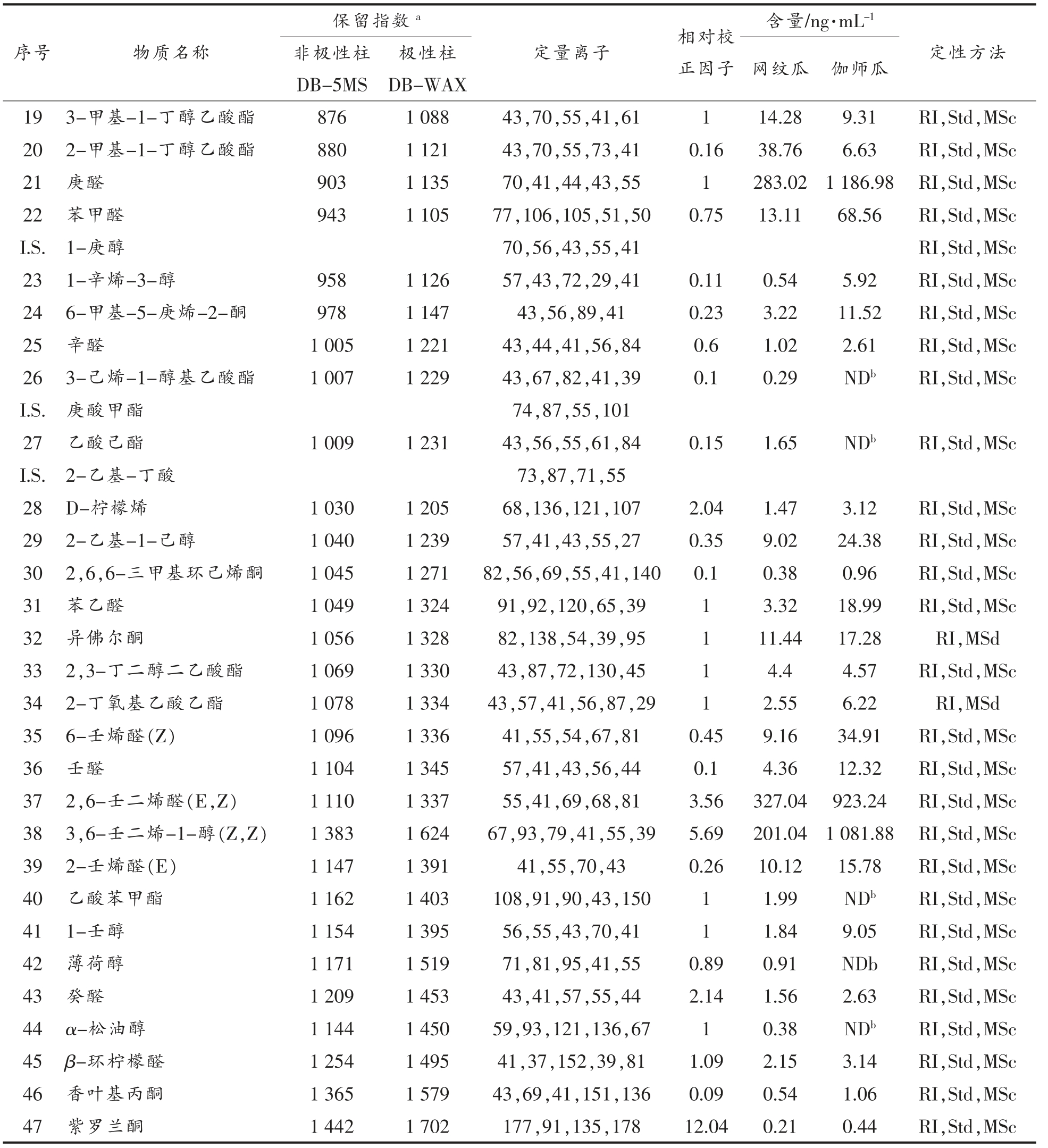
注:a:利用正构系列烷烃(C5-C20)分别计算出的各物质在DB-5 和DB-WAX 上的线性保留指数;b:物质浓度低于检测线,未检出;c:通过对应参考文献中各物质的保留指数与实验室计算出的各物质的保留指数、香气属性,Nist08 标准谱图库检索以及标准物质加入3 种方法定性;d:未获得相应标准品,通过对比参考文献中各物质的保留指数与实验室计算出的各物质的保留指数、Nist08 标准谱图库检索两种方法定性。
序号 物质名称保留指数a 含量/ng·mL-1非极性柱DB-5MS定量离子 相对校正因子极性柱DB-WAX 网纹瓜 伽师瓜定性方法19 3-甲基-1-丁醇乙酸酯 876 1 088 43,70,55,41,61 1 14.28 9.31 RI,Std,MSc 20 2-甲基-1-丁醇乙酸酯 880 1 121 43,70,55,73,41 0.16 38.76 6.63 RI,Std,MSc 21 庚醛 903 1 135 70,41,44,43,55 1 283.02 1 186.98 RI,Std,MSc 22 苯甲醛 943 1 105 77,106,105,51,50 0.75 13.11 68.56 RI,Std,MSc I.S.1-庚醇 70,56,43,55,41 RI,Std,MSc 23 1-辛烯-3-醇 958 1 126 57,43,72,29,41 0.11 0.54 5.92 RI,Std,MSc 24 6-甲基-5-庚烯-2-酮 978 1 147 43,56,89,41 0.23 3.22 11.52 RI,Std,MSc 25 辛醛 1 005 1 221 43,44,41,56,84 0.6 1.02 2.61 RI,Std,MSc 26 3-己烯-1-醇基乙酸酯 1 007 1 229 43,67,82,41,39 0.1 0.29 NDb RI,Std,MSc I.S.庚酸甲酯 74,87,55,101 27 乙酸己酯 1 009 1 231 43,56,55,61,84 0.15 1.65 NDb RI,Std,MSc I.S.2-乙基-丁酸 73,87,71,55 28 D-柠檬烯 1 030 1 205 68,136,121,107 2.04 1.47 3.12 RI,Std,MSc 29 2-乙基-1-己醇 1 040 1 239 57,41,43,55,27 0.35 9.02 24.38 RI,Std,MSc 30 2,6,6-三甲基环己烯酮 1 045 1 271 82,56,69,55,41,140 0.1 0.38 0.96 RI,Std,MSc 31 苯乙醛 1 049 1 324 91,92,120,65,39 1 3.32 18.99 RI,Std,MSc 32 异佛尔酮 1 056 1 328 82,138,54,39,95 1 11.44 17.28 RI,MSd 33 2,3-丁二醇二乙酸酯 1 069 1 330 43,87,72,130,45 1 4.4 4.57 RI,Std,MSc 34 2-丁氧基乙酸乙酯 1 078 1 334 43,57,41,56,87,29 1 2.55 6.22 RI,MSd 35 6-壬烯醛(Z) 1 096 1 336 41,55,54,67,81 0.45 9.16 34.91 RI,Std,MSc 36 壬醛 1 104 1 345 57,41,43,56,44 0.1 4.36 12.32 RI,Std,MSc 37 2,6-壬二烯醛(E,Z) 1 110 1 337 55,41,69,68,81 3.56 327.04 923.24 RI,Std,MSc 38 3,6-壬二烯-1-醇(Z,Z) 1 383 1 624 67,93,79,41,55,39 5.69 201.04 1 081.88 RI,Std,MSc 39 2-壬烯醛(E) 1 147 1 391 41,55,70,43 0.26 10.12 15.78 RI,Std,MSc 40 乙酸苯甲酯 1 162 1 403 108,91,90,43,150 1 1.99 NDb RI,Std,MSc 41 1-壬醇 1 154 1 395 56,55,43,70,41 1 1.84 9.05 RI,Std,MSc 42 薄荷醇 1 171 1 519 71,81,95,41,55 0.89 0.91 NDb RI,Std,MSc 43 癸醛 1 209 1 453 43,41,57,55,44 2.14 1.56 2.63 RI,Std,MSc 44 α-松油醇 1 144 1 450 59,93,121,136,67 1 0.38 NDb RI,Std,MSc 45 β-环柠檬醛 1 254 1 495 41,37,152,39,81 1.09 2.15 3.14 RI,Std,MSc 46 香叶基丙酮 1 365 1 579 43,69,41,151,136 0.09 0.54 1.06 RI,Std,MSc 47 紫罗兰酮 1 442 1 702 177,91,135,178 12.04 0.21 0.44 RI,Std,MSc
由图1可知,构成两类甜瓜的挥发性成分类没有明显差异,主要由酯类、醛类、醇类和酮类组分组成。但不同类甜瓜,同类成分中挥发性成分数量相差较大。伽师瓜中,多数挥发性成分属于C9醇和C9 醛;而网纹甜瓜中,以短链脂肪族酯类成分数量最多,且以带支链的乙酸酯类、丁酸酯类和丙酸酯类为主,据报道这些成分主要由丙氨酸、γ-氨基丁酸和缬氨酸为前体合成[28]。Beaulieu 等人[5]曾报道,非呼吸跃变型甜瓜挥发性成分以短链脂肪醛和醇类为主,而呼吸跃变型甜瓜的挥发性成分以酯类为主,这与本试验结论相吻合。甜瓜中酯类挥发性成分是在果实成熟过程中,以辅酶A 配体或辅酶A 酯作酰基供体,在乙醇乙酰基转移酶作用下,由醇类成分的酯化作用生成[5]。而短链脂肪醛类成分是在脂酶、 脂肪氧合酶和氢过氧化物裂解酶的共同作用下亚油酸、 亚麻酸等脂肪酸的酶促降解生成[27]。由此推测,两类甜瓜挥发性成分种类中成分数量差异是因为相关酶的构成不同。
由表3可知,各成分相对于所选取内标物质的相对定量校正因子差异较大,其中质谱对香叶基丙酮的灵敏度最低,相对定量校正因子仅为0.09,而对于2-甲基丁酸甲酯的灵敏度最高,相对定量校正因子高达28.41。这表明不同成分在同一检测器上的响应灵敏度差异较大,因此利用峰面积表征成分含量的半定量方法误差较大。网纹瓜中共鉴定出43 中挥发性成分,其中丁酸乙酯含量最高,质量浓度为1 098.26 μg/mL,占总成分的55.49%以上。而在伽师瓜中共鉴定出39 种挥发性成分,含量最高的为庚醛,占总成分的21.19%以上。由此可知,呼吸跃变型甜瓜中的主导成分为酯类,而非呼吸跃变型甜瓜为短链脂肪醛,这与上述Beaulieu 等人[5]的分析相符。
图2表明,网纹瓜和伽师瓜中成分种类间含量差异较大。网纹瓜中酯类成分含量最高,为5 958.5 ng/mL,占总成分的85.83%;其次为醛类成分,含量为703.8 ng/mL,占总成分的10.14%。而伽师瓜中酯类含量为1 938.3 ng/mL,占总成分的35.26%,仅为网纹瓜中的30%左右。结合表3,网纹瓜中酯类成分不仅在数量上占优势,而且质量浓度也占绝对优势,这与先前报道结论一致[29]。伽师瓜中醛类和醇类为主要成分,且以C9 醇和C9醛为主(见表3),含量分别为2 352.6 ng/mL 和1 222.3 ng/mL,二者占总成分的63.91%,分别是伽师瓜中醛类与醇类成分含量的3.3 和4.6 倍。由于C9 醇和C9 醛类成分的香气阈值较低,由此推测,它们是伽师瓜中主要香气贡献物质[30-31]。
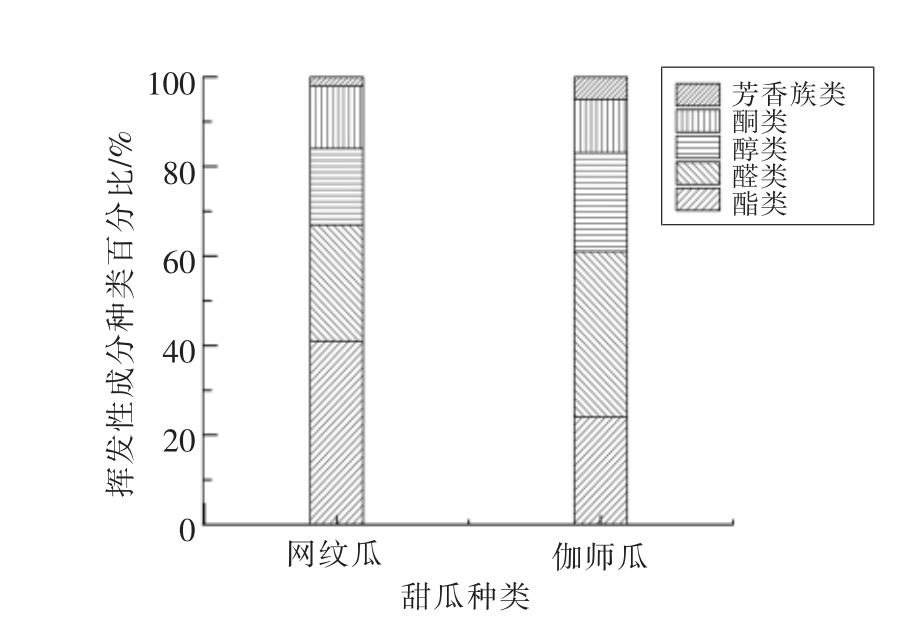
图1 网纹瓜和伽师瓜中挥发性成分种类组成
Fig.1 The distribution of classes of odorants in two cultivars of muskmelon fruit
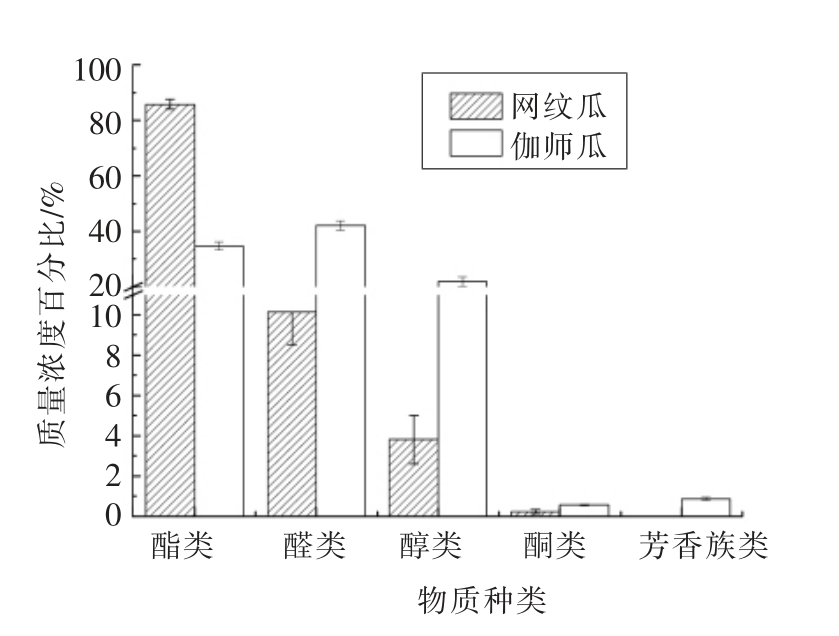
图2 网纹瓜和伽师瓜中挥发性成分的质量分数
Fig.2 The percentage contents of main classes of odorants in two muskmelon cultivars
由图3可知,两类甜瓜整体特征香气强度非常相近,但“果香”、“黄瓜清香”、“青草味”3 个属性都存在明显差异,并以“果香”和“黄瓜清香”的差异最明显。其中,网纹瓜的“果香”比较突出,而伽师瓜的“黄瓜清香”和“青草味”较为强烈。因此,网纹瓜的特征香味以浓郁饱满的“果香”为主,而伽师瓜特征香味以新鲜清香的“黄瓜清香”和“青草味”为标志。结合两类甜瓜挥发性成分定性与定量结果(图1和图2),网纹瓜中酯类成分的含量高于伽师瓜的3 倍,而伽师瓜C9 醛类和C9 醇类成分的含量分别是网纹瓜的3.3 倍和4.6 倍,这表明网纹瓜较浓郁的“果香” 源于高含量的酯类成分,而伽师瓜中显著的“黄瓜清香”和“青草味”源于C9 醛和C9 醇类成分。同时,目前已有报道关于C9 脂肪醛类是引起甜瓜“黄瓜清香”气味的主要成分,而酯类是引起瓜类浓郁“果香”气味的关键成分[32-34],与试验结论非常相似。
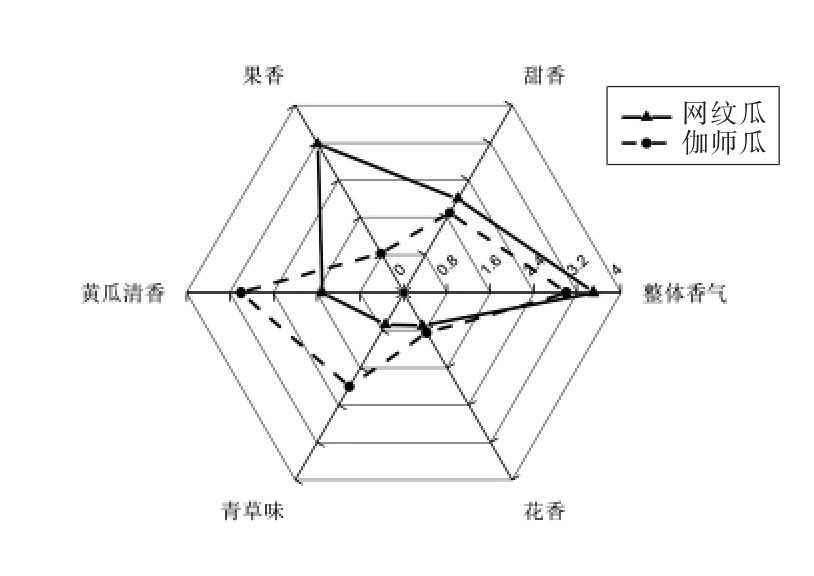
图3 网纹瓜和伽师瓜风味剖面分析
Fig.3 Descriptive aroma profiles of muskmelon juice of two different cultivrs
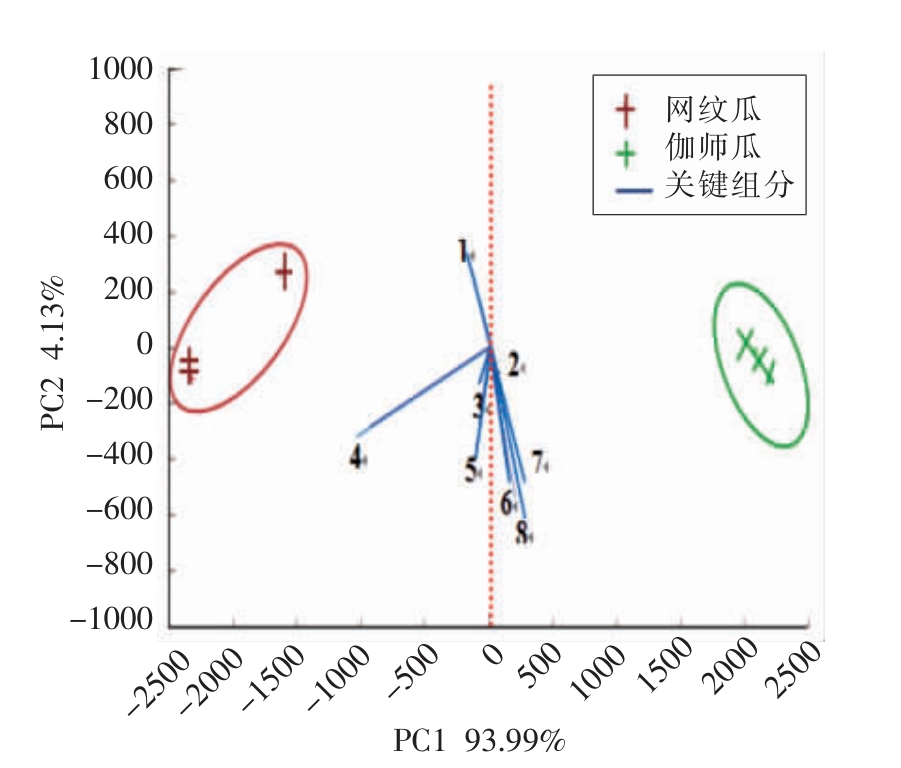
图4 两类甜瓜香气成分的主成分分析结果
Fig.4 The results of principal component analysis from two kinds of melon
注:1:乙酸甲酯;2:6-壬烯醛;3:丙酸乙酯;4:丁酸乙酯;5:乙酸乙酯;6:2,6-壬二烯(E,Z);7:2-壬烯醛(E);8:3,6-壬二烯-1-醇(Z,Z)。
主成分分析可直观地比较两类甜瓜特征香味与挥发性成分间的关联性。由图4可知,PC1 和PC2 的方差贡献率分别是93.99%和4.13%,共计98.02%,这表明应用前两种主成分可将两类甜瓜较好地区分。图4表明,网纹瓜与丁酸乙酯(4)、乙酸甲酯(1)、丙酸乙酯(3)、乙酸乙酯(5)4 种成分表现出较高相关性;而伽师瓜与6-壬烯醛(2)、2,6-壬二烯醛(E,Z)(6)、2-壬烯醛(E)(7)、3,6-壬二烯-1-醇(Z,Z)(8)4 种成分呈现较高相关性。结合两类甜香气属性感官评价结果,伽师瓜的特征香味是“黄瓜清香”和“青草味”,而网纹瓜的特征香味是“果香”,这表明6-壬烯醛、2,6-壬二烯醛(E,Z)、2-壬烯醛(E)、3,6-壬二烯-1-醇(Z,Z)是引起伽师瓜“黄瓜清香”和“青草味”属性的关键组分,而丁酸乙酯、乙酸甲酯、丙酸乙酯、乙酸乙酯4种成分是形成网纹瓜“果香”属性的关键组分。该结果证实了感官评价中网纹瓜浓郁的“果香”属性源于酯类成分,而伽师瓜显著的“黄瓜清香”和“青草味”属性源于高含量的C9 醛和C9 醇类成分的推论。同时,也与Gonda 等人[24]和Kourkoutas 等人[35] 关于酯类成分是跃变型瓜类的主要香气成分,而醇、 醛类是非跃变型瓜类中的主要香气物质的报道一致。
风味是甜瓜及其制品的重要商品品质,试验从滋味与香味两方面研究了不同类甜瓜的风味差异,同时将感官试验结合主成分分析证实了引起风味差异的主要成分及其类型。滋味方面,研究发现尽管两类甜瓜在甜度与酸度方面存在显著差异,但甜瓜汁都具有高甜度与低酸度的滋味特征。香气方面,整体上两类甜瓜挥发性成分种类没有明显差异,都以酯类、醇类和醛类成分为主。但网纹瓜中酯类含量是伽师瓜中的3.07 倍;而伽师瓜中C9 醇和C9 醛类成分含量分别是网纹瓜的中的3.3 倍和4.6 倍。这表明甜瓜香气成分具有品种依赖性,也是区分不同类型甜瓜和控制甜瓜品质的重要依据。感官试验结合主成分分析显示,网纹瓜香气特征是“果香味”,主要源于丁酸乙酯、乙酸甲酯、丙酸乙酯、乙酸乙酯4 种成分;而伽师瓜香气特征是“黄瓜清香味”和“青草味”,主要源于6-壬烯醛、2,6-壬二烯醛(E,Z)、2-壬烯醛(E)(7)、3,6-壬二烯-1-醇(Z,Z)4 种成分。试验以风味理化数据为基础,结合感官试验,建立起两类型甜瓜的风味指纹图谱,为鉴别不同类型的甜瓜,控制甜瓜品质及热加工甜瓜风味研究具有重要意义。
[1]LESTER G E,JIFON J L,MAKUS D J.Impact of potassium nutrition on postharvest fruit quality:Melon (Cucumis melo L)case study[J].Plant and Soil,2010,335(1/2):117-131.
[2]张永兵,李寐华,吴海波,等.新疆甜瓜地方品种资源的表型遗传多样性[J].园艺学报,2012,39(2):305-314.
[3]AMARO A L,BEAULIEU J C,GRIMM C C,et al.Effect of oxygen on aroma volatiles and quality of fresh-cut cantaloupe and honeydew melons [J].Food Chemistry,2012,130(1):49-57.
[4]TANG M,BIE Z,WU M,et al.Aroma characterization of' flavor No.3' Melon using headspace-solid phase microextraction combined with gas chromatog raphy-mass spectrometry[J].Acta Horticulturae,2010,(871):513.
[5]BEAULIEU J C,LEA J M.Characterization and semiquantitative analysis of volatiles in seedless watermelon varieties using solid-phase microextraction[J].Journal of Agricultural and Food Chemistry,2006,54(20):7789-7793.
[6]OBANDO-ULLOA J M,MORENO E,GARCÍAMAS J,et al.Climacteric or non-climacteric behavior in melon fruit:1.Aroma volatiles[J].Postharvest Biology and Technology,2008,49(1):27-37.
[7]HAYASHI R.An overview of the use of high pressure in bioscience and biotechnology[M].Amsterdam,Netherlands:Elsevier,1996:1-7.
[8]BEAULIEU J C.Volatile changes in cantaloupe during growth,maturation,and in stored fresh-cuts prepared from fruit harvested at various maturities[J].Journal of the American Society for Horticultural Science,2006,131(1):127-139.
[9]FREDES A,SALES C,BARREDA M,et al.Quantification of prominent volatile compounds responsible for muskmelon and watermelon aroma by purge and trap extraction followed by gas chromatography-mass spectrometry determination[J].Food Chemistry,2016,190(1):689-700.
[10]PRIYANKA D,SINDHOORA S,VIJAYANAND P,et al.Influence of thermal processing on the volatile constituents of muskmelon puree[J].Journal of Food Science and Technology,2015,52(5):3111-3116.
[11]PANG X,GUO X,QIN Z,et al.Identification of aroma-active compounds in Jiashi muskmelon juice by GC-O-MS and OAV calculation[J].Journal of Agricultural and Food Chemistry,2012,60 (17):4179-4185.
[12]VAN DEN DOOL H,KRATZ P D.A generalization of the retention index system including linear temperature programmed gas-liquid partition chromatography[J].Journal of Chromatography A,1963,11(C):463-471.
[13]IMHOF R,BOSSET J O.Quantitative GC-MS analysis of volatile flavour compounds in pasteurized milk and fermented milk products applying a standard addition method[J].LWT-Food Science and Technology,1994,27(3):265-269.
[14]NI H,HONG P,JI H F,et al.Comparative analyses of aromas of fresh,naringinase-treated and resin-absorbed juices of pummelo by GC-MS and sensory evaluation[J].Flavour and Fragrance Journal,2015,30(3):245-253.
[15]PANG X,CHEN D,HU X,et al.Verification of aroma profiles of Jiashi muskmelon juice characterized by odor activity value and gas chromatographyolfactometry/detection frequency analysis:aroma reconstitution experiments and omission tests[J].Journal of Agricultural and Food Chemistry,2012,60(42):10426-10432.
[16]SOLVAL K M,SUNDARARAJAN S,ALFARO L,et al.Development of cantaloupe (Cucumis melo)juice powders using spray drying technology [J].LWT-Food Science and Technology,2012,46(1):287-293.
[17]SUPAPVANICH S,TUCKER G A.Physicochemical changes in fresh-cut Honeydew melon fruit during storage[J].African Journal of Agricultural Research,2011,6(12):2737-2742.
[18]LAMIKANRA O,WATSON M A.Effects of ascorbic acid on peroxidase and polyphenoloxidase activities in fresh-cut cantaloupe melon[J].Journal of Food Science,2001,66(9):1283-1286.
[19]CHEN J,ZHANG J,FENG Z,et al.Influence of thermal and dense-phase carbon dioxide pasteurization on physicochemical properties and flavor compounds in Hami melon juice[J].Journal of Agricul tural and Food Chemistry,2009,57(13):5805-5808.
[20]LUNA-GUZMÁN I,BARRETT D M.Comparison of calcium chloride and calcium lactate effectiveness in maintaining shelf stability and quality of fresh-cut cantaloupes[J].Postharvest Biology and Technology,2000,19(1):61-72.
[21]MA Y,HU X,CHEN J,et al.The effect of freezing modes and frozen storage on aroma,enzyme and micro-organism in Hami melon[J].Food Science and Technology International,2007,13 (4):259-267.
[22]GOLDEN D A,RHODEHAMEL E J,KAUTTER D A.Growth of Salmonella spp.in cantaloupe,watermelon,and honeydew melons[J].Journal of Food Protection,1993,56(3):194-196.
[23]DEL ROSARIO B A,BEUCHAT L R.Survival and growth of enterohemorrhagic Escherichia coli O157:H7 in cantaloupe and watermelon[J].Journal of Food Protection,1995,58(1):105-107.
[24]GONDA I,BAR E,PORTNOY V,et al.Branchedchain and aromatic amino acid catabolism into aroma volatiles in Cucumis melo L.fruit[J].Journal of Experimental Botany,2010,61(4):1111-1123.
[25]KOURKOUTAS D,ELMORE J S,MOTTRAM D S.Comparison of the volatile compositions and flavour properties of cantaloupe,Galia and honeydew muskmelons[J].Food Chemistry,2006,97(1):95-102.
[26]VERZERA A,DIMA G,TRIPODI G,et al.Fast quantitative determination of aroma volatile constituents in melon fruits by headspace-solid-phase microextraction and gas chromatography-mass spectrometry[J].Food Analytical Methods,2011,4(2):141-149.
[27]OBANDO-ULLOA J M,MORENO E,GARCÍAMAS J,et al.Climacteric or non-climacteric behavior in melon fruit:1.Aroma volatiles[J].Postharvest Biology and Technology,2008,49(1):27-37.
[28]WANG Y,WYLLIE S G,LEACH D N.Chemical changes during the development and ripening of the fruit of Cucumis melo (cv.Makdimon)[J].Journal of Agricultural and Food Chemistry,1996,44 (1):210-216.
[29]WYLLIE S G,LEACH D N.Sulfur -containing compounds in the aroma volatiles of melons (Cucumis melo)[J].Journal of Agricultural and Food Chemistry,1992,40(2):253-256.
[30]BUTTERY R G,LING L C,JULIANO B O,et al.Cooked rice aroma and 2 -acetyl -1 -pyrroline [J].Journal of Agricultural and Food Chemistry,1983,31(4):823-826.
[31]BUETTNER A,SCHIEBERLE P.Evaluation of aroma differences between hand-squeezed juices from valencia late and navel oranges by quantitation of key odorants and flavor reconstitution experiments[J].Journal of Agricultural and Food Chemistry,2001,49(5):2387-2394.
[32]PERRY P L,WANG Y,LIN J.Analysis of honeydew melon (Cucumis melo var.inodorus)flavour and GC-MS/MS identification of (E,Z)-2,6-nonadienyl acetate[J].Flavour and Fragrance Journal,2009,24(6):341-347.
[33]SCHIEBERLE P,GROSCH W.Potent odorants of the wheat bread crumb differences to the crust and effect of a longer dough fermentation[J].Zeitschrift für Lebensmittel -Untersuchung und Forschung,1991,192(2):130-135.
[34]SCHIEBERLE P,OFNER S,GROSCH W.Evaluation of potent odorants in cucumbers (Cucumis sativus)and muskmelons (Cucumis melo)by aroma extract dilution analysis[J].Journal of Food Science,1990,55(1):193-195.
[35]KOURKOUTAS D,ELMORE J S,MOTTRAM D S.Comparison of the volatile compositions and flavour properties of cantaloupe,Galia and honeydew muskmelons[J].Food Chemistry,2006,97(1):95-102.
Building and Analyzing the Flavor Fingerprints of Two Typical Muskmelons