基于实时荧光环介导等温扩增快速检测鸡肉中的大肠杆菌O157:H7
赵远洋 王 瑾 林丽萍 郜彦彦 吴国平*
(江西农业大学食品科学与工程学院 南昌市农产品加工与质量控制重点实验室 南昌330045)
摘要 以大肠杆菌O157:H7 的VT2 基因序列设计特异性引物,利用Midori Green 新型核酸荧光染料,建立鸡肉中大肠杆菌O157:H7 实时荧光定量环介导等温扩增(Rti-LAMP)检测方法。纯培养大肠杆菌O157:H7 检测灵敏度达3.5 CFU/反应,需时45 min。模拟大肠杆菌O157:H7 污染鸡肉样品,经37 ℃增菌4 h,用Whirl-pak 无菌袋过滤离心得沉淀,提取样品DNA 模板用于Rti-LAMP 反应,检测大肠杆菌O157:H7 灵敏度达140 CFU/g,整个检测流程约7 h。采用蒙脱石封闭的活性炭前处理污染鸡肉样品,不经增菌过程,结果表明:该Rti-LAMP 检测方法灵敏度达12 CFU/g,整个检测耗时约4.5 h。市购鸡肉样品51 份,以大肠杆菌国标检测法为对照,研究基于Rti-LAMP 联合增菌或封闭活性炭预处理而不经增菌的两种方法,对比检测临床鸡肉样品大肠杆菌O157:H7 污染率。结果:国标法和增菌的Rti-LAMP 两种方法均检测到同一鸡肉样品为大肠杆菌O157:H7 阳性,经封闭活性炭预处理而未经增菌的Rti-LAMP 则检测到8 份鸡肉样品大肠杆菌O157:H7 阳性。研究表明,封闭活性炭预处理的Rti-LAMP 检测方法较国标法更灵敏、快速、简便、特异地检测鸡肉中大肠杆菌O157:H7 污染。
关键词 大肠杆菌O157:H7;鸡肉;实时环介导等温扩增;增菌;封闭的活性炭
大肠杆菌(E.coli)O157:H7 是肠出血性大肠杆菌中最常见的血清型,也是其多种血清型中最主要的致病菌株,感染剂量低于5 CFU[1-2]。感染该菌可使人患腹泻、出血性结肠炎(hemorhabic colitis,HC),还可引发溶血性尿毒综合征(hemolytic uremic syndrome,HUS)及血栓性血小板减少紫癜(thrombotic thrombocytopenic purpura,TTP)等严重并发症,致死率达5%~10%[3]。自1983年美国Riley 等[4]首次报道肠出血性大肠杆菌O157:H7以来,相继在英国、加拿大、日本、德国等多国出现爆发性流行病例。我国自1986年江苏徐州市首次报道大肠杆菌O157:H7 感染以来,广西、海南、广东等地都先后出现并分离到大肠杆菌O157:H7[5]。在世界范围内,家畜及其肉制品是大肠杆菌O157:H7 主要的传播途径,其中鸡、牛、猪等是该菌主要感染对象[6]。如何快速检测食品尤其是肉类食品中污染的大肠杆菌O157:H7,是有效防控大肠杆菌O157:H7 食源性疾病爆发的必要条件。
目前检测大肠杆菌O157:H7 的方法主要有传统分离培养、免疫学和分子生物学检测[7-9]。这些方法在不同的检测要求下都有各自的优点,也都存在不足,比如耗费时间长,操作过程繁琐及检测灵敏度低等。环介导等温扩增技术自2000年日本科学家Notomi 发明以来[10],因其可在等温条件下数十分钟内完成核酸的高倍扩增,从而成为继PCR 技术之后又一新型快速、 简便的分子生物学检测技术。目前各国研究人员在此基础上发展出多种病原菌的LAMP 检测方法,比如副猪嗜血杆菌(Haemophilus parasuis)[11]、沙门氏菌[12]、人乳头瘤病毒(HPV16)[13]、副溶血性弧菌[14]等。与PCR 等其它方法相比,LAMP 有独特的优点,如在等温条件下即可完成扩增反应,反应时间短 (40~60 min),灵敏度较高,反应温度较低(60~65 ℃),甚至可肉眼直接判断反应结果[15]。
许多研究表明,食品中存在多种水溶性DNA聚合酶抑制剂,会干扰PCR 等分子生物学方法检测食品中致病菌。活性炭是一种具有较大表面积、复杂孔隙结构的物质,具有良好的吸附性能,可以用来消减干扰PCR 聚合酶活性的抑制剂[16]。由于活性炭同时能吸附细菌,所以需对其表面进行适当封闭,从而防止细菌被吸附。据文献[17]报道,使用蒙脱石封闭的活性炭可以消减食品中抑制剂,不影响食品中细菌的回收。
Midori Green 是一种新型的核酸荧光染料,具有灵敏性高,毒性低,安全性好的优点,而利用该染料进行实时荧光定量LAMP 法 (Rti-LAMP)的报道不多[18]。本研究采用Midori Green 为核酸染料,建立大肠杆菌O157:H7 的Rti-LAMP 检测技术;通过模拟鸡肉污染大肠杆菌O157:H7,建立基于Rti-LAMP 检测鸡肉样品中的大肠杆菌O157:H7 并与国标检测法进行对比。
1 材料与方法
1.1 材料与试剂
大肠杆菌O157:H7 ATCC BAA-708 菌株,本实验室保存;鸡脯肉样品,市场购买;月桂基硫酸盐胰蛋白胨肉汤(LST)、EC 肉汤等,青岛高科园海博科技有限公司产品;胰蛋白酶大豆肉汤(TSB),美国Difco 公司;Bst DNA polymerse,新西兰Biolabs 公司;Midori Green,dNTPs,Bulldog Bio公司;2×Taq Master Mix,上海欣百诺生物科技有限公司;Whirl-Pak 均质过滤袋,美国Nasco 公司;八 连 管,BIO-RAD;Activated carbon (Filtrasorb 200),美国Calgon Carbon 公司。
1.2 仪器与设备
拍击式均质机,AES chemuex 公司;紫外可见分光光度计(WFZ-UV-2100),尤尼科(上海)仪器有限公司;GL-21M 高速冷冻离心机,湖南湘仪实验室仪器开发有限公司;XB-150B 全自动雪花制冰机,宁波新艺超声设备有限公司;凝胶成像系统,法国Vibler Lourmat 公司;电泳仪(EPS300)、电泳槽(VE-180),上海天能科技有限公司;荧光PCR 仪,CFX Connect Real-time System,BIORAD。
1.3 方法
1.3.1 引物设计与合成 针对大肠杆菌 O157:H7 (VT2)基因,参考Hara-Kudo 等[19]设计了6 条特异性引物用于Rti-LAMP,包括两条内引物(FIP/BIP),两条外引物(F3/B3),两条环引物(Loop F/ Loop B),详见表1。引物由北京鼎国生物技术有限公司合成。
1.3.2 细菌培养、计数及细菌DNA 提取 将活化的大肠杆菌O157:H7 接种于3 mL TSB 液体培养基中,37 ℃,150 r/min 过夜培养16~18 h,以3%菌液量转接于10 mL TSB 液体培养基,37 ℃,150 r/min 培养1.5 h 左右至对数期细菌(OD600≈0.5)。将菌液用灭菌的生理盐水按10 倍梯度依次稀释,取100 μL 涂于平板,培养18~24 h 细菌计数,测定OD600 的数值,建立OD600 值与菌浓度的标准曲线。
细菌总DNA 制备,生理盐水稀释的细菌500 μL 加入500 μL 2×TZ 裂解液[20],于99.5 ℃下加热10 min,冰上冷却后高速离心5 min,取上清即为细菌DNA 模板。
表1 LAMP 引物
Table 1 Primers used in the Rti-LAMP

引物 序列(5’~3’)FIP GCT-CTT-GAT-GCA-TCT-CTG-GTA-CAC-TCA-CTG-GTT-TCA-TCA-TAT-CTG-G BIP CTG-TCA-CAG-CAG-AAG-CCT-TAC-GGA-CGA-AAT-TCT-CCC-TGT-ATC-TGC-C F3 CAG-TTA-TAC-CAC-TCT-GCA-ACG-TG B3 CTG-ATT-CGC-CGC-CAG-TTC Loop F TGT-ATT-ACC-ACT-GAA-CTC-CAT-TAA-CG Loop B GGC-ATT-TCC-ACT-AAA-CTC-CAT-TAA-CG
1.3.3 Rti-LAMP 反应 Rti-LAMP 反应体系总体积 为25 μL:2.5 μL 10×buffer,5 μL 25 mmol/L MgCl2,2.5 μL 12.5 mmol/L dNTPs,2 μL 20 mmol/L FIP,2 μL 20 mmol/L BIP,0.4 μL 20 mmol/L F3,0.4 μL 20 mmol/L B3,1.2 μL 20 mmol/L Loop F,1.2 μL 20 mmol/L Loop B,1 μL 1 ∶500 稀释的荧光染料Midori Green,0.9 μL Bst 聚合酶,2 μL DNA 模板,无菌去离子水补足至25 μL。制备好的反应管放入BIO-RAD CFX Connect Real-time System 内65 ℃扩增反应60 min。每分钟读取荧光数值,设定样品荧光值出现指数增加的时间为Tp值(类似于Rti-PCR 的Ct 值)[21-22],测定Tp 值与细菌浓度之间关系函数。
1.3.4 琼脂糖凝胶电泳 Rti-LAMP 产物上样于2%琼脂糖凝胶,将1 μL 的Midori Green 原液加入到20 mL 琼脂糖凝胶后进行电泳。电泳条件为:电压80 V,电流60 mA,时间35 min,取出置于凝胶成像系统拍照观察。
1.3.5 蒙脱石封闭活性炭(BCAC)的制备 16 g活性炭用蒸馏水冲洗至流水无色,放入烘箱烘干待用。取蒙脱石4 g 加蒸馏水200 mL,振荡摇匀至完全溶解,转移至250 mL 离心杯中室温下700 r/min,1 min,将上清液倒入加了上述活性炭的三角瓶中,37 ℃下150 r/min,振荡3 h。然后转移到55℃烘箱中烘干备用。
1.3.6 模拟大肠杆菌O157:H7 污染鸡肉样品 取25 g 经国标检测大肠杆菌O157:H7 阴性的鸡肉样品,置于装有75 mL PBS(50 mmol/L)缓冲液的Whirl-Pak 均质过滤袋中,加入生理盐水稀释至适宜浓度的大肠杆菌O157:H7 0.5 mL,以制备浓度为0,140,450,1 400,4 500,14 000,45 000 CFU/g的人工模拟污染样品,将均质袋置于均质机中,37℃下拍打1 min,随后放入37 ℃的水浴增菌4 h。样品过滤液转移至离心杯中,800 r/min 离心5 min,上清液通过含0.5 g 玻璃棉的灭菌注射器过滤,取过滤液用于样品中细菌DNA 的提取。
1.3.7 封闭活性炭对鸡肉样品前处理 模拟大肠杆菌O157:H7 污染鸡肉样品的步骤见1.3.6 节,但不经过增菌培养。滤液转移至离心杯中,10 000 r/min 离心5 min,除去上清,用30 mL PBS(50 mmol/L)缓冲液重悬,加入4 g 制备的BCAC,37℃150 r/min 振荡15 min,用含0.2 g 玻璃棉的灭菌注射器过滤,取过滤液用于样品中细菌DNA 的提取。
1.3.8 样品中细菌DNA 的提取 将过滤液于10 000 r/min 下离心5 min,弃上清,沉淀重悬于0.5 mL 生理盐水,加入等体积2×TZ 裂解液,混匀后于99.5 ℃下加热10 min,冰浴2 min 后12 000 r/min 离心10 min,上清即为样品DNA 模板,取2 μL 作为Rti-LAMP 反应模板。
1.3.9 临床鸡肉样品的对比检测 从市场上购买51 份冷冻鸡肉样品,利用增菌Rti-LAMP、封闭活性炭预处理未增菌的Rti-LAMP 和国标法(GB 4789.38-2012 食品安全国家标准食品微生物学检验),同时检测这些鸡肉样品中大肠杆菌O157:H7污染情况。
2 结果与分析
2.1 大肠杆菌O157:H7 的Rti-LAMP 检测方法建立
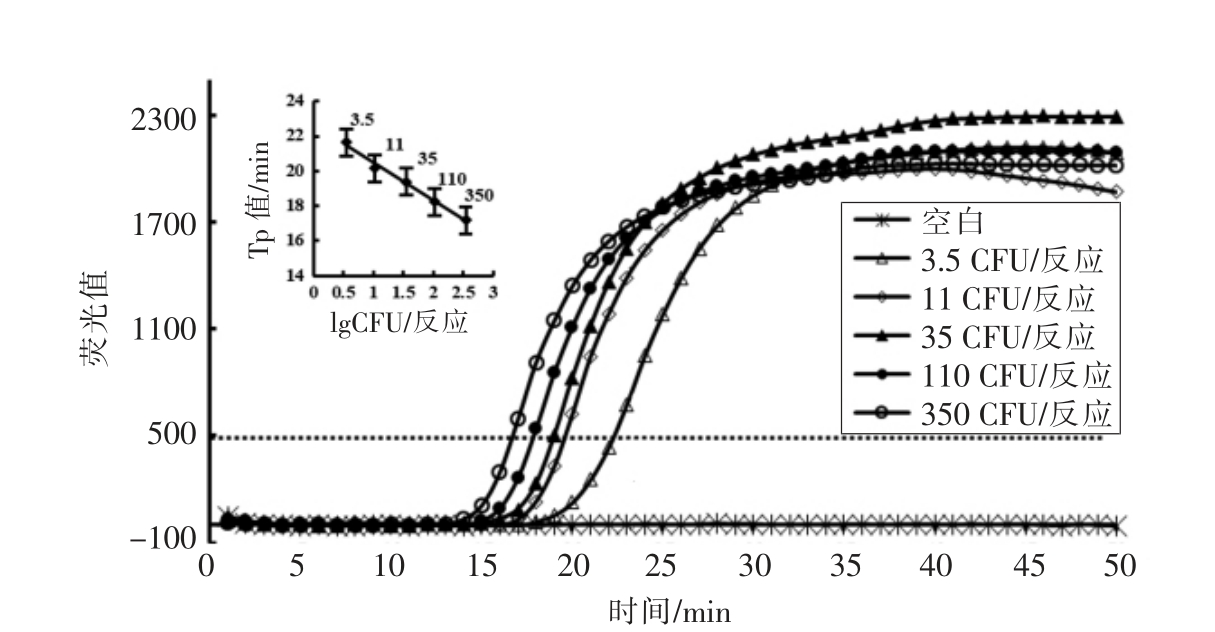
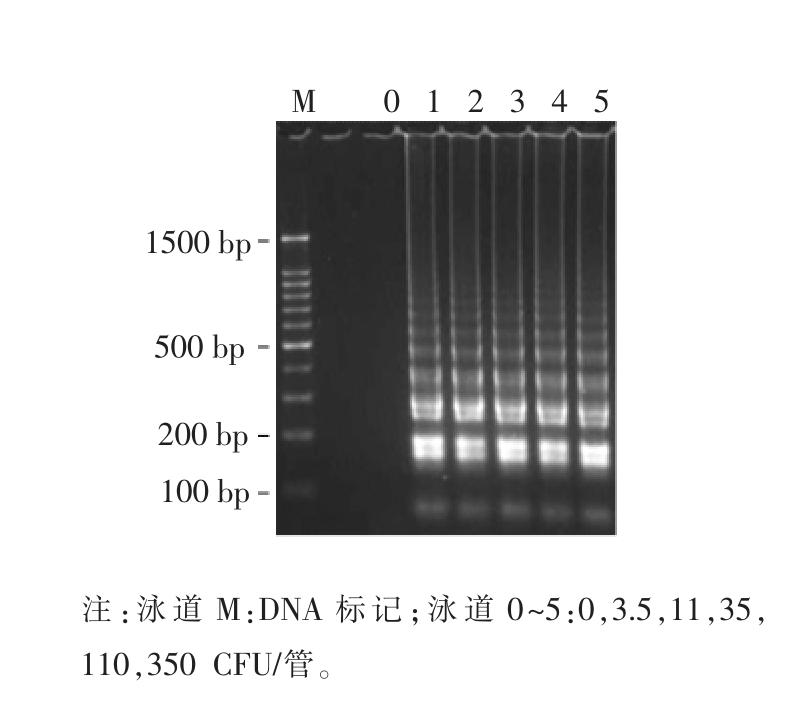
以大肠杆菌 O157:H7 裂解液为模板,结合Midori green 核酸荧光染料,通过设计的6 条特异性引物进行Rti-LAMP 反应,其结果显示阳性样品在30 min 之内出现荧光值呈指数增加,而阴性样品则没有荧光指数增加现象。为测定Rti-LAMP的灵敏度,设置了0,1.1,3.5,11,35,110,350 CFU/管,共7 个梯度,结果表明3.5 CFU/管可稳定扩增检出,低于该浓度则检出稳定性不够,故该Rti-LAMP 的检测灵敏度为3.5 CFU/管(图1)。以荧光值500 作为衡量各反应荧光指数增加出现的时间(Tp 值),以Tp 值为纵坐标,lg(CFU/管)为横坐标,则细菌CFU 与Tp 值之间的线性回归方程为Y=-2.1632X+22.655,决定系数R2=0.9896,表明在3.5~350 CFU/管范围内,其细菌浓度与其相应的Tp 值具有良好的线性关系,通过Rti-LAMP的Tp 值可实现定量检测大肠杆菌O157:H7(图1)。大肠杆菌O157:H7 的Rti-LAMP 扩增产物电泳图如图2所示,典型LAMP 扩增产物是一系列梯度的DNA 片段混合物,在电泳图上呈现出规律的梯状条带,表明本研究建立的Rti-LAMP 法检测大肠杆菌O157:H7 具有良好的特异性。
2.2 增菌前处理的Rti-LAMP 检测人工模拟大肠杆菌O157:H7 污染的鸡肉样品
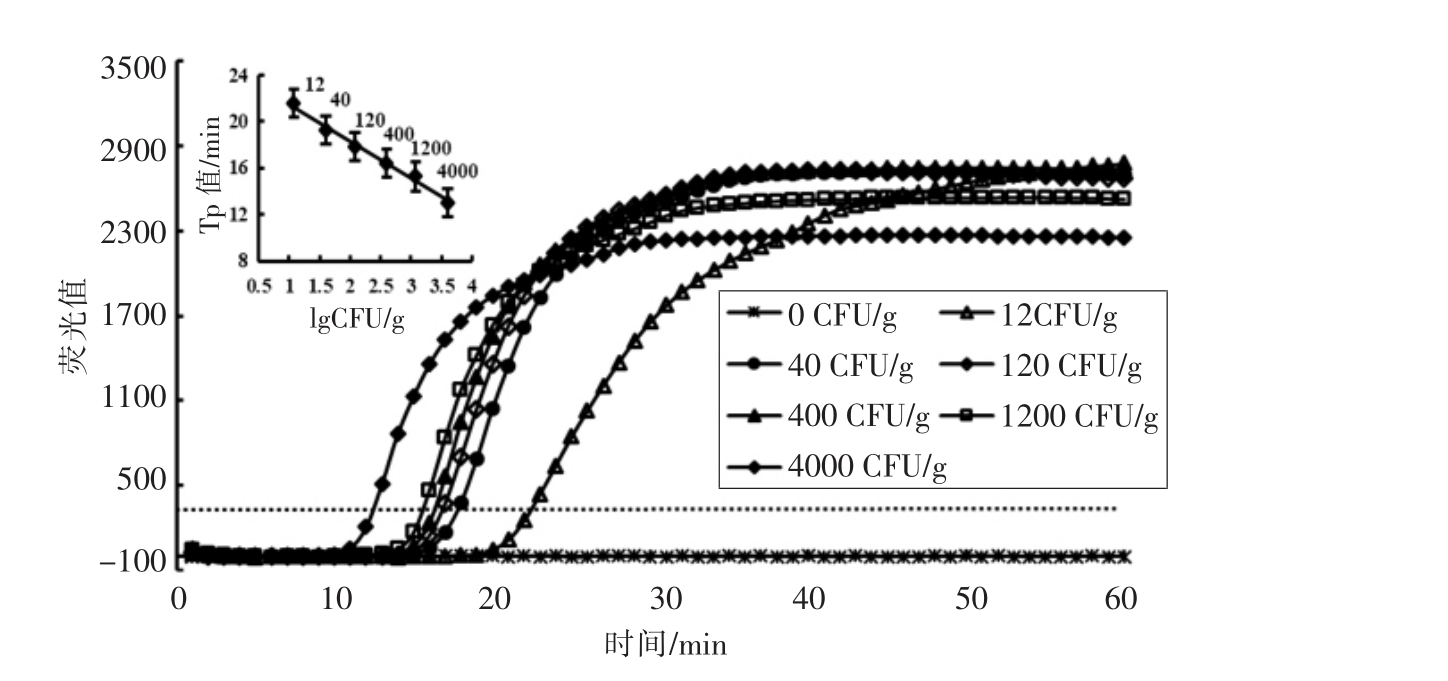
为研究Rti-LAMP 检测鸡肉样品中大肠杆菌O157:H7 的灵敏度和特异性,本研究人工模拟大肠杆菌O157:H7 污染鸡肉样品,经37 ℃增菌4 h后,提取样品DNA 进行Rti-LAMP 检测。结果表明,Rti-LAMP 能稳定检测140 CFU/g 的样品,显示该方法检测灵敏度为140 CFU/g(图3),整个检测时间约为7 h。以Tp 值为纵坐标,lg(CFU/g)为横坐标,建立的线性回归方程为:Y=-3.9792X+31.218,决定系数R2=0.9504,表明本研究增菌前处理的Rti-LAMP 具有定量分析检测鸡肉样品中大肠杆菌O157:H7 的污染程度(图3)。如图4所示,扩增产物与纯菌扩增产物的电泳条带完全一致,说明该方法检测鸡肉中大肠杆菌O157:H7 特异性良好。
2.3 封闭活性炭前处理的Rti-LAMP 检测人工模拟E.coli O157:H7污染的鸡肉样品
封闭活性炭的用量经本实验室优化[23]后,确定处理每份样品的用量为4 g。使用封闭活性炭处理人工模拟污染大肠杆菌O157:H7 的鸡肉样品,不经过增菌步骤,提取样品DNA 进行检测。结果表明,使用封闭活性炭处理后的Rti-LAMP 能稳定检测出12 CFU/g 的鸡肉样品(图5),表明经封闭活性炭预处理的Rti-LAMP 较增菌前处理的Rti-LAMP 检测灵敏度提高约10 倍。3 次重复试验,以Tp 平均值为纵坐标,lg(CFU/g)为横坐标,线性回归方程为:Y=-3.1888X+24.684,决定系数R2=0.9905,说明在12~4 000 CFU/g 范围内具有良好的可定量分析特性。
2.4 3 种方法对比检测临床鸡肉样品
使用上述建立的两种大肠杆菌O157:H7 的Rti-LAMP 方法和国标法进行对比检测分析,对市场上购买的51 份冷冻鸡肉样品进行大肠杆菌O157:H7 检测,检测结果见表2。结果表明,增菌前处理的Rti-LAMP 和国标法,均检测到1 份大肠杆菌O157:H7 阳性样品,且为同一份鸡肉样品;而使用封闭活性炭预处理的Rti-LAMP 法,还检测到另外7 份阳性样品(共8 份)。因此,本研究建立的鸡肉样品中大肠杆菌O157:H7 增菌前处理的Rti-LAMP 检测方法与国标法灵敏度相当,而使用封闭活性炭前处理的Rti-LAMP 检测方法则具有更高的检测灵敏度,且检测时间极大地缩短至4.5 h 左右。
表2 3 种检测方法对临床鸡肉样品中大肠杆菌O157:H7 的检测结果
Table 2 Three methods detected clinical chicken samples for E.coli O157:H7

*注:3 种方法均检测到此份临床鸡肉样品为大肠杆菌O157:H7 阳性。
临床鸡肉样品 阳性 阴性国标法 51 1* 50增菌前处理的Rti-LAMP 51 1* 50封闭活性炭前处理的Rti-LAMP 51 1*+7 43
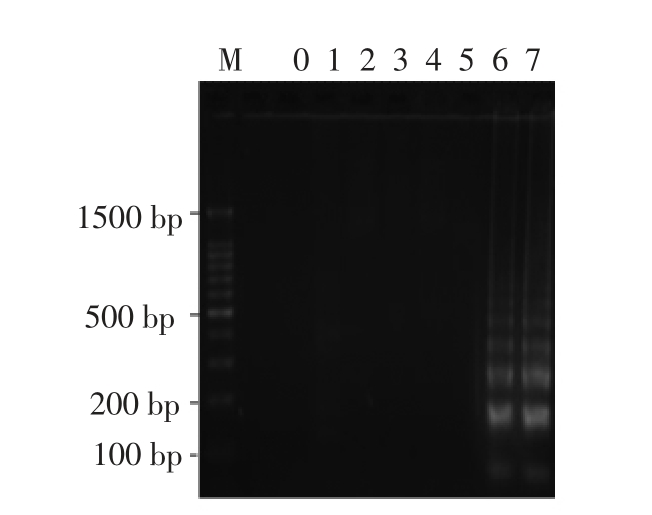
为验证临床鸡肉样品大肠杆菌O157:H7 Rti-LAMP 检测的特异性,将扩增产物进行琼脂糖凝胶电泳(图6),结果DNA 扩增条带与大肠杆菌O157:H7 纯菌扩增条带一致,表明本研究建立的Rti-LAMP 检测鸡肉样品中大肠杆菌O157:H7 具有良好的特异性。
3 讨论
本研究根据大肠杆菌O157:H7 的VT2 基因设计了6 条特异性引物,结合Midori Green 新型核酸染料,建立了大肠杆菌O157:H7 的Rti-LAMP 检测方法,其中纯培养菌液灵敏度达到3.5 CFU/反应,模拟大肠杆菌O157:H7 污染的鸡肉样品中增菌前处理的Rti-LAMP 检测灵敏度为140 CFU/g,整个检测流程可在7 h 内完成;而经封闭活性炭前处理的Rti-LAMP 检测灵敏度为12 CFU/g,需时约4.5 h 左右。
检测的51 份临床鸡肉样品,增菌前处理的Rti-LAMP 方法和国标法检出率均为1.96%。据Zhang 等[5]对中国南方多个省市183 份鸡肉污染情况调查,结果大肠杆菌O157:H7 的阳性检出率为3.28%。这与本试验的检测结果大致相似,表明Rti-LAMP 与国标法具有相同的检测灵敏度,但Rti-LAMP 所需时间约7 h,可在一个工作日内完成,较国标法节省了时间和人力。
研究表明,由于食品成分的复杂性,其中存在着多种水溶性DNA 聚合酶抑制剂,对检测的灵敏度和稳定性产生很大的影响[16]。例如本研究中未经封闭活性炭处理的Rti-LAMP 对模拟污染的鸡肉样品进行检测,其线性函数的R2 系数较低(0.9504),显示食品组分中的抑制剂对扩增反应有一定的影响。本研究尝试使用蒙脱石封闭的活性炭进行前处理以消减抑制剂,结果表明经封闭的活性炭前处理人工模拟大肠杆菌O157:H7 污染的鸡肉样品,相比增菌但未使用封闭活性炭处理的Rti-LAMP 方法灵敏度提高了约10 倍。封闭活性炭前处理的Rti-LAMP 检出临床鸡肉样品8份大肠杆菌O157:H7 阳性,进一步说明该方法检测灵敏度确实有很大的提高,同时不需要增菌,极大地缩短检测至4.5 h。封闭活性炭前处理的Rti-LAMP 法检出鸡肉样品大肠杆菌O157:H7 高阳性率,推测可能的原因主要有两点:一是鸡肉中污染的大肠杆菌O157:H7 浓度并不低,但由于食品在加工储藏过程中会对细菌造成抑制和损伤,导致细菌活力降低甚至死亡,增菌培养时,损伤细菌不易生长繁殖,从而影响了国标法的检出率;但由于Rti-LAMP 法是对目标菌DNA 的扩增检测,损伤细菌其DNA 可以作为扩增模板;二是封闭活性炭消减鸡肉中可溶性抑制剂效果好,解除了抑制剂对DNA 聚合酶的抑制作用,从而极大地提高了Rti-LAMP 检测灵敏度。国家食品安全标准(GB 29921-2013)中规定,同一批次的5 份样品中大肠杆菌O157:H7 的检出率为0,说明对大肠杆菌O157:H7 有着严格的限定标准,所以严格控制大肠杆菌O157:H7 的检出对于保障食品安全具有重要意义。当然,本研究建立的Rti-LAMP 方法无法区别目标菌是死菌还是活菌,如何利用分子生物学方法进行鉴别,实现临床样品致病菌更精准的检测,仍需进一步研究。
参 考 文 献
[1]赵嘉咏,张白帆,穆玉姣,等.河南省出血性大肠埃希菌O157 病原学特征与分子分型研究[J].中国病原生物学杂志,2016,11(9):812-814.
[2]刘道亮,胡连霞,赵占民,等.改良环介导等温扩增技术快速检测肉类中的大肠杆菌O157:H7[J].微生物学通报,2011,38(3):430-435.
[3]CRAIG S WONG,M D,SRDJAN JELACIC,et al.The risk of the hemolytic-uremic syndrome after antibiotic treatment of Escherichia coli O157:H7 infections[J].New England Journal of Medicine,2000,342(26):1930-1936.
[4]RILEY L W,REMIS R S,HELGERSON S D,et al.Hemorrhagic colitis associated with a rare Escherichia coli serotype[J].New England Journal of Medicine,1983,308(12):681-685.
[5]ZHANG S H,ZHU X M,WU Q P,et al.Prevalence and characterization of Escherichia coli O157 and O157:H7 in retail fresh raw meat in South China[J].Annals of Microbiology,2015,65(4):1993-1999.
[6]赵璐,苏战强,逯晓龙,等.大肠杆菌O157:H7 在部分市售鸡肉和鸡蛋中的污染状况调查[J].新疆农业科学,2014,51(10):1948-1954.
[7]黄海燕,陈亮,陈萍.双抗体夹心ELISA 法检测食品中出血性大肠杆菌O157[J].食品工业科技,2016,37(11):185-188.
[8]夏灿,蒋蔚,刘迎春,等.肠出血性大肠杆菌O157:H7 抗原基因及毒力基因多重荧光定量PCR 检测方法的建立[J].畜牧与兽医,2016,48(10):13-21.
[9]WU W,ZHAO S M,MAO Y P,et al.A sensitive lateral flow biosensor for Escherichia coli O157:H7 detection based on aptamer mediated strand displacement amplification[J].Analytica Chimica Acta,2015,861(3):62-68.
[10]NOTOMI T,OKAYAMA H,MASUBUCHI H,et al.Loop-mediated isothermal amplification of DNA[J].Nucleic Acids Research,2000,28(12):e63.
[11]WANG Y,FANG Y,LIU Y Y,et al.Development and evaluation of loop-mediated isothermal amplification for rapid detection of Haemophilus parasuis[J].FEMS Microbiology Letters,2010,313(1):54-60.
[12]庞心怡,满朝新,赵玥明,等.环介导等温扩增技术快速检测肉中沙门氏菌[J].中国食物与营养,2015,21(8):12-15.
[13]JEARANAIKOON P,PRAKRANKAMANANT P,LEELAYUWAT C,et al.The evaluation of loop-mediated isothermal amplification-quartz crystal microbalance (LAMP-QCM)biosensor as a real-time measurement of HPV16 DNA[J].Journal of Virological Methods,2016,229(3):8-11.
[14]ZENG J,WEI H Y,ZHANG L,et al.Rapid detection of Vibrio parahaemolyticus in raw oysters using immunomagnetic separation combined with loopmediated isothermal amplification[J].International Journal of Food Microbiology,2014,174(9):123-128.
[15]MAYURKUMAR P.BHIMANI,BHARAT B.BHANDERI et al.Loop-mediated Isothermal Amplification assay (LAMP)based detection of Pasteurella multocida in cases of haemorrhagic septicaemia and fowl cholera[J].Veterinaria Italiana,2015,51(2):115-121.
[16]WU G P,CHEN S H,ROBERT E LEVIN.Rapid real -time loop -mediated isothermal amplification combined with coated activated carbon for detection of low numbers of Salmonella enterica from lettuce without enrichment[J].Food Control,2015,56(10):47-52.
[17]LEE J L,ROBERT E LEVIN.Detection of 5 CFU/g of Escherichia coli O157:H7 on lettuce using activated charcoal and real-time PCR without enrichment[J].Food Microbiology,2011,28(3):562-567.
[18]WU G P,ROBERT E LEVIN.Rapid and sensitive detection of Salmonella enterica ser.enteritis retrieved from lettuce using a Real-time Loop-mediated Amplification Isothermal Assay without enrichment[J].Food Biotechnology,2015,29 (3):263-275.
[19]YUKIKO H K,JIRO N,KAYOKO O,et al.Sensitive and rapid detection of Vero toxin-producing Escherichia coli using loop-mediated isothermal amplification[J].Journal of Medical Microbiology,2007,56(3):398-406.
[20]ABOLMAATY A,VU C,OLIVER J,et al.Development of a new lysis solution for releasing genomic DNA from bacterial cells for DNA amplification by polymerase chain reaction[J].Microbios,2000,101(400):181-189.
[21]WU G P,CHEN S H,ROBERT E.LEVIN.Application of ethidium bromide monoazide for quantification of viable and dead cells of Salmonella enterica by real-time loop-mediated isothermal amplification[J].Journal of Microbiological Methods,2015,117(10):41-48.
[22]姜彦君,都启晶,赵宏坤.食源性致病菌多重PCR检测方法的建立与应用[J].中国食品学报,2013,13(10):162-169.
[23]王瑾,林丽萍,郜妍妍,等.实时荧光环介导等温扩增快速检测鸡肉中沙门氏菌[J].食品科学,2016,37(24):170-174.
Rapid Detection of Escherichia coli O157:H7 from Chicken Using a Real-time Loop-mediated Amplification Isothermal Assay
Zhao Yuanyang Wang Jin Lin Liping Gao Yanyan Wu Guoping*
(School of Food Science and Engineering,Jiangxi Agricultural University,Key Lab for Agricultural Products Processing and Quality Control of Nanchang City,Nanchang 330045)
Abstract In this study,a real-time loop amplified DNA assay system (Rti-LAMP)was developed for the rapid detection of Escherichia coli(E.coli)O157:H7 on the chicken.It showed that the lowest level of 3.5 CFU/ reaction for pure E.coli culture could be detected and finished in 45 minutes by the Rti-LAMP targeting the VT2 gene using Midori green as nucleic acid dye.Furthermore,seeding 25 g portions of chicken with various numbers of E.coli CFU,followed enrichment culture at 37 ℃for 4 h,then filtration through Whirl-pak bag and pelleting the bacterial cells by centrifugation at 13 000 g.The resulting pellets were suspended in saline and processed for cell lysis and DNA purification.2 μL purified DNA samples was incorporated into 25 μL Rti-LAMP reactions at 65 ℃for 60 min.The lowest level 140 CFU/g of E.coli consistently detected by the Rti-LAMP assay.The entire assay could be completed in 7 h.Moreover,the samples were pretreated with activated carbon coated with bentonite and without enrichment for Rti-LAMP reactions.The results showed that the sensitivity of the sample treated with coated activated carbon was 12 CFU/g and finished in 4.5 h.Fifty-one chicken samples purchased from market were detected by the Rti-LAMP assay with enrichment,the Rti-LAMP with bentonite coated activated carbon(BCAC)pretreated but without enrichment,as the control of E.coli O157:H7 culture.The same one sample was E.coli O157:H7 positive by the Rti-LAMP assay with enrichment and E.coli culture,and other 7 samples (total 8 samples)were also E.coli O157:H7 positive detected by the Rti-LAMP pretreated with BCAC.These data suggested that the Rti-LAMP combined with BCAC pretreatment was more sensitive,rapid,simple and specific than that of culture for detection of E.coli O157:H7 retrieved from Chicken.
Keywords E.coli O157:H7;chicken;Rti-LAMP;enrichment culture;bentonite coated activated carbon
文章编号 1009-7848(2019)03-0281-08
doi:10.16429/j.1009-7848.2019.03.035
收稿日期:2018-03-11
基金项目:国家自然科学基金项目(31560480);江西省自然科学基金项目(20171ACB20013)
作者简介:赵远洋,男,1992年出生,硕士生
通讯作者:吴国平 E-mail:jdwgp@163.com