东北膜荚黄芪内生细菌的分离及其活性代谢物分析
翟李欣1,2 徐慧超1,2 李 伟1,2 郑 雪1,2 郑春英1,2*
(1 黑龙江大学 农业微生物技术教育部工程研究中心 哈尔滨1505002 黑龙江大学生命科学学院 黑龙江省普通高校微生物重点实验室 哈尔滨150080)
摘要 研究北芪内生细菌及其次生代谢产物,旨在深入开发新资源。采用平板分离法从北芪中分离内生细菌,利用滤纸片法测定北芪内生细菌的抑菌活性。以芒柄花素及北芪生药为对照,采用HPLC 法分析北芪内生细菌活性代谢物。同时对筛选出的目的菌株结合形态特征观察、 生理生化试验及16S rDNA 序列分析进行菌种鉴定。所得北芪内生细菌中,有31 株内生细菌发酵液对11 株试验菌表现出不同的抑菌活性,占总分离菌株的86.11%。HPLC 分析表明,2 株内生细菌发酵产物与北芪生药样品在相同保留时间内有相应的色谱峰出现,其中菌株HX8 经鉴定为甲基营养型芽孢杆菌。北芪内生细菌具有较好的抑菌活性,其中内生细菌HX8 发酵产生北芪活性成分或类似化合物,这为利用内生菌发酵生产北芪活性成分提供了新思路和途径。
关键词 黄芪;内生细菌;抑菌活性;活性代谢物
植物内生菌是具有丰富多样性特征的微生物类群,几乎存在于每种植物的不同组织器官内。据统计,自然界中至少存在着一百万种内生菌[1]。内生菌的多样性表现以下几个方面:同种植物的不同部位,在其组织内所生长的内生菌的种类及数目不同[2];同种植物在不同生理、病理状态下,其内生菌种类及数目也会相应发生改变[3];产地、气候等环境因素直接影响内生菌种类及数目[4-5]。植物内生菌次生代谢产物的多样性是受其宿主植物中内生细菌的多样性所决定[6]。据报道[7-8],从植物内生菌中分离得到的次生代谢产物有49%是已知结构化合物,51%是新结构类型的化合物。植物内生菌是一种新型生物活性物质资源,研究植物内生细菌具有重要的理论意义和较高的商业应用价值。
黄芪(Astragalus membranaceus)为豆科植物蒙古黄芪(Astragalus membranaceus (Fisch.)Bge.var.mongholicus(Bge.)Hsiao)或膜荚黄芪(Astragalus membranaceus (Fisch.)Bge.)的干燥根[9],主要分布于东北与西北等地,分布于东北的膜荚黄芪(Astragalus membranaceus (Fisch.)Bge.)品系简称“北芪”[10],具有抑菌[11]、抗炎[12]、抗病毒[13]、抗肿瘤[14]、抗氧化[15]、降血糖[16]等多种活性作用。
寒地黑土造就了东北膜荚黄芪(Astragalus membranaceus(Fisch.)Bge.)特有品质,现被广泛应用于功能性保健食品、 食品添加剂、 药品等领域。本文以主产于东北地区的膜荚黄芪(Astragalus membranaceus(Fisch.)Bge.)(北芪)为研究对象,对其内生细菌进行分离及活性代谢物初步研究,并与生药活性成分作对比分析,筛选出能够产与宿主植物北芪相同、相似或全新的具有抑菌、抗氧化等实用价值的目的菌株,为开发新资源、创制新药、 开辟新型北芪活性成分的生产方法奠定基础。
1 材料
1.1 植物样品
野生豆科植物膜荚黄芪Astragalus membranaceus (Fisch.)Bge.健康植株分别于2015年8,9月采自黑龙江省大兴安岭地区。
1.2 培养基
NA 分离培养基及PDA 培养基:同文献[17]。
1.3 试验菌株
粪肠球菌 (Enterococcus facalis)、 屎肠球菌(Enterococcus faecium)、金色葡萄球菌(Staphylococcus aureus)、短小芽孢杆菌(Bacillus pumilus)、枯草芽孢杆菌(Bacillus subtilis)、 铜绿假单孢菌(Pseudomonas aeruginosa)、单增李斯特菌 (Listeria monocytogenes)、大肠杆菌(Escherichia coli)、鲍曼不动杆菌(Acinetobacter baumannii)、肺炎克雷 伯菌(Klebsiella penumoniae)、白假丝酵母(Candida albicans),均购于黑龙江省应用微生物研究所。
1.4 仪器与试剂
高效液相色谱仪(FL2200 HPLC,浙江温岭);电子天平(METTLER TOLEDO,美国)。
16SrDNA 序列扩增引物(上海生工生物工程股份有限公司合成),甲醇为色谱纯,其他试剂均为分析纯。
2 方法
2.1 北芪内生细菌的分离
将北芪根、茎样品冲洗,剥取韧皮部,按下述程序进行表面消毒:75% 乙醇浸1min→5% NaCl 浸5min→75%乙醇浸360 s→无菌水冲洗3 次→10%H2O2 浸15 min→浸于75%酒精1 min→无菌水冲3 次。将根、 茎韧皮部切成1 cm 的小块(无菌操作),置于NA 液体分离培养基中,放入水浴摇床;同时,也将其置于NA 固体分离培养基中的样品放入培养箱中,培养条件均为:37 ℃;培养3~5 d。观察,待根、茎小块四周长出菌体后,将菌体转入平板,多次划线分离纯化;另取表面消毒程序最后冲洗样品的无菌水液倒入NA 液体培养基,或涂布平板培养作对照,以排除所分离得到的内生细菌为残留在样品表面的菌株。
2.2 抑菌试验
2.2.1 北芪内生细菌发酵产物的制备 取分离得到的北芪内生细菌,活化后分别接种于含有50 mL NB 培养基的三角瓶中(n=3),于37 ℃,120 r/min 摇床培养3d,取出,作为北芪内生细菌供试品液(1×107CFU/mL)。以20%的装液量将上述北芪内生细菌供试品液接种于新配制NB 培养基中,同等条件下发酵培养5 d,取出,抽滤,滤液醇沉(3倍量95%乙醇,V/V),取上清液,回收溶剂后作为北芪内生细菌发酵产物备用。
2.2.2 抑菌试验 取2.1 节的北芪内生细菌发酵产物以等量的水饱和正丁醇超声1h,于50℃条件下,将正丁醇提取液减压浓缩后,用1 mL 甲醇溶解,作为供试品溶液,参阅文献[18],按滤纸片法操作进行抑菌活性测定。
2.3 北芪内生细菌活性代谢物分析
2.3.1 HPLC 分析条件 色谱柱:Venusil XBPC18 柱 (4.6 mm×250 mm,5 μm,USA);流动相:甲醇-水-冰醋酸(50 ∶49.7 ∶0.3)流速:1 mL/min;柱温:25℃;检测波长:254nm;进样量:10μL。
2.3.2 对照品溶液的制备 称取芒柄花素对照品适量,用甲醇稀释溶解,制成质量浓度为0.5 mg/mL 对照品溶液,备用。
2.3.3 供试品溶液制备 取2.1 节北芪内生细菌发酵产物(n=6),分别以等量的乙酸乙酯、正丁醇、氯仿萃取,各萃取液减压(50 ℃水浴条件下)浓缩近干,加入1 mL 甲醇溶解,于4 ℃保存,备用;同时,另取NB 培养基同法操作后作为空白对照品溶液;另取北芪生药3 g,精密加入甲醇50 mL,超声提取1 h,取出,放冷,滤过,滤液浓缩至5 mL 后作为对照药材液,备用。
2.3.4 样品测定 依照3.1 节的色谱条件,分别精密吸取对照品液、对照药材液、供试品液、空白对照液各10 μL(n=3)进样,检测。
2.4 菌种鉴定
2.4.1 形态学观察及生理生化鉴定 参照文献[19]。
2.4.2 16 S rDNA 序列扩增和序列分析 北芪内生菌按照常规方法[20]进行PCR 扩增。采用16S rDNA 通用引物为:27F:5′-AGAGTTTGATCCTGGCTCAG-3′和1492R:5′-GGTTACCTTGTTACGACTT-3′。PCR 产物纯化后测序(委托上海生工生物工程股份有限公司)。序列提交GenBank 数据库,在GenBank 网站上用Blast 软件进行相似性搜索,得到相近典型菌株的16S rDNA 基因序列后,用软件MEGA6.0 进行多重序列比对,构建系统进化树,分析结果并确定菌株的分类地位。
3 结果
3.1 北芪内生细菌的分离
从健康北芪根部组织、 茎部组织中共分离出36 株内生细菌,其中,从茎中分离得到16 株,从根中分离得到20 株。
3.2 内生细菌的抑菌活性
在所分离得到的36 株北芪内生细菌中,有31 株内生细菌发酵液对11 株供试致病菌具有不同程度的抑菌作用,占分离菌株的86.11%,北芪内生细菌抑菌活性筛选结果见表1。
表1 北芪内生细菌发酵液抑菌试验结果
Table 1 Antimicrobial activities of endophytic bacteria isolated from Astragalus membranaceus to the tested bacteria and fungi in screening
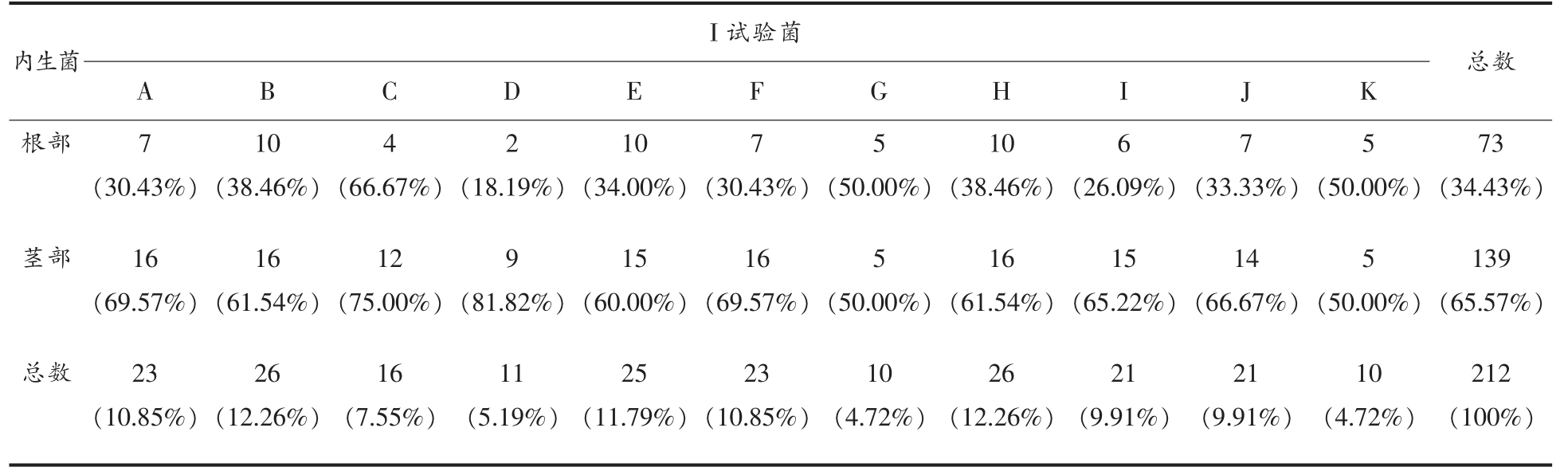
注:A:大肠杆菌;B:枯草芽孢杆菌;C:金黄色葡萄球菌;D:短小芽孢杆菌;E:铜绿假单孢菌;F:单增李斯特菌;G:肺炎克雷伯菌;H:鲍曼不动杆菌;I:屎肠球菌;J:粪肠球菌;K:白假丝酵母。表中的数值为具有抑菌活性的内生细菌数,括号内的数值为具有抑菌作用的内生菌占总菌数的百分数。
内生菌I 试验菌A B C D E F G H I J K总数根部 7(30.43%)茎部 16(69.57%)总数 23(10.85%)10(38.46%)16(61.54%)26(12.26%)4(66.67%)12(75.00%)16(7.55%)2(18.19%)9(81.82%)11(5.19%)10(34.00%)15(60.00%)25(11.79%)7(30.43%)16(69.57%)23(10.85%)5(50.00%)5(50.00%)10(4.72%)10(38.46%)16(61.54%)26(12.26%)6(26.09%)15(65.22%)21(9.91%)7(33.33%)14(66.67%)21(9.91%)5(50.00%)5(50.00%)10(4.72%)73(34.43%)139(65.57%)212(100%)
3.3 北芪内生细菌活性代谢物分析结果
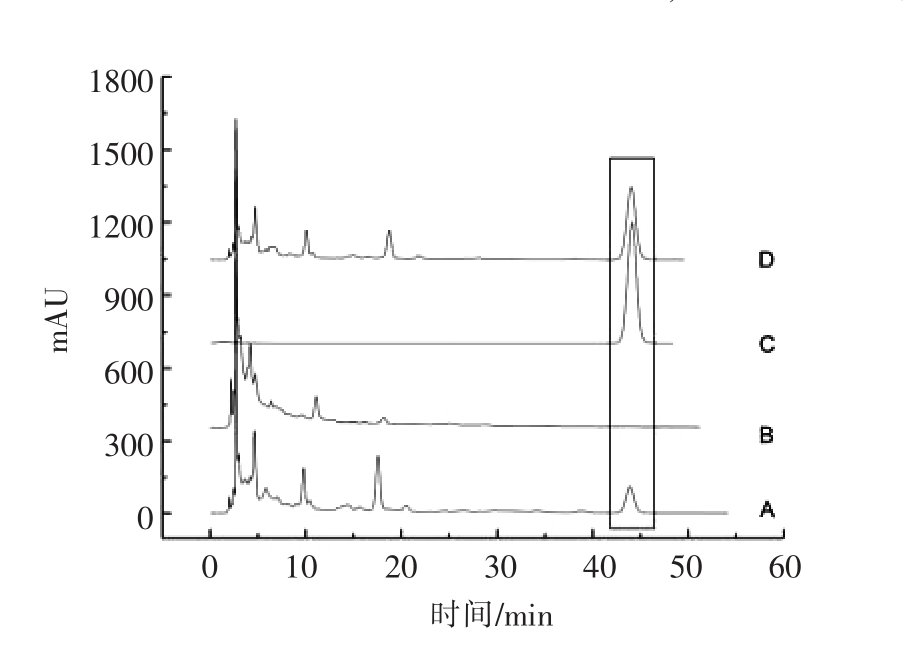
3.3.1 色谱条件下活性成分的分离 在3.1 节的色谱条件下,对照药材液中各物质得到了较好的分离,其中北芪根对照药材液在与对照品芒柄花素相同保留时间处出现一相同色谱峰,该色谱峰采用对照品加入法确认为芒柄花素,结果见图1。
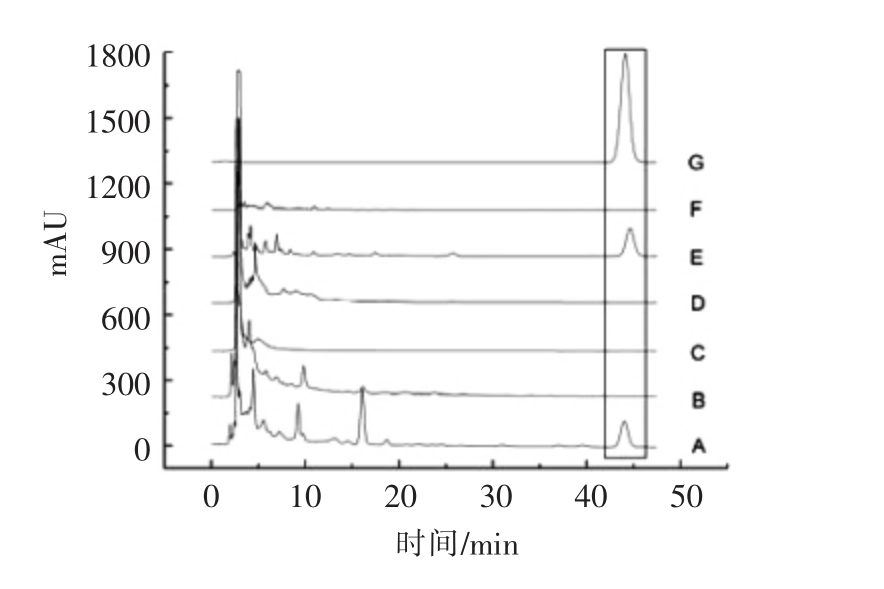
3.3.2 北芪内生细菌活性代谢物分析结果 采用HPLC 法分析36 株北芪内生细菌发酵液不同极性部位,发现内生细菌HX8 及HX14 发酵液中含有大量活性物质,并且内生细菌HX8、HX14 在与对照品及对照药材对比分析后发现,该菌株可能含有北芪活性成分芒柄花素,结果见图2及图3。
由图2可以看出,在保留时间10~12min 时,内生细菌HX8 发酵液经乙酸乙酯、氯仿萃取所得的供试品液出现与北芪根、 茎生药样品相同的色谱峰;在保留时间18 min 左右时,内生细菌HX8发酵液经乙酸乙酯萃取所得供试品液中出现与北芪茎生药样品相同的色谱峰;由图2和图3可以看出,在保留时间44min 时,内生细菌HX8、HX14发酵液经乙酸乙酯萃取所得供试品液中出现与北芪根生药样品的活性成分——芒柄花素,上述试验结果说明,内生细菌HX8、HX14 发酵液中含有与北芪生药相同或相似的活性成分,该检测结果对深入研究北芪内生细菌HX8、HX14 活性成分提供参考。
3.4 菌种鉴定
据抑菌试验结果及HPLC 法对36 株北芪内生细菌活性代谢物分析结果,对具有潜在应用价值的北芪内生细菌HX8 进行了菌种鉴定。
3.4.1 形态学观察及生理生化鉴定结果 北芪内生细菌HX8 形态学观察及生理生化鉴定结果见表2。
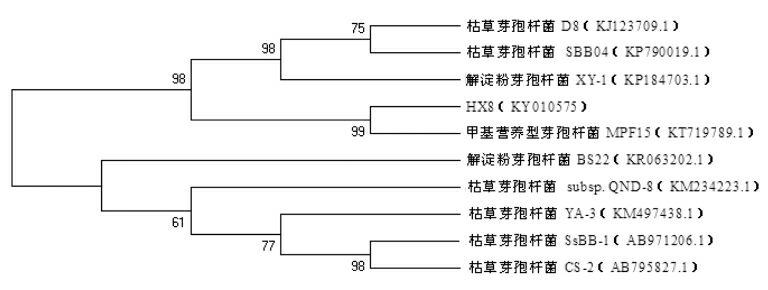
3.4.2 16S rDNA 鉴定结果 北芪内生细菌HX8 PCR 扩增后获得1 条1 000 bp 左右的特异性条带,将测序结果利用BLAST 分析并与GenBank中的核苷酸序列进行比对,然后用MEGA6.0 软件构建北芪内生细菌HX8 的系统发育树(见图4),分析其种属关系。分析结果表明,HX8 序列(登录号:KY010575)与甲基营养型芽孢杆菌Bacillus methylotrophicus strain MPF 15 的16S rDNA 序列的同源性最高,相似性为99%。结合菌体形态特征、生理生化鉴定结果确定菌株HX8 为枯草芽孢杆菌(Bacillus methylotrophicus)。
4 讨论
表2 北芪内生细菌HX8 形态学观察及生理生化鉴定结果
Table 2 Identification results of physiological and biochemical characteristics for strain HX8

结果HX8菌落形态 圆形菌落颜色 黄色革兰氏染色 +细胞形态 杆菌鞭毛 +淀粉水解反应 +明胶液化试验 +接触酶试验 +酯酶试验 +甲基红试验 -运动性试验 +V.P 试验 +菌膜形成试验 +最适生长温度 37 ℃需氧性试验 专性好氧菌最适盐浓度 3% NaCl最适生长pH 值 7.0对数生长期 6~9 h鉴定指标
以东北寒地药用植物膜荚黄芪(北芪)为研究对象,对其根、茎中的内生细菌进行了分离,并以抑菌活性为指标,对所分离得到的北芪内生细菌次生代谢产物进行抑菌活性筛选,以便能够得到产生较好抑菌活性物质的目的菌株,为开发新型防腐剂及新型抗菌药物提供参考;同时,以芒柄花素及北芪生药为对照,采用HPLC 法对北芪内生细菌次生代谢产物进行对比分析;结果表明,在36 株北芪内生细菌次生代谢产物中,存在着大量具有较好抑菌作用的活性物质,其中北芪内生细菌HX8,HX14 代谢物表现出了较好的抑菌活性,同时经HPLC 比对分析发现,此2 株内生细菌发酵液中活性物质可能含有与北芪生药活性成分相同或相似,是北芪活性成分产生菌,因此对此2株内生细菌中具有潜在应用价值的HX8 进行了菌种鉴定,为该菌株的深入研究奠定基础。
以芒柄花素为代表的黄酮类成分为黄芪主要活性成分之一[21],其中芒柄花素具有降压、抗癌及抗菌作用,是常用的药物原料[22],本文以芒柄花素及北芪生药为阳性双对照,对北芪内生细菌发酵液进行筛选,结果表明2 株北芪内生细菌HX8,HX14 发酵液中疑似含有芒柄花素,该结果对后续课题组采用柱色谱法分离此2 株目的细菌活性成分奠定基础;同时,也为采用微生物发酵法生产芒柄花素成分提供理论依据。此外,对北芪内生细菌发酵产物进行系统筛选研究,发掘出北芪活性成分产生菌,并对其进行综合利用,这对开发新资源、 采用微生物发酵法生产北芪活性成分及保护北芪药用植物可持续利用具有重要意义。
参 考 文 献
[1]NATASA R,BORUT S.Endophytic fungi-The trea sure chest of antibacterial substances[J].Phytomedicine,2012,19(14):1270-1284.
[2]BHORE S J,KOMATHI V.Types of endophytic bacteria associated with traditional medicinal plant Lantana camara Linn[J].Phcog J,2012,4(32):20-23.
[3]A ELIZABETH ARNOLD.Understanding the diversity of foliar endophytic fungi:progress,challenges,and frontiers[J].Fungal Biology Reviews,2007,21(2/3):51-66.
[4]EMI MATSUMURA,KENJI FUKUDA.A comparison of fungal endophytic community diversity in tree leaves of rural and urban temperate forests of Kanto district,eastern Japan[J].Fungal Biology,2013,117(3):191-201.
[5]YANG G D,GAO R,WANG Y,et al.Determination of swainsonine in the endophytic Undifilum fungi by high-performance liquid chromatography with evaporative light -scattering detector [J].Toxicon,2012,60(1):44-49.
[6]GUNTER B,STE’PHANE C,BIRGIT M,et al.Metabolic potential of endophytic bacteria[J].Current Opinion in Biotechnology,2014,27:30-37.
[7]BARBARA SCHULZ,CHRISTINE BOYLE,SIEGFRIED DRAEGER,et al.Endophytic fungi:a source of novel biologically active secondary metabolites[J].Mycological Research,2002,106(9):996-1004.
[8]BARBARA SCHULZ,CHRISTINE BOYLE.The endophytic continuum[J].Mycological Research,2005,109 (6):661-686.
[9]国家药典委员会.中华人民共和国药典2015年版(一部)[S].北京:中国医药科技出版社,2015:302.
[10]秦雪梅,何盼,李振宇,等.黄芪的名称考证[J].中药材,2014,37(6):1077-1078.
[11]CHEN J,LI Y,YANG L Q,et al.Biological activities of flavonoids from pathogenic-infected Astragalus adsurgens[J].Food Chemistry,2012,131(2):546-551.
[12]WANG X F,LI Y L,YANG X J,et al.Astragalus polysaccharide reduces inflammatory response by decreasing permeability of LPS-infected Caco2 cells[J].International Journal of Biological Macromolecules,2013,60:347-352.
[13]CHEN Y,SONG M Y,WANG Y X,et al.The anti -DHAV activities of Astragalus polysaccharide and its sulfate compared with those of BSRPS and its sulfate[J].Carbohydrate Polymers,2015,117(6):339-345.
[14]YANG B,XIAO B,SUN T Y.Antitumor and immunomodulatory activity of Astragalus membranaceus polysaccharides in H22 tumor-bearing mice[J].International Journal of Biological Macromolecules,2013,62:287-290.
[15]CHENA R Z,TAN L,JIN C G,et al.Extraction,isolation,characterization and antioxidant activity of polysaccharides from Astragalus membranaceus [J].Industrial Crops and Products,2015,77(23):434-443.
[16]MAO X Q,YUA F,WANG N,et al.Hypoglycemic effect of polysaccharide enriched extract of Astragalus membranaceus in diet induced insulin resistant C57BL/6J mice and its potential mechanism[J].Phytomedicine,2009,16 (5):416-425.
[17]郭晓璐,卢玢宇,郑春英.刺五加内生细菌的分离及其抑菌活性研究[J].中国新药杂志,2014,23(22):31-35.
[18]CHIKHI I,ALLALI H,BECHLAGHEM K,et al.Assessment of in vitro antimicrobial potency and free radical scavenging capacity of the essential oil and ethanol extract of Calycotome villosa sub sp.intermedia growing in Algeria[J].Asian Pacific Journal of Tropical Disease,2014,4(5):356-362.
[19]BUCHANAN R E,BERGEY N E.Bergey’s Manul of Systematic Bacteriology[M].9ed.Baltimore:Williams& Wilkins Company,1994:198.
[20]YANG Q,ZHANG J,ZHU K,et al.Influence of oxytetracycline on the structure and activity of microbial community in wheat rhizosphere soil[J].Journal of Environmentan Sciences,2009,21(7):954-959.
[21]Kuo Y H,Tsai W J,Loke S H,et al.Astragalus membranaceus flavonoids (AMF)ameliorate chronic fatigue syndrome induced by food intake restriction plus forced swimming[J].Journal of Ethnopharmacology,2009,122(1):28-34.
[22]PEGGOTY M,ELUMALAI P,IAN W,et al.Synthesis,antimycobacterial evaluation and pharmacophore modeling of analogues of the natural product formononetin[J].Bioorganic & Medicinal Chemistry Letters,2015,25(12):2510-2513.
Isolation of Endophytic Bacteria from Astragalus membranaceus (Fisch.)Bge.and Analysis of Their Secondary Metabolites
Zhai Lixin1,2 Xu Huichao1,2 Li Wei1,2 Zheng Xue1,2 Zheng Chunying1,2*
(1Engineering Research Center of Agricultural Microbiology Technology,Ministry of Education,Heilongjiang University,Harbin 1505002Key Laboratory of Microbiology,College of Heilongjiang Province,School of Life Sciences,Heilongjiang University,Harbin 150080)
Abstract Endophytic bacteria from Astragalus membranaceus (Fisch.)Bge.and their secondary metabolites were investigated in order to find novel resources.Endophytic bacteria were isolated from Astragalus membranaceus (Fisch.)Bge.by using the methods of plate cultivation,and the antimicrobial activities of endophytic bacteria’s secondary metabolites were carried out by paper disc diffusion method.Meanwhile,with formononetin and Astragalus membranaceus (Fisch.)Bge.real samples as reference substances,the secondary metabolites of these endophytic bacteria were analysis by HPLC,and the target endophytic bacteria were identified by the 16S rDNA sequence homology and their physiological and biochemical characteristics.The results indicated that 31 strains of endophytic bacteria(86.1% of the total strains isolated)showed the different antimicrobial activities,and the secondary metabolites of 2 stains had the similar or new active metabolites as their hosts,then the target bacterium HX8 was identified as Bacillus methylotrophicus.As a conclusion,Diverse antimicrobial natural products are existed in the secondary metabolites of endophytic bacteria from Astragalus membranaceus (Fisch.)Bge.,and HX8 can product the similar or new active metabolites as its host which provided a new thought and way for using endophytic bacteria to ferment and produce the components of Astragalus membranaceus (Fisch.)Bge.
Keywords Astragalus membranaceus(Fisch.)Bge.;endophytic bacteria;antimicrobial activity;secondary metabolites
文章编号 1009-7848(2019)03-0299-07
doi:10.16429/j.1009-7848.2019.03.037
收稿日期:2018-03-12
作者简历: 翟李欣,女,1990年出生,硕士生
通讯作者:郑春英 E-mail:zhengchunying68@163.com