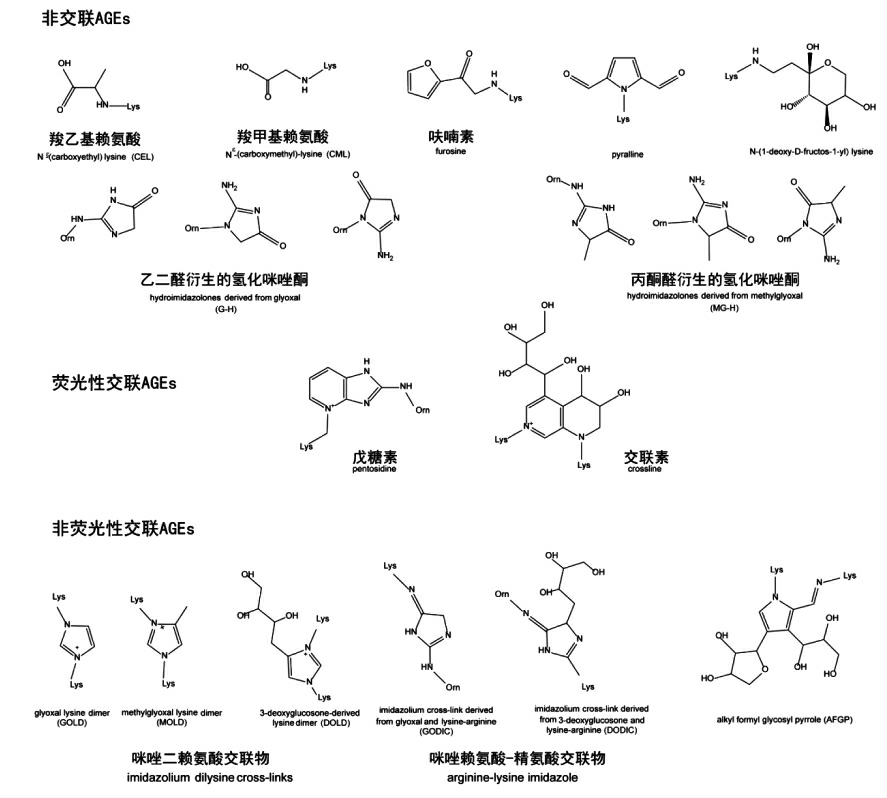
图1 常见的晚期糖基化末端产物
Fig.1 Structures of some common AGEs
晚期糖基化末端产物 (advanced glycation end products,AGEs)是蛋白质等分子上的游离氨基与还原糖通过美拉德反应(非酶糖基化)生成的一类物质(图1)。AGEs 除了在人体代谢过程中自发产生并积累外,还广泛存在于高糖高蛋白食品中,并在食品热加工过程中大量生成,通过膳食进入体内[1]。体内与体外研究均表明,AGEs 的积累与衰老、阿兹海默综合症、糖尿病密切相关,并能够引发心脑血管病、 糖尿病肾病及神经病变等多种糖尿病并发症[2-5]。AGEs 还可能导致体内蛋白质的修饰与交联,破坏蛋白质的正常构象,损害蛋白质功能[6]。此外,AGEs 与细胞中特定受体的作用还可能引发NF-κB、MAPK 等多种信号通路的异常激活,对组织与器官产生不利影响[7-8]。
随着人们生活与饮食习惯的改变,糖尿病、心血管疾病等慢性退行性疾病已成为威胁人类健康的重要因素。作为预防与治疗相关疾病的重要切入点,人们在抑制AGEs 的生成和积累方面已有一些深入的研究并发现了多种有效的AGEs 抑制剂。然而,诸如氨基胍、硒纳米颗粒以及阿司匹林等AGEs 抑制剂往往具有一定的毒副作用[9-10],无法在食品加工中广泛使用,更无法作为保健成分长期摄入。寻找食品级且安全有效的AGEs 抑制剂,对于控制AGEs 引发的危害具有重要的意义。
酚类化合物是一类分布广泛的植物次生代谢产物,根据分子结构可分为酚酸(包括羟基肉桂酸和羟基苯甲酸衍生物)、黄酮、芪类、姜黄素以及它们的聚合物[11](图2)。酚类化合物广泛分布于水果蔬菜及其它植物中,是人类膳食中的重要抗氧化成分之一。据估计,人均每日酚类化合物的摄入量为20 mg~1 g,远高于维生素E、维生素C 和类胡萝卜素等膳食抗氧化剂的摄入量[12-13]。天然酚类化合物除具有抗氧化、抗炎症、抗菌、抗癌等功能活性外,还具有显著的抗糖基化能力,可有效抑制AGEs 的生成,并对与AGEs 相关的多种疾病具有一定的预防与治疗效果[14-15]。

图1 常见的晚期糖基化末端产物
Fig.1 Structures of some common AGEs
体外模拟反应体系是研究AGEs 形成机制及调控的有效方法。将参与非酶糖基化反应的化合物在适宜条件下孵育,并在一定的周期内对体系中AGEs 的成分与含量进行监测,具有研究周期短且反应易控制等优点。富含酚类化合物的植物天然提取物,在体外模拟反应体系中表现出较强的抗糖基化活性。对多种植物天然提取物的研究均显示,提取物中总酚含量与抗糖基化能力之间具有显著的相关性[16]。通过探究酚类化合物在体外模拟体系中的抗糖基化能力,有助于控制热加工食品中AGEs 的生成,并为相关疾病的预防与治疗提供依据。目前有大量的研究证明天然酚类化合物在抑制非酶糖基化方面的突出效果,然而对其抑制非酶糖基化的机制方面仍缺乏详细信息。本文主要总结天然酚类化合物抗糖基化的机制,旨在为AGEs 的控制提供理论指导。
美拉德反应是AGEs 生成的经典途径(图3),主要分为以下3 个阶段:第1 阶段,还原性糖(如葡萄糖、果糖)中的羰基与游离氨基发生亲核加成反应,快速形成一类不稳定的亚胺化合物--西弗碱(Schiff base)。西弗碱的形成往往只需要几个小时,且反应是可逆的。随后,西弗碱通过自发的重排反应,即Amadori 重排反应,生成结构相对更稳定的酮胺[2],这种分子内的重排反应往往也是部分可逆的。以上这一阶段被称为糖基化早期阶段。有小部分的Amadori 重排产物能够直接通过氧化、水解反应不可逆地生成AGEs[17,60]。第2 阶段,Amadori 重排产物通过烯醇化反应、环化反应、氧化反应、 脱水反应和裂解反应等过程生成无色或黄色的、活泼的羰基化合物,如乙二醛(glyoxal,GO)、丙酮醛(methylglyoxal,MGO)、3-脱氧葡萄糖酮醛(3-deoxylglucoson,3DG)、葡萄糖酮醛等。在此过程中,Amadori 重排产物分子内结合的蛋白质及胺基化合物会重新游离出来。第3 阶段,二羰基化合物再次与蛋白质结合,通过一系列反应生成棕色的类黑素以及戊糖素、 羧甲基赖氨酸等AGEs[6]。AGEs 生成的早期阶段已为人们所熟知,但由于中晚期阶段机制较为复杂,因此某些具体的反应仍不明确[18]。此外,作为糖氧化与脂质过氧化的重要产物,由活性羰基化合物直接引发的非酶糖基化反应也被认为是AGEs 快速生成的重要途径(图3)[17]。

图2 常见的天然酚类化合物
Fig.2 Structures of some typical natural phenolic compounds
由于参与反应的还原糖和氨基化合物的不同以及下游反应的复杂性,AGEs 所代表的物质也多种多样。根据结构及性质,主要可分为荧光性交联的AGEs (如戊糖素、 交联素),非荧光交联的AGEs,(如咪唑二赖氨酸交联物)以及非交联的AGEs(如吡咯素、羧甲基赖氨酸)[17],常见的AGEs结构见图1。
AGEs 的生成与氧化反应密切相关,虽然Amadori 产物能够通过非氧化的途径生成活性羰基化合物[19],但更多的中间及终产物的生成均需要氧参与,如糖氧化和脂肪酸的氧化能够产生高反应活性的羰基化合物、 蛋白质的羧甲基产物也往往需要通过烯醇化的Amadori 重排产物氧化生成[19]。因此,分子氧的存在会显著加快非酶糖基化生成AGEs 的速率,而无氧条件则能够抑制AGEs的生成[6]。
自由基反应是氧化反应重要的实现途径,糖、脂质和蛋白质的氧化以及非酶糖基化生成AGEs的过程涉及大量的氧化反应并伴随着自由基的生成,在这一过程中,分子氧被还原为超氧阴离子自由基,随后在氢离子的作用下生成过氧化氢,并最终经过金属离子的催化生成羟基自由基和分子氧[20-21],同时还原糖和脂质通过自动氧化生成以碳或氧为中心的自由基,并生成活性羰基化合物,参与后续糖基化反应。西弗碱和Amadori 重排产物则在含氧自由基的作用下发生氢原子转移或电子的得失,使AGEs 生成及蛋白质交联得以进行[22-23]。
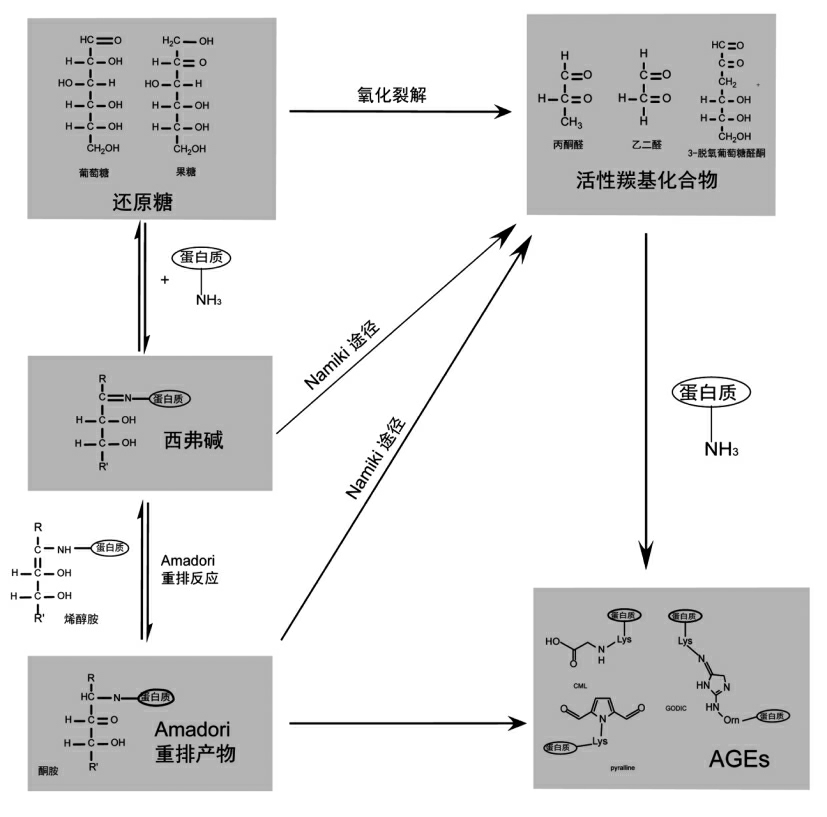
图3 AGEs 的生成过程
Fig.3 Reactions lead to the formation of AGEs
许多自由基清除剂都能够起到防止蛋白质糖基化修饰和交联、抑制AGEs 生成的作用[19,24]。作为一种重要的天然抗氧化物质,酚类化合物具有较维生素C、维生素E 更强的自由基清除能力。这种自由基清除活性能有效抑制还原糖的氧化和非酶糖基化反应各个阶段的进行,从而降低反应体系中的AGEs 水平[25-26]。对多种酚类化合物及富含酚类化合物的天然提取物的研究均表明,提取物的自由基清除能力与糖基化能力往往具有显著的相关性[16,27]。酚类化合物分子上酚羟基的解离能较低,能够为自由基提供氢原子,自身变为相对稳定的苯氧自由基,从而达到猝灭自由基,切断自由基传递链,终止氧化反应的作用[28](图4)。在该机制下,酚类化合物的抗氧化能力取决于其酚羟基的氢原子转移能力 (hydrogen-atom transfer,HAT)以及所形成的苯氧自由基的稳定性[29],它们与酚类化合物酚羟基的数量、 位置以及由此引起的共振、共轭效应和氢键形成有密切关系。研究表明,酚羟基对位和邻位的致活取代基(electron donating group,EDG,如-OH、-CH3 和-OCH3)有助于降低氢氧键的解离能,并通过共振效应和超共轭效应稳定所生成的苯氧自由基,从而提高酚类化合物的抗氧化能力。致顿基(electron withdrawing group,EWG)也能够通过电子离域作用稳定苯氧自由基。酚类化合物与溶剂之间的氢键会抑制抽氢反应的发生,从而降低其自由基清除能力,但苯氧自由基中心氧原子与相邻的羟基形成氢键却可以提高苯氧自由基的稳定性,提高带有邻苯二酚结构酚类化合物的自由基清除能力[28]。酚类化合物还能够为自由基提供单电子(图4),自身转变为稳定的阳离子自由基。酚类化合物酚羟基的电离势决定了其单电子转移 (single electron transfer,SET)能力的高低,电离势越低,酚类化合物越易提供电子,自由基清除能力越强。酚类化合物中,山奈酚等黄酮类物质和白藜芦醇等芪类分子的平面结构和共振效应能够引发电子离域,显著降低某些特定酚羟基的电离势,并通过提供电子发挥自由基清除活性[28]。
许多具有氧化还原活性的过渡金属离子,如Fe2+、Fe3+、Cu+、Cu2+等具有催化氧化反应的能力。在有氧条件下,过渡金属能够催化还原糖、脂质、蛋白质以及非酶糖基化中间产物的氧化,产生活性羰基化合物和自由基。例如,还原糖自动氧化过程中,烯醇化的糖分子在金属离子的作用下生成烯醇自由基,随后被氧化为活性羰基化合物并产生超氧自由基[30];脂质过氧化中,脂质过氧化物受到金属离子的催化生成过氧化自由基,并在有氧条件下将电子传递给脂质分子,引发脂质的进一步氧化[31];还原态的金属离子能够与蛋白质多肽链上的赖氨酸、精氨酸、脯氨酸等氨基酸残基形成复合物,并与过氧化氢反应生成羟基自由基,促进蛋白质在原位生成羰基衍生物,最终引发蛋白质的氧化[32];金属离子还能够催化非酶糖基化早期产物,如Amadori 重排生成的烯醇和酮胺的氧化[20]。除此之外,在金属离子的催化下,还原糖、脂质氧化所产生的过氧化氢、 超氧自由基等能够继续通过Haber-Weiss 或Fenton 反应生成羟基自由基,相比于其他自由基,羟基自由基具有更强的反应活性,其生成将会进一步促进AGEs 的生成[28,33]。以上这些机制的存在使非酶糖基化反应得以更快的进行,因此,金属离子的存在会成倍地提高反应体系中AGEs 的生成[49]。
然而,通过防止金属催化的葡萄糖、脂质以及Amadori 重排产物的氧化反应,金属螯合剂能够发挥显著的AGEs 抑制作用[49]。许多天然酚类化合物具有螯合Fe2+、Fe3+、Cu+、Cu2+等金属离子的能力,这种金属鳌合能力的高低主要取决于其金属结合位点上的电子给予能力,与其结构有着密切的关系。研究表明,同一苯环上相邻的两个羟基能够使酚类化合物结合金属离子,因此许多带有儿茶酚(邻苯二酚)、焦酚(邻苯三酚)结构的酚类化合物都表现出了一定的金属离子螯合能力 (图4),而仅带有一个酚羟基的酚类化合物由于负电荷密度较低往往不能与金属离子形成复合物[34]。酚酸类物质主要依赖于其分子内的儿茶酚、 焦酚结构鳌合金属,羟基肉桂酸衍生物较羟基苯甲酸衍生物具有更强的金属鳌合能力[34];黄酮化合物分子内除了B 环上的儿茶酚结构 (3'、4' 位点上的双羟基)作为主要的金属离子的结合位点外,3、5 位的双羟基、7、8 位的双羟基以及4 位的羰基也具有金属离子结合的功能[35]。总体来看,儿茶酚较焦酚结构具有更强的金属螯合能力。通过结构相似的酚酸和黄酮类化合物的对比研究发现,用焦酚替代酚类化合物分子中的儿茶酚结构会显著降低其金属鳌合能力[34-35]。天然酚类化合物的金属螯合能力能够抑制金属离子催化的氧化反应,是除自由基清除能力外,其发挥抗氧化活性的另一个重要方面[29]。除此之外,也有研究表明某些酚类化合物与金属离子的复合物相对于酚类化合物具有更强的抗氧化活性[37]。然而,大多数对富含酚类化合物的植物提取物的研究并未发现提取物金属螯合能力与抗糖基化能力之间具有显著的相关关系[36],说明金属螯合能力可能并非酚类化合物抗糖基化的必须机制。
活性羰基化合物又被称为α-二羰基化合物、α-含氧醛,其分子内包含两个位于相邻碳原子上的羰基。活性羰基化合物存在于多种食物中,是油炸焙烤类食品色泽与风味物质的前体,常见的活性羰基化合物包括乙二醛(GO)、丙酮醛(MGO)和3-脱氧葡萄糖醛(3-DG)。在非酶糖基化反应过程中,活性羰基化合物往往通过西弗碱和Amadori重排产物的裂解产生,并参与到后续的反应中,此过程常被称作Namiki 途径(图3)[6]。除此之外,活性羰基化合物还可由还原糖及脂质的氧化产生[38]。活性羰基化合物具有很强的反应活性,相比还原糖分子,活性羰基化合物能够在数小时之内便与蛋白质发生非酶糖基化反应[59]。某些氨基酸(如赖氨酸、精氨酸和苏氨酸)及氨基酸残基(半胱氨酸、组氨酸)极易与羰基化合物反应,生成蛋白羰基化合物,并通过氧化、脱水、环化等反应生成AGEs[6]。此外,活性羰基化合物分子中的两个羰基可以分别与蛋白质多肽链上的游离氨基结合,生成GOLD、MOLD 等AGEs,成为引发蛋白质交联反应的必经步骤[38]。因此,活性羰基化合物是非酶糖基化的重要途径,能够显著促进AGEs 的生成。
天然酚类化合物以及富含酚类化合物的植物提取物具有显著的活性羰基化合物清除能力,并能够抑制由活性羰基化合物引起的AGEs 生成[39-41]。对于多种植物提取物的研究均表明,提取物中的总酚含量与其羰基化合物清除能力、AGEs 抑制能力呈现显著的正相关[39,42-43]。Tolgahan Kocadag等[44]测定了不同材料制作的饼干中羰基化合物的含量,结果也表明,饼干中总酚含量与其乙二醛、丙酮醛和二乙酰的含量呈现负相关,这是由于酚类化合物对羰基化合物的清除作用造成的。
酚类物质具有提供电子的能力,而活性羰基化合物具有一定的亲电性质[45],这是天然酚类化合物具备羰基清除能力的基础。对于多种酚类化合物的研究表明,酚类化合物芳香环上的非取代碳原子能够与活性羰基化合物发生亲电取代反应,形成羰基化合物复合物(图4)[45-46]。在此过程中,天然酚类化合物与蛋白质中的赖氨酸、精氨酸残基等糖基化活性位点竞争性地结合活性羰基化合物,从而起到清除活性羰基化合物,抑制AGEs的生成的作用[41-42,46]。
由于酚类化合物结构的差异,其结合活性羰基化合物的位点也不相同。此外,酚类化合物分子上羟基的位置与数目对其羰基化合物结合能力也有着明显的影响。邻苯三酚苯环中的4 位与5 位碳原子是MGO 的主要结合位点[47]。3,4-二羟基苯乙酸分子内上2 位碳原子是与MGO 结合的主要位点[46]。姜黄素类化合物主要通过侧链上的羰基发挥羰基化合物结合能力[48]。根皮素与根皮苷分子上A 环的3、5 位是羰基化合物的结合位点,但根皮素较根皮苷具有更强的羰基化合物结合能力,说明根皮素分子中A 环上的2 位羟基在结合羰基化合物方面发挥着重要的作用[50]。对于黄酮类化合物的研究则表明,黄酮分子内A 环上的6位与8 位碳原子是主要的羰基化合物结合部位,但C 环中2,3 位的双键以及A 环中5 位的羟基取代能够显著提高黄酮化合物的活性[47]。
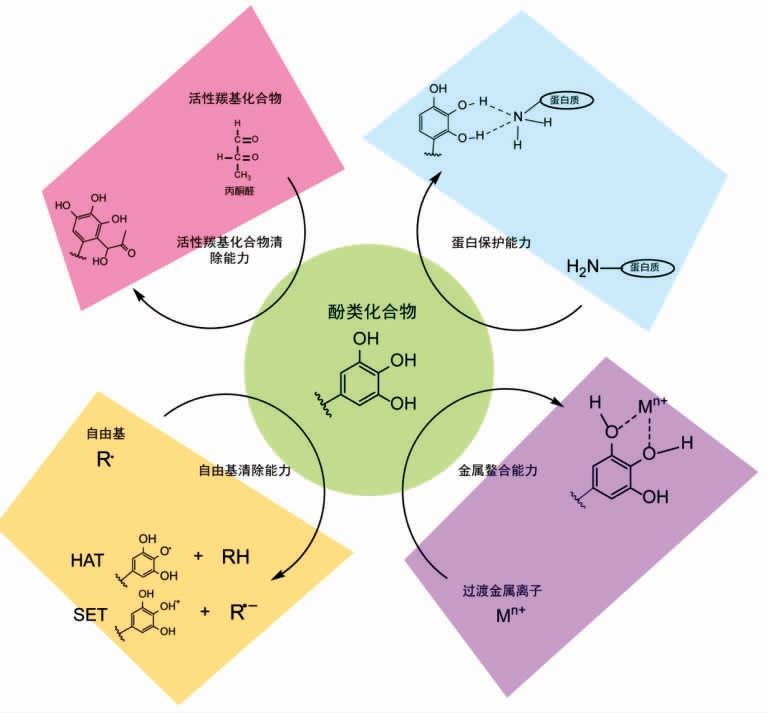
图4 天然酚类化合物抑制AGEs 生成的机制
Fig.4 Mechanisms underlie the antiglycation property of natural derived phenolic compounds
蛋白质多肽链上的赖氨酸、 精氨酸和半胱氨酸残基相对其他氨基酸残基更易参与非酶糖基化反应,这些位点非酶糖基化与AGEs 的生成水平密切相关。对牛血清蛋白(bovine serum albumin,BSA)的研究已经阐明了Lys525、Arg410 等多个易于发生非酶糖基化的氨基酸位点[51]。这些氨基酸残基往往位于蛋白质分子表面[52],具有较强的亲核特性且接近其他赖氨酸与组氨酸等碱性氨基酸残基。在Amadori 重排产物的生成中起到催化作用。蛋白的非酶糖基化和AGEs 的生成会导致功能性蛋白构象的改变,对血清蛋白、血红蛋白、溶菌酶等的体外研究表明,非酶糖基化会导致蛋白质结构的显著改变,主要表现为亲水性、紫外可见光谱和荧光性的改变、 分子中的α 螺旋比例的降低、β-折叠层和无规则卷曲比例的增加、三级结构的消失等[53-55]。在功能上则主要表现为酶活性的改变、受体识别能力的减弱、蛋白质半衰期及免疫特性的改变等,严重影响蛋白质功能的发挥[18, 51,54]。
天然酚类化合物具有结合蛋白质的性质,该性质很早就被应用于食品的澄清与脱涩。酚类化合物分子中的芳香环与蛋白质多肽链上的疏水氨基酸之间通过疏水作用聚拢,并在羧基与碱性氨基酸残基间的静态力、 羟基与多肽链上C-O 和N-H 键之间的氢键甚至共价键等的作用下维持复合物的稳定性[28,40,56]。天然酚类化合物与蛋白质的结合能够有效保护蛋白质结构的完整性,抑制非酶糖基化的发生[53,57],其作用机制主要体现在两个方面。第一,对于某些蛋白质的对接研究(docking study)表明,酚类化合物具有与蛋白质多肽链中氨基结合的能力。例如,绿原酸能够与BSA 上的Lys 93、Lys 232、Lys 261 和Arg194 相结合,丁香酸能够与BSA 上的Lys 93 和Arg194 位点相结合[53]。酚类化合物与参与非酶糖基化氨基酸残基的结合能够有效保护游离氨基,阻止蛋白质受到非酶糖基化修饰。第二,酚类化合物能够通过维持蛋白质结构的稳定性来抑制非酶糖基化,例如,矢车菊素-3-葡萄糖苷能够通过氢键与范德华力自发地插入BSA IIIA 结构域的疏水腔内[58],绿原酸与阿魏酸也能够通过疏水作用力分别插入HSA分子的IIA 和IIIA 结构域的疏水腔内[56]。酚类化合物可能在一定程度上破坏蛋白质原有的氢键网络,但并不会引发其二级结构的显著变化,相反,酚类化合物的结合能够有效维持蛋白质二级结构中α 螺旋的稳定性,抑制β-折叠层、无规则卷曲的生成以及疏水基团的暴露,从而防止蛋白质内部的氨基酸残基受到修饰[25]。
近年来,天然酚类化合物由于其突出的功能活性已成为食品领域的研究热点。目前已有大量资料证明,天然酚类化合物能够有效抑制AGEs的生成,对与AGEs 相关疾病的预防与治疗具有一定作用。通过总结现有研究成果,本文归纳了天然酚类化合物抑制AGEs 生成的4 种机制:自由基清除能力、金属螯合能力、羰基清除能力以及蛋白质结合能力(图4)。需要看到的是,以上所讨论的抑制机理往往是共同作用的。某些酚类化合物由于其特殊的结构,各种糖基化抑制机制的协同效应能够使其具备更为明显的抗糖基化活性,这些物质将会是今后研究与应用的重点。
然而,由于酚类化合物种类的繁多和抑制机制本身的复杂性,目前的研究多侧重于对酚类化合物非酶糖基化抑制活性的描述而非抑制机制的探究,对天然酚类化合物抑制AGEs 生成机制的探讨往往缺乏系统性。在天然酚类化合物抑制AGEs 生成这一课题中,仍旧有许多问题亟待解决。
首先,相对简单的体外模拟反应体系虽然有助于简化研究过程,但并不能完全反映酚类化合物在体内的作用机制。与其他食品成分一样,天然酚类化合物需要经过人体的吸收代谢后才能够发挥其生理作用,酚类化合物经过人体代谢后的产物是否依然通过原有的机制发挥作用,仍有待于研究。另一方面,酚类化合物在体内并非简单的化学作用,而是通过影响酶的活性,基因的表达来调控相关的信号通路,减轻体内蛋白的非酶糖基化修饰以及AGEs 生成带来的不利影响。在这一点上,细胞实验、动物实验将会是评价酚类化合物抑制AGEs 生成的重要手段。
其次,天然酚类化合物的抗糖基化活性会受到多种因素的影响,从酚类化合物本身的性质来看,溶解度、浓度、代谢途径等都会对其性质产生明显的影响,在某些情况下,酚类化合物反而具有促进氧化的作用[28],很可能也同时促进了AGEs 的生成。而从非酶糖基化反应本身来看,反应体系的pH 值、反应物的种类、浓度、温度都会显著改变AGEs 的生成途径与速率[6]。现有的体外模拟反应体系多选用BSA、葡萄糖及MGO 等具有代表性的反应物,在生理pH,生理浓度下进行研究,但由于食品成分复杂,加工方式多样,酚类化合物在模拟反应体系中抑制AGEs 生成的机制可能并不适用于食品体系。
虽然对酚类化合物抗糖基化的研究已具备了一定的理论基础,但目前酚类化合物尚未得到广泛的应用,将酚类化合物应用于食品质量的改善甚至相关疾病的防治目前仍无法完全实现,但由于酚类化合物安全无毒、 来源广泛,因此在抑制AGEs 在食品中的生成以及预防与治疗相关疾病等方面仍具有重要的研究价值。
[1]URIBARRI J,WOODRUFF S,GOODMAN S,et al.Advanced glycation end products in foods and a practical guide to their reduction in the diet [J].Journal of the American Dietetic Association,2010,110(6):911-916.
[2]TAKEUCHI M,BUCALA R,SUZUKI T,et al.Neurotoxicity of advanced glycation end-products for cultured cortical neurons [J].Journal of Neuropatholo gy & Experimental Neurology,2001,59(12):1094-1105.
[3]TAN K C B,SHIU S W M,YING W,et al.Serum advanced glycation end products (AGEs)are associated with insulin resistance[J].Diabetes/metabolism Research & Reviews,2011,27(5):488-492.
[4]BODIGA V L,EDA S R,BODIGA S.Advanced glycation end products:role in pathology of diabetic cardiomyopathy[J].Heart Failure Reviews,2013,19(1):49-63.
[5]FUKAMI K E I,UEDA S,YAMAGISHI S I,et al.AGEs activate mesangial TGF-β-Smad signaling via an angiotensin II type I receptor interaction[J].Kidney International,2004,66(6):2137-2147.
[6]POULSEN M W,HEDEGAARD R V,ANDERSEN J M,et al.Advanced glycation endproducts in food and their effects on health[J].Food & Chemical Toxicology An International Journal Published for the British Industrial Biological Research Association,2013,60(10):10-37.
[7]BIERHAUS A,SCHIEKOFER S,SCHWANINGER M,et al.Diabetes-associated sustained activation of the transcription factor nuclear factor-kappa B[J].Diabetes,2001,50(12):2792-2808.
[8]NAKAJIMA Y,INAGAKI Y,KIDO J,et al.Advanced glycation end products increase expression of S100A8 and A9 via RAGE-MAPK in rat dental pulp cells[J].Oral Diseases,2015,21(3):328-234.
[9]AHMED N.Advanced glycation endproducts-role in pathology of diabetic complications[J].Diabetes Research & Clinical Practice,2005,67(1):3-21.
[10]HE Y,CHEN S,LIU Z,et al.Toxicity of selenium nanoparticles in male Sprague-Dawley rats at supranutritional and nonlethal levels[J].Life Sciences,2014,115(1/2):44-51.
[11]CHEYNIER V.Phenolic compounds:from plants to foods[J].Phytochemistry Reviews,2012,11(2/3):153-177.
[12]SOOBRATTEE M A,NEERGHEEN V S,LUXIMON-RAMMA A,et al.Phenolics as potential antioxidant therapeutic agents:Mechanism and actions[J].Mutation Research / fundamental & Molecular Mechanisms of Mutagenesis,2005,579(1/2):200-213.
[13]Institute of Medicine(US).Panel on dietary antioxidants and related compounds.dietary reference intakes for vitamin C,vitamin E,selenium,and carotenoids[M].Washington D.C.:National Academies Press,2000:154,243.
[14]KARIMI J,MOHAMMAD T G,TAVILANI H,et al.Myricetin inhibits advanced glycation end product(AGE)-induced migration of retinal pericytes through phosphorylation of ERK1/2,FAK-1,and paxillin in vitro and in vivo[J].Biochemical Pharmacology,2015,93(4):496-505.
[15]XIE W,WANG W,SU H,et al.Effect of ethanolic extracts of Ananas comosus L.leaves on insulin sensitivity in rats and HepG2[J].Comparative Biochemistry & Physiology Part C Toxicology & Pharmacology,2006,143(4):429-435.
[16]KUO C T,LIU T H,HSU T H,et al.Antioxidant and antiglycation properties of different solvent extracts from Chinese olive (Canarium album L.)fruit[J].Asian Pacific Journal of Tropical Medicine,2015,8(12):987-995.
[17]GAENS K H,STEHOUWER C D,SCHALKWIJK C G.Advanced glycation endproducts and its receptor for advanced glycation endproducts in obesity[J].Current Opinion in Lipidology,2013,24(1):4-11.
[18]GAENS,KATRIEN H J,STEHOUWER,et al.The Nε-(carboxymethyl)lysine-RAGE axis:putative implications for the pathogenesis of obesity -related complications[J].Expert Review of Endocrinology &Metabolism,2014,5(5):839-854.
[19]SMITH P R,THORNALLEY P J.Mechanism of the degradation of non-enzymatically glycated proteins under physiological conditions.Studies with the model fructosamine,N epsilon-(1-deoxy-D-fructos-1-yl)hippuryl-lysine[J].European Journal of Biochemistry,1992,210(3):729-739.
[20]MULLARKEY C J,EDELSTEIN D,BROWNLEE M.Free radical generation by early glycation products:A mechanism for accelerated atherogenesis in diabetes[J].Biochemical & Biophysical Research Communications,1990,173(173):932-939.
[21]SPITELLER G.Peroxyl radicals are essential reagents in the oxidation steps of the maillard reaction leading to generation of advanced glycation end products[J].Annals of the New York Academy of Sciences,2008,1126(1):128-133.
[22]WOLFF S P,CRABBE M J C,THORNALLEY P J.The autoxidation of glyceraldehyde and other sim ple monosaccharides[J].Cellular & Molecular Life Sciences Cmls,1984,40(40):244-246.
[23]AHMED M U,THORPE S R,BAYNES J W.Identification of N epsilon-carboxymethyllysine as a degradation product of fructoselysine in glycated protein[J].Journal of Biological Chemistry,1986,261(11):4889-4894.
[24]SAJITHLAL G B,CHITHRA P,CHANDRAKASAN G.Advanced glycation end products induce crosslinking of collagen in vitro[J].Biochimica Et Biophysica Acta,1998,1407(3):215-224.
[25]THILAVECH T,NGAMUKOTE S,ABEYWARDENA M,et al.Protective effects of cyanidin-3-rutinoside against monosaccharides-induced protein glycation and oxidation[J].International Journal of Biological Macromolecules,2015,75(1):515-520.
[26]HSIEH C L,LIN Y C,YEN G C,et al.Preventive effects of guava (Psidium guajava,L.)leaves and its active compounds against α-dicarbonyl compounds-induced blood coagulation[J].Food Chem istry,2007,103(2):528-535.
[27]DAIPONMAK W,SENAKUN C,SIRIAMORNPUN S.Antiglycation capacity and antioxidant activities of different pigmented Thai rice[J].International Journal of Food Science & Technology,2014,49 (8):1805-1810.
[28]QUIDEAU S,DEFFIEUX D,DOUAT-CASASSUS C,et al.Plant polyphenols:chemical properties,biological activities,and synthesis[J].Angewandte Chemie International Edition,2011,50 (3):586-621.
[29]RICE-EVANS C,MILLER N,PAGANGA G.Antioxidant properties of phenolic compounds[J].Trends in Plant Science,1997,2(4):152-159.
[30]WOLFF S P,DEAN R T.Glucose autoxidation and protein modification.The potential role of ‘autoxidative glycosylation’ in diabetes[J].Biochemical Journal,1987,245(1):243-250.
[31]KNIGHT J A,MCCLELLAN L.Metal -catalyzed peroxidation of polyunsaturated fatty acids[J].Annals of Clinical & Laboratory Science,1989,19 (5):377-382.
[32]TRNKOVÁ L,DRŠATA J,BOUŠOVÁ I.Oxidation as an important factor of protein damage:Implications for Maillard reaction[J].Journal of Biosciences,2015,40(2):419-439.
[33]CHACE K V,CARUBELLI R,NORDQUIST R E.The role of nonenzymatic glycosylation,transition metals,and free radicals in the formation of collagen aggregates[J].Archives of Biochemistry & Biophysics,1991,288(2):473-480.
[34]MIRJANA A,JOHN V C,BRUNO D M,et al.Iron-chelation properties of phenolic acids bearing catechol and galloyl groups[J].Food Chemistry,2006,98(1):23-31.
[35]KHOKHAR S,APENTEN R O.Iron binding characteristics of phenolic compounds:some tentative structure-activity relations[J].Food Chemistry,2003,81(1):133-140.
[36]THUMMAJITASAKUL S,TUMCHALEE L,KOOLWONG S,et al.Antioxidant and antibacterial potentials of some Thai native plant extracts[J].Zeitschrift Für Ärztliche Fortbildung,2014,63(17):930-934.
[37]El H H,NKHILI E,TOMAO V,et al.Interactions of quercetin with iron and copper ions:complexation and autoxidation[J].Free Radical Research,2006,40(3):303-320.
[38]YIM M B,YIM H S,LEE C,et al.Protein glycation:creation of catalytic sites for free radical generation[J].Annals of the New York Academy of Sciences,2001,928(1):48-53.
[39]SOMPONG W,ADISAKWATTANA S.Inhibitory effect of herbal medicines and their trapping abilities against methylglyoxal -derived advanced glycation end-products[J].Bmc Complementary & Alternative Medicine,2015,15(1):1-8.
[40]MESÍAS M,NAVARRO M,MARTÍNEZ-SAEZ N,et al.Antiglycative and carbonyl trapping properties of the water soluble fraction of coffee silverskin[J].Food Research International,2014,62(62):1120-1126.
[41]KIM J,JEONG I H,KIM C S,et al.Chlorogenic acid inhibits the formation of advanced glycation end products and associated protein cross -linking [J].Archives of Pharmacal Research,2011,34(3):495-500.
[42]HARSHA P S C S,MESIAS M,LAVELLI V,et al.Grape skin extracts from winemaking by-products as a source of trapping agents for reactive carbonyl species[J].Journal of the Science of Food & Agri culture,2015,96(2):656-663.
[43]MESÍAS M,NAVARRO M,GÖKMEN V,et al.Antiglycative effect of fruit and vegetable seed extracts:inhibition of AGE formation and carbonyltrapping abilities[J].Journal of the Science of Food& Agriculture,2013,93(8):2037-2044.
[44]KOCADAG LI T,ŽILIC S,TAS N G,et al.Formation of α-dicarbonyl compounds in cookies made from wheat,hull-less barley and colored corn and its relation with phenolic compounds,free amino acids and sugars[J].European Food Research &Technology,2015,242(1):51-60.
[45]TOTLANI V M,PETERSON D G.Epicatechin car bonyl-trapping reactions in aqueous maillard systems:Identification and structural elucidation[J].Journal of Agricultural & Food Chemistry,2006,54(19):7311-7318.
[46]NAVARRO M,MORALES F J.Mechanism of reactive carbonyl species trapping by hydroxytyrosol un der simulated physiological conditions[J].Food Chemistry,2015,175(1):92-99.
[47]SHAO X,CHEN H,ZHU Y,et al.Essential structural requirements and additive effects for flavonoids to scavenge methylglyoxal[J].Journal of Agricultural & Food Chemistry,2014,62 (14):3202-3210.
[48]ZHU Y,ZHAO Y,WANG P,et al.Bioactive ginger constituents alleviate protein glycation by trapping methylglyoxal[J].Chemical Research in Toxicology,2015,28(9):1842-1849.
[49]SAJITHLAL G B,CHITHRA P,CHANDRAKASAN G.An in vitro study on the role of metal catalyzed oxidation in glycation and crosslinking of collagen[J].Molecular & Cellular Biochemistry,1999,194(1/2):257-263.
[50]SHAO X,BAI N K,HO C,et al.Apple polyphenols,phloretin and phloridzin:new trapping agents of reactive dicarbonyl species[J].Chemical Research in Toxicology,2008,21(10):2042-2050.
[51]RONDEAU P,BOURDON E.The glycation of albumin:Structural and functional impacts[J].Biochimie,2011,93(4):645-658.
[52]LEDESMAOSUNA A I,RAMOSCLAMONT G,VÁZQUEZMORENO L.Characterization of bovine serum albumin glycated with glucose,galactose and lactose[J].Acta Biochimica Polonica,2008,55(3):491-497.
[53]BHATTACHERJEE A,DATTA A.Mechanism of antiglycating properties of syringic and chlorogenic acids in in vitro glycation system[J].Food Research International,2015,77(3):540-548.
[54]KHAN M S,TABREZ S,RABBANI N,et al.Oxidative stress mediated cytotoxicity of glycated albumin:comparative analysis of glycation by glucose metabolites[J].Journal of Fluorescence,2015,25(6):1721-1726.
[55]IRAM A,ALAM T,KHAN J M,et al.Molten globule of hemoglobin proceeds into aggregates and advanced glycated end products[J].Plos One,2013,8(8):e72075-e72075.
[56]KANG J,YUAN L,XIE M X,et al.Interactions of human serum albumin with chlorogenic acid and ferulic acid[J].Biochimica Et Biophysica Acta,2004,1674(2):205-214.
[57]VLASSOPOULOS A,LEAN M E J,COMBET E.Inhibition of protein glycation by phenolic acids:physiological relevance and implication of proteinphenolic interactions[J].Proceedings of the Nutrition Society,2014,74(OCE1):10711-10716.
[58]SHI J H,WANG J,ZHU Y Y,et al.Characterization of intermolecular interaction between cyanidin-3-glucoside and bovine serum albumin:Spectroscopic and molecular docking methods[J].Luminescence the Journal of Biological & Chemical Luminescence,2014,29(5):522-530.
[59]THORNALLEY P J,LANGBORG A,MINHAS H S.Formation of glyoxal,methylglyoxal and 3-deoxyglucosone in the glycation of proteins by glucose[J].Biochemical Journal,1999,344 Pt 1(1):109-116.
[60]AHMED N.Advanced glycation endproducts-role in pathology of diabetic complications[J].Diabetes Research & Clinical Practice,2005,67(1):3-21.
Research Progress of Inhibitory Effect of Natural-derived Phenolic Compounds on Advanced Glycation End Products