多酚是植物性食物中广泛存在的一种非营养成分,根据其化学结构特点主要分为酚酸、类黄酮、芪类、香豆素、单宁等,具有丰富的生物活性,如抗氧化、抗炎、抗衰老、抗动脉粥样硬化、抗代谢性疾病、抗菌和光损伤保护作用等,在促进人体健康、美容护肤等方面发挥重要作用[1-3]。日常膳食中多酚的主要来源包括水果、蔬菜、全谷物、香草、香料、咖啡豆和茶叶等[4]。本课题组前期研究发现部分多酚类化合物可直接作用于Caco-2 或HaCaT细胞,促进SIRT3 的转录表达,上调抗氧化酶SOD2 的活性,从而增强细胞的抗氧化能力,缓解细胞的氧化应激损伤[5-6]。近年来,临床发现皮肤与肠道之间具有密切的关系。肠道吸收异常会引发皮肤病,如肠病性肢端皮炎、皮肤过敏、银屑病等,而患有这些皮肤病的同时,肠道也会表现出腹胀、腹泻、大便粘稠等症状[7-8]。多酚类化合物经肠道吸收后,是否还能发挥保护作用需要进一步探究。
Caco-2 细胞来源于人结肠腺肿瘤,可在体外培养条件下自发分化形成连续单层的肠上皮样细胞,与肠道上皮细胞在形态学和生理功能上具有相似性[9-10]。由于Caco-2 单层细胞模型简便、高效的特点,国内外通常将其作为体外模拟肠道吸收模型,应用于大量口服药物的筛选以及药物的转运吸收研究中[11-12]。近年来在食品领域,特别是膳食活性成分的功能研究领域也开始运用Caco-2单层细胞模型预测活性成分在体内的吸收情况,如利用Caco-2 单层细胞模型检测类胡萝卜素类化合物的运输效率,发现虾青素的运输效率最高[13];利用Caco-2 细胞单层模型评价蓝莓花色苷类化合物的吸收情况,可以得到花色苷在Caco-2 细胞单层的吸收规律,即羟基基团越多,-OCH3 基团越少,其渗透性越差[14]。通过对膳食活性成分在Caco-2 单层细胞模型吸收、转运情况的探究,筛选高效的目标活性物质。此外,将膳食活性成分处理Caco-2 单层细胞后与靶细胞共培养,则能直观反映活性成分在肠道吸收后对靶器官或组织的影响。
前期研究表明,白藜芦醇、山奈酚、安石榴苷、漆树黄酮4 种多酚均能促进HaCaT 细胞SIRT3基因的表达,是潜在的SIRT3 多酚激活剂,其中白藜芦醇、安石榴苷、漆树黄酮降低了UVB 诱导的HaCaT 细胞内ROS 水平,安石榴苷对UVB 引起的细胞衰老具有修复作用[6]。这些多酚类化合物对HaCaT 细胞的保护作用极有可能与SIRT3 介导的抗氧化途径有关。在此基础上,本文进一步探究这4 种多酚类化合物以及月见草素B 在被肠道转运后的保护作用及机制。通过建立Caco-2 与HaCaT细胞trans-well 共培养体系,体外模拟肠道转运吸收,从以下两个方面探究白藜芦醇、山奈酚、安石榴苷、漆树黄酮以及月见草素B 这5 种多酚类化合物的保护作用:一是多酚对HaCaT 细胞SIRT3的间接激活作用,二是多酚对UVB 诱导的HaCaT细胞氧化应激的间接抑制作用。
1 材料与方法
1.1 材料与试剂
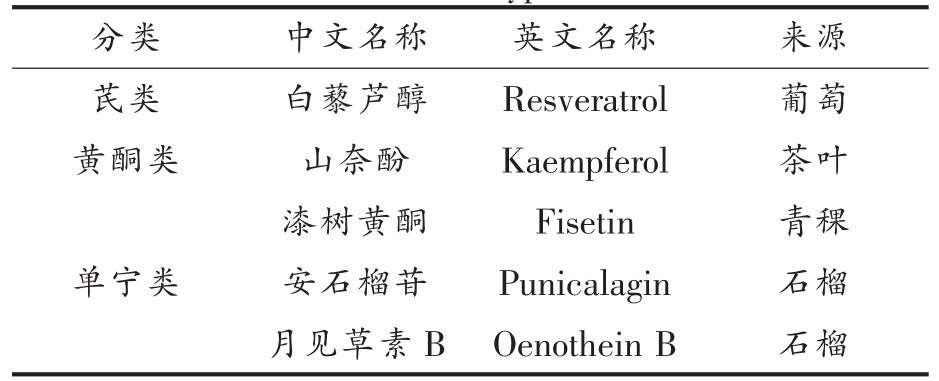
白藜芦醇、山奈酚、安石榴苷、漆树黄酮和月见草素B 的来源见表1,化学结构参照Ito 等[15]的研究结果。
表1 多酚类化合物
Table 1 Polyphenols
?
人结直肠腺癌细胞(Caco-2)、人正常皮肤永生化角质形成细胞(HaCaT),日本理研生物资源中心(筑波,日本);4 孔板细胞培养皿、0.4 μm 高密度半透明PET 膜,美国Corning 公司;DMEM 培养基,日本Nissui 公司;0.25%胰蛋白酶消化液、胎牛血清,美国Life Technologies 公司;总RNA 提取试剂盒,日本Roche 公司;pEGFP-C3 荧光蛋白报告系统,日本Takara 公司;慢病毒表达质粒pSUPER.retro.puro,美国OligoEngine 公司;HilyMax 转染试剂,日本Dojindo 公司;聚凝胺,美国Merck Millipore 公司;Thunderbird SYBR qPCR Mix 荧光定量PCR 试剂盒,日本Tiyobo 公司;BESH2O2-Ac 过氧化氢荧光探针,日本WAKO 公司。
1.2 仪器与设备
CO2 培养箱,美国Thermo 公司;细胞电阻仪Millicell-ERS-2,美国Millipore 公司;Thermal Cycler Dice Real Time System TP-800 实时荧光定量PCR 仪,日本Takara 公司;IN Cell Analyzer 1000,英国GE Healthcare 公司;CL-1000 紫外交联仪,美国UVP 公司。
1.3 试验方法
1.3.1 Caco-2 细胞的分化 Caco-2 细胞,采用含10%胎牛血清的DMEM 培养基,置于37 ℃、5%CO2 的细胞培养箱中培养。选取培养至3~6 代的处于对数生长期的Caco-2 细胞,接种于细胞培养小室的PET 膜上(AP 侧,Apical side),密度为2×105/mL,体积250 μL,在小室的下侧(BL 侧,Basolateral side)加入750 μL DMEM 完全培养基。每3 d 更换一次培养基,进行Caco-2 细胞的自发分化。空白对照组中AP 侧和BL 侧中加入对应等量的DMEM 完全培养基。
1.3.2 单层Caco-2 细胞跨膜电阻值(TEER)的测定 Caco-2 细胞自发分化后会形成连续的单层细胞。采用细胞电阻仪测定单层Caco-2 细胞的TEER 值。首先将电极放入预热至37 ℃的Hank's平衡盐溶液(Hank's balanced salt solution,HBSS)中平衡20 min。吸走AP 侧和BL 侧的培养基,在AP 侧和BL 侧分别加入500 μL 和1.5 mL 的HBSS 洗涤,重复2 次。吸走HBSS 后,在AP 侧和BL侧分别加入500 μL 和1.5 mL 的HBSS,检测单层细胞两侧的跨膜电阻。空白对照组也按照以上操作,获得空白值。TEER 值(Ω·cm2)=(测定电阻值-空白值)/单层表面积。试验重复3 次。通过测定Caco-2 细胞的TEER 值,可以判断Caco-2 细胞是否形成紧密连续的单层细胞。
1.3.3 Caco-2 细胞与HaCaT 细胞trans-well 共培养体系的建立 HaCaT 细胞,采用含10%胎牛血清的DMEM 培养基,置于37 ℃、5%CO2 的细胞培养箱中培养。将处于对数生长期的HaCaT 细胞接种于24 孔板,每孔细胞数量为1×105,待细胞完全贴壁后,将接种有自发分化形成紧密连续的单层Caco-2 细胞的小室,置于接种有HaCaT 细胞的24 孔板上,即形成Caco-2 细胞与HaCaT 细胞trans-well 共培养体系,AP 侧为Caco-2 细胞,BL侧为HaCaT 细胞。在共培养体系的AP 侧分别加入终浓度为10 μmol/L 的白藜芦醇、山奈酚、安石榴苷、漆树黄酮、月见草素B,对照组中加入等量的DMSO。整个共培养体系在37 ℃、5%CO2 的条件下继续培养48 h,用于下一步试验。
1.3.4 构建HaCaT 细胞SIRT3-EGFP 报告基因系统 HaCaT 细胞SIRT3-EGFP 报告基因系统的构建参考Zhao 等[5]的方法。以人类基因组DNA 为模板,进行PCR 扩增人类SIRT3 启动子(-653--1),将其装入无启动子的pEGFP-C3 表达载体中,得到特定的pSIRT3p-EGFP 质粒。将构建的pSIRT3p-EGFP 质粒转染HaCaT 细胞,用于评价受试物对SIRT3 启动子活性的影响。利用IN Cell Analyzer 1000 监测EGFP 荧光的变化,可定量测定SIRT3 启动子的活性。SIRT3 激活剂筛选系统如文献[6]中的图1所示。试验重复3 次。
1.3.5 HaCaT 细胞SIRT3 基因表达水平的测定 按照总RNA 提取试剂盒说明提取细胞RNA,参照Fujiki 等[16]的方法反转录合成cDNA。以cDNA 为模板,根据Thunderbird SYBR qPCR Mix试剂盒说明进行半定量实时荧光定量聚合酶链式反应 (Quantitative real-time PCR,qRT-PCR),测定细胞SIRT3 基因mRNA 表达水平。β-actin 为内参基因。SIRT3 和β-actin 基因的PCR 引物序列见表2。试验重复3 次。
1.3.6 评价SIRT3 多酚激活剂对UVB 诱导Ha-CaT 细胞产生ROS 的清除作用 Caco-2 细胞培养14 d 后,自发分化形成紧密连续的单层细胞,可以用于下一步试验。第15 天将需要评价的受试物加入含有Caco-2 细胞的AP 侧,培养48 h 后收集BL 侧的培养液,并于-80 ℃保存以备用。
将处于对数生长期的HaCaT 细胞接种于10 mm 细胞培养皿中,每孔的细胞数量为5×105。培养24 h 后,吸出培养基,加入少量磷酸缓冲盐溶液(PBS)覆盖细胞,利用紫外交联仪对细胞进行紫外线处理,照射剂量为8 mJ/cm2。24 h 后,使用0.25%胰蛋白酶消化液消化HaCaT 细胞,将其重新接种于96 孔板,培养6 h 后,吸走培养基,加入之前回收的已解冻预热的Caco-2 细胞培养体系中BL 侧的培养液,培养48 h 后测定HaCaT 细胞内活性氧含量。试验重复3 次。
1.3.7 HaCaT 细胞内活性氧含量的测定 采用过氧化氢特异性荧光探针BES-H2O2-Ac 法测定细胞内活性氧分子 (Reactive oxygen species,ROS)的含量。吸出培养基,用4-羟乙基哌嗪乙磺酸【4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid,HEPES,pH=7.4】缓冲液洗涤细胞2 次,然后加入终浓度为5 μmol/L 的BES-H2O2-Ac 和Hoechst 33342 染料,37 ℃培养箱内孵育30 min。消化并收集细胞,HEPES 润洗2 次后用显微细胞图像分析测定系统IN Cell Analyzer 1000 进行检测。
1.3.8 shSIRT3-HaCaT 细胞模型的构建 shSIRT3-HaCaT 细胞模型按照先前建立的方法[17]构建。设计靶向SIRT3 基因特异性短发夹RNA(shRNA)表达的引物序列 (表2) 并连接到慢病毒表达质粒pSUPER.retro.puro 中,成功构建慢病毒重组表达质粒pSUPER-puro-shSIRT3。使用HilyMax 转染试剂将pGag-pol,pVSV-G 质粒以及构建的重组表达质粒pSUPER-puro-shSIRT3 共转染293T 细胞后,细胞在含10%胎牛血清的DMEM 培养基中,置于37 ℃、5%CO2 细胞培养箱中培养24 h 之后,弃去旧培养基,用含2%胎牛血清的DMEM 培养基继续培养24 h。收集病毒上清液,并添加10 mg/mL 聚凝胺,用于感染HaCaT 细胞。24 h 后,在HaCaT 细胞中添加3 μg/mL 嘌呤霉素,处理3 d,筛选得到pSUPER-puro-shSIRT3 稳转HaCaT 细胞系。
表2 引物序列
Table 2 Primer sequences

?
1.4 数据统计分析
试验数据采用软件SPSS 19.0 进行统计学分析,组间比较采用单因素ANOVA 方差分析,Turkey 法进行事后检验,结果以“平均数±标准差”表示,以P<0.05 为差异有统计学意义。
2 结果与分析
2.1 单层Caco-2 细胞跨膜电阻值的测定结果
Caco-2 细胞可在体外培养条件下自发进行上皮样分化,并且形成紧密连接的单层。TEER 值用于评价单层Caco-2 细胞是否形成了致密的紧密连接。本试验分别测定了Caco-2 细胞在体外培养3 d 及14 d 时的TEER 值,结果如图1所示。Caco-2 细胞在体外培养14 d 时,TEER 值显著高于培养3 d 时细胞的TEER 值,且其远远大于500 Ω·cm2,表明单层Caco-2 细胞具有足够的紧密连接和完整性[18-19]。因此,选择在Caco-2 细胞培养14 d 时,建立Caco-2 和HaCaT 细胞共培养体系。
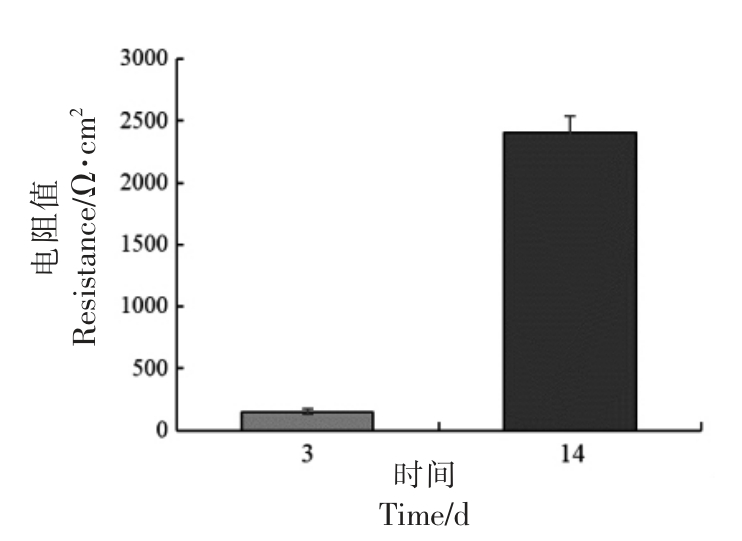
图1 培养时间对Caco-2 细胞跨膜电阻值的影响
Fig.1 Effects of culture time on trans-epithelial resistance of Caco-2 cells
2.2 多酚类化合物对HaCaT 细胞SIRT3 表达的影响
构建HaCaT 细胞SIRT3-EGFP 报告基因系统,在Caco-2 和HaCaT 细胞共培养体系(图2)中分别评价了白藜芦醇(Resveratrol,RSV)、山奈酚(Kaempferol)、安石榴苷(Punicalagin)、漆树黄酮(Fisetin)、月见草素B(Oenothein B)这5 种多酚类化合物在干预Caco-2 细胞后,对HaCaT 细胞SIRT3 表达的影响,结果如图3、图4所示。利用IN Cell Analyzer 1000 对细胞内EGFP 荧光定量分析结果显示,在多酚类化合物的干预下,HaCaT细胞内EGFP 荧光强度相比于对照组 (DMSO)均显著增强。利用qRT-PCR 技术进一步检测HaCaT细胞内源性SIRT3 基因mRNA 表达水平的结果显示,白藜芦醇、山奈酚、月见草素B 显著上调了该基因的表达水平,而安石榴苷与漆树黄酮没有显著影响。上述研究结果表明,白藜芦醇、山奈酚、月见草素B 可以间接增强HaCaT 细胞SIRT3 基因的表达。
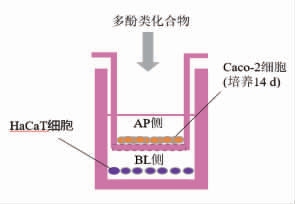
图2 Caco-2 与HaCaT 细胞trans-well 共培养体系
Fig.2 Trans-well co-culture system of Caco-2 and HaCaT cells
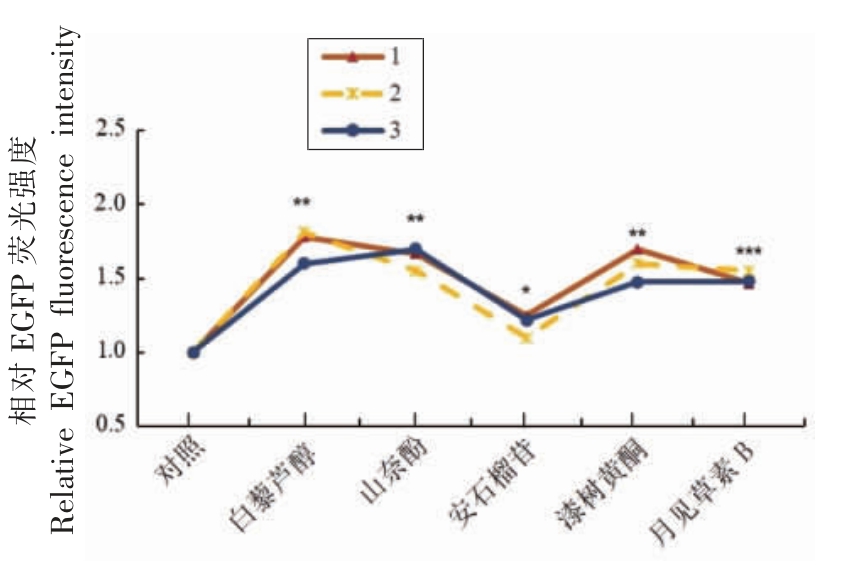
图3 多酚类化合物对EGFP 荧光强度的影响
Fig.3 Effects of polyphenols on EGFP fluorescence intensity
注:*.与对照组相比较,P <0.05;**.与对照组相比较,P <0.01;***.与对照组相比较,P <0.001。
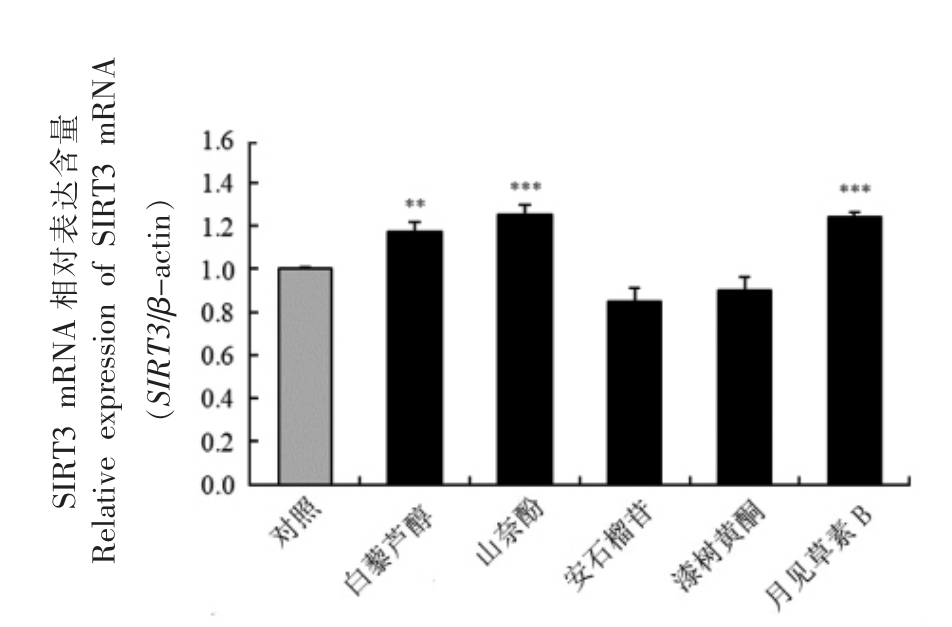
图4 多酚类化合物对SIRT3 mRNA 表达水平的影响
Fig.4 Effects of polyphenols on SIRT3 mRNA expression
注:**.与对照组相比较,P <0.01;***.与对照组相比较,P <0.001。
2.3 SIRT3 多酚激活剂对UVB 诱导HaCaT 细胞产生ROS 的清除作用
在共培养体系中,本文进一步评价了能够激活SIRT3 表达的3 种多酚类化合物对UVB 诱导的HaCaT 细胞内ROS 的清除作用。如图5所示,在UVB 照射条件下,HaCaT 细胞内ROS 的含量显著增加(P<0.01),提示HaCaT 细胞在UVB 照射下发生了氧化应激;白藜芦醇、山奈酚、月见草素B 在Non-UVB 条件下对细胞内ROS 的产生没有显著影响;而在UVB 照射条件下,月见草素B 极显著地降低了HaCaT 细胞内ROS 水平;白藜芦醇和山奈酚并未显著清除UVB 诱导的过量ROS 的产生。综上所述,在Caco-2 和HaCaT 细胞共培养体系下,月见草素B 具有降低UVB 诱导的HaCaT细胞氧化应激的作用。
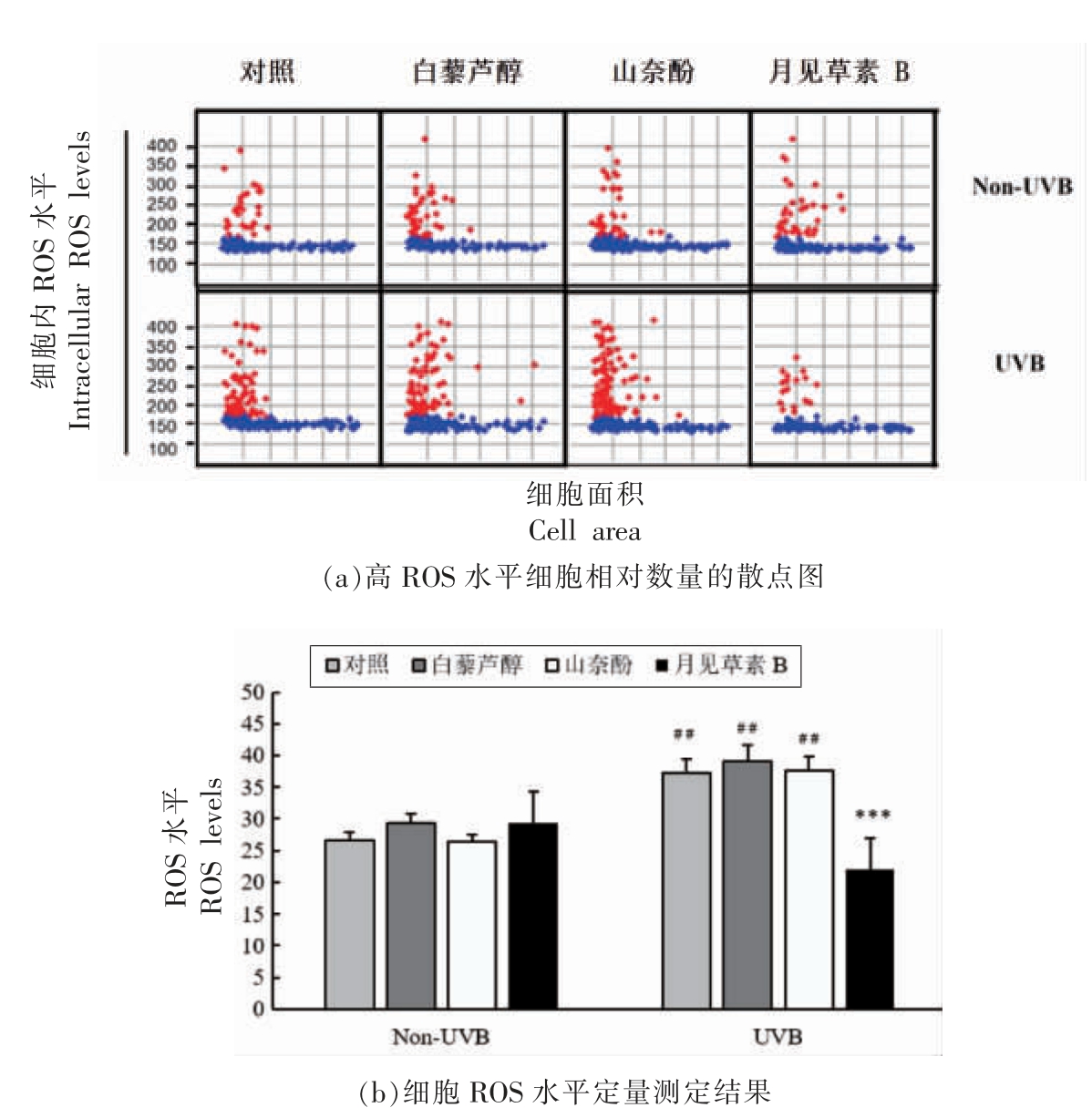
图5 具有激活SIRT3 转录作用的多酚类化合物对Non-UVB 及UVB 照射下细胞内ROS 含量的影响
Fig.5 Effects of polyphenols with SIRT3 activation activity on intracellular ROS levels induced by Non-UVB exposure and UVB exposure
注:***.与UVB-对照组相比较,P<0.001;##.与Non-UVB-对照组相比较,P<0.01。
2.4 SIRT3 介导月见草素B 调控HaCaT 细胞氧化应激水平
为了进一步验证月见草素B 清除HaCaT 细胞中UVB 诱导的ROS 是否依赖于SIRT3,本试验按照1.3.8 节的方法建立了HaCaT 细胞SIRT3 基因沉默模型,并按照1.3.6 节的方法评价了月见草素B 对Mock-HaCaT 细胞以及shSIRT3-HaCaT细胞中UVB 诱导产生的ROS 的清除作用。结果如图6所示。在Mock-HaCaT 细胞中,月见草素B对UVB 诱导的ROS 具有显著的清除作用,ROS水平比DMSO 处理组降低了14%;当SIRT3 基因沉默后,月见草素B 不再有效地抑制ROS 的产生。由此可见,月见草素B 对细胞内ROS 的清除作用具有SIRT3 依赖性。
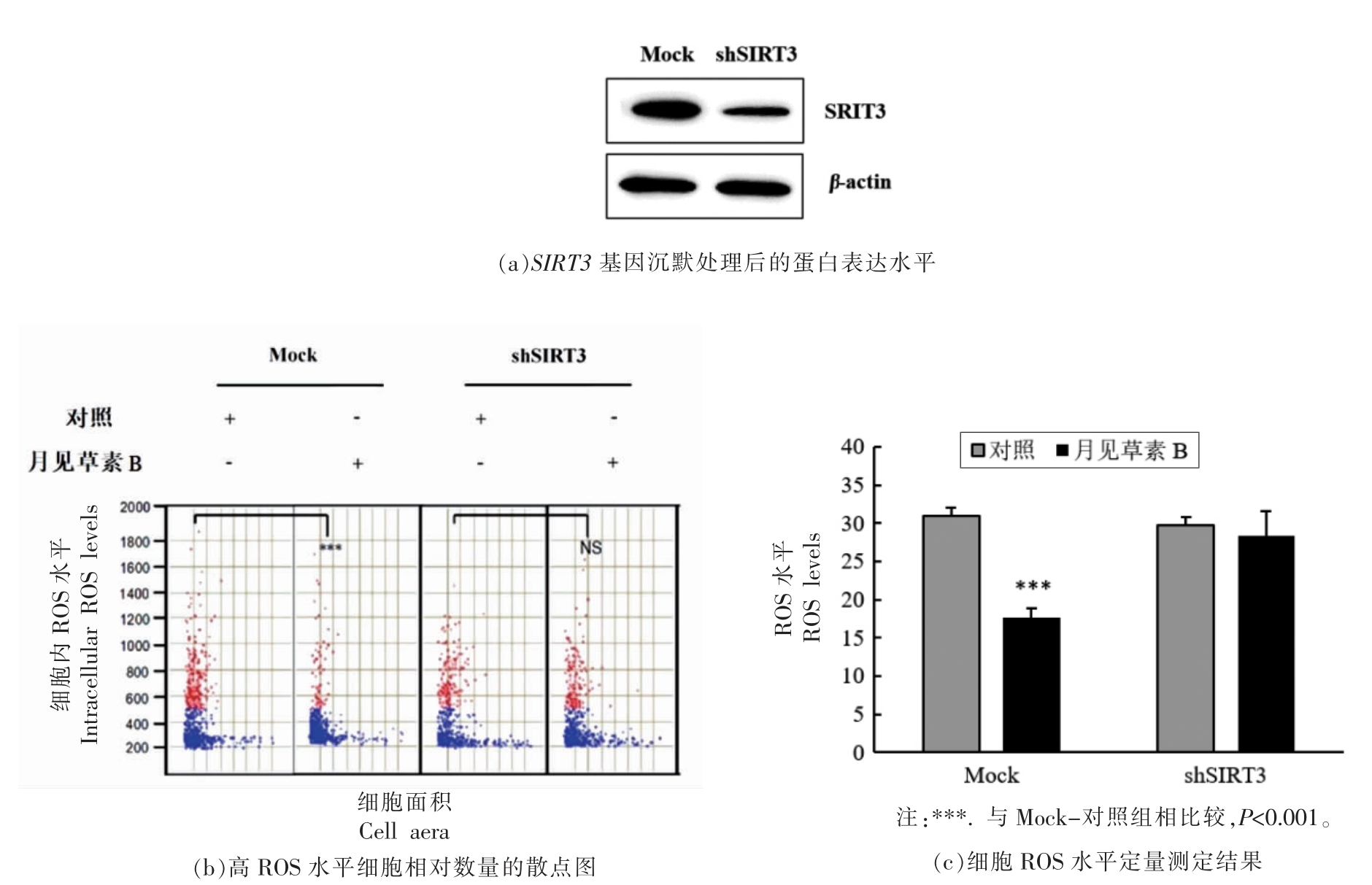
图6 月见草素B 对UVB 照射条件下的Mock 和SIRT3 基因沉默(shSIRT3)HaCaT 细胞内ROS 水平的影响
Fig.6 Effects of oenothein B on intracellular ROS levels in UVB-irradiated Mock-and SIRT3-silenced (shSIRT3) HaCaT cells
3 讨论
本文构建了HaCaT 细胞SIRT3-EGFP 报告基因系统,在Caco-2 细胞及HaCaT 细胞共培养体系中,评价了白藜芦醇、山奈酚、安石榴苷、漆树黄酮、月见草素B 这5 种多酚类化合物在肠道吸收后对HaCaT 细胞SIRT3 表达的影响,以及对UVB诱导的HaCaT 细胞氧化应激的抑制作用。研究发现,在Caco-2 与HaCaT 细胞共培养体系下,月见草素B 降低了HaCaT 细胞氧化应激水平,SIRT3介导了其对ROS 的调控。
在前期研究发现白藜芦醇、山奈酚、安石榴苷、漆树黄酮均能够在激活HaCaT 细胞中SIRT3的表达。为了进一步探究几种多酚化合物在经过肠道吸收后,对HaCaT 细胞的影响,构建了Caco-2 与HaCaT 细胞共培养体系。结果表明,白藜芦醇、山奈酚、安石榴苷、漆树黄酮以及月见草素B均能显著增强HaCaT 细胞外源性SIRT3 的表达。内源性SIRT3 mRNA 表达结果表明,安石榴苷在共培养体系下并不能激活HaCaT 细胞的SIRT3基因的转录表达。前期研究发现,当安石榴苷作用于单独培养的HaCaT 细胞时,它可以显著激活HaCaT 细胞SIRT3 基因的表达[6];当它作用于单独培养的Caco-2 细胞时,并没有影响其SIRT3 基因的转录活性[5]。P-糖蛋白是一种跨膜转运糖蛋白,主要分布于细胞质膜上,是主要的外排转运蛋白,也是耐药形成的重要因素[20-21]。多项研究报道安石榴苷是P-糖蛋白的底物,P-糖蛋白参与了安石榴苷的转运过程[22-24]。由此推测,上述原因可能导致了Caco-2 细胞对安石榴苷的吸收率低下,进一步影响HaCaT 细胞中SIRT3 的表达。白藜芦醇、山奈酚、漆树黄酮作用于单独培养的Caco-2 细胞与HaCaT 细胞均能显著增强两种细胞SIRT3 的表达[5-6],然而在共培养体系下,白藜芦醇和山奈酚表现出显著的SIRT3 激活作用,漆树黄酮并未激活SIRT3 的表达。漆树黄酮与山奈酚均属于黄酮醇类化合物,也是同分异构体,二者的差别在于山奈酚的A 环C5 位上多了一个羟基,而漆树黄酮的B环C5' 位上多了一个羟基。结构差异可能导致其渗透性以及通过细胞单层所需要的共轭结合力的差异,从而导致漆树黄酮的作用效果不显著,而山奈酚却具有良好的效果[25-26]。
综合上述结果可知,本文共筛选得到3 种多酚(白藜芦醇、山奈酚以及月见草素B),可增强共培养体系下HaCaT 细胞的SIRT3 基因表达。SIRT3 是去乙酰化酶(Sirtuin)家族中的一员,主要位于线粒体中,可以发挥去乙酰化活性,调节线粒体的功能、再生和动态,从而维持氧化还原稳态,以防止细胞代谢过程中发生的氧化应激[27-28]。在共培养体系中,通过UVB 诱导HaCaT 细胞发生氧化应激,评价了白藜芦醇、山奈酚、月见草素B 对活性氧的清除作用。试验数据表明,月见草素B 显著减少了细胞内ROS 水平。为了进一步验证SIRT3 在月见草素B 改善UVB 诱导的细胞氧化应激中的必要性,本文构建了SIRT3 基因沉默的HaCaT 细胞,结果表明SIRT3 基因表达的沉默显著抑制了月见草素B 对ROS 的清除能力。研究表明,桉叶水提物可显著减少抑制f-MLP(Formylmet-leuphenylalanine)和PMA(4β-phorbol-12βmyristate-α13-acetate) 诱导的人中性粒细胞活性氧的产生,而且很大程度上归因于桉叶水提物中含有的月见草素B[29]。Chen 等[30]发现月见草素B可减少线虫衰老过程中ROS 的累积,并延长其寿命,其主要的作用靶点包括insulin/IGF-1、饮食限制以及线粒体电子传递链等途径上的关键基因。月见草素是一种潜在的高效抗氧化剂,并有助于延缓衰老。本研究发现月见草素B 对UVB 诱导的细胞活性氧也有很好的清除效果,并且为月见草素B 的抗氧化机制提供了新的思路。
综上所述,本文首次发现了月见草素B 在Caco-2 与HaCaT 细胞共培养体系中,增强HaCaT细胞SIRT3 基因的表达,并抑制UVB 引起的Ha-CaT 细胞的氧化应激水平,其抗氧化作用具有SIRT3 依赖性。月见草素B 在单独培养的Caco-2细胞中并没有影响其SIRT3 基因的表达[5]。因此,月见草素B 是通过Caco-2 细胞的吸收、转运后,以原型的方式作用于HaCaT 细胞,还是通过Caco-2 细胞的代谢作用产生的活性物质作用于HaCaT 细胞,尚有待研究。今后可进一步探究月见草素B 在Caco-2 细胞单层模型中的摄取特性、转运机制以及代谢产物的组成。再者,体外模拟肠道吸收的条件与实际情况还存在偏差,因此月见草素B 的体内药动学研究对于优化其生物利用度、发挥其最佳的功效具有重要意义。此外,月见草素B 可能通过影响Caco-2 细胞自身分泌物的改变,而间接影响HaCaT 细胞。研究表明,肌肽是一种SIRT3 的激活剂,可促进Caco-2 细胞分泌可激活神经元SH-SY5Y 细胞的外泌体,并促进外泌体中一种新型miRNA-miR-6769-5p 的表达,从而增强了其靶基因ATXN1 的表达,激活SH-SY5Y 细胞[31]。多项研究发现靶向调节SIRT3 的miRNA 有很 多,如miRNA-31、miRNA-1、miRNA-19b 和miRNA-320 等[32-33]。因此,从miRNA 层面深入探究在Caco-2 与HaCaT 细胞共培养体系下,月见草素B 依赖SIRT3 发挥抗氧化作用的分子机制是个潜在的研究方向。本文的研究为月见草B 作为食品功能因子的开发提供了理论依据。
[1]左丹,廖霞,李瑶,等.基于肠道吸收机制的膳食多酚代谢研究进展[J].食品科学,2017,38(7):266-271.
ZUO D,LIAO X,LI Y,et al.Progress in research on dietary polyphenols metabolism based on a mechanism involving intestinal absorption[J].Food Science,2017,38(7):266-271.
[2]CHERUBIM D J,MARTINS C V,FARIÑA L,et al.Polyphenols as natural antioxidants in cosmetics applications[J].Journal of Cosmetic Dermatology,2019,19(1):33-37.
[3]GÜNES B A,AKSOY A N,KOÇYI˙ I˙T A.The Importance of polyphenols as functional food in Health[J].Bezmialem Science,2019,7(2):157-163.
I˙T A.The Importance of polyphenols as functional food in Health[J].Bezmialem Science,2019,7(2):157-163.
[4]YANG J,DWYER J T,PETERSON J J.Polyphe nols in foods[J].Nutrition Today,2016,51(6):290-300.
[5]ZHAO C,SAKAGUCHI T,FUJITA K,et al.Pomegranate-derived polyphenols reduce reactive oxygen species production via SIRT3-mediated SOD2 activation[J].Oxidative Medicine and Cellular Longevity,2016,2016:1-9.
[6]陈慧,KATAKURA Y,扈洪波,等.SIRT3 多酚激活剂的筛选及其对UVB 诱导皮肤细胞衰老的修复作用[J].食品科学,2020,42(5):115-121.
CHEN H,KATAKURA Y,HU H B,et al.Antiaging effects of SIRT3-augmenting polyphenols on UVB-irradiated HaCaT cells[J].Food Science,2020,42(5):115-121.
[7]段云峰,金锋.肠道微生物与皮肤疾病-肠-脑-皮轴研究进展[J].科学通报,2017,62(5):360-371.
DUAN Y F,JIN F.Gut microbes and skin disease,gut-brain-skin axis:A review (in Chinese)[J].Chinese Science Bulletin,2017,62(5):360-371.
[8]DOHIL M.The skin-gut connection[J].Australasian Journal of Dermatology,2012,53(4):A8.
[9]ARTURSSON P,PALM K,LUTHMAN K.Caco-2 monolayers in experimental and theoretical predictions of drug transport[J].Advanced Drug Delivery Reviews,2012,64:280-289.
[10]黄海智,陈健乐,程焕,等.Caco-2 细胞模型预测活性物质吸收代谢的研究进展[J].中国食品学报,2015,15(1):164-172.
HUANG H Z,CHEN J L,CHENG H,et al.Research progress of Caco-2 models in absorption and metabolism of active substance[J].Journal of Chinese Institute of Food Science and Technology,2015,15(1):164-172.
[11]FEARN R A,HIRST B H.Predicting oral drug absorption and hepatobiliary clearance:Human intestinal and hepatic in vitro cell models[J].Environmental Toxicology and Pharmacology,2006,21 (2):168-178.
[12]沈凯,王景田.药物肠吸收实验研究方法进展[J].中国新药杂志,2003,12(12):988-991.
SHEN K,WANG J T.Progress in experimental methods for study of drugs' intestinal absorption[J].Chinese Journal of New Drugs,2003,12 (12):988-991.
[13]LAURIE O,RYAN L,O'BRIEN N.Comparison of the uptake and secretion of carotene and xanthophyll carotenoids by Caco-2 intestinal cells[J].Comparison of the uptake and secretion of carotene and xanthophyll carotenoids by Caco-2 intestinal cells,2008,98(1):38-44.
[14]YI W,AKOH C C,FISCHER J,et al.Absorption of anthocyanins from blueberry extracts by Caco-2 human intestinal cell monolayers[J].Journal of Agricultural and Food Chemistry,2006,54(15):5651-5658.
[15]ITO H,LI P,KOREISHI M,et al.Ellagitannin oligomers and a neolignan from pomegranate arils and their inhibitory effects on the formation of advanced glycation end products[J].Food Chemistry,2014,152:323-330.
[16]FUJIKI T,MIURA T,MAURA M,et al.TAK1 represses transcription of the human telomerase reverse transcriptase gene [J].Oncogene,2007,26(36):5258-5266.
[17]ZHAO C,HARUKA M,SHIORI O,et al.Identification of polyphenols that repair the ultraviolet-Binduced DNA damage via SIRT1-dependent XPC/XPA activation[J].Journal of Functional Foods,2019,54:119-127.
[18]杨秀伟,杨晓达,王莹,等.中药化学成分肠吸收研究中Caco-2 细胞模型和标准操作规程的建立[J].中西医结合学报,2007,5(6):634-641.
YANG X W,YANG X D,WANG Y,et al.Establishment of Caco-2 cell monolayer model and standard operation procedure for assessing intestinal absorption of chemical components of traditional Chinese medicine[J].Journal of Integrative Medicine,2007,5(6):634-641.
[19]陈锐,丁国芳,杨最素,等.鳕鱼皮胶原蛋白肽在Caco-2 细胞单层模型中的吸收机制[J].食品科学,2018,39(19):154-161.
CHEN R,DING G F,YANG Z S,et al.Absorption mechanism of cod skin collagen peptide in Caco-2 cell monolayer model[J].Food Science,2018,39(19):154-161.
[20]BAJAJ G,RODRIGUEZ-PROTEAU R,VENKATARAMAN A,et al.MDR1 function is sensitive to the phosphorylation state of myosin regulatory light chain[J].Biochemical and Biophysical Research Communications,2010,398(1):7-12.
[21]ELMELIEGY M,VOURVAHIS M,GUO C,et al.Effect of P-glycoprotein (P-gp) inducers on exposure of P-gp substrates:Review of clinical drug-drug interaction studies[J].Clinical Pharmacokinetics,2020,59(6):699-714.
[22]谢莉,田莉,高晓黎.安石榴苷在Caco-2 细胞的摄取特性研究[J].中国中医药信息杂志,2015,22(11):79-82.
XIE L,TIAN L,GAO X L,et al.Uptake property study on punicalagin in Caco-2 cells[J].Chinese Journal of Information on Traditional Chinese Medicine,2015,22(11):79-82.
[23]周本宏,李旷宇,姜姗,等.安石榴苷在Caco-2 细胞模型的肠吸收机制[J].中国现代中药,2019,21(3):316-322.
ZHOU B H,LI K Y,JIANG S,et al.Transport mechanism of punicalagin based on human intestinal Caco-2 cells[J].Modern Chinese Medicine,2019,21(3):316-322.
[24]周本宏,张红盼,郭咸希,等.安石榴苷在MDCK细胞单层模型上的转运机制研究[J].中国药师,2018,21(1):1-5.
ZHOU B H,ZHANG H P,GUO X X,et al.Study on the transport mechanism of punicalagin in MDCK cells monolayer model[J].China Pharmacist,2018,21(1):1-5.
[25]BARRINGTON R,WILLIAMSON G,BENNETT R N,et al.Absorption,conjugation and efflux of the flavonoids,kaempferol and galangin,using the intestinal CaCo-2/TC7 cell model[J].Journal of functional foods,2009,1(1):74-87.
[26]TIAN X,YANG X,YANG X,et al.Studies of intestinal permeability of 36 flavonoids using Caco-2 cell monolayer model [J].International Journal of Pharmaceutics,2009,367(1/2):58-64.
[27]ANSARI A,RAHMAN M S,SAHA S K,et al.Function of the SIRT3 mitochondrial deacetylase in cellular physiology,cancer,and neurodegenerative disease[J].Aging Cell,2017,16(1):4-16.
[28]ALEXANDRA S B,MARCIA C H.SIRT3 regulation of mitochondrial oxidative stress[J].Experimental Gerontology,2013,48(7):634-639.
[29]KISS A K,BAZYLKO A,FILIPEK A,et al.Oenothein B' s contribution to the anti-inflammatory and antioxidant activity of Epilobium sp[J].Phytomedicine,2011,18(7):557-560.
[30]CHEN Y,ONKEN B,CHEN H,et al.Healthy lifespan extension mediated by oenothein B isolated from Eucalyptus grandis × Eucalyptus urophylla GL9 in Caenorhabditis elegans[J].Food & Function,2020,11(3):2439-2450.
[31]SUGIHARA Y,ONOUE S,TASHIRO K,et al.Carnosine induces intestinal cells to secrete exosomes that activate neuronal cells[J].PLoS ONE,2019,14(5):e217394.
[32]KAO Y,CHOU C,YEH L,et al.MicroRNA miR-31 targets SIRT3 to disrupt mitochondrial activity and increase oxidative stress in oral carcinoma[J].Cancer Letters,2019,456:40-48.
[33]LIU J,CHEN S,BISWAS S,et al.Glucose-induced oxidative stress and accelerated aging in endothelial cells are mediated by the depletion of mitochondrial SIRTs[J].Physiological Reports,2020,8(3):e14331.