乳酸菌细菌素是乳酸菌为适应生长条件或环境变化,由核糖体合成后经加工修饰的具有抑菌活性的蛋白质或多肽[1],因其可被人胃肠道蛋白酶降解,且具有无抗药性、安全、无毒、无残留等优良特性,而成为益生菌活性代谢产物研究与开发的热点[2]。受到培养条件、细菌生长期及自身调控系统的影响,乳酸菌细菌素的产生水平往往很低,严重制约了其工业化生产及应用[3-5]。目前已工业化应用的细菌素仅有乳酸链球菌素[6](Nisin)和片球菌素[7](Pediocin) PA-1。
目前可用于提高乳酸菌细菌素产量的方法有优化培养基及发酵条件,高效表达合成相关基因,添加诱导物或施加环境条件刺激等[3]。采用发酵条件优化来提高细菌素产量的效果有限,而且所使用的大部分培养基成本不够经济;利用基因工程技术构建的乳酸菌细菌素异源表达系统[4-5]可能会出现细菌素活性低和安全性有待验证等问题;添加诱导物或施加环境条件刺激可利用诱导调控和胁迫应答提高细菌素产量,不涉及安全性问题且成本低廉,被认为是最有应用前景的技术手段[3]。有研究发现,添加外源特定微生物共培养可以作为环境条件刺激乳酸菌细菌素的生物合成[8]。如在植物乳杆菌(Lactobacillus plantarum)NC8 [9]、J23[10]、嗜酸乳杆菌N2[11]等菌株代谢产细菌素的研究中,均发现存在外源微生物可通过共培养促进产细菌素菌株生长并诱导细菌素高效合成,而且这些外源微生物具有一定的特异性[12]。
植物乳杆菌 (Lactobacillus plantarum)RX-8分离自中国传统泡菜,课题组前期研究发现,该菌株可代谢产生IIb 类细菌素plantaricin EF[13]。有研究报道该细菌素抑菌谱广,加工应用特性良好,有作为天然食品生物防腐剂的巨大潜力[14],然而合成水平较低,使其工业化生产及应用严重受限。为了探索外源微生物共培养作为环境刺激因子诱导菌株RX-8 高效合成plantaricin EF 的可行性,本研究基于菌株RX-8 代谢产细菌素现有常规纯培养条件及其主要合成影响因素,构建低产、不产细菌素纯培养模型评价体系。分别添加不同发酵食品来源(谷物醋、白酒、酸鱼)的16 个菌株进行共培养,通过测定共培养前、后代谢所产细菌素的抑菌活性,筛选最佳共培养诱导菌株及其条件。对比分析诱导菌株在不同处理菌体细胞及发酵上清液的诱导作用,推测起诱导作用的物质类型。研究结果对解析混合发酵体系下细菌素生物合成调控机制,实现植物乳杆菌素的工业化生产应用提供参考依据。
1 材料与方法
1.1 材料与试剂
1.1.1 试验菌株 产细菌素菌株:植物乳杆菌(Lactobacillus plantarum) RX-8,分离自泡菜,保藏于北京工商大学中水楼微生物实验室。
共培养菌株:酿酒酵母(Saccharomyces cerevisiae)Y-47、Y-48、Y-49、Y-50、Y-51 分离自白酒酒曲;枯草芽孢杆菌(Bacillus subtilis)BS-15、BS-77、凝结芽孢杆菌(Bacillus coagulans)BC-29、BC-83 分离自谷物醋醋醅;植物乳杆菌(Lactobacillus plantarum)LP-45、LP-68、发酵乳杆菌(Lactobacillus fermentum)LF-23、LF-33、LF-56、肠膜明串珠菌(Leuconostoc mesenteroides)LF-78、戊糖片球菌(Pediococcus pentosaceus)PP-30 分离自酸鱼;以上菌株均保藏于北京工商大学益生菌活性代谢产物课题组实验室。
指示菌:单核细胞增生李斯特菌 (Listeria monocytogenes)ATCC 35152(4B),美国典型微生物菌种保藏中心。
1.1.2 试剂材料 MRS 肉汤、胰蛋白胨大豆肉汤(TSB)、YPD 培养基,北京陆桥技术有限责任公司;蛋白酶K、牛津杯、硫酸铵、细菌过滤膜(直径0.22 μm),北京半夏生物有限公司;Trans-Well 小室,美国康宁公司;2.5 mol/L HCl、2.5 mol/L NaOH、Na2HPO4-NaH2PO4 缓冲液(pH 7.0)、生理盐水均为分析纯级,天津市福晨化学试剂厂。
1.2 仪器与设备
多功能酶标仪,美国Thermo Electron 公司;UB-7 pH 计,美国DENVER 仪器公司;LDZX-75KB 立式压力灭菌器,上海安申医疗器械厂;TGL-20M 低温离心机,长沙平凡仪器仪表有限公司;Supra 22K 大容量高速冷冻离心机,韩国翰尼(Hanil)公司。
1.3 试验方法
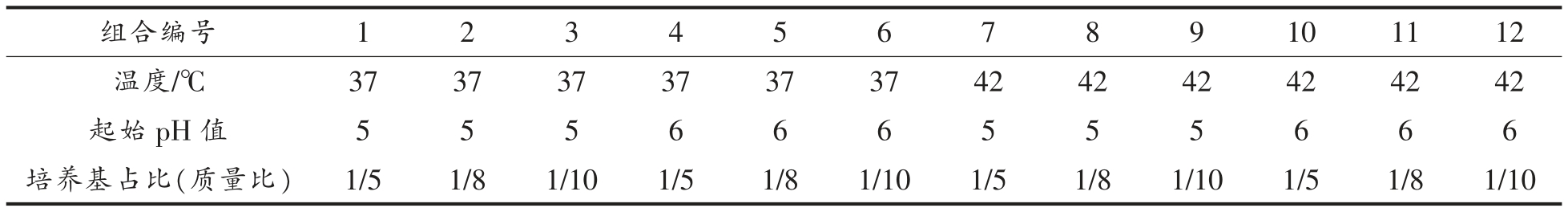
1.3.1 不产和低产细菌素培养模型体系构建 基于前期对植物乳杆菌RX-8 代谢产细菌素培养条件的研究,在接种量(体积分数1%)和培养时间(24 h)不变的条件下,选取3 种对细菌素合成影响显著的因素(培养温度、培养基起始pH 值、培养基浓度)设置以下培养条件。通过对细菌素合成量的测定,确定不产和低产细菌素培养模型体系的培养条件,细菌素的合成量用对指示菌的抑菌圈直径表示。
表1 不产和低产细菌素培养条件设置
Table 1 Setting of non-and low-yield bacteriocin culture conditions
?
1.3.2 可诱导菌株的筛选
1.3.2.1 纯培养与共培养发酵上清液的制备 将植物乳杆菌RX-8 接种至MRS 肉汤培养基,30 ℃培养24 h 后得纯培养发酵液。
将各共培养试验菌株(16 株)从斜面接种到各自的液体培养基中,培养至对数期后以体积分数1%接种量转接一代,期间每隔1 h 测定OD600nm吸光度。连续培养2 代,取第3 代菌株备用。在不产、低产、正常产细菌素的培养模型下,向乳杆菌RX-8 发酵液中加入16 株共培养试验菌株进行共同发酵,接种比例1∶1(体积比),接种密度则根据各自菌体达到稳定初期时的OD 值确定,培养24 h 得共培养发酵液。
将纯培养与共培养发酵液10 000 r/min 离心取上清,用2.5 mol/L NaOH 调整pH 值为6.5。在调好pH 值的发酵上清液中加入溶于磷酸缓冲液的过氧化氢酶,至终质量浓度5 mg/mL,37 ℃水浴2 h 后用0.22 μm 滤膜过滤,得无细胞发酵上清液(Cell-free supernatant,CFS)。
1.3.2.2 细菌素粗提液的制备 采用硫酸铵沉淀法[15]从无细胞发酵上清液中制取纯培养细菌素粗提液。用NaOH 调节CFS 的pH 值至7,再将研磨成粉的硫酸铵缓慢加入,用磁力搅拌器不断搅拌,直到硫酸铵的最终饱和度为80%。置于4 ℃冰箱中静置沉淀过夜,然后12 000 r/min 4 ℃下冷冻离心10 min,收集沉淀。将沉淀复溶于0.02 mol/L 的Na2HPO4-NaH2PO4(pH 7.0)缓冲液中,即为细菌素粗提液。
1.3.2.3 测定不同细菌素粗提液的抑菌活性 取纯培养和共培养细菌素粗提液,通过琼脂扩散法[16]测定其对指示菌单增李斯特菌ATCC 35152 的抑菌圈直径,其中平板在30 ℃下培养6 h,用游标卡尺测量抑菌圈直径,读数精确至0.01 mm。进行3次生物学重复试验,取3 次结果的平均值。在不产、低产、正常产细菌素的培养模型培养条件下,以纯培养下的细菌素EF 粗提液为对照,比较共培养和纯培养条件下所得抑菌圈直径差,抑菌直径差为正数代表有诱导能力,为0 或负数代表无诱导能力。以最大的抑菌直径差下的共培养菌株为最佳诱导菌,相应的培养模型为后续研究所用的培养模型体系。
1.3.3 共培养菌株对细菌素RX-8 的敏感性测试 采用1.3.2.3 方法研究纯培养细菌素粗提液对16 株共培养菌株的抗菌活性。每组处理重复3次,以抑菌圈直径的平均值代表共培养菌株对细菌素EF 的敏感性。
1.3.4 最佳诱导菌诱导能力的验证 使用低产细菌素培养模型的条件,分别纯培养和1∶1 共培养最佳诱导菌和植物乳杆菌RX-8,每隔4 h 取纯培养和共培养下的CFS,制取细菌素粗提液,然后用1.3.2.3 节的方法测定三者对指示菌的抑菌活性。每组处理重复3 次,以抑菌圈直径的平均值为结果。并且每隔4 h 取纯培养和共培养条件下的发酵液,进行梯度稀释后,平板计数和测定OD600nm 的吸光度。
1.3.5 确定最佳诱导菌与RX-8 的最佳接种比例和初始接种浓度 为确定枯草芽孢杆菌BS-15 和植物乳杆菌RX-8 的最佳接种比例,分别采用1∶1,10∶1,1∶10 (枯草芽孢杆菌BS-15∶植物乳杆菌RX-8,体积比)这3 种比例接种培养,测定共培养发酵上清液的抑菌活性。
制备不同菌体密度的乳杆菌RX-8 和枯草芽孢杆菌BS-15:分别将2 株菌活化2 代,从0~24 h,每隔3 h 取第3 代菌株的发酵液,进行梯度稀释后平板计数并测定OD600nm 的吸光度,确定菌体密度与吸光度的变化关系。通过吸光度进而获得不同菌体密度105,106,107,108,109 CFU/mL 的发酵液。在最佳初始接种浓度的基础上,将不同浓度的2 株菌进行组合,测定共培养发酵上清液的抑菌活性。
1.3.6 起诱导作用物质的初步探究 将枯草芽孢杆菌BS-15 进行如下处理:(1) 将枯草芽孢杆菌BS-15 纯培养发酵液10 000 r/min 离心后弃上清,然后用生理盐水清洗3 遍,即得菌悬液;(2)将菌悬液在121 ℃灭活15 min,得灭活菌悬液;(3)用0.22 μm 细菌过滤膜处理发酵上清液,得无菌发酵上清液;(4)在无菌发酵上清中加入2 mg/mL 的蛋白酶K,在pH 8.0 下37 ℃孵育2 h,再于80 ℃加热15 min 灭活酶,即得酶解无菌发酵上清;将上述操作处理所得与植物乳杆菌RX-8 在1.3.5 节所得的最优条件下直接共培养。(5)用Trans-Well分隔两种菌,使二者虽无法直接接触但可以自由交换代谢物质,使两种菌在1.3.5 节所得的最优条件下间接共培养。将培养后的不同处理组菌液离心取上清液,进行抑菌活性检测。
2 结果与分析
2.1 不产和低产细菌素培养体系的建立
分析12 种培养条件组合下细菌素合成的变化情况,如图1所示,不同培养条件下,抑菌圈直径变化差异明显,在组合8 和9 条件下,乳杆菌RX-8 不能代谢产生细菌素;在组合3 条件下,该菌株可代谢产生较低水平的细菌素。根据以上结果,确定低产细菌素培养体系的培养条件为:培养温度37 ℃、培养基起始pH 5、培养基1/10 MRS、接种量1%、培养时间24 h。不产细菌素培养体系的培养条件为:培养温度42 ℃、培养基起始pH 5、培养基1/10 MRS、接种量1%、培养时间24 h。
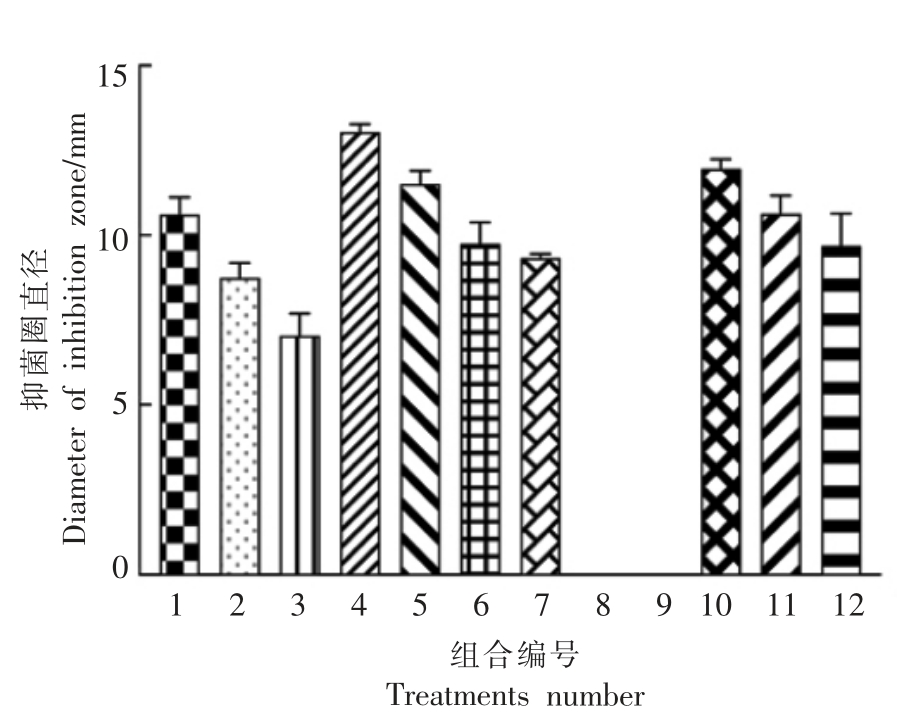
图1 低产和不产细菌素培养体系的建立
Fig.1 The establishment of low-yield and non-bacteriocin-producing culture system
2.2 诱导菌株及共培养体系的确定
在不同产细菌素培养体系下,植物乳杆菌RX-8 与16 株试验菌株共培养后得到的抑菌直径差如表2所示。在不产细菌素培养体系下,只有5株菌能诱导乳杆菌RX-8 产细菌素,然而未实现细菌素产量从不产到正常产,推测是由于这种不产培养体系的营养物质少,不能满足菌体自身营养供给;在低产细菌素培养体系下,有15 株菌促进了乳杆菌RX-8 细菌素的合成,其中枯草芽孢杆菌BS-15 和酿酒酵母菌Y-49 促进效果最为显著,抑菌直径差达到11 mm 以上,使细菌素产量从低产到较高产;而在正常产细菌素培养体系下,虽然16 株试验菌株都有促进效果,但促进效果低于低产培养体系,因此不能作为最佳共培养体系,枯草芽孢杆菌在此体系下促进效果显著,抑菌直径差达10.55 mm。综合以上不同培养体系抑菌直径差的结果,最终选取枯草芽孢杆菌BS-15 为共培养菌株,低产培养体系为共培养的培养条件。
表2 不同产细菌素培养体系下共培养诱导菌株的筛选
Table 2 Screening of co-culture induced strains in different bacteriocin-producing culture systems
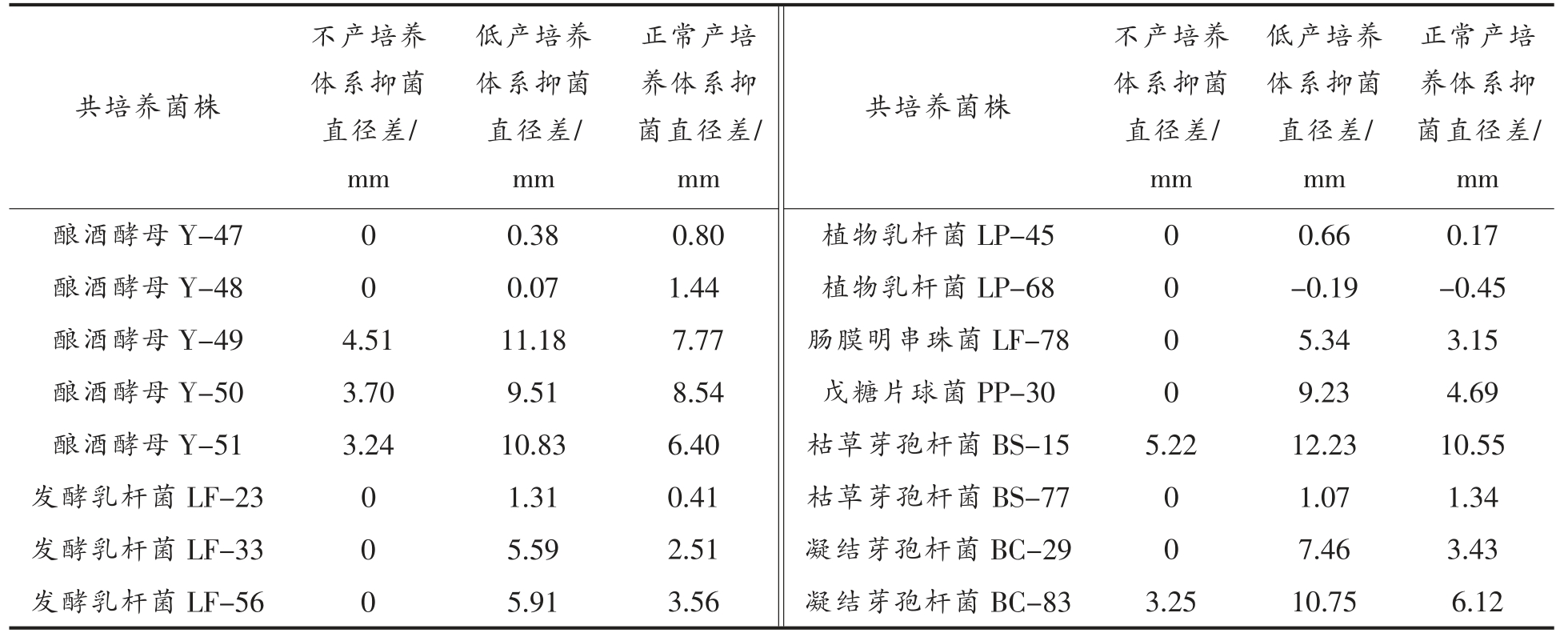
低产培养体系抑菌直径差/mm酿酒酵母Y-47 0 0.38酿酒酵母Y-48 0 0.07酿酒酵母Y-49 4.51 11.18酿酒酵母Y-50 3.70 9.51酿酒酵母Y-51 3.24 10.83发酵乳杆菌LF-23 0 1.31发酵乳杆菌LF-33 0 5.59发酵乳杆菌LF-56 0 5.91共培养菌株不产培养体系抑菌直径差/mm正常产培养体系抑菌直径差/mm 0.80 1.44 7.77 8.54 6.40 0.41 2.51 3.56共培养菌株植物乳杆菌LP-45植物乳杆菌LP-68肠膜明串珠菌LF-78戊糖片球菌PP-30枯草芽孢杆菌BS-15枯草芽孢杆菌BS-77凝结芽孢杆菌BC-29凝结芽孢杆菌BC-83不产培养体系抑菌直径差/mm 0 0 0 0 5.22 0 0 3.25低产培养体系抑菌直径差/mm 0.66-0.19 5.34 9.23 12.23 1.07 7.46 10.75正常产培养体系抑菌直径差/mm 0.17-0.45 3.15 4.69 10.55 1.34 3.43 6.12
2.3 共培养菌株对细菌素EF 的敏感性研
究
如表3所示,细菌素EF 对试验的16 株菌株具有不同程度的抑制作用。其中对2 株酿酒酵母菌(Y-50、Y-51)没有抑制作用;对1 株酿酒酵母菌(Y-49)、1 株发酵乳杆菌(LF-56)、1 株肠膜明串珠菌(LF-78) 和2 株凝结芽孢杆菌 (BC-29、BC-83)有较弱的抑制作用;对细菌素EF 敏感性差的菌株更容易造成环境胁迫,出现强诱导性的可能性更大。对酿酒酵母菌Y-48、植物乳杆菌LP-45、枯草芽孢杆菌BS-77 有明显的抑制作用。只有特定的菌株有敏感性且敏感性强弱各不相同,这与细菌素对不同靶细胞的作用机制不同,以及对同一种细菌素可以通过多种作用机制发挥作用有关[17]。
表3 共培养菌株对细菌素EF 的敏感性研究
Table 3 Study on the sensitivity of co-cultured strains to plantaricin EF

注:-.表示没有敏感性;+++.表示敏感性强;++.表示敏感性较强;+.表示敏感性一般。
?
2.4 最佳诱导菌对指示菌诱导作用的验证结果
枯草芽孢杆菌BS-15 对指示菌有无抑菌活性的检测如图2a 所示,可以看出枯草芽孢杆菌培养液发酵上清对指示菌无抑菌作用,枯草芽孢杆菌BS-15 与植物乳杆菌RX-8 共培养发酵液对指示菌的抑菌活性明显强于乳杆菌RX-8 纯培养发酵液。由此,可以排除诱导菌对抑菌圈直径的干扰。表明枯草芽孢杆菌BS-15 与乳杆菌RX-8 共培养发酵液所提取出的细菌素是plantaricin EF,增加的抑菌圈直径代表着plantaricin EF 的产量增高。
共培养和纯培养过程中,0~32 h 细菌素的合成情况如图2b 所示,4 h 时共培养体系中只产生少量细菌素,而纯培养体系还尚未合成细菌素。两种培养体系下,细菌素的合成量变化趋势大致相同,合成量均在20 h 左右达到稳定,32 h 左右开始减少。当达到稳定期时,共培养体系中细菌素的合成量约是纯培养的3 倍。说明诱导菌不仅可以极大的提高细菌素产量,还可以把开始产细菌素的时间提前。共培养和纯培养过程中,0~32 h 细菌生长情况如图3所示,细菌素合成量的变化趋势和群体密度的变化一致,表明细菌素的产量和细胞数量有关,这或许涉及到群体感应机制。
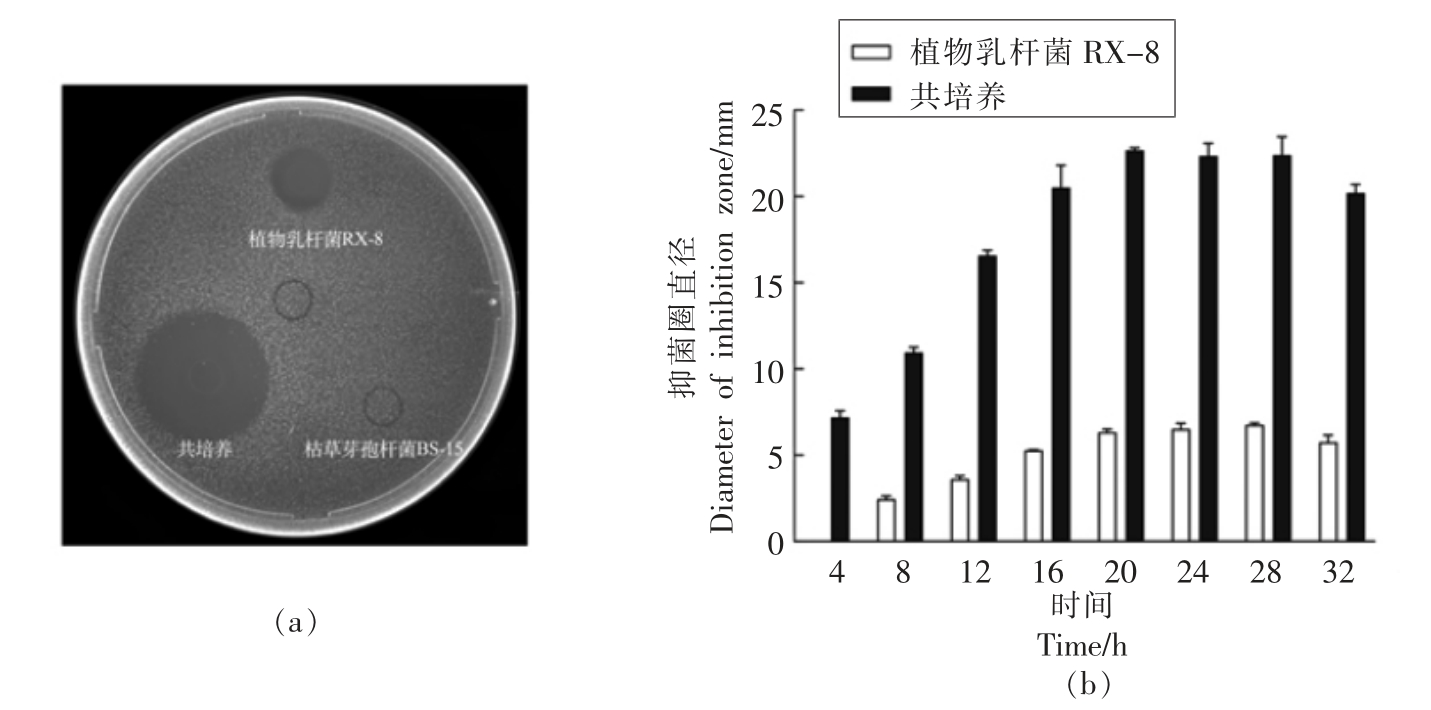
图2 共培养与纯培养过程中细菌素合成量的变化情况
Fig.2 The changes of bacteriocin synthesis in co-culture and mono-culture
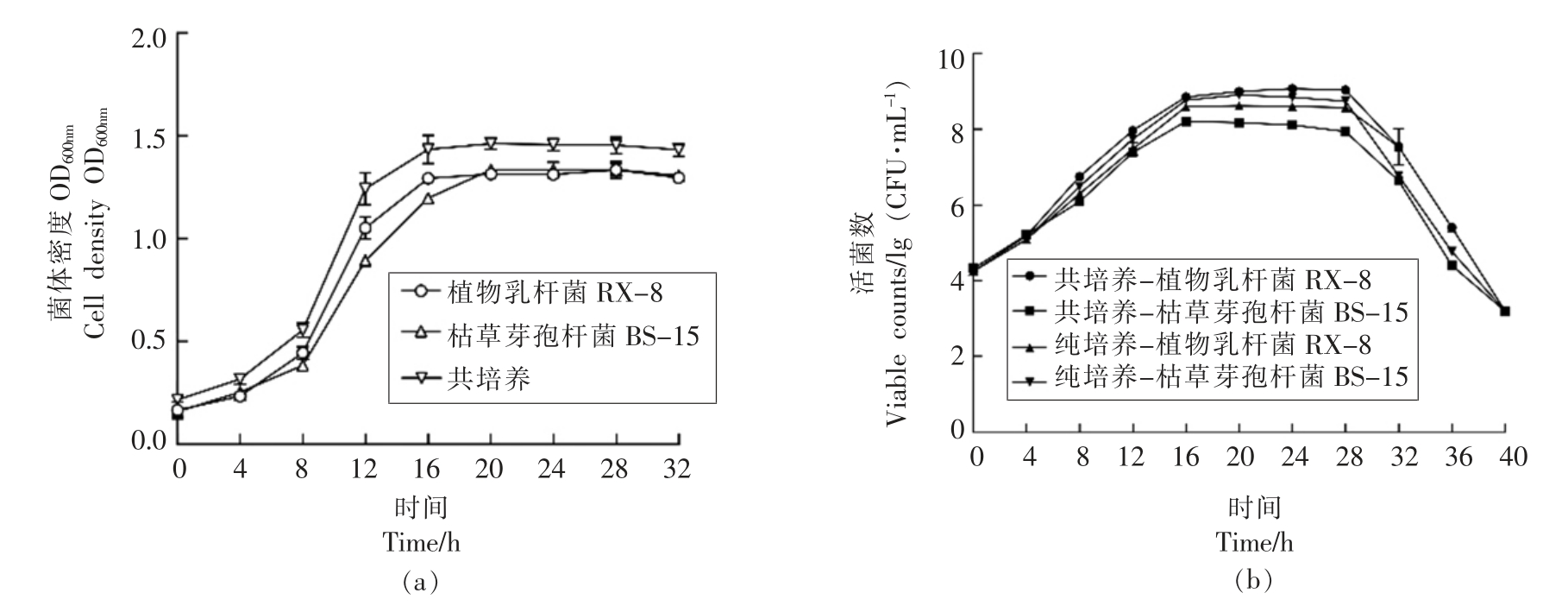
图3 共培养和纯培养条件下菌株的生长情况
Fig.3 The growth of strains in co-culture and mono-culture
2.5 共培养下的最佳接种比例和初始接种浓度
由图4a 可知,不同接种比例对细菌素RX-8的产量影响不大。10∶1 接种比例下,细菌素plantaricin EF 的合成量略高于接种比例为1∶1 和1∶10 的培养体系。图4b 所示,不同浓度的枯草芽孢杆菌无法诱导浓度为105 CFU/mL 的乳杆菌RX-8分泌plantaricin EF;发现乳杆菌RX-8 的接种浓度从106 CFU/mL 起,不同浓度枯草芽孢杆菌共培养后都能诱导其分泌plantaricin EF;枯草芽孢杆菌接种浓度在105~108 CFU/mL 时,诱导乳杆菌RX-8(107,108,109 CFU/mL)所分泌的细菌素量基本一致。在该浓度范围内,细菌素plantaricin EF产量与乳杆菌RX-8 的浓度无关,而与枯草芽孢杆菌BS-15 的浓度有关。而且,乳杆菌RX-8 浓度在105~108 CFU/mL 时,浓度为109 CFU/mL 的枯草芽孢杆菌的诱导效果与108 CFU/mL 的相同,然而乳杆菌RX-8 浓度为109 CFU/mL 时,109 CFU/mL枯草芽孢杆菌BS-15 的诱导效果比浓度为108 CFU/mL 的效果差。最终确定乳杆菌RX-8 初始接种浓度为107 CFU/mL,诱导菌株枯草芽孢杆菌初始接种浓度为108 CFU/mL。
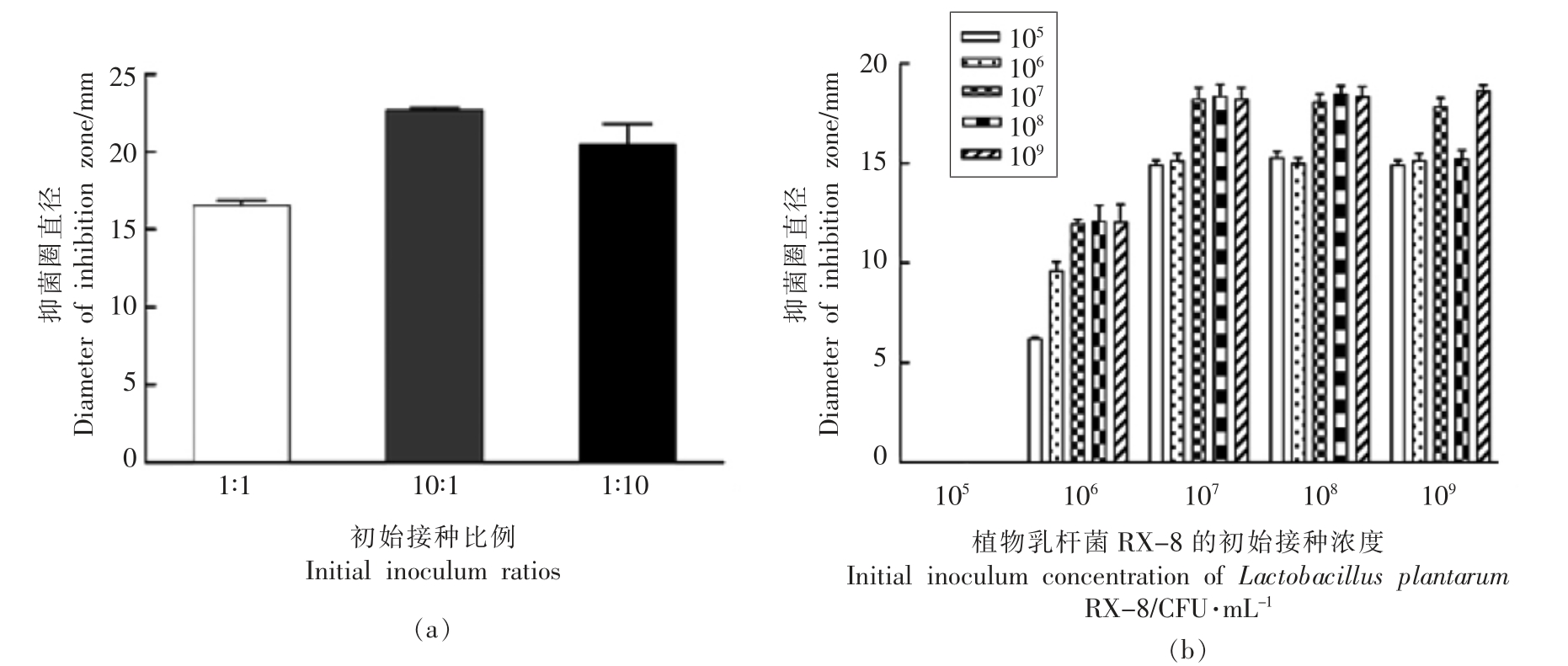
图4 初始接种比例与接种浓度的测定
Fig.4 Determination of initial inoculation ratio and inoculation concentration
2.6 起诱导作用的物质研究
为探明诱导乳杆菌RX-8 合成更多细菌素的物质。试验将枯草芽孢杆菌进行不同处理,再与乳杆菌RX-8 共培养,结果如图5所示。与纯培养乳杆菌RX-8 相比,只有枯草芽孢杆菌的上清液和菌体自身诱导了乳杆菌RX-8 产生细菌素,而蛋白酶和高压高温处理后的芽孢杆菌无诱导作用,说明诱导物质是活细胞产生的蛋白类物质。使用Trans-Well 小室可以使两种菌无法直接接触,然而其分泌的物质可以自由通过,Trans-Well 小室分隔后共培养发酵上清的抑菌能力显著增加。结果表明枯草芽孢杆菌BS-15 可分泌合成一种能起到诱导作用的蛋白类物质。
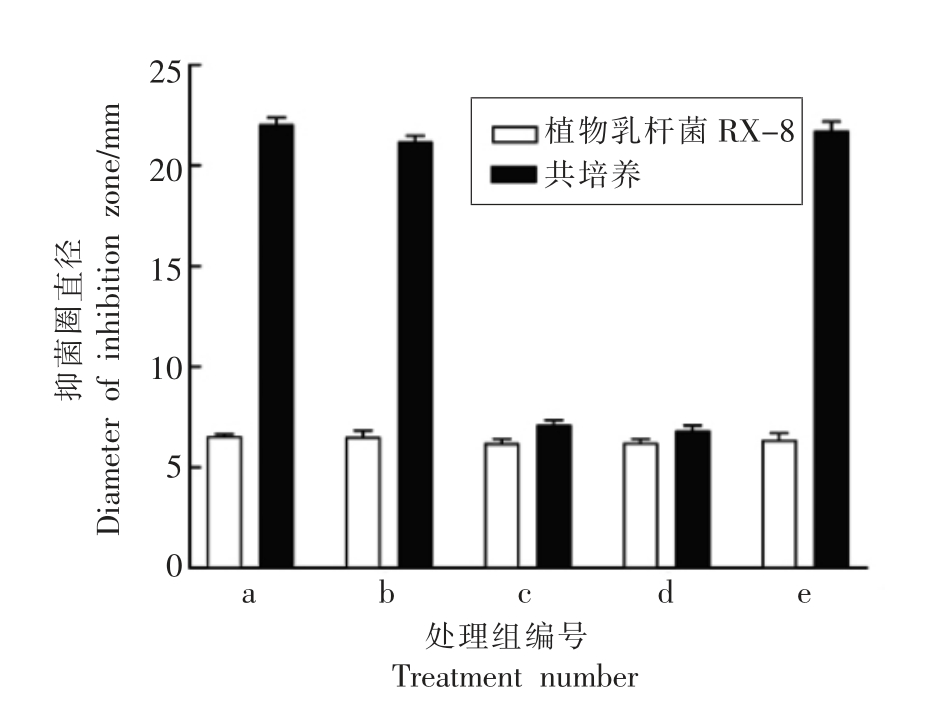
图5 不同处理条件下枯草芽孢杆菌BS-15 的诱导能力检测
Fig.5 Detection of the inducibility of Bacillus subtilis BS-15 under different treatment conditions
3 结论与讨论
3.1 讨论
本研究筛选得到的诱导菌具有高度特异性,并且菌株的诱导性和菌株的亲缘关系无直接相关性,同种菌内不同菌株诱导性的强弱也各不相同。与植物乳杆菌RX-8 亲缘关系远的5 株酿酒酵母中有3 株具有强诱导性,而另外2 株几乎无诱导性。与植物乳杆菌RX-8 亲缘关系近的植物乳杆菌和发酵乳杆菌中部分菌株有较强的诱导性,其它菌株诱导性很弱。之前报道[9-10,18]中具有诱导作用的蜡样芽胞杆菌、枯草芽孢杆菌、戊糖片球菌、肠膜明串球菌也表现出仅有一部分特定菌株有强诱导性;能产L-乳酸的2 株凝结芽孢杆菌都有优良的诱导性。
结合共培养菌株对细菌素RX-8 敏感性来看,发现敏感性强的菌株的诱导性很低,而诱导性低的菌株敏感性不一定很强。酿酒酵母Y-48、植物乳杆菌LP-45、枯草芽孢杆菌BS-77 对细菌素EF 的敏感性强,然而诱导性很弱,推测可能是因为少量细菌素EF 就能很好的抑制这3 株菌,无法对乳杆菌RX-8 造成环境胁迫。酿酒酵母Y-47、发酵乳杆菌LF-23、植物乳杆菌LP-68 的诱导性也很弱,然而它们的敏感性并不强。具有抗性的两株酿酒酵母(Y-50 和Y-51)可以诱导不产、低产和正常产培养模型体系中的细菌素EF 产量增高,表现出强诱导性。可见共培养菌株的敏感性并不是共培养菌株具有诱导性的唯一影响因素。
从16 株菌中筛选得到最佳诱导菌:枯草芽孢杆菌BS-15,对其诱导作用进行验证后,优化其与植物乳杆菌RX-8 的共培养体系的发酵条件。Mellefont 等[19]在乳酸杆菌与其它细菌共培养研究中发现,混合体系中的协同增长作用与菌株的初始浓度有一定关系。本研究在验证过程中,同样探究了不同共培养接种条件对细菌素合成的影响,发现共培养下细菌素plantaricin EF 的合成与菌体密度紧密相关,因此,共培养中接种菌体密度配比尤其重要。试验最终确定枯草芽孢杆菌BS-15和植物乳杆菌RX-8 的接种比例为10∶1,植物乳杆菌RX-8 接种浓度为107 CFU/mL,枯草芽孢杆菌BS-15 接种浓度为108 CFU/mL。并且,课题组前期研究表明纯培养条件下乳杆菌RX-8 合成细菌素的行为受群体感应 (Quorum sensing,QS)系统调控。猜测共培养条件下细菌种属间的群体感应系统参与调控细菌素的合成过程,而luxS 基因是其中的关键基因。从系统发育树上来看,乳酸乳球菌、植物乳杆菌与枯草芽孢杆菌的luxS 基因发育水平均属于硬壁菌门(Firmicutes)[20]。或许,枯草芽孢杆菌BS-15 和植物乳杆菌RX-8 也具有相似的luxS 基因,能够产生相似的AI-2 信号分子,被乳杆菌RX-8 的组氨酸激酶感受器识别,导致细菌素基因转录水平增加,从而提高plantaricin EF的产量。
试验结果表明枯草芽孢杆菌BS-15 产生具有诱导作用的蛋白或多肽类物质。而且已有研究报道,诱导菌产生的蛋白类信号分子能够增强产细菌素菌株生存能力,甚至能增加细菌素产量。Cagno 等[21]将植物乳杆菌DC400 与乳酸菌共培养时,发现植物乳杆菌DC400 本身的信号分子PlnA可以增强或抑制乳酸菌一些蛋白的表达,来增强它自身的生存能力。Maldonado 等[22]在培养植物乳杆菌NC8 时添加外源肽PLNC8IF,发现与加入共培养物一样均促进植物乳杆菌NC8 转录产生细菌素。Tabasco 等[23]在培养嗜酸乳杆菌La-5 时,加入人工合成的成熟肽IP-1800,发现细菌素lactacin B 活性增加。
诱导物质也可能是具有诱导效应的氨基酸,可能对细菌素合成、加工、释放、调控过程中的关键蛋白或酶有诱导作用,比如协助切割信号肽,将成熟的细菌素转运到胞外的ABC 转运蛋白和辅助蛋白;能提高组氨酸蛋白激酶、响应调节蛋白等细菌素调控蛋白的活性;能抑制降解细菌素的酶活性,避免细菌素被分解造成细菌素胞外积累[24]。
这些猜测都需要通过进一步试验证实,本课题组接下来会研究共培养体系下细菌素的合成是否与信号分子的分泌成正相关,探究细菌素产量增加与群体感应系统之间的关系。
3.2 结论
共培养体系下,多种微生物都具有诱导植物乳杆菌RX-8 合成细菌素plantaricin EF 能力提高的作用,其中枯草芽孢杆菌BS-15 的诱导效果最好,且最佳初始接种比例为10∶1,最佳初始接种浓度为107 CFU/mL 乳杆菌RX-8,诱导菌株枯草芽孢杆菌BS-15 为108 CFU/mL。起诱导作用的是枯草芽孢杆菌的蛋白类分泌物。
[1]CHIKINDAS M L,WEEKS R,DRIDER D,et al.Functions and emerging applications of bacteriocins[J].Curr Opin Biotechnol,2018,49:23-28.
[2]COTTER P D,HILL C,ROSS R P.Bacteriocins:Developing innate immunity for food[J].Nat Rev Microbiol,2005,3(10):777-788.
[3]章检明,任璐雅,易华西,等.乳酸菌细菌素的高效表达方法研究[J].中国酿造,2014,33(7):29-33.
ZHANG J M,REN L Y,YI H X,et al.Strategies to increase bacteriocin production by lactic acid bacteria[J].China Brewing,2014,33(7):29-33.
[4]KLOCKE M,MUNDT K,IDLER F,et al.Heterologous expression of enterocin A,a bacteriocin from Enterococcus faecium,fused to a cellulose-binding domain in Escherichia coli results in a functional protein with inhibitory activity against Listeria [J].Appl Microbiol Biotechnol,2005,67(4):532-538.
[5]刘国荣,孙勇,李平兰.Ⅱa 类乳酸菌细菌素的异源表达研究进展[J].食品科学,2012,33(5):323-327.
LIU G Y,SUN Y,LI P L.Research advances in heterologous expression of class IIa bacteriocins from lactic acid bacteria[J].Food Science,2012,33(5):323-327.
[6]GHARSALLAOUI A,OULAHAL N,JOLY C,et al.Nisin as a food preservative:Part 1:Physicochemical properties,antimicrobial activity,and main uses[J].Crit Rev Food Sci Nutr,2016,56(8):1262-1274.
[7]CHEN C M,SEBRANEK J G,DICKSON J S,et al.Combining pediocin (ALTA 2341) with postpackaging thermal pasteurization for control of Listeria monocytogenes on frankfurters[J].J Food Prot,2004,67(9):1855-1865.
[8]LEROUX M,PETERSON S B,MOUGOUS J D.Bacterial danger sensing[J].J Mol Biol,2015,427(23):3744-3753.
[9]MALDONADO A,RUIZ-BARBA J L,JIMENEZDIAZ R.Production of plantaricin NC8 by Lactobacillus plantarum NC8 is induced in the presence of different types of gram-positive bacteria[J].Arch Microbiol,2004,181(1):8-16.
[10]ROJO-BEZARES B,SAENZ Y,NAVARRO L,et al.Coculture-inducible bacteriocin activity of Lactobacillus plantarum strain J23 isolated from grape must[J].Food Microbiol,2007,24(5):482-491.
[11]BAREFOOT S F,CHEN Y R,HUGHES T A,et al.Identification and purification of a protein that induces production of the Lactobacillus acidophilus bacteriocin lactacin B[J].Appl Environ Microbiol,1994,60(10):3522-3528.
[12]贾芳芳,孟祥晨.乳酸菌中共培养诱导细菌素产生机制的研究进展[J].食品安全质量检测学报,2017,8(4):1298-1304.
JIA F F,MENG X C.Research progress of co-culture-inducible bacteriocin production in lactic acid bacteria [J].Journal of Food Safety and Quality,2017,8(4):1298-1304.
[13]李雪.特定微生物共培养对细菌素plantaricin RX-8合成的诱导作用研究[D].北京:北京工商大学,2020.
LI X.Study on the induction of the synthesis of bacteriocin plantaricin RX-8 by co-culture of specific microorganisms[D].Beijing:Beijing Technology and Business University,2020.
[14]HEENEY D D,YAROV-YAROVOY V,MARCO M L.Sensitivity to the two peptide bacteriocin plantaricin EF is dependent on CorC,a membranebound,magnesium/cobalt efflux protein[J].Microbiologyopen,2019,8(11):e827.
[15]刘国荣,王成涛,孙宝国.长寿老人源双歧杆菌BL-8 产细菌素的提纯及其分子特性[J].中国食品学报,2018,18(5):115-121.
LIU G Y,WANG C T,SUN B G.Purification and molecular characteristics of bacteriocin produced by bifidobacterium BL-8 from centenarians' intestine[J].Journal of Chinese Institute of Food Science and Technology,2018,18(5):115-121.
[16]LIU G,LV Y,LI P,et al.Pentocin 31-1,an anti-Listeria bacteriocin produced by Lactobacillus pentosus 31-1 isolated from Xuan-Wei Ham,a traditional China fermented meat product[J].Food Control,2008,19(4):353-359.
[17]王利君,郦萍,付碧石,等.乳酸菌细菌素抗菌作用机制研究进展[J].食品科技,2020,45(1):36-42.
WANG L J,LI P,FU B S,et al.Advances in research on antibacterial mechanism of lactic acid bacteria bacteriocin[J].Food Science and Technology,2020,45(1):36-42.
[18]SPERANDIO V,MELLIES J L,NGUYEN W,et al.Quorum sensing controls expression of the type III secretion gene transcription and protein secretion in enterohemorrhagic and enteropathogenic Escherichia coli[J].Proc Natl Acad Sci U S A,1999,96(26):15196-15201.
[19]MELLEFONT L A,MCMEEKIN T A,ROSS T.Effect of relative inoculum concentration on Listeria monocytogenes growth in co-culture[J].Int J Food Microbiol,2008,121(2):157-168.
[20]LERAT E,MORAN N A.The evolutionary history of quorum-sensing systems in bacteria[J].Mol Biol Evol,2004,21(5):903-913.
[21]DI CAGNO R,DE ANGELIS M,CALASSO M,et al.Quorum sensing in sourdough Lactobacillus plantarum DC400:Induction of plantaricin A (PlnA)under co-cultivation with other lactic acid bacteria and effect of PlnA on bacterial and Caco-2 cells[J].Proteomics,2010,10(11):2175-2190.
[22]MALDONADO A,JIMENEZ-DIAZ R,RUIZ-BARBA J L.Induction of plantaricin production in Lactobacillus plantarum NC8 after coculture with specific gram-positive bacteria is mediated by an autoinduction mechanism[J].J Bacteriol,2004,186(5):1556-1564.
[23]TABASCO R,GARCIA-CAYUELA T,PELAEZ C,et al.Lactobacillus acidophilus La-5 increases lactacin B production when it senses live target bacteria[J].Int J Food Microbiol,2009,132(2/3):109-116.
[24]章检明,张兰威,易华西,等.乳酸菌Ⅱ类细菌素生物合成及其代谢调控策略[J].中国酿造,2019,38(2):1-6.
ZHANG J M,ZHANG L W,YI H X,et al.Biosynthesis and strategies of metabolism regulation for class II bacteriocins produced by lactic acid bacteria[J].China Brewing,2019,38(2):1-6.