骨折是很常见的临床疾病,以愈合无畸形,尽快恢复肢体功能作为骨折治疗的目标。骨折后其完整性一般情况下可完全恢复,然而愈合过程也可能受到例如:骨质疏松、肥胖、糖尿病、血管疾病、感染等因素的影响[1]。临床医学认为如果超过3 个月仍未完全愈合即被称为延迟愈合,超过9个月后且最后3 个月内没有愈合迹象,被称为不愈合。据统计,每年由车祸、运动损伤或工作事故造成的骨折中,有高达10%~15%的患者出现延迟或不愈合的情况[2],需要额外的长期治疗,治疗成本高且对患者的生活质量有很大影响。目前,临床上尚无药物被批准用于治疗骨不连以加速骨折愈合[3]。由于临床上采用的物理疗法和基因疗法价格高昂且有副作用,因此,采用膳食辅助治疗的方法加快患者骨折愈合进程逐渐成为研究热点。
海地瓜属棘皮动物门(Echinodermata)芋参目(Molpadida)的动物,是一种食用性较差的低值海参,主要分布在我国东海、南海,资源丰富且价格低廉,具有巨大的开发潜力[4]。海地瓜体内含有酸性黏多糖、皂苷、胶原蛋白和磷脂型DHA、EPA 等多种活性物质,已证明这些物质具有降血糖,抗肿瘤,降血脂,抗氧化的生理活性[5-8]。中医学认为,海参具有补肾益精的功效,肾主骨生髓[9-10],有关海地瓜对骨折愈合过程的影响尚未见报道。本研究以海地瓜为研究对象,建立右胫开放性骨折模型,研究海地瓜对模型小鼠骨折愈合过程的影响,旨在为海地瓜的深度开发及在骨折愈合方面的应用提供指导,为海地瓜保健食品的开发提供依据。
1 材料与方法
1.1 材料及试剂
1.1.1 材料 海地瓜 (Acaudina molpadioidea)和仿刺参(Apostichopus japonicus),青岛市南山水产市场,二者已经制成干制品。将购得的两种干海参分别清洗后置于胶体磨中粉碎,烘干后得到海参粉,过140 目筛,将细粉置于干燥器中保存待用。用生理盐水配成50 mg/mL 的海参悬浊液用于灌胃。
1.1.2 实验动物 雌性C57BL/6 小鼠,SPF 级别,体重 (20.00±2.5)g,许可证号SCXK (鲁)2014-0007。小鼠饲养温度(23±1)℃,相对湿度约为40%~60%,明暗交替12 h /12 h,整个实验期间允许小鼠自由饮食、饮水。
1.1.3 主要试剂 Aggrecan、Col10α、MMP13 ELISA 测定试剂盒,美国R&D;UNIQ-10 柱式Trizol总RNA 抽提试剂盒、随机引物,上海生工;MMLV 逆转录酶,美国Promega;dNTP Mixture,宝日医生物技术有限公司;SOX9、VEGF 等目的基因引物序列合成自金唯智生物科技有限公司;实验过程所需其它试剂均为国产分析纯级。
1.1.4 仪器与设备 GL-20M 高速冷冻离心机,上海卢湘仪离心机仪器公司;Model 680 型酶标仪,美国Bio-Rad 公司;WGP-300 型隔水式恒温培育箱,上海安亭科学仪器有限公司;BH-2 型显微镜,日本Olympus 公司;Ultra Trurrax T18 basic型高速匀浆机,德国Ika 公司;LightCycler 96Instrument 实时荧光定量PCR 仪,瑞士Roche 公司。
1.2 方法
1.2.1 模型建立与实验设计 70 只健康小鼠适应性饲养1 周后,配制质量分数为4%的水合氯醛用于麻醉,每只小鼠统一在右胫中上1/3 处位置进行胫骨开放性骨折。术后3 d 均需腹腔注射青霉素防止术后感染,将手术后成功的小鼠随机分为3 组:骨折模型组(生理盐水)、仿刺参组(500 mg/kg BW)、海地瓜组(500 mg/kg BW),每组21只。骨折后第1 天立即灌胃受试物,每天1 次,按照10 mL/kg BW 的灌胃体积进行连续干预。每组分别于术后第5,10,21 天取7 只小鼠禁食、不禁水8 h,称重、摘眼球取血,分离血清用于相关指标的测定;取骨痂,快速剔除肌肉和筋膜组织,或固定于中性甲醛中用于组织形态学的测定,或入液氮暂存用于测定相关基因mRNA 的转录水平。
1.2.2 骨痂组织形态学观察 取不同时期小鼠右胫骨痂,剥去附着肌肉筋膜组织后快速放入体积分数为10%的中性甲醛溶液中固定,冲洗掉固定液后再放入质量分数为8%的EDTA 脱钙溶液中,每隔1 周更换1 次脱钙液,脱钙时间为3 周。得到的组织进行常规的石蜡包埋切片,组织厚度为7 μm,H&E 染色观察。
1.2.3 血清生化指标测定 参照ELISA 试剂盒说明书测定血清Aggrecan、Col10α、MMP13 的含量。
1.2.4 qRT-PCR 分析 不同时期骨痂RNA 按照UNIQ-10 柱式Trizol 总RNA 抽提试剂盒说明书进行提取,使用NanoDrop-2000 微量分光光度计测定RNA 纯度和浓度后,取1 μg RNA 样品进行逆转录,采用qRT-PCR 法测定骨痂中不同时期SOX9、Col10α、MMP-13、VEGF、Col1α、ALP、Ihh、Patched、Gli1、Gli2、Smad1、Smad4、Smad5、RUNX2的转录水平。反应体系为25 μL,其中cDNA 样品5 μL,对应基因的上下游引物各0.75 μL,DEPC水6 μL,SYBR 荧光染料12.5 μL。扩增过程:预变性(95 ℃,10 min),变性(95 ℃,15 s),退火(60 ℃,20 s),延伸(72 ℃,30 s),扩增过程共计35 个循环。表1为各个基因的具体引物序列,各目的基因mRNA 表达量以β-actin 作为内参校正。
表1 目的基因引物序列
Table 1 The primer sequence of different genes

?
(续表1)
?
1.3 统计分析
所有数据均以“ ±s”表示,使用SPSS 22.0软件进行单因素方差分析 (one-way ANOVA),LSD 法进行组间比较,以P<0.05 表示存在统计学意义上的显著差异。
±s”表示,使用SPSS 22.0软件进行单因素方差分析 (one-way ANOVA),LSD 法进行组间比较,以P<0.05 表示存在统计学意义上的显著差异。
2 结果与分析
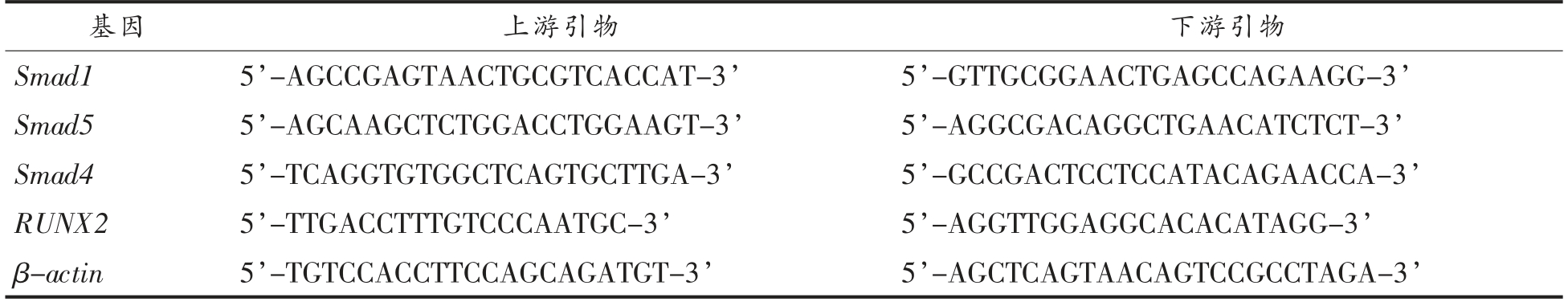
2.1 海地瓜对模型小鼠SOX9 和Aggrecan 水平的影响
SOX9 是软骨细胞在早期分化过程中表达的特异性转录因子,其转录水平的升高标志着软骨细胞开始增殖并成熟,此时软骨细胞数量增多并开始合成Aggrecan。因此,Aggrecan 的血清含量可反映此时软骨基质合成情况[11-12]。图1(a,b)结果显示,骨折术后第5 天,海地瓜与仿刺参组的SOX9 转录水平均显著高于模型组,分别升高了60.34%和63.33%(P<0.01),即海地瓜干预可促进模型小鼠提前形成软骨细胞;骨折术后第10天,此时模型组显示出活跃的软骨细胞生成,而海地瓜与仿刺参组SOX9 mRNA 转录水平与Aggrecan 血清浓度相较于模型组均显著降低,分别显著降低了52.83%,55.19%和12.1%,16.4%(P<0.01)。结果表明海地瓜具有促进软骨形成的作用,较模型组提前渡过了软骨细胞增殖及软骨基质合成高峰期。
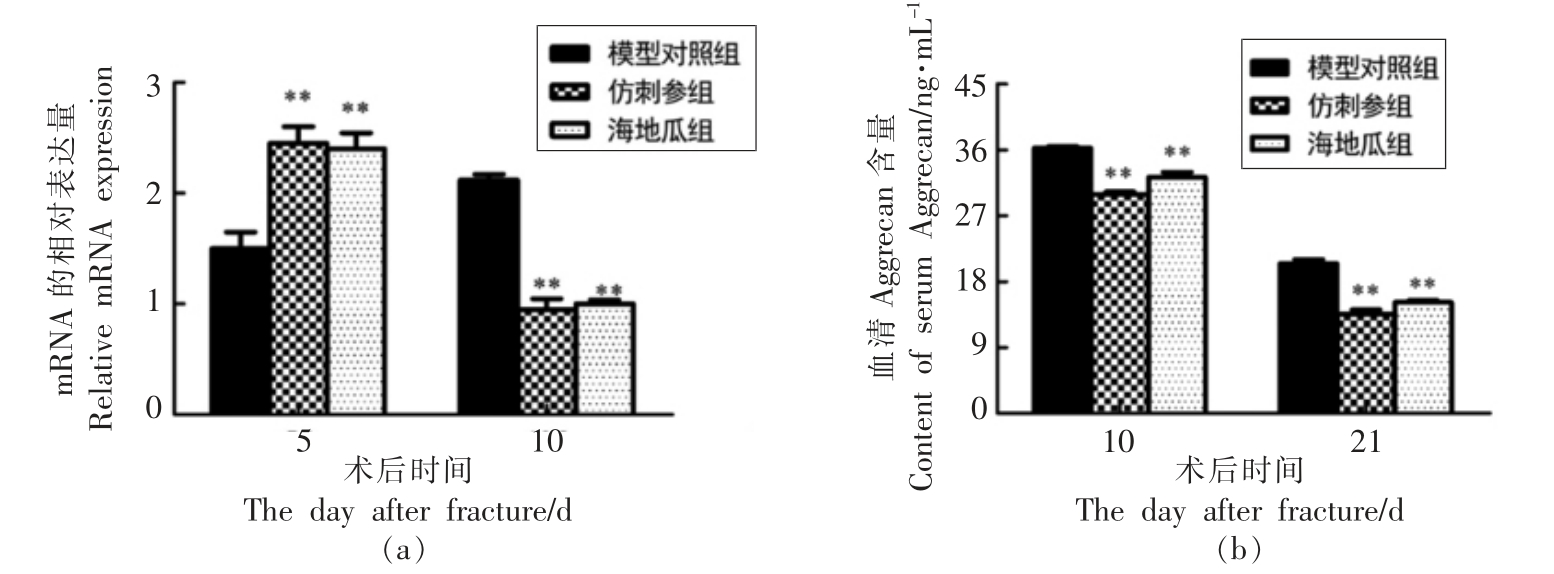
图1 海地瓜对模型小鼠SOX9(a)和Aggrecan(b)水平的影响
Fig.1 Effects of Acaudina molpadioidea on SOX9 (a) and Aggrecan (b) in fracture model mice
注:数据以 ±s 表示,**.P<0.01 与模型对照组相比。
±s 表示,**.P<0.01 与模型对照组相比。
2.2 海地瓜对模型小鼠Col10α、MMP13 和VEGF 水平的影响
Col10α 的表达会刺激增殖或预肥大的软骨细胞转化为肥大软骨细胞[13],肥大软骨细胞分泌金属蛋白酶MMP13,介导软骨中Ⅱ型胶原蛋白的降解[14]。如图2所示,术后第10 天,与模型组相比,海地瓜与仿刺参的干预均显著降低血清Col10α含量,分别降低了15.78%和19.31%(图2a)(P<0.01),同时血清MMP13 的含量分别增加了15.02%和14.91%(P<0.01)(图2b),模型组血清Col10α 和MMP13 含量的变化进程均显著落后。说明海地瓜干预能够更早的渡过软骨细胞肥大阶段,促进软骨基质降解,为后期成骨细胞入侵奠定基础,其作用效果与仿刺参相当。
血管入侵为新骨生成奠定了重要基础,对软骨内骨化过程至关重要,VEGF 是促进血管生成的经典诱导因子[15]。如图2c 所示,模型组VEGF mRNA 转录水平直至骨折后第21 天仍持续升高,且转录显著水平低于两种海参干预组,该结果表明模型小鼠血管生成进程落后。而海地瓜与仿刺参的干预均在第10 天显著上调了VEGF mRNA转录水平。说明海地瓜加快了模型小鼠血管入侵速度,为成骨细胞和破骨细胞募集于折断端做好准备,其作用效果与仿刺参相当。
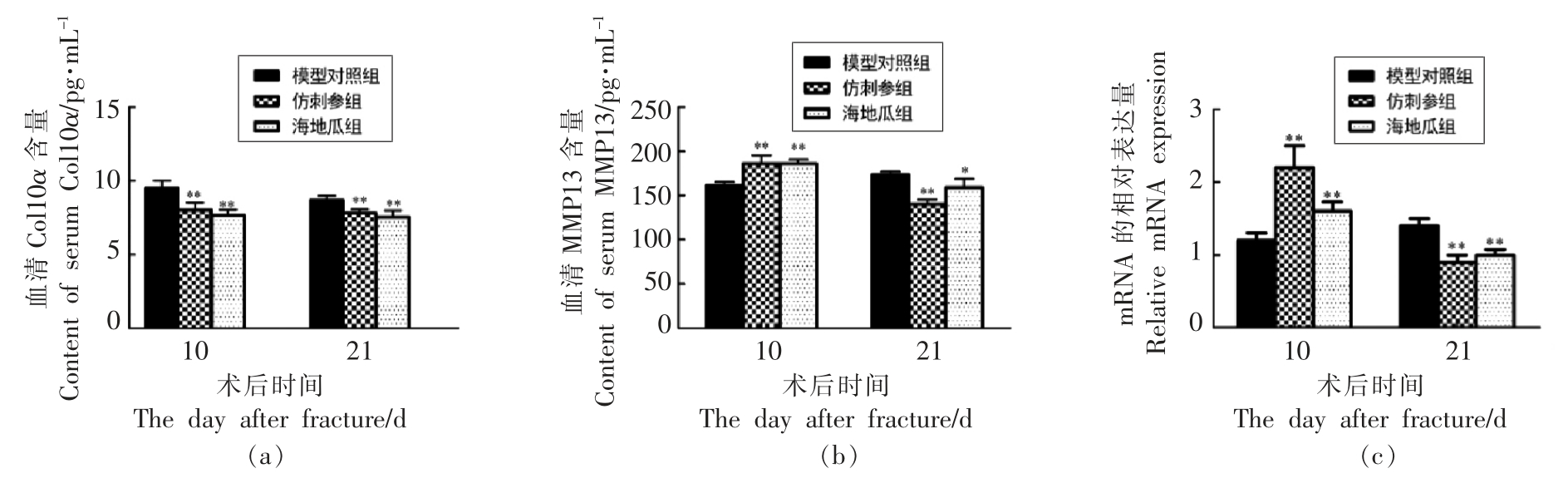
图2 海地瓜对模型小鼠Col10α(a),MMP13(b)和VEGF(c)水平的影响
Fig.2 Effects of Acaudina molpadioidea on Col10α(a),MMP13 (b) and VEGF (c) in fracture model mice
注:数据以 ±s 表示,*.P<0.05,**.P<0.01 与模型对照组相比。
±s 表示,*.P<0.05,**.P<0.01 与模型对照组相比。
2.3 海地瓜对模型小鼠ALP 和Col1α 水平的影响
ALP 和Col1α 是不同阶段新骨生成的标志基因[16]。如图3所示,模型组的ALP、Col1α 的转录水平均在术后21 d 才达到顶峰,术后第10 天,海地瓜与仿刺参干预即可显著上调早期成骨标志物ALP 的转录水平,与模型组滞后的骨生成相比分别升高了291.32%和212.2%(P < 0.01);术后第21 天,海地瓜与仿刺参组Col1α 转录水平较模型组分别显著上调了74.66%和101.42%(P<0.01)。说明海地瓜干预使模型小鼠的新骨生成活跃,在骨折愈合中期和后期均能显著加快新骨生成速度,其作用效果与仿刺参相当。
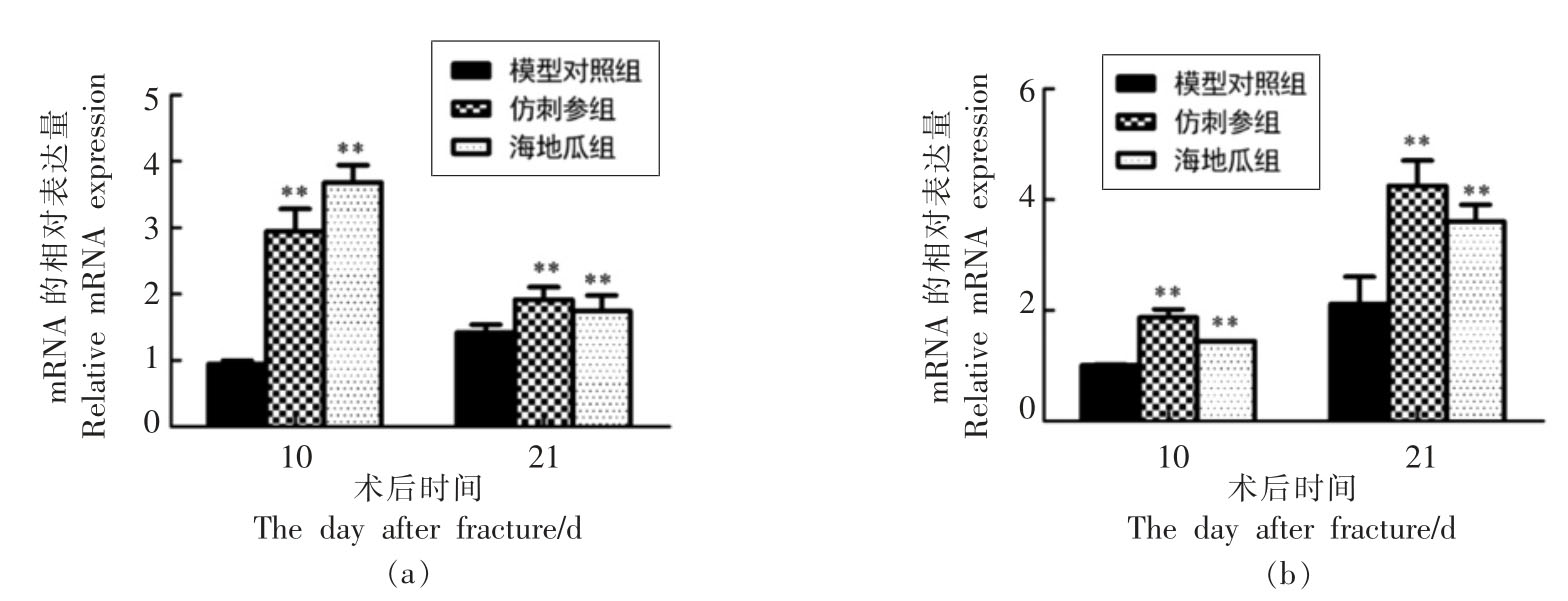
图3 海地瓜对模型小鼠ALP(a)和Col1α(b)水平的影响
Fig.3 Effects of Acaudina molpadioidea on ALP (a) and Col1α (b) in fracture model mice
注:数据以 ±s 表示,**.P<0.01 与模型对照组相比。
±s 表示,**.P<0.01 与模型对照组相比。
2.4 海地瓜促进骨折小鼠纤维愈伤组织的形成
如图4所示,骨折术后第5 天,模型组充斥着大量血肿,仍存在明显的炎症浸润且没有形成纤维骨痂。与模型组相比,灌胃海地瓜与仿刺参使模型小鼠的折断端已初步连接在一起,折断端由血肿快速转变为纤维结缔组织,表明二者的干预使其更快的渡过了炎症期,也更有利于软骨性骨痂的形成,海地瓜的作用效果略次于仿刺参。
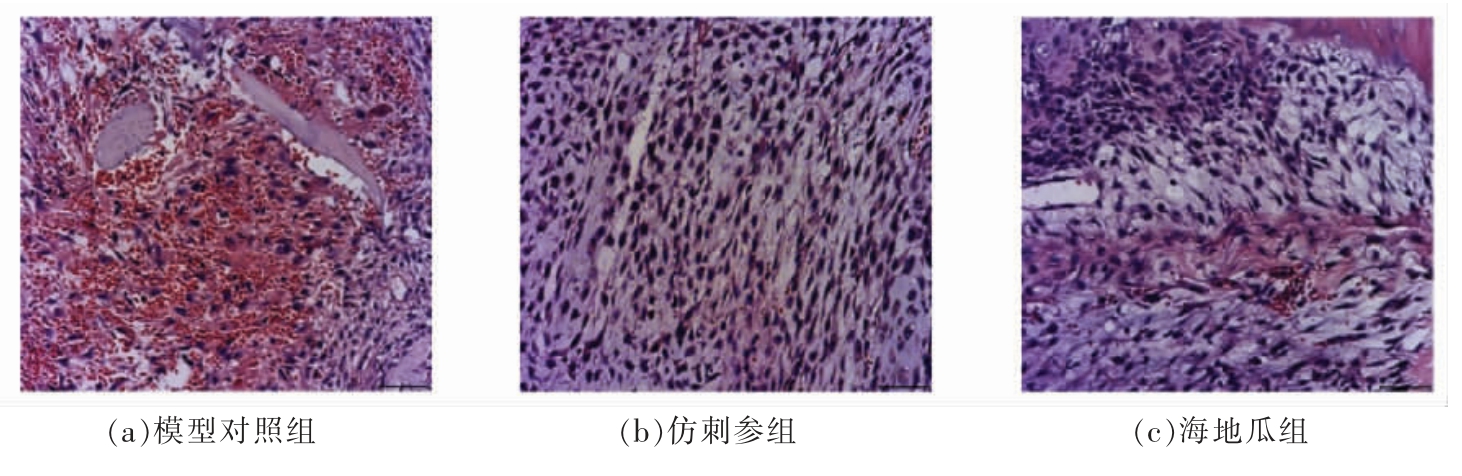
图4 术后5 d 骨痂组织切片H & E 染色(10×放大)
Fig.4 H & E staining of the callus on days 5 post-surgery (10× magnification)
2.5 海地瓜促进骨折小鼠软骨痂的形成
骨折术后第10 天为软骨痂期,如图5所示,模型组的软骨细胞为圆形排列、体积较小的幼稚软骨细胞,只有极少数软骨细胞出现肥大,并未开始终末分化。灌胃海地瓜与仿刺参干预后,模型小鼠的骨折断端出现了大量肥大软骨细胞,且出现了矿化新骨;仿刺参组软骨细胞面积更少,肥大软骨矿化凋亡更明显,且有大量新生骨小梁出现。即海地瓜干预在第10 天相比模型组更快的渡过了软骨增殖期,加速了软骨细胞的肥大矿化,其中海地瓜促进软骨性骨痂向骨性骨痂的转变作用效果略次于仿刺参。
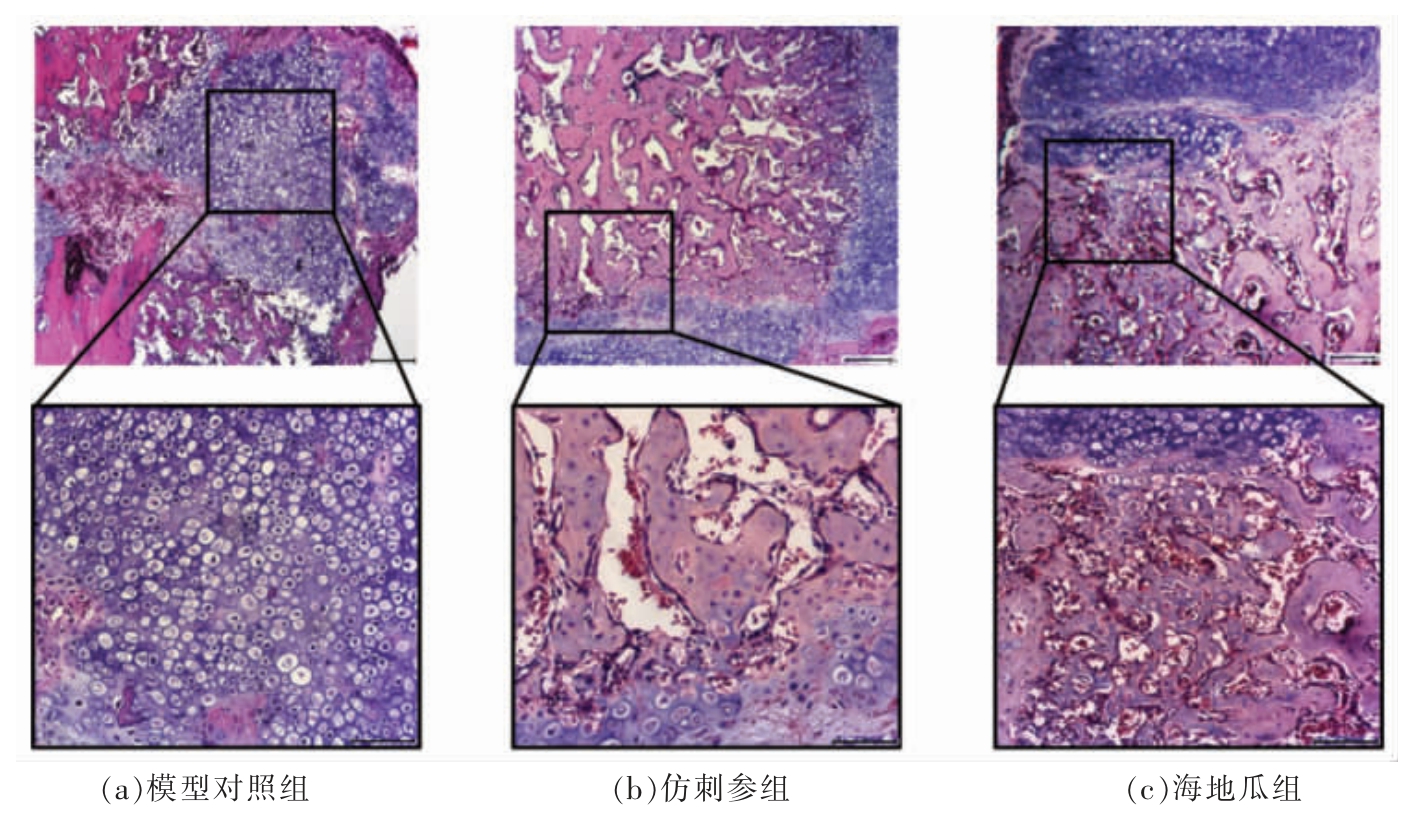
图5 术后10 d 骨痂组织切片H & E 染色(10×和20×放大)
Fig.5 H & E staining of the callus on days 10 post-surgery (10× and 20× magnification)
2.6 海地瓜促进骨折小鼠硬骨痂形成与重塑
骨折术后21 d,3 组的染色结果均显示出硬骨痂期的特点。如图6所示,模型组形成的硬骨痂排列松散且不规则,呈现明显的编织骨特点,骨细胞分布广且数量多。灌胃海地瓜与仿刺参使模型小鼠的骨细胞分化更加成熟,体积变小,数量变少,且编织骨转变为了更致密的板层骨。说明海地瓜的干预加快了模型小鼠的新骨生成速率,促进编织骨向板层骨转化,其作用效果与仿刺参相当。
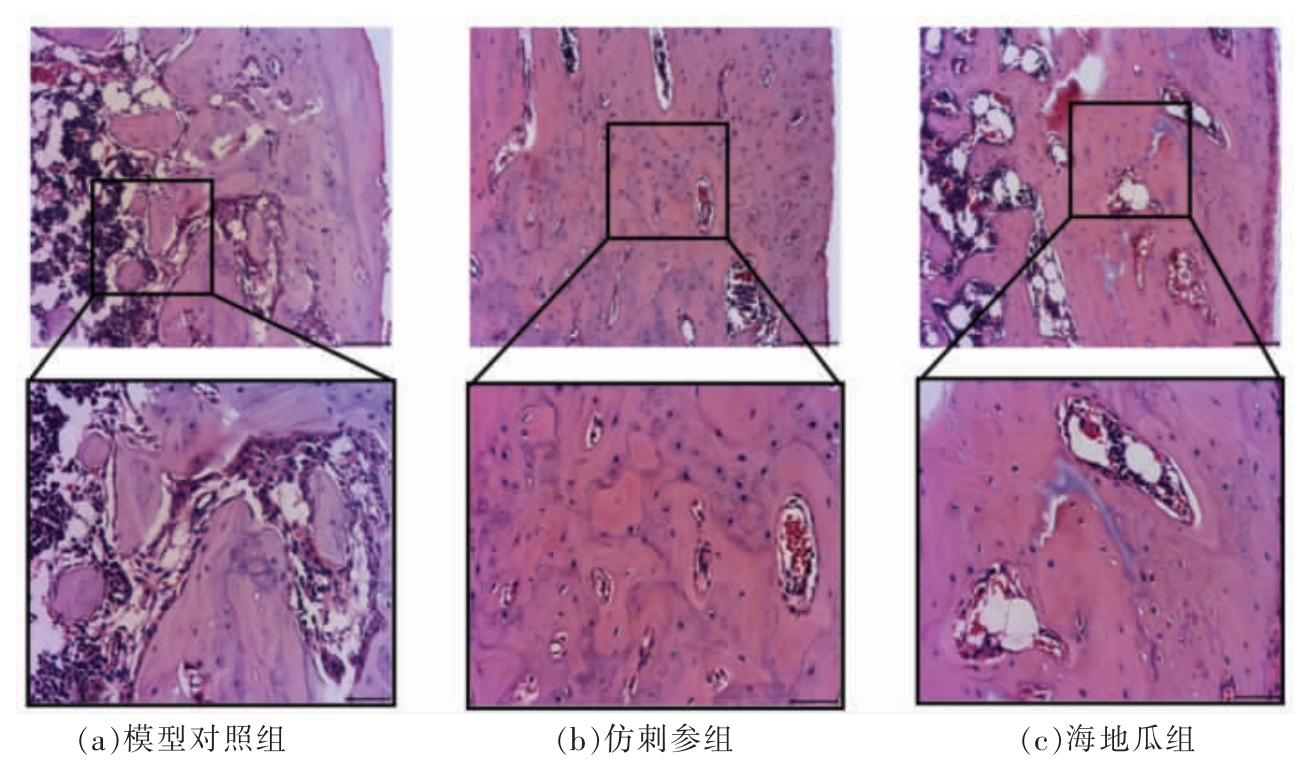
图6 术后21 d 骨痂组织切片H & E 染色(10×和20×放大)
Fig.6 H & E staining of the callus on 21 days post-surgery (10× and 20× magnification)
2.7 海地瓜激活Ihh-PThrp 和Smads/Runx2信号通路促进骨折愈合
Ihh 主要由肥大前的软骨细胞分泌,Ihh 信号激活后既可以调节软骨细胞的增殖,也可以调节软骨细胞的肥大分化与矿化成骨[17],是软骨内骨化的重要过程。如图7所示,骨折后第10 天,与模型组相比,海地瓜与仿刺参的干预均能显著下调Ihh、Patched、Gli1、Gli2 的转录水平,使模型小鼠提早渡过软骨细胞的肥大阶段,加快了矿化与新骨生成进程;骨折术后第21 天,二者的干预同样下调了Ihh 通路关键基因的表达,该结果表明海地瓜可通过Ihh 信号通路促进软骨细胞的肥大过程。
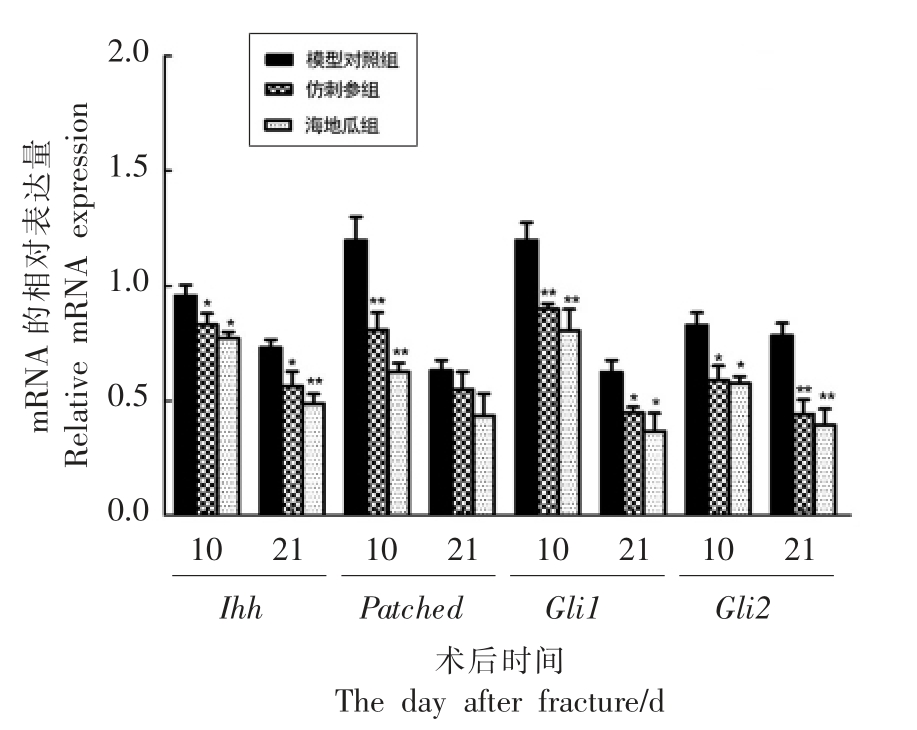
图7 Ihh-PThrp 通路关键因子mRNA 的表达
Fig.7 The mRNA impression of key genes in Ihh pathway
注:数据以 ±s 表示,*.P<0.05,**.P<0.01 与模型对照组相比。
±s 表示,*.P<0.05,**.P<0.01 与模型对照组相比。
由Smads 介导的BMP 信号不仅可以调控骨生成,而且还可以调控软骨细胞的肥大和成熟。Smads/Runx2 通路关键基因的mRNA 转录水平如图8所示。术后第10 天,海地瓜与仿刺参的干预可显著降低Smad1、Smad4、Smad5、Runx2 的mRNA 表达水平;术后第21 天,Smads/Runx2 通路关键基因的mRNA 表达各组之间无显著差异,以上结果侧面反映了仿刺参与海地瓜的Smads/Runx2信号在术后第10 天减弱,即海地瓜的干预能促进软骨细胞更快的渡过肥大时期,提早进入矿化成骨阶段,其作用效果与仿刺参相当。
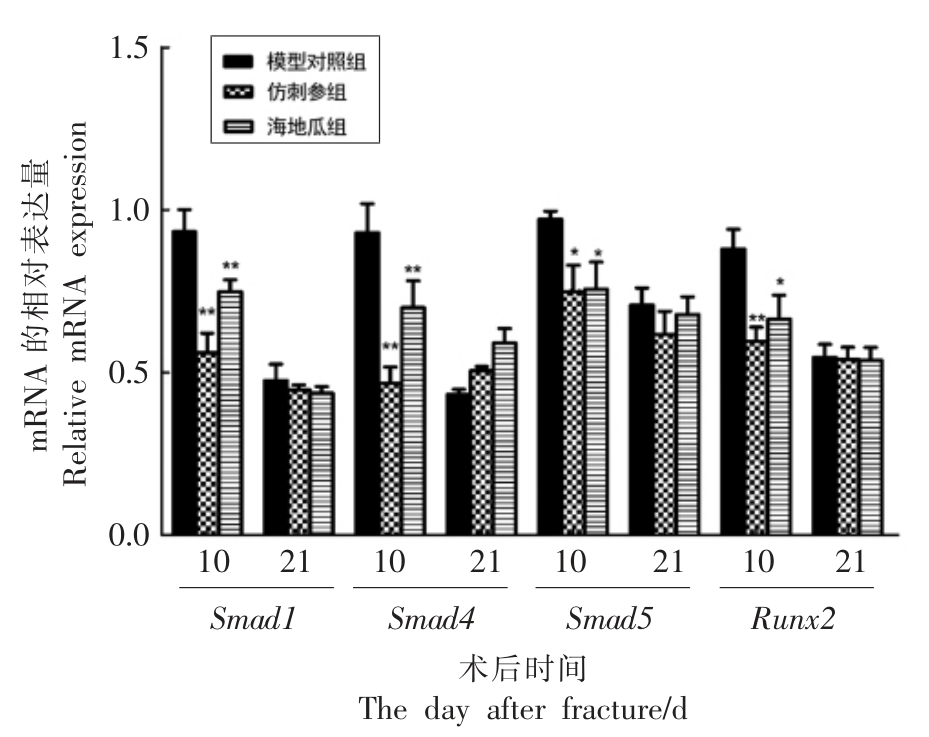
图8 Smads/Runx2 通路关键因子mRNA 的表达
Fig.8 The mRNA impression of key genes in Smads/Runx2 pathway
注:数据以 ±s 表示,*.P<0.05,**.P<0.01 与模型对照组相比。
±s 表示,*.P<0.05,**.P<0.01 与模型对照组相比。
3 讨论
本实验采用右胫开放性骨折模型,探究海地瓜对小鼠骨折愈合过程的影响。结果显示,海地瓜的促骨折愈合作用效果与仿刺参相当,海地瓜使愈合早期的模型小鼠更快的渡过软骨增殖及肥大阶段,促进基质降解及血管入侵,加快新骨形成速率以加速软骨内骨化过程,促进骨折愈合。其作用是通过激活Ihh 和Smads/Runx2 信号通路实现的。
骨折修复是一个复杂的过程,骨折后继发性骨愈合过程类似于纵向骨生长过程中的软骨内成骨过程[18],即利用内源性再生潜能恢复原始骨结构,促进矿化组织的增加。然而目前骨折愈合的详细病理生理机制尚未完全阐明,以往的研究结果表明,这一过程主要依赖于成骨细胞和破骨细胞的作用以及软骨内骨化过程中多种细胞因子的调控[19]。
Sox9 是一种含有高迁移率组框DNA 结合区的蛋白,主要在增殖的软骨细胞中表达,是软骨细胞分化的特异性转录因子,能够诱导软骨基质如Aggrecan 和CoL2α 的合成,在软骨内骨化中尤为重要[20]。Akiyama 等[21]通过体内实验发现在肢芽的间充质细胞中敲除Sox9 后,软骨形成受阻,并且软骨基质标志基因的表达低下。本研究结果显示,海地瓜干预可上调愈合早期Sox9 的mRNA 转录,组织学染色结果也表明其能促进骨折早期软骨组织的形成从而加快骨折愈合。在新骨形成初期,血管生成与骨形成紧密相连,VEGF 是有力的促血管生成因子,ALP 代表早期骨矿化程度[22]。海地瓜干预在术后第10 天显著促进了血管生成和新骨的形成,在不同程度上提高了VEGF 和ALP 的mRNA 转录水平,这与组织学染色结果中海地瓜干预促进模型小鼠的软骨痂向硬骨痂转变及愈合程度相对应,证明海地瓜可促进骨性骨痂的形成,且作用效果与仿刺参相当。
软骨细胞肥大矿化是软骨内骨化中重要的过程,它是血管入侵肥大区域,新骨组织代替软骨组织的基础[23]。Ihh 信号和Smads/Runx2 信号在调控软骨细胞的肥大过程中发挥着重要作用,软骨细胞表达Col10a 是软骨基质矿化的前提[24-25]。本研究中,骨折后第10 天,海地瓜干预后血清Col10α含量显著下降,对应此时Ihh 信号和Smads/Runx2的转导信号减弱,即海地瓜的干预使模型小鼠提早渡过了软骨肥大时期,步入新骨形成时期,这与组织形态学结果一致。Smads/Runx2 信号中Smads蛋白是BMP2 在细胞内信号传递过程中的重要中介因子,Retting 等[26]通过实验证明在软骨内骨化中Smad1 和Smad5 是软骨分化中非常关键的调控因子。本研究中,对Smads/Runx2 信号通路中Samd1、Smad4 和Smad5 的转录水平进行了测定,结果显示术后第10 天,海地瓜组的Samd1、Smad4和Smad5 的转录水平均显著降低,这与Ihh 信号中关键基因表达的趋势相同,提示海地瓜干预也可以通过Smads/Runx2 信号通路调控软骨细胞的肥大过程。有研究表明,Smads 蛋白和Runx2 结合后可以激活Col10a 的转录活性[27-28],并且Amano等[29]通过免疫共沉淀的方法发现Gli1/Gli2 可以分别结合在RUNX2、Smads 的结合位点上并形成共聚体,然后共同结合在Col10a 的启动子上,进而激活Col10a 的转录,促进软骨细胞的肥大。本研究中海地瓜干预激活了Ihh 及Smads/Runx2 信号通路中关键基因的表达,促进Col10a 的转录,推测海地瓜可能通过Ihh 信号和BMP2/smads 信号的交互作用调控软骨细胞的肥大过程。
本研究证实了海地瓜整参的促进骨折愈合活性,已有前人探究了不同来源的活性肽[30]、多糖[31]及皂苷[32]等活性成分在骨折愈合软骨内骨化过程中发挥的积极作用,海地瓜中含有的酸性黏多糖、胶原肽、皂苷等活性成分可能是促进骨折愈合的关键因素,然而现有研究并未明确具体起作用的活性成分,以及这些活性成分起作用的具体靶点,其潜在机制值得进一步研究,这将加深对海参骨折愈合过程中改善效果的理解。
综上所述,海地瓜可通过促进软骨细胞增殖肥大、基质降解、血管入侵及新骨生成以加快软骨内骨化进程,从而加速模型小鼠骨折愈合,其促进机制可能与Ihh 信号和BMP2/smads 信号交互并调控软骨细胞的肥大有关,本研究首次以摄入整参的方式对比了海地瓜与仿刺参促进骨折愈合的活性,为以海地瓜为代表的低值海参的药用价值开发提供了理论支撑。
[1]EINHORN T A,GERSTENFELD L C.Fracture healing:Mechanisms and interventions[J].Nature Reviews Rheumatology,2014,11(1):45-54.
[2]ANTONOVA E,LE T K,BURGE R,et al.Tibia shaft fractures:Costly burden of nonunions[J].BMC Musculoskeletal Disorders,2013,14(1):42-42.
[3]TZIOUPIS C,GIANNOUDIS P V.Prevalence of long-bone non-unions[J].Injury,2007,38:S3-S9.
[4]宋迪,吉爱国,梁浩,等.刺参生物活性物质的研究进展[J].中国生化药物杂志,2006,27(5):316-319.
SONG D,JI A G,LIANG H,et al.Progress of the studies on the bioactive substances in the Stichopus japonicus[J].Chinese Journal of Biochemical Pharmaceutics,2006,27(5):316-319.
[5]ROWE M L,ACHHALA S,ELPHICK M R.Neuropeptides and polypeptide hormones in echinoderms:New insights from analysis of the transcriptome of the sea cucumber Apostichopus japonicus[J].General & Comparative Endocrinology,2014,197:43-55.
[6]ZHANG X M,HAN L W,SHENG W L,et al.Two novel non-holostane type glycosides from the viscera of sea cucumber Apostichopus japonicus[J].Journal of Asian Natural Products Research,2020,22(4):329-337.
[7]CHEN X R,MAI K S,ZHANG W B,et al.Dietary supplements of guanosine improve the growth,non-specific immunity of sea cucumber,Apostichopus japonicus Selenka,and its resistance against Vibrio splendidus[J].Aquaculture Nutrition,2017,24(1):3445-3452.
[8]LIU H H,KO W C,HU M L.Hypolipidemic effect of glycosaminoglycans from the sea cucumber Metriatyla scabra in rats fed a cholesterol-supplemented diet[J].Journal of Agricultural & Food Chemistry,2002,50(12):3602-3606.
[9]胡艳芳,董书君,续晓琪,等.3 种低值海参中海参多糖的提取分离及化学组成研究[J].食品与发酵工业,2015,41(2):227-232.
HU Y F,DONG S J,XU X Q,et al.Extraction,separation and chemical composition of sea cucumber polysaccharides from three low value sea cucumbers[J].Food and Fermentation Industries,2015,41(2):227-232.
[10]LI S,LI J,ZHI Z,et al.Macromolecular properties and hypolipidemic effects of four sulfated polysaccharides from sea cucumbers [J].Carbohydr Polym,2017,173:330-337.
[11]TAO K,REY-RICO A,FRISCH J,et al.RAAVmediated combined gene transfer and overexpression of TGF-β and SOX9 remodels human osteoarthritic articular cartilage [J].Osteoarthritis and Cartilage,2016,34(12):2181-2190.
[12]ELENA K,LASSAR A B,ELAZAR Z.A pathway to bone:Signaling molecules and transcription factors involved in chondrocyte development and maturation[J].Development,2015,142(5):817-831.
[13]NOVAK S,ROEDER E,SINDER B P,et al.Modulation of Notch1 signaling regulates bone fracture healing[J].Journal of Orthopaedic Research,2020,38(11):2350-2361.
[14]FENG S R,LIU G H,YIN H U.Effect of movement on osteochondral fracture outcomes evaluated by MRI and MMP-13 expression[J].Journal of Nanchang University (Medical Science),2012,11(6):491-498.
[15]ZHANG Y T,HAO Z C,WANG P F,et al.Exosomes from human umbilical cord mesenchymal stem cells enhance fracture healing through HIF-1α-mediated promotion of angiogenesis in a rat model of stabilized fracture[J].Cell Proliferation,2019,8(1):172-184.
[16]DE KROON L M G,NARCISI R,VAN D A G G H,et al.SMAD3 and SMAD4 have a more dominant role than SMAD2 in TGFβ-induced chondrogenic differentiation of bone marrow-derived mesenchymal stem cells[J].Scientific Reports,2017,7:43164-43177.
[17]郭敏,张婧,鹿蕾,等.实验性单侧前牙反 (牙合)修复体对大鼠髁突软骨中甲状旁腺激素相关蛋白和PTH/PTHrP 受体-1 表达的影响[J].华西口腔医学杂志,2013,32(2):122-126.
GUO M,ZHANG J,LU L,et al.Effects of experimentally created unilateral anterior crossbite prosthesis on the expression of parathyroid hormone-related peptide and parathyroid hormone receptor-1 in mandibular condylar cartilage of rat[J].West China Journal of Stomatology,2013,32(2):122-126.
[18]MA T,CHEN Y,CHEN Y,et al.MicroRNA-132,delivered by mesenchymal stem cell-derived exosomes,promote angiogenesis in myocardial infarction[J].Stem Cells International,2018,2018:3290372.
[19]FURUTA T,MIYAKI S,ISHITOBI H,et al.Mesenchymal stem cell-derived exosomes promote fracture healing in a mouse model[J].Stem Cells Translational Medicine,2016,5(12):1620-1630.
[20]UUSITALO H,HILTUNEN A,AHONEN M,et al.Accelerated up-regulation of L-Sox5,Sox6,and Sox9 by BMP-2 gene transfer during murine fracture healing[J].Journal of Bone & Mineral Research the Official Journal of the American Society for Bone &Mineral Research,2001,16(10):122-134.
[21]AKIYAMA H,CHABOISSIER M C,MARTIN J F,et al.The transcription factor Sox9 has essential roles in successive steps of the chondrocyte differentiation pathway and is required for expression of Sox5 and Sox6[J].Genes Dev,2012,16(21):2813-2828.
[22]KURU P,AKYUZ G,CER?IT H P,et al.Fracture history in osteoporosis:Risk factors and its effect on quality of life[J].Balkan Medical Journal,2015,97(17):1406-1410.
[23]LONG F,ORNITZ D M.Development of the endochondral skeleton[J].Cold Spring Harbor Perspectives in Biology,2013,5(1):1-23.
[24]SOUNG D Y,TALEBIAN L,MATHENY C J,et al.Runx1 dose-dependently regulates endochondral ossification during skeletal development and fracture healing[J].Journal of Bone and Mineral Research,2012,27(7):1585-1597.
[25]FUJITA T,AZUMA Y,FUKUYAMA R,et al.Runx2 induces osteoblast and chondrocyte differentiation and enhances their migration by coupling with PI3K-Akt signaling[J].The Journal of Cell Biology,2004,166(1):85-95.
[26]RETTING K N,SONG B,YOON B S,et al.BMP canonical Smad signaling through Smad1 and Smad5 is required for endochondral bone formation[J].Development,2009,136(7):1093-1104.
[27]DRISSI M H,LI X,SHEU T J,et al.Runx2/Cbfa1 stimulation by retinoic acid is potentiated by BMP2 signaling through interaction with Smad1 on the collagen X promoter in chondrocytes[J].J Cell Biochem,2003,90(6):1287-1298.
[28]LEBOY P,GRASSO-KNIGHT G,D'ANGELO M,et al.Smad-Runx interactions during chondrocyte maturation[J].J Bone Joint Surg Am,2001,83-A Suppl 1(Pt 1):S15-22.
[29]AMANO K,DENSMORE M,NISHIMURA R,et al.Indian hedgehog signaling regulates transcription and expression of collagen Type X via Runx2/Smads interactions [J].Journal of Biological Chemistry,2014,289(36):24898-24910.
[30]TOOSI S,BEHRAVAN J.Osteogenesis and bone remodeling:A focus on growth factors and bioactive peptides[J].BioFactors,2020,46(3):326-340.
[31]袁辉,马岝,王得利.半枝莲多糖对兔下颌骨骨折愈合过程中VEGF、SGF、bFGF 表达水平的影响[J].亚太传统医药,2015,11(24):19-20.
YUAN H,MA Z,WANG D L.Effect of Scutellaria barbata polysaccharide on the expression of VEGF,SGF and bFGF during mandibular fracture healing in rabbits[J].Asia-Pacific Traditional Medicine,2015,11(24):19-20.
[32]ELIAS P M,FRIEND D S,GOERKE J.Membrane sterol heterogeneity.Freeze-fracture detection with saponins and filipin[J].Journal of Histochemistry &Cytochemistry,1979,27(9):1247-1260.