双孢蘑菇(Agaricus bisporus),是世界范围内广泛种植的一种食用菌,我国年产量已超过100万t,年出口量保持在50 万t 左右[1]。双孢蘑菇蛋白质含量高,占鲜重的3.5%~4.5%,是普通蔬菜的几倍至几十倍,在食用菌中位居前列,是一种潜在的蛋白质资源,有“植物肉”之称[2]。双孢蘑菇除了鲜销外,大多加工成罐藏产品为主[3],加工过程中约10%的食用菌菇柄、残次品和碎屑等边角料被废弃,不仅增加环境污染,还会造成资源浪费[4]。然而,这些边角料同样具有高蛋白、低脂肪的特点,使其成为制备生物活性肽的潜在热门原料。
生物活性肽是一种对机体生命活动有益或具有特定生理调节作用的肽类化合物[5]。血管紧张素转化酶(Angiotensin converting enzyme,ACE),是人体血压调节的一种关键限速酶。ACE 抑制肽是具有ACE 抑制活性的肽类物质,一方面能够阻止ACE 催化缓激肽的水解,使其具有正常的收缩血管能力,另一方面还能阻止ACE 催化血管紧张素Ⅰ转化为具有收缩血管能力的血管紧张素Ⅱ,降血压作用显著[6-7]。此外,与合成的降压药物不同,ACE 抑制肽具有安全性高,毒副作用小,可长期食用等优点,因此,食源性ACE 抑制肽成为近年来的研究焦点[8]。
目前,以食用菌为原料获取ACE 抑制肽的方法主要有水提法、硫酸铵沉淀法和甲醇沉淀法等[9]。研究者多以大白口蘑[10]、蟹味菇[11]、茶树菇[12-13]、灵芝[14]、侧耳菌[15]等栽培食用菌子实体和灰树花、双色牛肝菌等野生食用菌为原料,利用直接提取法制备ACE 抑制肽。受资源限制,若以子实体整菇为原料,则生产成本较高[16]。以上这些方法虽然提取工艺简单、快捷、提取率较高,但是得到的ACE抑制肽种类比较单一,且原料利用率较低。而采用酶法水解制备ACE 抑制肽,不仅可以更充分地利用原料中的蛋白资源,而且有可能获得种类更丰富的ACE 抑制肽。然而,酶法水解双孢菇边角料蛋白制备ACE 抑制肽的研究尚未见报道。
鉴于此,本试验以工厂生产的双孢菇菇柄、异形菇等边角料为原料,利用碱溶酸沉法提取双孢菇边角料蛋白,超声波处理后,分别选用胰蛋白酶、碱性蛋白酶和复合蛋白酶对其进行酶解,通过测定蛋白的水解度和ACE 抑制率来确定最佳的蛋白酶种类。采用响应面试验设计方法,优化蛋白酶酶解工艺条件,以期获得新的ACE 抑制肽,为双孢菇产业边角料高值利用提供新途径。
1 材料与方法
1.1 材料与试剂
双孢菇边角料,天水众兴菌业科技有限公司。血管紧张素转化酶(ACE),美国Sigma 公司;N-[3-(2-呋喃基) 丙烯酰]-L-苯丙氨酰-甘氨酰-甘氨酸(FAPGG),西宝生物科技(上海)股份有限公司;碱性蛋白酶(20 万u/g)、胰蛋白酶(250 USP u/mg)、复合蛋白酶(120 u/mg)、茚三酮、硼酸、硼砂、氢氧化钠,源叶生物科技有限公司。
1.2 仪器与设备
FA1204B 电子分析天平,上海佑科仪器仪表有限公司;TU-1810 系列紫外可见分光光度计,北京普析通用仪器有限责任公司;HBS-1096A 酶标分析仪,南京德铁实验设备有限公司;101-1-S-H电热恒温鼓风干燥箱,上海跃进医疗器械厂;DFY-200 高速多功能粉碎机,上海塞耐力有限公司;HWS-26 电热恒温水浴锅,上海一恒科学仪器有限公司;TGL-16 台式高速冷冻离心机,湖南湘仪实验室仪器开发有限公司;LGJ-10FD 型冷冻干燥机,北京亚星仪科科技有限公司。
1.3 试验方法
1.3.1 原料的预处理 将双孢蘑菇边角料进行干制:1~4 h,38~40 ℃;4~8 h,40~45 ℃;8~12 h,45~50 ℃;12~16 h,50~53 ℃;17 h 以后,55~60 ℃,直至恒重,用粉碎机粉碎干制好的原料。
1.3.2 超声波辅助提取食用菌蛋白 将双孢菇边角料粉末以一定的料水比制成溶液,经过超声波处理后,用1 mol/L 的NaOH 调节溶液pH 值为10.0,浸提2 h,以6 000 r/min 速度离心15 min,取上清液,用1 mol/L 的HCL 调节上清液的pH 值为4.5,静沉2 h,8 000 r/min 离心20 min,并收集沉淀。
1.3.3 超声波辅助酶法水解双孢菇子实体蛋白 将收集得到的双孢菇边角料蛋白溶液,以一定的功率超声一定时间,然后用不同的蛋白酶酶解食用菌蛋白溶液,酶解完成后,在90 ℃水浴中灭酶10 min,冷却离心(10 000 r/min,4 ℃,20 min),收集上清液,用0.45 μm 膜过滤,将滤液冻干。
1.3.4 蛋白酶的筛选 分别使用胃蛋白酶、碱性蛋白酶和胰蛋白酶对溶液进行依次酶解,以蛋白水解度和ACE 抑制率为指标,筛选出最佳的蛋白酶。
1.3.5 单因素实验设计 分别以酶解温度(30~50℃)、酶解时间(30~150 min)、酶解pH 值(7~9)、蛋白酶添加量(3~7 mg/100 mL)和料水比(1∶10~1∶50)为单因素,以蛋白水解度和ACE 抑制率为指标,确定最佳的酶解温度、时间、pH 值、添加量和料水比。
1.3.6 响应面优化试验 分别选择酶解时间、酶解温度、酶解pH 值和蛋白酶添加量4 个因素进行进一步优化。以单因素实验确定的最佳因素水平为中点,以ACE 抑制率为响应值。利用CCD(Central Composite Design) 进行响应面试验设计。4 因素3 水平编码表如表1所示。
表1 响应面试验因素水平编码值表
Table 1 Coding values of response surface test factor levels
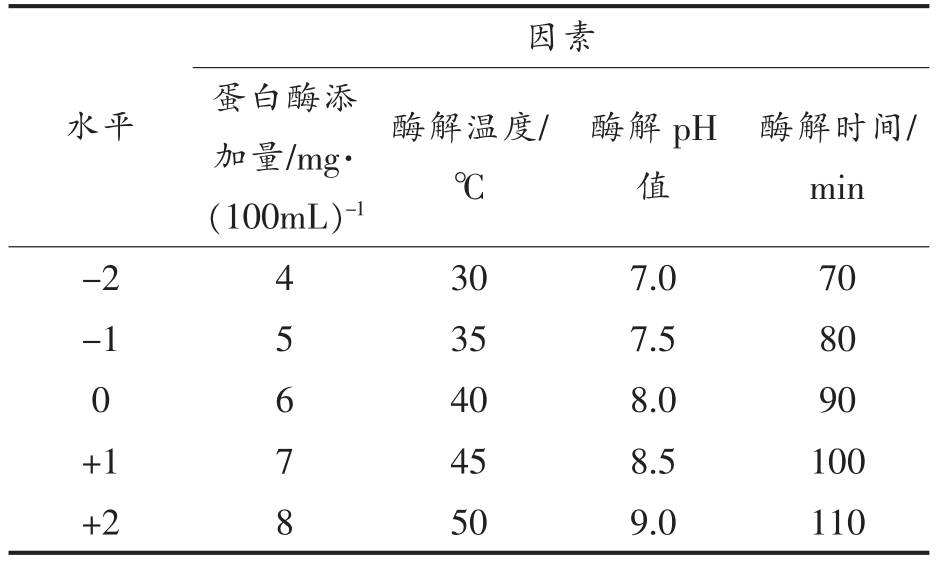
因素水平 蛋白酶添加量/mg·(100mL)-1酶解温度/℃酶解pH值酶解时间/min-2 4 30 7.0 70-1 5 35 7.5 80 0 6 40 8.0 90+1 7 45 8.5 100+2 8 50 9.0 110
1.3.7 测定方法
1.3.7.1 蛋白质含量的测定 总蛋白质含量测定采用碱溶法,即样品先用2 mol/L NaOH 提取4 h后,采用福林酚法测定可溶性蛋白质含量。
1.3.7.2 蛋白提取率的测定 蛋白提取率按公式(1)计算。
式中,a——双孢菇提取量 (g);b——样品中蛋白质含量(g)。
1.3.7.3 水解度的测定 标准曲线的绘制:将甘氨酸置于50 ℃烘箱中干燥。称取0.1 g 甘氨酸置于小烧杯中,加入少量的去离子水溶解后,转入100 mL 的容量瓶中定容。取2 mL 甘氨酸溶液定容至100 mL,此时该溶液中甘氨酸为20 μg/mL。分别取20 μg/mL 甘氨酸溶液0,0.1,0.2,0.3,0.4,0.5,0.6,0.7,0.8,0.9,1.0 mL 置于试管中,分别加入1.0 mL 茚三酮显色剂,混合均匀,置于沸水中加热15 min,静置冷却至室温,加入5 mL 质量分数40%的乙醇溶液,混合均匀,15 min 后以0 号管为空白对照,于570 nm 波长处测定吸光值。根据标准曲线计算出酶解前、后中游离氨基的含量,总蛋白质含量测定采用碱溶法。水解度按公式(2)计算。

1.3.7.4 ACE 抑制肽活性测定 参考Shalaby 等[17]的方法,并稍作修改。将1.0 mmol/L FAPGG 溶解于pH 值为7.5、含有0.3 mol/L NaCl 的Tris-HCl(50 mmol/L)中配制底物溶液,置于37 ℃水浴锅中保温。取10 μL 酶解液加入96 孔板中,然后加入150 μL 的底物溶液,迅速将孔板放入酶标仪中,于340 nm 波长下测定吸光值,每30 s 记录1 次,共30 min。空白组以10 μL 的缓冲液代替酶解液,对照组以10 μL 的0.25 U/mL 的ACE 溶液代替酶解液。以吸光值变化(ΔA)对时间做出曲线,计算斜率。ACE 抑制率按公式(3)计算。
1.4 数据分析与处理
所有试验重复3 次,结果以“平均值±标准偏差”表示,并采用Design Expert 10 和Origin 8.0软件对数据进行分析和处理。
2 结果与分析
2.1 蛋白酶的筛选
选择复合蛋白酶、胰蛋白酶、胃蛋白酶、碱性蛋白酶和木瓜蛋白酶依次酶解原料蛋白,测定其水解度和ACE 抑制率,结果如图1所示。
由图1可知,供试的5 种蛋白酶(复合蛋白酶、胰蛋白酶、木瓜蛋白酶、胃蛋白酶和碱性蛋白酶)均可酶解双孢菇蛋白,并产生一定的ACE 抑制效应,且与直接提取法制备ACE 抑制肽相比,采用5 种蛋白水解酶处理后,其水解度显著提高,其抑制率均发生了明显变化。其中,木瓜蛋白酶和胃蛋白酶酶解后的ACE 抑制率较低,而碱性蛋白酶的ACE 抑制率最高,其蛋白水解度也较高。通过直接提取也可以获得具有活性的ACE 抑制肽,然而其ACE 抑制率低于通过超声波辅助酶法制备的ACE 抑制率。因此,本试验选用碱性蛋白酶酶解双孢菇蛋白制备ACE 抑制肽。
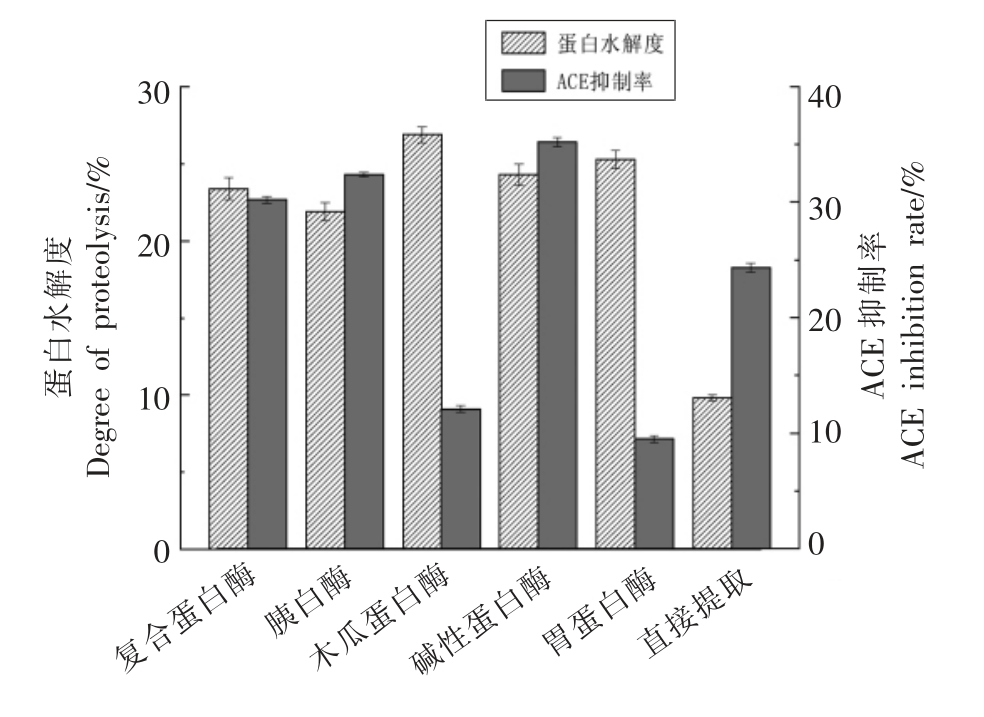
图1 不同蛋白酶对水解度和ACE 抑制率的影响
Fig.1 Effects of different proteases on degree of hydrolysis and ACE inhibition rate
2.2 酶解条件的单因素实验
2.2.1 料水比对酶解效果的影响 用不同的料水比溶解双孢菇边角料粉末,然后用1.0 mol/L 的NaOH 溶液调节溶液pH 值为8.0,添加5 mg/100 mL 的碱性蛋白酶,40 ℃水浴酶解90 min,以水解度和ACE 抑制率为测定指标,来确定响应面优化的中心值。结果如图2所示。
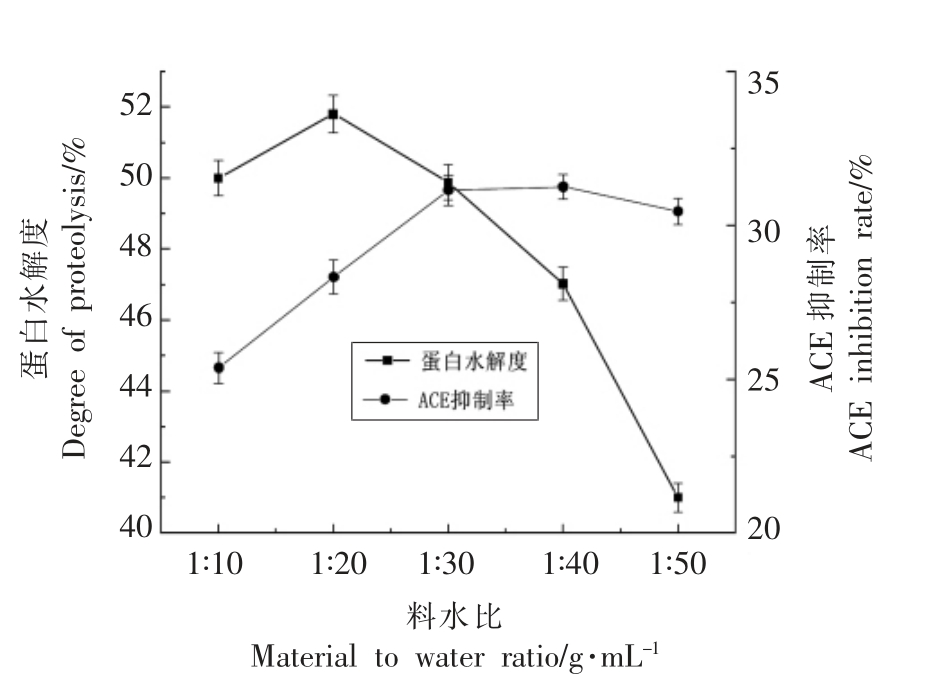
图2 料水比对双孢菇蛋白酶解的影响
Fig.2 Effect of material water ratio on proteolysis of Agaricus bisporus protein
由图2可知,随着料水比比值的下降,ACE 抑制率整体呈上升趋势,当达到1∶30 后,基本保持不变,相反,蛋白水解度呈下降趋势。因此,本试验确定最佳的料水比为1∶30。
2.2.2 蛋白酶添加量对酶解效果的影响 将原料蛋白以1∶30 的料水比制成溶液,调节溶液pH值为8.0,添加不同量的碱性蛋白酶,40 ℃水浴酶解90 min,以ACE 抑制率和蛋白水解度为指标来确定最佳的蛋白酶添量,结果如图3所示。
由图3可知,随着蛋白酶添加量的增加,蛋白的水解度也随之增大,然而当添加量达到6 mg/100 mL 时,ACE 抑制率最大。随着蛋白酶添加量的增加,ACE 抑制率反而降低,可能是因为蛋白酶将其中一些具有活性的ACE 抑制肽酶解成一些游离的氨基酸和没有活性的肽,从而造成ACE 抑制率的降低。本试验选择6 mg/100 mL 为蛋白酶添加量的中心点进行后续的响应面优化试验。
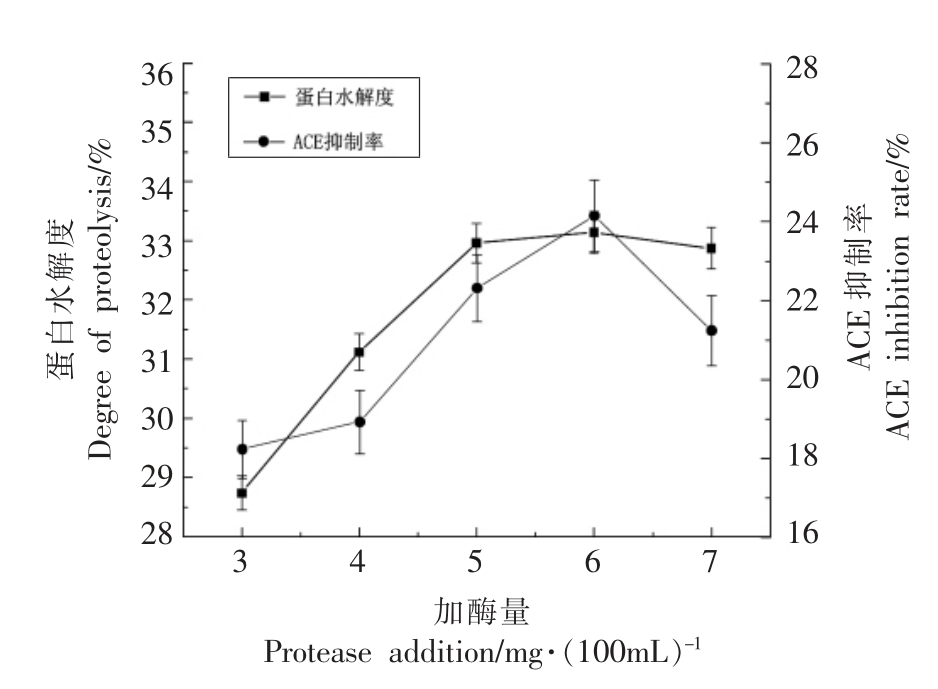
图3 蛋白酶添加量对双孢菇蛋白水解的影响
Fig.3 Effect of protease addition on the hydrolysis of Agaricus bisporus protein
2.2.3 蛋白酶酶解温度对酶解效果的影响 将原料蛋白以1∶30 的料水比制成溶液,调节溶液pH 值为8.0,添加5 mg/100 mL 的碱性蛋白酶在不同温度中酶解90 min,以ACE 抑制率和蛋白水解度为指标,确定最佳的酶解温度,结果如图4所示。
由图4可知,随着酶解温度的升高,蛋白水解度和ACE 抑制率均呈现先升高后下降的趋势,由于温度对碱性蛋白酶的活力有一定的影响,从而造成蛋白水解度的降低;而随着温度的升高,一些对温度敏感的活性肽其活性会受到抑制,甚至失活,从而造成ACE 抑制率降低。其中ACE 抑制率在40 ℃时最大,此时的蛋白水解度也相对较大。本试验选择40 ℃为酶解温度中心点进行后续的响应面优化试验。
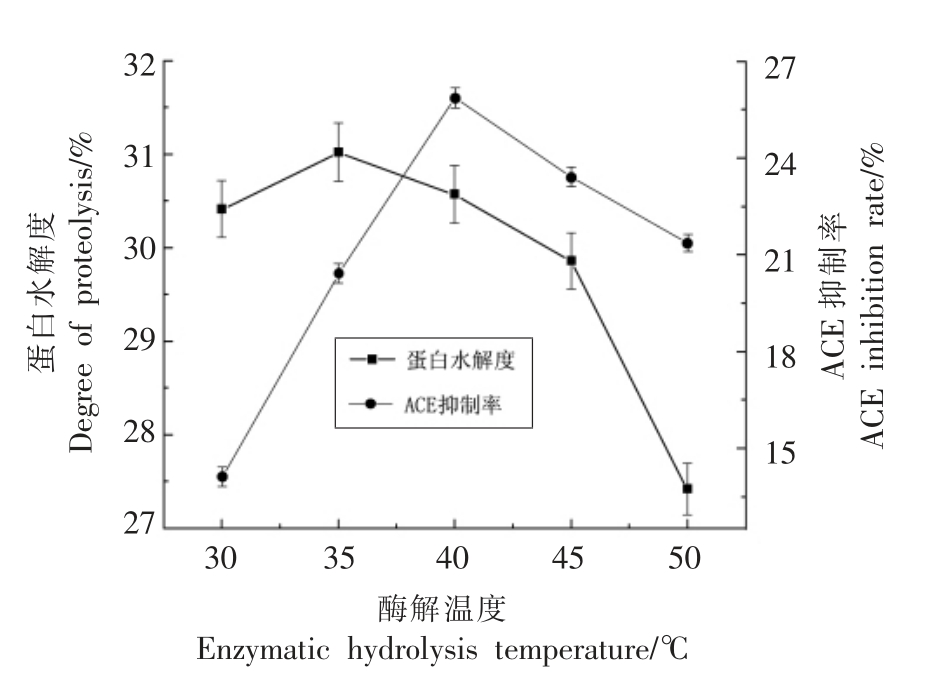
图4 蛋白酶酶解温度对双孢菇蛋白水解的影响
Fig.4 Effect of temperature on the hydrolysis of Agaricus bisporus protein
2.2.4 溶液pH 值对酶解效果的影响 将原料蛋白以1∶30 的料水比制成溶液,添加5 mg/100 mL 的碱性蛋白酶,将溶液置于40 ℃水浴锅中,用1.0 mol/L 的NaOH 溶液调节上述溶液pH 值,分别在不同的pH 值下酶解90 min,以ACE 抑制率和蛋白水解度为指标,确定碱性蛋白酶的最佳pH 值,结果如图5所示。
由图5可知,随着酶解pH 值的升高,蛋白水解度也逐渐增大。当pH 值增加到8.0 后,蛋白水解度变化不大,由于碱性蛋白酶对pH 值不敏感,因此蛋白水解度变化较小;而ACE 抑制率随着pH 值的升高呈先增加后减小的趋势,由于一些对碱敏感的活性肽随着pH 值的升高而失活,从而造成ACE 抑制率的降低。其中,pH 值为8.0时,ACE 抑制率最大。因此,本试验以pH 8.0 为中心点进行后续的响应面优化试验。
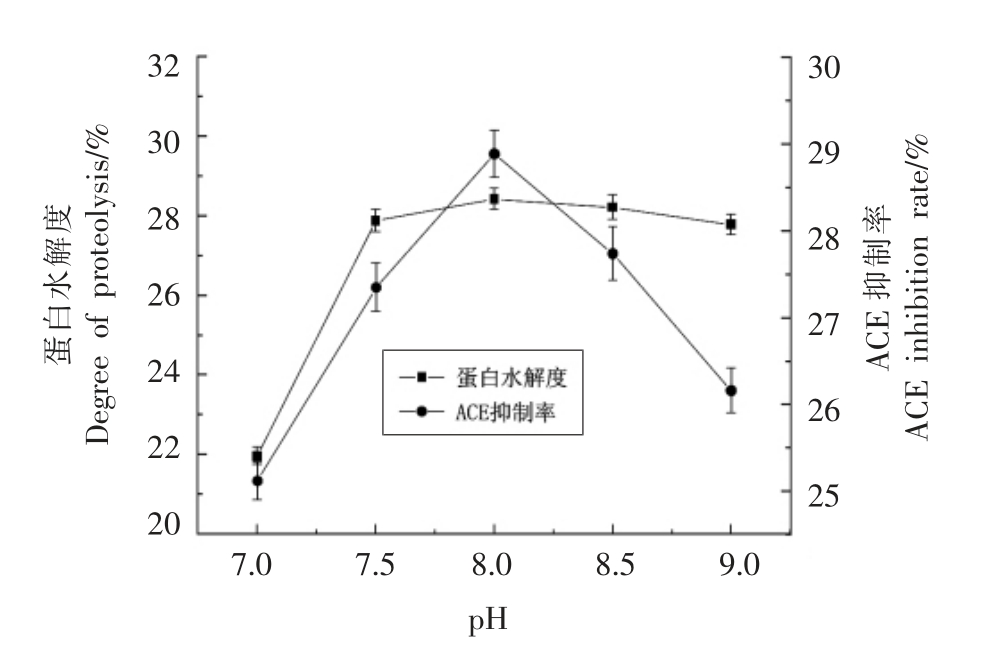
图5 溶液pH 对双孢菇蛋白酶解的影响
Fig.5 Effect of pH on proteolysis of Agaricus bisporus protein
2.2.5 酶解时间对酶解效果的影响 将原料蛋白以1∶30 的料水比制成溶液,调节溶液pH 值为8.0,添加5 mg/100 mL 的碱性蛋白酶在40 ℃水浴锅中酶解不同时间,以ACE 抑制率和蛋白水解度为指标,确定最佳的酶解时间。结果如图6所示。
由图6可知,随着酶解时间的延长,蛋白水解度显著升高,然而当酶解时间达到90 min 时,蛋白水解度和ACE 抑制率均达到峰值,之后随着酶解时间的延长,ACE 抑制率有所下将,可能因为有些活性肽被酶解成一些游离氨基酸或一些没有活性的肽,进而造成ACE 抑制率的降低。因此,本试验以90 min 为酶解时间的中心点进行后续的响应面优化试验。
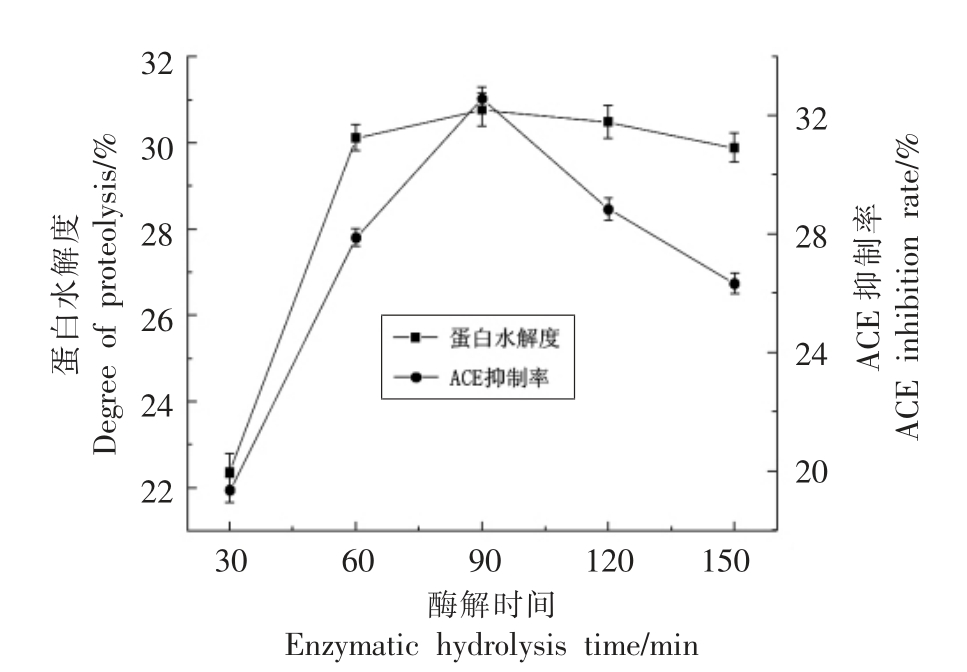
图6 酶解时间对双孢菇蛋白酶解的影响
Fig.6 Effect of enzymolysis time on proteolysis of Agaricus bisporus protein
2.3 响应面优化试验
根据单因素实验结果可知,影响双孢菇蛋白质水解制备ACE 抑制肽的主要因素有:pH 值、酶添加量、水解时间和水解温度。因此,选择这4 个影响因素进行响应面中心组合设计进行优化,响应面试验结果见表2,方差分析表见表3。
表2 响应面试验结果
Table 2 Response surface test results
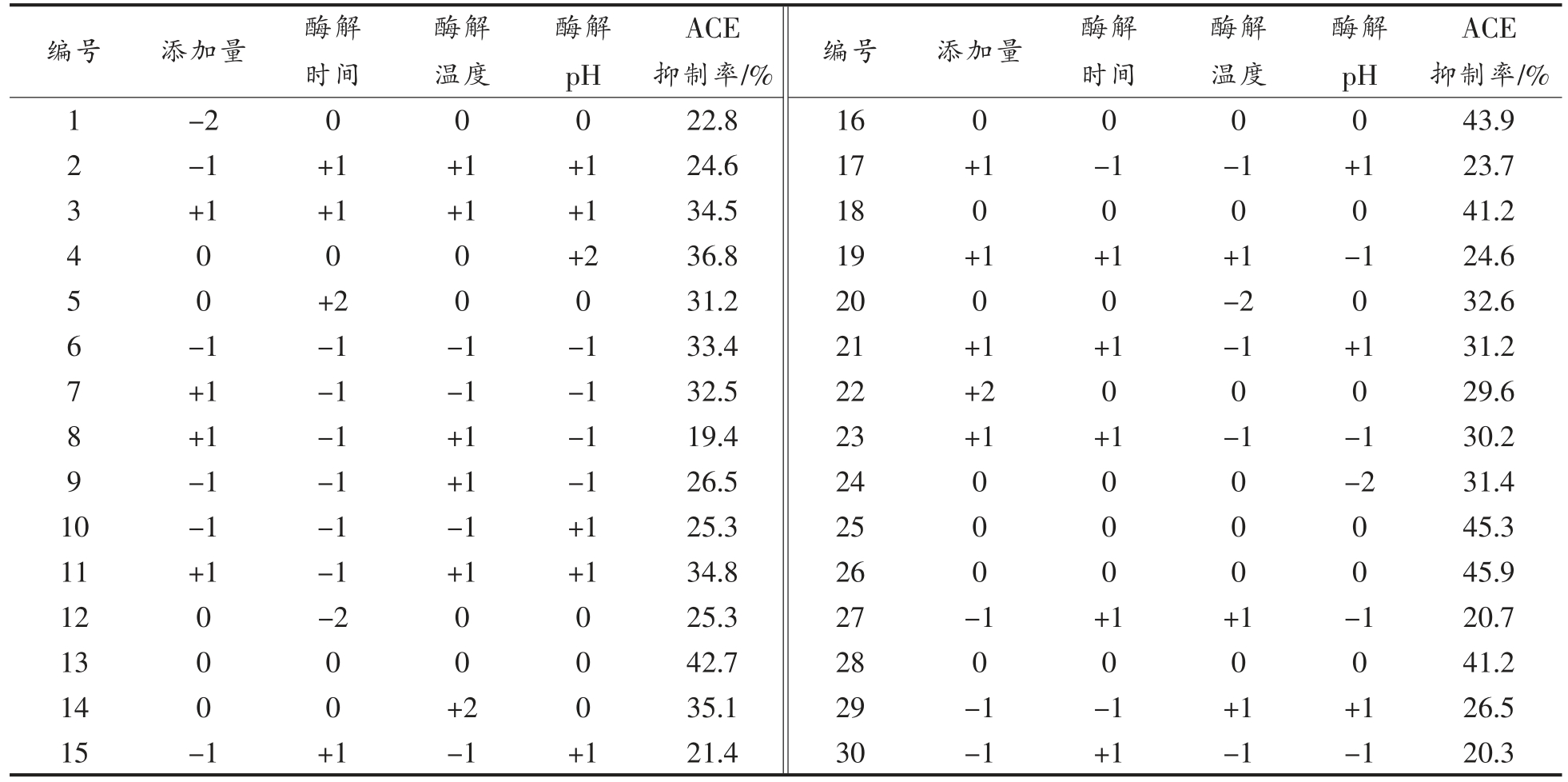
编号 添加量 酶解时间酶解pH 1-2 0 0 0 2-1 +1 +1 +1 3 +1 +1 +1 +1 4 0 0 0 +2 5 0 +2 0 0 6-1-1-1-1 7 +1-1-1-1 8 +1-1 +1-1 9-1-1 +1-1 10-1-1-1 +1 11 +1-1 +1 +1 12 0-2 0 0 13 0 0 0 0 14 0 0 +2 0 15-1 +1-1 +1酶解温度ACE抑制率/%22.8 24.6 34.5 36.8 31.2 33.4 32.5 19.4 26.5 25.3 34.8 25.3 42.7 35.1 21.4编号16 17 18 19 20 21 22 23 24 25 26 27 28 29 30添加量0+1 0+1 0+1+2+1 000-10-1-1酶解时间0-1 0+1 0+1 0+1 000+10-1+1酶解温度0-1 0+1-2-1 0-1 000+10+1-1酶解pH 0+1 0-1 0+1 0-1-2 00-10+1-1 ACE抑制率/%43.9 23.7 41.2 24.6 32.6 31.2 29.6 30.2 31.4 45.3 45.9 20.7 41.2 26.5 20.3
对响应面试验数据进行分析处理,得到的二次多项式方程:
Y = 43.37+1.91A-0.12B-0.27C+1.05D+2.18AB-0.14AC+1.29AD+0.56BC + 1.09BD +2.75CD-4.86A2-4.35B2-3.26C2-2.89D2
式中,Y——ACE 抑制率 (%),A——蛋白酶添加量(mg/100 mL),B——酶解温度(℃),C——酶解pH 值,D——酶解时间(min)。由表3可知,该模型显著(F=8.89,P<0.0001)。模型的决定系数R2=0.8924,并且失拟项不显著,说明该模型拟合度较好,是相对可靠的。4 个因素的显著性影响大小依次为:酶添加量>酶解时间>pH 值>水解温度。其中,蛋白酶添加量和酶解时间表现显著,因此,可以看出蛋白酶添加量和酶解时间对于双孢菇蛋白水解液ACE 抑制率的影响较大。由表3中的方差分析表可以看出,蛋白酶添加量与酶解温度、酶解时间与溶液pH 值的交互作用较明显(P<0.05),其交互作用如图7和图8所示。
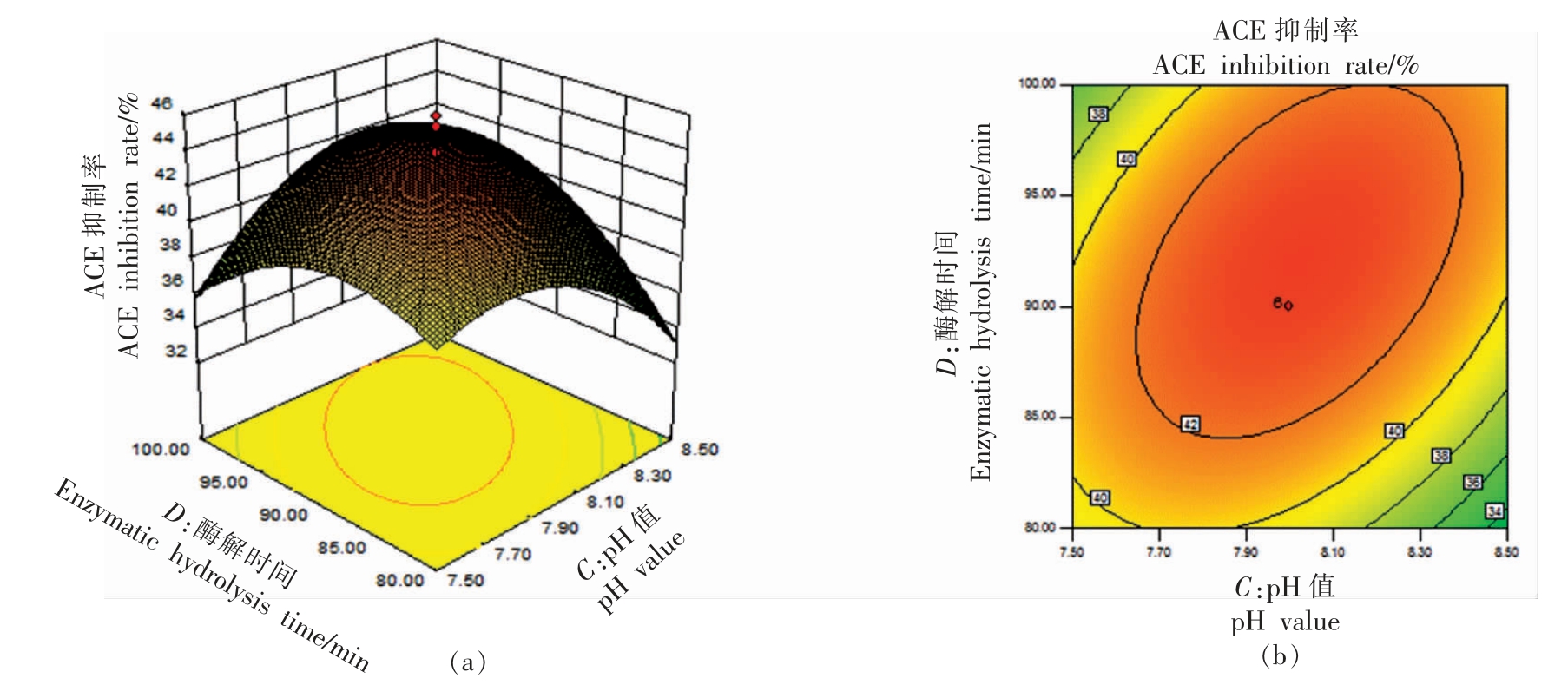
图8 pH 值与酶解时间的交互作用
Fig.8 Interaction between pH value and enzymolysis time
表3 方差分析表
Table 3 Analysis of variance
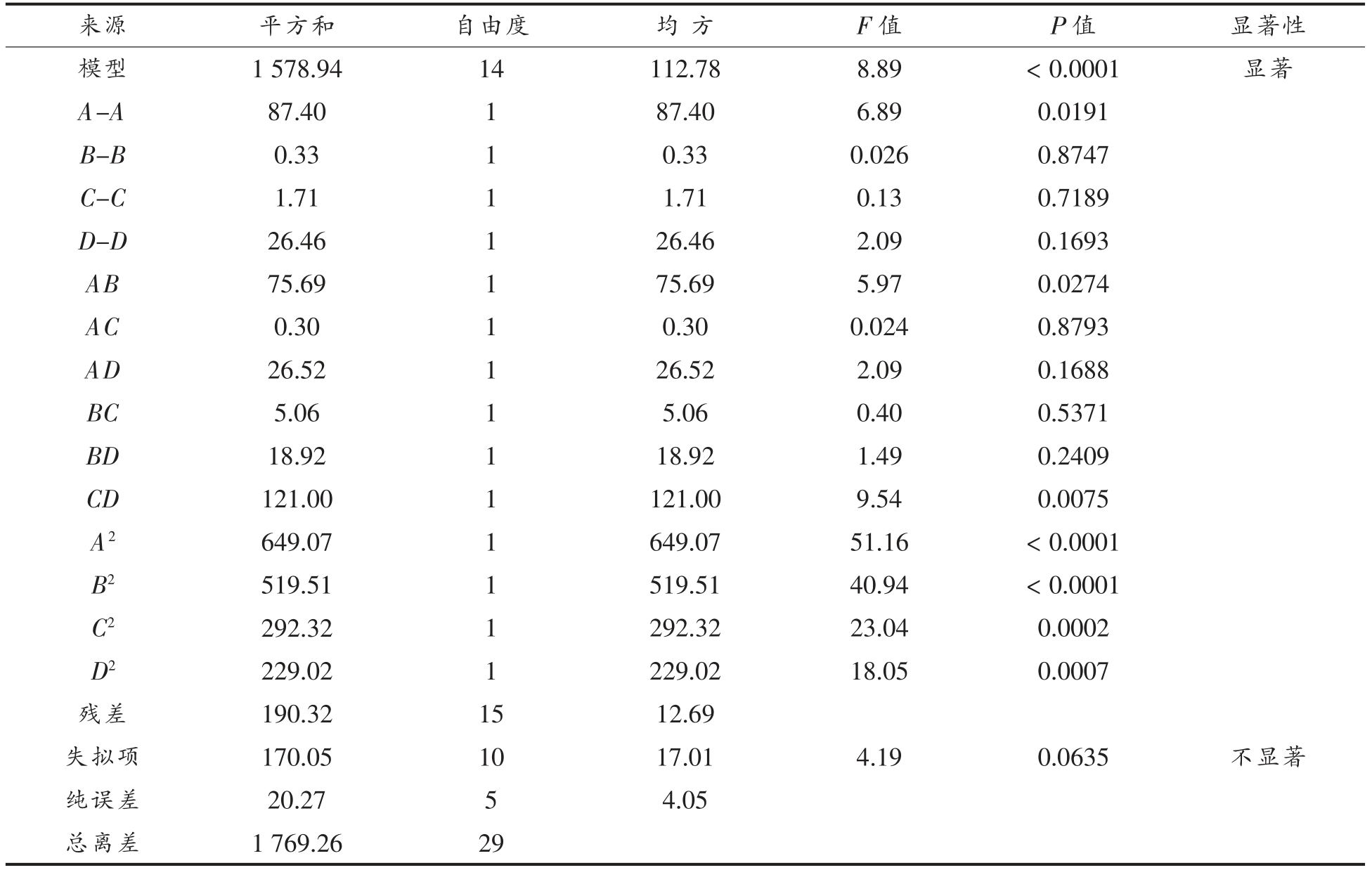
来源 平方和 自由度 均 方 F 值 P 值 显著性模型 1 578.94 14 112.78 8.89 <0.0001 显著A-A 87.40 1 87.40 6.89 0.0191 B-B 0.33 1 0.33 0.026 0.8747 C-C 1.71 1 1.71 0.13 0.7189 D-D 26.46 1 26.46 2.09 0.1693 AB 75.69 1 75.69 5.97 0.0274 AC 0.30 1 0.30 0.024 0.8793 AD 26.52 1 26.52 2.09 0.1688 BC 5.06 1 5.06 0.40 0.5371 BD 18.92 1 18.92 1.49 0.2409 CD 121.00 1 121.00 9.54 0.0075 A2 649.07 1 649.07 51.16 <0.0001 B2 519.51 1 519.51 40.94 <0.0001 C2 292.32 1 292.32 23.04 0.0002 D2 229.02 1 229.02 18.05 0.0007残差 190.32 15 12.69失拟项 170.05 10 17.01 4.19 0.0635 不显著纯误差 20.27 5 4.05总离差 1 769.26 29
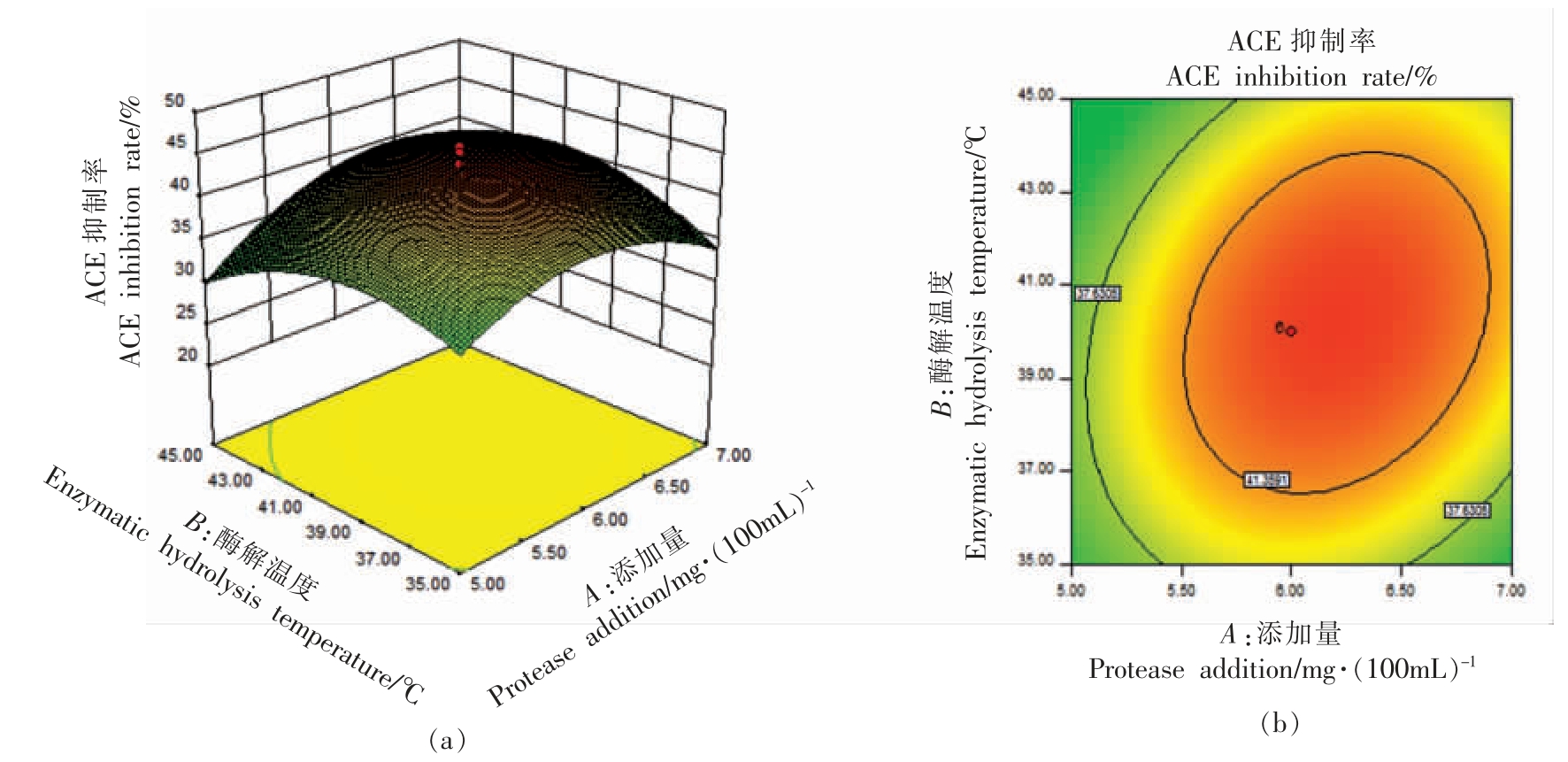
图7 蛋白酶添加量与酶解温度的交互作用
Fig.7 Interaction between protease addition and enzymolysis temperature
以上两图可直观反映pH 值与温度、酶添加量与反应时间的相互作用对ACE 抑制率的影响。网状图形上部空间曲面的陡峭程度反映的是此自变量因素对ACE 抑制率响应值的影响程度,位于图像下部等值线图的椭圆离心率则反映了因素互相作用的效果大小。各曲面顶点是影响酶解效果各作用因素的最佳条件。用Design Expert 8.0 软件预测得到的理论最优酶解条件为:碱性蛋白酶添加量6.25 mg/100 mL,酶解温度40.47 ℃,酶解时间92.97 min,酶解pH 值8.04,此时ACE 抑制率可达到43.75%。在该条件下进行验证试验,测得水解液的ACE 抑制率为43.4%。
3 讨论
食源性活性肽的研究与开发一直受到科学家们的高度关注[18-21],特别是食源性血管紧张素转换酶(ACE)抑制肽[22-24]。许新月[25]对杏鲍菇蛋白质的提取以及复合酶酶解杏鲍菇蛋白质提取ACE 抑制肽工艺进行了优化,同时测定了ACE 抑制肽的体外降血压活性,发现酶解温度50 ℃、酶解pH 7.0、酶解时间60 min、碱性蛋白酶与复合蛋白酶配比为4∶3(质量比)时,ACE 抑制率为67.1%。说明酶法水解食用菌蛋白可以获得高效的ACE 抑制肽,并能更好的利用食用菌蛋白,从而提高原料的利用率,可为食用菌的高值利用提供一定的理论依据。然而,某些高蛋白含量的材料不一定都能够通过酶解法制备ACE 抑制肽。因此,在制备食源性ACE 抑制肽的过程中,原料的选择与制备条件对ACE 抑制肽的活性及得率具有十分重要的影响。
食用菌ACE 抑制肽的制备目前以直接提取法为主[9],而直接提取法只适用于动植物中存在的一些天然生物活性肽,由于天然生物活性肽含量极微,组成复杂,提取分离纯化成本高,种类单一,且此种方法分离的ACE 抑制肽来源有限。生物酶解法因具有生产条件温和,水解过程可控,并且可以充分酶解原料中的蛋白,从而大大提高了获得新型生物活性肽的可能性[26]。加入酶后,势必会断裂底物中更多的肽键位点,从而使目标蛋白中的小肽和游离氨基酸的量大大增加,提高蛋白质的水解度[27-28],同时,也增加了获得潜在的生物活性肽的机会。然而,酶解法也可能会出现过度酶解的现象,从而造成一些ACE 抑制肽进一步被水解成小分子短肽或游离氨基酸,进而影响其ACE 抑制活性。同时,在本研究的单因素实验中,发现温度和pH 值对活性肽的影响也比较严重。由于酶解条件的控制对ACE 抑制肽活性的影响至关重要,因此,本研究优化了酶解工艺,确保得到稳定、高活性的ACE 抑制肽。
本研究利用双孢菇工业化生产的一些残次品,通过对蛋白酶酶解条件的优化,获得了具有潜在活性的ACE 抑制肽,并且计算了其得率,为24.36 mg/g,工业化生产前景良好,可为双孢菇产业残次副产物的高值利用提供有效途径。然而通过酶法获得的ACE 抑制肽,其具体的序列结构、机体内的稳定性以及具体的作用机理尚不明确,接下来将做进一步研究。
4 结论
本试验以工厂化生产的双孢菇菇柄、异形菇等边角料为原料,通过超声波辅助酶法获得了具有潜在活性的ACE 抑制肽,并对其工艺进行了优化,确定了最佳蛋白酶为碱性蛋白酶,其优化后的工艺参数为:碱性蛋白酶添加量6.25 mg/100 mL,酶解温度40.47 ℃,酶解时间92.97 min,酶解pH值8.04,此时ACE 抑制率可达到43.75%。在该条件下进行验证试验,测得水解液的ACE 抑制率为43.4%,得率为24.36 mg/g,工业化生产前景良好。结果显示,超声波辅助酶法酶解双孢菇蛋白制备ACE 抑制肽,可为酶法水解食用菌蛋白制备ACE抑制肽和双孢菇产业边角料高值利用提供一定的理论依据和新途径。
[1]宋婷婷,范丽军,冯伟林.不同水稻品种的稻草栽培双孢蘑菇比较试验[J].食药用菌,2020,28(4):268-271.
SONG T T,FAN L J,FENG W L.Comparative test on cultivation of Agaricus bisporus with straw of different rice varieties[J].Edible and Medicinal Fungi,2020,28(4):268-271.
[2]党仪安.双孢菇抗氧化肽的制备工艺研究[D].泰安:山东农业大学,2019.
DANG Y A.Study on processing technology of an tioxidant polypeptide from Agaricus Bisporus[D].Tai'an:Shandong Agricultural University,2019.
[3]刘君昂,李琳,周国英.双孢蘑菇的研究现状及其在湖南地区的发展前景[J].安徽农业科学,2007,35(5):1346-1347,1350.
LIU J A,LI L,ZHOU G Y.Research progress of Agricus bisporus and development prospect in hunan province[J].Anhui Agricultural Sciences,2007,35(5):1346-1347,1350.
[4]刘佳,王桂瑛,程志斌,等.云南野生食用菌天然风味调料的开发前景[J].安徽农业科学,2016,44(23):41-42,79.
LIU J,WANG G Y,CHENG Z B,et al.Exploitation prospect of natural flavoring for wild edible fungus in Yunnan province[J].Anhui Agricultural Sciences,2016,44(23):41-42,79.
[5]李勇.生物活性肽研究现况和进展[J].食品与发酵工业,2007,33(1):3-9.
LI Y.Current status and progress of research on bioactive peptides[J].Food and Fermentation Industry,2007,33(1):3-9.
[6]LIU C,FANG L,MIN W,et al.Exploration of the molecular inter-actions between angiotensin-I-converting enzyme (ACE) and the inhibitory peptides derived from hazelnut (Corylus heterophylla Fisch)[J].Food Chemistry,2018,245(11):471-480.
[7]ZHANG T,LI M,FU X,et al.Purification and charicterization of angiotensin I-converting enzyme(ACE) inhibitory peptides with specific structure XPro[J].European Food Research & Technology,2019,245(12):333-338.
[8]刘文颖,周明,冯晓文,等.乳清低聚肽的血管紧张素转化酶抑制作用及其稳定性研究[J].食品与发酵工业,2020,46(16):24-29,36.
LIU W Y,ZHOU M,FENG X W,et al.Study on stability and ACE inhibitory activity of whey oligopeptide[J].Food and Fermentation Industry,2020,46(16):24-29,36.
[9]许新月,崔文玉,柏雨岑,等.食用菌ACE 抑制肽制备及其功能活性研究进展[J].山东农业科学,2019,51(11):157-160,167.
XU X Y,CUI W Y,BO Y C,et al.Research progress of preparation and function activity of ACE inhibitory peptide from edible fungus[J].East Agricultural Science,2019,51(11):157-160,167.
[10]PAIVA L,LIMA E,NETO A I,et al.Isolation and characterization of angiotensin I-converting enzyme (ACE) inhibitory peptides from Ulva rigida C.Agardh protein hydrolysate[J].Journal of Functional Foods,2016,26(7):65-76.
[11]KANG M G,KIM Y H,BOLORMAA Z,et al.Characterization of an antihypertensive angiotensin Iconverting enzyme inhibitory peptide from the edible mushroom Hypsizygus marmoreus [J].BioMed Re search International,2013,2013(29):283-964.
[12]TRAN H B,YAMSMOTO A,MATSUMOTO S,et al.Hypotensive effects and angiotensin-converting enzyme inhibitory peptides of reishi (Ganoderma lingzhi) auto-digested extract[J].Molecules,2014,19(9):13473-13485.
[13]伍善广,孙红娜,孙建华,等.茶树菇中降压活性蛋白提取工艺优化[J].南方医科大学学报,2010,30(6):1264-1267.
WU S G,SUN H J,SUN J H,et al.Technical optimization for extracting hypotensive active peptides from Agrocybe aegerita[J].Journal of Southern Medical University,2010,30(6):1264-1267.
[14]孙红娜.茶树菇降血压活性肽的提取分离研究[D].南宁:广西大学,2008.
SUN H N.Study on extraction and separation of antihypertensive peptides from Agrocybe aegerita[D].Nanning:Guangxi University,2008.
[15]JANG J H,JEONG S C,KIM J H,et al.Characterisation of a new antihypertensive angiotensin Iconverting enzyme inhibitory peptide from Pleurotus cornucopiae[J].Food Chemistry,2011,127(2):412-418.
[16]潘迎捷,谭琦,陈明杰,等.我国食用菌产业发展的回顾与展望[J].食用菌学报,2001,8(2):1-9.
PAN Y J,TAN Q,CHEN M J,et al.Retrospect and prospect of development mushroom industry in China[J].Acta Edible Fungi,2001,8(2):1-9.
[17]SHALABY S M,MILA Z,JEANETTE O.Performance of two commonly used angiotensin-converting enzyme inhibition assays using FA-PGG and HHL as substrates[J].Journal of Dairy Research,2006,73(2):178-86.
[18]阮晓慧,韩军岐,张润光,等.食源性生物活性肽制备工艺、功能特性及应用研究进展[J].食品与发酵工业,2016,42(6):248-253.
RUAN X H,HAN J Q,ZHANG R G,et al.Progress in the preparation,functional properties and applications of food-derived bioactive peptides[J].Food and Fermentation Industry,2016,42(6):248-253.
[19]BAH C S,CARNE A,MCCONNELL M A,et al.Production of bioactive peptide hydrolysates from deer,sheep,pig and cattle red blood cell fractions using plant and fungal protease preparations[J].Food Chemistry,2016,202(2):458-466.
[20]PIOVESANA S,CAPRIOTTI A L,CAVALIERE C,et al.Recent trends and analytical challenges in plant bioactive peptide separation,identification and validation[J].Analytical & Bioanalytical Chemistry,2018,410(15):1-20.
[21]RUTHERFURD-MARKWICK K J,MOUGHAN P J.Bioactive peptides derived from food[J].Journal of AOAC International,2005,88(3):955-966.
[22]DASKAYADIKMEN C,YUCETEPE A,KARBANCIOGLUGULER F,et al.Angiotensin-I-converting enzyme (ACE)-Inhibitory peptides from plants[J].Nutrients,2017,9(4):316-335.
[23]RUDOLPH S,LUNOW D,KAISER S,et al.Identification and quantification of ACE-inhibiting peptides in enzymatic hydrolysates of plant proteins[J].Food Chemistry,2017,224(12):19-25.
[24]梁婷婷,佟立涛,蒲华寅,等.动植物源蛋白体外消化产物结构性质及ACE 抑制活性[J].食品科学,2018,39(4):6-12.
LIANG T T,TONG L T,PU H Y,et al.Structures and angiotensin converting enzyme (ACE) inhibitory activity of in Vitro digests of animal and plant proteins[J].Food Science,2018,39(4):6-12.
[25]许新月.超声辅助酶法制备杏鲍菇降血压活性多肽工艺优化[D].泰安:山东农业大学,2020.
XU X Y.Optimization of ultrasonic assisted enzymatic preparation of antihypertensive peptides from Pleurotus Eryngii[D].Tai'an:Shandong Agricultural University,2020.
[26]王晓丹,薛璐,胡志和,等.ACE 抑制肽构效关系研究进展[J].食品科学,2017,38(5):305-310.
WANG X D,XUE L,HU Z H,et al.Progress in research on structure-activity relationship of ACE inhibitory peptides[J].Food Science,2017,38(5):305-310.
[27]张萍,陈合,廖娜.复合酶水解乳清蛋白制备抗氧化肽的工艺优化[J].乳业科学与技术,2017,40(5):8-11.
ZHANG P,CHEN H,LIAO N.Process optimization for preparation of antioxidant peptides by enzymatic hydrolysis of whey protein concentration with protamex[J].Journal of Dairy Science and Technology,2017,40(5):8-11.
[28]黄金梅,胡居吾,高红,等.米渣肽双酶两步水解法制备过程中物化特性与结构变化[J].食品与发酵工业,2019,45(16):32-39.
HUANG J M,HU J W,GAO H,et al.Physicochemical properties and peptide pattern changes in rice dreg peptides prepared by double enzyme hydrolysis[J].Food and Fermentation Industry,2019,45(16):32-39.