鸡蛋营养丰富,含有人体所必需的多种蛋白质、脂肪、碳水化合物、无机盐及维生素等,被称为“人类理想的营养库”。其所含的必需氨基酸量与人体基本相符,生物效价高,是一种优质的蛋白质来源,在食品领域具有很高的加工价值。除了营养价值外,其蛋清蛋白还具有许多功能特性,如起泡性、凝胶性、乳化性等,特别是蛋清蛋白的起泡性,广泛应用于蛋糕、冰淇淋等食品中。蛋清中含有40 多种蛋白质,其主要蛋白组分为卵清蛋白(~54%)、卵类黏蛋白(~11%)、卵转铁蛋白(~12%)、卵黏蛋白(~3.5%)和溶菌酶(~3.4%)[1]。蛋清蛋白出色的起泡能力归因于其不同组分蛋白在搅打过程中,吸附在空气-水界面上相互作用的能力[2]。优化蛋清蛋白的起泡性,研究烘焙类食品的专用蛋液十分必要,将有利于提高该类食品加工的生产效率,降低生产成本。
蛋清蛋白的起泡性受诸多因素影响,如蛋白质浓度[3]、pH[4]、温度[5]、离子强度[6]、分子间的相互作用[7]等。此外,贮藏条件对鸡蛋新鲜度有很大影响。随着贮藏时间的延长,蛋清中浓厚蛋白逐渐稀化,稀薄蛋白的含量越来越高,这在一定程度上会影响蛋清蛋白的起泡性。基于这些因素,国内外学者采用不同的方法来改善蛋清蛋白的起泡特性,主要有化学改性、物理改性、酶法改性和基因工程改性。其中,化学改性中使用的化学试剂可能会对健康造成不利影响,如引起中毒、食物过敏和营养受损等,在食品工业中的应用十分有限[8]。酶法改性由于成本高,作用时间长,灭酶困难等弊端限制了其广泛应用,而基因工程改性因其技术周期长,操作繁琐,见效慢等原因而没有重大进展。相比以上方法,物理改性受到国内外学者的关注。超声作为非热处理中物理改性方式之一,以能耗低,安全、环保,对产品营养特性影响较小等优点而引起研究人员的关注[9]。超声可分为高频低场强超声(100 kHz~1 MHz,场强<1 W/cm2)和低频高场强超声(20~100 kHz,场强为10~1 000 W/cm2)。其中,高频低场强的超声主要用于食品的无损检测,低频高场强的超声通常用于食品蛋白质分子的改性修饰[10]。高场强超声的改性作用主要与其产生的空化作用、动态搅拌、剪切应力以及湍流有关[8]。空穴的循环生成和坍塌在黏性介质中引起理化变化,气泡的快速坍塌在周围的液体中产生剪切力,当剪切力足够强时,就可破坏在体相聚集体中的共价键[11]。
一些研究表明,高场强超声可以通过改变蛋白质的分子特性,从而引起蛋白质结构和功能特性发生变化。Gülseren 等[12]研究了高强度超声处理对牛血清白蛋白水溶液结构和功能特性的影响,发现超声处理牛血清蛋白,其表面活性和表面疏水性明显增强,游离巯基基团数量减少,且蛋白质的二级结构变得更为有序。Jambrak 等[13]分别采用20 kHz 和40 kHz 超声处理乳清蛋白,观察到乳清蛋白的电导率下降,溶解度增加,起泡能力和起泡稳定性均有明显改善。Stefanovic等[14]用超声处理蛋清蛋白溶液,发现超声处理增强了起泡性,这可能与超声处理引起蛋清蛋白的部分展开有关。部分展开的柔性蛋白在界面处快速吸附并展开。本试验主要探究不同超声功率和时间对蛋清蛋白起泡性的影响,找出超声处理改善蛋清蛋白起泡性的最优组合。
1 材料与方法
1.1 材料与试剂
新鲜海兰褐鸡蛋,湖北武汉市九峰新月鸡场。磷酸盐缓冲液 (Phosphate buffered saline,PBS),中国Biosharp 生物技术有限公司;其它化学试剂均为分析纯级。
1.2 仪器与设备
XHF-DY 高速均质器,浙江赛德仪器设备有限公司;FS-600N 超声分散仪,上海生析超声仪器有限公司;FE20 数显pH 计、AR2140 电子分析天平,上海梅特勒-托利多仪器有限公司;IKA Works Inc 磁力搅拌器,德国IKA 公司;IM-25 制冰机,常熟市雪科电器有限公司;APA2000 激光粒度分布仪、Nano-ZS Zeta 电位-激光粒度仪,英国马尔文仪器有限公司;AR2000ex 流变仪,美国TA仪器公司;TRACKER-S 界面流变张力仪,法国泰克利斯公司。
1.3 试验方法
1.3.1 样品制备 在 (4±1)℃下贮存的新鲜鸡蛋经洗涤、人工破碎后,将蛋清与蛋黄分离。使用磁力搅拌器在4 ℃下搅拌2 h,以得到均匀的蛋清液样品。将所有样品用1 mol/L 盐酸和1 mol/L 氢氧化钠调节pH 值至8.0 左右,随后进行超声处理,设置不同超声功率(120,240 W),不同超声时间(0,1,5,10,20,30 min)。将80 mL 蛋清液放入100 mL 烧杯中,使超声探头置于蛋清液面下2~3 cm 处,整个超声过程中在冰水浴中进行,以防止超声处理导致蛋清液的局部过热,对试验结果造成影响。
1.3.2 起泡性的测定 采用An 等[15]的方法测定发泡性能,稍加修改。将超声处理后的20 mL 新鲜蛋清溶液在25 ℃下9 000 r/min 均质1 min。通过比较2 min 时的泡沫体积与样品的初始液体体积来测量起泡力(FA),将静置30 min 时的泡沫体积与样品的初始泡沫体积进行比较,以确定泡沫稳定性(FS)。
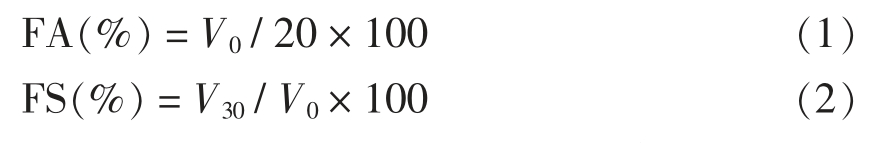
式中,V0——2 min 时的泡沫体积(mL);V30——静置30 min 时的泡沫体积(mL)。
1.3.3 Zeta 电位的测定 将蛋清液用PBS 溶液(pH=7.4)稀释至0.1 mg/mL,用胶头滴管往Zeta 电位皿中加入3 mL 左右蛋清液,排出Zeta 电位皿中的气泡。使用Zeta 电位-激光粒度仪测定蛋清液的Zeta 电位。所有测量均在25 ℃下进行,重复3 次。
1.3.4 粒径的测定 使用激光粒度分布仪测定超声处理后的新鲜蛋清溶液,设定蛋白折射率为1.450,吸收指数为0.001。所有测量均在25 ℃下进行,重复3 次。
1.3.5 表面张力的测定 参考Lajnaf 等[16]的方法,使用界面流变张力仪进行动态表面张力的测定。在计算机的驱动下,注射器针尖形成轴对称的气滴,该注射器浸没在含有蛋白质溶液的比色皿中。将注射器-比色皿系统放置在光源和高速电荷耦合器件(CCD)相机之间的光学平台上。CCD 摄像机连接到视频采集卡板上,以1 帧/s 的速度将图像记录到计算机的硬盘驱动器上,然后根据拉普拉斯方程,通过分析所产生的气滴轮廓来计算界面张力。所有测试均在控制仪器温度为 (20±1)℃下进行。
1.3.6 流变特性的测定 按照Wang 等[17]的描述,使用流变仪测定蛋清的动态流变。将蛋清蛋白样品放置在直径为60 mm 的平板上,设置平板间隙为1.0 mm。除去平板以外多余的样品溶液,表面涂上甘油,以防止水分蒸发。恒定频率为1 Hz,在0.01%~100%的应变范围内,确定振动振幅模式下的线性黏弹性区域。随后,在黏弹性线性范围内,得到了0.1~10 Hz 频率范围内的弹性模量G' (储能模量)和黏性模量G''(损耗模量)。最后,在剪切速率模式下,得到了剪切速率在1~100 1/s 之间变化时的表观黏度。所有程序均在25 ℃下恒温进行。
1.4 统计学分析
所有试验均一式3 份,每个样品均一式2 份进行分析测定。数据以“平均值±标准差”表示,并使用单因素方差分析(ANOVA)进行分析(P<0.05)以评估结果的显着性。使用SPSS 软件(版本19.0)通过Duncan 的多范围测试比较数据。使用Origin软件(版本8.5)绘制图片。
2 结果与分析
2.1 超声处理对蛋清蛋白起泡性的影响
通常泡沫是一种两相体系,泡沫的形成取决于蛋白质分子在空气-水界面上的迁移、展开和重排[18]。蛋白质的起泡力由蛋白质的溶解度、表面活性决定,而泡沫稳定性是由蛋白质的黏度、成膜性决定。图1a、图2a 表明了蛋清蛋白在120 W 超声处理条件下,随着超声时间的延长,起泡力呈先增大后降低的趋势,在20 min 处达到最大为266.7%,是未处理蛋清(38.89%)的6.9 倍;而泡沫稳定性则先降低后有所增加,在5 min 时最低,为77.27%。由此可见,高场强超声有效地提高了蛋清蛋白的起泡力,超声的空化效应和机械作用能够降低蛋白质分子的聚集程度,提高蛋白质吸附到空气-水界面的速率。然而在起泡力有所改善的同时,泡沫稳定性却有所下降,这可能主要与超声处理降低蛋清液的黏度有关。由图1b 可知,相较于120 W 超声处理,在240 W 超声处理下,蛋清液的起泡力没有得到明显改善,最大起泡力仅为68.75%,这可能是由于在更高功率的超声作用下,蛋清中的蛋白质重新发生聚集,表面张力变大所致。因此适当的超声作用能够提高蛋清蛋白的起泡力,使蛋清中的蛋白质在溶液中分散得更广,折叠蛋白打开的更多,有利于蛋白质在界面上的扩散吸附,而超声作用增强到一定程度,则会导致起泡力下降。也有一些研究表明超声处理是一种快速提高蛋白质起泡性能的有效方法,Arzeni等[19]研究了超声对于蛋清蛋白功能特性的影响,发现超声处理后,蛋白质的表观黏度降低,表面疏水性增强,显著提高了蛋清蛋白的起泡特性。朱建华等[20]认为随着超声时间的延长以及超声功率的增大,大豆分离蛋白表面张力显著降低,表面疏水性有所提高,从而显著改善了大豆分离蛋白的起泡性能。
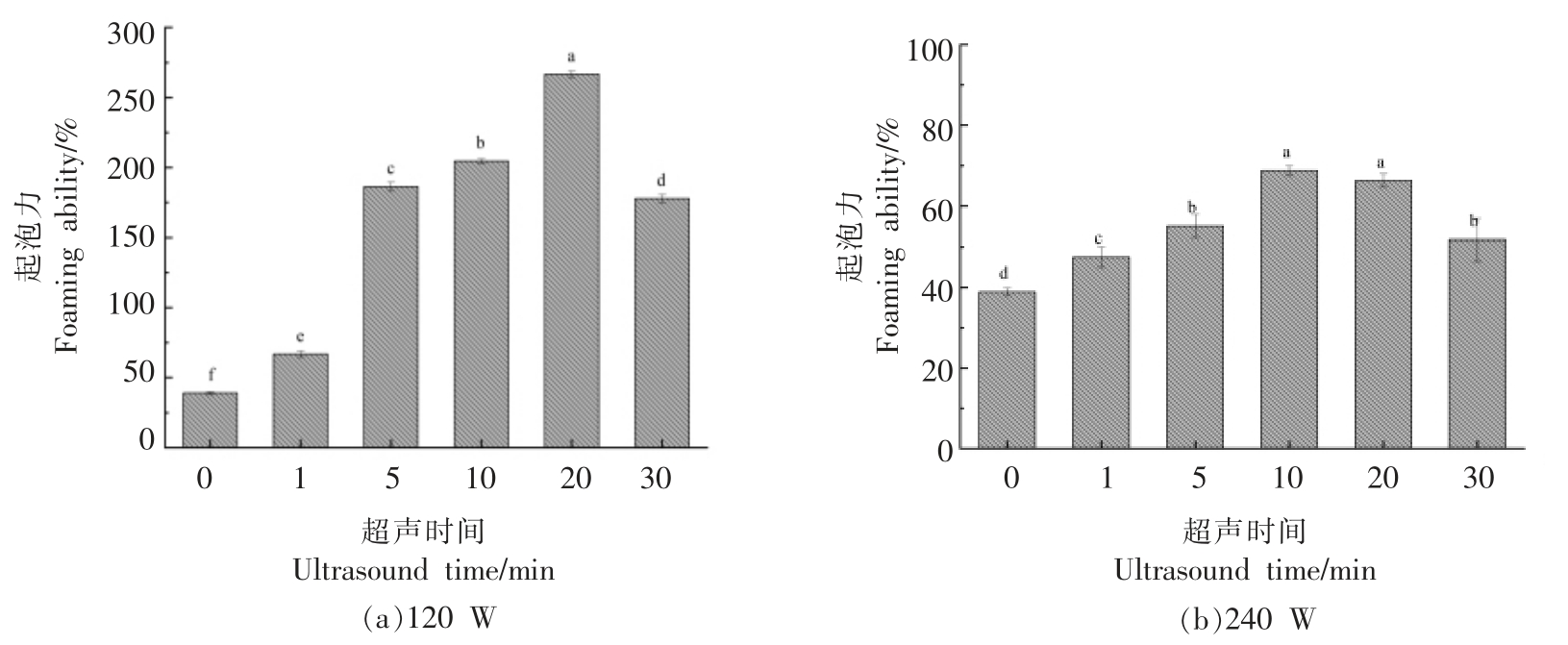
图1 不同超声条件下蛋清蛋白起泡力随超声时间的变化
Fig.1 Changes of foaming ability at different ultrasonic time
注:a~f 表示在单因素方差分析(ANOVA)下样品差异显著,P <0.05。
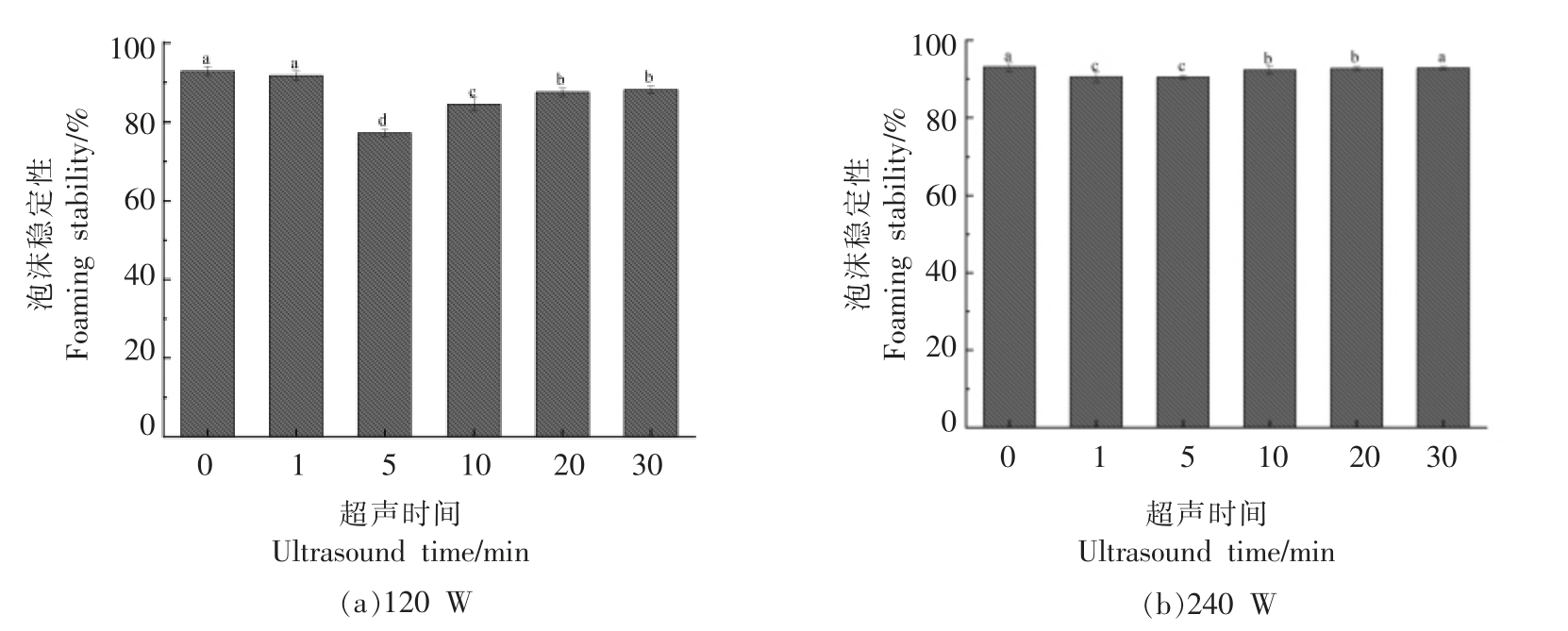
图2 不同超声条件下蛋清蛋白泡沫稳定性随超声时间的变化
Fig.2 Changes of foaming stability at different ultrasonic time
注:a~f 表示在单因素方差分析(ANOVA)下样品差异显著,P <0.05。
2.2 超声时间对蛋清蛋白粒径分布的影响
蛋白质的粒径分布直接取决于蛋白质分子间的分散和聚集状况,因此可以将粒径的分布变化作为测量蛋白质聚集程度的一项指标。如图3所示,在120 W 超声处理下,超声前20 min 内,蛋清液粒径整体随超声时间的增加呈左移趋势,且小粒径区域面积显著增大。与未经超声处理的蛋清液相比,超声20 min 的蛋清液中小粒径部分(<100 nm)占比明显增加,由20.92%增加到43.39%;相应地,大粒径区域(>100 nm)占比由79.08%减小到56.31%。这可能是由于超声处理破坏了氢键、疏水和静电相互作用等非共价结合力,使蛋白质颗粒破裂,促进颗粒解体,减小了蛋白质的粒径;而超声30 min 时大粒径区域面积有所增大(由56.31%增大到74.4%),这可能是由于更高强度的超声作用暴露出更多的疏水性基团,这些基团通过疏水和静电作用相互交联,使蛋白质重新生成聚集体,从而增加了蛋白质的粒径大小。蛋白质的聚集程度对其在气液界面上的界面吸附有着很大影响,因此显著影响了起泡性能。较小尺寸的蛋白分子可以迅速扩散并吸附到界面上,有利于提高蛋白质的起泡性。而较大的蛋白分子可以增加界面膜的厚度,并减慢泡沫中液体的排放速度,因而提高了蛋白质的泡沫稳定性[21]。李弓中等[10]也报道了类似的结果,在超声15 min 内,蛋清蛋白的粒径向小粒径方向移动,平均粒径明显降低;然而随着超声时间的延长,蛋清蛋白的粒径向大粒径方向移动,平均粒径显著增大。然而Gülseren等[12]和Jiang 等[9]却得到不同的结果,即超声处理分别增加了牛血清蛋白和黑豆分离蛋白的粒径。在相对较低的超声处理下,湍流力可能会增加碰撞和聚集速度,使得蛋白质形成不稳定的聚集体而导致粒径增大。
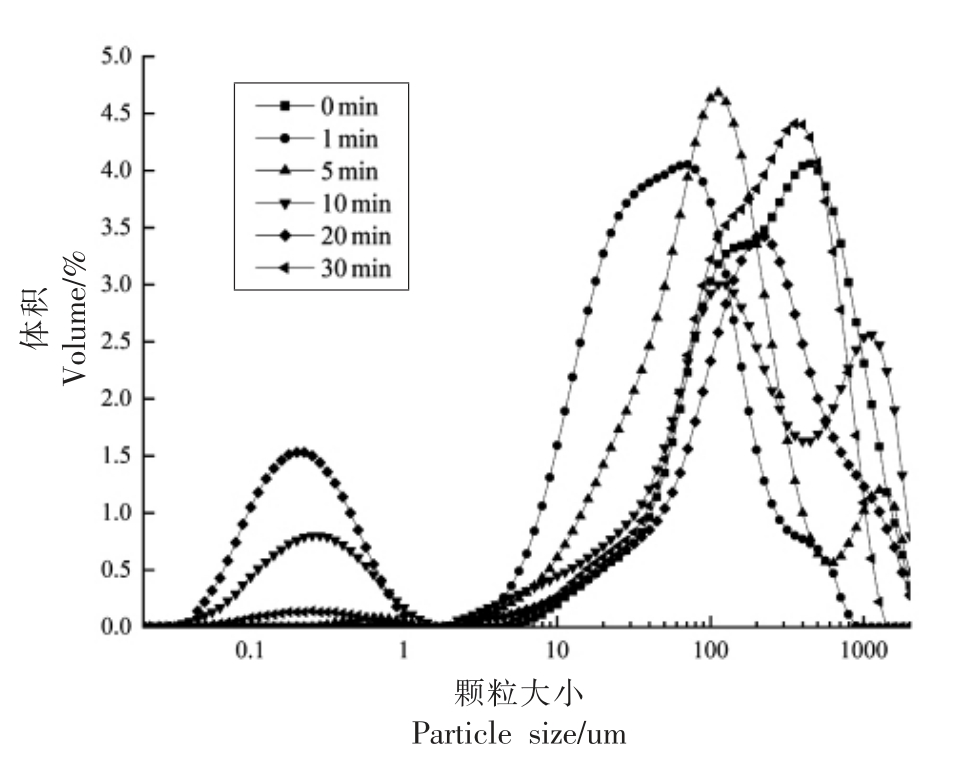
图3 不同超声时间下蛋清蛋白粒径分布变化
Fig.3 Changes of egg white particle size distribution under different ultrasound time
2.3 超声时间对蛋清蛋白Zeta 电位的影响
Zeta 电位可以用来评估胶体分散体系的稳定性,并表明蛋白质分子之间的静电斥力和相互作用的程度[22]。由于蛋白质是以胶体形式分散在水溶液中,因此Zeta 电位是描述蛋白质表面电荷的关键参数。蛋白质的起泡特性在接近其等电点时达到最佳,这是因为净中性电荷蛋白质的静电排斥作用最小,蛋白质吸附到界面的速度最快。
由图4可知,随着超声时间的延长,Zeta 电位的绝对值呈先下降后上升的趋势,未处理蛋清的绝对电位(-14.47 mV)明显高于超声处理20 min(-8.16 mV),这表明超声处理后,蛋白质的表面负电荷减少了,这可能是因为超声处理暴露了更多带正电的基团,从而中和了带电粒子的电位。蛋白质表面净电荷含量减少,气液界面上的吸附能垒降低,从而提高了蛋白质的界面吸附速率,有利于起泡性。然而,Zeta 电位绝对值的降低表明蛋清液体系的不稳定性增加,不利于泡沫稳定性,这也就可以解释超声处理能提高蛋清液的起泡性,却降低了其泡沫稳定性。同样Xiong 等[23]在研究高强度超声对卵清蛋白的改性作用中,得到了超声处理会引起蛋白质结构和构象发生不可逆变化,导致卵清蛋白表面净电荷减少,提高了其界面吸附速率。
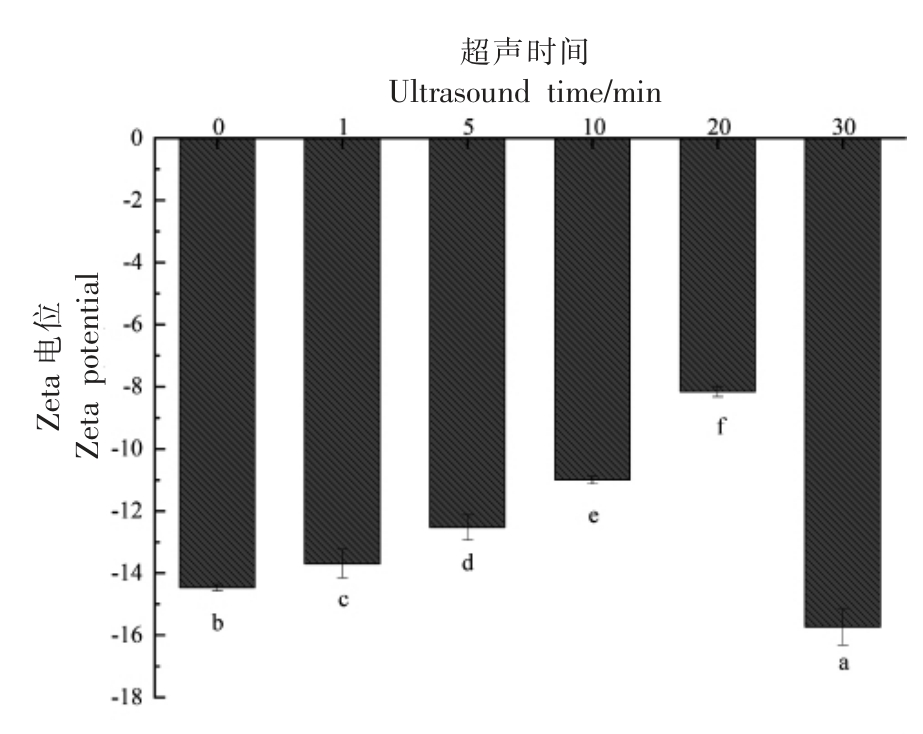
图4 不同超声时间下蛋清蛋白Zeta 电位变化
Fig.4 Zeta potential changes of egg white under different ultrasound time
注:a~f 表示在单因素方差分析(ANOVA)下样品差异显著,P <0.05。
2.4 超声时间对蛋清蛋白表面张力的影响
空气-水界面的表面张力称为两亲性分子之间的范德华相互作用。这些两亲性蛋白分子吸附到界面上,导致表面张力降低[24]。表面张力是起泡性的主要决定因素,并且表面张力降低的速度越快,则说明蛋白质的吸附速度越快[25]。图5显示了不同超声时间处理下,蛋清蛋白在空气-水界面处表面张力的变化。随着吸附时间的延长,所有样品的表面张力都显示出逐渐降低的趋势,在最初的1 500 s 中表面张力迅速降低,这表明蛋白质分子在空气-水界面迅速扩散并重排,而后表面张力下降趋于平稳,这意味着蛋白质在界面上的吸附逐渐趋于饱和,从而在吸附和重排过程中形成了能垒。
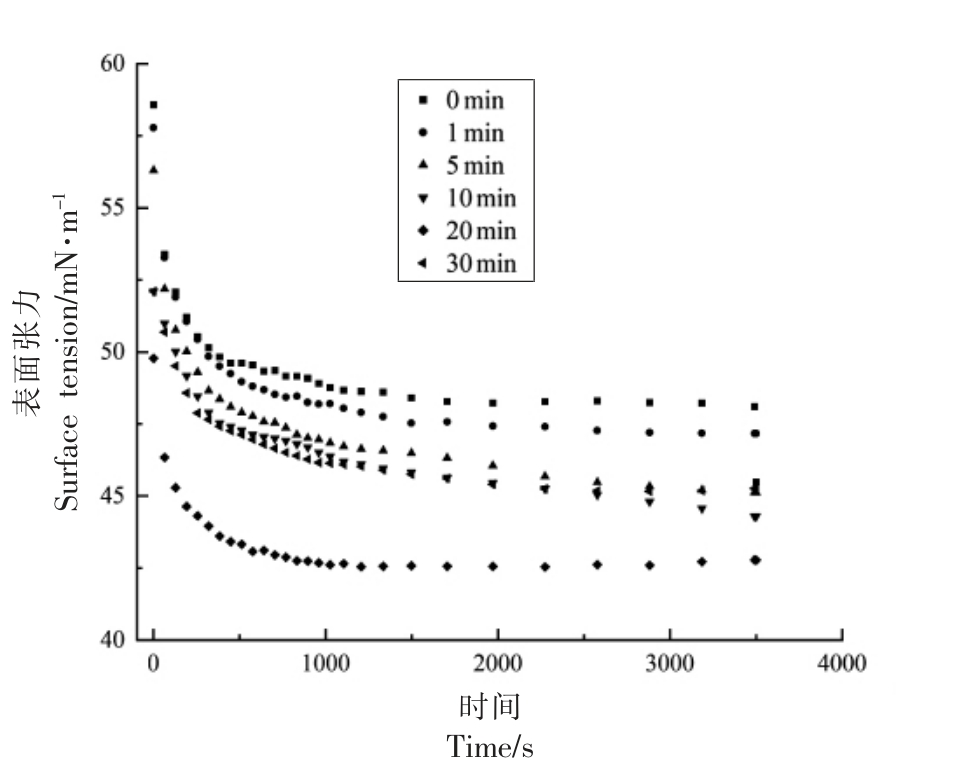
图5 不同超声时间下蛋清蛋白表面张力的变化
Fig.5 Changes of egg white surface tension under different ultrasound time
由图6可知,超声20 min 时的表面张力(43.18 mN/m)明显低于未处理蛋清液(49.62 mN/m),这表明超声处理显著降低了蛋清蛋白的表面张力,并且随超声时间的延长呈先下降后上升的趋势,这也与起泡性的趋势相对应。Xiong 等[23]发现较低的表面张力与较小的粒径大小及较少的表面净电荷有关,这可以减小静电势垒,加快蛋白质在空气-水界面的吸附速率,蛋白质分子能快速扩散至界面,并有利于蛋白质分子在界面上的展开和重排,从而有利于提高起泡性。
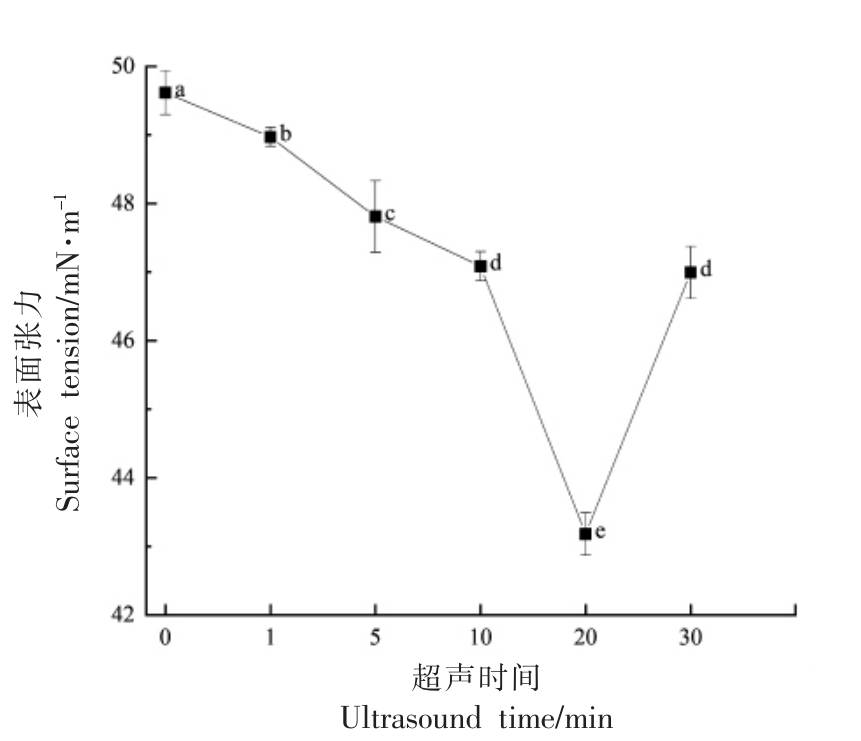
图6 吸附时间为550 s 时蛋清液的表面张力
Fig.6 The surface tension of egg white with adsorption time of 550 s
注:a~f 表示在单因素方差分析(ANOVA)下样品差异显著,P <0.05。
2.5 超声处理对蛋清蛋白流变特性的影响
几乎所有蛋白质都具有发泡能力,然而由于不同蛋白质的流变特性不同,其起泡性和泡沫稳定性往往也存在差异[26]。图7、8 显示了不同超声时间对蛋清液剪切流变特性的影响,可以看出在120 W 超声处理下前20 min 内,弹性模量(G')和黏性模量(G'')均呈现下降趋势,这可能是由于超声处理减弱了蛋白质之间的相互作用,导致其黏弹性降低,有利于蛋白质分子吸附到界面处,有利于泡沫的形成,而不利于泡沫稳定性。超声30 min时,G' 和G'' 有所回升,这可能是由于更高强度的超声处理使得更多的巯基基团暴露,蛋白质分子
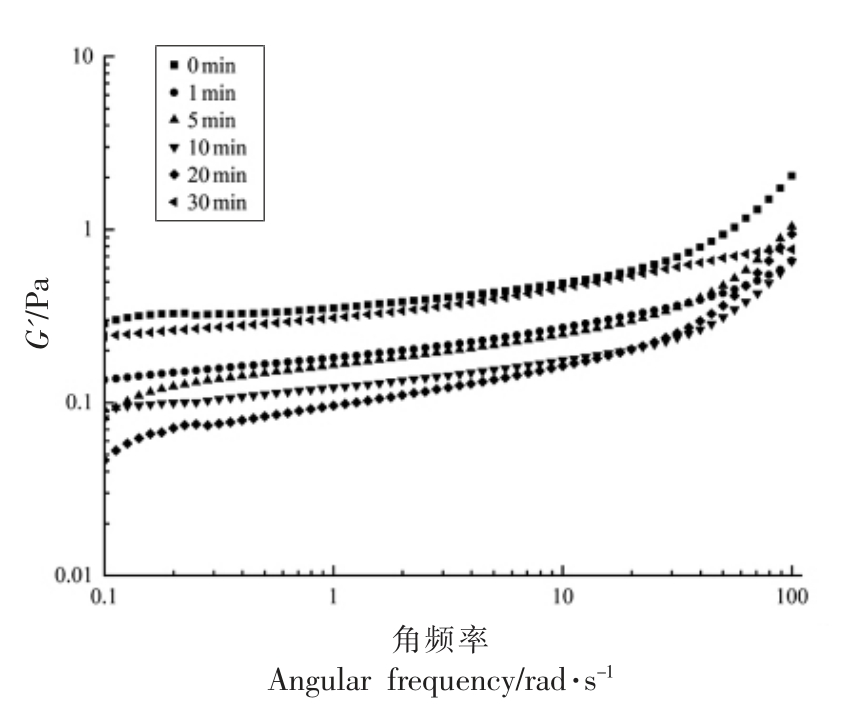
图7 不同超声时间下蛋清蛋白G' 的变化
Fig.7 Changes of egg white protein G'under different ultrasound time
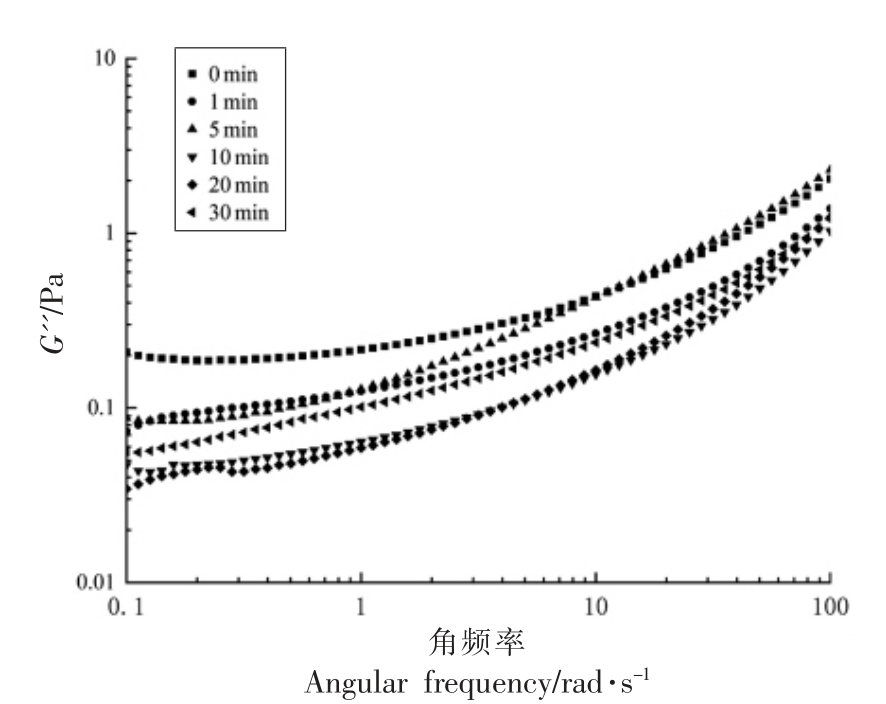
图8 不同超声时间下蛋清液G'' 的变化
Fig.8 Changes of egg white protein G''under different ultrasound time
由图9所示,蛋白的表观黏度随剪切速率的增加而降低,表现出剪切变稀的假塑性流体特征。剪切稀化行为可能是由于在剪切力的作用下蛋白质分子之间的非共价键断裂,从而引起蛋白质聚集体破碎导致;并且在剪切过程中蛋白质分子也会向剪切方向进行定向重排,导致流动阻力减小。在相同的剪切速率下,与未经超声处理的蛋清液相比,超声处理显著减小了蛋清液的表观黏度,在超声处理20 min 时降至最低。这主要与超声处理减小了蛋清蛋白的粒径有关。随着超声时间的延长,超声30 min 时表观黏度又有所增大,可能是由于更高强度的超声作用引起蛋白质重新聚集,蛋清蛋白粒径增大所致。这与超声处理对蛋清液黏弹性模量的影响一致,表明适当的超声强度破坏了蛋白分子内部的非共价键,使得蛋白质分子间的相互作用减弱。
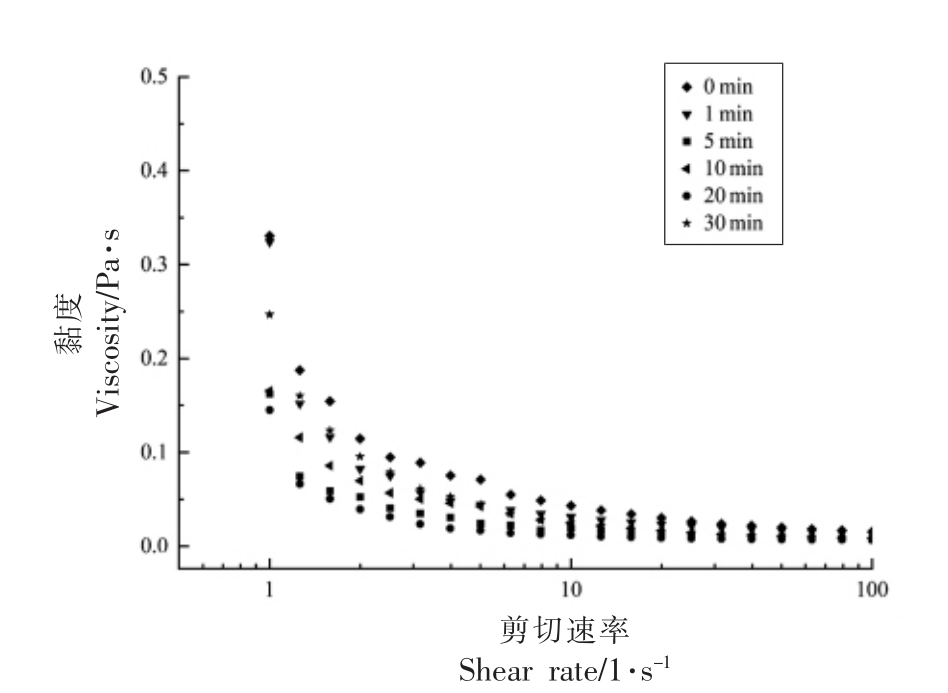
图9 不同超声时间下蛋清蛋白表观黏度的变化
Fig.9 Changes of egg white apparent viscosity under different ultrasonic time
为了更加直观的观察到蛋清蛋白流变特性随超声时间的变化,记录了角频率为1 rad/s 时G',G'' 和损耗角正切(tanδ)的数据,以及拟合powerlaw 模型得出的相关参数(图10,表1)。原蛋清溶之间重新生成二硫键[27],相互作用增强,该现象也与粒径的增大相对应。在整个频率扫描过程中,蛋清蛋白的G' 和G'' 均随角频率的增加迅速增加,且G' 总是大于G'',这表明蛋清蛋白在气液界面的界面膜一直以弹性为主导,表现出黏弹性固体的性质。液的G' 和G'' 显著高于超声处理20 min 时(分别为0.35 Pa 下降到0.09 Pa,0.21 Pa 下降到0.05 Pa)。通常tanδ 的降低表明样品倾向变得更具弹性,蛋白质结构更接近于固态,这不利于泡沫的形成。可以看到超声30 min 时tanδ 最小,这也与超声30 min 时起泡性的下降有关。此外,所有拟合曲线的R2 都大于0.9,说明不同超声时间处理下的蛋清液对power-law 模型具有很高的相关性,拟合效果较好。由表1可知,黏度系数k 也随着超声时间的延长呈先降低后上升的趋势,k 值的降低说明超声处理降低了蛋清液体系的黏度和流动阻力,与表观黏度曲线的变化趋势相对应。所有样品的流动特性指数n<1,也表明样品均呈假塑性流体特征,延长超声时间并没有改变蛋清液的流体特征。
表1 角频率为1 rad/s 时频率扫描的数据记录(G',G'' 和tanδ)以及拟合power-law 模型的相关参数(k,n)
Table 1 The frequency sweep data (G',G'' and tanδ) were obtained at an angular frequency of 1 rad/s,and the parameters (k,n) of fitting the power-law model
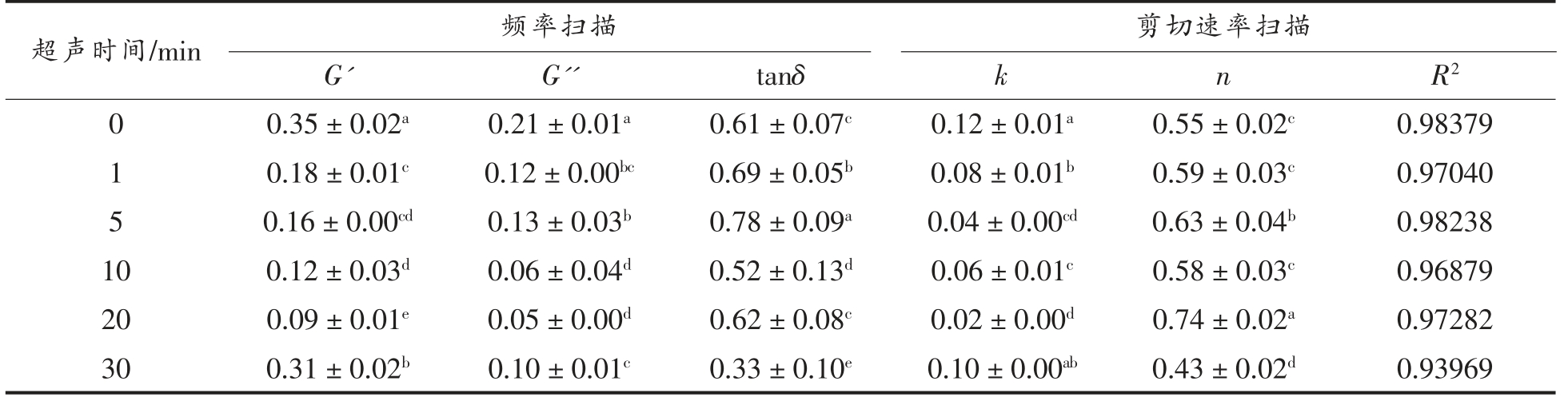
超声时间/min 频率扫描 剪切速率扫描G' G'' tanδ k n R2 0 0.35±0.02a 0.21±0.01a 0.61±0.07c 0.12±0.01a 0.55±0.02c 0.98379 1 0.18±0.01c 0.12±0.00bc 0.69±0.05b 0.08±0.01b 0.59±0.03c 0.97040 5 0.16±0.00cd 0.13±0.03b 0.78±0.09a 0.04±0.00cd 0.63±0.04b 0.98238 10 0.12±0.03d 0.06±0.04d 0.52±0.13d 0.06±0.01c 0.58±0.03c 0.96879 20 0.09±0.01e 0.05±0.00d 0.62±0.08c 0.02±0.00d 0.74±0.02a 0.97282 30 0.31±0.02b 0.10±0.01c 0.33±0.10e 0.10±0.00ab 0.43±0.02d 0.93969
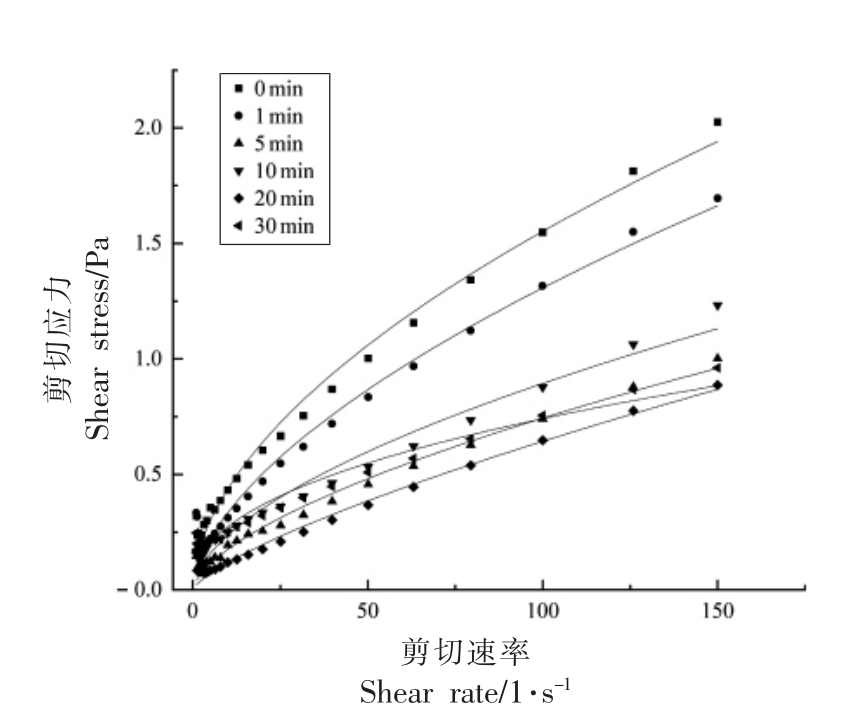
图10 不同超声时间下蛋清液剪切应力与剪切速率的关系曲线
Fig.10 Relationship between shear stress and shear rate of egg white under different ultrasonic time
3 结论
本试验利用超声技术来处理蛋清蛋白溶液以期改善其起泡性,发现相比240 W 超声处理,120 W 超声条件下更能显著提高蛋清蛋白的起泡性,这可能是由于高强度的超声作用使原本松弛展开的蛋白质又重新聚集,不利于蛋白质快速吸附到气液界面。延长超声时间,蛋清蛋白的起泡性呈现先升高后下降的趋势,然而均明显高于未处理蛋清;泡沫稳定性则呈先降低后缓慢上升的趋势。最终得出在超声功率为120 W,超声时间为20 min时获得最大起泡力。随着超声时间的延长,蛋清液的表面张力、粒径和绝对Zeta 电位值均呈先下降后上升的趋势,在20 min 时达到最低,较低的表面张力、粒径和绝对Zeta 电位值有利于蛋白质的界面吸附、展开和重排。流变分析结果表明,随着超声时间的延长,黏弹性模量、表观黏度均表现出先下降后升高的趋势。拟合power-law 模型的结果显示所有样品均具有较好的拟合效果,且流动特性指数n<1,表明样品均呈假塑性流体特征,延长超声时间并没有改变蛋清液的流体特征。本研究通过超声处理显著提高了蛋清液的起泡特性,并对其改善机理进行了探究,拓宽了超声波技术在食品加工领域的应用范围。
[1]LI-CHAN E C Y,POWRIE W D,NAKAI S.The chemistry of eggs and egg products[M].UK:Macmillan Education,1986:97-139.
[2]FARHAD A,TIAN Z G,CHEN L Y,et al.Effect of CaCl2 on the stability and rheological properties of foams and high-sugar aerated systems produced by preheated egg white protein[J].Food Hydrocolloids,2020,106:105887.
[3]LAU K,DICKINSON E.Structural and rheological properties of aerated high sugar systems containing egg albumen[J].Journal of Food Science,2004,69(5):232-239.
[4]KUROPATWA M,TOLKACH A,KULOZIK U.Impact of pH on the interactions between whey and egg white proteins as assessed by the foamability of their mixture[J].Food Hydrocolloids,2009,23(8):2174-2181.
[5]LOMAKINA K,MIKOVA K.A study of the factors affecting the foaming properties of egg white-a review[J].Czech Journal of Food Sciences,2006,24(3):110-118.
[6]KATO A,TAKAHASHI A,MATSUDOMI N,et al.Determination of foaming properties of proteins by conductivity measurements[J].Journal of Food Science,1983,48(1):62-65.
[7]RAIKOS V,CAMPBELL L,EUSTON S R.Effects of sucrose and sodium chloride on foaming properties of egg white proteins[J].Food Research International,2007,40(3):347-355.
[8]MIRMOGHTADAIE L,ALIABADI S S,HOSSEINI S M,et al.Recent approaches in physical modification of protein functionality[J].Food Chemistry,2016,199:619-627.
[9]JIANG L,WANG J,LI Y,et al.Effects of ultrasound on the structure and physical properties of black bean protein isolates[J].Food Research International,2014,62:595-601.
[10]李弓中,赵英,王俊彤,等.超声处理对蛋清蛋白结构性质及蛋清液起泡性的影响 [J].食品科学,2019,40(9):68-75.
LI G Z,ZHAO Y,WANG J T,et al.Effect of ultrasonic treatment on protein structure and physicochemical and foaming properties of liquid egg white[J].Food Science,2019,40(9):68-75.
[11]GÜZEY D.Modification of protein structure and functionality using high-intensity ultrasound[D].U S A e Tennessee:The University of Tennessee at Chattanooga,2002.
[12]GÜLSEREN I,GÜZEY D,BRUCE B D,et al.Structural and functional changes in ultrasonicated bovine serum albumin solutions[J].Ultrasonics Sonochemistry,2007,14(2):173-183.
[13]JAMBRAK A R,MASON T J,LELAS V,et al.Effect of ultrasound treatment on solubility and foaming properties of whey protein suspensions[J].Journal of Food Engineering,2008,86(2):281-287.
[14]STEFANOVI C A B,JOVANOVIC J R,DOJCI NOVIC M B,et al.Effect of the controlled highintensity ultrasound on improving functionality and structural changes of egg white proteins[J].Food &Bioprocess Technology,2017,10(7):1224-1239.
[15]AN Y,CUI B,WANG Y et al.Functional properties of ovalbumin glycosylated with carboxymethyl cellulose of different substitution degree[J].Food Hydrocolloids,2014,40:1-8.
[16]LAJNAF R,PICART-PALMADE L,ATTIA H,et al.Foaming and adsorption behavior of bovine and camel proteins mixed layers at the air/water interface[J].Colloids & Surfaces B Biointerfaces,2017,151:287-294.
[17]WANG P,CHEN H,MOHANAD B,et al.Effect of frozen storage on physico-chemistry of wheat gluten proteins:Studies on gluten-,glutenin-and gliadin-rich fractions[J].Food Hydrocolloids,2014,39:187-194.
[18]CHEN Y,SHENG L,GOUDA M,et al.Studies on foaming and physicochemical properties of egg white during cold storage[J].Colloids & Surfaces A Physicochemical & Engineering Aspects,2019,582:123916.
[19]ARZENI C,PÉREZ O E,PILOSOF A M R.Functionality of egg white proteins as affected by high intensity ultrasound[J].Food Hydrocolloids,2012,29(2):308-316.
[20]朱建华,杨晓泉,熊犍.超声处理对大豆蛋白表面性质的影响[J].食品与发酵工业,2005,31(3):16-20.
ZHU J H,YANG X Q,XIONG J.The effect of ultrasonic treatment on the surface properties of soy protein[J].Food Fermentation and Industries,2005,31(3):16-20.
[21]DAVIS J P,FOEGEDING E A.Comparisons of the foaming and interfacial properties of whey protein isolate and egg white proteins[J].Colloids & Surfaces B Biointerfaces,2007,54(2):200-210.
[22]LI P S,SUN Z,MA M H,et al.Effect of microwave-assisted phosphorylation modification on the structural and foaming properties of egg white powder[J].Elsevier LWT,2018,97:151-156.
[23]XIONG W F,WANG Y T,ZHANG C L,et al.High intensity ultrasound modified ovalbumin:Structure,interface and gelation properties[J].Ultrasonics-Sonochemistry,2016,31:302-309.
[24]MASON T J,PANIWNYK L,LORIMER J P.The uses of ultrasound in food technology[J].1996,3(3):253-260.
[25]WANG P,TAO H,WU F,et al.Effect of frozen storage on the foaming properties of wheat gliadin[J].Food Chemistry,2014,164:44-49.
[26]刘冉,曾庆华,王振宇,等.超声波处理对大豆分离蛋白凝胶流变性和凝胶形成的影响[J].食品工业科技,2020,41(21):87-92,98.
LIU R,ZENG Q H,WANG Z Y,et al.Effects of ultrasonic treatment on gel rheological properties and gel formation of soybean protein isolate[J].Food Industry Technology,2020,41(21):87-92,98.
[27]GHARBI N,LABBAFI M.Effect of processing on aggregation mechanism of egg white proteins[J].Food Chemistry,2018,252:126-133.