食品在保藏过程中易发生腐败变质,保鲜膜是常用的解决方法之一[1],目前被广泛应用于制作食品保鲜膜的材料主要有塑料、金属、纸等[2]。这些材料虽能够达到保鲜食品的目的,但存在一些缺点,如:材料不易降解[3],金属离子析出[4]和机械性能差[5]等问题。开发新型无毒、可降解且机械性能高的包装材料成为研究者需要攻克的难题。常见的无毒可降解材料包括天然多糖、蛋白质[6]以及合成的高分子材料,如聚乳酸、聚乙烯醇和聚乙二醇等[7]。为了提高膜的机械性能,Guo 等[8]将甲基纤维素(MC)和聚乳酸(PLA)混合,结果表明,MC/PLA质量比在99∶1~9∶1 范围时,MC/PLA 膜的拉伸强度和延伸率均显著提高,甲基纤维素/聚乳酸(97∶3)膜的拉伸强度和伸长率是最优的,分别比纯甲基纤维素膜高30%和35%。Pan 等[9]将氧化石墨烯加入壳聚糖中,结果表明,纳米复合材料的断裂强度和拉伸模量分别显著提高了93%和51%。Narges 等[10]通过浇注法将不同质量分数(0.1%,0.5%,1%) 的纳米壳聚糖或纳米纤维素加入羧甲基纤维素(CMC)膜溶液中,结果表明,纳米复合膜的拉伸强度和断裂伸长率随质量分数的增加而提高。目前,将功能性的天然物质添加到高分子聚合物中是研究热点。
魔芋葡甘聚糖(Konjac glucomannan,KGM)是从魔芋块茎中提取的多糖之一,是一种非常重要的生物可再生资源。KGM 的分子链由D-葡萄糖和甘露糖以1∶1.6 的物质的量比通过分子β-1,4-糖苷键连接,每19 个糖残基上有1 个乙酰基[11]。由于KGM 具有可生物降解性、高黏度、无毒性、成膜能力以及资源丰富[12],因此被广泛应用于制备食品包装薄膜。Lin 等[13]用KGM 开发一种新型的高性能活性食品包装:魔芋葡甘聚糖/聚乳酸/反式-肉桂酸微膜(KPTMF)。Zou 等[14]以高直链玉米淀粉(HCS)和KGM 为基料,研制甘油增塑复合膜-HCS/KGM 复合膜。Wu 等[15]将红甘蓝花青素(RCA)固定在氧化甲壳素纳米晶体(O-ChNCs)/KGM 基质中,制备一种智能活性膜。然而,KGM水溶性高,力学性能差,无抗菌性,限制了其发展[16-17]。近年来,研究者提出许多构建活性食品包装膜的方法。Lei 等[18]通过铸造法将果胶芋葡甘露聚糖与茶多酚结合形成复合可食用薄膜,虽然制备工艺简单、环保,但是所得膜缺乏较大的比表面积,且其分子质量对所载生物活性化合物的活性有很大影响。Aydogdu 等[19]利用静电纺丝技术制备载没食子酸羟丙基甲基纤维素纳米纤维,用于活性食品包装,虽然得到的薄膜具有较大的比表面积,但是活性物质通常挥发性强,对高压和高温敏感,静电纺丝后其生物活性可能相对较低。
微流体纺丝技术是制备超细微纳米纤维的主要技术之一[20],该技术以简单、安全、多样化、低成本和可扩展制造能力而广受关注。Mu 等[21]利用微流体纺丝技术构建有序的微纤维阵列,获得的超细纤维尺寸一致且宽度均匀。Zhang 等[22]利用微流体纺丝技术制备新型微液反应器,并产生荧光超细纤维。Hu 等[23]通过微流体纺丝技术获得强海藻酸钙微纤维,且所制备的海藻酸钙微纤维的最大强度达185.1 MPa。
本研究以KGM 为原料,结合PAAM,首先制备KGM/PAAM 溶胶,利用流变性能测试确定性能稳定的微流纺丝液;其次结合微流体纺丝技术,制备KGM/PAAM 微纤丝膜,并表征其结构和性能;最后验证微纤丝膜的抗菌性能。本研究为开发新型抗菌可降解包装材料提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
魔芋葡甘聚糖(KGM),中国云南三爱魔芋食品有限公司;聚丙烯酰胺(PAAM),国药集团化学试剂有限公司;去离子水,自制。
1.2 仪器与设备
JNS/MF 型微流体纺丝机,南京捷纳思新材料有限公司;HH-4 数显恒温水浴锅,常州国华电器有限公司;JEOLJSM6380LV 型扫描电镜,日本电子株会社;AV-ATAR360 傅里叶变换红外光谱仪,美国Nicolet 尼高力公司;AB-50 电子分析天平,瑞士Mette 公司;R30A 电动搅拌器,上海弗鲁克科技发展有限公司;NovaNanoSEM230 场发射扫描电镜,美国FEI 公司;DSC200F3 差示扫描量热计,耐驰(上海)机械仪器有限公司;XRD-6000 衍射仪,日本岛津公司;SC083654 实验室专用超纯水机,厦门精艺兴业科技有限公司。
1.3 试验方法
1.3.1 PAAM 溶胶的制备 准确称取99 g 去离子水放入烧杯中,以500 r/min 的转速,在50 ℃水浴加热下,加入1 g PAAM 固体粉末使之完全溶解,即得所需1%的PAAM 溶胶。
1.3.2 KGM 溶胶的制备 准确称取99 g 去离子水放入烧杯中,以500 r/min 的转速,在50 ℃水浴加热下,缓慢加入1 g KGM,匀速搅拌1 h 形成1%的KGM 溶胶。
1.3.3 KGM/PAAM 微流体纺丝溶胶的制备 取一定量的KGM 溶胶和PAAM 溶胶,利用注射器将两种溶胶按不同比例均匀混合,超声波脱气30 min,制得不同比例的KGM/PAAM 微流纺丝溶胶。
1.3.4 KGM/PAAM 微纤丝膜的制备 将制得的KGM/PAAM 微流纺丝溶胶利用微流体纺丝机制备微纤丝膜。微流体流速固定在0.1 mL/h,电机转速固定在800 r/min,将收集得到微纤丝膜置于真空干燥箱中干燥24 h,得到干燥的KGM/PAAM 微纤丝膜。
1.3.5 负载氧氟沙星的KGM/PAAM 微纤丝膜的制备 对制得的不同比例KGM/PAAM 微流纺丝溶胶进行流变性能测试,确定性能稳定的微流纺丝溶胶,加入适量氧氟沙星颗粒,利用注射器均匀混合,使用微流体纺丝机制备微纤丝膜。微流体流速固定在0.1 mL/h,电机转速固定在800 r/min,将收集得到的微纤丝膜置于真空干燥箱中干燥24 h,得到干燥的负载氧氟沙星KGM/PAAM 微纤丝膜。
1.4 测试与表征
1.4.1 流变性能测试 KGM/PAAM 溶胶流变特性的测试:使用MCR301 Rheoplus 流变仪进行测试,采用标准平行板(PP-50,50 mm 直径,1 mm 间隙)进行研究。在25 ℃下,0.1~300 s-1 剪切速率范围内,测试不同比例的KGM/PAAM 溶胶的剪切应力。
1.4.2 傅里叶红外光谱(FT-IR) KGM/PAAM 微纤丝膜用KBr 研磨成粉末并压平成薄片,用AVATAR360 型傅里叶红外光谱仪(FT-IR)在4 000~400 cm-1 波长范围内扫描测定,分辨率为4 cm-1。
1.4.3 热重分析(TGA) 使用DSC200F3 型差示扫描量热计 (DSC) 在N2 环境下,称取2.0 mg KGM/PAAM 微纤丝膜,分别密封于坩埚中,得到了样品在以10 k/min 的速率在40~600 ℃之间的热行为,以空密封坩埚作参照对象,每个试验重复3 次。
1.4.4 扫描电镜测试 (SEM) 在13.3 Pa 真空度下,将KGM/PAAM 微纤丝膜固定在覆盖碳条的圆柱形显微镜短板上,涂上100~200 Å 厚度的金层,然后用JEOLJSM 6380LV 型扫描电子显微镜在加速电压为15 kV 下观察其表面形貌。
1.4.5 X 射线光电子能谱(XRD) 制备的KGM/PAAM 微纤丝膜采用XRD-6000 衍射仪进行分析,衍射扫描区域为5°~60°,扫描速度为0.1°/s。
1.5 抗菌性能测试
1) 根据抑菌圈,评价负载氧氟沙星KGM/PAAM 微纤丝膜对革兰氏阳性的金黄色葡萄球菌和革兰氏阴性的大肠杆菌的抑菌效果[24]。所有菌株均在37 ℃琼脂板上培养24 h。将3~5 个细菌分离菌落放入5 mL Luria-Bertani 培养基 (LB 培养基)中,制备接种菌(1%胰蛋白酶,0.5%酵母提取物,1%NaCl,灭菌时间为120 ℃,20 min),然后在37 ℃的条件下孵育24 h。将得到的菌悬液用相同的LB 培养基稀释,在625 nm 波长处用紫外可见分光计测定菌浓度。随后,将0.1 mL 含有大约106~107 CFU/mL 被测细菌的接种物接种在固体LB 培养基表面。最后,用直径6 mm 的模具将微纤丝膜切成圆盘状,然后放置在LB 平板上。在37℃孵育24 h 后测定抑制区直径。
2) 分别制备TCBS 和Chromagar 平板,接种副溶血性弧菌,将微纤丝膜切成半圆形(尺寸为平板培养基的一半)放置在平板上,在37 ℃孵育24 h 后观察平板。
2 结果与分析
2.1 KGM//PAAM 溶胶的流变性质与微纤丝膜的微观形貌
为了获得性能优良的KGM 溶胶,本研究将PAAM 与KGM 按一定比例混合,两种高分子在水中形成缠结网络 (图1a)。通过流变性测试 (图1b),随着剪切速率的增加,KGM、PAAM、KGM∶PAAM(质量比)=1∶1 的剪切应力逐渐变大,然而当剪切速率达到一定值后,剪切应力的变化平缓,表现出剪切稀化现象,这是由于剪切速率的增大使得高分子化合物的分子链发生定向排列[25],与单一KGM 溶胶相比,加入同比例的PAAM 使得剪切应力有较大的变化,分子间协同增效作用更强,形成的溶胶更加均匀、稳定,流动性更强;当KGM∶PAAM(质量比)=3∶7 或KGM∶PAAM(质量比)=7∶3 时,随着剪切速率的不断增加,剪切应力呈不规则变化,在形成溶胶的过程中,PAAM 易缠结成块,形成的KGM/PAAM 溶胶流动性较差,本研究最终选定了KGM∶PAAM(质量比)=1∶1 作为纺丝溶胶,利用微流体纺丝技术制备了KGM/PAAM 微纤丝膜(图1c)。通过SEM 观察到平行排列和矩形网格的微观结构,微纤丝膜的宽度约为100 μm,进一步将氧氟沙星颗粒负载于微纤丝膜中,颗粒可以均匀的分散在膜的微纤丝中(图1c)。
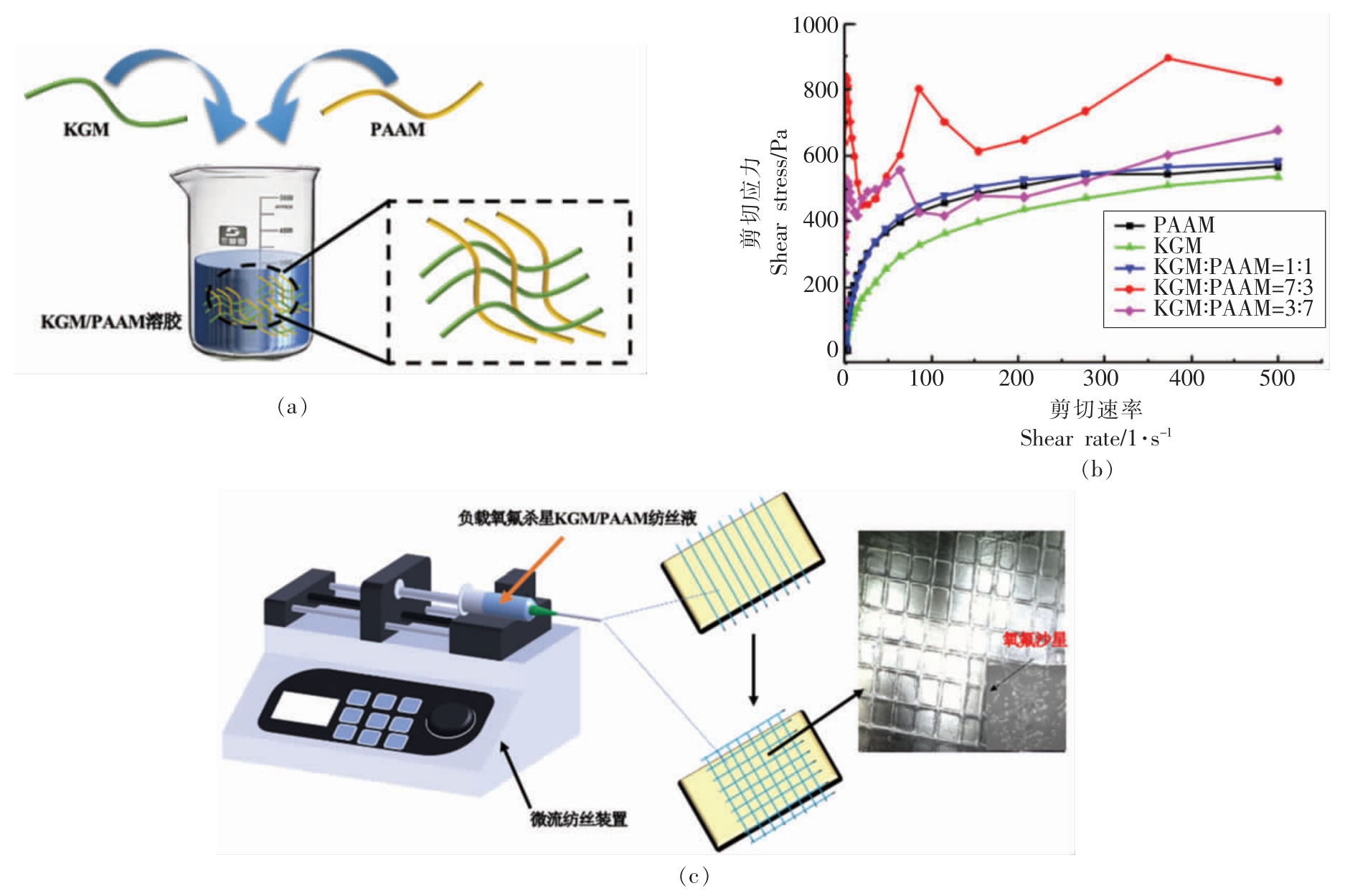
图1 (a) KGM/PAAM 溶胶网络示意图;(b)KGM/PAAM 溶胶在不同剪切速率下随剪切应力变化的流变行为;(c)MST 制备微纤丝膜的形成过程以及负载氧氟沙星的SEM 图像
Fig.1 (a) The schematic representation of network of KGM/PAAM sol;(b) Rheology behavior of KGM/PAAM sols changes in shear stress with shear rate at different ratios;(c) The formation process of preparing microfibril film via MST and SEM images of microfibril film loaded with ofloxacin
2.2 KGM//PAAM 微纤丝膜的表征
本研究利用FT-IR、XRD 和TGA 对KGM 和KGM/PAAM 微纤丝膜进行表征。图2a 为KGM 和KGM/PAAM 复合材料在波数为4 000~400 cm-1 时的FT-IR 光谱。两者吸收带都在3 446 cm-1 附近,表示O-H 的拉伸振动,在2 927 cm-1 处有较弱吸收峰,对应于-CH2-的对称及非对称伸缩振动峰,881 cm-1 处的吸收峰,对应于多糖中的β-1,4 糖苷键。KGM/PAAM 光谱中,2 771 cm-1 处的吸收峰可能是PAAM 中C-H 的特征伸缩振动。同时,在1 729 cm-1 附近的吸收峰被分散,表明在碱性条件下加入PAAM 去除了KGM 中的乙酰基[25]。如图2b 所示,在KGM 中观察到在2θ=22°处有一个明显的峰,说明KGM 是一种非晶态材料[13],此外,KGM/PAAM 中出现了一些衍射峰,说明微膜中KGM 和PAAM 之间存在分子间的相互作用[26]。图2c 为KGM/PAAM 的TGA 曲线。质量损失的第一阶段(低于150 ℃)主要由于水分蒸发引起,这可能是伴随着破坏分子间的氢键所导致的,两者质量损失相似[27]。第二阶段是150~300 ℃,KGM/PAAM 质量损失约为13%,而KGM 质量损失较大,约45%,主要原因是主链降解的质量损失和交联网络的破坏[28-29]。第三阶段从300 ℃开始,到550 ℃以后趋于平缓,这一阶段KGM/PAAM 的质量损失低于KGM,而重量残差高于KGM。这说明与PAAM 复合后制备的微纤丝膜的热稳定性增强。
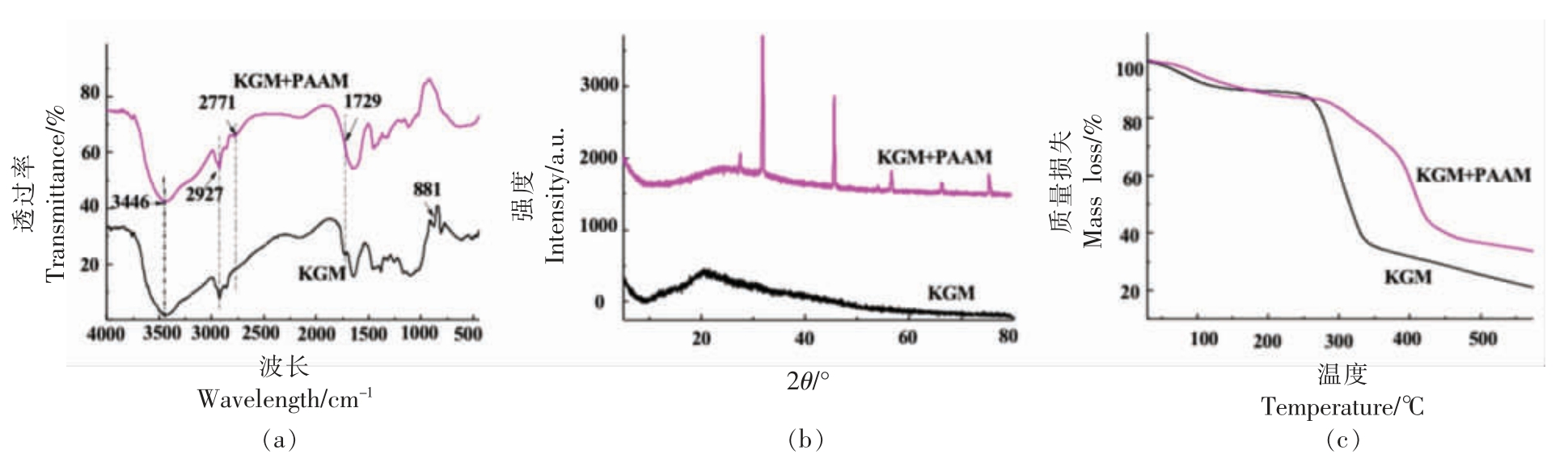
图2 KGM 和KGM/PAAM 的(a)FT-IR 光谱(b)XRD 图谱和(c)TGA 曲线
Fig.2 FT-IR spectrum (a) XRD pattern (b) and TGA curves (c) of KGM and KGM/PAAM
2.3 负载氧氟沙星的KGM/PAAM 微纤丝膜的抗菌性能
氧氟沙星的抗菌机制是通过抑制细菌DNA旋转酶的活性,阻止细菌DNA 的合成和复制而导致细菌死亡[12]。由于直接将氧氟沙星通过喷洒、涂抹的方式作用于食品表面会导致药物性能的不稳定,从而影响抗菌效果,通常会选择一种负载体,由于膜具有无毒环保、成本低廉、能够用于运输药物等优点[30],本研究将氧氟沙星负载于制备的KGM/PAAM 微纤丝膜。为了明确负载氧氟沙星的KGM/PAAM 微纤丝膜的抗菌性能,本研究选择副溶血弧菌、大肠杆菌、金黄色葡萄球菌作为模型细菌。由图3a 和图3b 可知,在37 ℃孵育24 h 后,TCBS 和Chromagar 平板上没有微纤丝膜的区域副溶血性弧菌密集分布,有微纤丝膜的区域未见副溶血性弧菌,由此可见,微纤丝膜对副溶血性弧菌有明显的抑菌效果。由图3c 和图3d 可知,没有负载氧氟沙星的KGM/PAAM 微纤丝膜对大肠杆菌抑菌圈直径为0 mm,没有抑菌效果;负载氧氟沙星的KGM/PAAM 微纤丝膜对大肠杆菌抑菌圈直径为39.6 mm,由此可见,微纤丝膜对大肠杆菌产生了很好的抗菌效果。由图3e 和图3f 可知,没有负载氧氟沙星的KGM/PAAM 微纤丝膜对金黄色葡萄球菌抑菌圈直径为0 mm,没有抑菌效果;负载氧氟沙星的KGM/PAAM 微纤丝膜对金黄色葡萄球菌抑菌圈直径为31.5 mm,微纤丝膜对金黄色葡萄球菌产生了良好的抗菌效果。副溶血弧菌作为一种常见病原菌,易引起海产品中毒,本研究制备的微纤丝膜对副溶血弧菌有明显的抑菌效果,为海产品保鲜研究提供了一定的理论指导,同时,微纤丝膜对大肠杆菌、金黄色葡萄球菌的抑菌效果,亦可用于肉制品、乳制品等食品的保鲜。
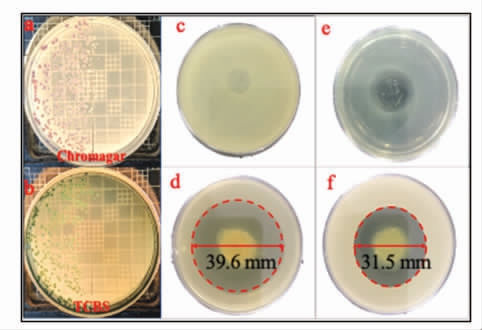
图3 Chromagar 平板副溶血性弧菌分布图(a);TCBS 平板副溶血性弧菌分布图 (b);KGM/PAAM微纤丝膜对大肠杆菌的抑菌圈 (c);负载氧氟沙星的KGM/PAAM 微纤丝膜对大肠杆菌的抑制圈(d);KGM/PAAM 微纤丝膜对金黄色葡萄球菌的抑制圈(e);负载氧氟沙星的KGM/PAAM 微纤丝膜对金黄色葡萄球菌的抑制圈(f)
Fig.3 Distribution of Vibrio parahaemolyticus on Chromagar tablet (a);Distribution of Vibrio parah -aemolyticus on TCBS tablet (b);the inhibition zone of KGM/PAAM microfibril film to E.coli (c);the inhibition zone of KGM/PAAM microfibril film loaded with ofloxacin to E.coli (d);the inhibition zone of KGM/PAAM microfibril film to Staphylococcus aureus (e);the inhibition zone of KGM/PAAM microfibril film loaded with ofloxacin to Staphylococcus aureus (f)
3 结论
本研究以KGM 为原料,结合PAAM,获得了不同质量比的KGM/PAAM 溶胶,并对溶胶的流变性能进行研究,最终选定了KGM∶PAAM(质量比)=1∶1 作为纺丝溶胶,运用微流体纺丝技术,制备KGM/PAAM 微纤丝膜,SEM 观察到平行排列和矩形网格的微观结构,膜的宽度为100 μm;FT-IR和XRD 表明KGM 和PAAM 之间存在分子相互作用;TGA 表明KGM/PAAM 的质量损失低于KGM,说明与PAAM 复合后制备的微纤丝膜的热稳定性增强。进一步将氧氟沙星负载于KGM/PAAM 微纤丝膜中,并进行抗菌试验,结果表明,微纤丝膜对副溶血性弧菌有明显的抑菌效果,为海产品保鲜研究提供了一定的理论指导;同时微纤丝膜对大肠杆菌、金黄色葡萄球菌的抑菌圈直径分别为39.6,31.5 mm,具有良好的抑菌特性,在食品包装中具有一定的应用价值。本研究为构建新型抗菌材料提供了一定的理论基础。
[1]LIU X F,HAN W,ZHU Y X,et al.Anti-oxidative and antibacterial self-healing edible polyelectrolyte multilayer film in fresh-cut fruits[J].Journal of Nanoscience and Nanotechnology,2018,18(4):2592-2600.
[2]付露莹,王锐,张有林.食品包装材料研究进展[J].包装与食品机械,2018,36(1):51-56.
FU L Y,WANG R,ZHANG Y L.Advance in food packing materials[J].Packaging and Food Ma chinery,2018,36(1):51-56.
[3]汪慧,吴旻,赵瑜婕,等.载锌与ε-聚赖氨酸抗菌膜的制备及其抗菌、物理性能研究[J].食品科学,2020,41(5):223-229.
WANG H,WU M,ZHAO Y J,et al.Preparation and antibacterial and physical properties of antibacterial membrane containing zinc and ε-polylysine[J].Food Science,2020,41(5):223-229.
[4]陈浩,张有林.我国食品包装材料现状及其安全性分析[J].包装与食品机械,2017,35(6):53-57.
CHEN H,ZHANG Y L.The present situation and safety analysis of food packaging materials in China[J].Packaging and Food Machinery,2017,35(6):53-57.
[5]GALIKHANOV M F,GALEEVA L R,NAZMIEVA A I.Strengthening of paper materials under the action of unipolar corona discharge by increasing the level of interaction between cellulose fibers[J].Fibre Chemistry,2020,51(5):387-391.
[6]CHANG W,LIU F,SHARIF H R.Preparation of chitosan films by neutralization for improving their preservation effects on chilled meat[J].Food Hydrocolloids,2019,90:50-61.
[7]DING C,CHEN S Y,XIAO X F.Preparation and characterization of lysine-modified polylactic acid microspheres[J].International Journal of Polymeric Materials and Polymeric Biomaterials,2020,69(17):1123-1133.
[8]GUO P J,WANG F,DUO T T,et al.Facile Fabrication of methylcellulose/PLA membrane with improved properties[J].coatings,2020,10(5):1-13.
[9]PAN Y Z,WU T F,BAO H Q,et al.Green fabrication of chitosan films reinforced with parallel aligned graphene oxide[J].Carbohydrate Polymers,2010,83(4):1908-1915.
[10]NARGES J,SAEEDEH S A,MARYAM M,et al.Comparing mechanical,barrier and antimicrobial properties of nanocellulose/CMC and nanochitosan/CMC composite films[J].International Journal of Biological Macromolecules,2020,164:2323-2328.
[11]WANG K,GAO S J,SHEN C H,et al.Preparation of cationic konjac glucomannan in NaOH/urea aqueous solution[J].Carbohydrate Polymers,2018,181:736-743.
[12]WANG L,LIN L Z,GUO Y Y,et al.Enhanced functional properties of nanocomposite film incorporated with EGCG-loaded dialdehyde glucomannan/gelatin matrix for food packaging[J].Food Hydrocolloids,2020,108:105863.
[13]LIN W M,NI Y S,LIU D Y,et al.Robust microfluidic construction of konjac glucomannan-based micro-films for active food packaging[J].International Journal of Biological Macromolecules,2019,137:982-991.
[14]ZOU Y Y,YUAN C,CUI B,et al.Formation of high amylose corn starch/konjac glucomannan composite film with improved mechanical and barrier properties[J].Carbohydrate Polymers,2021,251:117039.
[15]WU C H,LI Y L,SUN J S,et al.Novel konjac glucomannan films with oxidized chitin nanocrystals immobilized red cabbage anthocyanins for intelligent food packaging[J].Food Hydrocolloids,2020,98:124-133.
[16]NI X W,WANG K,WU K,et al.Stability,microstructure and rheological behavior of konjac glucomannan-zein mixed systems[J].Carbohydrate Polymers,2018,188:260-267.
[17]WANG J Y,CHEN X,ZHANG C G,et al.Transparent konjac glucomannan/cellulose nanofibril composite films with improved mechanical properties and thermal stability[J].Cellulose,2019,26(5):3155-3165.
[18]LEI Y L,WU H J,JIAO C,et al.Investigation of the structural and physical properties,antioxidant and antimicrobial activity of pectin-konjac glucomannan composite edible films incorporated with tea polyphenol[J].Food Hydrocolloids,2019,94:128-135.
[19]AYDOGDU A,SUMNU G,SAHIN S.Fabrication of gallic acid loaded Hydroxypropyl methylcellulose nanofibers by electrospinning technique as active packaging material[J].Carbohydrate Polymers,2019,208:241-250.
[20]崔婷婷,刘吉东,解安全,等.多功能纳米纤维微流体纺丝技术及其应用研究进展[J].纺织学报,2018,39(12):158-165.
CUI T T,LIU J D,XIE J G,et al.Microfluidic spinning technology for multifunctional nanofibers and application and research progress thereof[J].Journal of Textile Research,2018,39(12):158-165.
[21]MU R J,NI Y S,WANG L,et al.Fabrication of ordered konjac glucomannan microfiber arrays via facile microfluidic spinning method[J].Materials Letters,2017,196:410-413.
[22]ZHANG Y,WANG C F,CHEN L,et al.Microfluidic-spinning-directed microreactors toward generation of multiple nanocrystals loaded anisotropic fluorescent microfibers[J].Advanced Functional materials,2015,25(47):7253-7262.
[23]HU X L,TIAN M W,SUN B,et al.Hydrodynamic alignment and microfluidic spinning of strengthreinforced calcium alginate microfibers[J].Materials Letters,2018,230:148-151.
[24]ZHOU L P,XU T W,YAN J C,et al.Fabrication and characterization of matrine-loaded konjac glucomannan/ fish gelatin composite hydrogel as antimicrobial wound dressing[J].Food Hydrocolloids,2020,104:105702.
[25]XU P F,YAO Q Q,YU N,et al.Narrow-dispersed konjac glucomannan nanospheres with high moisture adsorption and desorption ability by inverse emulsion crosslinking [J].Materials Letters,2014,137:59-61.
[26]NI Y S,LIN W M,MU R J,et al.Facile fabrication of novel konjac glucomannan films with antibacterial properties via microfluidic spinning strategy[J].Carbohydrate Polymers,2019,208:469-476.
[27]WANG L,DU Y,MU R J,et al.Mussel-inspired fabrication of konjac glucomannan/microcrystalline cellulose intelligent hydrogel with pH-responsive sustained release behavior[J].International Journal of Biological Macromolecules,2018,113:285-293.
[28]YANG M L,SHI J S,XIA Y Z.Effect of SiO2,PVA and glycerol concentrations on chemical and mechanical properties of alginate-based films[J].International Journal of Biological Macromolecules,2018,107:2686-2694.
[29]ZHANG R,XIE J,YANG B,et al.Self-assembly of chitosan and cellulose chains into a 3D porous polysaccharide alloy film:Co-dissolving,structure and biological properties[J].Applied Surface Science,2019,493:1032-1041.
[30]YADAV S,MEHROTRA G K,DYTTA P K.Chitosan based ZnO nanoparticles loaded gallic-acid films for active food packaging[J].Food Chemistry,2020,334:127605.