丙烯醛是不饱和羰基化合物中结构最简单的物质,分子式为C3H4O(CH2=CH-CHO),在室温下为一种透明、无色至浅黄色易燃液体,具有刺激性气味。作为一种具有高度反应性的醛类,丙烯醛是合成其它有机物重要的中间介质,如杀生物剂、蛋氨酸等[1]。丙烯醛是一种普遍存在的环境污染物,产生于汽油、柴油、香烟、木材或塑料等有机物燃烧过程中;它还广泛存在于加工食品,特别是油炸和焙烤等热加工食品以及酒类中,如啤酒、葡萄酒和朗姆酒等[2-7]。Logue 等[8]计算美国室内空气中1 192 种物质对健康的累积影响,丙烯醛与PM2.5及甲醛被列为最重要的健康影响物质,而且作为一种主要空气和水毒物被记录于美国环境保护署,其推荐水中含量不得超过65 μg/L,然而实测值往往高于此数据[1,9]。在生物系统中,它可由烯丙醇、烯丙胺、精胺、亚精胺和抗癌药物环磷酰胺代谢产生[10-15]。
丙烯醛因含有α,β-不饱和羰基结构而极易发生亲核反应,与人体内的DNA、蛋白质发生交联,损耗体内谷胱甘肽(GSH)水平,破坏人体抗氧化系统,诱发活性氧产生,增加氧化应激水平,促进细胞凋亡,进而诱发各种疾病,如阿尔兹海默症、糖尿病、动脉粥样化、老年痴呆病以及癌症等[2,16-20]。丙烯醛也是一种基因毒性物质,通过损伤DNA 诱发基因突变,干扰DNA 修复,导致细胞凋亡[21-23]。
从前人的研究可推断,丙烯醛在油炸薯片中形成后迅速消减。Granvogl[24]、Ewert 等[25]将菜籽油和商用油炸油在180 ℃下加热4 h 后用于油炸薯片、薯条和圈饼,而后检测油炸油和油炸制品中丙烯醛含量,结果发现油炸油中的丙烯醛含量比薯片高出数千倍(菜籽油2 897~4 561 倍,商用油2 603~3 674 倍)。鉴于丙烯醛溶于食用油,油炸油和油炸品中的丙烯醛浓度理应相等,以上现象说明油炸制品中的丙烯醛大多被消除。本研究团队推测在油炸过程中,薯片的一些组分,如多酚、糖类、蛋白质、氨基酸与丙烯醛发生反应,导致薯片中丙烯醛含量显著降低。本团队前期研究[26-28]表明,半胱氨酸、γ-氨基丁酸、丙氨酸可与丙烯醛反应降低丙烯醛含量。然而,其它氨基酸是否发挥消减作用及其机制尚不清楚。马铃薯游离氨基酸含量很高,Elmore 等[29]在马铃薯中检测到22 种氨基酸,其中含量最高的天冬酰胺达27 mmol/kg,并且随着薯片制品加工过程中含量逐渐减少,本团队推测其它氨基酸也会在丙烯醛的消除中发挥重要作用。本试验中将马铃薯中含量较高的7 种氨基酸与丙烯醛反应,分离纯化出主要产物,检测代表性产物在薯片中的含量,以阐明油炸薯片中丙烯醛的消减机制。
1 材料与方法
1.1 材料与试剂
丙烯醛(分析纯级),中国成都艾克达化学试剂有限公司;L-缬氨酸 (Val,99%)、L-苏氨酸(Thr,99%)、L-天冬氨酸 (Asp,99%)、L-谷氨酸(Glu,99%)、L-甘氨酸 (Gly,99%)、L-天冬酰胺(Asn,99%)、L-谷氨酰胺(Gln,99%)、正己烷(分析纯级),北京百灵威科技有限公司;D2O,剑桥同位素公司 (Cambridge Isotope Laboratories);DMSO-d6,上海麦克林生化科技有限公司;甲醇(色谱纯级),美国Mallinckrodt Baker 公司;A-HG 型十八烷基键合硅胶(ODS),日本东京YMC 有限公司;葡聚糖凝胶LH-20(Sephadex LH-20),上海国药化学试剂有限公司。所有分离用有机溶剂均为国产分析纯级。
1.2 仪器与设备
HR-200 分析天平,广州市艾安得仪器有限公司;LC-20AT 高效液相色谱仪【配有电喷雾离子源(ESI)】,日本Shimadzu 公司;SHA-BA 恒温振荡器,江苏省金坛市医疗仪器厂;N-1300 型旋转蒸发仪,东京理化器械株式会社;Scientz-10N 型真空冷冻干燥机,宁波新芝生物科技有限公司;X500R QTOF 型高分辨质谱仪,美国SCIEX 公司;600 MHz Avance III 型核磁共振仪,瑞士布鲁克公司。
1.3 方法
1.3.1 氨基酸-丙烯醛产物制备 反应在150 mL具塞锥形瓶中进行,研究发现[26]氨基酸与丙烯醛的反应比例为2∶1(物质的量的比)时效果比较理想,因此采用这一比例,并根据不同氨基酸反应难易程度,在50~80 ℃、密封条件下反应2~5 h。
1.3.2 反应结果检测 采用HPLC、HPLC-MS/MS检测粗反应产物以及对分离纯化后物质进行纯度和结构鉴定。色谱条件:色谱柱:ZORBAX SB-Aq,4.6 mm×250 mm,5 μm;流动相:怡宝水(A)、色谱级甲醇(B);检测器:SPD-M20A 光电二极管阵列检测器;分析条件:流动相为5%B 水溶液,流速:0.6 mL/min,进样体积为2 μL。柱温:40 ℃,产物的检测波长220 nm 和254 nm。
质谱条件:色谱柱:Agilent InfinityLab Poroshell 120 EC-C18;流动相:0.1%甲酸水(A)、色谱级甲醇(B);分析条件:流动相为5%B 水溶液,流速:0.4 mL/min,进样体积为0.5 μL。离子源为电喷雾离子源(ESI),扫描范围为m/z 50~800;源温度为300 ℃,去溶剂化温度为250 ℃,毛细管电压为4 000 V,扫描速率为1 000 u/s,碰撞能量为15~25 eV。
1.3.3 分离纯化 柱层析法进行产物分离纯化,填料选择为反相硅胶ODS 和葡聚糖凝胶LH-20,其中ODS 操作为:200 mL 填料于纯甲醇中浸泡过夜,装载于30 mm×500 mm 规格的玻璃层析柱中,梯度平衡后,5%甲醇(超声后)作为洗脱液等度洗脱,流速为1 mL/min,各馏分体积为5 mL。
将100 mL 葡聚糖凝胶LH-20 于5%甲醇中浸泡48 h(期间不断搅拌,保证充分溶胀)[30]后,装柱于25 mm×100 cm 层析柱中,5%甲醇作为洗脱液等度洗脱,流速为0.125 mL/min,洗脱液总体积250 mL,各馏分体积为3 mL。
配制显色剂:称取0.2 g 2,4-二硝基苯肼(DNPH)溶于100 mL 乙醇中,滴加5 mL 浓盐酸至溶解。取各馏分200 μL 与100 μL 显色剂于96 孔板中混合,取有沉淀产生或有颜色变化的馏分于HPLC 和HPLC-MS/MS 检测纯度,HPLC 检测为单峰且浓度含量达95%以上并于HPLC-MS/MS 下检测为单一质荷比的馏分混合冷冻干燥后收集固体样品。
1.3.4 结构鉴定 将纯度达95%以上样品于HPLC-MS/MS 获得一级、二级质谱,在高分辨质谱【HRMS,离子源为电喷雾离子源(ESI),扫描范围为m/z 50~1500】下,分析获得精确相对分子质量。称取冻干样品15 mg 溶解于500 μL DMSO-d6 以及D2O 中并用Avance III 光谱仪获得氢谱、碳谱、Dept-135 谱图。
1.3.5 食品中产物的含量检测 选取市场上2 种鲜切油炸薯片,采用正己烷作溶剂,索氏抽提法[31]脱脂。将脱脂薯片用研钵碾碎后称取1 g 样品,置于50 mL 离心管中,加入10 mL 50%甲醇/水超声10 min(重复该操作3 次),离心(10 000 r/min)30 min,取上清液真空旋干,加6 mL 50%甲醇溶液溶解,过0.22 μm 膜,用HPLC-MS/MS 检测食品中丙烯醛-天冬酰胺反应产物含量,采用MRM(正离子模式)模式进行定量分析。
1.4 数据分析
试验数据采用Microsoft Excel 软件处理,使用“平均数±标准差”( ±s)表示。
±s)表示。
2 结果与分析
丙烯醛和7 种氨基酸反应后,几乎检测不到体系中的丙烯醛(显色法),而产生了含量很高的新产物(图1~7)。
2.1 目标产物的确定
试验所采用的反应条件如表1所示(氨基酸与丙烯醛物质量比为2∶1)。不同氨基酸与丙烯醛反应产物的HPLC 图谱如图1~7 所示。在不同波长下找到主要生成物作为目标产物,并对其进行全波长扫描,结果表明,大部分氨基酸与丙烯醛反应的产物最大吸收波长为λmax=220 nm。而结构最简单的氨基酸——甘氨酸,与丙烯醛反应后生成两种含量较高的产物,分别为目标产物1(λmax=220 nm),目标产物2(λmax=275 nm)(图7);且两个产物极性非常接近,保留时间分别为5.273,4.815 min。
表1 不同氨基酸的反应条件
Table 1 Reaction conditions of amino acids
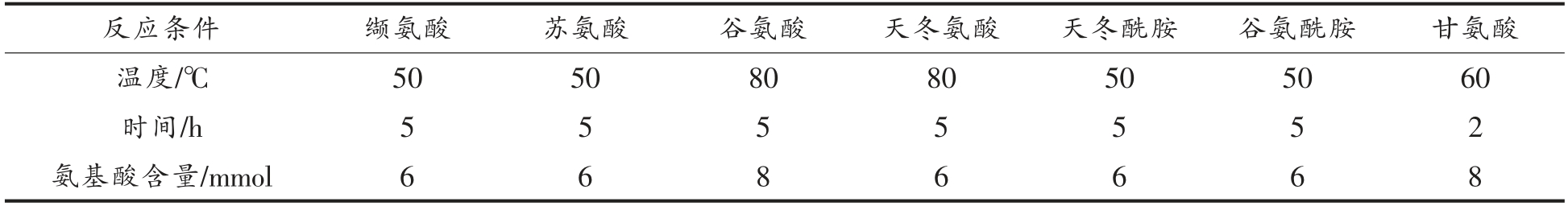
反应条件 缬氨酸 苏氨酸 谷氨酸 天冬氨酸 天冬酰胺 谷氨酰胺 甘氨酸温时度/℃ 50 50 80 80 50 50 60间/h 5 5 5 5 5 5 2氨基酸含量/mmol 6 6 8 6 6 6 8
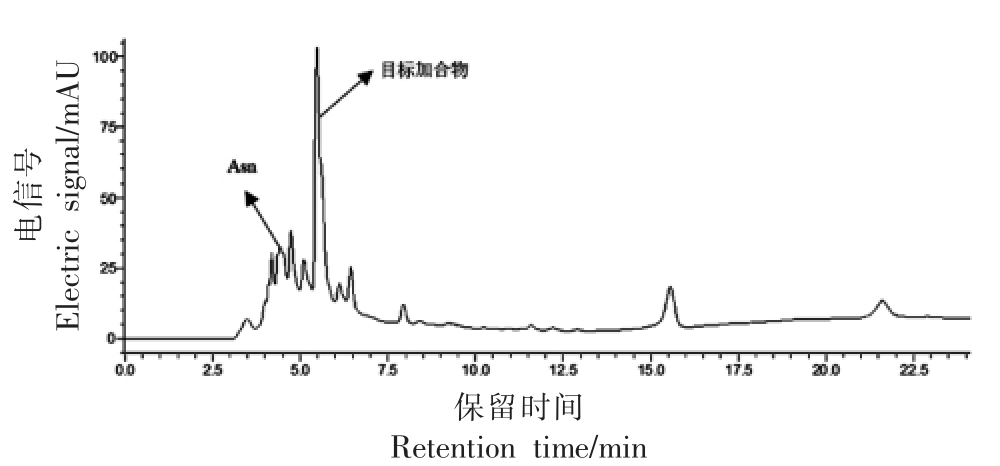
图1 天冬酰胺与丙烯醛反应结果
Fig.1 HPLC results of reactions between asparagine and acrolein
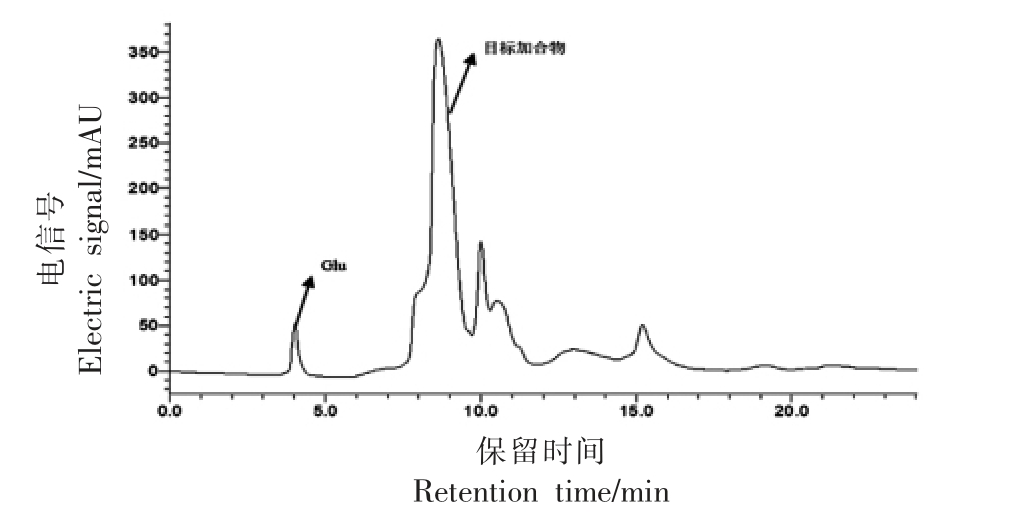
图2 谷氨酸与丙烯醛反应结果
Fig.2 HPLC results of reactions between glutamate and acrolein
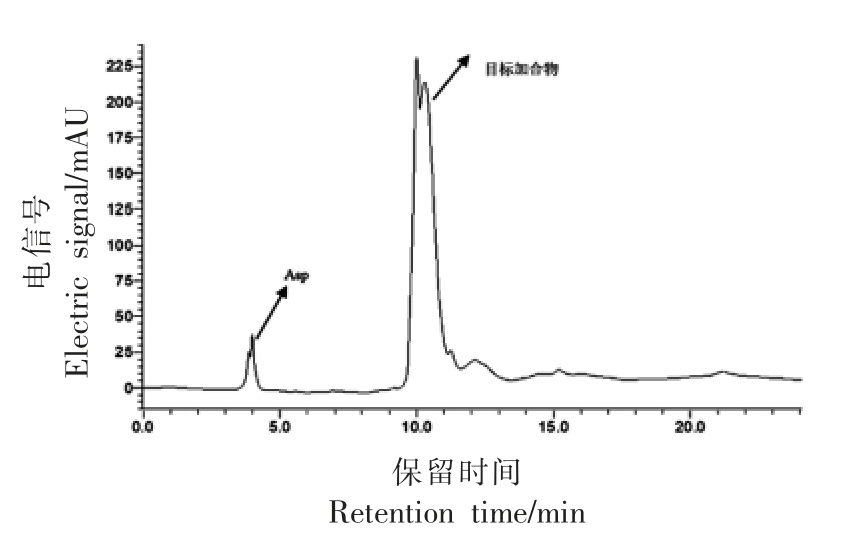
图3 天冬氨酸与丙烯醛反应结果
Fig.3 HPLC results of reactions between aspartic acid and acrolein
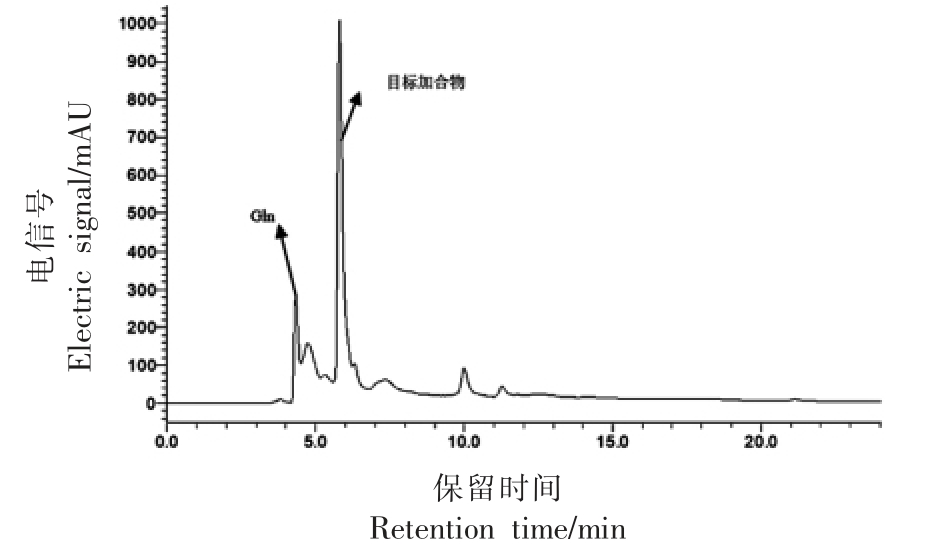
图4 谷氨酰胺与丙烯醛反应结果
Fig.4 HPLC results of reactions between glutamine and acrolein
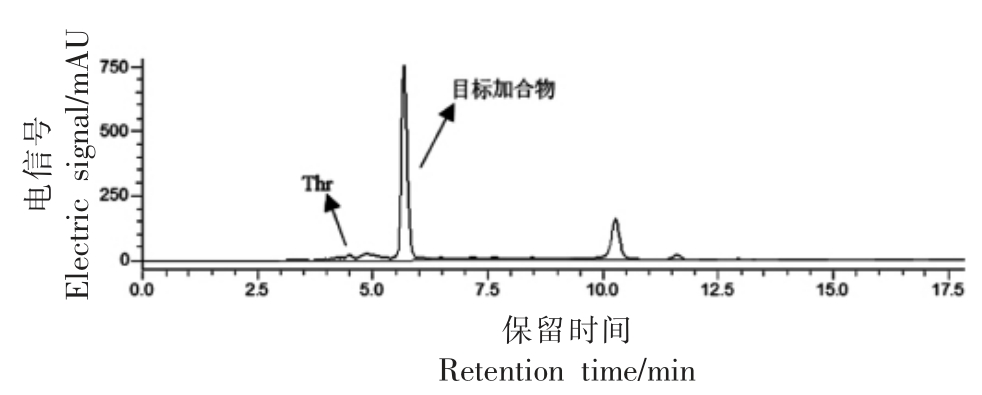
图5 苏氨酸与丙烯醛反应结果
Fig.5 HPLC results of reactions between threonine and acrolein
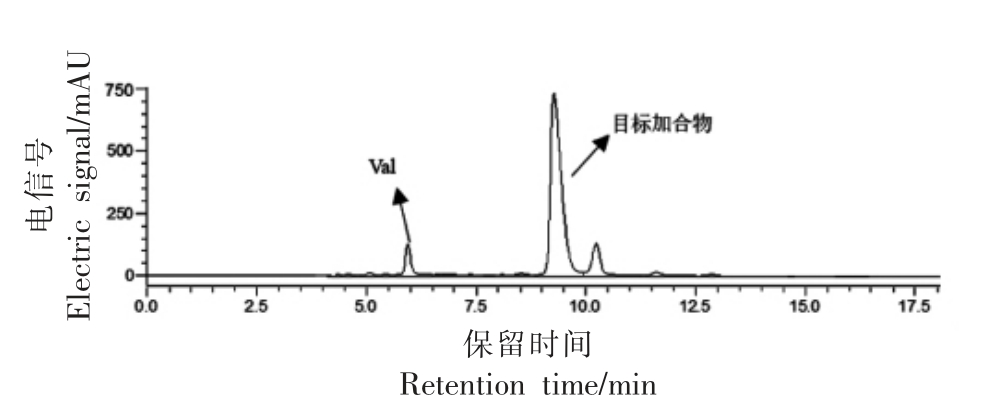
图6 缬氨酸与丙烯醛反应结果
Fig.6 HPLC results of reactions between valine and acrolein
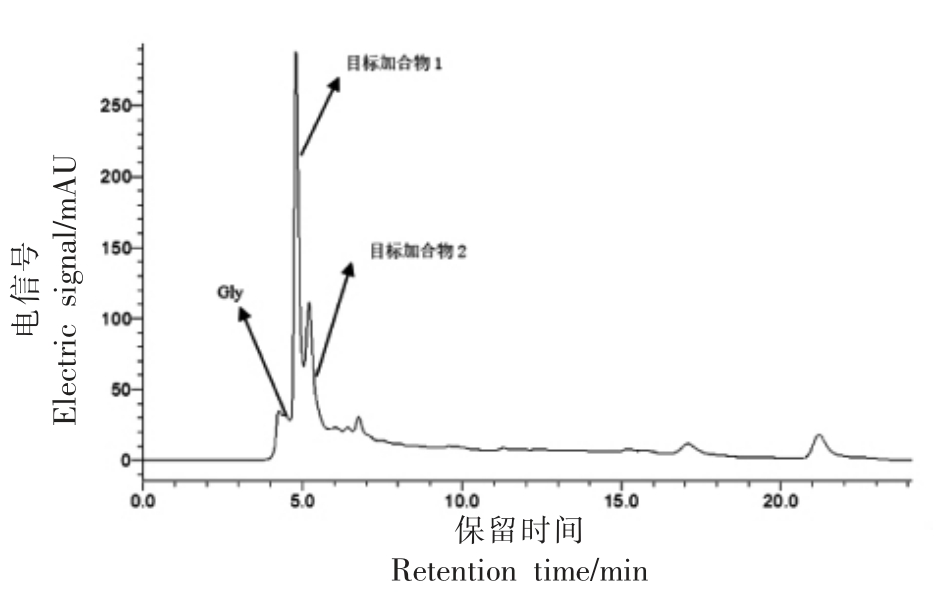
图7 甘氨酸与丙烯醛反应结果
Fig.7 HPLC results of reactions between glycine and acrolein
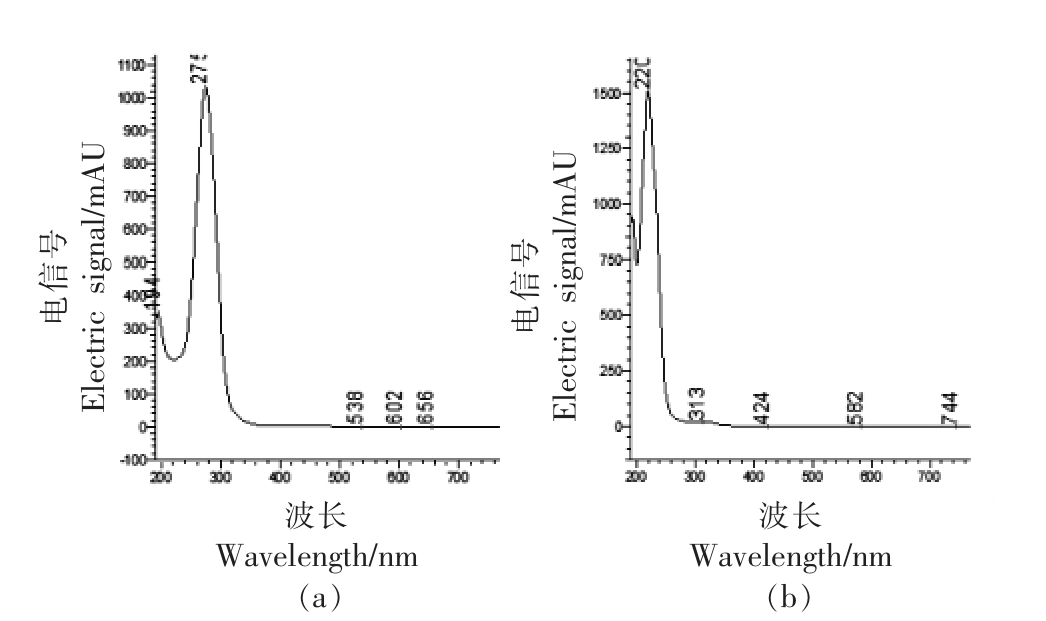
图8 不同氨基酸与丙烯醛反应结果的全波长扫描图
Fig.8 Full-wavelength scan result of reactions between seven amino acids and acrolein
2.2 反应产物的分离纯化
氨基酸及其产物属于极性偏大的化合物,ODS 作为填料进行分离所用时间较短并且可以达到较好的分离效果。甘氨酸反应混合物中的两个目标产物因保留时间相近,极性相似,ODS 不能达到很好的分离效果。葡聚糖凝胶LH-20 洗脱溶剂为反相时,起反相分配作用,极性大的物质保留弱,先被洗脱,极性小的化合物后出柱,并且可以通过增加柱长及控制流速达到目标分离效果,因此甘氨酸混合物在ODS 分离后,收集目标馏分于葡聚糖凝胶柱进行二次分离。
DNPH 是羰基物质(醛、酮)的常用显色剂。根据本团队的前期研究结果[26],本研究的反应产物可能具有羰基结构,因此本文采用DNPH 显色剂对洗脱成分进行显色,发现目标产物产生橙红色沉淀(经后期结构鉴定,产生橙红色沉淀的产物具有相似的结构,λmax=220 nm,统称为产物类1)。而甘氨酸目标产物2 不同于其它产物,与该显色剂显色时并未有沉淀产生,且显色剂颜色由橙黄色转变为红棕色(λmax=275 nm,统称为产物类2),如图9(以甘氨酸为例)所示。同时经HPLC 检测后,产物在HPLC 上呈现单峰,峰形窄且尖,含量占比95%以上,如图10(以甘氨酸为例)所示。
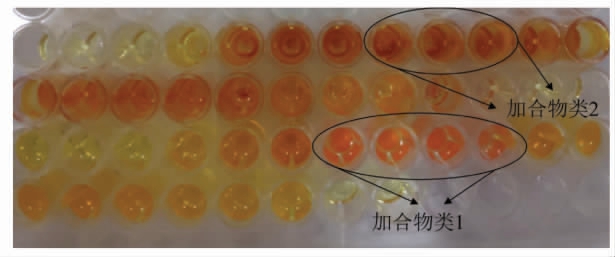
图9 甘氨酸两类产物与DNPH 显色剂反应结果
Fig.9 Chromogenic color of the reaction products of glycine by DNPH
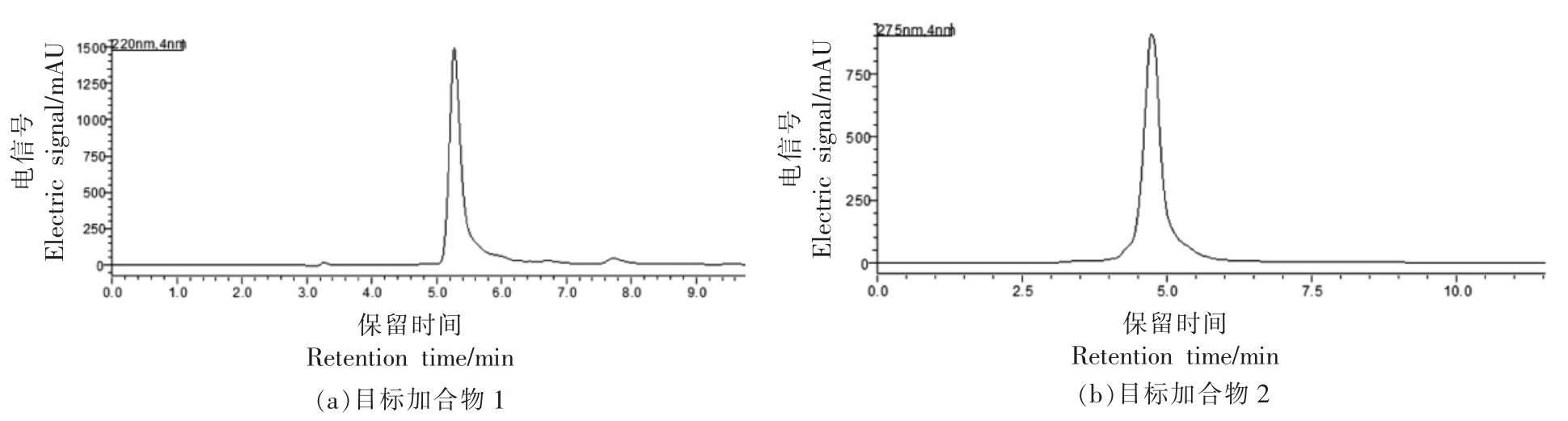
图10 甘氨酸分离纯化后HPLC 检测图
Fig.10 HPLC chromatograph of the purified adducts of glycine
2.3 结构鉴定
分别对纯化后的产物进行产物离子扫描及核磁分析。产物类1 样品溶解于DMSO-d6 且出峰效果较好,产物类2 样品在DMSO-d6 中出现沉淀,因此改用D2O 作为溶剂进行核磁分析。核磁分析结果如表2~8 所示。核磁结果与前期研究结果[26]类似,两类产物都存在δC 为193 附近的峰,且每种产物至少有一个δC 在170 附近出峰点,说明氨基酸的羧基未参与反应。综合前期研究及本次研究结果,发现氨基酸与丙烯醛的反应类型更倾向于氨基与丙烯醛双键发生亲核加成反应(迈克尔加成反应)后,丙烯醛残余的两分子羰基自身缩合形成含氮六元杂环,并且二级质谱结果表明该结构具有较强稳定性。该反应机理也由Jiang 等[28]证实,合成了γ-氨基丁酸与丙烯醛的产物,并对其结构进行分析也得出了具有类似环状结构的化合物,并且这些化合物相对于丙烯醛本身大大降低了其毒性,为氨基酸作为食品添加剂提供一种可能。
表2 天冬氨酸-丙烯醛产物结构的NMR 结果
Table 2 Structure identification of aspartic acid-acrolein
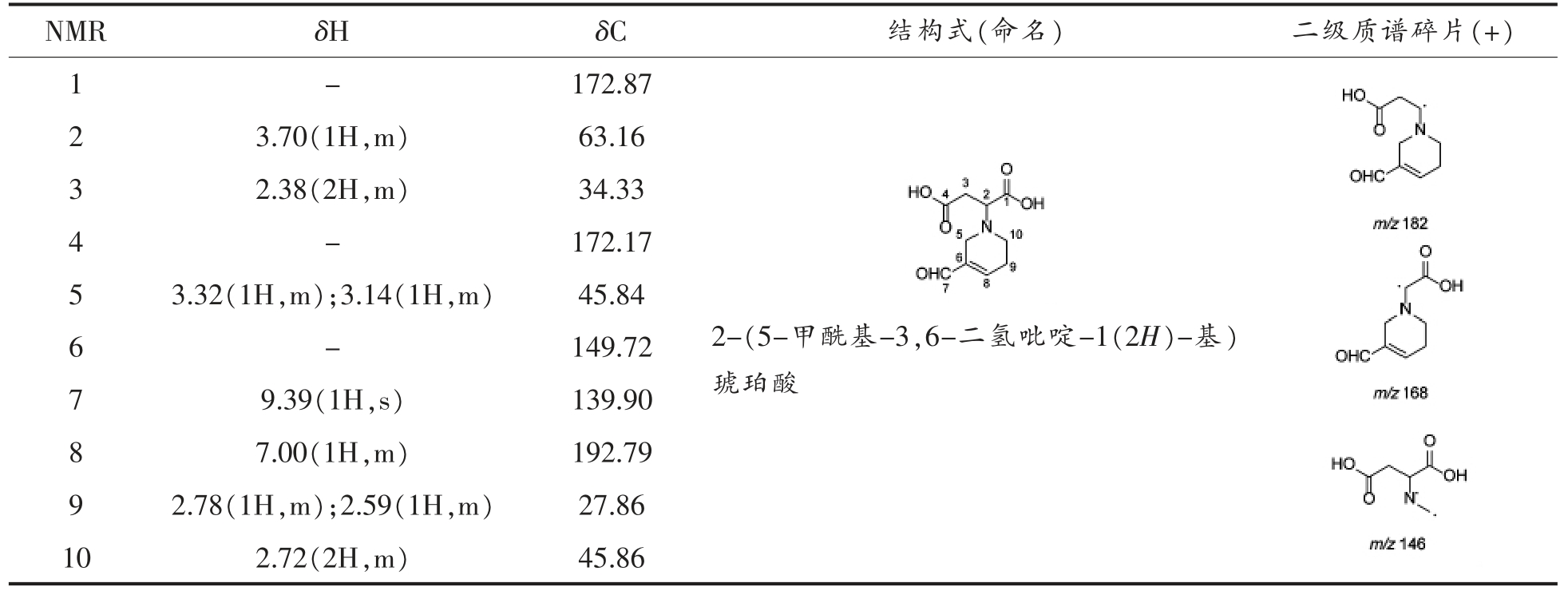
NMR δH δC 结构式(命名) 二级质谱碎片(+)1-172.87 3.70(1H,m) 63.16 3 2.38(2H,m) 34.33 4-172.17 2 5 3.32(1H,m);3.14(1H,m) 45.84 6-149.72images/BZ_237_1345_680_1551_874.png9.39(1H,s) 139.90 8 7.00(1H,m) 192.79 9 2.78(1H,m);2.59(1H,m) 27.86 10 2.72(2H,m) 45.86 7 2-(5-甲酰基-3,6-二氢吡啶-1(2H)-基)琥珀酸images/BZ_237_1884_586_2084_1204.png
甘氨酸与丙烯醛反应产生了2 种主要产物(图7)。基于目标产物1 的显色反应 (橙红色沉淀)、紫外吸收(λmax=220 nm)和一级、二级质谱结果(图11),其结构类型应属于产物类1。采用高分辨质谱对目标产物2 分析,得出该产物精确相对分子质量为282.1285,化学式为C13H18N2O5。通过计算,其不饱和度为6,推算出为3 分子丙烯醛与2 分子甘氨酸发生反应、脱去两分子水的产物。经二级质谱及NMR 结果分析产物结构如表8所示。推测其反应途径如图12(反应途径2):同样,1 分子甘氨酸先与2 分子丙烯醛发生迈克尔加成后,丙烯醛未参与反应的两个醛基,其中1 个与新1分子甘氨酸发生羰氨反应后脱水,另1 个与新1分子丙烯醛发生羟醛缩合后脱水,产生1 个共轭结构。该产物具有较多的双键结构且有明显共轭,因此紫外吸收强(λmax=275 nm),并且由于结构中多个双键的存在容易与DMSO-d6 发生亲核反应,进而核磁分析时不能以DMSO-d6 作为溶剂。由此,本研究认为氨基酸与丙烯醛反应有2 条途径(图12):产物类1 按反应途径1 进行,并且研究认为其为氨基酸与丙烯醛反应的主要途径,且该产物生成温度跨度可从37 ℃至160 ℃[28];产物类2 按反应途径2 进行。
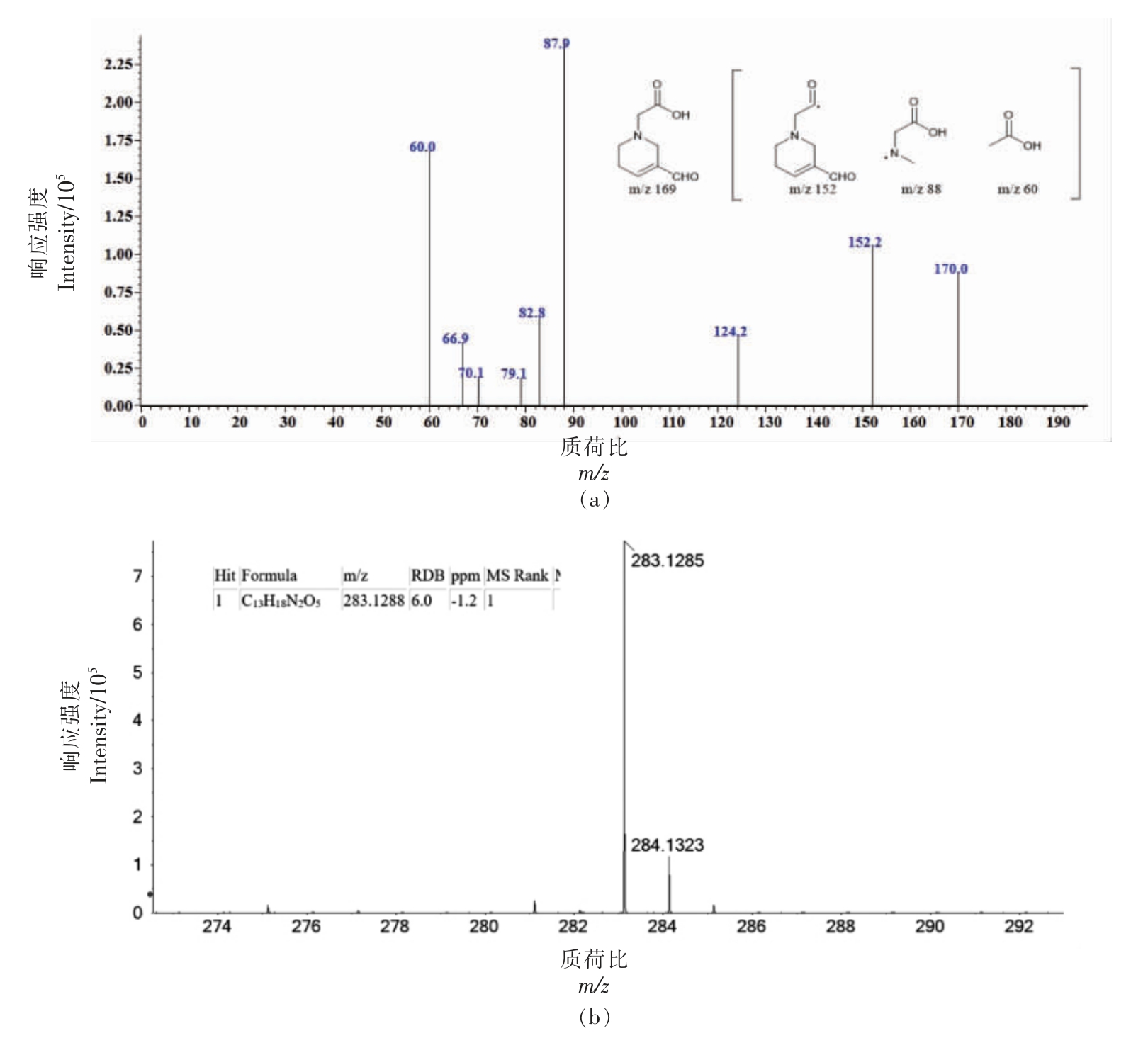
图11 甘氨酸-丙烯醛产物1 质谱分析结果(a:正离子模式)、甘氨酸-丙烯醛产物2 高分辨质谱结果(b)
Fig.11 MS2 results of glycine-acrolein product 1 (a:positive ion mode),TOF-MS results of glycine-acrolein product 2 (b)
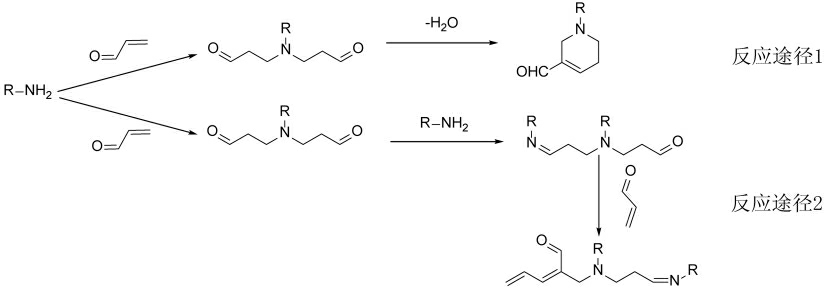
图12 氨基酸与丙烯醛反应机理
Fig.12 Reaction mechanisms of amino acids and acrolein
表8 甘氨酸-丙烯醛产物2 结构的NMR 结果
Table 8 Structure identification result of glycine-acroelin-2
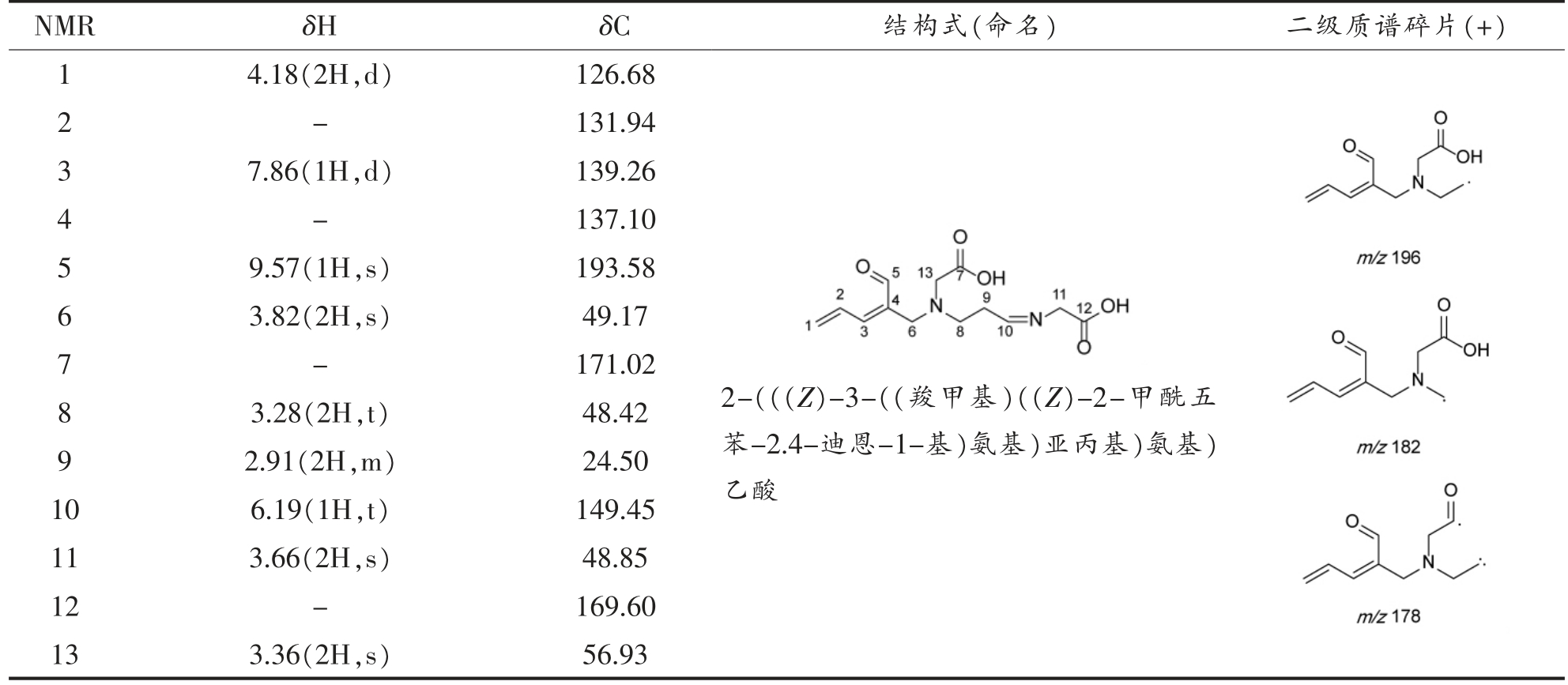
NMR δH δC 结构式(命名) 二级质谱碎片(+)1 4.18(2H,d) 126.68 2 131.94 3 7.86(1H,d) 139.26 4-137.10-9.57(1H,s) 193.58 6 3.82(2H,s) 49.17 7-171.02 5 3.28(2H,t) 48.42 9 2.91(2H,m) 24.50 10 6.19(1H,t) 149.45 11 3.66(2H,s) 48.85 12-169.60 13 3.36(2H,s) 56.93 8 2-(((Z)-3-((羧甲基)((Z)-2-甲酰五苯-2.4-迪恩-1-基)氨基)亚丙基)氨基)乙酸
2.4 油炸薯片中天冬酰胺-丙烯醛产物含量检测
马铃薯中天冬酰胺的含量最高为27 000 μmol/kg,且其含量随着热处理时间的延长而逐渐减少[29]。本研究以天冬酰胺-丙烯醛加合物为代表,开发了其基于HPLC-MS/MS 的检测技术。MRM 分析条件:定量离子对:227/168(碰撞能量为20 eV,驻留时间为220 ms);定性离子对:227/181(碰撞能量为22 eV,驻留时间为220 ms)。流动相:A 相/B 相:水/乙腈(含0.1%甲酸),流速0.5 mL/min,洗脱程序:0~2 min,2%B~100%B;2~8 min,100%B~100%B;8~8.01 min,100%B~2%B;8.01~18 min,2%B。结果表明,两种油炸鲜切薯片中的天冬酰胺-丙烯醛加合物含量分别为(1.89±0.30)μg/kg,(1.46±0.19)μg/kg,低于γ-氨基丁酸-丙烯醛加合物含量。天冬酰胺-丙烯醛加合物在油炸薯片中的存在说明,鲜切薯片在油炸过程中,消失的丙烯醛与马铃薯中的氨基酸结合是丙烯醛在薯片中暴露量降低的原因之一。本研究的检测技术为食品中其它氨基酸-丙烯醛加合物的检测提供了参考。
表3 谷氨酸-丙烯醛产物结构的NMR 结果
Table 3 Structure identification of glutamic acid-acrolein
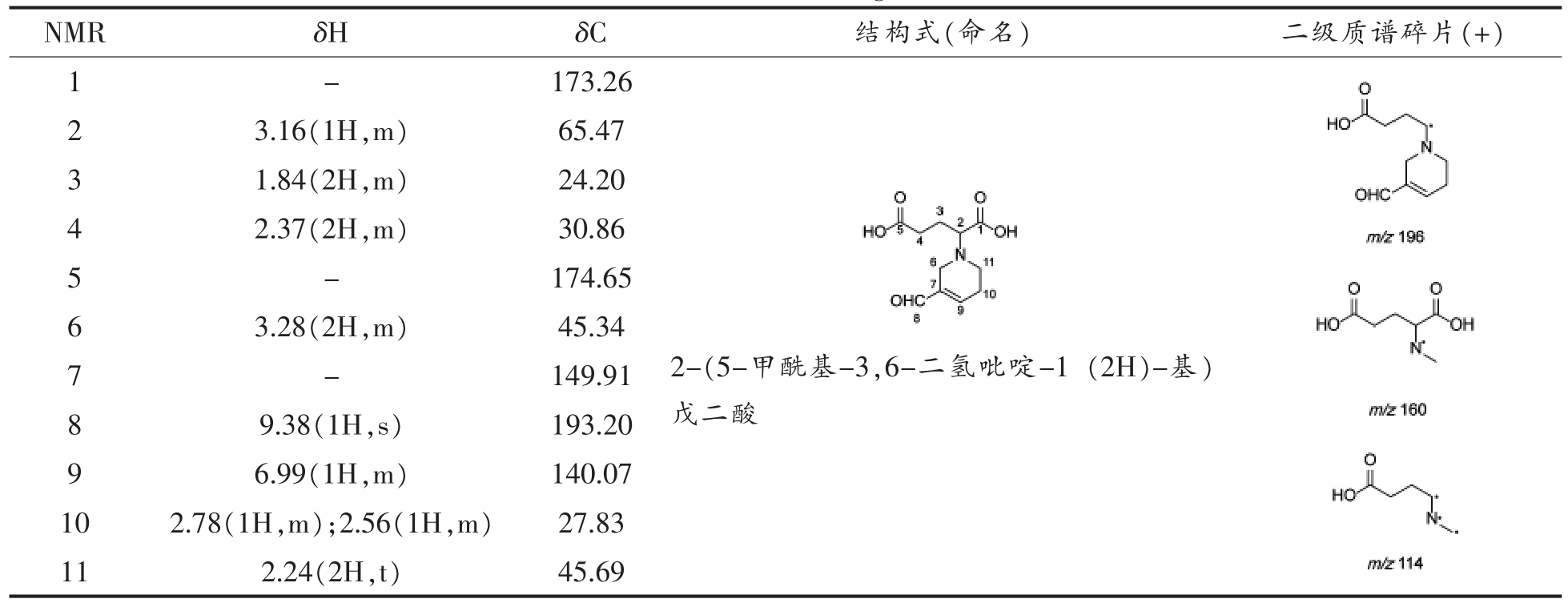
NMR δH δC 结构式(命名) 二级质谱碎片(+)1-173.26 3.16(1H,m) 65.47 3 1.84(2H,m) 24.20 4 2.37(2H,m) 30.86 5-174.65 2 3.28(2H,m) 45.34 7-149.91 6images/BZ_237_1293_1611_1506_1807.png9.38(1H,s) 193.20 9 6.99(1H,m) 140.07 10 2.78(1H,m);2.56(1H,m) 27.83 11 2.24(2H,t) 45.69 8 2-(5-甲酰基-3,6-二氢吡啶-1 (2H)-基)戊二酸images/BZ_237_1851_1483_2073_2112.png
表4 谷氨酰胺-丙烯醛产物结构的NMR 结果
Table 4 Structure identification of glutamine-acrolein
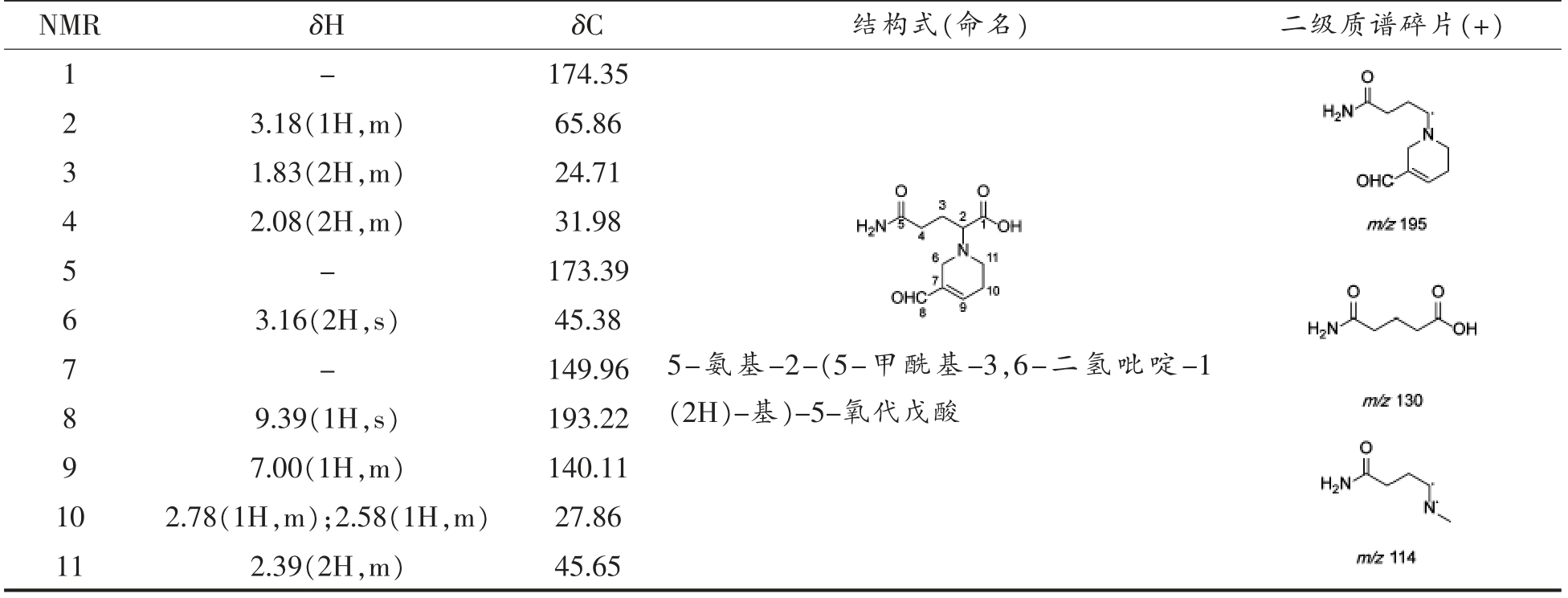
NMR δH δC 结构式(命名) 二级质谱碎片(+)1-174.35 3.18(1H,m) 65.86 3 1.83(2H,m) 24.71 4 2.08(2H,m) 31.98 5-173.39 2 3.16(2H,s) 45.38 7-149.96 6 9.39(1H,s) 193.22 9 7.00(1H,m) 140.11 10 2.78(1H,m);2.58(1H,m) 27.86 11 2.39(2H,m) 45.65 8 5-氨基-2-(5-甲酰基-3,6-二氢吡啶-1(2H)-基)-5-氧代戊酸
表5 缬氨酸-丙烯醛产物结构的NMR 结果
Table 5 Structure identification of valine-acrolein
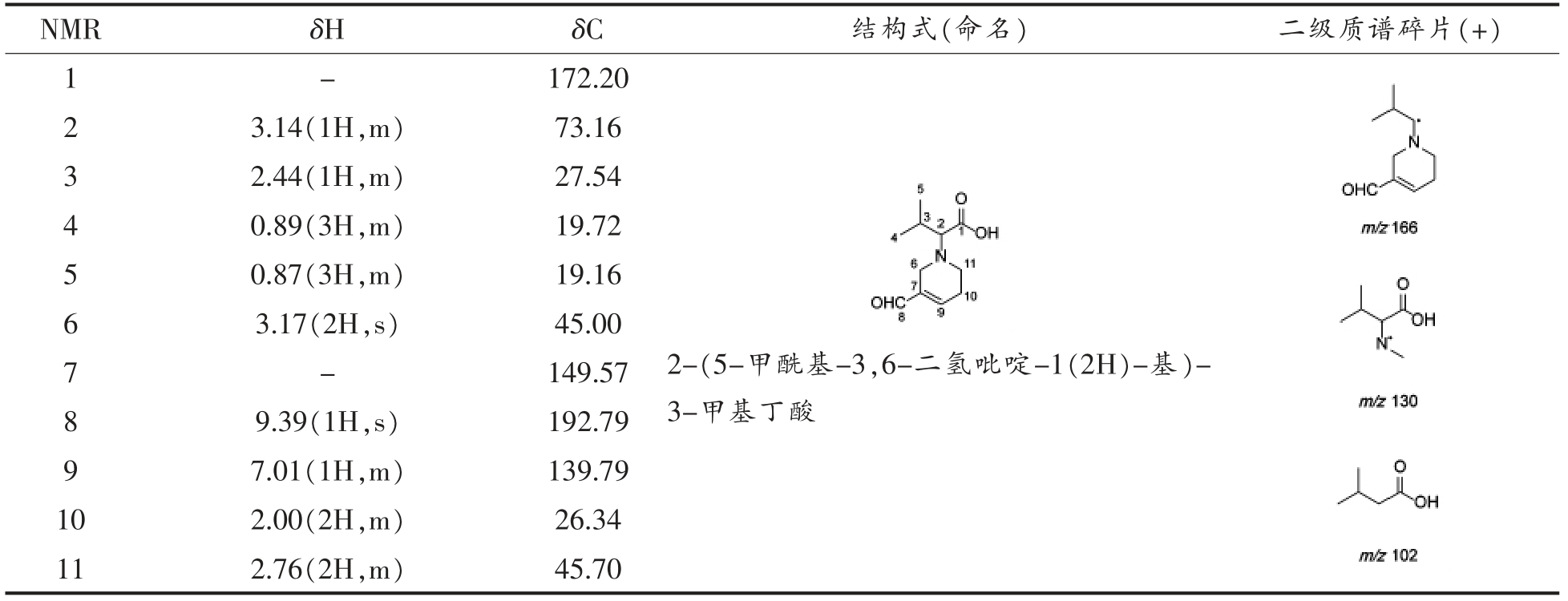
NMR δH δC 结构式(命名) 二级质谱碎片(+)1-172.20 3.14(1H,m) 73.16 3 2.44(1H,m) 27.54 4 0.89(3H,m) 19.72 5 0.87(3H,m) 19.16 6 3.17(2H,s) 45.00 7-149.57 2 9.39(1H,s) 192.79 9 7.01(1H,m) 139.79 10 2.00(2H,m) 26.34 11 2.76(2H,m) 45.70 8 2-(5-甲酰基-3,6-二氢吡啶-1(2H)-基)-3-甲基丁酸
表6 天冬酰胺-丙烯醛产物结构的NMR 结果
Table 6 Structure identification result of asparagine-acrolein
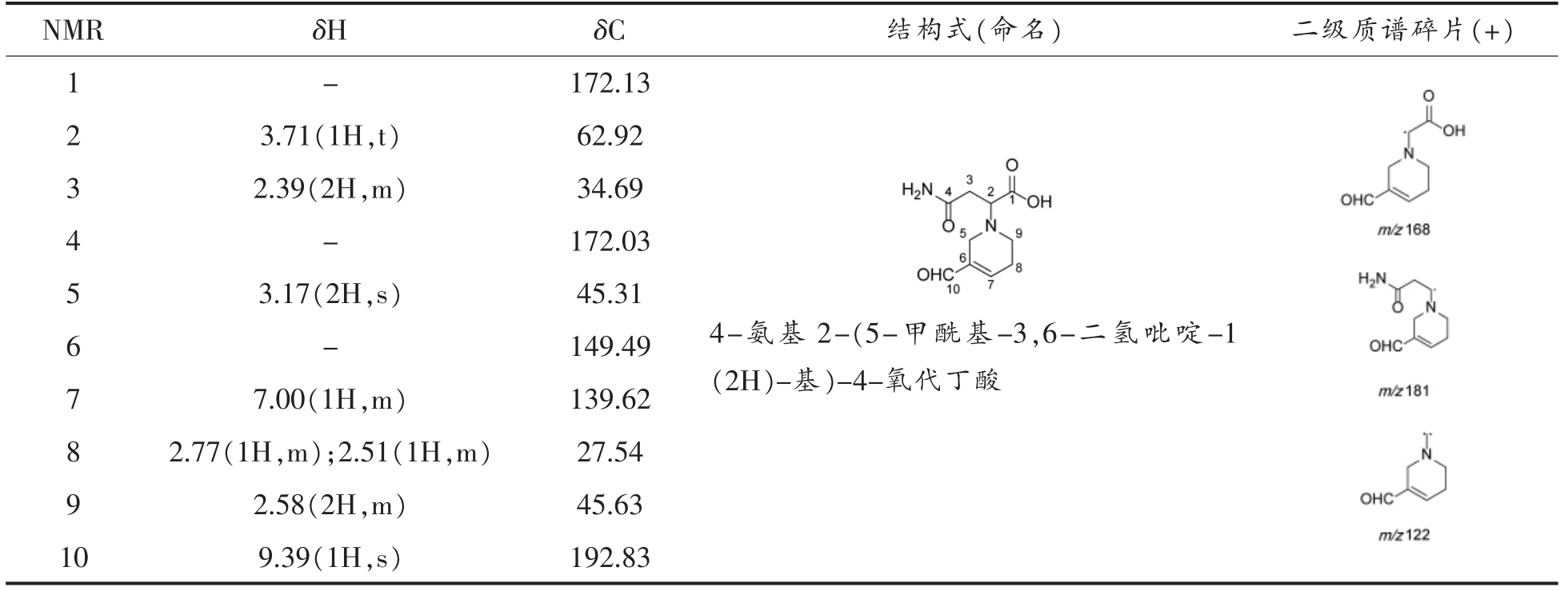
NMR δH δC 结构式(命名) 二级质谱碎片(+)1-172.13 3.71(1H,t) 62.92 3 2.39(2H,m) 34.69 4-172.03 2 3.17(2H,s) 45.31 6-149.49 5 7.00(1H,m) 139.62 8 2.77(1H,m);2.51(1H,m) 27.54 9 2.58(2H,m) 45.63 10 9.39(1H,s) 192.83 7 4-氨基2-(5-甲酰基-3,6-二氢吡啶-1(2H)-基)-4-氧代丁酸
表7 苏氨酸-丙烯醛产物结构的NMR 结果
Table 7 Structure identification result of threonine-acrolein
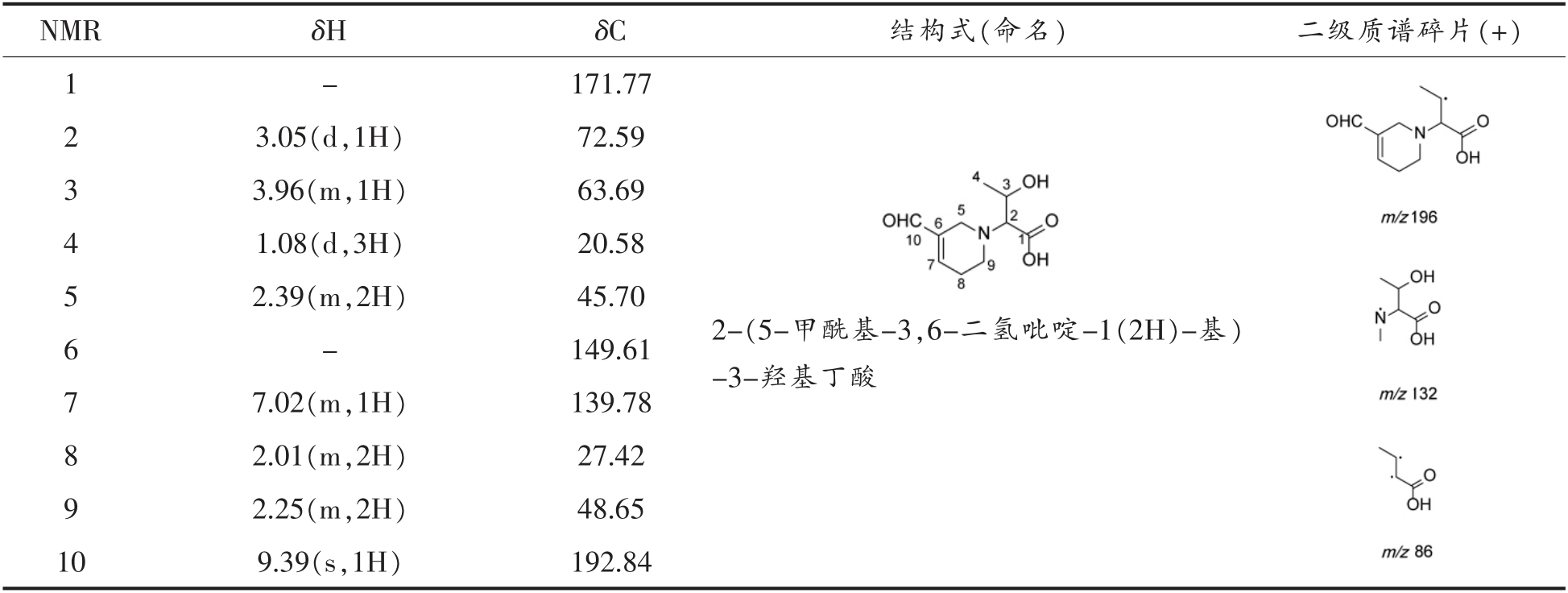
NMR δH δC 结构式(命名) 二级质谱碎片(+)1-171.77 3.05(d,1H) 72.59 3 3.96(m,1H) 63.69 4 1.08(d,3H) 20.58 5 2.39(m,2H) 45.70 6-149.61 2 7.02(m,1H) 139.78 8 2.01(m,2H) 27.42 9 2.25(m,2H) 48.65 10 9.39(s,1H) 192.84 7 2-(5-甲酰基-3,6-二氢吡啶-1(2H)-基)-3-羟基丁酸
3 结论
本研究分离纯化出8 种氨基酸与丙烯醛反应主要产物,并对其进行结构鉴定。结果发现,氨基酸与丙烯醛主要通过两种途径发生反应:一是先进行迈克尔加成反应,再进行羟醛缩合反应,且该反应途径是几乎所有氨基酸与丙烯醛反应的主要途径;二是先进行迈克尔加成反应,再发生羰氨反应和羟醛缩合反应。同时发现,代表性产物天冬酰胺-丙烯醛反应产物存在于鲜切油炸薯片中。本研究结果表明,马铃薯中存在的游离氨基酸可能在油炸薯片的丙烯醛消减中发挥重要作用,其作用机理是氨基酸的氨基与丙烯醛的烯基和羰基反应形成新的产物。然而,这些新产物吸收后,是否会在体内再次释放出丙烯醛,从而增加丙烯醛的体内暴露水平,还需进一步研究。
[1]HENNING R J,JOHNSON G T,COYLE J P,et al.Acrolein can cause cardiovascular disease:A review[J].Cardiovasc Toxicol,2017,17(3):227-236.
[2]HUANG I J,JIN M H,PI R B,et al.Acrolein induces Alzheimer's disease-like pathologies in vitro and in vivo[J].Toxicology Letters,2013,217(3):184-191.
[3]BEIN K,LEIKAUF G D.Acrolein-a pulmonary hazard[J].Molecular Nutrition & Food Research,2011,55(9):1342-1360.
[4]KEHRER J P,BISWAL S S.The molecular effects of acrolein[J].Toxicological Sciences,2000,57(1):6-15.
[5]KWAK H S,HAN J Y,KOREN G,et al.Vapor compounds released from nicotine-free inhalators as a smoking-cessation aid[J].Applied Sciences,2019,9(11):2232.
[6]LEE H W,WANG H T,WENG M W,et al.Cigarette side-stream smoke lung and bladder carcinogenesis:Inducing mutagenic acrolein-DNA adducts,inhibiting DNA repair and enhancing an chorage-independent-growth cell transformation[J].Oncotarget,2015,6(32):33226-33236.
[7]KUNTIC M,OELZE M,STEVEN S,et al.Shortterm e-cigarette vapour exposure causes vascular oxidative stress and dysfunction:Evidence for a close connection to brain damage and a key role of the phagocytic NADPH oxidase (NOX-2)[J].Eur Heart J,2020,41(26):2472-2483.
[8]LOGUE J M,SMALL M J,STERN D,et al.Spatial variation in ambient air toxics concentrations and health risks between industrial-influenced,urban,and rural sites[J].J Air Waste Manag Assoc,2010,60(3):271-286.
[9]CONKLIN D J,BARSKI O A,LESGARDS J F,et al.Acrolein consumption induces systemic dyslipidemia and lipoprotein modification[J].Toxicol Appl Pharmacol,2010,243(1):1-12.
[10]GOKCE A B,EREN B,SAGIR D,et al.Inhibition of acrolein-induced apoptosis by the antioxidant selenium[J].Toxicol Ind Health,2020,36(2):84-92.
[11]GU Y P,YANG X M,LUO P,et al.Inhibition of acrolein-induced autophagy and apoptosis by a glycosaminoglycan from Sepia esculenta ink in mouse Leydig cells[J].Carbohydrate Polymers,2017,163:270-279.
[12]HE X,SONG W,LIU C,et al.Rapamycin inhibits acrolein-induced apoptosis by alleviating ROS-driven mitochondrial dysfunction in male germ cells[J].Cell Prolif,2014,47(2):161-171.
[13]HOU K,YU Q,HU X,et al.Protective effect of Ganoderma atrum polysaccharide on acrolein-induced macrophage injury via autophagy-dependent apoptosis pathway[J].Food Chem Toxicol,2019,133:110757.
[14]LAU S,RANGARAJAN R,PHILIDET C,et al.Effects of acrolein in comparison to its prodrug cyclophosphamide on human primary endothelial cells in vitro[J].Toxicol In Vitro,2020,62(6):104685.
[15]LI L,JIANG L,GENG C,et al.The role of oxidative stress in acrolein-induced DNA damage in HepG2 cells[J].Free Radic Res,2008,42(4):354-361.
[16]YIN Z,JIANG K,SHI L,et al.Formation of dicysteine acrolein adduct decreases cytotoxicity of acrolein by ROS alleviation and apoptosis intervention[J].J Hazard Mater,2019,387:121686.
[17]HONG J H,LEE P A H,LU Y C,et al.Acrolein contributes to urothelial carcinomas in patients with chronic kidney disease[J].Urol Oncol,2020,38(5):465-475.
[18]ZHANG D,JIANG X,XIAO L,et al.Mechanistic studies of inhibition on acrolein by myricetin [J].Food Chem,2020,323(9):126788.
[19]CHEN L,WU X,ZEB F,et al.Acrolein-induced apoptosis of smooth muscle cells through NEAT1-Bmal1/Clock pathway and a protection from asparagus extract[J].Environ Pollut,2020,258(Suppl 1):113735.
[20]LUO J,SHI R.Acrolein induces oxidative stress in brain mitochondria[J].Neurochem Int,2005,46(3):243-252.
[21]TANG M S,WANG H T,HU Y,et al.Acrolein induced DNA damage,mutagenicity and effect on DNA repair[J].Mol Nutr Food Res,2011,55(9):1291-300.
[22]YILDIZBAYRAK N,ORTA-YILMAZ B,AYDIN Y,et al.Acrolein exerts a genotoxic effect in the Leydig cells by stimulating DNA damage-induced apoptosis[J].Environ Sci Pollut Res Int,2020,27(13):15869-15877.
[23]SARKAR P.Response of DNA damage genes in acrolein-treated lung adenocarcinoma cells[J].Mol Cell Biochem,2019,450(1/2):187-198.
[24]GRANVOGL M.Development of three stable isotope dilution assays for the quantitation of (E)-2-butenal(crotonaldehyde) in heat-processed edible fats and oils as well as in food[J].J Agric Food Chem,2014,62(6):1272-1282.
[25]EWERT A,GRANVOGL M,SCHIEBERLE P.Isotope-labeling studies on the formation pathway of acrolein during heat processing of oils[J].J Agric Food Chem,2014,62(33):8524-8529.
[26]邹照佳,郑洁,黄才欢,等.丙烯醛-丙氨酸加合物制备与细胞毒性[J].食品科学,2021,42(9):1-6.ZOU Z J,ZHENG J,HUANG C H,et al.Preparation and cytotoxicity of acrolein-alanine adduct[J].Food Science,2021,42(9):1-6.
[27]JIANG K,HUANG C,JIAO R,et al.Adducts formed during protein digestion decreased the toxicity of five carbonyl compounds against Caco-2 cells[J].J Hazard Mater,2019,363:26-33.
[28]JIANG K,YIN Z,ZHOU P,et al.The scavenging capacity of gamma-aminobutyric acid for acrolein and the cytotoxicity of the formed adduct[J].Food Funct,2020,11(9):7736-7747.
[29]ELMORE J S,KOUTSIDIS G,DODSON A T,et al.Measurement of acrylamide and its precursors in potato,wheat,and rye model systems[J].Journal of Agricultural and Food Chemistry,2005,53 (4):1286-1293.
[30]孙美玲,殷廷,张钦,等.海参水煮液中ACE 抑制肽的分离纯化[J].大连工业大学学报,2019,38(1):15-18.
SUN M L,YIN T,ZHANG Q,et al.Purification and characterization of angiotensin converting enzyme inhibitory peptides from the sea cucumber cooking water[J].Journal of the Dalian Polytechnic University 2019,38(1):15-18.
[31]WANG G,LIU P,HE J,et al.Identification of a 5-hydroxymethylfurfural-lysine schiff base and its cytotoxicity in three cell lines[J].J Agric Food Chem,2019,67(36):10214-10221.