橄榄属于木犀科木犀榄属,主要分布在地中海沿岸国家,集中产地为意大利、西班牙、希腊。在中国,其被大量种植在甘肃、广东、广西、云南、四川等地区[1]。陇南是我国主要的橄榄生长地区,橄榄油产量和产值均居全国第一位[2]。橄榄果渣是橄榄榨油后剩余的残渣,含有十分丰富的纤维素、半纤维素、果胶等成分,是优良的膳食纤维来源,据报道,每吨橄榄果榨油后约产生0.2 t 的橄榄渣,而橄榄渣的传统利用方法是将其作为饲料、肥料甚至直接丢弃,这些利用方法不仅造成资源的浪费,还引起许多环境问题[3-4]。
纤维素是一类由葡萄糖苷通过糖苷键连接而成的多糖类物质的总称,是生物质的重要组成成分,不溶于水及大多数有机溶剂。在食物中广泛存在于水果、蔬菜及谷物等植物基食品中。由于人体内缺乏相应的纤维素酶,因此不能被人体消化吸收而随粪便排出体外。然而,近年来研究发现纤维素是人体健康不可或缺的一类营养素,具有促进肠道蠕动,降血糖,降血脂,预防高血压以及心血管疾病等生理功能,对人体健康起到积极作用[5]。
目前,提取农业废渣中纤维素的方法主要有酸法、碱法、酶法及机械处理法,碱法提取纤维素已广泛运用于马铃薯渣、果渣、豆渣、茶渣等原料中[6-7]。然而,目前有关碱法提取橄榄渣纤维素及结构表征的方法鲜有报道。本研究以橄榄果渣为原料,用碱液浸提法提取橄榄果渣中的纤维素。在此基础上,利用硫酸和盐酸将此纤维素水解成微晶纤维素,通过电子扫描显微镜、傅里叶红外光谱仪、X 射线衍射仪、差示扫描量热仪分析原始纤维素与微晶纤维素的结构,并对比两类纤维素的持水力、持油力及膨胀力等理化性质,为进一步研究橄榄果渣纤维素的性能与应用提供试验依据。
1 材料与方法
1.1 试验材料及仪器
橄榄渣(橄榄果榨油之后剩余的残渣),甘肃武都油橄榄厂。尼罗红、荧光增白剂,美国Sigma公司。溴化钾、氢氧化钠、浓硫酸、浓盐酸等均为国产分析纯级。
FW100 高速万能粉碎机,天津泰斯特仪器有限公司;T-203 电子天平,美国丹佛;202-00 干燥箱,北京化玻联医疗器械有限公司;TD5A 台式离心机,湖南凯达科学仪器有限公司;HCJ-6D 磁力搅拌水浴锅,常州朗越仪器制造有限公司;Vetex70 傅里叶变换红外光谱仪、Model D8 X-射线衍射仪,德国布鲁克公司;Q2000 差示扫描量热仪,美国TA 公司;A1R 激光共聚焦扫描显微镜,日本尼康公司。
1.2 试验方法
1.2.1 初始纤维素的制备 将橄榄果渣置于80℃干燥箱中干燥8 h,使含水量不高于5%,去除果核,粉碎后过40~60 目筛,将所得橄榄渣粉末和质量分数8%的氢氧化钠溶液按1∶15 混合,于80 ℃水浴锅中水解80 min,随后用6 mol/L 盐酸中和。将上述所得混合物用高速离心机4 000 r/min 离心15 min,沉淀用大量蒸馏水洗涤,再离心,重复以上步骤3 次,弃上清,所得沉淀即为初始纤维素。将其置于50 ℃干燥箱中,干燥至恒重,使含水量不高于5%。保存在干燥器中备用。
1.2.2 微晶纤维素的制备 取上述初始纤维素分别 与2 mol/L H2SO4、2 mol/L HCl 按料液比1∶10混合,在45 ℃磁力搅拌水浴锅中水解45 min[8],转速为200 r/min,随后加入大量蒸馏水以停止反应,用质量分数8%的一定量氢氧化钠溶液中和,随后过滤所得滤渣分别为H2SO4-MCC、HCl-MCC。将其置于50 ℃干燥箱中,干燥至恒重,使含水量不高于5%。保存在干燥器中备用。
1.3 纤维素相关性质表征
1.3.1 持水性测定 准确称取1.00 g 纤维素于50 mL 离心管中,加入25 mL 蒸馏水,充分振荡1 h,继而3 000 r/min 离心10 min,随后弃去上层清液并用滤纸将壁上残留的水滴吸干,然后称取质量。按式(1)计算持水力(WRHC)[9]。
式中,m2——吸水后样品的质量(g);m1——吸水前样品的质量(g)。
1.3.2 持油性测定 准确称取1.00 g 纤维素于50 mL 离心管中,加入20 g 玉米油,室温下静置1 h。3 000 r/min 离心20 min,弃去上层清液并用滤纸将壁上残留的油滴吸干,然后称其质量。按式(2)计算持油力(WOHC)[9]。
式中,m2——吸油后样品的质量(g);m1——吸油前样品的质量(g)。
1.3.3 膨胀力测定 准确称取1.00 g 纤维素于20 mL 刻度试管中,轻微振荡,使表面保持平整,读取纤维素干品体积记为V1,然后准确移取10 mL 蒸馏水加入试管,振荡均匀后放置24 h,读取纤维素吸水之后的体积记为V2。按式(3)计算膨胀力(WSC)[10]。
式中,V2——吸水后的体积(mL);V1——吸水前的体积(mL);m——样品的质量(g)。
1.3.4 结晶度测定 将纤维素样品研磨至细粉末状,干燥至恒重,在室温下于X-射线衍射仪上进行谱图测定,在40 kV、40 mA,以及衍射角2θ=10°~40°条件下测定,扫描速度为0.02°/min。晶粒尺寸根据Scherrer 公式[11]计算,见式(4)。
式中,L002——水解纤维素002 面晶粒尺寸(nm);k——Scherrer 常数,取0.94;γ——X 射线的波长,为0.154 nm;β——衍射峰半高宽(rad);θ——衍射角(°)。
1.3.5 DSC 测定 称取5 mg 左右的纤维素置于DSC 铝盒中,以空的密封铝盒作为对照,氮气作为保护气,测定模式为Standard 模式,待测样品以10 ℃/min 的速率从20 ℃升至500 ℃[12]。
1.3.6 微观结构 采用电子扫描显微镜观察不同纤维素的微观结构,观察时采用高真空模式,工作电压为10 kV。将纤维素样品干燥,然后喷金,粘台后观察。
1.3.7 傅里叶变换红外光谱 准确称取1 mg 纤维素粉末于玛瑙研钵中充分研磨,再加入100 mg干燥至恒重的溴化钾粉末,继续研磨至样品与溴化钾粉末混合均匀后,称取30 mg 混合物压片,薄片置于傅里叶变换红外光谱仪上进行谱图测定。测定范围为4 000~400 cm-1,分辨率为4 cm-1。
1.3.8 乳化性测定 乳液的配制根据Hu 等[13]的方法稍作修改。将纤维素配成0.2%的悬浮液,然后10 000 r/min 匀浆2 min,按与玉米油质量比为4∶1 的比例加入一定量的玉米油进行混合,10 000 r/min 匀浆2 min。油滴和纤维素分别用尼罗红和荧光增白剂进行染色,用盖玻片覆盖载有乳液的载玻片,利用激光共聚焦扫描显微镜(CLSM)观察乳液的乳化结果。
2 结果与分析
2.1 持水力、持油力和膨胀力
3 种纤维素的持水力、持油力和膨胀力测定数据如表1所示,纤维素本身具有较高的持水性,这是因为纤维素中存在较多的羟基[14],纤维素与水分子间的氢键作用决定了其较高的持水性,经硫酸和盐酸水解之后得到的微晶纤维素,持水力由原先的3.19(初始纤维素)升高到3.81(H2SO4-MCC)和3.24(HCl-MCC),酸水解过程破坏了纤维素的原有结构,导致更多的亲水基团暴露,增加了亲水基团的比表面积,因此持水性增强。3 种纤维素的持油力均低于持水力,且总体较低,这是因为所提取的纤维素是水不溶性的,而申辉等[15]研究发现水溶性纤维具有较好的吸附有机物的特性,水不溶性纤维的吸油性相对较差。申瑞玲等[16]报道称高纤维素含量的食品可以降低对油脂的吸附,而木质素和半纤维素含量较高时持油性较强,这与本文酸水解之后微晶纤维素的持油性较低的结果相符。膨胀力的变化趋势与持水力一致,膨胀力代表纤维素的生理功能,即可以使人体肠道增容,使人产生饱腹感,可以有效预防肥胖症。硫酸水解得到的微晶纤维素的膨胀力最大,盐酸水解次之。且水解之后的微晶纤维素的膨胀力均高于初始纤维素,表明酸水解之后纤维素的生理活性有所提高。
表1 不同纤维素的持水力、持油力及膨胀力
Table 1 The water/oil holding capacity and swelling force of different cellulose samples
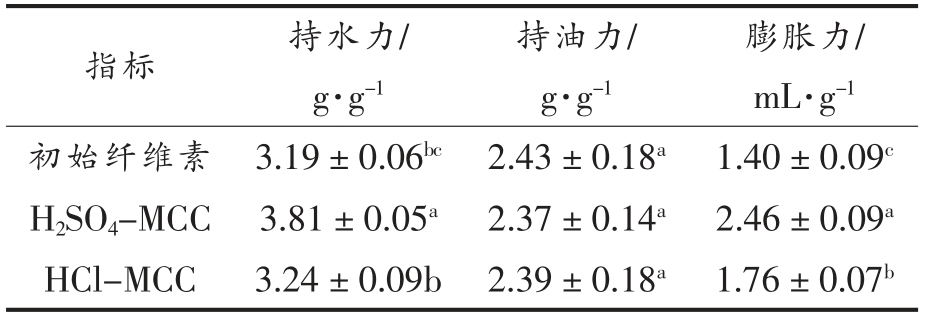
注:初始纤维素为碱液浸提得到的纤维素,H2SO4-MCC 为硫酸水解初始纤维素得到的微晶纤维素,HCl-MCC 为盐酸水解初始纤维素得到的微晶纤维素。表中不同小写肩标字母表示差异达显著水平(P<0.05)。
膨胀力/mL·g-1初始纤维素 3.19±0.06bc 2.43±0.18a 1.40±0.09c H2SO4-MCC 3.81±0.05a 2.37±0.14a 2.46±0.09a HCl-MCC 3.24±0.09b 2.39±0.18a 1.76±0.07b指标 持水力/g·g-1持油力/g·g-1
2.2 结晶度分析
不同的纤维素变体有纤维素Ⅰ、纤维素Ⅱ、纤维素Ⅲ、纤维素Ⅳ和纤维素X[17],图1为初始纤维素和微晶纤维素的XRD 图谱,H2SO4-MCC 与HCl-MCC 的衍射图谱基本一致,表明材料结晶具有相同性。观察几种纤维素的X 衍射图谱,可以看出,所有纤维素在2θ 约为22°左右有一个尖锐的峰,在2θ 约为14°和16°左右有2 个较为弱一点的峰,分别代表纤维素结晶区和无定形区的衍射强度,这是典型的纤维素Ⅰ型结构[18-20]。经酸水解前、后的纤维素,虽然特征谱线几乎一致,但结晶度有较大差异。通过Jade 软件计算出纤维素的结晶 度 分 别 为37.53% ( 初 始 纤 维 素)、75.77%(H2SO4-MCC) 和 64.92% (HCl-MCC)。依 据Scherrer 公式计算纤维素的晶粒尺寸分别为2.57 nm(初始纤维素)、5.35 nm(H2SO4-MCC)和4.96 nm(HCl-MCC)。与结晶区相比,无定形区纤维素分子链的排列是松散无序的。酸水解过程H+可以进入纤维素的无定形区,加速葡萄糖间糖苷键的断裂[21]。随着酸水解过程的进行,纤维素无定形区被水解,结晶区所占的比例升高,因此结晶度增大。这一结果与之前的报道[22]类似,即初始纤维素经过酸水解之后晶粒数量增多,尺寸增大,结构更加规整。晶粒尺寸增大也表明无定形区减少,结晶区比例增大,晶型更加完整。
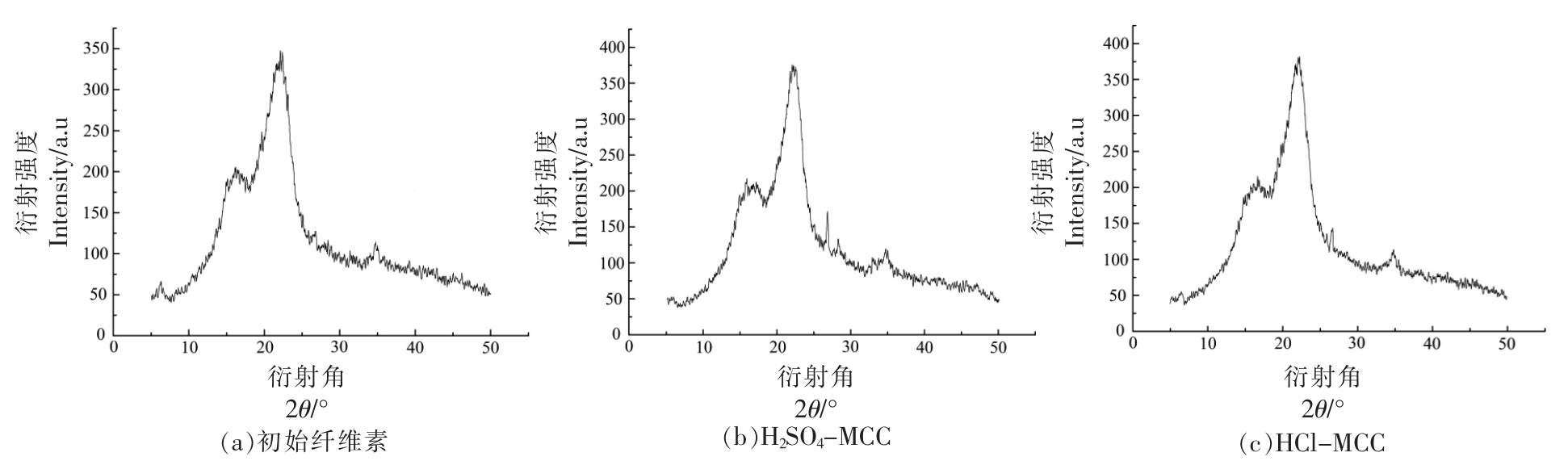
图1 不同纤维素的X 射线衍射图谱
Fig.1 XRD patterns of different cellulose samples
2.3 DSC 结果分析
图2所示为不同纤维素的DSC 曲线,由图2可知3 种纤维素在100 ℃和360 ℃左右有2 个明显的峰,100 ℃左右的峰代表水的蒸发损失,此温度越高,焓值越大,表明水的蒸发越困难,证明其持水性越好。水的蒸发温度从108.89 ℃(初始纤维素) 升高至112.57 ℃(H2SO4-MCC) 和109.9 ℃(HCl-MCC),这是由于酸水解之后纤维素表面暴露出更多的羟基,更容易保持水分,这与纤维素的持水性测定结果相一致。360 ℃左右的峰是由于随着温度的升高,在高温作用下分子链发生断裂,纤维素开始降解所形成,其温度受结晶度、结晶尺寸[23-24]的影响较大,此处的起点温度越高,热稳定性越好[25]。H2SO4-MCC 和HCl-MCC 的热降解温度稍低于初始纤维素,这可能是由于通过盐酸和硫酸水解作用导致粒径和聚合度减小,纤维素比表面积增大,暴露在外面的活性基团增多,因此热稳定性降低。
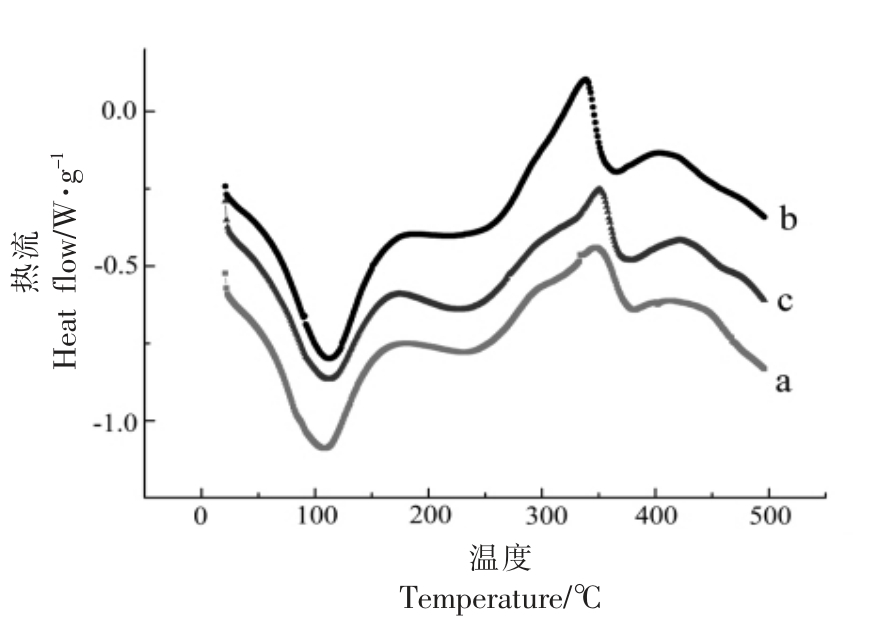
图2 不同纤维素的DSC 扫描图谱
Fig.2 DSC results of different cellulose samples
注:a.初始纤维素,b.H2SO4-MCC,c.HCl-MCC。
2.4 微观结构分析
SEM 图可用来分析纤维素的形态学特征和结构特征,如图3所示,初始纤维素的微观结构呈扁平且相互交叠状分布(图3a),由于半纤维素和木质素的存在使其分布杂乱又无序,且表面不平整。经酸水解后初始纤维素降解断裂,以短棒状的纤维片段为主,长度变短,直径几乎保持不变,表面更加光滑整齐(图3b,3c),可见纤维素的水解反应主要是结构疏松的无定形部分发生降解,纤维横向断裂,剩余部分表面更加光滑,结构更加紧凑[26],跟上述X 衍射结果一致。

图3 纤维素扫描电子显微镜图
Fig.3 Scanning electron microscope images of cellulose samples
2.5 傅里叶变换红外光谱(FTIR)分析
纤维素的FTIR 图谱如图4所示,3 条曲线峰在一定程度上都展示了其独特的特征结构。其中890 cm-1 与1 165 cm-1 处为β-1,4-糖苷键的特征吸收峰。3 650~3 000 cm-1 处的吸收峰是由纤维素分子中-OH 的伸缩振动所引起,酸水解后,由于氢键的形成,波数向低波数移动[27],表明酸水解有利于形成氢键。2 900 cm-1 处的吸收峰是C-H 基团的弯曲振动所引起,1 640 cm-1 是吸收水的峰[28],1 430 cm-1 处的吸收峰对应着-CH2-的伸缩振动[29];1 736 cm-1 代表的是羰基伸缩区中的一些附加带,是半纤维素中羧基和乙酰基中C-O 的伸缩振动,然而酸水解之后此处的峰变小甚至消失不见,表明酸水解之后部分半纤维素水解。
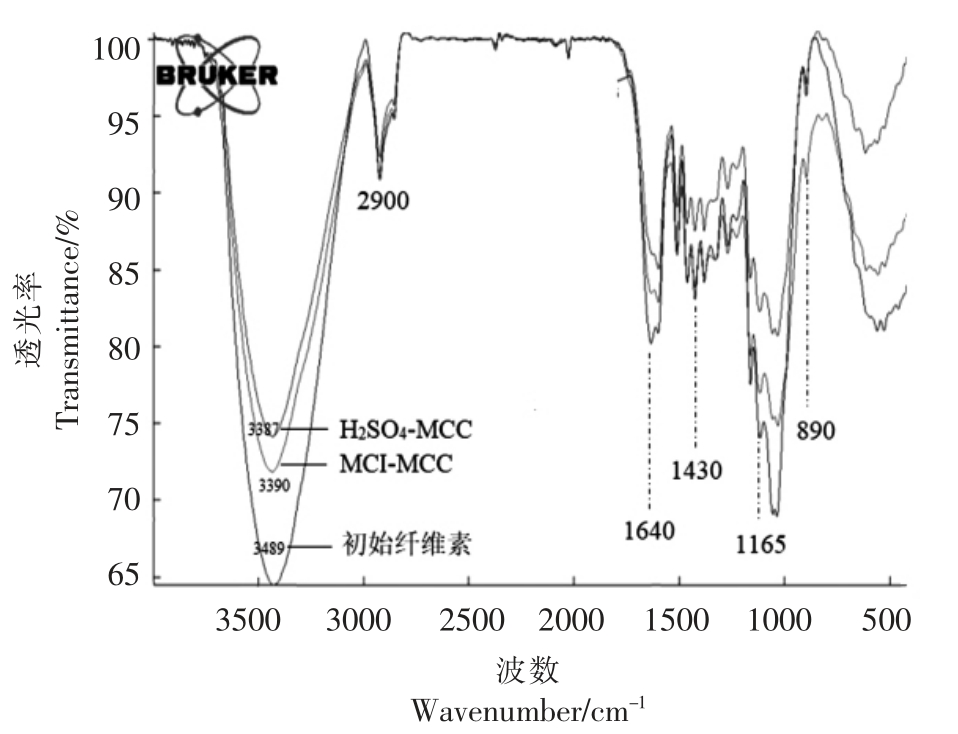
图4 不同纤维素样品的FTIR 图谱
Fig.4 FTIR spectrum of different cellulose samples
2.6 乳化性分析
用尼罗红和荧光增白剂1∶1 混合液对新鲜乳液进行染色,观察油滴的分布情况,这种纤维素固体颗粒可以吸附在油-水界面稳定乳液的机制称为皮克林机制,由固体颗粒稳定的乳液称为皮克林乳液[30],纤维素因具有高度有序的结晶结构,并且具有很强的分子内和分子间氢键,导致其难溶于水[31],因此限制了纤维素的乳液稳定作用。Kalashnikova 等[32]研究指出,酸水解纤维素是一个异构过程,得到含有大量纤维素纳米颗粒的浑浊悬浮液。颗粒在界面的不可逆吸附是液滴稳定的主要原因。图5红色区域代表油滴,蓝色区域代表纤维素基质,由图5可知,酸水解之后的微晶纤维素(图5b,5c)与初始纤维素(图5a)相比,油滴分布比较均匀且油滴较小,说明乳液稳定性较好[33]。对比H2SO4-MCC 与HCl-MCC 的乳化特性,发现H2SO4-MCC 形成的乳液更加稳定,形成这种情况的可能原因是SO42+的引入增加了纤维素的不可逆吸附作用[34]。

图5 纤维素乳液的CLSM 图片
Fig.5 CLSM images of cellulose emulsions
3 结论
本研究以橄榄果渣为原料,经干燥、粉碎、碱液浸提过程提取出橄榄果渣中的纤维素。在此基础上,进一步采用低浓度的硫酸和盐酸溶液将上述纤维素水解为微晶纤维素。酸水解后微晶纤维素的持水力和膨胀力增加,持油力低于持水力,且总体较低。X 衍射图谱表明初始纤维素与微晶纤维素均属于纤维素Ⅰ型,且微晶纤维素结晶度和晶粒尺寸较大,分别为75.77%,5.35 nm (H2SO4-MCC)以及64.92%,4.96 nm(HCl-MCC)。DSC 扫描结果显示微晶纤维素降解温度低于初始纤维素,这是由于微晶纤维素样品聚合度小,比表面积增加,暴露在外的活性基团较多,导致其热稳定性降低。FTIR 图谱证明酸水解使纤维素中部分半纤维素水解。SEM 图片显示酸水解之后纤维横向断裂,以短棒状的纤维片段为主,直径几乎不变。
[1]杨志攀,孔令明,冯宪超,等.橄榄渣提取物对马肉饼的抗氧化作用[J].食品工业科技,2018,39(14):6.
YANG Z P,KONG L M,FENG X C,et al.Antioxidant effect of olive pomace extract on horse patties[J].Science and Technology of Food Industry,2018,39(14):6.
[2]吴凡.橄榄果渣制备羟基酪醇及体外抗氧化活性研究[D].兰州:西北师范大学,2019.
WU F.Study on preparation of hydroxy tyrosol from olive pomace and it’s vitro antioxidant activity[D].Lanzhou:Northwest Normal University,2019.
[3]刘美辰.国内外橄榄油紫外吸光度限量标准和测定方法的对比研究[J].食品科技,2019,44(9):320-324.
LIU M C.Comparison and study of ultraviolet absorption limit standards and determination methods of olive oil from organizations and countries[J].Food Science and Technology,2019,44(9):320-324.
[4]BARTOLI M,ROSI L,GIOVANNELLI A,et al.Characterization of bio-oil and bio-char produced by low-temperature microwave-assisted pyrolysis of olive pruning residue using various absorbers[J].Waste Management & Research,2020,38(2):213-225.
[5]ABBOUD K Y,IACOMINI M,SIMAS F F,et al.High methoxyl pectin from the soluble dietary fiber of passion fruit peel forms weak gel without the requirement of sugar addition[J].Carbohydrate Polymers,2020,246:116616.
[6]周正容,林天昌,时小东,等.碳酸钠和盐酸法提取荞麦壳中水不可溶性膳食纤维的对比研究[J].食品工业科技,2020,41(14):8.
ZHOU Z R,LIN T C,SHI X D,et al.Comparative study on extraction of water insoluble dietary fiber from buckwheat shell by sodium carbonate and hydrochloric acid[J].Science and Technology of Food Industry,2020,41(14):8.
[7]程水明,陈亨坚,林朝霞,等.碱法提取桑椹果渣中不溶性膳食纤维工艺研究[J].中国酿造,2016,35(6):105-108.
CHENG S M,CHEN H J,LIN Z X,et al.Study on alkali extraction of insoluble dietary fiber from mulberry residue[J].China Brewing,2016,35(6):105-108.
[8]KUSUMATTAQIIN F,CHONKAEW W.Preparation and Characterization of microcrystalline cellulose(MCC) by acid hydrolysis using microwave assisted method from cotton wool[J].Macromolecular Symposia,2015,354(1):35-41.
[9]LU H,GUI Y,ZHENG L,et al.Morphological,crystalline,thermal and physicochemical properties of cellulose nanocrystals obtained from sweet potato residue[J].Food Research International,2013,50(1):121-128.
[10]MEI H,JIA X,DI Q,et al.Structure,physicochemical properties and adsorption function of insoluble dietary fiber from ginseng residue:A potential functional ingredient[J].Food Chemistry,2019,286:522-529.
[11]QIANG D,ZHANG M,LI J,et al.Selective hydrolysis of cellulose for the preparation of microcrystalline cellulose by phosphotungstic acid[J].Cellulose,2016,23(2):1199-1207.
[12]CAZON P,VELAZQUEZ G,VAZQUEZ M,et al.Novel composite films from regenerated celluloseglycerol-polyvinyl alcohol:Mechanical and barrier properties[J].Food Hydrocolloids,2019,89:481-491.
[13]HU Z,PATTEN T,PELTON R,et al.Synergistic stabilization of emulsions and emulsion gels with water-soluble polymers and cellulose nanocrystals[J].ACS Sustainable Chemistry,2015,3(5):1023-1031.
[14]GUO Y,ZHANG X H,HAO W H,et al.Nanobacterial cellulose/soy protein isolate complex gel as fat substitutes in ice cream model[J].Carbohydrate Polymers,2018,198:620-630.
[15]申辉,范学辉,张清安,等.苦杏仁皮水不溶性膳食纤维提取工艺优化及其特性分析[J].食品科学,2014,35(20):6-10.
SHEN H,FAN X H,ZHANG Q A,et al.Optimization of extraction process and characteristic analysis of water-insoluble dietary fiber from bitter almond peel[J].Food Science,2014,35(20):6-10.
[16]申瑞玲,陈明,董吉林.燕麦水溶性膳食纤维对高脂喂养小鼠肥胖预防研究[J].粮食与油脂,2012,25(2):10-12.
SHEN R L,CHEN M,DONG J L.Prevention of obesity in high fat fed mice with oat water-soluble dietary fiber[J].Cereals & Oils,2012,25(2):10-12.
[17]刘玲玲,田云波,刘雄.纳米豆渣纤维素的理化性质和表征特性[J].食品科学,2012,33(9):41-46.
LIU L L,TIAN Y B,LIU X.Physicochemical properties and characterization of nano soybean residue cellulose[J].Food Science,2012,33(9):41-46.
[18]ROBLES E,FERNÁNDEZ-RODRÍGUEZA J,BAR BOSA A M,et al.Production of cellulose nanoparticles from blue agave waste treated with environmentally friendly processes[J].Carbohydrate Polymers,2018,183:294-302.
[19]WANG W,LIANG T,BAI H,et al.All cellulose composites based on cellulose diacetate and nanofibrillated cellulose prepared by alkali treatment[J].Carbohydrate Polymers,2018,179:297-304.
[20]LI J,ZHANG X,ZHANG M,et al.Ultrasonic enhance acid hydrolysis selectivity of cellulose with HCl-FeCl3 as catalyst[J].Carbohydrate Polymers,2015,117(6):917-922.
[21]FURUKAWA H,KOBAYASHI N,ITAYA Y,et al.Effects of Brnsted and Lewis acidities on activity and selectivity of heteropolyacid-based catalysts for hydrolysis of cellobiose and cellulose[J].Green Chemistry,2009,11(10):1627-1632.
[22]KASIRI N,FATHI M.Production of cellulose nanocrystals from pistachio shells and their application for stabilizing Pickering emulsions[J].International Journal of Biological Macromolecules,2018,106:1023-1031.
[23]CHEN W,YU H,LIU Y,et al.Individualization of cellulose nanofibers from wood using high-intensity ultrasonication combined with chemical pretreatments[J].Carbohydrate Polymers,2011,83(4):1804-1811.
[24]COELHO C C S,MICHELIN M,CERQUEIRA M A,et al.Cellulose nanocrystals from grape pomace:Production,properties and cytotoxicity assessment[J].Carbohydrate Polymers,2018,192:327-336.
[25]MIRANDA M I G,BICA C I D,NACHTIGALL S M B,et al.Kinetical thermal degradation study of maize straw and soybean hull celluloses by simultaneous DSC-TGA and MDSC techniques[J].Thermochimica Acta,2013,565(6):65-71.
[26]张美云,强丹丹,李金宝,等.微晶纤维素制备过程中纤维素结构与形态特征的变化[J].中国造纸,2016,35(6):28-32.
ZHANG M Y,QIANG D D,LI J B,et al.Changes of cellulose structure and morphological characteristics during the preparation of microcrystalline cellulose[J].China Pulp and Paper,2016,35(6):28-32.
[27]姚远,张洋,赵华,等.酸法制备纳米纤维素特性及其气凝胶的制备[J].纤维素科学与技术,2017,25(2):38-44.
YAO Y,ZHANG Y,ZHAO H,et al.Preparation of nanofibers by acid method and preparation of aerogels[J].Cellulose Science and Technology,2017,25(2):38-44.
[28]AHMADI M,MADADLOU A,SABOURI A A,et al.Isolation of micro-and nano-crystalline cellulose particles and fabrication of crystalline particles-loaded whey protein cold-set gel[J].Food Chemistry,2015,174(1):97-103.
[29]HAAFIZ M K M,HASSAN A,ZAKARIA Z,et al.Physicochemical characterization of cellulose nanowhiskers extracted from oil palm biomass microcrys talline cellulose[J].Materials Letters,2013,113(12):87-89.
[30]ZHU Y,MCCLEMENTS D J,ZHOU W,et al.Influence of ionic strength and thermal pretreatment on the freeze-thaw stability of Pickering emulsion gels[J].Food Chemistry,2020,303:125401.
[31]DANG X,LIU P,YANG M,et al.Production and characterization of dialdehyde cellulose through green and sustainable approach[J].Cellulose,2019,26(5):247-254.
[32]KALASHNIKOVA I,BIZOT H,CATHALA B,et al.New Pickering emulsions stabilized by bacterial cellulose nanocrystals[J].Langmuir the ACS Journal of Surfaces & Colloids,2011,27(12):7471-7479.
[33]BAI L,LV S,XIANG W,et al.Oil-in-water Pickering emulsions via microfluidization with cellulose nanocrystals:1.Formation and stability[J].Food Hydrocolloids,2019,96:699-708.
[34]KALE R D,BANSAL P S,GORADE V G,et al.Extraction of microcrystalline cellulose from cotton sliver and its comparison with commercial microcrystalline cellulose[J].Journal of Polymers & the Environment,2018,26(1):355-364.