鱼糜制品因营养丰富、口感鲜嫩等特点而深受广大消费者喜爱。低温冷冻贮藏作为冷冻鱼糜品质保持的重要手段之一,能够抑制鱼糜制品中微生物生长,延长产品货架期。然而,鱼糜在冷冻过程中会形成较大冰晶,其力学效应会破坏组织细胞,严重影响鱼糜质构特性,导致营养成分损失,持水性下降,以及加工特性降低等一系列不良后果。
近年来,关于冷冻鱼糜制品品质控制的研究主要集中于:以抑制冰晶生长为靶向的抗冻剂的研发。冰晶的形成是鱼糜冷冻过程中最直接、最显著的物理变化,是导致冷冻鱼糜品质劣化的“元凶”。冰晶的力学效应会破坏肌肉组织结构,导致反应因子外泄,从而使蛋白质、脂质等鱼糜主要组分发生一系列生化反应,进而影响冷冻鱼糜的质地特征、感官品质和营养价值。目前,仅以抑制冰晶形成为作用靶点的抗冻剂因安全及成本的局限性,而使其应用受到限制。例如:传统抗冻剂蔗糖等糖类,因高热量、高甜度而导致肥胖和龋齿等健康问题,且不适于糖尿病患者食用;多聚磷酸盐的摄入亦存在加重高血压或慢性肾病等的风险[1-2]。抗冻蛋白和抗冻多肽因优异的抗冻特性而受到人们的青睐,然而其高昂的生产成本,苛刻的制备条件,使其难以规模化应用于鱼糜加工业,因此有必要对现有冷冻保护策略做补充和拓展,以最大程度地增强鱼糜的冷冻品质。
鉴于上述抗冻剂的局限性,仅通过抑制冰晶形成或许无法完全实现鱼糜的冷冻保护。通过添加冷冻稳定剂(多糖、亲水性胶体、抗氧化物质等)进一步增强鱼糜组分的冻融稳定性,或可作为抗冻手段的重要补充,从而最大程度实现鱼糜的冷冻保护。与抗冻剂的作用对象不同(控制冰晶形成),冷冻稳定剂是基于自身结构的化学可反应性,通过与关键鱼糜组分(蛋白质和脂肪)的相互作用,以增强鱼糜的冷冻保护能力(图1)[3-4]。目前已有大量文献总结了冰晶的形成机理和几种抗冻剂的冷冻保护机制[5-7],然而对于以稳定鱼糜组分为作用靶向的冷冻稳定剂及其稳定机制尚无系统的总结。本文重点阐述几类冷冻稳定剂(糖类、蛋白水解物类、胶体类和多酚类等)的稳定机理,并总结冷冻鱼糜冷冻期间发生的品质劣化规律,对于进一步增强鱼糜的冷冻贮藏品质以及开发高品质鱼糜制品具有重要意义。
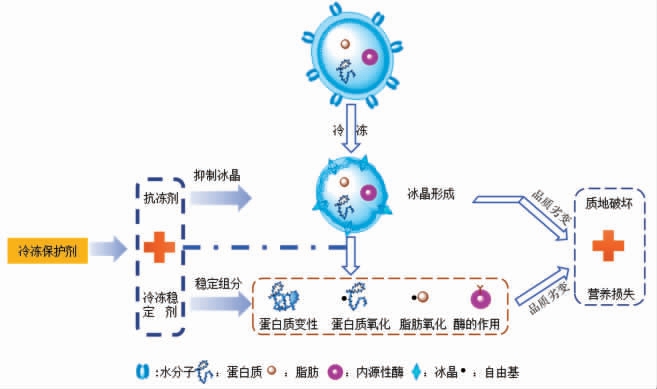
图1 冷冻鱼糜低温保护策略示意图
Fig.1 Schematic diagram of cryoprotective strategy for frozen surimi
1 鱼糜冻藏期间品质变化规律
在鱼糜的制备过程中,通过漂洗可除去部分脂肪、水溶性蛋白质、色素以及一些内源性蛋白酶[8],在一定程度上延缓了鱼糜贮藏过程中的品质劣变。然而漂洗后的鱼糜还保留了一定量的脂质、内源性蛋白酶等[9-10],在冰晶力学效应作用下,蛋白酶、促氧化辅助因子从受损组织泄出,从而导致蛋白质降解和脂肪氧化等不良反应(表1)。此外鱼糜中丰富的蛋白质也容易在冷冻条件下发生氧化、聚集和变性等生化反应。鱼糜组分在冷冻过程中的上述反应,进一步影响鱼糜的色泽、凝胶性、质构特性、持水性以及营养特性。
1.1 色泽变化
色泽是衡量鱼糜品质的重要指标,色泽不仅影响人们食用鱼糜制品的感官体验,还可反映鱼糜制品品质的劣化程度。高铁肌红蛋白和脱氧肌红蛋白是鱼类肌肉中红色色素的主要成分,而鱼糜在冻藏期间的色泽变化主要是由于肌红蛋白氧化形成高铁肌红蛋白[11],这与鱼糜冻藏的脂质氧化密切相关。已有研究表明,脂质氧化的次生产物己烯醛和4-羟基壬烯醛(4-HNE)等醛类物质会与蛋白质中的亲核氨基酸残基通过共价作用结合,从而促进氧合肌红蛋白氧化形成高铁肌红蛋白[12]。一般而言,随着鱼糜冻藏时间的延长,鱼糜的白度值下降。陈康[13]研究发现,在30 d 冷冻贮藏过程中,复合鱼糜制品的L*值(亮度值)和白度值呈现下降趋势。这可能由于在贮藏过程中部分微生物生长分解蛋白质,产生的一些代谢产物在鱼糜中堆积,从而影响鱼糜色泽;另一方面,可能是由于冷冻过程中的油脂腐败加速了鱼糜色泽的变化。
1.2 凝胶特性变化
冷冻过程中肌原纤维蛋白变性,其构象发生不可逆改变,导致其理化性质改变,将直接影响鱼糜的凝胶能力。Benjakul 等[14]研究了冷冻对鱼糜凝胶特性的影响,在冷藏过程中蜥蜴鱼鱼糜的破断力和凹陷深度均显著下降,-18 ℃下冷藏1 周后破断力和凹陷深度较新鲜样本分别下降43.8%和71.8%。冷冻过程中鱼糜凝胶特性的下降是多种因素共同作用的结果[14-15]:一方面由于冷冻过程中组织结构被破坏,导致TMAOase 被释放到肌肉组织中,通过氧化三甲胺(Trimetlylamine oxide,TMAO)生成甲醛,破坏肌球蛋白的完整性,从而导致鱼糜蛋白凝胶能力降低;另一方面,冷冻贮藏过程中发生的脂质氧化等生化反应也会对鱼糜蛋白的结构和功能造成不利影响;此外,鱼糜凝胶特性的减弱除了与肌球蛋白变性有关以外,鱼糜中的谷氨酰胺转氨酶(Transglutaminase,TGase)活性降低也是使得鱼糜凝胶能力下降的因素之一。
1.3 质构特性变化
鱼糜的质构特性是反映鱼糜品质的关键指标之一。冻藏过程中鱼糜凝胶的硬度、弹性、咀嚼性和胶黏性都呈现先增强后下降的趋势。冻藏初期鱼糜质构增强是由于冻藏过程中肌原纤维蛋白构象发生变化,以及脂质氧化产生的羟基自由基促进巯基氧化,导致二硫键增多,表面疏水性增强,从而加强了鱼糜蛋白的相互交联;然而随着贮藏时间的延长,肌原纤维蛋白的氧化过度交联会阻碍反应性官能团的有序作用,使蛋白质基质中的氢键相互作用减弱,最终降低了蛋白质-蛋白质和蛋白质-水之间的相互作用,导致鱼糜凝胶质构特性降低[16]。此外,冷冻期间鱼糜的内源性蛋白酶和由微生物产生的蛋白酶对结缔组织蛋白的水解作用也可能是鱼糜质构特性降低的另一原因[17]。
1.4 持水性变化
持水性特是衡量鱼糜品质的重要指标,可以反映鱼糜蛋白的变性程度。任丽娜[18]研究了-18℃和-50 ℃下白鲢鱼鱼糜持水性的变化,结果显示,随冻藏时间的延长,鱼糜持水性持续下降,且-18 ℃下贮藏12 周的鱼糜持水性下降超过20%,滴水损失超过10%,显著低于-50 ℃贮藏的鱼糜。研究表明,冻藏过程中鱼糜持水性的下降和滴水损失的增加与蛋白质变性密切相关。冻藏期间冰晶的形成破坏了细胞,造成水分流失,一方面会导致稳定蛋白质结构的氢键遭到破坏,蛋白质亲水区域和疏水区域暴露,并与相邻蛋白区域相互作用致使蛋白质聚集变性,另一方面脱水导致体系离子强度增大,同样诱导蛋白质发生聚集变性[19]。鱼糜蛋白质的聚集变性导致其功能特性降低,持水能力显著降低。
2 冷冻鱼糜品质劣化机制
冻藏期间鱼糜品质变化与自身组分(蛋白质、脂质和水分)的各种生化反应密切相关。国内外对冻藏鱼糜品质劣化机制进行了大量研究 (表1),主要包括冰晶的机械效应、酶的激活、脂质氧化以及蛋白质冷冻变性。
表1 鱼糜冻藏期间品质变化规律及其发生机制
Table 1 Quality changes and the corresponding mechanisms of surimi during frozen storage

品质变化 变化机制 参考文献a.冻藏过程中鱼糜发生一定的褐变,红度值(a*)降低,同时显著降低其白度。b.冻藏期间鱼糜凝胶特性降低,鱼糜蛋白成凝胶能力下降。c.冻藏初期鱼糜质构特性有所增强,然而随着冻藏时间的延长,其质构特性劣化,硬度、弹性、咀嚼性等均降低。d.冻藏期间鱼糜持水性下降,保水能力降低。a.冰晶形成导致细胞脱水,一方面使得稳定蛋白质构象的氢键被破坏,另一方面导致体系离子浓度升高,蛋白质发生聚集变性,造成鱼糜品质发生劣变。b.氧化三甲胺脱甲基酶(Trimethylamine-N-oxidedemethylase,TMAOase)催化产生甲醛诱导鱼糜蛋白质交联,造成鱼糜品质劣化。c.内源性蛋白水解酶作用于肌原纤维蛋白,导致其发生不可逆降解,维持鱼糜品质特性的主要蛋白质被破坏。d.脂质氧化产生的次级氧化产物造成鱼糜酸败变质,还会与肌红蛋白通过共价结合改变其在鱼糜中的存在形态,造成鱼糜色泽劣化。e.脂质氧化产生的次级氧化产物诱导鱼糜蛋白质加速氧化变性,导致蛋白质构象改变,功能特性丧失,造成鱼糜品质劣变。f.鱼糜蛋白质冷冻变性,构象发生不可逆变化,功能特性丧失,导致巯基氧化、疏水性氨基酸残基暴露等,造成鱼糜品质劣化。[12]~[23]
2.1 内源性酶激活
氧化三甲胺脱甲基酶(Trimethylamine-N-oxidedemethylase,TMAOase),是一种存在于海产品肌肉和内脏组织中的内源酶,该酶可以催化氧化三甲胺(Trimetlylamine oxide,TMAO)还原产生二甲胺(Dimethylamine,DMA)和甲醛(Formaldehyde,FA)。Huidobro 等[24]研究发现,冻藏后的鱼糜蛋白中形成稳定的非二硫共价键,增强了蛋白质之间的交联程度。甲醛被认为是诱导鱼糜蛋白质交联的主要物质之一。这可能是由于在鱼糜冻藏过程中,冰晶的形成破坏了细胞组织,TMAOase 进入肌肉组织催化TMAO 形成DMA 和FA,促进蛋白质交联变性,导致鱼糜蛋白质构象发生变化,从而影响鱼糜的品质[19]。TMAOase 对冷冻鱼糜品质的影响与鱼的种类及加工过程密切相关。TMAOase 通常存在于鳕科类鱼类中,而在非鳕科鱼类(鲱鱼、鲉鱼、鲭鱼等)的组织中TMAOase 活性很低或几乎没有,且TMAOase 通常在鱼类内脏组织中活性较高,肌肉组织中活性较低[25]。
鱼肉中除了氧化三甲胺脱甲基酶外,还存在多种内源性酶,一定程度上影响鱼糜的凝胶品质。例如,TGase 作为一种内源性酶,通过催化蛋白质转移酰胺基的转移酶,可以催化鱼糜赖氨酸残基上的ε-酰基形成蛋白质分子间的ε-(γ-谷氨酰胺)-赖氨酸交联,从而增强鱼糜的凝胶品质[26]。TGase 对鱼糜凝胶的增强效应在冷冻贮藏初期尤为明显。这可能由于鱼糜蛋白质结构的变化,使鱼糜中游离氨基酸含量增加,在TGase 作用下促进了蛋白质分子间的交联,增强了鱼糜质构特性[27]。然而长期冷冻会破坏TGase 构象,使TGase 活性下降甚至丧失,从而导致鱼糜品质劣化。
此外,鱼肉组织中还存在多种以组织蛋白酶为主的内源性蛋白水解酶。其中丝氨酸蛋白酶和半胱氨酸蛋白酶可能是导致肌原纤维蛋白降解的主要内源性酶。鱼糜在冻藏期间肌肉组织内的丝氨酸蛋白酶外泄,水解肌原纤维蛋白,会造成鱼糜品质不可逆劣变[21]。鱼糜的漂洗加工可以去除组织蛋白酶B 和H,然而无法去除具有较高活性的组织蛋白酶L。组织蛋白酶L 能催化水解鱼糜肌球蛋白[28],造成鱼糜品质劣变。低温贮藏对组织蛋白酶的活性影响很小,在-20 ℃下冷藏8 周仍保留了77%的活性[29]。目前,鱼糜中添加特定内源酶抑制剂(半胱氨酸酶抑制剂、丝氨酸酶抑制剂等)是解决内源性蛋白水解酶作用的有效手段。
2.2 脂质氧化
脂质氧化是导致水产品冻藏期间发生变质腐败的重要因素,不仅对产品色泽产生不利影响,还是导致产品产生异味和腐臭味的主要因素[30]。鱼糜在冷冻贮藏期间通过脂质氧化反应可产生自由基以及醛、酮等次级代谢产物,是导致鱼糜冻藏期间品质劣变的关键因素之一。一方面,脂质氧化产生的代谢产物直接危害鱼糜品质;另一方面,脂肪氧化产生的羟基自由基和过氧自由基将肌原纤维蛋白中的巯基氧化形成二硫键[20]。在氧存在的情况下,自由基与蛋白质和肽的反应会引起肽链主链和氨基酸侧链发生构象改变,如图2所示,蛋白质氧化会导致蛋白质共价交联衍生物的形成、氨基酸侧链的改性以及肽键断裂等。氧化反应带来的蛋白质构象的变化进一步导致鱼糜品质发生劣化,造成冷冻鱼糜凝胶特性和持水性下降,色泽变差,必需氨基酸损失以及蛋白质消化率降低[31-32]。
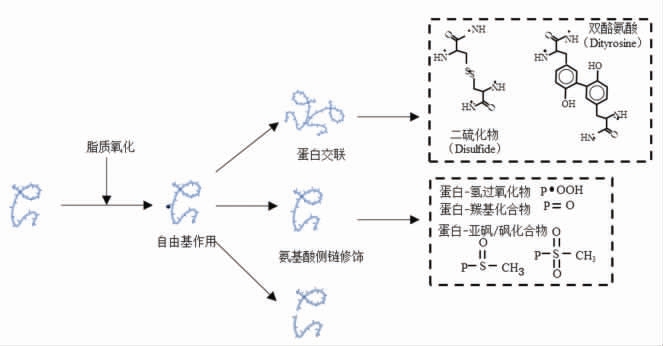
图2 脂质氧化诱导蛋白质构象变化
Fig.2 Conformational changes of protein induced by lipid oxidation
2.3 蛋白质冷冻变性
鱼肉蛋白冻藏过程中的品质劣变与鱼糜肌原纤维蛋白的结构演变密切相关。通过拉曼光谱发现,冻藏期间鱼糜蛋白质α-螺旋结构减少,无规卷曲相对含量升高,主链构象由有序发展为无序,导致鱼糜盐溶性蛋白含量下降,巯基氧化形成二硫键,Ca2+-ATPase 活力下降,以及芳香族氨基酸残基暴露导致疏水相互作用增强,造成鱼糜品质劣变[23]。
国内外学者对鱼肉蛋白冷冻变性机理进行了大量研究,并取得了一定成果。目前人们广泛接受的蛋白质冷冻变性模型主要包括以下两种:一是蛋白质分子的聚集,二是蛋白质多肽链的展开[22]。图3为冻藏过程中鱼糜蛋白质聚集变性模型。蛋白质聚集变性主要是具有α-螺旋结构蛋白质(如肌球蛋白)的变性模型。该模型指出,随着冻藏温度的降低,温度较低部位的水分形成冰晶,未冻结部分的水分子开始向冰晶形成区域迁移,冰晶生长,最终导致结合水脱离蛋白质结合位点,使蛋白质表面的功能基团相互暴露,并通过氢键、离子键、疏水键和二硫键等相互作用导致蛋白质聚集变性[22]。
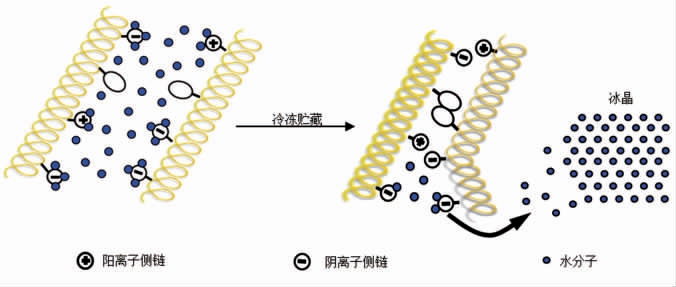
图3 冻藏过程中鱼肉蛋白质(聚集)变性模型[22]
Fig.3 Denaturation (aggregation) model of fish protein in frozen storage[22]
图4为冻藏过程中鱼糜蛋白质展开变性模型。蛋白质多肽链的展开变性主要是具有非螺旋结构或球形结构蛋白质 (如肌动蛋白) 的变性模型。未冻结时,蛋白质以高度水化的折叠蛋白状态存在,此时多肽链上的非极性基团位于蛋白质分子内部,热力学性质稳定。且蛋白质分子内部的非极性基团相互作用形成化学键进一步稳定了这种状态。随着冻藏过程进行,冰晶形成和生长使蛋白质水化程度降低,导致多肽链展开,蛋白质分子以开链状态存在,同时引起蛋白质理化性质发生变化[22]。
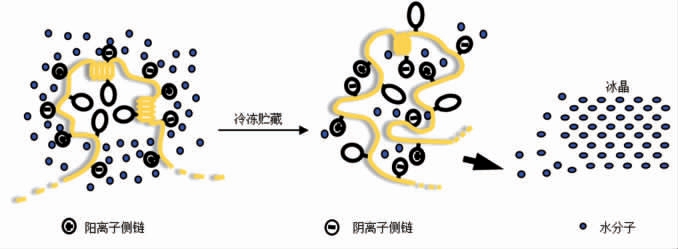
图4 冻藏过程中鱼肉蛋白质(展开)变性模型[22]
Fig.4 Denaturation (unfolding) model of fish protein in frozen storage[22]
3 冷冻稳定剂
鉴于现有抗冻剂(蔗糖、山梨醇、磷酸盐、抗冻蛋白和抗冻肽)的安全性、有效性及经济性,单纯通过抗冻剂抑制冰晶形成,或许无法较大程度提高鱼糜的冻藏品质。从稳定冷冻鱼糜组分的角度出发,通过添加不同种类的冷冻稳定剂以增强鱼糜组分的冻藏稳定性,或许可作为鱼糜冷冻保护策略的重要补充,从而最大程度上提高鱼糜及其制品的冷冻品质[33-35]。
与抗冻剂的作用对象不同(控制冰晶形成),冷冻稳定剂通过抑制食品组分冷冻过程中的各种生化反应,实现冷冻保护的目的。冷冻稳定剂种类繁多,根据化学性质的不同,冷冻稳定剂大致分为以下几类:糖类冷冻稳定剂、蛋白水解物类冷冻稳定剂、胶体类冷冻稳定剂以及多酚类冷冻稳定剂。不同的冷冻稳定剂对鱼糜冷冻贮藏品质的控制效果也有所差别,这取决于其不同的结构组成。一般而言,具有冷冻稳定效果的化学物通常具备以下特征:(1)相对较小的分子质量;(2)具有丰富的化学反应基因,分子中须含有一个必须基团和一个及以上的辅助基团,且两种基团空间分布合理[18]。
表2 冷冻稳定剂种类和作用机制
Table 2 Classification of frozen stabilizers and acting mechanism
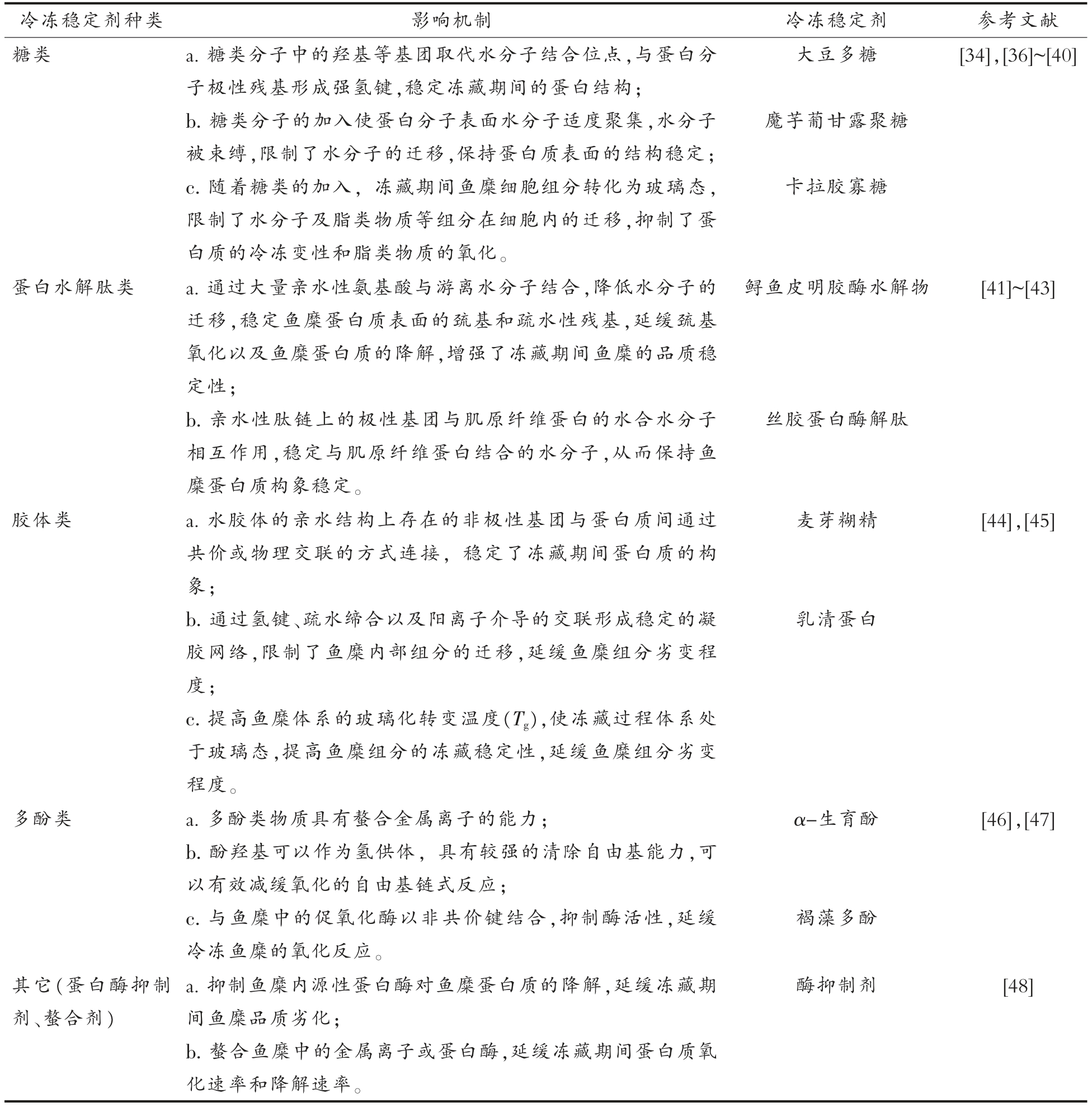
冷冻稳定剂种类 影响机制 冷冻稳定剂 参考文献糖类 a.糖类分子中的羟基等基团取代水分子结合位点,与蛋白分大豆多糖[34],[36]~[40]子极性残基形成强氢键,稳定冻藏期间的蛋白结构;b.糖类分子的加入使蛋白分子表面水分子适度聚集,水分子被束缚,限制了水分子的迁移,保持蛋白质表面的结构稳定;c.随着糖类的加入,冻藏期间鱼糜细胞组分转化为玻璃态,限制了水分子及脂类物质等组分在细胞内的迁移,抑制了蛋白质的冷冻变性和脂类物质的氧化。魔芋葡甘露聚糖卡拉胶寡糖蛋白水解肽类 a.通过大量亲水性氨基酸与游离水分子结合,降低水分子的迁移,稳定鱼糜蛋白质表面的巯基和疏水性残基,延缓巯基氧化以及鱼糜蛋白质的降解,增强了冻藏期间鱼糜的品质稳定性;b.亲水性肽链上的极性基团与肌原纤维蛋白的水合水分子相互作用,稳定与肌原纤维蛋白结合的水分子,从而保持鱼糜蛋白质构象稳定。胶体类 a.水胶体的亲水结构上存在的非极性基团与蛋白质间通过共价或物理交联的方式连接,稳定了冻藏期间蛋白质的构象;b.通过氢键、疏水缔合以及阳离子介导的交联形成稳定的凝胶网络,限制了鱼糜内部组分的迁移,延缓鱼糜组分劣变程度;c.提高鱼糜体系的玻璃化转变温度(Tg),使冻藏过程体系处于玻璃态,提高鱼糜组分的冻藏稳定性,延缓鱼糜组分劣变程度。多酚类 a.多酚类物质具有螯合金属离子的能力;b.酚羟基可以作为氢供体,具有较强的清除自由基能力,可以有效减缓氧化的自由基链式反应;c.与鱼糜中的促氧化酶以非共价键结合,抑制酶活性,延缓冷冻鱼糜的氧化反应。鲟鱼皮明胶酶水解物丝胶蛋白酶解肽麦芽糊精乳清蛋白α-生育酚褐藻多酚[41]~[43][44],[45][46],[47]其它(蛋白酶抑制剂、螯合剂)a.抑制鱼糜内源性蛋白酶对鱼糜蛋白质的降解,延缓冻藏期间鱼糜品质劣化;b.螯合鱼糜中的金属离子或蛋白酶,延缓冻藏期间蛋白质氧化速率和降解速率。酶抑制剂 [48]
3.1 糖类
糖类分子可以增大水分子表面张力,将部分自由水转化为结合水,导致蛋白质水化程度增强,抑制了蛋白质的聚集变性[49]。已有大量研究证实几种多糖(大豆多糖、壳聚糖和魔芋寡糖甘露聚糖等)能有效增强鱼糜组分的冻藏稳定性[34,38]。大豆多糖的添加可以有效抑制冻藏期间鱼糜蛋白质溶解度的下降,防止巯基含量的减少以及Ca2+-ATPase活性降低,从而可以抑制鱼糜蛋白冷冻变性[34]。壳聚糖也是一种优良的鱼糜冷冻保护剂,其可通过多重效应实现对鱼糜的冷冻保护:(1)螯合效应:壳聚糖通过与某些促氧化的金属离子反应形成络合物[50],降低冻藏期间鱼糜品质劣化;(2)抑菌效应:壳聚糖通过抑制鱼糜中的腐败细菌来延缓鱼糜蛋白降解并保持其结构稳定;(3)凝胶效应:壳聚糖还可以通过增强鱼糜的凝胶特性来减轻冷冻对鱼糜品质劣化的影响[51]。魔芋寡糖甘露聚糖具有丰富的亲水基团及少量的支链,添加魔芋寡糖甘露聚糖还可以保护肌原纤维蛋白的完整性,抑制冻藏期间鱼糜蛋白变性。此外,魔芋寡糖甘露聚糖还具有很强的抗氧化活性,显著降低冻藏期间脂质过氧化产物的生成,可以作为冷冻鱼糜的低温冷冻保护剂[38]。寡糖在增强肌原纤维蛋白冻藏稳定性方面也具有出色的表现,一方面卡拉胶寡糖可以通过氢键作用与蛋白质带电荷氨基酸的极性残基结合,增强冻藏期间蛋白质的稳定性,另一方面寡糖具有较强的自由基清除活性,因此卡拉胶寡糖同时具备稳定蛋白质和抗氧化的双重作用,是高效鱼糜冷冻稳定剂的选择之一[40]。
3.2 蛋白水解肽类
蛋白水解多肽的肽段序列中含有大量亲水性氨基酸,如脯氨酸、天冬酰胺、谷氨酰胺、精氨酸等。这些亲水性氨基酸具有高效的结合水分子能力,通过与肌原纤维蛋白水合水分子间的相互作用,使鱼糜蛋白质周围冻结水含量下降,起到维持肌原纤维蛋白构象稳定的作用[41,52]。
蛋白水解多肽的氨基酸组成和分子质量大小等均会影响其冷冻保护特性。研究发现,多肽中的丙氨酸、亮氨酸、蛋氨酸、缬氨酸等疏水性氨基酸和芳香族氨基酸可以作为质子供体淬灭自由基,抑制氧化反应的发生,且分子质量较低的多肽具有更强的淬灭自由基的能力,而蛋白水解肽中的亲水性氨基酸则起到约束水分子稳定鱼糜蛋白构象的作用[53]。Nikoo 等[42]研究发现,鲟鱼皮明胶酶水解物中含有丰富的疏水性氨基酸(如甘氨酸、脯氨酸等),大量的疏水性氨基酸使其具备较强的淬灭自由基的活性,增强冷冻鱼糜的抗氧化能力。此外,明胶水解物还具有约束水分子在鱼糜内部迁移的作用,稳定冻藏期间鱼糜蛋白结构。Korzeniowska 等[54]利用风味蛋白酶酶解太平洋鳕鱼得到鱼蛋白水解物,发现鱼蛋白水解物可通过与鱼肉蛋白质相互作用,形成具有低温保护的凝胶网络,抑制冻藏期间蛋白质冷冻变性,防止鱼糜在冻藏期间品质劣变。丝胶蛋白酶解肽含有丰富的极性氨基酸,特别是丝氨酸(Ser)和苏氨酸(Thr)等含羟基侧链的氨基酸,研究表明,丝胶蛋白酶解肽的添加可以有效抑制巯基的氧化,延缓埋藏在蛋白质表面的疏水性残基的暴露和鱼糜肌球蛋白重链的降解,从而延缓冻藏期间鱼糜品质的劣化[43]。
3.3 胶体类
亲水性胶体具有诸多功能特性,如胶凝特性、乳化特性、增稠特性以及抗冻特性等。胶体对鱼糜的冷冻稳定作用主要依赖于其黏度效应和凝胶效应。胶体结构中的某些活性基团可通过物理或化学交联方式提高蛋白质的冻藏稳定性;此外,也有研究表明,胶体还可提高体系的玻璃化转变温度(Tg),使体系处于玻璃态,提高了鱼糜组分的冻藏稳定性[55]。
一般而言,具有低温保护功能的亲水性胶体主要可以分为两大类[55]:一是琼脂、卡拉胶、海藻酸和阿拉伯树胶等多糖类亲水胶体;二是明胶、乳清蛋白等蛋白类亲水胶体。Akkose 等[56]研究了阿拉伯树胶对在玻璃化转变温度(Tg)下贮藏的牛肉的低温保护作用,阿拉伯树胶可以通过形成凝胶结构来抑制组织细胞间水分子的迁移,减小了冻藏期间牛肉组织的破坏,抑制了冻藏期间的脂肪与氧气的接触以及疏水性氨基酸的暴露,从而稳定了肉类组织中的成分,延缓其在冷冻条件下的品质劣化。Carvajal 等[44]研究了不同分子质量的麦芽糊精在抑制鱼肉蛋白质变性中的作用,结果表明,高分子质量的麦芽糊精通过固定水分子和提高玻璃化转变温度,从而增强了鱼肉蛋白质在低温下的构象稳定性,而低分子质量的麦芽糊精则是通过溶质排斥机制,即蛋白质-溶质相互作用,作为溶质被排除在蛋白质结构域之外,导致体系自由能增加,从而稳定了蛋白质构象,实现冰冻状态下蛋白的稳定性[39]。
某些蛋白类亲水胶体也具有一定的低温保护作用,其作为亲水胶体发挥低温保护作用主要归因于两方面[55,57]:一是作为增稠剂和胶凝剂,稳定鱼糜内部的游离水、脂质及蛋白质等组分;二是其含有丰富的亲水性氨基酸,可以很好地稳定与蛋白质结合的水分子,为鱼糜蛋白提供一个稳定的环境,阻碍蛋白质发生聚集变性。乳清蛋白可通过较强的自由基清除活性,有效抑制冻藏期间鱼糜的蛋白质氧化[58]。毕海丹等[45]发现乳清蛋白的添加能够减缓鱼糜脂质氧化和蛋白质变性,乳清蛋白分散在鱼糜中与肌原纤维蛋白相结合,稳定蛋白质结构,在一定程度上阻断了自由基链式反应,从而增强了冷冻鱼糜的持水能力,减弱了鱼糜质地劣化程度。
3.4 多酚类
鱼糜冻藏过程发生的脂质氧化和蛋白质氧化是造成鱼糜品质劣变的重要因素。为控制冻藏期间鱼糜的组分氧化,目前主要的方法是添加一些抗氧化物质,其中多酚类物质研究较为广泛。多酚类物质的抗氧化机理在于[59]:(1)多酚类物质具有螯合金属离子的能力,可以降低金属离子对于冻藏鱼糜品质劣化的诱导作用[60];(2)酚羟基可以作为氢供体,清除自由基能力强,可以有效减缓氧化的自由基链式反应;(3)酚类物质可以与鱼糜中的氧化酶通过非共价键结合,抑制酶活性,延缓冷冻鱼糜的氧化反应。
袁悦等[59]研究发现,添加表没食子儿茶素没食子酸酯(EGCG)可以减缓冻藏期间罗非鱼鱼糜肌原纤维蛋白的羰基化作用,有效抑制鱼糜在冻藏期间发生的蛋白质氧化和降解。EGCG 较强的自由基清除能力和螯合金属离子能力是其抑制鱼糜蛋白氧化的主要因素。而EGCG 含有的丰富羟基通过共价或非共价作用结合鱼糜蛋白中的疏水基团,或许是其抑制蛋白质降解的作用途径。α-生育酚作为抗氧化剂通过从羟基中提供一个氢原子来减少自由基,抑制冻藏期间氧化诱导的鱼糜蛋白变性。Tang 等[46]研究发现,添加α-生育酚降低了鱼糜羰基含量,减缓巯基下降程度。此外,褐藻多酚也可以有效抑制冻藏过程鱼糜的脂质氧化和蛋白质氧化,且其抗脂质氧化能力比α-生育酚强,而α-生育酚在抗蛋白质氧化方面的效果更好。二者在抗脂质氧化和蛋白质氧化方面的差异主要源于褐藻多酚具有强大的独立清除自由基的能力,从而能更有效的控制冻藏过程鱼糜的脂质氧化[47]。
3.5 其它
冻藏期间蛋白酶水解导致的鱼糜蛋白质降解是造成鱼糜品质劣变的重要因素之一。然而关于蛋白酶抑制剂对于增强冻藏期间鱼糜品质的研究较少,Fowler 等[48]研究了鲑鱼血浆对鱼糜蛋白水解的抑制作用,研究发现鲑鱼血浆中含有多种半胱氨酸酶抑制剂和丝氨酸蛋白酶抑制剂,可以有效抑制鱼糜中的内源性半胱氨酸蛋白酶和丝氨酸蛋白酶对肌原纤维蛋白的降解作用,而此类酶抑制剂在低温环境下的有效性有待研究。此外,某些螯合剂(EDTA 等)可以结合鱼糜中的一些蛋白酶或金属离子,从而延缓鱼糜蛋白降解速率和氧化速率,减轻冻藏期间内源性的酶和金属离子[60]对鱼糜品质的劣化作用。
4 结论与展望
现有抗冻剂较高的安全风险及应用成本,一定程度上限制了高质量鱼糜制品的开发。因此有必要发展一种新型的冷冻保护策略,以最大程度实现鱼糜的冷冻保护。通过添加冷冻稳定剂以增强食品组分的稳定性,或可作为现有冷冻保护策略(抑制冰晶形成)的重要补充,从而实现鱼糜及其制品最大程度的冷冻保护。本文总结了鱼糜在冻藏期间色泽、质构、持水性等品质特征的变化规律及其机理;从增强鱼糜组分冷冻稳定性角度出发,重点阐述了冷冻稳定剂的种类及其作用机制。基于此,未来新型冷冻保护剂的研发或从以下方面重点着力:(1)开发兼具抗冻和组分稳定特性的冷冻保护剂。如亲水性胶体的冰晶生长抑制效应以及丰富的化学反应活性,有望成为具有优异冷冻保护特性的冷冻保护剂,而材料的选择及改性或是未来亟待解决的关键问题之一;(2)冰晶抑制手段与冷冻稳定剂的耦合协同。冷冻稳定剂通过与不同冰晶生长抑制手段结合应用(物理方法如超声辅助冻结、液氮快速冻结和均匀磁场辅助冻结以及化学方法如抗冻蛋白等抗冻剂),以实现多靶点、多途径的冷冻保护。
[1]赵宏蕾,常婧瑶,陈佳新,等.乳化肉糜制品中降低磷酸盐的加工技术新策略研究进展[J].食品科学,2021,42(7):7.
ZHAO H L,CHANG J Y,CHEN J X,et al.Novel strategies for reducing phosphates in emulsified meat products:A review of phosphate replacers and new processing technologies[J].Food Science,2021,42(7):7.
[2]仪淑敏,叶贝贝,张诗雯,等.菊粉对冻藏鲢鱼鱼糜肌原纤维蛋白抗冻性的影响[J].食品科学,2019,40(12):16-21.
YI S M,YE B B,ZHANG S W,et al.Cryoprotective effect of inulin on myofibrillar protein from silver carp surimi during frozen storage[J].Food Science,2019,40(12):16-21.
[3]MARIN D,ALEMAN A,SANCHEZ-FAURE A,et al.Freeze-dried phosphatidylcholine liposomes encapsulating various antioxidant extracts from natural waste as functional ingredients in surimi gels [J].Food Chemistry,2018,245(15):525-535.
[4]GANI A,BENJAKUL S.Effect of antioxidants in combination of VCO nanoemulsion on gel properties and storage stability of refrigerated sardine surimi gel[J].International Journal of Food Science &Technology,2020,55(6):2451-2461.
[5]ZHU Z W,ZHOU Q Y,SUN D W.Measuring and controlling ice crystallization in frozen foods:A review of recent developments[J].Trends in Food Science & Technology,2019,90:13-25.
[6]TSAI S,CHONG G,MENG P J,et al.Sugars as supplemental cryoprotectants for marine organisms[J].Reviews in Aquaculture,2018,10(3):703-715.
[7]NADA H,FURUKAWA Y.Antifreeze proteins:Computer simulation studies on the mechanism of ice growth inhibition[J].Polymer Journal,2012,44(7):690-698.
[8]PRIYADARSHINI B,XAVIER K A M,NAYAK B B,et al.Instrumental quality attributes of single washed surimi gels of tilapia:Effect of different washing media[J].LWT-Food Science and Technology,2017,86:385-392.
[9]CHINABHARK K,BENJAKUL S,PRODPRAN T.Effect of pH on the properties of protein-based film from bigeye snapper (Priacanthus tayenus) surimi[J].Bioresource Technolgy,2007,98(1):221-225.
[10]JIN S K,KIM I S,KIM S J,et al.Effect of muscle type and washing times on physico-chemical characteristics and qualities of surimi[J].Journal of Food Engineering,2007,81(3):618-623.
[11]HAJJI S,HAMDI M,BOUFI S,et al.Suitability of chitosan nanoparticles as cryoprotectant on shelf life of restructured fish surimi during chilled storage[J].Cellulose,2019,26(11):6825-6847.
[12]LEE S,JOO S T,ALDERTON A L,et al.Oxymyoglobin and lipid oxidation in yellowfin tuna(Thunnus albacares) loins[J].Journal of Food Science,2003,68(5):1664-1668.
[13]陈康.提高复合鱼糜制品凝胶强度的工艺研究[D].杭州:浙江工商大学,2011.
CHEN K.Study on enhancement of gel strength of surimi-based products[D].Hangzhou:Zhejiang Gongshang University,2011.
[14]BENJAKUL S,VISESSANGUAN W,THONGKAEW C,et al.Effect of frozen storage on chemical and gel-forming properties of fish commonly used for surimi production in Thailand[J].Food Hydrocolloids,2005,19(2):197-207.
[15]秦影,欧昌荣,汤海青,等.鱼糜制品凝胶特性研究进展[J].核农学报,2015,29(9):1766-1773.
QIN Y,OU C R,TANG H Q,et al.Research progress on gel properties of surimi products [J].Journal of Nuclear Agricultural Sciences,2015,29(9):1766-1773.
[16]LU H,ZHANG L,LI Q,et al.Comparison of gel properties and biochemical characteristics of myofibrillar protein from bighead carp (Aristichthys nobilis)affected by frozen storage and a hydroxyl radicalgeneration oxidizing system[J].Food Chemistry,2017,223:96-103.
[17]VIJI P,TANUJA S,ZYNUDHEEN A,et al.Quality characteristics and shelflife of Sutchi cat fish (Pangasiandon Hypophthalmus) steaks during refrigerated storage[J].International Journal of Agriculture and Food Science Technology,2014,5(2):105-116.
[18]任丽娜.白鲢鱼肉肌原纤维蛋白冷冻变性的研究[D].无锡:江南大学,2014.
REN L N.Study on frozen denaturation of miofibrillar protein of silver carp (Hypophthalmichthys molitrix) muscle[D].Wuxi:Jiangnan University,2014.
[19]BURGAARD M G.Effect of frozen storage temperature on quality-related changes in fish muscle:Changes in physical,chemical and biochemical quality indicators during short-and long-term storage[D].Copenhagen:Technical University of Denmark,2010:17-30.
[20]ZHOU F,ZHAO M,ZHAO H,et al.Effects of oxidative modification on gel properties of isolated porcine myofibrillar protein by peroxyl radicals[J].Meat Science,2014,96(4):1432-1439.
[21]LIU J Y,YOSHIDA A,GAO Y L,et al.Degradation of myofibrillar proteins in the belly muscle of the threadfin bream is caused by the possible leakage of soluble serine proteinase from the viscera during storage[J].Fisheries Science,2020,86(2):407-414.
[22]周爱梅,曾庆孝,刘欣,等.冷冻鱼糜蛋白在冻藏中的物理化学变化及其影响因素[J].食品科学,2003,24(3):153-157.
ZHOU A M,ZENG Q X,LIU X,et al.Physicochemical changes of fish muscle protein during frozen storage and its affecting factors[J].Food Science,2003,24(3):153-157.
[23]高文宏,叶瑞森,潘廷跳,等.基于拉曼光谱解析冻藏过程中鱼糜蛋白的结构变化[J].食品科学,2018,39(24):71-77.
GAO W H,YE R S,PAN T T,et al.Analysis of structural changes of surimi proteins during frozen storage by raman spectroscopy [J].Food Science,2018,39(24):71-77.
[24]HUIDOBRO A,MOHAMED G F,TEJADA M.Aggregation of myofibrillar proteins in hake,sardine,and mixed minces during frozen storage[J].Journal of Agricultural and Food Chemistry,1998,46(7):2601-2608.
[25]REHBEIN H,SCHREIBER W.TMAO-ase activity in tissues of fish species from the Northeast Atlantic[J].Comparative Biochemistry and Physiology B-Biochemistry & Molecular Biology,1984,79(3):447-452.
[26]CAO H W,FAN D M,JIAO X D,et al.Intervention of transglutaminase in surimi gel under microwave irradiation[J].Food Chemistry,2018,268:378-385.
[27]AN Y,YOU J,XIONG S,et al.Short-term frozen storage enhances cross-linking that was induced by transglutaminase in surimi gels from silver carp(Hypophthalmichthys molitrix) [J].Food Chemistry,2018,257:216-222.
[28]AN H,WEERASINGHE V,SEYMOUR T A,et al.Cathepsin degradation of Pacific whiting surimi proteins[J].Journal of Food Science,1994,59(5):1013-1017.
[29]HO M L,CHEN G H,JIANG S T.Effects of mackerel cathepsins L and L-like,and calpain on the degradation of mackerel surimi[J].Fisheries Science,2000,66(3):558-568.
[30]AL-HIJAZEEN M,LEE E,MENDONCA A,et al.Effect of oregano essential oil (Origanum vulgare subsp.hirtum) on the storage stability and quality parameters of ground chicken breast meat[J].Antioxidants,2016,5(2):18.
[31]DU X,SUN Y,PAN D,et al.Change of the structure and the digestibility of myofibrillar proteins in Nanjing dry-cured duck during processing[J].Journal of the Science of Food and Agriculture,2018,98(8):3140-3147.
[32]LUND M N,HEINONEN M,BARON C P,et al.Protein oxidation in muscle foods:A review[J].Molecular Nutrition & Food Research,2011,55(1):83-95.
[33]GAO W,HOU R,ZENG X A.Synergistic effects of ultrasound and soluble soybean polysaccharide on frozen surimi from grass carp[J].Journal of Food Engineering,2019,240:1-8.
[34]GAO W,HUANG Y,ZENG X A,et al.Effect of soluble soybean polysaccharides on freeze-denaturation and structure of myofibrillar protein of bighead carp surimi with liquid nitrogen freezing[J].International Journal of Biological Macromolecules,2019,135:839-844.
[35]WANG Z,TAN Y,YANG N,et al.Influence of oscillating uniform magnetic field and iron supplementation on quality of freeze-thawed surimi[J].RSC Advances,2019,9(57):33163-33169.
[36]ZHANG B,CAO H J,WEI W Y,et al.Influence of temperature fluctuations on growth and recrystallization of ice crystals in frozen peeled shrimp(Litopenaeus vannamei) pre-soaked with carrageenan oligosaccharide and xylooligosaccharide[J].Food Chemistry,2020,306:125641.
[37]ZHANG B,YANG H C,TANG H,et al.Insights into cryoprotective roles of carrageenan oligosaccharides in peeled whiteleg shrimp (Litopenaeus vannamei) during frozen storage[J].Journal of Agricul tural and Food Chemistry,2017,65(8):1792-1801.
[38]LIU J,FANG C,LUO Y,et al.Effects of konjac oligo-glucomannan on the physicochemical properties of frozen surimi from red gurnard (Aspitrigla cuculus)[J].Food Hydrocolloids,2019,89:668-673.
[39]KUROZAWA L E,BARBIN D F,HUBINGER M D.Implications of non-equilibrium states and glass transitions in frozen and dried fish and meat products[M].Woodhead Publishing:Non-Equilibrium States and Glass Transitions in Foods,2017:325-348.
[40]ZHANG B,FANG C D,HAO G J,et al.Effect of kappa-carrageenan oligosaccharides on myofibrillar protein oxidation in peeled shrimp (Litopenaeus vannamei) during long-term frozen storage[J].Food Chemistry,2018,245:254-261.
[41]NIKOO M,BENJAKUL S,RAHMANIFARAH K.Hydrolysates from marine sources as cryoprotective substances in seafoods and seafood products[J].Trends in Food Science & Technology,2016,57:40-51.
[42]NIKOO M,BENJAKUL S,XU X.Antioxidant and cryoprotective effects of Amur sturgeon skin gelatin hydrolysate in unwashed fish mince[J].Food Chemistry,2015,181:295-303.
[43]WU J H,WANG S Y,WU Y,et al.Cryoprotective effect of sericin enzymatic peptides on the freeze-induced denaturation of grass carp surimi[J].Applied Mechanics and Materials,2011,140:291-295.
[44]CARVAJAL P A,MACDONALD G A,LANIER T C.Cryostabilization mechanism of fish muscle proteins by maltodextrins[J].Cryobiology,1999,38(1):16-26.
[45]毕海丹,崔旭海,王占一,等.茶多酚和乳清蛋白对冷藏鱼糜保鲜效果的影响[J].食品科学,2016,37(10):272-277.
BI H D,CUI X H,WANG Z Y,et al.Effects of tea polyphenols and whey protein isolate on preservation of surimi quality during cold storage [J].Food Science,2016,37(10):272-277.
[46]TANG S,FENG G,CUI W,et al.Effect of alpha-tocopherol on the physicochemical properties of sturgeon surimi during frozen storage[J].Molecules,2019,24(4):710.
[47]WANG T,LI Z,YUAN F,et al.Effects of brown seaweed polyphenols,alpha-tocopherol,and ascorbic acid on protein oxidation and textural properties of fish mince (Pagrosomus major) during frozen storage[J].Journal of the Science of Food and Agriculture,2017,97(4):1102-1107.
[48]FOWLER M R,PARK J W.Salmon blood plasma:Effective inhibitor of protease-laden Pacific whiting surimi and salmon mince[J].Food Chemistry,2015,176:448-54.
[49]ARAKAWA T,TIMASHEFF S N.Stabilization of protein structure by sugars[J].Biochemistry,1982,21(25):6536-6544.
[50]STEPHEN A M,PHILLIPS G O,WILLIAMS P A.Food polysaccharides and their applications[M].New York:Taylor & Francis,2006:503-504.
[51]SINGH A,BENJAKUL S,PRODPRAN T.Effect of chitooligosaccharide from squid pen on gel properties of sardine surimi gel and its stability during refrigerated storage[J].International Journal of Food Science & Technology,2019,54(10):2831-2838.
[52]束玉珍,杨文鸽,徐大伦,等.鲐鱼肉酶解物对带鱼鱼糜蛋白冷冻变性的影响[J].中国食品学报,2014,14(1):68-73.
SHU Y Z,YANG W G,XU D L,et al.Effect of mackerel hydrolysate on protein denaturation of hairtail surimi during frozen storage[J].Journal of Chinese Institute of Food Science and Technology,2014,14(1):68-73.
[53]ZHANG L,LI Q,HONG H,et al.Prevention of protein oxidation and enhancement of gel properties of silver carp (Hypophthalmichthys molitrix) surimi by addition of protein hydrolysates derived from surimi processing by-products[J].Food Chemistry,2020,316:126343.
[54]KORZENIOWSKA M,CHEUNG I W Y,LI-CHAN E C.Effects of fish protein hydrolysate and freezethaw treatment on physicochemical and gel properties of natural actomyosin from Pacific cod[J].Food Chemistry,2013,138(2/3):1967-1975.
[55]MAITY T,SAXENA A,RAJU P S.Use of hydrocolloids as cryoprotectant for frozen foods[J].Critical Reviews in Food Science and Nutrition,2018,58(3):420-435.
[56]AKKOSE A,AKTAS N.Determination of glass transition temperature of beef and effects of various cryoprotective agents on some chemical changes[J].Meat Science,2008,80(3):875-878.
[57]LIMPISOPHON K,IGUCHI H,TANAKA M,et al.Cryoprotective effect of gelatin hydrolysate from shark skin on denaturation of frozen surimi compared with that from bovine skin[J].Fisheries Science,2014,81(2):383-392.
[58]LI Y,KONG B,XIA X,et al.Inhibition of frozen storage-induced oxidation and structural changes in myofibril of common carp (Cyprinus carpio) surimi by cryoprotectant and hydrolysed whey protein addition[J].International Journal of Food Science & Technology,2013,48(9):1916-1923.
[59]袁悦,赵永强,杨贤庆,等.表没食子儿茶素没食子酸酯对冷冻罗非鱼鱼糜抗冻作用机制[J].食品科学,2019,40(24):79-85.
YUAN Y,ZHAO Y Q,YANG X Q,et al.Cryoprotective mechanism of epigallocatechin gallate on frozen nile tilapia (Orechromis niloticus) surimi[J].Food Science,2019,40(24):79-85.
[60]THANONKAEW A,BENJAKUL S,VISESSANGUAN W,et al.The effect of metal ions on lipid oxidation,colour and physicochemical properties of cuttlefish (Sepia pharaonis) subjected to multiple freeze-thaw cycles[J].Food Chemistry,2006,95(4):591-599.