人口老龄化现象日趋严重,随之而来的骨质疏松及其并发症已经成为世界面临的公共卫生问题,目前对于该病的治疗仍是临床上亟待解决的一大难题。骨是代谢活跃的矿化结缔组织,通过破骨细胞介导的骨吸收和成骨细胞介导的骨形成在其整个生命过程中不断重塑[1]。然而,骨重塑失衡会增加骨吸收,减少骨形成[2],从而导致骨质疏松症,表现为骨量减少和微结构恶化,造成机体骨折、发病,最终缩短寿命[3-4]。有效的预防和治疗骨质疏松和骨折是至关重要的,因为骨质疏松患者可能完全无症状,直到他们经历骨折[5]。骨质疏松治疗的主要目标是通过调节骨形成和骨吸收的平衡来恢复骨量。因此,许多科学家试图寻找刺激成骨细胞分化和抑制破骨细胞活力的有效化合物和分子[6-7]。成骨细胞作为骨形成的主要功能单位,只有其不断的增殖才能产生丰富的胶原基质,通过分化、矿化形成更多骨质。促进成骨细胞增殖、分化,改善成骨细胞功能,调节骨重建,对防治骨质疏松具有积极意义。
目前市面上治疗骨质疏松的药物均存在一定的副作用,不仅价格昂贵,还可能引起其它疾病。寻找副作用少、安全有效的功能性食品来预防骨质疏松成为研究热点。生物活性肽具有利用率高,易吸收,安全性高等特点。近年来,越来越多的研究发现海洋源活性肽具有抗骨质疏松的作用,这为开发预防骨质疏松的功能食品提供了新思路。Oh 等[8]从贻贝中提取抗氧化肽,研究其对去卵巢(OVX)小鼠的抗骨质疏松作用,结果发现治疗10周后增强了其骨密度和其它骨参数,降低了骨钙素和碱性磷酸酶(ALP)活性。Zhang 等[9]发现鲢鱼皮胶原肽可以改善骨密度,通过刺激转化生长因子β1(TGF-β1)/Smad 信号通路,改善胶原与整合素α2 β1 的相互作用来促进骨重塑。Chen 等[10]发现从牡蛎蛋白水解物中提取的肽,通过调节ERK1/2 MAPK 通路提高成骨细胞活力,同时增加骨基质蛋白,如BPM-2、OPN、OCN 的分泌。
中华管鞭虾(Solenocera crassicornis),俗称红虾,在海捕虾中占有十分重要的地位[11]。其加工过程中产生大量虾头、虾壳等废弃副产物。虾类加工副产物富含多种氨基酸,组成蛋白质的氨基酸比例与人体肌肉成分极为接近,可以作为很好的蛋白质资源,因此有效利用虾类加工副产物制备活性肽具有重要意义。虾肽具有抗氧化[12]、抗骨质疏松[13]、降血压[14]和改善小鼠肝毒性[15]等多种生物学功能,而其在抗骨质疏松方面的研究较少。本文选用虾肽作为MC3T3-E1 Subclone14 成骨细胞的受试活性成分,研究其对成骨细胞增殖、分化和矿化的影响,为虾副产物资源高值化利用提供理论支撑,也为预防骨质疏松功能食品的开发提供新思路。
1 材料与方法
1.1 材料与试剂
虾肽,由实验室自行制备,原料为舟山市越洋食品有限公司提供的红虾加工副产物虾头和虾壳;MC3T3-E1 Subclone14 细胞株,中国科学院上海细胞库;胎牛血清,Biological Industries 公司;胰酶、双抗、α-MEM 培养基,Thermo Scientific 公司;MTT、β-甘油磷酸钠、L-抗坏血酸,美国Sigma 公司;茜素红S 染色液,北京索莱宝科技有限公司;二甲基亚砜,上海阿拉丁生化科技股份有限公司;核酸染料,上海天能科技有限公司;FastKing cDNA 第一链合成试剂盒,天根生化科技有限公司;荧光定量试剂盒TB Green R Premix Ex TaqTM,TaKaRa 公司;PBS 溶液、4%多聚甲醛、Trizol,上海碧云天生物技术有限公司;DEPC 水,上海生工生物工程公司;ALP 试剂盒、OCN 试剂盒、COL-I 试剂盒,南京建成生物工程研究所;其它试剂均为国药试剂分析纯级。
1.2 仪器与设备
CO2 培养箱,赛默飞世尔科技有限公司;倒置光学显微镜,日本Olympus 公司;倒置荧光显微镜,德国Leica Microsystems;Synergy H1 酶标仪,美国BioTek;微量蛋白核酸定量仪,德国IMPLEN 公司;暗箱四用紫外分析仪,上海嘉鹏科技有限公司;PCR 仪,美国Bio-Rad 公司;实时荧光定量PCR 仪,赛默飞世尔科技有限公司;双开门冰箱,青岛海尔特种电器有限公司。
1.3 方法
1.3.1 虾肽的制备 红虾原料用均质机均质后,加入95%乙醇按照0.1 g/mL 的质量浓度混合,室温下搅拌脱脂8 h,过滤,取滤渣,45 ℃烘干,备用。按照0.5 g/mL 的质量浓度向滤渣中加入蒸馏水,pH 值调至7.2,加入2%碱性蛋白酶,于55 ℃下搅拌酶解5 h,90 ℃灭酶20 min,过滤取上清。将酶解液通过0.5 μm 孔径无机陶瓷膜分离。收集透过液依次通过1 000 u 和250 u 的超滤膜,收集透过液和截留液,得到250~1 000 u 组分,冷冻干燥得虾肽。
1.3.2 成骨细胞的培养 将冻存管从液氮罐中取出,放入37 ℃恒温水浴锅内,快速摇动使其在1 min 内完全解冻,待完全融化后,取出冻存液到入装有完全培养基(血清:α-MEM 培养基:双抗比例为9∶1∶0.1) 的离心管中,1 000 r/min 离心5 min,弃去上清。加入PBS 后吹打混匀,1 000 r/min 速度下离心5 min,缓慢弃上清,重复上述操作2 次。弃去上清后,加入完全培养基,吹打混匀,转移到T25 细胞培养瓶中,并放入37 ℃、5%CO2 培养箱中培养。在倒置显微镜下观察,细胞长成致密单层,数量占整个视野内的90%以上,进行传代。弃去培养瓶中原有培养液,加入PBS 轻柔吹打细胞3 次,弃去PBS 后,加入1 mL 0.25%胰酶进行消化1~2 min,镜下观察,当细胞收缩成圆形尚未浮起时,加入2 mL 完全培养基终止消化,用移液枪吹打培养瓶底,使细胞脱离瓶底。将细胞悬液转移到离心管中,1 000 r/min 离心5 min 去上清,加入适量完全培养基重悬。将重悬的细胞悬液按比例重新转移至新的T25 培养瓶中培养。
1.3.3 虾肽对成骨细胞增殖活性的影响 取对数生长期MC3T3-E1 Subclone14 细胞进行计数,将细胞以5×103 个/孔的密度接种到96 孔板中,每孔100 μL,边缘孔加入PBS,放入培养箱孵育。第2天上午,弃去培养液,对照组加入100 μL 完全培养液,其余组分别加入100 μL 含质量浓度分别为0.02,0.05,0.1 mg/mL SP 的完全培养液,每组6个重复,培养24 h。培养时间结束时,每孔各加入10 μL 质量浓度为0.5 mg/mL 的MTT 溶液,继续培养4 h 后弃去培养液。每孔加入150 μL DMSO溶液,轻轻振荡混匀。在酶标仪OD490nm 处测量各孔的吸光值。
式中,A0——空白组吸光度;A1——对照组吸光度;A2——样品组吸光度。
1.3.4 虾肽对成骨细胞分化的影响 为考察MC3T3-E1 Subclone14 细胞的分化能力,采用分化诱导培养基对细胞进行培养,分化诱导培养基为含有10 mmol/L β-甘油磷酸盐和50 μg/mL 抗坏血酸的完全培养基。将对数生长期细胞以2×104个/孔的密度接种于24 孔板,每孔1 mL。24 h 后,更换质量浓度为0,0.02,0.05,0.1 mg/mL 的虾肽分化诱导培养液进行培养,每个质量浓度设4 个复孔。细胞每隔3~4 d 更换1 次培养基,诱导分化3,7 d 和14 d。待培养结束后,收集上清液装入EP 管中,1 500 r/min 离心10 min,取上清-20 ℃保存待用。
将培养3 d 和7 d 的细胞培养液上清液按照试剂盒说明书在酶标板上进行加样,加样完毕后轻轻振荡混匀,在酶标仪波长520 nm 处测定各孔吸光度值。ALP 活力按式(2)计算。

将培养7 d 和14 d 的细胞上清液按照OCN、COL-I 试剂盒说明书上步骤进行检测。
1.3.5 虾肽对成骨细胞矿化的影响 将对数生长期细胞以2×104 个/孔的密度接种于24 孔板,每孔1 mL。24 h 后,更换为含质量浓度0,0.02,0.05,0.1,0.2 mg/mL 的虾肽分化诱导培养液进行培养,每个质量浓度设4 个复孔。细胞每隔3~4 d 更换1次培养基,诱导分化21 d。培养结束后吸走培养液,用预冷的PBS 轻柔洗2 次,4%多聚甲醛固定15 min,弃去固定液,超纯水洗3 次,将水完全吸干净后,慢慢加入茜素红S 染液,室温染色20~30 min,弃去染料,超纯水洗3 次,每孔加入适当超纯水,在低倍镜视野(×40)下随机选取8 个视野,用Image J 对矿化结节面积进行计算。
1.3.6 虾肽对成骨细胞分化相关基因mRNA 表达水平的影响 在24 孔板中接种对数生长期细胞,每孔5×104 个,放入培养箱孵育24 h 后,除对照组加入完全培养液外,其余试验组加入含不同浓度SP 的完全培养液孵育72 h。然后,用预冷PBS 清洗3 遍后,弃去PBS,加入1 mL 预冷TRIzol 试剂,反复吹打裂解细胞,通过Genebank 检索得到目的基因mRNA 序列,用Primer Premier 5.0软件设计合适引物,委托上海生工生物工程公司合成,按TRIzol 试剂法提取细胞总RNA。用核酸蛋白定量仪检测OD A260/A280、OD A260/A230及RNA 浓度,使用琼脂糖凝胶电泳检测所提RNA 的纯度。检测后的总RNA 根据反转录试剂盒说明书反转录合成cDNA。按照TaKaRa 公司的荧光定量试剂盒说明书配制反应体系,进行PCR反应。荧光的采集与溶解曲线的制作按照荧光定量PCR 仪的说明进行。每个样品靶基因的相对mRNA 表达水平用2-△△Ct 计算,以β-actin 为内参基因。
表1 RT-PCR 反应引物序列
Table 1 Primer sequence of Real-Time PCR

?
1.3.7 对成骨细胞OPG、RANKL、RUNX2 基因mRNA 表达水平的影响 按1.3.6 节方法检测虾肽对MC3T3-E1 Subclone14 细胞OPG、RANKL、RUNX2 基因mRNA 的表达水平,引物序列见表2。
表2 RT-PCR 反应引物序列
Table 2 Primer sequence of Real-Time PCR

基因登录号引物序列(5'-3')产物长度/bp退火温度/℃β-actinNM_007393.5F:AGTGTGACGTTGACATCCGT29861 R:GCAGCTCAGTAACAGTCCGC OPG N M_008764.3F:CAGAGAAGCCACGCAAAAGTG17360 R:AGCTGTGTCTCCGTTTTATCCT RANKLNM_011613.3F:GAAACATCGGGAAGCGTACC24659 R:GTACGTCGCATCTTGATCCG RUNX2NM_001145920.2F:AGCGGACGAGGCAAGAGTTT21962 R:AGGCGGGACACCTACTCTCATA
1.3.8 对成骨细胞OPG、RANKL、RUNX2 蛋白表达水平的影响 将对数生长期MC3T3-E1 Subclone14 细胞,以每孔5×104 个密度接种于6 孔板中,在37 ℃,5%CO2 的培养箱中孵育24 h。除对照组加入完全培养液外,其余试验组加入含不同质量浓度虾肽的完全培养液孵育72 h。然后用胰酶消化,收集细胞于1.5 mL 离心管中,每个离心管中加入40 μL RIPA 细胞裂解液,吹打数次,置冰上裂解15 min。然后用离心机12 000 r/min,4 ℃,离心10 min,取上清液。利用BCA 蛋白浓度测定试剂盒测定蛋白浓度,将每个样品的蛋白浓度调至相同,按比例加入Loading buffer,100 ℃煮沸10 min,4 000 r/min 离心5 min 取上清,将上清液进行SDS-PAGE 电泳及转膜。转膜后,5%脱脂牛奶常温孵育1 h,用一抗在一定比例下4 ℃振荡孵育过夜,再与二抗室温振荡孵育1 h,使用碧云天BeyoECL Star(特超敏ECL 化学发光试剂盒)显影,将膜置于显影液中,使用化学发光成像仪,观察条带,并拍照分析。
1.4 数据统计分析
试验数据以“平均值±标准差”表示,应用统计分析软件Graphpad Prism 8.0 进行数据分析,采用单因素方差分析(One-way-ANOVA)进行多组比较。结果判定标准为:P <0.05 表示差异显著;P<0.01 表示差异极显著。
2 结果
2.1 虾肽对成骨细胞增殖活性的影响
成骨细胞的成熟经历了增殖、分化和矿化3个阶段。首先采用MTT 法检测SP 对MC3T3-E1 Subclone14 细胞增殖活性的影响。如图1所示,与对照组相比,SP 对细胞存活没有显著抑制作用,说明虾肽对细胞的生长没有毒性。同时可以发现,SP 质量浓度在0.02~0.1 mg/mL 范围内,显著地促进细胞增殖,采用质量浓度为0.05,0.1 mg/mL 的虾肽处理24 h 后,其细胞增殖率分别为130.04%±3.80%(P <0.001),115.34%±0.76%(P <0.05),细胞用0.02,0.05 mg/mL 的虾肽处理48 h 后,其增殖率分别为117.73%±3.88%(P <0.01),115.88%±3.71%(P <0.01),虾肽处理72 h 后,质量浓度为0.02~0.1 mg/mL 各组细胞增殖率有所增加,无显著性差异。当质量浓度大于0.1 mg/mL,细胞增殖率降低,整体上SP 在质量浓度为0.5 mg/mL 和1 mg/mL 时,抑制了不同时间段细胞增殖。故选取0.02,0.05,0.1 mg/mL 3 个质量浓度进行下一步试验。
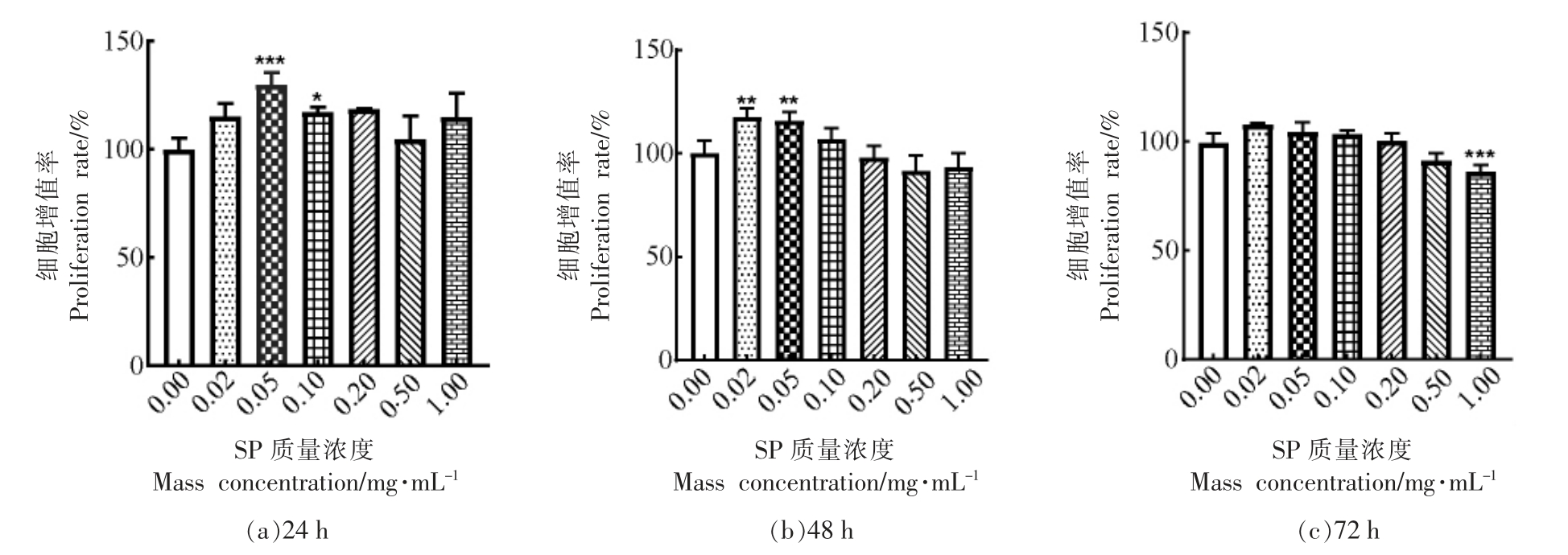
图1 虾肽对MC3T3-E1 Subclone14 细胞增殖率的影响
Fig.1 The effect of SP on proliferation rate of MC3T3-E1 Subclone14 cells
注:对照组相比,*.P <0.05;**.P <0.01;***.P <0.001。
2.2 虾肽对成骨细胞ALP 活力、OCN 和COL-I含量的影响
成骨细胞MC3T3-E1 Subclone 14 的分化是一个时间渐进性过程,考察0,0.02,0.05,0.1 mg/mL 质量浓度下,不同分子质量虾肽与诱导分化培养基共同作用3 d 和7 d 后,对成骨细胞ALP 活力的影响,结果见图2a。虾肽处理3 d 后,与对照组相比,SP 各浓度组ALP 活力分别显著提高了(33.33±0.64),(36.07±7.15),(25.44±11.75) U/L (P <0.05);虾肽处理7 d 后,SP 各质量浓度组ALP 活力分别显著提高了 (12.88±4.28),(18.04±4.25),(15.19±1.73) U/L (P <0.05)。虾肽各浓度组间ALP 活力无显著性差异(P >0.05)。
不同时期低分子质量虾肽对成骨细胞OCN和COL-I 含量的影响如图2b-2c 所示。SP 干预7 d 时,与对照组相比,OCN 的含量有所增加,无显著性差异,SP 干预14 d 时,当质量浓度为0.02,0.1 mg/mL 时,OCN 含量显著提高了(205.28±49.21),(132.87±33.42) ng/L(P <0.05);当质量浓度为0.05 mg/mL 时,OCN 含量有所提高,无显著性差异。SP 干预7 d,在0.02~0.1 mg/mL 质量浓度范围内,COL-I 含量分别显著提高了(10.90±2.47),(8.86±1.13),(6.26±0.26)ng/mL (P <0.05),SP 干预14 d 时,COL-I 含量分别显著提高了 (11.41±1.78),(11.45±3.14),(10.58±1.30)ng/mL。SP 干预7 d 时,COL-I 含量随浓度升高而缓慢降低。
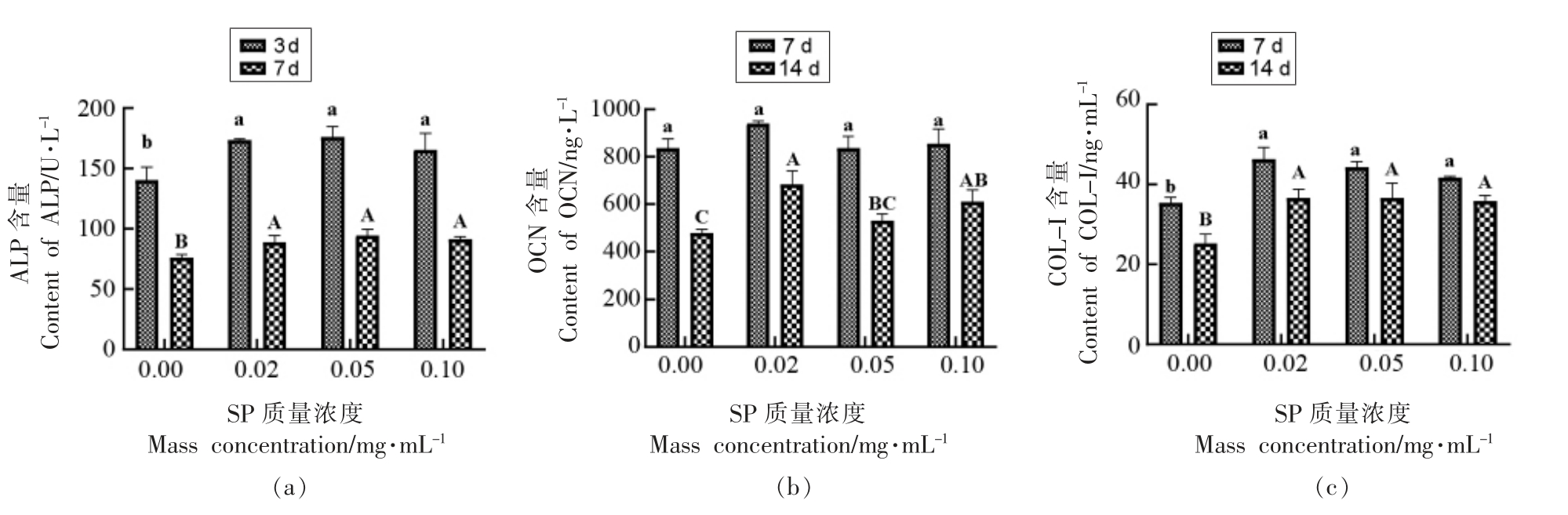
图2 不同时期虾肽对成骨细胞ALP(a)、OCN(b)和COL-I(c)含量的影响
Fig.2 Effects of SP in different periods on ALP (a),OCN (b) and COL-I (c) content of osteoblasts
注:不同小写字母代表组间差异显著(P <0.05),相同小写字母代表组间差异不显著(P >0.05)。
2.3 不同时期虾肽对成骨细胞矿化的影响
矿化基质的形成是成骨细胞分化末期的决定性标志,也是成骨能力的体现。当成骨细胞分化到一定阶段,其细胞表层的外基质会形成钙离子螯合物,这一螯合物就是矿化结节。利用茜素红染料与基质中的Ca2+耦合形成一种红色化合物,通过观察矿化结节的形成能直接反应出成骨细胞分化能力。虾肽处理分化诱导21 d 后,茜素红染色和矿化结节面积的结果分别如图3和图4所示。通过茜素红染色,产生了桔红色沉积,此即为矿化结节,与对照组相比,SP 所有试验组的矿化结节面积相对于对照组增加了7.03%±2.61%,8.74%±1.70%,20.54%±2.33%(P <0.05),矿化结节面积随SP 浓度增加而增大,呈现剂量依赖效应。
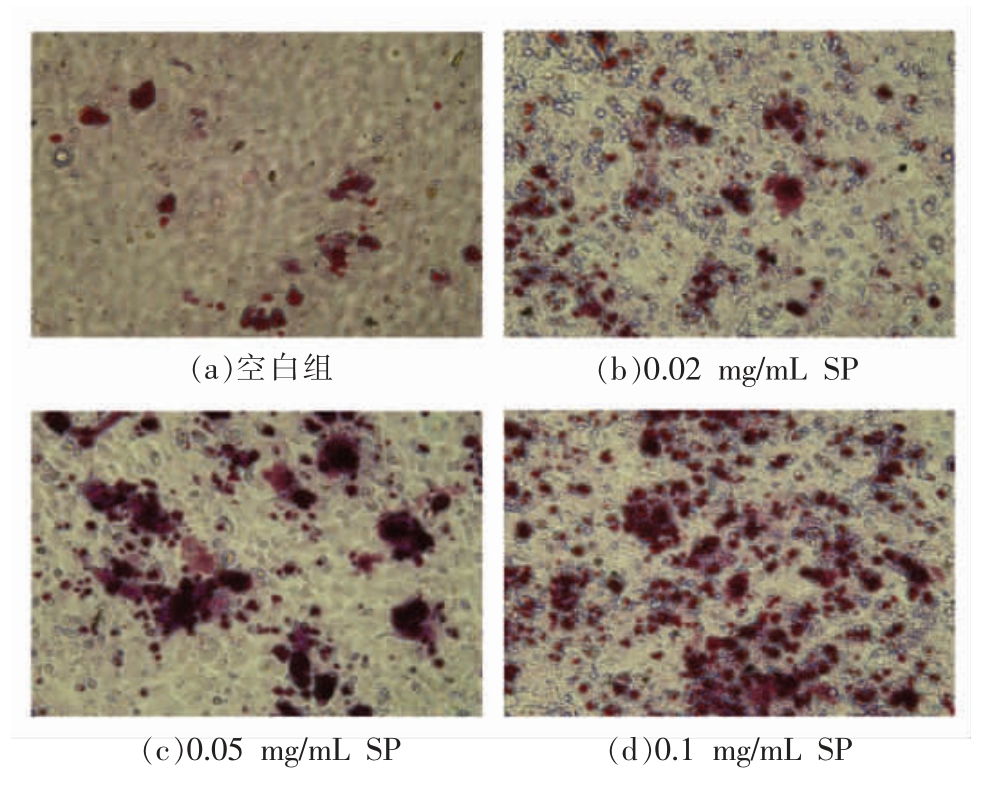
图3 不同组的茜素红染色图
Fig.3 Images of alizarin red staining in different groups
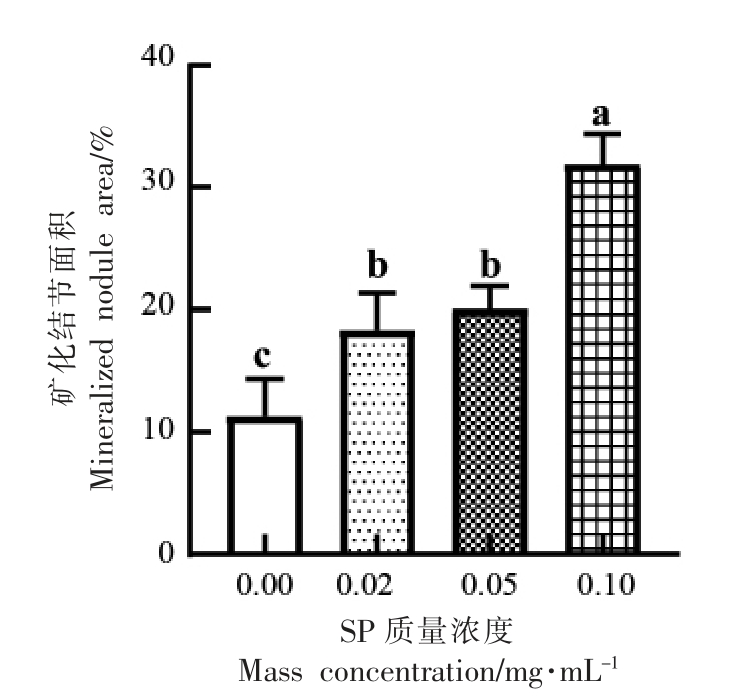
图4 不同组的矿化结节面积
Fig.4 Mineralized nodule area in different groups
注:不同小写字母代表组间差异显著(P <0.05),相同小写字母代表组间差异不显著(P >0.05)。
2.4 虾肽对成骨细胞分化相关基因mRNA 表达水平的影响
检测了不同浓度SP 对成骨细胞分化相关基因ALP、OCN 和COL-I 表达量的差异,结果如图5所示。与对照组相比,各试验组均能促进成骨细胞分化相关基因的表达,质量浓度为0.02 mg/mL时,ALP 和COL-I 的基因表达量分别显著提高了0.78±0.16 和1.33±0.18 (P <0.05),在0.02,0.05 mg/mL 质量浓度下,对ALP 和OCN 的基因表达量提高效果较好,OCN 的基因表达量均有所提高,无显著性差异。
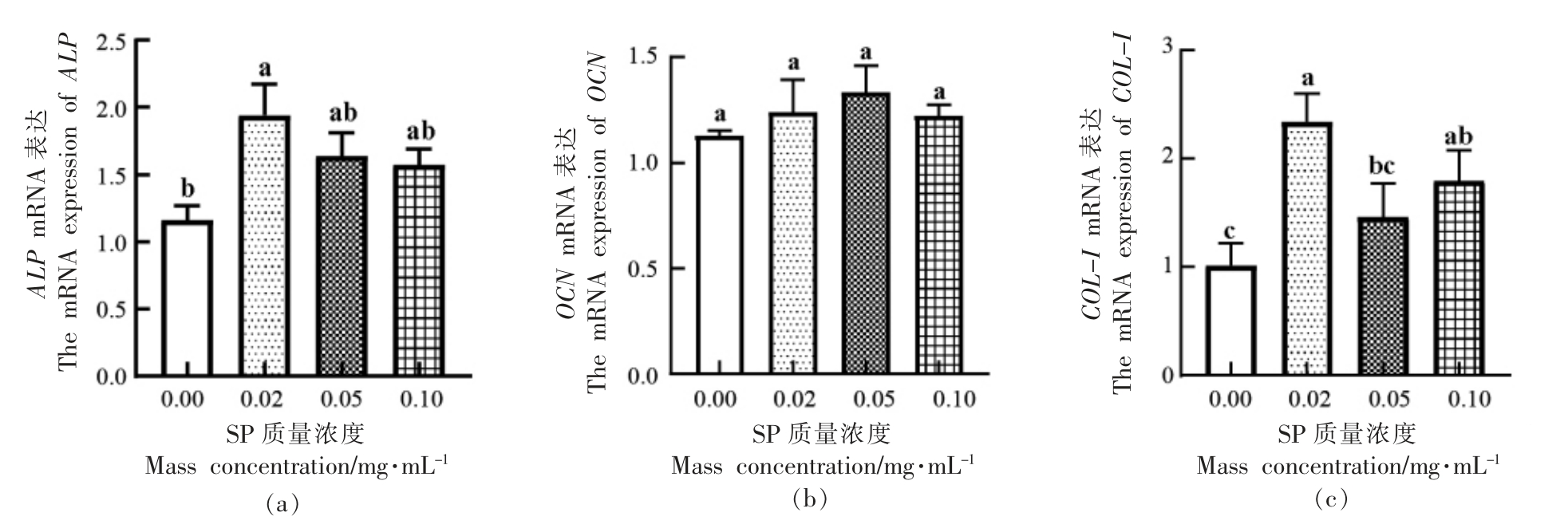
图5 虾肽对成骨细胞ALP(a)、OCN(b)、COL-I(c)mRNA 表达的影响
Fig.5 Effect of SP on ALP(a),OCN(b) and COL-I(c) mRNA expression in osteoblasts
注:不同小写字母代表组间差异显著(P <0.05),相同小写字母代表组间差异不显著(P >0.05)。
2.5 虾肽对OPG、RANKL、RUNX2 基因mRNA表达水平的影响
进一步通过QPCR 法检测低分子质量虾肽对MC3T3-E1 Subclone14 细胞OPG、RANKL 以及RUNX2 基因mRNA 表达水平的影响,结果如图6所示。当SP 质量浓度为0.02,0.05 mg/mL 时,显著提高了OPG、RUNX2 基因mRNA 表达水平,分别提高了2.08±0.34,2.94±0.16 和1.05±0.20,0.97±0.20(P <0.05),在0.1 mg/mL 时,无显著性差异;与对照组相比,各试验组RANKL 基因mRNA 表达水平均有所降低,SP 在0.02 mg/mL 时,对RANKL 基因mRNA 表达的抑制作用有显著性,降低了0.67±0.01(P <0.05)。
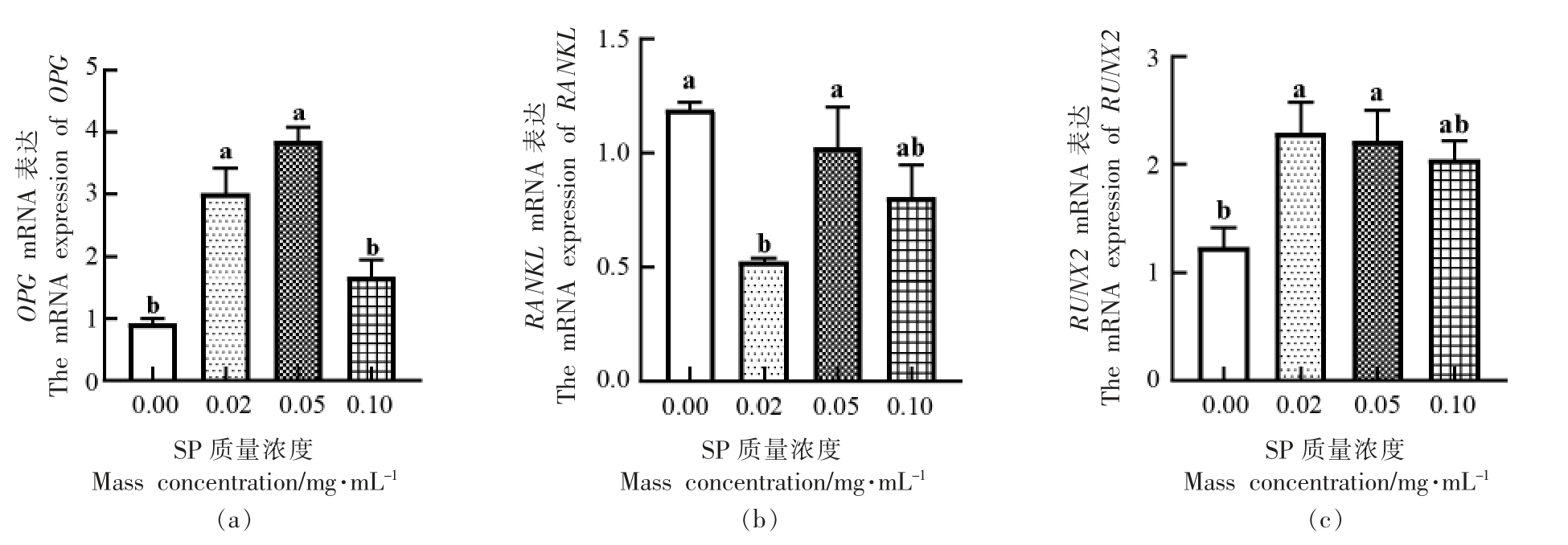
图6 虾肽对OPG(a)、RANKL(b)、RUNX2(c)基因mRNA 表达水平的影响
Fig.6 Effects of SP on mRNA expression of OPG (a),RANKL (b) and RUNX2 (c) genes
注:不同小写字母代表组间差异显著(P <0.05),相同小写字母代表组间差异不显著(P >0.05)。
2.6 虾肽对OPG、RANKL、RUNX2 蛋白表达水平的影响
选取质量浓度为0.02,0.05 mg/mL 效果较明显的两组,利用Western Blot 法进一步检测低分子质量虾肽对OPG、RANKL 以及RUNX2 蛋白表达水平的影响,结果如图7所示。与对照组相比,SP 质量浓度为0.02,0.05 mg/mL 时,OPG 蛋白的表达水平均显著提高,分别提高了1.68±0.08,4.14±0.13,RANKL 蛋白的表达水平显著降低,分别降低了0.75±0.09,2.15±0.07,且呈浓度依赖效应。这说明低分子质量虾肽可能通过上调OPG 蛋白表达和抑制RANKL 蛋白表达来调节OPG/RANKL 的比值,从而激活OPG-RANKL 信号通路来实现成骨细胞的分化。另外可以发现,随着质量浓度的升高,SP 显著提高RUNX2 蛋白的表达水平,且在质量浓度为0.05 mg/mL 时效果较好,相比对照组提高了3.69±0.15(P <0.05)。
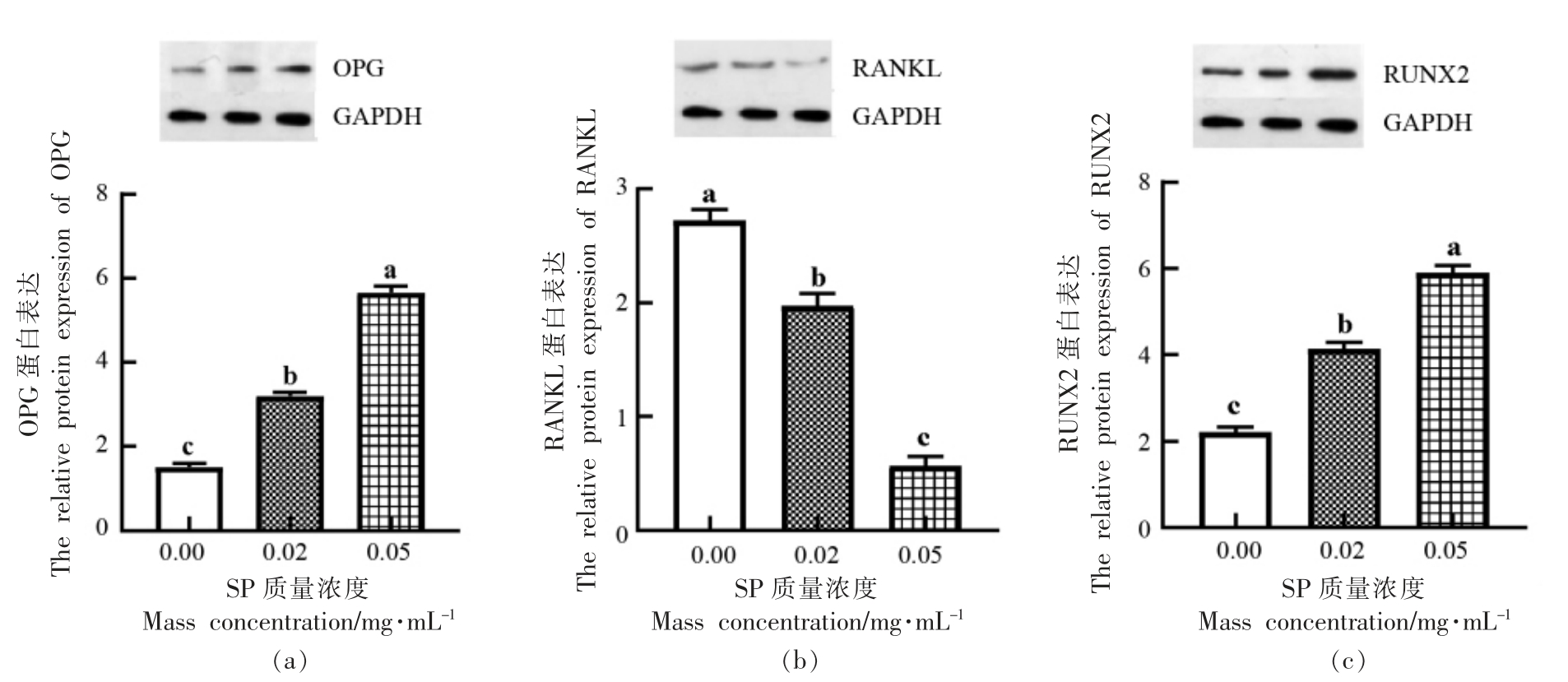
图7 虾肽对OPG(a)、RANKL(b)、RUNX2(c)蛋白表达水平的影响
Fig.7 Effects of SP on the protein expression of OPG(a),RANKL(b) and RUNX2(c)
注:不同小写字母代表组间差异显著(P <0.05),相同小写字母代表组间差异不显著(P >0.05)。
3 结论与讨论
本研究以MC3T3-E1 Subclone14 成骨细胞为试验对象,比较了虾肽对其增殖、分化和矿化的影响,研究发现SP 对成骨细胞均无明显毒副作用,具有较好的增殖活性。ALP、COL-I 和OCN 是成骨细胞分化和矿化阶段的重要标志物[16]。此外,成骨细胞分化涉及成骨基因,如ALP、COL-I 和OCN 的分期特异性表达,这些基因可用于监测前成骨细胞向完全成熟细胞的发展[17]。这些成骨基因在体外是成骨细胞分化和骨形成的标志[18]。在前成骨细胞向成熟成骨细胞转化过程中,首先表达ALP 基因,然后是COL-I,最后是OCN 基因[19]。碱性磷酸酶(ALP)被认为是成骨细胞成骨活性早期标志的酶,它可以水解单磷酸酯,为矿化过程提供磷酸盐,因此,强ALP 活性是成骨细胞分化早期所必需的。OCN 是最突出的非胶原蛋白,占骨组织有机基质的1.5%。OCN 是在骨形成后期由成熟的成骨细胞和骨细胞合成和分泌的,对骨细胞外基质中羟基磷灰石的结合和沉积起重要作用[20]。OCN 与成骨和矿化率直接相关[21],血清中OCN 水平被认为是骨组织形成的标志。COL-I 是骨组织中主要的细胞外基质(ECM)分子,构成了90%~95%的有机基质[22]。对骨组织结构的完整及维持其生物力学特性起着非常重要的作用,也是成骨细胞向基质成熟方向分化的标志 [23]。通过ELISA 试剂盒检测细胞上清中ALP、OCN、COL-I分泌的含量,发现细胞培养3 d 和7 d 时,SP 能促进ALP 的表达从而促进成骨细胞的分化。细胞培养7 d 和14 d 时,不同质量浓度SP 均能增加OCN、COL-I 分泌的含量。基质矿化是诱导成骨细胞分化的最后一步。作为成骨细胞成熟的标志,这一步骤保持了骨形成的完整性。茜素红染色已广泛应用于矿物沉积的鉴定[24]。用茜素红染色法研究SP 对成骨细胞矿化的影响,可以发现SP 能显著促进成骨细胞矿化结节的形成。同时,进一步通过QPCR 法检测发现SP 能通过上调ALP、OCN、COL-I 基因的表达,促进MC3T3-E1 Subclone14细胞分化。
RUNX2 是决定MC3T3-E1 向成骨细胞分化方向的关键调控因子[25]。当成骨细胞达到终末分化时,它们分泌不同的补充骨基质的基质蛋白,如I 型胶原(COL-I)、骨钙素(OCN)和碱性磷酸酶(ALP)[26]。COL-I 形成胶原纤维,作为骨组织的支架。ALP 生成磷酸钙沉积在成熟成骨细胞中,促进骨矿化,而OCN 是参与矿化调控最丰富的蛋白[27]。本研究显示,SP 显著增加了RUNX2 的表达,说明SP 通过提高RUNX2 转录触发成骨细胞的分化过程。其它成骨相关基因包括ALP、COL-I 和OCN在成骨细胞分化和成熟的各个阶段也被SP 升高。因此,在成骨细胞分化和骨形成的所有阶段,SP都具有诱导MC3T3-E1 细胞成骨的能力。
成骨细胞通过OPG/RANKL/RANK 系统调节破骨细胞的生成来控制骨吸收。RANKL 通过与受体RANK 结合,在破骨细胞生成的激活中起关键作用[28]。OPG 是成骨细胞分泌的可溶性蛋白,其与RANKL 结合,占据RANK 的结合位点,阻断其作用,因此OPG 是骨吸收的负调控因子,作为一种可溶性的RANKL 受体拮抗剂,降低破骨生成[29-30]。多项研究证明,打破RANK、RANKL 和OPG 的平衡会导致骨质疏松等骨骼疾病[31-32]。而RANKL/OPG 比值是成骨细胞骨与破骨细胞骨动态平衡决定因素之一,该比值大于1 可保证成骨细胞骨合成能力处于优势地位。在本研究中,发现SP 能促进细胞上清OPG 分泌并抑制RNAKL 分泌,通过调节OPG 和RANKL 的基因和蛋白表达,从而激活OPG/RANKL/RANK 信号通路,并促进RUNX2在基因和蛋白水平的上调。这表明SP 通过下调RANKL/OPG 的比例来刺激成骨细胞的骨形成。
本研究为将虾肽开发成为一种预防骨质疏松的功能性产品提供理论依据,同时也为促进虾加工副产物的充分开发提供有效参考。
[1]KATSIMBRI P.The biology of normal bone remodelling[J].European Journal of Cancer Care,2017,26(6):e12740.
[2]SIMS N A,GOOI J H.Bone remodeling:Multiple cellular interactions required for coupling of bone formation and resorption[J].Seminars in Cell & Developmental Biology,2008,19(5):444-451.
[3]PHETFONG J,SANVORANART T,NARTPRAYUT K,et al.Osteoporosis:The current status of mesenchymal stem cell-based therapy [J].Cellular &Molecular Biology Letters,2016,21(12):12.
[4]LORENTZON M,CUMMINGS S R.Osteoporosis:The evolution of a diagnosis[J].Journal of Internal Medicine,2015,277(6):650-661.
[5]TELLA S H,GALLAGHER J C.Prevention and treatment of postmenopausal osteoporosis[J].The Journal of Steroid Biochemistry and Molecular Biology,2014,142:155-170.
[6]CARSON M A,CLARKE S A.Bioactive compounds from marine organisms:Potential for bone growth and healing[J].Marine Drugs,2018,16(9):340.
[7]JOLLY J J,CHIN K Y,ALIAS E,et al.Protective effects of selected botanical agents on bone[J].International Journal of Environmental Research and Public health,2018,15(5):963.
[8]OH Y,AHN C B,CHO W H,et al.Anti-osteoporotic effects of antioxidant peptides PIISVYWK and FSVVPSPK from Mytilus edulis on ovariectomized mice[J].Antioxidants,2020,9(9):866.
[9]ZHANG L,ZHANG S,SONG H,et al.Effect of collagen hydrolysates from silver carp skin (Hypophthalmichthys molitrix) on osteoporosis in chronologically aged mice:Increasing bone remodeling[J].Nutrients,2018,10(10):1434.
[10]CHEN H,SHI P,XU Z,et al.Oral administration of oyster peptide prevents bone loss in ovariectomized mice[J].eFood,2020,1(4):298-309.
[11]江杨阳,杨水兵,余海霞,等.不同冻结方式对红虾肌肉品质的影响[J].现代食品科技,2017,33(10):142-148,116.
JIANG Y Y,YANG S B,YU H X,et al.Effects of different freezing methods on the quality of red shrimp[J].Modern Food Science and Technology,2017,33(10):142-148,116.
[12]LAN C,ZHAO Y Q,LI X R,et al.High Fischer ratio oligopeptides determination from Antartic krill:Preparation,peptides profiles,and in vitro antioxidant activity[J].Journal of Food Biochemistry,2019,43(5):e12827.
[13]韩立华,王菲,戴宇峰,等.南极磷虾肽对去卵巢骨质疏松症小鼠肠钙吸收的改善作用研究[J].中国海洋药物,2017,36(5):42-48.
HAN L H,WANG F,DAI Y F,et al.The improvement of peptide from Antarctic krill on intestinal calcium absorption in ovariectomized mice with osteoporosis[J].Chinese Journal of Marine Drugs,2017,36(5):42-48.
[14]JI W,ZHANG C,JI H.Two novel bioactive peptides from Antarctic krill with dual angiotensin converting enzyme and dipeptidyl peptidase IV inhibitory activities[J].Journal of Food Science,2017,82(7):1742-1749.
[15]JIANG S,ZHANG Z,YU F,et al.Ameliorative effect of low molecular weight peptides from the head of red shrimp (Solenocera crassicornis) against cyclophosphamide-induced hepatotoxicity in mice[J].Journal of Functional Foods,2020,72:104085.
[16]SUN J,LI J,LI C,et al.Role of bone morphogenetic protein-2 in osteogenic differentiation of mesenchymal stem cells[J].Molecular Medicine Reports,2015,12(3):4230-4237.
[17]HU Y,TANG X X,HE H Y.Gene expression during induced differentiation of sheep bone marrow mesenchymal stem cells into osteoblasts[J].Genet Mol Res,2013,12(4):6527-6534.
[18]KIM H K,KIM J H,PARK D S,et al.Osteogenesis induced by a bone forming peptide from the prodomain region of BMP-7[J].Biomaterials,2012,33(29):7057-7063.
[19]HUTTUNEN M M,PEKKINEN M,AHLSTRÖM M E B,et al.Long-term effects of tripeptide Ile-Pro-Pro on osteoblast differentiation in vitro [J].The Journal of Nutritional Biochemistry,2008,19(10):708-715.
[20]WU W,HE L,LI C,et al.Phosphorylation of porcine bone collagen peptide to improve its calcium chelating capacity and its effect on promoting the proliferation,differentiation and mineralization of osteoblastic MC3T3-E1 cells[J].Journal of Functional Foods,2020,64(C):103701.
[21]ZHENG L,YANG L,ZHAO X,et al.Effect of risperidone on proliferation and apoptosis of MC3T3-E1 cells[J].Brazilian Journal of Medical and Biological Research,2019,52(3):e8098.
[22]HOSSEINI S,NADERI-MANESH H,VALI H,et al.Contribution of osteocalcin-mimetic peptide enhances osteogenic activity and extracellular matrix mineralization of human osteoblast-like cells[J].Colloids and Surfaces B:Biointerfaces,2018,173:662-671.
[23]贺敏,周晓春,陈鹏,等.鲫鱼卵唾液酸糖肽对成骨细胞MC3T3-E1 增殖、分化、矿化及OPG/RANKL基因表达的影响[J].中国食品学报,2015,15(11):16-22.
HE M,ZHOU X C,CHEN P,et al.Effects of sialyglycopeptides from the eggs of Carassius auratus on the proliferation,differentiation,mineralization,OPG/RANKL gene experssion of MC3T3-E1 cells[J].Journal of Chinese Institute of Food Science and Technology,2015,15(11):16-22.
[24]WEI W,LIU S,SONG J,et al.MGF-19E peptide promoted proliferation,differentiation and mineralization of MC3T3-E1 cell and promoted bone defect healing[J].Gene,2020,749:144703.
[25]ALMALKI S G,AGRAWAL D K.Key transcription factors in the differentiation of mesenchymal stem cells[J].Differentiation.2016,92(1/2):41-51.
[26]KATSIMBRI P.The biology of normal bone remodelling[J].European Journal of Cancer Care,2017,26(6):e12740.
[27]GOLUB E E,BOESZE-BATTAGLIA K.The role of alkaline phosphatase in mineralization [J].Current Opinion in Orthopaedics,2007,18(5):444-448.
[28]FRANCESCHI R T,GE C,XIAO G,et al.Transcriptional regulation of osteoblasts[J].2007,1116:196-207.
[29]LIU W,ZHANG X.Receptor activator of nuclear factor-κB ligand (RANKL)/RANK/osteoprotegerin system in bone and other tissues[J].Molecular Medicine Reports,2015,11(5):3212-3218.
[30]KIM M,KANG J H,OH G H,et al.Ishige sinicola extract stimulates osteoblast proliferation and differentiation via the bone morphogenetic protein 2/runt-related gene 2 signalling pathway[J].Zeitschrift für Naturforschung C,2019,74(7/8):167-174.
[31]SUN X,WEI B,PENG Z,et al.Protective effects of Dipsacus asper polysaccharide on osteoporosis in vivo by regulating RANKL/RANK/OPG/VEGF and PI3K/Akt/eNOS pathway[J].International Journal of Biological Macromolecules,2019,129:579-587.
[32]YANG B,LI S,CHEN Z,et al.Amyloid β peptide promotes bone formation by regulating Wnt/βcatenin signaling and the OPG/RANKL/RANK system[J].The FASEB Journal,2020,34(3):3583-3593.