食源性致病菌不仅导致食品腐败变质,而且会引发一些食源性疾病[1]。食品中常见的食源性致病菌主要包括肠炎沙门氏菌、单核细胞增生李斯特菌、金黄色葡萄球菌、志贺氏菌[2]。沙门氏菌(Salmonella)是一种革兰氏阴性菌,主要寄生在人类和动物的肠道中,并广泛存在于肉类及蛋类产品中,引发的食源性疾病症状有发热、恶心、呕吐和腹泻等[3-4]。据统计,在世界各国由细菌引起的食物中毒中,肠炎沙门氏菌所引起的食物中毒占很大比例[5]。此外,生物膜是细菌污染食品的另一种方式。生物膜是一种具有三维结构的微生物群落,在生物膜的胞外存在各种各样的生物大分子会对微生物起到保护作用,因此生物膜的存在会增加灭菌的难度[6-7]。许多研究报道了肠炎沙门氏菌具有较强的生物膜形成能力,可以在食品的表面、不锈钢、聚氯乙烯(聚氯乙烯)和玻璃等形成生物膜[8-11]。鉴于沙门氏菌的危害,开发一种既安全又有效的方法来抑制肠炎沙门氏菌游离菌体和生物膜的生长显得尤其重要。
超声为一种新型的非热杀菌方式,主要通过空化作用来破坏微生物的形态结构并使之产生亚致死损伤[12-14]。然而,当超声单独灭活细菌的游离和生物膜细胞时,不能达到理想的灭菌效果。Li等[13]研究发现超声单独处理金黄色葡萄球菌15 min,仅使金黄色葡萄球菌的菌落数降低0.31 lg(CFU/mL)。许多研究人员研究了超声与化学抑菌剂联合处理的杀菌效果。迟媛等[14]研究发现超声联合次氯酸钠具有明显的协同杀菌效果,当二者联合处理时会对菌体造成更为严重的损伤。Park 等[15]研究发现0.15%富马酸联合频率为40 kHz 超声,可显著降低苹果汁中的大肠杆菌、沙门氏菌、李斯特菌数量。上述研究说明超声联合化学抑菌剂处理具有明显的协同杀菌作用。乳酸是一种羧酸,属于α-羟酸,主要通过降低微生物所生活的环境中的pH 来抑制微生物的生长代谢,从而达到杀菌的目的[16]。有研究表明,5%乳酸可显著灭活牛肉中的大肠杆菌[17]。Li 等[18]研究发现1%,1.5%和2%乳酸可使鸡蛋表面的肠炎沙门氏菌降到检测限以下。王凤婷等[19]当使用1%乳酸处理阴沟肠杆菌游离细胞30 min 时,可完全杀死该细胞。刘亚文等[20]用乳酸(1.25,2.50 mg/mL)处理,使阴沟肠杆菌生物膜的生长受到严重的抑制。然而,关于超声联合乳酸处理的抗菌和抗生物膜机制还未见报道。本文以腐败鸡肉中分离的沙门氏菌为目标菌株,研究超声联合乳酸处理对沙门氏菌游离和生物膜细胞的杀菌和作用,为沙门氏菌及其生物膜的控制提供一个新的方法。
1 材料与方法
1.1 材料与试剂
沙门氏菌(Salmonella)为本实验室从腐败的肉制品中分离获得。
BHI 脑心浸液肉汤和固体培养基,青岛海博生物科技有限公司;乳酸、十二水合磷酸氢二钠、二水合磷酸二氢钠和氯化钠,国药集团化学试剂有限公司;增强型ATP 检测试剂盒,上海碧云天生物技术有限公司;LIVE/DEAD BacLightTM 试剂盒和NuncTM Lab-TekTM 8 孔腔室盖玻片系统,赛默飞世尔科技公司;24 孔聚氯乙烯培养板,美国康宁公司。
1.2 仪器与设备
PE(Ultra View VOX)转盘式激光共聚焦显微镜,美国珀金埃尔默股份有限公司;EVO-LS10 扫描电子显微镜,德国卡尔蔡司股份公司;KQ-800KD 超声清洗机,中国昆山超声仪器有限公司。
1.3 方法
1.3.1 菌种活化 将分离到的沙门氏菌按1∶100的比例接种于新鲜的脑心浸液肉汤 (Brain heart infusion broth,BHI)培养基中,37 ℃,200 r/min 摇床培养至对数期,随后将对数期的菌液转接到新鲜的BHI 培养基中,反复转接3 次,然后,将菌液与50%的无菌甘油按照1 ∶1 的比例混合后保存到-80 ℃冰箱中。每次试验前,将沙门氏菌菌液按照1∶100 的比例接种于无菌的脑心浸液肉汤培养基中,在37 ℃条件下培养至对数期,置于4 ℃条件下备用[19-20]。
1.3.2 杀菌处理
1.3.2.1 游离菌体的杀菌 将培养至对数期的沙门氏菌菌液置于4 ℃条件下,5 000 r/min,离心10 min。去除上清,菌泥用0.85%的生理盐水洗涤2次。试验分为4 组,第1 组:超声单独(Ultrasound,US,400 W,50 kHz)处理,向菌泥中加入等量的0.85%的生理盐水,然后置于超声清洗机中杀菌处理;第2 组:乳酸(0.5%LA,1%LA)单独处理,分别向菌泥中加入等量的0.5%或1%的乳酸;第3 组:超声联合乳酸(US+0.5%LA,US+1%LA)处理,分别向菌泥中加入等量的0.5%或1%乳酸,混匀后立刻置于超声清洗机中(400 W,50 kHz);第4 组:对照组,在获得的菌泥中加入等量的0.85%的生理盐水,不做任何处理。所有试验组需设置3 个平行样,分别在第5,10,20,30,60 分钟取样。样品内菌落的计数方法如下,取1 mL 菌液加入9 mL 无菌的0.1 mol/L PBS 中,按10 倍稀释法梯度稀释,随后选择适合的梯度,吸取1 mL 菌液加入平板,倒入47 ℃的BHI 固体培养基,待培养基凝固,将平板放入37 ℃培养箱,培养24 h。
1.3.2.2 生物膜的杀菌 将培养至对数期的沙门氏菌按照1∶100 的比例添加到新鲜的BHI 液体培养基中,然后按每孔1 mL 规格加入24 孔聚氯乙烯培养板中,37 ℃条件下培养72 h,每隔24 h 更换1 次培养基[20]。将生物膜用无菌的0.01 mol/L PBS 洗涤3 次。试验共分为4 组,第1 组:超声单独(US,400 W,50 kHz)处理,向生物膜中加入1 mL 无菌的0.01 mol/L PBS,置于超声清洗机中杀菌处理,杀菌时间分别设置为5,10,20,30,60 min;第2 组:乳酸(0.5%LA,1%LA)单独处理,分别向生物膜中加入1 mL 0.5%或1%的乳酸,杀菌处理,处理时间分别为5,10,20,30,60 min;第3组:超声联合乳酸(US+0.5%LA,US+1%LA)处理,分别向生物膜中加入1 mL 乳酸 (0.5%LA,1%LA),立刻置于超声清洗机中(400 W,50 kHz),杀菌时间分别设置为5,10,20,30,60 min;第4 组:对照组,向生物膜中加入1 mL 无菌0.01 mol/L PBS,不做任何处理,第5,10,20,30,60 分钟取样。处理结束后,用灭菌的棉签刮擦24 孔聚氯乙烯培养板孔壁和底部,将生物膜及孔内溶液一起收集至9 mL 无菌的0.1 mol/L PBS 中,终止反应。生物膜菌落计数方法参考1.3.2.1 节游离菌体的菌落计数方法。
1.3.3 菌体的细胞形态观察 采用扫描电子显微镜观察沙门氏菌游离和生物膜细胞的细胞形态变化。沙门氏菌游离细胞的杀菌方法参考1.3.2.1节。将对照组和处理组的沙门氏菌游离细胞体置于4 ℃条件下6 000 r/min 离心5 min,去上清液,将离心所得菌泥用体积分数2.5%的戊二醛在4℃条件下固定12 h。
沙门氏菌生物膜培养和杀菌方法参考1.3.2.2节。将对数期的沙门氏菌菌液按1∶100 比例接种于新鲜BHI 液体培养基中,按照每孔400 μL 规格加入NuncTM Lab-TekTM 8 孔腔室盖玻片中,培养72 h,每24 h 更换培养基。将经不同处理以及对照组生物膜用0.01 mol/L PBS 洗涤3 次,置于超净工作台中晾干。移除隔板,用2.5%戊二醛在4℃条件下固定12 h[21]。
1.3.4 细胞膜完整性和通透性观察 激光共聚焦电镜主要用于观察超声联合乳酸处理后对沙门氏菌游离和生物膜细胞的细胞膜完整性和通透性的影响。沙门氏菌游离细胞菌泥收集方法参考1.3.3节。将收集的菌泥用LIVE/DEAD BacLightTM 试剂避光染色30 min。染色结束后,用0.85%生理盐水洗去多余探针,然后用2.5%戊二醛固定30 min。固定结束后吸出戊二醛,将菌泥重悬于0.85%生理盐水中。
沙门氏菌生物膜的培养及处理方法参考1.3.3 节。将处理组与对照组的生物膜用LIVE/DEAD BacLightTM 试剂避光染色30 min,染色结束后,吸出染色液,用0.01 mol/L PBS 轻轻洗去多余探针,用2.5%戊二醛固定30 min。之后,吸出戊二醛,将生物膜晾干。去除孔间隔板,然后通过激光共聚焦电镜观察生物膜细胞的细胞膜通透性变化[21-22]。
1.3.5 呼吸链脱氢酶活性的测定 三苯基四氮唑氯化物(TTC)试验是一种用来测定细胞中呼吸链脱氢酶活性的重要方法[23]。将处理组与对照组的沙门氏菌游离菌体或生物膜菌液1 mL 与2 mL(0.05 mol/L)Tris-HCl 缓冲液(pH=8.6),2 mL(0.1 mol/L)葡萄糖溶液和2 mL(1 mg/mL)TTC 溶液混合,然后,在37 ℃培养箱中静置反应2 h。反应结束后向每个试管中加入2 滴浓缩的硫酸终止反应。最后,将溶液与5 mL 石油醚混合后萃取有机相,测定其在波长490 nm 处的吸光值。
1.3.6 胞外ATP 浓度的测定 沙门氏菌游离和生物膜细胞的培养及处理方法参考1.3.2.1 节和1.3.2.2 节。将沙门氏菌游离和生物膜细胞在4 ℃条件下,5 000 r/min 离心5 min,留上清液,并将上清液放置于冰上保存。沙门氏菌游离和生物膜细胞的化学发光值的测量方法按照ATP 试剂盒上的说明书[21]。
1.4 数据统计与分析
试验结果表示为“平均值±标准差”,所有试验样本均设置3 个平行样。采用SPSS 26.0 进行显著性检验,P<0.05 为差异显著。
2 结果与分析
2.1 超声联合乳酸处理对沙门氏菌游离和生物膜细胞的杀菌效果
超声、乳酸以及两者联合处理对沙门氏菌游离细胞的杀菌效果见表1。沙门氏菌游离细胞的初始菌数约9 lg(CFU/mL),经US 处理60 min 后沙门氏菌游离细胞的活菌数仅降低0.43 lg(CFU/mL),而经0.5%LA 和1%LA 处理60 min,使得沙门氏菌游离菌细胞的活菌数降到检测限以下,这说明与超声相比,乳酸杀菌效果相对较好。经US+0.5%LA 处理30 min 后,沙门氏菌游离细胞的菌数降低6.88 lg(CFU/mL),杀菌效果显著优于单一处理组 (P<0.05)。此外,经US+1%LA 处理20 min,可使沙门氏菌游菌细胞菌数降到检测限以下,而经1%LA 处理60 min 才能达到相同的效果,说明联合处理可以提高杀菌效率,缩短杀菌时间。
表1 不同处理对沙门氏菌游离菌体细胞的杀菌效果
Table 1 Inactivation of Salmonella planktonic cells by different treatments
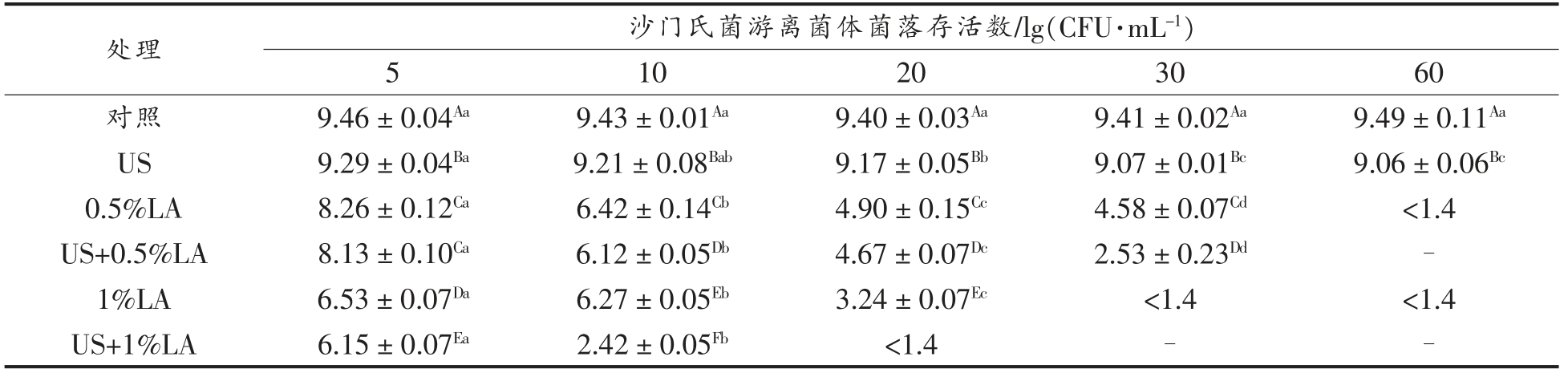
注:US.超声;LA.乳酸;US+LA.超声联合乳酸;不同的大写字母表示同列差异显著;不同的小写字母表示同行差异显著;<1.4.无法检测水平;-.无菌。
处理沙门氏菌游离菌体菌落存活数/lg(CFU·mL-1)5 10203060对照9.46±0.04Aa9.43±0.01Aa9.40±0.03Aa9.41±0.02Aa9.49±0.11Aa US9.29±0.04Ba9.21±0.08Bab9.17±0.05Bb9.07±0.01Bc9.06±0.06Bc 0.5%LA8.26±0.12Ca6.42±0.14Cb4.90±0.15Cc4.58±0.07Cd<1.4 US+0.5%LA8.13±0.10Ca6.12±0.05Db4.67±0.07Dc2.53±0.23Dd-1%LA6.53±0.07Da6.27±0.05Eb3.24±0.07Ec<1.4<1.4 US+1%LA6.15±0.07Ea2.42±0.05Fb<1.4--
超声、乳酸以及两者联合处理对沙门氏菌生物膜细胞的杀菌效果见表2。沙门氏菌生物膜细胞初始菌数约9 lg(CFU/mL),经US 处理60 min,生物膜细胞的菌数与对照组相比只降低0.33 lg(CFU/mL),而经0.5%LA 和1%LA 处理60 min,沙门氏菌生物膜细胞的菌数分别下降4.21 lg(CFU/mL)和5.79 lg(CFU/mL)。此外,经US+1%LA 处理60 min,使得生物膜细胞的菌落存活数降到检测限以下,而单独的超声和乳酸处理在60 min 的处理时间内都未达到该杀菌效果。经US+0.5%LA 处理60 min,沙门氏菌生物膜细胞菌数下降5.87 lg(CFU/mL),而经1%LA 单独处理60 min,沙门氏菌生物膜细胞菌数下降5.78 lg(CFU/mL)。超声协同低浓度乳酸处理组的杀菌效果达到高浓度乳酸的杀菌效果,说明超声联合乳酸处理可以降低使用乳酸的浓度,二者联合处理具有明显的协同效应。
表2 不同处理对沙门氏菌生物膜菌体细胞的杀菌效果
Table 2 Inactivation of Salmonella biofilm cells by different treatments

注:US.超声;LA.乳酸;US+LA.超声联合乳酸;不同的大写字母表示同列差异显著;不同的小写字母表示同行差异显著;<1.4.无法检测水平。
处理沙门氏菌生物膜菌数/lg(CFU·mL-1)5 10203060对照9.38±0.07Aa9.38±0.02Aa9.40±0.03Aa9.41±0.02Aa9.43±0.04Aa US9.37±0.03Aa9.27±0.03ABb9.25±0.06Bb9.17±0.02Bc9.10±0.05Bc 0.5%LA9.35±0.06Aa9.13±0.02Bb7.96±0.08Cc6.84±0.05Cd5.22±0.07Ce US+0.5%LA9.16±0.04Ba7.22±0.08Ca5.93±0.06Db4.95±0.11Dc3.56±0.04Dd 1%LA7.20±0.15Ca7.08±0.04Cb4.80±0.09Ec4.58±0.14Ed3.64±0.09De US+1%LA6.96±0.04Da6.44±0.18Db4.55±0.10Fc2.62±0.13Fd<1.4
2.2 扫描电镜下沙门氏菌游离和生物膜细胞的菌体形态
扫描电镜下沙门氏菌游离和生物膜细胞的菌体形态变化如图1所示,对照组的沙门氏菌游离和生物膜细胞呈饱满的杆状,表面光滑且无破损(图1A1,1B1)。经US 处理30 min,菌体开始出现轻微的破损,表面开始褶皱,变粗糙,然而,仍具有完整的菌体细胞结构图(1A2,1B2)。经1%LA 处理30 min,菌体表面开始出现孔洞,菌体细胞变形凹陷(图1A3,1B3)。经US+1%LA 处理30 min,菌体表面出现孔洞,菌体细胞开始黏附在一起,内容物大量泄露,大部分菌体形态结构被完全破坏(图1A4,1B4)。这说明US+1%LA 协同处理对菌体的损伤程度明显高于单独的US 和1%LA 处理。

图1 不同处理的沙门氏菌游离(A)和生物膜(B)菌体的扫描电镜拍摄图
Fig.1 SEM images of different treatments on Salmonella planktonic (A) and biofilm cells (B)
注:US.超声;LA.乳酸;US+LA.超声联合乳酸。
2.3 激光共聚焦电镜下沙门氏菌游离和生物膜细胞的菌体形态
沙门氏菌游离和生物膜菌体细胞的激光共聚焦电镜图见图2。未经任何处理的沙门氏菌游离和生物膜细胞在显微镜下几乎全部呈绿色,说明未处理的细胞膜均是完整的,且其通透性未发生改变(图2A1,2B1)。经US 处理30 min,极少部分的游离和生物膜菌体细胞呈红色,表明US 处理仅造成少部分菌体细胞膜的损伤(图2A2,2B2)。经1%LA 处理30 min,多数游离和生物膜菌体呈红色荧光,少数菌体依然为绿色,说明乳酸处理造成大部分菌体细胞损伤,破坏细胞膜的完整性,使细胞膜通透性改变(图2A3,2B3)。经US+1%LA 协同处理,绝大部分菌体死亡,呈红色,仅有极少数菌体呈绿色(图2A4,2B4),说明协同处理对菌体细胞的损伤程度最高,协同处理组对菌体细胞膜的破坏程度显著高于单一处理组。
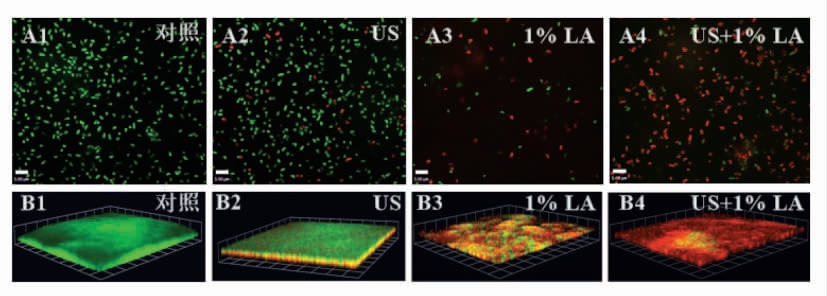
图2 不同处理的沙门氏菌游离(A)和生物膜(B)菌体的激光共聚焦电镜拍摄图
Fig.2 CLSM images of different treatments on Salmonella planktonic (A) and biofilm cells (B)
注:US.超声;LA.乳酸;US+LA.超声联合乳酸。
2.4 呼吸链脱氢酶活性
通过观察490 nm 波长处吸光值的变化来研究超声联合乳酸处理对沙门氏菌游离和生物膜细胞中呼吸链脱氢酶的抑制作用。如图3所示,对照组的沙门氏菌游离和生物膜细胞在490 nm 波长处的吸光值分别为0.336 和0.371。经US,1%LA以及US+1%LA 处理30 min,沙门氏菌游离细胞在490 nm 波长处吸光值分别为0.300,0.076 和0.059,沙门氏菌生物膜在490 nm 波长处吸光值分别为0.347,0.139 和0.091。这表明超声、乳酸、超声协同乳酸都对沙门氏菌游离和生物膜细胞内的呼吸链脱氢酶产生抑制作用,且3 种处理方式对呼吸链脱氢酶活性的抑制作用具有显著性差异(P<0.05)。超声联合乳酸处理后,沙门氏菌游离和生物膜细胞内的呼吸链脱氢酶活性下降最多,乳酸单独处理其次,超声联合处理酶的活性下降最少,说明乳酸对酶活的影响明显高于超声,且超声联合乳酸处理对沙门氏菌游离和生物膜细胞内的呼吸链脱氢酶活性的抑制作用明显高于单一处理组。
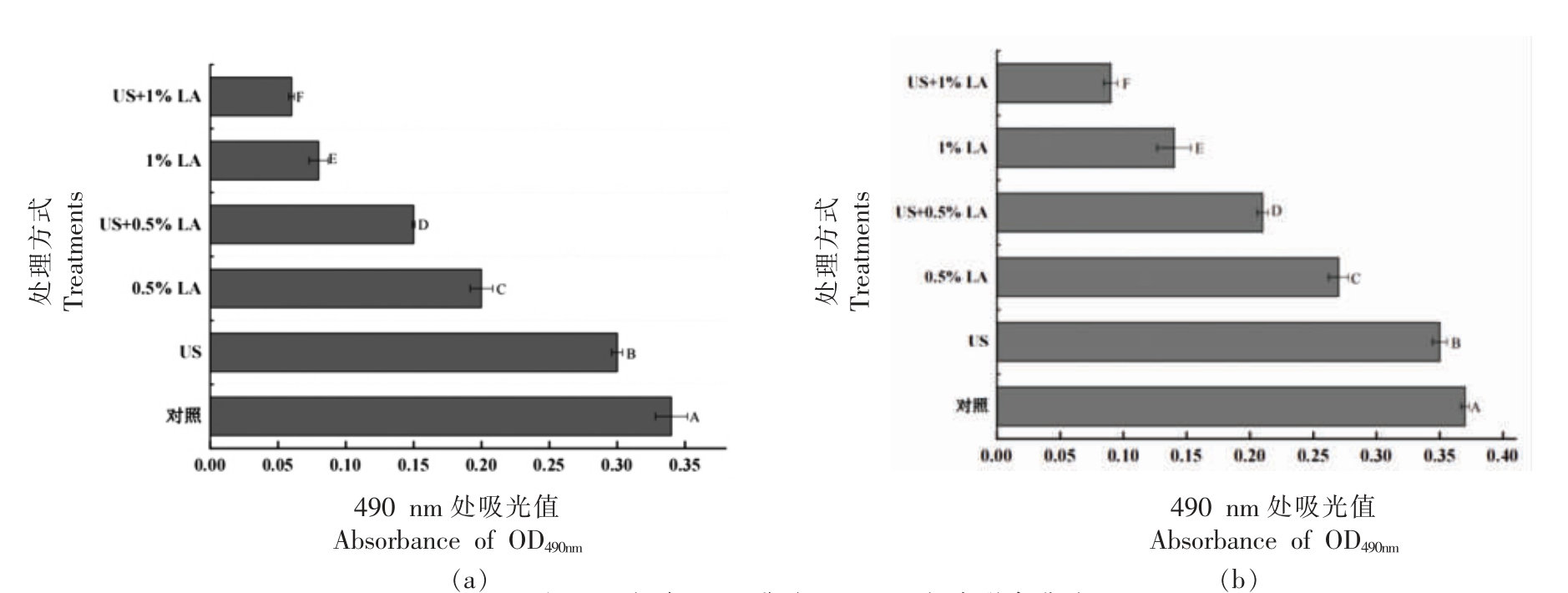
图3 不同处理的沙门氏菌游离(a)和生物膜(b)细胞呼吸链脱氢酶酶活性变化
Fig.3 The activity of RCD in Salmonella planktonic (a) and biofilm cells (b) after different treatments
注:US.超声;LA.乳酸;US+LA.超声联合乳酸。
2.5 胞外ATP 浓度
胞外ATP 浓度的增加反映细菌细胞膜完整性受到破坏。如图4所示,未经任何处理的沙门氏菌游离和生物膜细胞的胞外ATP 浓度分别为6.30 nmol/mL 和7.37 nmol/mL。经US,LA 以及US+LA 处理30 min,沙门氏菌游离和生物膜细胞的胞外ATP 浓度明显增加,说明处理后菌体细胞膜的通透性增加,联合处理组的胞外ATP 浓度显著高于相同条件下的单一处理组 (P<0.05),且US+1%LA 处理组的胞外ATP 浓度显著高于其它处理组(P<0.05),这说明US+1%LA 可快速破坏沙门氏菌游离和生物膜细胞的细胞膜,造成胞内ATP 浓度的释放。
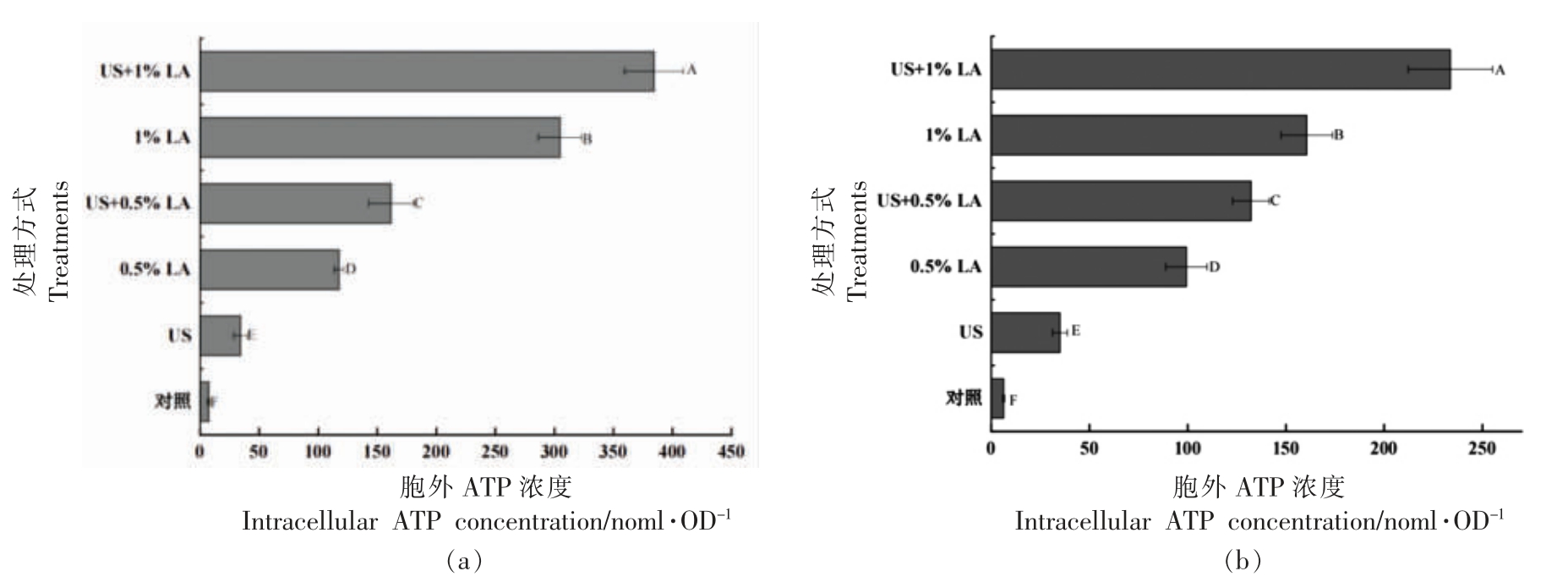
图4 不同处理的沙门氏菌游离(a)和生物膜(b)细胞胞外ATP 变化
Fig.4 The release of ATP in Salmonella planktonic (a) and biofilm cells (b) after different treatments
注:US.超声;LA.乳酸;US+LA.超声联合乳酸。
3 讨论
超声联合乳酸对沙门氏菌游离和生物膜细胞具有明显的协同杀菌作用,效果明显优于单一处理,这主要归因于超声导致细胞产生亚致死损伤,促进乳酸更好地进入细胞,从而达到协同杀菌的目的[24]。事实上,超声协同化学抑菌剂具有明显的协同杀菌效应,如Zhang 等[25]报道,超声联合天然化合物在抑制大肠杆菌和单细胞增生李斯特菌的生长方面具有明显的协同效应;Shao 等[26]报道,酸性电解水的单一处理只将细菌菌数降低3.0l lg(CFU/mL),而酸性电解水与超声结合可以减少4.8l lg(CFU/mL)。Yu 等[27]发现高强度超声波(HIU,20 kHz,60 W)和二氧化氯(4 mg/L)的结合对金黄色葡萄球菌生物膜细胞的失活有明显的协同作用。Guo 等[28]发现单独超声或百里香精油纳米乳使大肠杆菌菌落总数分别减少0.69,4.13 lg(CFU/mL),超声与百里香精油纳米乳液联合处理可将大肠杆菌菌落总数减少7.42 lg(CFU/mL)。然而,目前关于超声联合乳酸处理的协同杀菌效果未见报道。
超声联合乳酸处理可显著增加细菌的细胞膜通透性以及破坏细胞膜的完整性,从而导致胞外ATP 泄露增加,这主要归因于超声可以帮助乳酸快速进入细胞,从而迅速破坏细菌的细胞膜。此外,超声联合乳酸处理还破坏蛋白质结构,导致细菌呼吸链脱氢酶的降低。Liu 等[29]研究发现苯乳酸联合酸性电解水具有明显的协同杀菌作用,二者联合处理时可迅速破坏细菌的细胞膜的完整性,引起ATP 的泄露。Liu 等[30]研究发现苯乳酸可以迅速破坏阴沟肠杆菌的细胞膜,导致ATP 与胞内大分子物质的泄露。王凤婷等[19]研究中发现1%乳酸使得阴沟肠杆菌胞外ATP 浓度显著增加。Liu 等[31]报道,随着芳樟醇浓度的增加,绿脓杆菌呼吸链脱氢酶活性逐渐降低。林祎[23]报道,超声辅助热处理可显著降低沙门氏菌和单增李斯特菌的呼吸链脱氢酶活性。以上研究表明,当细菌细胞膜的完整性受到破坏时引起细胞ATP 的泄露和呼吸链脱氢酶活性降低,从而导致细菌死亡。此外,超声单独杀菌效果不明显,对细胞产生一定的损伤,然而这种损伤不足以导致细菌死亡。当超声联合乳酸处理时,超声促进乳酸进入细胞,使细菌的细胞膜严重损伤,引起胞内物质泄露,导致菌体死亡。综上,超声联合乳酸处理可缩短杀菌时间,降低杀菌时使用乳酸的浓度,且二者联合处理可显著提高杀菌效率。
4 结论
研究了超声联合乳酸处理对沙门氏菌游离及生物膜细胞的抑制作用,结果表明超声,0.5%,1.0%乳酸均有杀菌效果,其中超声联合乳酸的杀菌效果最好,二者具有明显的协同效应。扫描电镜结果表明,超声联合乳酸处理后,细菌菌体结构遭到严重破坏,大部分细胞无完整的菌体结构。激光共聚焦扫描电镜结果表明,超声联合乳酸处理可显著增强细菌细胞膜的通透性。胞外ATP 浓度增加较明显,说明二者联合处理可显著破坏细菌细胞膜的完整性。此外,超声联合乳酸处理显著降低了细胞呼吸链脱氢酶的活性。综上,超声联合乳酸处理主要通过破坏细菌细胞膜的完整性,增加细胞膜通透性,导致胞外ATP 浓度升高及细胞呼吸链脱氢酶活性降低,最终达到杀菌的目的。
[1]LIU F,LIU Y N,SUN Z L,et al.Preparation and antibacterial properties of ε-polylysine-containing gelatin/chitosan nanofiber films[J].International Journal of Biological Macromolecules,2020,164:3376-3387.
[2]孙晋跃,孙芝兰,吴海虹,等.非热杀菌技术在低温鸡肉制品致病菌控制中的应用研究进[J].肉类研究,2020,34(8):84-90.
SUN J Y,SUN Z L,WU H H,et al.Advances in application of non-thermal sterilization technologies to control pathogens in low temperature chicken products[J].Meat Research,2020,34(8):84-90.
[3]李琳琼,洪静,张爱静,等.酸胁迫处理对鼠伤寒沙门氏菌抗酸性的影响[J].食品科学,2021,42(1):33-40.
LI L Q,HONG J,ZHANG A J,et al.Acid resistance in Salmonella typhimurium induced by culture in the presence of organic acids[J].Food Science,2021,42(1):33-40.
[4]蔡晓军,孙杨赢,潘道东,等.迷迭香主要组分对沙门氏菌的抑制机理[J].中国食品学报,2019,19(3):134-140.
CAI X J,SUN Y Y,PAN D D,et al.Antibacterial mechanism of rosemarys' main component against Salmonella[J].Journal of Chinese Institute of Food Science and Technology,2019,19(3):134-140.
[5]姚蓝,马文娟,李晚宁,等.生菜表面肠炎沙门氏菌(ATCC13076)的吸附及其清除[J].现代食品科技,2019,35(11):170-175,309.
YAO L,MA W J,LI W N,et al.Adsorption and elimination of Salmonella enteritidis (ATCC13076)on the lettuce[J].Modern Food Science and Technology,2019,35(11):170-175,309.
[6]LIU F,DU L H,ZHAO T,et al.Effects of phenyllactic acid as sanitizing agent for inactivation of Listeria monocytogenes biofilms[J].Food Control,2017,78:72-78.
[7]OPPENHEIMER-SHAANAN Y,STEINBERG N,KOLODKIN-GAL I.Small molecules are natural triggers for the disassembly of biofilms[J].Trends in Microbiology,2013,21(11):594-601.
[8]GKANA E N,GIAOURIS E D,DOULGERAKI A I,et al.Biofilm formation by Salmonella Typhimurium and Staphylococcus aureus on stainless steel under either monoor dualspecies multistrain conditions and resistance of sessile communities to sublethal chemical disinfection[J].Food Control,2016,73:838-846.
[9]AL-ROUSAN A A,OLAIMAT A N,OSAIL T,et al.Use of acetic and citric acids to inhibit Escherichia coli O157:H7,Salmonella Typhimurium and Staphylococcus aureus in tabbouleh salad [J].Food Microbiology,2018,73:61-66.
[10]BYUN K H,SANG H H,YOON J W,et al.Efficacy of chlorine-based disinfectants (sodium hypochlorite and chlorine dioxide) on Salmonella enteritidis planktonic cells,biofilms on food contact surfaces and chicken skin[J].Food Control,2020,123(2):107838.
[11]SCHLISSELBERG D B,YARON S.The effects of stainless steel finish on Salmonella typhimurium attachment,biofilm formation and sensitivity to chlorine[J].Food Microbiology,2013,35(1):65-72.
[12]费楠,李芳菲,党苗苗,等.非热杀菌技术特点及在肉制品加工中的应用[J].食品安全质量检测学报,2015,6(2):540-544.
FEI N,LI F F,DANG M M,et al.Characteristics and application of non-thermal sterilization technology in meat products processing[J].Journal of Food Safety and Quality,2015,6(2):540-544.
[13]LI J,SUO Y J,LIAO X Y,et al.Analysis of Staphylococcus aureus cell viability,sublethal injury and death induced by synergistic combination of ultrasound and mild heat[J].Ultrasonics Sonochemistry,2017,39:101-110.
[14]迟媛,弓敏,马艳秋,等.超声协同次氯酸钠杀灭腐败菌效果与动力学研究[J].农业机械学报,2020,51(7):372-381.
CHI Y,GONG M,MA Y Q,et al.Bactericidal effect of three typical strains by ultrasonic combined with sodium hypochlorite[J].Transactions of the Chinese Society for Agricultural Machinery,2020,51(7):372-381.
[15]PARK J S,HA J W.Ultrasound treatment combined with fumaric acid for inactivating foodborne pathogens in apple juice and its mechanisms [J].Food Microbiology,2019,84:103277.
[16]黄小龙.冰鲜鸡肉腐败优势菌群及其化学抑菌剂的研究[D].邯郸:河北工程大学,2017.
HUANG X L.The ice fresh chicken corruption advantage bacterium group and chemical bacteriostatic agent research[D].Handan: Hebei University of Engineering,2017.
[17]YOUSSEF M K,YANG X,BADONI M,et al.Effects of spray volume,type of surface tissue and inoculum level on the survival of Escherichia coli on beef sprayed with 5% lactic acid[J].Food Control,2012,25(2):717-722.
[18]LI Z,GUO R,WANG F,et al.Inactivation of Salmonella enteritidis on eggshells by lactic acid spray[J].Food Control,2019,104:201-207.
[19]王凤婷,孙芝兰,吴海虹,等.乳酸对阴沟肠杆菌的抑菌作用及其机制分析[J].食品科学,2018,39(6):95-100.
WANG F T,SUN Z L,WU H H,et al.Antimicrobial activity and mechanism of lactic acid on Enterobacter cloacae[J].Food Science,2018,39(6):95-100.
[20]刘亚文,靳盼盼,许晓曦,等.乳酸对阴沟肠杆菌生物膜形成的抑制作用[J].食品科学,2020,41(7):1-7.
LIU Y W,JIN P P,XU X X,et al.Inhibitory effect of lactic acid on biofilm formation of Enterobacter cloacae[J].Food Science,2020,41(7):1-7.
[21]汤纯.小龙虾细菌污染情况调查及控制技术研究[D].扬州:扬州大学,2020.
TANG C.Investigation on bacterial contamination of red swamp crayfish and its control technology[D].Yangzhou:Yangzhou University,2020.
[22]王凤婷,靳盼盼,刘芳,等.乳酸对粪肠球菌的抑菌作用及作用机制[J].江苏农业学报,2018,34:200-206.
WANG F T,JIN P P,LIU F,et al.Antimicrobial activity and mechanism of lactic acid on Enterococcus faecalis[J].Jiangsu Journal of Agricultural Sciences,2018,34:200-206.
[23]林祎.声热复合处理对液态乳中致病菌的杀菌效果与理化特性影响研究[D].杭州:浙江大学,2018.
LIN Y.Effect of thermos-sonication treatment on pathogens inactivation and physicochemical properties of liquid milk[D].Hangzhou:Zhejiang University,2018.
[24]LIAO H,JIANG L,CHENG Y,et al.Application of nisin-assisted thermosonication processing for preservation and quality retention of fresh apple juice[J].Ultrasonics Sonochemistry,2018,42:244-249.
[25]ZHANG H C,WANG S Y,GOON K.Experimental data for inactivation of foodborne pathogens based on synergistic effects of ultrasound and natural compounds during fresh produce washing[J].Ultrasonics Sonochemistry,2020,64:104983.
[26]SHAO L T,DONG Y,CHEN X J,et al.Modeling the elimination of mature biofilms formed by Staphylococcus aureus and Salmonella spp.Using combined ultrasound and disinfectants[J].Ultrasonics Sonochemistry,2020,69:105269.
[27]YU H,LIU Y,YANG F W,et al.Synergistic efficacy of high-intensity ultrasound and chlorine dioxide combination for Staphylococcus aureus biofilm control[J].Food Control,2021,122:107822.
[28]GUO M M,ZHANG L J,HE Q,et al.Synergistic antibacterial effects of ultrasound and thyme essential oils nanoemulsion against Escherichia coli O157:H7[J].Ultrasonics Sonochemistry,2020,66:104988.
[29]LIU F,TANG C,WANG D B,et al.The synergistic effects of phenyllactic acid and slightly acid electrolyzed water to effectively inactivate Klebsiella oxytoca planktonic and biofilm cells[J].Food Control,2020,20:107804.
[30]LIU F,WANG F T,DU L H,et al.Antibacterial and antibiofilm activity of phenyllactic acid against Enterobacter cloacae[J].Food Control,2018,84:442-448.
[31]LIU X,CAI J X,CHEN H M,et al.Antibacterial activity and mechanism of linalool against Pseudomonas aeruginosa[J].Microbial Pathogenesis,2020,