如果一种食物被证明能够有利于身体的1 个或多个目标功能,且不仅具有足够的营养效果,而且与改善健康和福祉或降低患病风险有关,那么它就可以被视为“功能性”[1]。食品功能性成分是正常饮食的一部分,它们不是药物或其它膳食补充剂,功能性食品之所以能发挥功效,均来源于其丰富的活性成分[2]。近年来,食品工业中功能性食品的开发和商业化趋势日益高涨,功能性食品提取物(如苹果皮、黑胡萝卜、米糠)正被用于药代动力学研究和临床实践[3]。这些物质能否在人体内产生功效,首先在于它们能否被充分吸收利用。然而,由于功能性食品提取物分子质量大、结构复杂、理化性质特殊,受到人体发育屏障的限制,阻碍了这些功能性食品提取物的吸收,因此,研究这些功能性食品提取物的吸收代谢机制,及其在人体内的作用方式势在必行。
Caco-2 细胞培养模型,人结肠腺癌细胞系,被广泛用于评估Caco-2 细胞对药物和化学物质的摄取和生物利用的有效性。在体外培养过程中,形成单细胞层后,自发地进行上皮样分化,具有微绒毛结构、刷状边缘以及细胞间紧密连接等类似于人类小肠黏膜细胞的结构,可以模拟体外培养的人肠上皮的结构和功能[4-6]。Caco-2 细胞培养模型在研究营养素或药物吸收、转运和代谢方面都极为重要,在功能性食品中也得到广泛的应用。然而,Caco-2 细胞模型与人类上皮细胞存在差异。例如,Caco-2 细胞模型的细胞旁途径渗透率低于人类上皮,由于缺乏足够的黏液层,很容易允许高度扩散的小分子通过微绒毛渗透[7]。近年来,多方机构和人员在原始的模型基础上不断改进,建立了新的Caco-2 模型,例如:加速Caco-2 渗透性模型[8]、TC-7 细胞模型[9]以及包含75%Caco-2 细胞和25%HT29-5 M21 细胞的共培养体系[10]。这些模型虽然对营养物质的消耗会有所增加,但是对生物有效性的预测准确度得到提升。
一般来说,Caco-2 细胞在培养后7 d 开始分化,分化完成约21 d。短期培养获得的未分化Caco-2 细胞通常用于研究活性成分的抗癌或抗氧化活性,而分化后的Caco-2 单层细胞由于形态、标志酶的表达,以及与人小肠相似的通透性特征而被用于体外模拟肠道[11]。此外,由于分子生物学的发展,分化的Caco-2 细胞模型得到极大的发展。例如,用微流控细胞培养技术建立2D 或3D细胞模型、共培养模型等[12-14]。这不仅克服了传统模型的局限性,而且进一步拓宽了食品因素与肠道相互作用的应用范围。本文综述功能性食品提取物在Caco-2 细胞模型上的吸收、转运、代谢和功能评价等方面,以及Caco-2 模型的培养方法和共培养研究进展,概括功能性提取物在Caco-2 模型中的抗炎、抗氧化、抗肿瘤等功能性机制,以及应用中面临的挑战。
1 Caco-2 细胞分化模型建立
1.1 Caco-2 细胞培养方法
1.1.1 在普通平板培养皿上培养Caco-2 细胞Caco-2 细胞在用于研究吸收代谢机制和功能评价之前,需要进行传代培养。一般在37 ℃、5%CO2的潮湿环境中,于含有不同浓度和比例的胎牛血清、非必需氨基酸、青霉素、链霉素等培养液的MEM(低限量Eagle 培养基)或DMEM(Dulbecco改良的Eagle 培养基) 上生长,在培养瓶中传代20~60 代,细胞融合80%~90%。据各项研究表明[15-16],Caco-2 细胞培养分为以下步骤:
1) 培养液与缓冲溶液的配制 培养液用MEM 或DMEM,缓冲液用标准Hanks 平衡盐溶液(HBSS)和0.25%胰蛋白酶-0.02%EDTA 消化液。
2) 细胞的复苏 从液氮罐中取出细胞冷冻管,解冻后离心,加入培养液重悬细胞,调整细胞密度,接种于培养瓶培养。
3) Caco-2 细胞的传代 细胞生长到高密度时,需要分至新的培养瓶中,加入消化液漂洗细胞后,置于37 ℃消化,终止消化后,用吸管吹打脱壁,将细胞分瓶置于培养箱中培养。
4) Caco-2 细胞的冻存 加入适量冻存培养液,计数后调整最终密度装入冻存管,按照标准冻存程序存入液氮罐中。
1.1.2 在Transwell 上培养Caco-2 细胞 用于建立Caco-2 细胞模型的Caco-2 细胞一般在第20~60 代之间[17],在大多数试验中,Caco-2 细胞的培养密度小于2.5×105 个/cm2,因为密度太大容易导致大量细胞死亡。Transwell 这项技术的主要材料是Transwell 小室,其外形类似于一个可放置在孔板里的小杯子,Transwell 的命名也由于厂家不同而不同,并且可以用不同材料、不同尺寸的小室来进行不同的试验。杯子其余部分的材料与普通的孔板类似,最大的不同是杯子底层有一张有通透性的膜。这层膜上的微孔大小大约在0.1~12.0 μm之间,根据不同试验要求可用不同材料,一般常用的是聚碳酸酯膜。Caco-2 细胞培养模型见图1。当把Transwell 小室放在培养板上后,小室内叫做上室,培养板内叫做下室,分别装上、下层培养液,以聚碳酸酯膜相隔。运用不同薄膜和不同孔径可以研究共培养、细胞迁移、细胞侵袭等[18]。此外,由于Caco-2 细胞模型要求细胞不能穿过多孔膜,因此通常选择孔径为0.44 μm 的膜。将Caco-2 细胞以约1×10 个/mL,每孔0.5 mL 的密度接种在Transwell 内培养21 d 左右。Transwell 小室一般用于研究生物活性物质在Caco-2 细胞中的转运吸收机制,测定细胞活性,评价抗炎、抗氧化等功能性。例如,在共培养系统中,因为不研究细胞的运动能力,因此可以选择小于3.0 μm 的孔径,细胞不会通过薄膜。将2 个细胞分别种于上室和下室,可以研究下室细胞分泌的物质对上室物质的影响[19]。
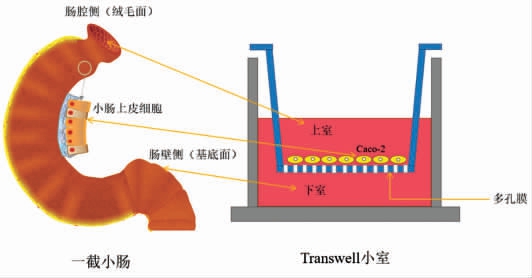
图1 Caco-2 细胞培养模型
Fig.1 Conventional Transwell plate and schematic diagram of Caco-2 cell model
1.2 Caco-2 细胞Transwell 模型的评估
细胞极性可以通过检测细胞绒毛膜表面标记酶的活性,或者通过光学或电子显微镜观察分化标记结构的形成来确认[20]。转化酶、乳糖酶、异麦芽糖酶和碱性磷酸酶是小肠刷状缘细胞的标志酶,它们的活性在一定程度上反映了Caco-2 细胞分化的程度[21]。电子显微镜(TEM)可以直接观察到单层顶端微绒毛和细胞间紧密连接的形成过程。光学显微镜下可观察到单分子膜的形成过程[22]。
Caco-2 单层的完整性和渗透性可以通过Millicell 伏特欧姆计和STX 100C 电极测量的跨上皮电阻(TEER)值进行评估[23]。因为该值准确度比较高,所以广泛用于评估Caco-2 单层的完整性。当单层膜的TEER 值大于300 Ω 时,Caco-2单层可用于进一步试验[24]。
此外测定暴露标志物的跨膜通量也能反映单层的通透性,常用的标志物有甘露醇、菊粉、聚乙二醇、荧光黄等,甘露醇渗透性的变化是一个比较敏感的细胞单层完整性标志[25]。在实验室中,一个完整的Caco-2 细胞单层的[14C]甘露醇通透性通常为(1.2±0.5)×10-7 cm/s,认为渗透系数大于5×10-7 cm/s 表示细胞单层受损,大于1×10-6 cm/s 表示细胞单层对类药物化合物的破坏完整性。以甘露醇的低通透性(<0.5%/h)作为评价Caco-2 单层完整性的标准[26]。
转运效率(Papp)可以用来评估细胞模型的转运效率,该参数描述了分子穿过细胞屏障每单位面积所经过的通量,Papp 与细胞紧密性和表面转运蛋白有关,Caco-2 细胞中Papp 的值较低,可能是因为紧密连接较窄,吸收转运蛋白的表达较低[27]。
总之,随着Caco-2 细胞的生长和分化,单层细胞的TEER 值以及细胞内标志酶的表达和活性逐渐增加,而单层细胞对标志物的通透性逐渐降低。所有这些信号表明Caco-2 细胞已经分化,Caco-2 细胞模型已经可以用于实验。
2 功能性食品提取物在Caco-2 细胞中的应用
2.1 功能性食品提取物在Caco-2 细胞模型中的抗炎作用研究
分化的Caco-2 细胞模型是研究功能性食品提取物抗氧化、抗癌和抗炎活性非常合适的模型。炎症反应的初始阶段包括巨噬细胞的激活,导致细胞因子的分泌,如IL-1β、TNF-α 和IL-6,或IL-10,它们是促炎因子,具有抗炎活性[28]。根据反应机制可知,提高抗炎作用的机理是减少促炎因子的释放,抑制促进促炎因子释放的酶的活性,抑制信号通路等。有研究利用双孢蘑菇提取物处理受脂多糖(LPS)和TNF-α 刺激的Caco-2 细胞,可显著降低环加氧酶COX-2 和前列腺素PGF-2α受体的表达。而蘑菇提取物能增加Caco-2 细胞核转录因子Nrf-2 的表达,降低IL-6 水平。Caco-2细胞膜中多不饱和脂肪酸与饱和脂肪酸的含量发生了显著变化。这些结果表明,双孢蘑菇生物量提取物具有抗炎特性[29]。许多饮食成分,如植物化学物质,在抗炎方面发挥着重要作用,如肉桂中的肉桂酸和肉桂醛具有抗炎活性。在肠上皮Caco-2 细胞和RAW264.7 巨噬细胞的共培养模型中发现,肉桂醛抑制LPS 刺激的巨噬细胞产生NO、TNF-α和PGE2,阻断LPS 刺激的巨噬细胞的炎性细胞因子水平和iNOS、COX-2、NF-κB 和IκB 的蛋白表达,肉桂酸对Jnk、NF-κB、IKKα/β 和p38MAPK 的磷酸化均有抑制作用。肉桂醛还能降低NFκB、IKKα/β 和p38MAPK 的磷酸化水平,而不影响JNK 的磷酸化水平[30]。
2.2 功能性食品提取物在Caco-2 细胞模型中的抗氧化活性研究
自由基的产生与人类疾病的发生有关,维持健康生活依赖于饮食中抗氧化物质的供应,抗氧化物质可以调节体内的自由基过程[31]。大豆被认为是一种很有前景的生物活性肽来源。在人Caco-2 细胞模型中,用H2O2 刺激细胞单层,确定了4 个大豆蛋白水解物SPH 组分(SPH-I、SPH-II 和SPH-III)对细胞的抗氧化和保护潜力。SPH-I 和SPH-III 均能减少自由基的产生,而SPH-I 的抗氧化活性最强。氨基酸分析结果表明,SPH-I 富含疏水性和抗氧化性氨基酸,这与其较强的抗氧化活性有关。此外,SPH-I 通过抑制脂质过氧化和刺激抗氧化酶活性来保护Caco-2 细胞免受H2O2 诱导的氧化应激[32]。食用牡丹花(FDB)不同器官的酚类物质组成和抗氧化活性均不同,卵巢表现出最高的DPPH 和ABTS·+自由基清除活性,牡丹雄蕊中的总酚提取物 (TPE) 具有很强的清除活性氧(ROS)的能力,TPE 可以升高TEER 值,增强Caco-2 细胞的屏障功能,增加Caco-2 细胞中ZO-1、CLDN3 和occludin 的mRNA 含量,然而不影响CLDN1 的mRNA 水平[33]。综上可知,功能性食品提取物在Caco-2 细胞中的抗氧化机理大致为清除活性氧和自由基,提高抗氧化酶的活性等。
2.3 功能性食品提取物在Caco-2 细胞模型中的抗癌和抗增殖研究
癌症是一种以不受控制的细胞分裂和异常细胞数量增加为特征的疾病。功能性食品提取物中存在的活性化合物的不同作用机制是促进细胞凋亡、细胞周期阻滞和抑制与癌症发病有关的各种信号转导途径[34]。水果和蔬菜中存在的各种营养素和植物化学物质已被视为潜在的抗癌因子。有研究表明,绿原酸(CGA)是许多人群的主要膳食多酚,咖啡中含有大量绿原酸,有研究表明咖啡摄入量与结肠癌发生率呈负相关[35]。Caspase-3 的激活是细胞凋亡的确认性标记。在CGA 的细胞中,Caspase-3 裂解的存在证明了这些化合物裂解Caspase-3 的能力。此外,CGA 与其微生物代谢物的结合,在亚毒性浓度下,可以抑制细胞增殖和细胞周期中S 期的进展。在消化过程中,形成的多种多酚代谢产物的组合可以共同发挥作用,增加抗结肠癌的效果[36]。另外一项研究称,杨树是一种预防与饮食有关的慢性疾病的药物,例如:肥胖症和糖尿病。杨树果实中含有多种酚类化合物,主要为绿原酸、原花青素、花青素苷和槲皮素。杨树酚类提取物作为细胞保护剂,可通过GLUT2 和CD36/FAT 转运蛋白降低Caco-2 细胞对葡萄糖和游离脂肪酸的摄取,减少诱导氧化应激反应,减少脂质蓄积。此外,以最高浓度的化合物进行的温育会诱导细胞凋亡而不是坏死,这反过来又会减弱炎症反应,这是由于坏死受损细胞的细胞内成分渗漏减少所致,可谓是一项开创性的研究[37]。

图2 功能性食品提取物在Caco-2 细胞模型中通过线粒体通路诱导细胞凋亡的抗增殖机制[36]
Fig.2 Anti-proliferation mechanism of functional food extracts inducing apoptosis through mitochondrial pathway in Caco-2 cell model[36]
2.4 功能性食品提取物在Caco-2 细胞中的降血脂和降糖研究
谷类、水果等功能性食品富含酚类、类黄酮、酚酸、花青素和植物甾醇等植物成分。流行病学研究证明,长期食用谷物可以有效增加脂肪酸结合蛋白的表达,从而显著减少脂肪堆积,缓解心血管疾病[38]。据报道,从咖啡浆果中提取的咖啡阿拉伯果肉提取物(CPE)以剂量依赖的方式诱导Caco-2细胞胆固醇胶束转运显著减少,CPE 通过下调NPC1L1 介导的LXR 活化,干扰胶束复合物的形成,来抑制肠道胆固醇吸收,从而在体内外发挥降胆固醇作用[39]。Ⅱ型糖尿病(T2D)是一种缺乏胰岛素引起的高血糖为特征的代谢紊乱,DPP4、α-葡萄糖苷酶和谷氨酰胺是T2D 治疗最受关注的靶点。燕麦球蛋白的胰蛋白酶水解物在体外具有很强的DPP4 抑制活性,而且在Caco-2 细胞中大量培养(48 h)后,DPP4 蛋白的表达也被下调,揭示燕麦多肽可能具有促进GLP-1 在人体内释放的巨大潜力,因此燕麦多肽能下调餐后血糖的水平[40]。总之,功能性食品提取物是通过下调葡萄糖和胆固醇吸收靶点的表达和上调转运蛋白,来起到降糖、降脂的作用。
3 功能性食品提取物在Caco-2 细胞中的吸收、转运和代谢机制
3.1 吸收机制
表1 在Caco-2 细胞模型中的功能性食品提取物的抗炎、抗氧化、抗增殖、降糖、降脂特性
Table 1 Antioxidant,anti-inflammatory,anti-proliferation and anti-cancer properties of functional food extracts (FFEs)using Caco-2 cell line

功能性食品提取物类型细胞培养模型功能作用作用机理参考文献黑胡萝卜中的酚类化合物Caco-2 和EA.hy926 在Transwell 上共培养抗炎IL-8、VEDF、单核细胞趋化蛋白和细胞间黏附分子的释放受到抑制[41]~[43]ROS、IL-1b 诱导的PGE-2 和IL-8 分泌减少及NF-kB 活性下调可可多酚提取物Caco-2 在DMEM 培养皿中培养单宁酰基水解酶处理葡萄渣Caco-2 在含DMEM 的T-75 培养瓶中培养NF-kB、MAPK 下游JNK 通路、iNOS和COX-2 活性下调Granny Smith 苹果原花青素提取物Caco-2 在含MEM 的T-75 培养瓶中培养抗氧化、抗炎上调超氧化物歧化酶、过氧化氢酶和谷胱甘肽的mRNA 表达,下调NFkβ,IL-6,TNF-α mRNA 表达[44]~[47]提高H2O2+IL-1β 诱导的细胞内谷胱甘肽含量和谷胱甘肽过氧化物酶活性;减少IL-8、TNF-α、IL-6 和COX-2蛋白的分泌胡萝卜中的花青素和马铃薯中的花青素合欢叶提取物中的黄酮类化合物Caco-2 在DMEM 培养皿中培养H2O2 诱导的 (IL)-1β、IL-6、IL-8 和TNF-α 的降低,内在抗氧化防御机制的恢复橄榄油酚类提取物Caco-2 在含DMEM 的6 孔Transwell 中培养Caco-2 在含MEM 的24 或48孔Transwell 中培养MAP 激酶、NF-kB、JNK1/2 磷酸化的调节以及抑制IL-6、IL-8 和NO 的产生煮熟的规则变黑(RR)和非变黑(CND)蔓越莓豆的酚类提取物Caco-2 在含MEM 的T-75 培养瓶中培养抗氧化TNF-α 诱导的细胞因子IL-8 释放减少及超氧化物歧化酶、过氧化氢酶、谷胱甘肽和谷胱甘肽过氧化物酶的升高[48],[49]杏仁皮酚类提取物Caco-2 在MEM 培养皿中培养免受氧化应激的保护松树皮提取物Caco-2 在含DMEM 的T-25 或T-75 培养瓶中培养抗氧化、抗癌细胞色素c 释放,Caspase-3 活化,ROS 生成减少,细胞周期阻滞和凋亡[50]钩子的丙酮提取物Caco-2 在DMEM 培养皿中培养抗增殖3/7 细胞在Caco-2 细胞中凋亡[51]~[53]生奶上清液Caco-2 在含DMEM 的T-75 培养瓶中培养从原料奶中提取的牛乳脂肪球膜(MFGM)铁皮的水提物和醇提物Caco-2、HeLa、Jeg-3 和JAR 在含RPMI1640 培养基的T-75培养瓶中培养;MC3T3-E1 MG63 和HDF 在含DMEM 的T-75 培养瓶中培养减少ROS 的产生皮蛋Caco-2 在含DMEM 的T-75 培养瓶中培养抗增殖、抗炎上调Caspase-3 诱导Caco-2 细胞凋亡;降低IL-6 和TNF-α 的表达[54]青稞啤酒糟中提取的可溶性膳食纤维(SDF)Caco-2 在MEM 培养瓶中培养 降低胆固醇含量控制胆固醇外流相关的肠道基因,ABCA1、ABCG5 和LXRα 的表达水平均被SDF 上调,降低胆固醇吸收和合成相关基因的转录水平[55]~[57]
(续表1)

功能性食品提取物类型细胞培养模型功能作用作用机理参考文献富含植物甾醇的肉类 Caco-2 在含DMEM 的6 孔Transwell 中培养肠上皮细胞胆固醇摄取的减少抑制HMG-CoA 还原酶活性与降低胆固醇渗透性黑豆蛋白组分Caco-2 在MEM 培养皿中培养 降低葡萄糖含量从马鞭草冷凝物中提取咖啡酰奎宁酸Caco-2 在含DMEM 的12 孔Transwell 中培养GLUT2 和SGLT1 表达下调[58],[59]含饼干的咖啡纤维Caco-2 在含DMEM 的12 孔Transwell 中培养;HuTu-80 在含MEM 的24 孔Transwell 中培养改进5-羟色胺、胰高血糖素样肽(GLP-1) 和抗氧化酶;α-葡萄糖苷酶活性降低乳酸菌益生菌发酵骆驼奶的研究Caco-2、MCF-7 在含DMEM 的96 孔Transwell 中培养抗肿瘤、抗 糖 尿病、抗氧化抗癌活性,α-淀粉酶和α-葡糖苷酶抑制潜力,抗氧化剂和蛋白水解[60]
食物中的营养素或外源性物质在消化系统消化后被吸收到血液中,然后在体内重新分布的程度通常以生物利用度为特征。由于一些微量营养素的含量较低,生物利用度与食物的膳食成分、营养素的存在形式以及宿主的生理状况直接相关[61-62]。小肠对营养物质进入血液循环的吸收主要是由肠道上皮细胞完成的。在分化的Caco-2 细胞模型中,生长在微孔膜上的单层细胞在对应于肠腔的AP 室和对应于肠血管和淋巴循环的BL 室之间形成屏障[63]。因此,评估目标化合物在分化的Caco-2单层上的吸收是预测其在人体内生物利用度的策略之一。
近年来,利用分化的Caco-2 细胞模型进行了大量的生物利用度试验研究,主要集中在以下几个方面:
1) 控制被动扩散营养素的生物利用度 微量元素在不同条件下的生物利用度差异很大,例如:为了控制茶叶中氟的生物利用度,在Caco-2细胞模型上评价了茶叶中各成分对氟生物利用度的影响。发现消化液中的酶和酸可能会影响铝和氟的结合形式,从而影响氟的吸收。茶叶中的多酚类物质EGCG 在高浓度的情况下,也能抑制氟的积累,这对未来研究减少茶叶引起的氟中毒是很有意义的[64]。
2) 营养分子前体吸收评价 一项研究把姜黄素包埋在固体脂质纳米粒(SLN)中,包埋在SLN中的姜黄素在消化后,大部分被溶解在混合胶束中,混合胶束的大小和表面电荷影响它们在体外通过黏液覆盖的小肠上皮的通透性,由于胶束的中性表面电荷,固体脂质纳米粒中的姜黄素迅速渗透到上皮细胞,使在大鼠模型中的生物利用度比姜黄素溶液中的提高了12 倍以上[65]。
3) 营养物质相互作用对生物利用度的影响
基于分化的Caco-2 细胞模型的研究表明,营养素的生物利用率在很大程度上取决于食品-食品的协同作用。制备了天然酪蛋白酸钠-维生素A复合物(NaCAS-VA)和改性酪蛋白酸钠-维生素A 复合物(SNaCaS-VA)等多种复合物,在整个消化过程中,监测含酪蛋白和各种酪蛋白酸钠-维生素A 复合物的消化液中维生素A 的含量。研究结果表明,不同乳蛋白维生素复合体的维生素A 摄取维生素的能力高于游离态的维生素A[66]。
4) 营养物质结构与生物利用度的关系 一项研究对紫肉甘薯(PFSP)花色苷的胃肠道生物利用度进行了测定,并与红酒花色苷的生物利用度进行了比较。红葡萄酒中的花色苷主要是C3 单葡萄糖苷,而PFSP 中的花色苷中同时含有糖苷和二葡糖苷部分,与不太复杂的红葡萄酒花色苷相比,酰化花色苷对整体模拟消化表现出更高的抵抗力,在肠道水平的降解率分别约为30%和45%[67]。
5)胃肠消化对营养物质生物利用度的影响 Caco-2 细胞分化模型常被用来预测消化产物的生物利用度,特别是各种食物蛋白中的多肽。大豆蛋白水解物中含有具有较高生物利用度的抗氧化肽,可作为功能性食品原料的潜在来源。类似的试验表明,Stracchino (典型的意大利软奶酪)和mbc (一种独特的受保护原产地标识水牛奶产品)具有良好的稳定性和生物利用度,是潜在的功能性食品[42,68-69]。
3.2 转运机制
基于分化的Caco-2 细胞模型,不仅可以评估食物中营养物质和外源物质的生物利用度,而且可以研究特定条件下的膜转运机制。小肠内营养素的膜转运可通过以下4 种方式中的1 种或多种实现:被动扩散、细胞旁转运、载体介导转运和内吞作用[70]。
利用Caco-2 细胞模型对没食子酸的吸收转运方式进行了研究,它的转运方式以被动方式为主,同时没食子酸在Caco-2 细胞的转运受浓度、温度、pH 值及P-gp 抑制剂的影响,P-gp 参与了没食子酸的转运[71]。用两种不同吸收机制(内吞作用和细胞旁途径) 的特异性抑制剂或增强剂(Wortmannin 和细胞松弛素D) 评价燕麦醯胺(AVNs)的潜在转运途径。结果显示,在细胞松弛素D 存在下,3 种AVNs 的Papp 值均显著增加,加入Wortmannin 后无明显变化。表明这3 种AVNs 是通过细胞旁途径吸收的[72]。钩藤碱在Caco-2 细胞模型的吸收规律研究中,对影响钩藤碱在Caco-2 细胞模型上转运特征的因素(包括浓度、时间及跨膜转运蛋白P-糖蛋白)进行考察,当加入P-糖蛋白抑制剂后,药物由BL 侧向AP 侧的转运量显著减少,而由AP 侧到BL 侧的转运量显著增加。钩藤碱在Caco-2 细胞上转运存在一定的浓度及时间依赖性,且P-糖蛋白介导钩藤碱在Caco-2 细胞上转运[73]。通过测定豌豆铁蛋白在胃pH 条件下的稳定性并阐明Caco-2 细胞摄取铁的机制,评价了豌豆铁蛋白作为食物补充剂的作用。网状蛋白介导的内吞抑制剂(氯丙嗪)使铁蛋白通过Caco-2 细胞的转运降低了30%。网状蛋白介导的内吞作用被认为是豌豆铁蛋白进入Caco-2 细胞单层的转运途径[74]。
3.3 代谢机制

图3 羟基肉桂酸在Caco-2 细胞模型中的代谢机制[76-77]
Fig.3 Metabolic mechanism of hydroxycinnamic acid in Caco-2 cell model[76-77]
利用分化的Caco-2 细胞模型证明溶血磷脂,如溶血磷脂酰胆碱,在被肠上皮细胞吸收之前由肠道以2 种方式代谢,包括代谢酶的分泌和代谢酶的顶端选择性表达[75]。羟基肉桂酸是一种重要的抗氧化剂,其在分化的Caco-2 细胞中的代谢表明其代谢途径分为I 期脱酯和II 期向顶端排泄2个阶段。研究结果还表明,肠上皮中的硫酸化可能是羟基肉桂酸的最初代谢途径。它主要被水解,然后甲基化。硫酸化被认为是Caco-2 细胞单层的重要代谢途径。原则上,Caco-2 细胞单层可以形成羟基肉桂酸的葡萄糖醛酸和硫酸盐结合物[76-77]。肠上皮代谢是由I 相和II 相代谢酶引起的。存在于小肠上皮细胞的各种酶系统是口服药物的第1 道代谢屏障,其中包括I 相代谢酶(细胞色素P450等)及Ⅱ相代谢酶。这些酶可以减少药物的口服生物利用度,并且与药物相互作用及药物生物利用度的个体差异有关[78]。
4 分化Caco-2 细胞模型在食品-肠道相互作用研究中的应用前景
4.1 改变渗透系统的组成以校正生物利用度
当通过分化的Caco-2 细胞模型预测营养物质的生物利用度时,结果容易受到许多因素的影响,如受试者的理化性质、单层面积、pH 梯度以及与塑料装置的非特异性结合,这些因素可能会导致体内和体外实验结果不一致[79]。例如,脂溶性营养物质只有在与肠上皮细胞中的乳糜微粒结合时才能被吸收,而在正常细胞培养条件下,Caco-2细胞不能分泌乳糜微粒[80]。为了解决这个问题,有科学家研究Caco-2 细胞对多种类胡萝卜素的肠道吸收时,在分化的Caco-2 单层的AP 侧添加了油酸、牛黄胆酸和3H-甘油,并成功地建立了Caco-2 细胞分泌富含甘油三酯的脂蛋白模型[81]。另一项研究用仿生工程细胞外基质(ECM)代替标准Caco-2 细胞模型中的胶原基质。ECM 含有来源于小肠ECM 蛋白的模块化蛋白结构域。在这个改进的Caco-2 模型中,体内通过细胞旁运输的物质的转运速率显著提高[82]。这些方法都提高了分化的Caco-2 细胞模型对生物利用度预测的准确度。
4.2 利用分子生物学研究转运蛋白或代谢酶
研究表明,Caco-2 细胞单层转运蛋白、代谢酶和核受体的表达与小肠的表达不完全一致。与人类小肠和大肠相比,一些外排转运蛋白在Caco-2 单层中表达不足,其中乳腺癌耐药蛋白BCRP(ABCG2)在Caco-2 细胞中的转录水平比在大肠中低100 倍[83]。除了寻找其它合适的肠道细胞模型作为替代方案外,已经有多种方法来修改Caco-2 细胞模型,以满足不同试验的需要。具体地说,Caco-2 细胞模型常用的修饰方法包括基因修饰、基因敲除、转染、亚克隆等技术[84-85]。一项研究用人工染色体(HAC)载体构建细胞色素P450(CYP)3A4 和NADPH-细胞色素P450 还原酶(CPR)共同表达的Caco-2 细胞。利用微细胞介导的染色体转移技术将CYP3A4-CPR-HAC 载体转入Caco-2 细胞,亲本细胞与CYP3A4-CPR-HAC/Caco-2 细胞单层之间具有较高的跨皮电阻(TEER) 值和一定的通透性,CYP3A4-CPR-HAC/Caco-2 细胞中的代谢活性高于已有的表达CYP3A4 的Caco-2 细胞模型的代谢活性,这使得能够在传统模型基础上,更灵敏地检测代谢物来评估肠道代谢[85]。充分利用现代分子生物学和遗传信息对Caco-2 细胞中某些蛋白质的表达进行暂时或稳定的调控,是今后对该模型进行修正的一种可行而有效的方法。
4.3 细胞共培养更好地模拟肠道细胞的微环境
4.3.1 Caco-2 细胞与其它细胞共培养 小肠上皮黏液层的形成依赖于杯状细胞分泌黏液的能力,因此没有杯状细胞的单个Caco-2 细胞单层不能形成类似于小肠上皮的黏液层。由于没有黏膜层,分化的Caco-2 细胞模型的旁路通透性总是低于体内[86]。为了使分化的Caco-2 细胞模型能够形成黏液层,Caco-2 细胞与产生黏蛋白的细胞系HT29-MTX 共培养[87]。用分泌黏液的Caco-2/HT29-MTX-E12 共培养和Caco-2 单层作为体外细胞转运模型,研究胰岛素的通透性,共培养的通透性显著大于Caco-2 细胞单层[88]。应用肠黏膜炎症模型研究了牛初乳的抗炎和抗菌作用,结果表明,当肿瘤坏死因子(TNF-α)刺激Caco-2/HT29细胞单层时,初乳可降低IL-8 的水平[89]。在研究肉桂酸和肉桂醛抗炎作用时,用到的是Caco-2 和RAW264.7 共培养模型。RAW264.7 对脂多糖非常敏感,LPS 可激活巨噬细胞系RAW264.7,诱导NF-κB 途径,增加NO 的产生和细胞因子的分泌,如IL-1β、IL-6、IL-8 等。由于Caco-2 和RAW264.7 共用介质,LPS 激活的RAW264.7 中的NO 和炎性细胞因子影响Caco-2 单层,通过LPS 和炎性细胞因子的影响抑制屏障功能。将免疫细胞产生的多种细胞因子暴露于上皮细胞可以导致生物反应,而不是只暴露一种细胞因子[30]。
4.3.2 建立3D Caco-2 细胞模型 肠道是一个非常复杂的环境,多种细胞相互作用以维持正常的肠道功能。一维Caco-2 细胞模型不能准确模拟肠道环境,不能对肠道细胞间的串扰进行详细研究。因此,涉及Caco-2 细胞的二维 (2D) 甚至三维(3D)细胞模型开始出现,用于研究肠上皮细胞与其它细胞之间的相互作用。例如,一项研究开发了一种3D 人体肠道基质等效物(3D-ISE),它由人小肠上皮下肌纤维母细胞(ISEMF)嵌入自身细胞外基质组成。然后将Caco-2 种植到扁平或图案化的细胞合成的基质等效结构上,并对它们进行培养,直到分化形成良好的上皮组织。结果证明,花纹基质增加了吸收表面积、上皮增殖率和微绒毛密度。此外,它还引起上皮细胞生物学功能的改变,如酶和黏液的产生、极化和紧密性。因此它是一个结合三维形貌和充足的间质微环境,具有生理相关特征的三维肠道模型[90]。
4.3.3 建立人体肠道-血管微流控系统 最近世卫组织建立了一种新型的人体肠道-血管微流控系统来研究宿主-微生物之间的相互作用。肠上皮细胞(Caco-2)与血管内皮细胞(HUVECs)在蠕动微流控芯片上共培养5 d,在该芯片上建立了大肠杆菌引起的肠道损伤和炎症反应模型,并评价了干酪乳杆菌和抗生素的治疗效果。作为一种传统的体外肠道吸收模型,Caco-2 细胞通常在Transwell 中培养至少3 周,以分化成具有肠道吸收功能的模型。与之形成鲜明对比的是,这项研究结果显示周期性蠕动加上微流控装置中的液体流动,显著促进了肠上皮细胞的增殖以及糖萼和微绒毛的分泌。此外,芯片上周期性蠕动加液体流动也会影响肠上皮细胞屏障的分化、吸收和代谢功能[91]。与传统的细胞培养方法相比,微流控细胞培养有很多优点,可以提供一个更接近活体的细胞环境,以确保得出更可靠的分析结果,在体外研究宿主-微生物相互作用以及微生物群在肠道疾病中的作用和机制方面显示出良好的潜力。
5 结论
为了分析功能性食品及其提取物用于疾病治疗的途径,需要通过细胞的分析来研究食品与细胞之间的分子机制和相互作用。用Caco-2 细胞单层作为评价细胞模型,可以更方便地研究功能性食品提取物的不同作用机制。在Caco-2 细胞和共培养体系中可以观察到功能性食品提取物的抗炎、抗氧化和降胆固醇等生物活性。功能性食品提取物在细胞模型中经过了吸收、转运、代谢等转化,不同的功能性食品提取物具有不同的转化机制。近期对Caco-2 细胞模型进行了不同方式的改进,可以改变渗透系统的成分组成,来提高生物利用度的准确度,建立的共培养体系更贴切模拟肠道环境。
Caco-2 细胞可以为功能性食品提取物的研究提供更深入的了解。分化后的Caco-2 细胞表现出小肠上皮细胞的特征,并含有转运体和药物代谢酶,如酯酶、氨基肽酶和硫酸盐。然而,与小肠上皮相比,Caco-2 细胞存在一些缺陷或局限性,如低的细胞旁通透性和高度可扩散的小分子渗入微绒毛等。肠上皮细胞与Caco-2 细胞的主要不同之处在于Caco-2 细胞没有黏液层。另一个区别是Caco-2 细胞单层细胞中最重要的代谢酶CYP3A4低表达,CYP3A4 是人体上皮中主要的药物代谢酶。基因表达分析表明,与体内环境相比,Caco-2细胞摄取和外排转运蛋白的表达减少,从而导致误差的产生。尽管有这些限制,药物通过Caco-2单层的渗透特性与其对人体肠道上皮的渗透非常接近。因此,Caco-2 单层是一种强大的体外模型。
鉴于分化后的Caco-2 细胞模型不能完全模拟真实肠道,研究人员从自动化、生物化学、分子生物学和细胞共培养等方面对分化后的Caco-2细胞模型进行了大量的改进。开发了一种兼具人体肠道上皮特性和对大分子低通透性的共培养体系。虽然共培养体系显示出很好的重复性,但仍存在载体的高定量表达问题,这可能会消耗大量的营养物质和药物。在未来的研究中,分化的Caco-2 细胞模型应该在具有简单性和可靠性的情况下更接近内部环境,研究出成本效益高的细胞模型用于大规模食品-肠道相互作用分析。
[1]VERSCHUREN P M.Functional foods:Scientific and global perspectives[J].British Journal of Nutrition,2002,88(S2):S126-S130.
[2]ASHWELL M.Concepts of functional food[J].Nutrition & Food Science,2004,34(1):47.
[3]PLASEK B,LAKNER Z,KASZA G,et al.Consumer evaluation of the role of functional food products in disease prevention and the characteristics of target groups[J].Nutrients,2020,12(1):69.
[4]SADEGHI E S,ISKANDAR M M,SLENO L,et al.Absorption and metabolism of phenolics from digests of polyphenol-rich potato extracts using the Caco-2/HepG2 co-culture system[J].Foods,2018,7(1):8.
[5]XU Q,HONG H,WU J,et al.Bioavailability of bioactive peptides derived from food proteins across the intestinal epithelial membrane:A review [J].Trends in Food Science & Technology,2019,86:399-411.
[6]SCHRECK K,MELZIG M F.Intestinal saturated long-chain fatty acid,glucose and fructose transporters and their inhibition by natural plant extracts in Caco-2 cells[J].Molecules,2018,23(10):2544.
[7]BERMUDEZ-BRITO M,MUÑOZ-QUEZADA S,GÓMEZ-LLORENTE C,et al.Lactobacillus paracasei CNCM I-4034 and its culture supernatant modulate Salmonella-induced inflammation in a novel transwell co-culture of human intestinal-like dendritic and Caco-2 cells[J].BMC microbiology,2015,15(1):1-15.
[8]SEVIN E,DEHOUCK L,FABULAS-DA COSTA A,et al.Accelerated Caco-2 cell permeability model for drug discovery[J].Journal of Pharmacological and Toxicological Methods,2013,68(3):334-339.
[9]PEREIRA-CARO G,MATEOS R,SAHA S,et al.Transepithelial transport and metabolism of new lipophilic ether derivatives of hydroxytyrosol by enterocyte-like Caco-2/TC7 cells[J].Journal of Agricultural and Food Chemistry,2010,58(21):11501-11509.
[10]NOLLEVAUX G,DEVILLÉ C,EL MOUALIJ B,et al.Development of a serum-free co-culture of human intestinal epithelium cell-lines (Caco-2/HT29-5M21)[J].BMC Cell Biology,2006,7(1):1-11.
[11]熊雰,梁春来,于洲,等.3 种纳米氧化锌对不同分化状态Caco-2 细胞的毒性作用研究[J].毒理学杂志,2018,32(2):87-92.
XIONG F,LIANG C L,YU Z,et al.Toxic effects of three ZnO nanoparticles in undifferentiated and differentiated Caco-2 cells[J].Journal of Toxicology,2018,32(2):87-92.
[12]GAO D,LIU H,JIANG Y,et al.Recent developments in microfluidic devices for in vitro cell culture for cell-biology research[J].Trends in Analytical Chemistry,2012,35:150-164.
[13]BHAT M I,KAPILA S,KAPILA R.Lactobacillus fermentum (MTCC-5898) supplementation renders prophylactic action against Escherichia coli impaired intestinal barrier function through tight junction modulation[J].LWT,2020,123:109118.
[14]MÁRMOL I,JIMÉNEZ-MORENO N,ANCÍN-AZPILICUETA C,et al.A combination of Rosa Canina extracts and gold complex favors apoptosis of Caco-2 cells by increasing oxidative stress and mitochondrial dysfunction [J].Antioxidants,2019,9(1):17.
[15]GE Z,NIE R,MAIMAITI T,et al.Comparison of the inhibition on cellular 22-NBD-cholesterol accumulation and transportation of monomeric catechins and their corresponding A-type dimers in Caco-2 cell monolayers[J].Journal of Functional Foods,2016,27:343-351.
[16]WANG D,WILLIAMS B A,FERRUZZI M G,et al.Microbial metabolites,but not other phenolics derived from grape seed phenolic extract,are transported through differentiated Caco-2 cell monolayers[J].Food Chemistry,2013,138(2/3):1564-1573.
[17]CHEN K,ROCA M.In vitro bioavailability of chlorophyll pigments from edible seaweeds[J].Journal of Functional Foods,2018,41:25-33.
[18]DENARO M,SMERIGLIO A,DE FRANCESCO C,et al.In vitro intestinal transport and anti-inflammatory properties of ideain across Caco-2 transwell model[J].Fitoterapia,2020,146:104723.
[19]蔡文建,张意,陈宵,等.人源化肝细胞共培养系统为基础的代谢活化系统研究[J].毒理学杂志,2020,34(2):17-21,27.
CAI W J,ZHANG Y,CHEN X,et al.Metabolic activation system based on co-culture system of human hepatocytes[J].Journal of Toxicology,2020,34(2):17-21,27.
[20]SÄÄF A M,HALBLEIB J M,CHEN X,et al.Parallels between global transcriptional programs of polarizing Caco-2 intestinal epithelial cells in vitro and gene expression programs in normal colon and colon cancer[J].Molecular Biology of the Cell,2007,18(11):4245-4260.
[21]EKMEKCIOGLU C,FEYERTAG J,MARKTL W.Cinnamic acid inhibits proliferation and modulates brush border membrane enzyme activities in Caco-2 cells[J].Cancer Letters,1998,128(2):137-144.
[22]CABELLOS J,DELPIVO C,VÁZQUEZ-CAMPOS S,et al.In vitro assessment of CeO2 nanoparticles effects on intestinal microvilli morphology[J].Toxicology in Vitro,2019,59:70-77.
[23]VOLPE D A.Variability in Caco-2 and MDCK cell-based intestinal permeability assays[J].Journal of Pharmaceutical Sciences,2008,97(2):712-725.
[24]HUBATSCH I,RAGNARSSON E G E,ARTURSSON P.Determination of drug permeability and prediction of drug absorption in Caco-2 monolayers[J].Nature Protocols,2007,2(9):2111-2119.
[25]ARTURSSON P,PALM K,LUTHMAN K.Caco-2 monolayers in experimental and theoretical predictions of drug transport[J].Advanced Drug Delivery Reviews,2001,46(1/2/3):27-43.
[26]DAI Y,MENG Q,MU W,et al.Recent advances in the applications and biotechnological production of mannitol[J].Journal of Functional Foods,2017,36:404-409.
[27]SUN H,CHOW E C Y,LIU S,et al.The Caco-2 cell monolayer:usefulness and limitations[J].Expert Opinion on Drug Metabolism & Toxicology,2008,4(4):395-411.
[28]KAGNOFF M F.The intestinal epithelium is an integral component of a communications network[J].The Journal of Clinical Investigation,2014,124(7):2841-2843.
[29]MUSZYNSKA B,GRZYWACZ A,KALA K,et al.Anti-inflammatory potential of in vitro cultures of the white button mushroom,Agaricus bisporus (Agaricomycetes),in Caco-2 cells [J].International Journal of Medicinal Mushrooms,2018,20 (2):129-139.
[30]KIM M S,KIM J Y.Cinnamon subcritical water extract attenuates intestinal inflammation and enhances intestinal tight junction in a Caco-2 and RAW264.7 co-culture model[J].Food & Function,2019,10(7):4350-4360.
[31]CHENG C,ZOU Y,PENG J.Oregano essential oil attenuates RAW264.7 cells from lipopolysaccharideinduced inflammatory response through regulating NADPH oxidase activation-driven oxidative stress[J].Molecules,2018,23(8):1857.
[32]ZHANG Q,TONG X,SUI X,et al.Antioxidant activity and protective effects of Alcalase-hydrolyzed soybean hydrolysate in human intestinal epithelial Caco-2 cells[J].Food Research International,2018,111:256-264.
[33]XIANG J,YANG C,BETA T,et al.Phenolic profile and antioxidant activity of the edible tree peony flower and underlying mechanisms of preventive effect on H2O2-induced oxidative damage in Caco-2 cells[J].Foods,2019,8(10):471.
[34]HANSAKUL P,AREE K,TANUCHIT S,et al.Growth arrest and apoptosis via caspase activation of dioscoreanone in human non-small-cell lung cancer A549 cells[J].BMC Complementary and Alternative Medicine,2014,14(1):1-12.
[35]TAPIERO H,TEW K D,BA G N,et al.Polyphenols:Do they play a role in the prevention of human pathologies?[J].Biomedicine & Pharmacotherapy,2002,56(4):200-207.
[36]SADEGHI EKBATAN S,LI X Q,GHORBANI M,et al.Chlorogenic acid and its microbial metabolites exert anti-proliferative effects,S-phase cell-cycle arrest and apoptosis in human colon cancer Caco-2 cells[J].International Journal of Molecular Sciences,2018,19(3):723.
[37]ZAKŁOS-SZYDA M,PAWLIK N,POLKA D,et al.Viburnum opulus fruit phenolic compounds as cytoprotective agents able to decrease free fatty acids and glucose uptake by Caco-2 cells[J].Antioxidants,2019,8(8):262.
[38]ZHANG Q,LUNA-VITAL D,DE MEJIA E G.Anthocyanins from colored maize ameliorated the inflammatory paracrine interplay between macrophages and adipocytes through regulation of NF-κB and JNK-dependent MAPK pathways[J].Journal of Functional Foods,2019,54:175-186.
[39]ONTAWONG A,DUANGJAI A,MUANPRASAT C,et al.Lipid-lowering effects of Coffea arabica pulp aqueous extract in Caco-2 cells and hypercholesterolemic rats[J].Phytomedicine,2019,52:187-197.
[40]WANG F,ZHANG Y,YU T,et al.Oat globulin peptides regulate antidiabetic drug targets and glucose transporters in Caco-2 cells [J].Journal of Functional Foods,2018,42:12-20.
[41]KAMILOGLU S,GROOTAERT C,CAPANOGLU E,et al.Anti-inflammatory potential of black carrot(Daucus carota L.) polyphenols in a co-culture model of intestinal Caco-2 and endothelial EA.hy926 cells [J].Molecular Nutrition & Food Research,2017,61(2):1600455.
[42]NIETO J A,JAIME L,ARRANZ E,et al.Winemaking by-products as anti-inflammatory food ingredients[J].Food and Agricultural Immunology,2017,28(6):1507-1518.
[43]RODRÍGUEZ-RAMIRO I,RAMOS S,LÓPEZ-OLIVA E,et al.Cocoa polyphenols prevent inflammation in the colon of azoxymethane-treated rats and in TNF-α-stimulated Caco-2 cells[J].British Journal of Nutrition,2013,110(2):206-215.
[44]WU H,LUO T,LI Y M,et al.Granny Smith apple procyanidin extract upregulates tight junction protein expression and modulates oxidative stress and inflammation in lipopolysaccharide-induced Caco-2 cells[J].Food & Function,2018,9(6):3321-3329.
[45]PRAENGAM K,MUANGNOI C,CHAROENKIATKUL S,et al.Antioxidant and anti-inflammatory activity of aqueous fraction from Albizia lebbeck leaves[J].International Food Research Journal,2017,24(3):1174-1185.
[46]XU J,MOJSOSKA B.The immunomodulation effect of Aronia extract lacks association with its antioxidant anthocyanins [J].Journal of Medicinal Food,2013,16(4):334-342.
[47]GUINA T,DEIANA M,CALFAPIETRA S,et al.The role of p38 MAPK in the induction of intestinal inflammation by dietary oxysterols:Modulation by wine phenolics[J].Food & Function,2015,6(4):1218-1228.
[48]DENIS M C,DESJARDINS Y,FURTOS A,et al.Prevention of oxidative stress,inflammation and mitochondrial dysfunction in the intestine by different cranberry phenolic fractions [J].Clinical Science,2015,128(3):197-212.
[49]AN J,LIU J,LIANG Y,et al.Characterization,bioavailability and protective effects of phenolic-rich extracts from almond hulls against pro-oxidant induced toxicity in Caco-2 cells[J].Food Chemistry,2020,322:126742.
[50]QUERO J,JIMÉNEZ-MORENO N,ESPARZA I,et al.Grape stem extracts with potential anticancer and antioxidant properties[J].Antioxidants,2021,10(2):243.
[51]SKAŁA E,SITAREK P,TOMA M,et al.Inhibition of human glioma cell proliferation by altered Bax/Bcl-2-p53 expression and apoptosis induction by Rhaponticum carthamoides extracts from transformed and normal roots[J].Journal of Pharmacy and Pharmacology,2016,68(11):1454-1464.
[52]ALNAQDY A,AL-JABRI A,AL MAHROOQI Z,et al.Inhibition effect of honey on the adherence of Salmonella to intestinal epithelial cells in vitro[J].International Journal of Food Microbiology,2005,103(3):347-351.
[53]SHALOM J,COCK I E.Terminalia ferdinandiana Exell.fruit and leaf extracts inhibit proliferation and induce apoptosis in selected human cancer cell lines[J].Nutrition and Cancer,2018,70(4):1-15.
[54]MAO C,YU Z,LI C,et al.The functional properties of preserved eggs:From anti-cancer and anti-inflammatory aspects[J].Korean Journal for Food Science of Animal Resources,2018,38(3):615-628.
[55]GUO W,SHU Y,YANG X.Tea dietary fiber improves serum and hepatic lipid profiles in mice fed a high cholesterol diet[J].Plant Foods for Human Nutrition,2016,71(2):145-150.
[56]GRASSO S,HARRISON S M,MONAHAN F J,et al.The effect of plant sterol-enriched turkey meat on cholesterol bio-accessibility during in vitro digestion and Caco-2 cell uptake[J].International Journal of Food Sciences and Nutrition,2018,69(2):176-182.
[57]ARANTES A A,FALÉ P L,COSTA L C B,et al.Inhibition of HMG-CoA reductase activity and cholesterol permeation through Caco-2 cells by caffeoylquinic acids from Vernonia condensata leaves[J].Revista Brasileira de Farmacognosia,2016,26(6):738-743.
[58]LIN S T,TU S H,YANG P S,et al.Apple polyphenol phloretin inhibits colorectal cancer cell growth via inhibition of the type 2 glucose transporter and activation of p53-mediated signaling[J].Journal of Agricultural and Food Chemistry,2016,64(36):6826-6837.
[59]MARTINEZ-SAEZ N,HOCHKOGLER C M,SOMOZA V,et al.Biscuits with no added sugar containing stevia,coffee fibre and fructooligosaccharides modifies α-glucosidase activity and the release of GLP-1 from HuTu-80 cells and serotonin from Caco-2 cells after in vitro digestion [J].Nutrients,2017,9(7):694.
[60]AYYASH M,AL-DHAHERI A S,AL MAHADIN S,et al.In vitro investigation of anticancer,antihypertensive,antidiabetic,and antioxidant activities of camel milk fermented with camel milk probiotic:A comparative study with fermented bovine milk[J].Journal of Dairy Science,2018,101(2):900-911.
[61]杨芳,金永国,蔡朝霞,等.Caco-2 细胞体外吸收模型的建立、评价及其在营养素吸收研究中的应用[C]//第九届中国蛋品科技大会.中国畜产品加工研究会,2010.
YANG F,JIN Y G,CAI C X,et al.Establishment,assessment and application to nutrient absorption of Caco-2 cell in vitro absorption model[C]//The 9th China Egg Technology Conference.The China Animal Products Processing Research Association,2010.
[62]MAN Y,XU T,ADHIKARI B,et al.Iron supplementation and iron-fortified foods:A review[J].Critical Reviews in Food Science and Nutrition,2022,62(16):4504-4525.
[63]ROUSSEAU S,CELUS M,DUIJSENS D,et al.The impact of postharvest storage and cooking time on mineral bioaccessibility in common beans[J].Food& Function,2020,11(9):7584-7595.
[64]PENG Y,XI J,SUN Y,et al.Tea components influencing bioavailability of fluoride and potential transport mechanism in the Caco-2 cell line model[J].International Journal of Food Science & Technology,2020,55(4):1792-1799.
[65]KAKKAR V,SINGH S,SINGLA D,et al.Exploring solid lipid nanoparticles to enhance the oral bioavailability of curcumin[J].Molecular Nutrition &Food Research,2011,55(3):495-503.
[66]ZHOU H,ZHENG B,ZHANG Z,et al.Fortification of plant-based milk with calcium may reduce vitamin D bioaccessibility:An in vitro digestion study[J].Journal of Agricultural and Food Chemistry,2021,69(14):4223-4233.
[67]JOKIOJA J,YANG B,LINDERBORG K M.Acylated anthocyanins:A review on their bioavailability and effects on postprandial carbohydrate metabolism and inflammation[J].Comprehensive Reviews in Food Science and Food Safety,2021,20(6):5570-5615.
[68]XIE N,LIU S,WANG C,et al.Stability of casein antioxidant peptide fractions during in vitro digestion/Caco-2 cell model:Characteristics of the resistant peptides[J].European Food Research and Technology,2014,239(4):577-586.
[69]BASILICATA M G,PEPE G,ADESSO S,et al.Antioxidant properties of buffalo-milk dairy products:A β-Lg peptide released after gastrointestinal digestion of buffalo ricotta cheese reduces oxidative stress in intestinal epithelial cells[J].International Journal of Molecular Sciences,2018,19(7):1955.
[70]SUN H,CHOW E C Y,LIU S,et al.The Caco-2 cell monolayer:Usefulness and limitations[J].Expert Opinion on Drug Metabolism & Toxicology,2008,4(4):395-411.
[71]程珍珍,周本宏,姜姗,等.没食子酸在Caco-2 细胞模型中的吸收转运研究[J].中国药理学通报,2020,36(8):1183-1184.
CHENG Z Z,ZHOU B H,JIANG S,et al.Absorption and transport of gallic acid in Caco-2 cell model[J].Chinese Pharmacological Bulletin 2020,36(8):1183-1184.
[72]CHEN C,LI T,CHEN Z,et al.Absorption rates and mechanisms of avenanthramides in a Caco-2 cell model and their antioxidant activity during absorption[J].Journal of Agricultural and Food Chemistry,2020,68(8):2347-2356.
[73]孟杰,苏瑞,廖赟,等.钩藤碱在Caco-2 细胞模型中吸收规律研究[J].安徽中医药大学学报,2020,39(5):60-65.
MENG J,SU R,LIAO Y,et al.Absorption mechanism of rhynchophylline in the Caco-2 cell model[J].Journal of Anhui Traditional Chinese Medical College,2020,39(5):60-65.
[74]PERFECTO A,RODRIGUEZ-RAMIRO I,RODRIGUEZ-CELMA J,et al.Pea ferritin stability under gastric pH conditions determines the mechanism of iron uptake in Caco-2 cells[J].The Journal of Nutrition,2018,148(8):1229-1235.
[75]INABA M,MUROTA K,NIKAWADORI M,et al.Extracellular metabolism-dependent uptake of lysolipids through cultured monolayer of differentiated Caco-2 cells [J].Biochimica et Biophysica Acta(BBA)-Molecular and Cell Biology of Lipids,2014,1841(1):121-131.
[76]KERN S M,BENNETT R N,NEEDS P W,et al.Characterization of metabolites of hydroxycinnamates in the in vitro model of human small intestinal epithelium Caco-2 cells[J].Journal of Agricultural and Food Chemistry,2003,51(27):7884-7891.
[77]LAURENT C,BESANÇON P,CAPORICCIO B.Flavonoids from a grape seed extract interact with digestive secretions and intestinal cells as assessed in an in vitro digestion/Caco-2 cell culture model[J].Food Chemistry,2007,100(4):1704-1712.
[78]NISHIMURA M,NAITO S.Tissue-specific mRNA expression profiles of human phase I metabolizing enzymes except for cytochrome P450 and phase II metabolizing enzymes[J].Drug Metabolism and Pharmacokinetics,2006,21(5):357-374.
[79]UNGELL A L B.Caco-2 replace or refine?[J].Drug Discovery Today:Technologies,2004,1(4):423-430.
[80]REBOUL E,BOREL P.Proteins involved in uptake,intracellular transport and basolateral secretion of fat-soluble vitamins and carotenoids by mammalian enterocytes[J].Progress in Lipid Research,2011,50(4):388-402.
[81]DURING A,HARRISON E H.An in vitro model to study the intestinal absorption of carotenoids[J].Food Research International,2005,38(8/9):1001-1008.
[82]LIANG E,CHESSIC K,YAZDANIAN M.Evaluation of an accelerated Caco-2 cell permeability model[J].Journal of Pharmaceutical Sciences,2000,89(3):336-345.
[83]SEITHEL A,KARLSSON J,HILGENDORF C,et al.Variability in mRNA expression of ABC-and SLC-transporters in human intestinal cells:Comparison between human segments and Caco-2 cells[J].European Journal of Pharmaceutical Sciences,2006,28(4):291-299.
[84]HUA F,SHI M,ZHU X,et al.Transport and uptake of clausenamide enantiomers in CYP3A4-transfected Caco-2 cells:An insight into the effluxmetabolism alliance[J].Biochemical Pharmacology,2015,98(1):224-230.
[85]TAKENAKA T,KAZUKI K,HARADA N,et al.Development of Caco-2 cells co-expressing CYP3A4 and NADPH-cytochrome P450 reductase using a human artificial chromosome for the prediction of intestinal extraction ratio of CYP3A4 substrates[J].Drug Metabolism and Pharmacokinetics,2017,32(1):61-68.
[86]XIE J,YU R,QI J,et al.Pectin and inulin stimulated the mucus formation at a similar level:An omics-based comparative analysis[J].Journal of Food Science,2020,85(6):1939-1947.
[87]WANG F,YANG Y,JU X,et al.Polyelectrolyte complex nanoparticles from chitosan and acylated rapeseed cruciferin protein for curcumin delivery[J].Journal of Agricultural and Food Chemistry,2018,66(11):2685-2693.
[88]LI P,NIELSEN H M,MÜLLERTZ A.Impact of lipid-based drug delivery systems on the transport and uptake of insulin across Caco-2 cell monolayers[J].Journal of Pharmaceutical Sciences,2016,105(9):2743-2751.
[89]AN M J,CHEON J H,KIM S W,et al.Bovine colostrum inhibits nuclear factor κB-mediated proinflammatory cytokine expression in intestinal epithelial cells[J].Nutrition Research,2009,29(4):275-280.
[90]DE GREGORIO V,IMPARATO G,URCIUOLO F,et al.3D stromal tissue equivalent affects intestinal epithelium morphogenesis in vitro[J].Biotechnology and Bioengineering,2018,115(4):1062-1075.
[91]KANG T H,KIM H J.Farewell to animal testing:Innovations on human intestinal microphysiological systems[J].Micromachines,2016,7(7):107.