小肠结肠炎耶尔森氏菌(Yersinia enterocolitica,Y.enterocolitica)是一种分布广泛的革兰氏阴性无芽孢杆菌,存在于蔬菜、乳制品、肉类、豆制品和沙拉等食品中。因其能在4 ℃的低温下生长繁殖,故该菌在速冻水饺、冷冻熟食等多种食品中常被检出,成为食物冷藏、储运中的微生物安全隐患[1]。小肠结肠炎耶尔森氏菌是导致人类胃肠道疾病的重要食源性病原体,其典型感染症状为胃肠炎、发热,亦可引起阑尾炎、反应性关节炎、败血症等多种并发症[2]。小肠结肠炎耶尔森氏菌引起的耶尔森氏菌病,是全世界最受关注的食源性疾病之一,在2018 年,欧盟确诊病例高达6 699 例,据美国疾病控制与预防中心估计,在美国,由该菌引起的疾病每年约11.7 万例,导致640 人住院,35 人死亡[3-4]。由此可见,预防和控制小肠结肠炎耶尔森氏菌,对于各国的公共健康卫生都具有重要的意义。
随着现代食品工业的发展和生活水平的提高,人们对食品的安全性、卫生性和营养性的要求越来越高。然而,传统的热杀菌工艺极易造成产品风味劣变,营养大量损失等诸多食品品质问题[5-6]。另外,化学防腐剂是目前使用最多的食品防腐剂,然而,其用量超过一定限度后,会给人们的健康带来极大的危害[7-8]。寻找安全、低成本、对食品感官影响小的方法来控制小肠结肠炎耶尔森氏菌的污染显得尤为重要。
近年来,许多来自动物、植物和微生物的天然化合物的抗菌特性受到广泛关注。辅酶Q0(2,3-二甲氧基-5-甲基-1,4 对苯醌,图1)是一种发现于真菌牛樟芝中的还原性天然化合物,具有抗肿瘤、抗炎、抗氧化等多种生物活性[9-11]。研究表明,辅酶Q0 能够清除单增李斯特菌在3 种材料表面形成的生物被膜,并能抑制其对Caco-2 细胞的黏附和侵袭[12]。此外,Zhao 等[13]发现乳酸链球菌素和辅酶Q0 的组合可以表现出对金黄色葡萄球菌的抑制作用。尽管人们研究了辅酶Q0 对部分细菌的抑制效果,然而,辅酶Q0 对小肠结肠炎耶尔森氏菌的抑制作用及可能的抑菌机理还鲜有报道。

图1 辅酶Q0 结构
Fig.1 The structure of coenzyme Q0
基于以上问题,本研究以小肠结肠炎耶尔森氏菌为研究对象,通过测定辅酶Q0 对小肠结肠炎耶尔森氏菌ATCC 23715 的MIC 和MBC、生长曲线的影响,以及辅酶Q0 对LB 肉汤中菌体的抑杀作用,评价其抑菌效果。通过测定辅酶Q0 对细菌膜电位、胞内ATP 浓度、细胞膜完整性以及菌体细胞形态的影响,探究其对菌体细胞膜的影响。本研究旨在为辅酶Q0 应用于食品生产加工过程中有效控制小肠结肠炎耶尔森氏菌奠定理论基础。
1 材料与方法
1.1 菌株、细胞及试剂
小肠结肠炎耶尔森氏菌ATCC 23715 购于美国模式培养物寄存库(American type culture collection,ATCC)。辅酶Q0(色谱纯级,纯度99%),北京百灵威科技有限公司;氯化钠、氯化钾、磷酸二氢钾、二甲基亚砜(Dimethyl sulfoxide,DMSO),天津市科密欧化学试剂有限公司;LB 琼脂(Luriabertani agar)、LB 肉汤(Luria-bertani broth),北京陆桥技术有限公司;ATP 检测试剂盒,上海碧云天生物技术公司;荧光探针DiBAC4(3),美国Sigma公司;LIVE/DEAD BacLightTM 细菌活性检测试剂盒,赛默飞世尔科技公司;其它所用有机溶剂均为国产分析纯级。
BacLightTM 细菌活性检测试剂盒,赛默飞世尔科技公司;其它所用有机溶剂均为国产分析纯级。
1.2 仪器与设备
YT-CJ-LND 型超净工作台,北京亚泰科隆仪器技术有限公司;Model 680 酶标仪,美国BIORAD 公司;Victor X3 多功能酶标仪,美国PE 公司;5840R 高速冷冻离心机,德国Eppendorf 公司;SmartSpecTM Plus 分光光度计,美国Bio-Rad 公司;微生物全自动生长曲线分析仪,芬兰Bioscreen公司;A1 激光共聚焦显微镜,日本Nikon 公司;S-4800 型场发射扫描电镜,日本Hitachi 公司。
1.3 试验方法
1.3.1 菌种活化 将冻存于-80 ℃冰箱中的小肠结肠炎耶尔森氏菌ATCC 23715 在37 ℃条件下置于在LB 琼脂平板上进行菌种活化,随后挑取单菌落接种于30 mL LB 肉汤中,置于25 ℃条件下180 r/min 摇床培养18 h 使细菌处于对数生长期,将培养后的菌液在4 ℃、转速为8 000×g 的条件下离心5 min,去除上清液,用磷酸盐缓冲液(Phosphate buffered saline,PBS)洗涤菌体,重复洗涤2次后,用所需溶液对菌体进行重悬浮,测定并调整菌悬液在波长600 nm 下的吸光度值(OD600nm)为0.5,此时菌液浓度约为8×108 CFU/mL。
1.3.2 最小抑菌浓度(MIC)和最小杀菌浓度(MBC)的测定 辅酶Q0 对小肠结肠炎耶尔森氏菌最小抑菌浓度的测定采用液体稀释法[14]。按照1.3.1 节中的方法培养活化小肠结肠炎耶尔森氏菌并制备菌悬液,用LB 肉汤稀释1 600 倍(此时菌悬液浓度约为5×105 CFU/mL)。其次,利用LB肉汤对用1%(体积分数,下同)DMSO 溶解的辅酶Q0 进行梯度稀释,向其中各加入菌悬液,使辅酶Q0 的 终 质 量 浓 度 为0.20,0.10,0.05,0.025,0.0125,0.00625,0.003125,0.0015625 mg/mL,充分吹打混匀。各吸取200 μL 加于96 孔板中,加样结束后,检测各孔对应的OD600nm。随后,将样品放置于37 ℃恒温培养箱中培养24 h 后再次检测OD600nm,若两次之差小于0.05,则认为该浓度能够抑制细菌生长,即为辅酶Q0 的MIC。试验设置不含辅酶Q0 的菌悬液为对照组,含0.5% DMSO 的LB 肉汤为空白对照组。将辅酶Q0 质量浓度为MIC 和高于MIC 的样液进行涂布,并放置在25℃的培养箱中培养48 h,然后观察是否有菌落。无菌落出现的最小质量浓度即为辅酶Q0 的MBC。
1.3.3 辅酶Q0 对小肠结肠炎耶尔森氏菌ATCC 23715 生长曲线的影响 辅酶Q0 对小肠结肠炎耶尔森氏菌ATCC 23715 生长曲线的影响的测定根据Shu 等[15]的方法,按照上述1.3.1 节中的方法培养、活化小肠结肠炎耶尔森氏菌ATCC 23715并制备菌悬液。使用LB 肉汤将菌悬液稀释至1×106 CFU/mL 后备用。于离心管中使用LB 肉汤对1% DMSO 溶解的辅酶Q0 进行梯度稀释,并分别向其中加入等体积菌悬液后涡旋混匀,使离心管中辅酶Q0 终质量浓度分别为MIC、1/2 MIC、1/4 MIC、1/8 MIC。同时,试验设置不添加辅酶Q0 的菌悬液作为对照组以及含0.5% DMSO 的LB 肉汤作为空白对照组。向蜂窝板每孔中加入250 μL不同浓度辅酶Q0 与菌悬液的混合溶液后,将其置于微生物全自动生长曲线分析仪中于25 ℃下培养,并于48 h 内每隔1 h 测定各孔样品的OD600nm,绘制生长曲线。
1.3.4 辅酶Q0 对小肠结肠炎耶尔森氏菌ATCC 23715 在LB 介质中的抑杀作用 采用1.3.1 节所示方法活化菌株。根据石超等[16]的方法,将菌液用LB 肉汤稀释至菌浓度为1×108 CFU/mL,其次将辅酶Q0 加入到200 μL DMSO 中混合备用。分别向离心管中加入10 mL LB 肉汤和100 μL 菌液,调整辅酶Q0 的质量浓度,至终质量浓度为0、1/2 MIC、MIC 和2 MIC 充分吹打并混匀,将不含辅酶Q0 的样品设置为对照组。然后置于25 ℃培养箱中恒温培养,分别在0,1,3,6,9,12 h 时取样,直接或用PBS 溶液进行等倍稀释后涂布于LB 平板培养基上,于37 ℃恒温培养24 h 后记录菌落的总数。
1.3.5 辅酶Q0 对小肠结肠炎耶尔森氏菌ATCC 23715 膜电位的影响 参照石超等[17]的方法,借助DiBAC4(3)阴离子荧光染料测定辅酶Q0 对小肠结肠炎耶尔森氏菌ATCC 23715 膜电位的影响。按照上述1.3.1 节中的方法制得菌悬液,吸取125 μL 加于黑色酶标板中,25 ℃培养箱中培养30 min。随后,每孔加入3 μL 1 μmol/L 阴离子荧光染料DiBAC4(3),25 ℃培养30 min。最后,将125 μL辅酶Q0 溶液加入黑色酶标板各孔中,使辅酶Q0的终质量浓度分别为0、MIC 和2 MIC。测定激发波长和发射波长分别为492 nm 和515 nm 处的荧光强度。根据荧光强度判断细胞静息电位状态,若荧光强度降低,表明细胞膜超极化;反之,表明细胞膜去极化。
1.3.6 辅酶Q0 对小肠结肠炎耶尔森氏菌ATCC 23715 细胞内ATP 浓度的影响 小肠结肠炎耶尔森氏菌细胞内ATP 浓度变化的测定参考Shi 等[18]的方法,并稍作修改。使样品中辅酶Q0 的终质量浓度分别为0、MIC、2 MIC,空白对照组添加PBS及3 种质量浓度的辅酶Q0 溶液。将样品放入25℃培养箱培养30 min 后取出,放入冰浴中保存,逐个进行超声波细胞裂解。裂解结束后,立即置于100 ℃下处理3 min 以使样品中的ATP 酶失去活性。将菌液离心(5 000×g,4 ℃,5 min),吸出上清液,上清液使用冰浴保存。将上清液和配制好的ATP 检测试剂各100 μL 加入白色酶标板中,使用多功能酶标仪测定上清液化学发光强度。配置终浓度分别为0.01,0.1,1,10 μmol/L 的ATP标准液,测得各浓度ATP 标准液荧光强度,绘制ATP工作曲线,根据工作曲线计算细胞内ATP 的浓度。
1.3.7 辅酶Q0 对小肠结肠炎耶尔森氏菌ATCC 23715 细胞膜完整性的影响 用激光共聚焦扫描显微镜观察辅酶Q0 对小肠结肠炎耶尔森氏菌ATCC 23715 细胞膜完整性的影响,参照郭都等[19]的方法并进行一定的修改。首先按照1.3.1 节的方法对菌种进行活化培养,随后用8.5 mg/mL 的无菌NaCl 溶液对菌体进行洗涤与重悬浮处理,调整菌悬液的OD600nm 为0.5。在25 ℃条件下,分别使用0、1/2 MIC、MIC、2 MIC 质量浓度的辅酶Q0 处理菌体30 min 后,在避光条件下将按照1∶1 比例混合的碘化丙啶(Propidium iodide,PI)、SYTO 9 染料加入以上菌液中孵育5 min。取3 μL 染后菌液滴在载玻片上,盖上盖玻片置于激光共聚焦扫描显微镜下观察拍照,并进行分析。
1.3.8 辅酶Q0 对小肠结肠炎耶尔森氏菌ATCC 23715 细胞形态的影响 参照石超等[17]的方法,利用场发射扫描电子显微镜观察辅酶Q0 对小肠结肠炎耶尔森氏菌细胞形态的影响。按照1.3.1 节的方法制备菌悬液,添加不同浓度辅酶Q0(0、MIC和2 MIC)的菌悬液置于25 ℃培养箱培养,分别在2 h 和4 h 取出,使用PBS 溶液洗涤菌体两次。向离心管中加入2.5%戊二醛溶液固定洗涤后的菌体,于4 ℃条件保存过夜。依次使用PBS、无菌水清洗菌体,离心(5 000×g、5 min、4 ℃),弃去上清液。再次用2.5%的戊二醛溶液固定菌体,于4 ℃条件放置5 h。再次固定完成后,离心(5 000×g、5 min、4 ℃),弃去上清液,分别用体积分数为30%,50%,70%,80%,90%,100%的乙醇洗脱10 min,用100%的乙醇重悬浮。将5 μL 的样品滴于载玻片上,并贴附于场发射扫描电子显微镜载物台上。观察小肠结肠炎耶尔森氏菌细胞形态。
1.4 数据分析
通过SPSS 20.0 软件对所得数据进行统计分析,并采用Duncan 法分析多组间差异显著性,P<0.05 为显著,P<0.01 则为极显著。数据结果以(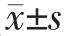 )表示。
)表示。
2 结果与分析
2.1 辅酶Q0 对小肠结肠炎耶尔森氏菌ATCC 23715 的最小抑菌浓度和最小杀菌浓度
试验选取标准菌株ATCC 23715 作为试验菌株,检测试验结果为辅酶Q0 对小肠结肠炎耶尔森氏菌ATCC 23715 的MIC 和MBC 均为0.10 mg/mL,表明辅酶Q0 对小肠结肠炎耶尔森氏菌ATCC 23715 具有良好的抑制作用。
2.2 辅酶Q0 作用下小肠结肠炎耶尔森氏菌ATCC 23715 的生长曲线
由图2 可知,辅酶Q0 能够明显降低小肠结肠炎耶尔森氏菌ATCC 23715 的生长速率及最大菌体浓度。当辅酶Q0 的质量浓度为MIC 时,小肠结肠炎耶尔森氏菌的生长被完全抑制。质量浓度为1/2 MIC 的辅酶Q0 虽没有完全抑制小肠结肠炎耶尔森氏菌的生长,但与对照组相比,其延滞期增长。1/4 MIC、1/8 MIC 辅酶Q0 处理的小肠结肠炎耶尔森氏菌的生长曲线与对照组较为相近,菌体浓度随辅酶Q0 升高而减小。由此说明,辅酶Q0对小肠结肠炎耶尔森氏菌生长的抑制作用呈现质量浓度依赖性。
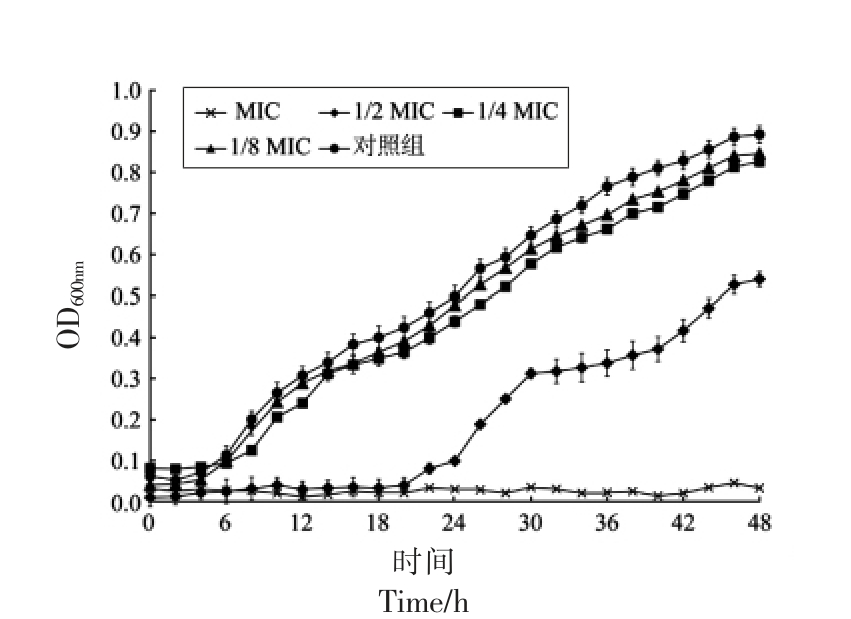
图2 小肠结肠炎耶尔森氏菌ATCC 23715 在含有不同质量浓度辅酶Q0 的LB 介质中的生长曲线
Fig.2 Growth curves of Y.enterocolitica ATCC 23715 cultured in LB medium with various mass concentrations of coenzyme Q0
2.3 辅酶Q0 对小肠结肠炎耶尔森氏菌ATCC 23715 在LB 介质中的抑杀作用
小肠结肠炎耶尔森氏菌在含有不同质量浓度辅酶Q0 的LB 介质中的抑杀作用如图3 所示。对照组菌体数量在LB 介质中呈持续增长趋势,12 h后细菌数量增加至(9.00±0.17)lg(CFU/mL)。与对照组相比,质量浓度为1/2 MIC 的辅酶Q0 能明显抑制小肠结肠炎耶尔森氏菌的生长,且细菌数量几乎维持9 h 不变。质量浓度为MIC 和2 MIC的辅酶Q0 能明显抑杀小肠结肠炎耶尔森氏菌,质量浓度为MIC 的处理组在6 h 后菌量降至检出限(1 CFU/mL)以下,质量浓度为2 MIC 组在3 h 后菌量降至检出限以下。
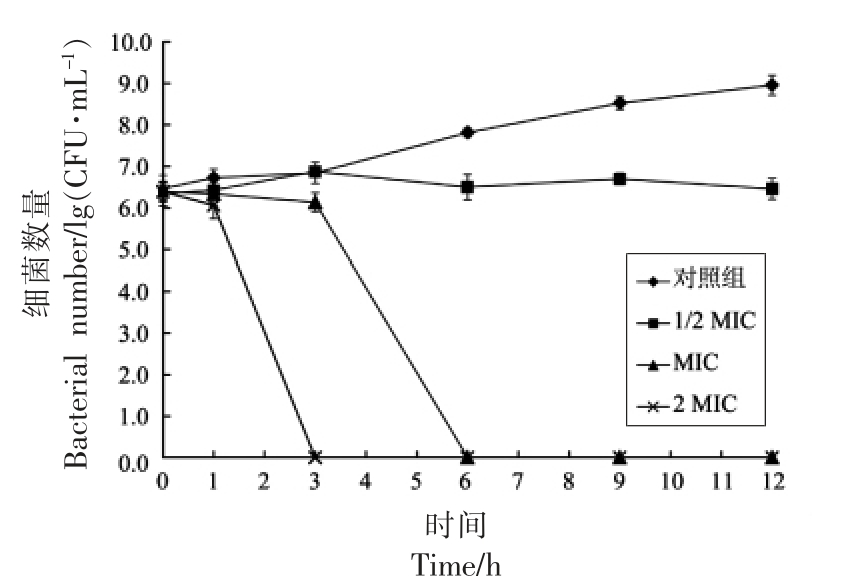
图3 辅酶Q0 对小肠结肠炎耶尔森氏菌ATCC 23715 在LB 介质中的抑杀作用
Fig.3 Inhibitory effect of coenzyme Q0 on Y.enterocolitica ATCC 23715 in LB medium
2.4 辅酶Q0 对小肠结肠炎耶尔森氏菌ATCC 23715 膜电位的影响
DiBAC4(3)是一种指示膜电位变化的亲脂性阴离子荧光染料,本身无荧光,进入细胞与胞浆蛋白结合后发出荧光。DiBAC4(3)进入细胞后,荧光强度增加,表明细胞膜去极化;反之,表明细胞膜超极化。由图4 可得,用辅酶Q0 处理的小肠结肠炎耶尔森氏菌ATCC 23715 细胞膜呈现出超极化现象,荧光强度极显著降低(P<0.01),且质量浓度为2 MIC 辅酶Q0 处理后的细胞超极化现象更加明显。
图4 辅酶Q0 对小肠结肠炎耶尔森氏菌ATCC 23715 膜电位的影响
Fig.4 Effect of coenzyme Q0 on membrane potentials of Y.enterocolitica ATCC 23715
注:**.与对照组相比差异极显著(P<0.01),下同。
2.5 辅酶Q0 对小肠结肠炎耶尔森氏菌ATCC 23715 细胞内ATP 浓度的影响
试验利用了ATP 水解产生能量使过量的荧光素在过量的荧光素酶催化下产生荧光,从而使荧光强度与菌体胞内ATP 的浓度成正比关系的原理。试验数据表明,ATP 浓度与相对荧光强度呈良好线性关系(y=40712x+1632.9;R2=0.9999),据此可以通过测量的荧光强度计算出细胞内ATP浓度。
由图5 可知,辅酶Q0 对小肠结肠炎耶尔森氏菌的细胞内ATP 浓度有极显著地降低作用(P <0.01)。在未经辅酶Q0 处理的对照组中,菌体细胞内ATP 浓度为(1.138±0.025)μmol/L。试验组中,质量浓度为MIC 的辅酶Q0 处理细胞后,细胞内ATP 浓度为(0.188±0.041)μmol/L;质量浓度为2 MIC 的辅酶Q0 处理细胞后,细胞内ATP 浓度为(0.054±0.002)μmol/L。
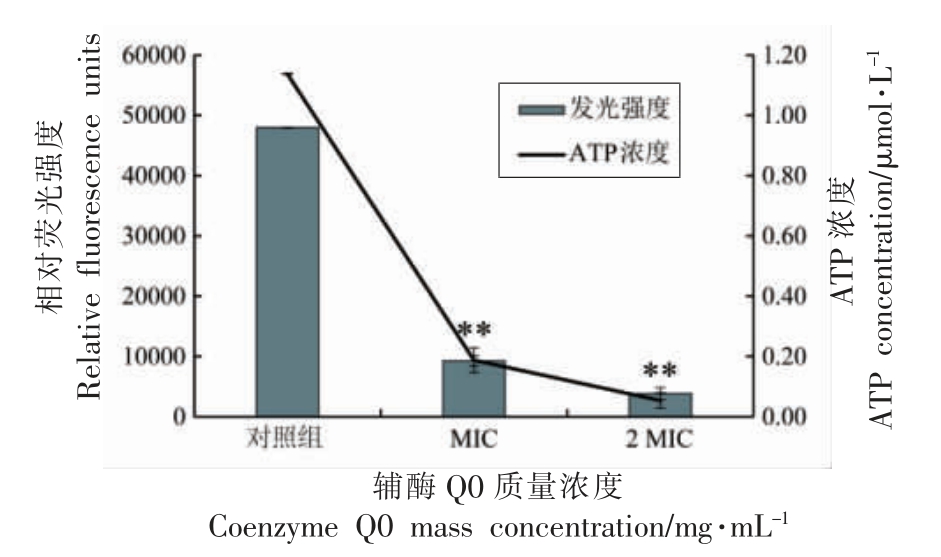
图5 辅酶Q0 对小肠结肠炎耶尔森氏菌ATCC 23715 细胞内ATP 浓度的影响
Fig.5 Effect of coenzyme Q0 on ATP concentration in Y.enterocolitica ATCC 23715 cells
2.6 辅酶Q0 对小肠结肠炎耶尔森氏菌ATCC 23715 细胞膜完整性的影响
利用LIVE/DEAD  BacLightTM 细菌活性试剂盒对小肠结肠炎耶尔森氏菌ATCC 23715 细胞膜的完整性进行定性研究。LIVE/DEAD
BacLightTM 细菌活性试剂盒对小肠结肠炎耶尔森氏菌ATCC 23715 细胞膜的完整性进行定性研究。LIVE/DEAD BacLightTM细菌活性试剂盒中含有SYTO 9 小分子染料和PI大分子染料。SYTO 9 染料能够穿透完整的细胞膜进入菌体细胞并与其核酸结合而呈现绿色荧光。PI 染料只能够进入细胞膜残缺的细胞中并与其核酸结合而让菌体呈现红色并覆盖绿色荧光,因此红色荧光与绿色荧光比例代表细胞膜受损的菌体与细胞膜完整菌体的比例。
BacLightTM细菌活性试剂盒中含有SYTO 9 小分子染料和PI大分子染料。SYTO 9 染料能够穿透完整的细胞膜进入菌体细胞并与其核酸结合而呈现绿色荧光。PI 染料只能够进入细胞膜残缺的细胞中并与其核酸结合而让菌体呈现红色并覆盖绿色荧光,因此红色荧光与绿色荧光比例代表细胞膜受损的菌体与细胞膜完整菌体的比例。
如图6 所示,25 ℃处理30 min 后,未经辅酶Q0 处理的菌体(图6a)几乎全部被SYTO 9 染色,说明细菌细胞膜完整;经质量浓度为MIC 的辅酶Q0 处理后(图6b),视野中菌体绝大多数呈现绿色荧光,小部分菌体呈现黄色荧光,表明在此质量浓度辅酶Q0 作用下,菌体细胞膜完整性下降;经质量浓度为2 MIC 辅酶Q0 处理后(图6c),视野中菌体黄色荧光比例上升并显现出一定比例的红色荧光,说明细胞膜完整性破坏程度增加;质量浓度为4 MIC 辅酶Q0 处理后(图6d),视野中的菌体绝大多数呈现红色荧光,说明细胞膜完整性几乎全部遭到破坏。

图6 激光共聚焦观察辅酶Q0 处理前、后小肠结肠炎耶尔森氏菌ATCC 23715 细胞膜的完整性(1 200×)
Fig.6 Membrane integrity of Y.enterocolitica ATCC 23715 before and after coenzyme Q0 treatment by confocal laser scanning microscope(1 200×)
2.7 辅酶Q0 对小肠结肠炎耶尔森氏菌ATCC 23715 细胞形态的影响
如图7 所示,未经辅酶Q0 处理(图7a、d)的小肠结肠炎耶尔森氏菌ATCC 23715 呈光滑饱满的杆状。与对照组相比,经质量浓度为MIC 的辅酶Q0 处理2 h 后(图7b),个别菌体出现皱缩现象。随着辅酶Q0 质量浓度增加至2 MIC(图7c),细菌表面凹陷且皱缩程度加剧。相比于处理2 h,辅酶Q0 处理4 h 后(图7e、f)细菌表面呈现出较明显的皱褶,细胞变形塌陷更为严重。因此,辅酶Q0 对小肠结肠炎耶尔森氏菌ATCC 23715 细胞形态有一定影响,并且细菌细胞形态变化呈时间和质量浓度依赖性。
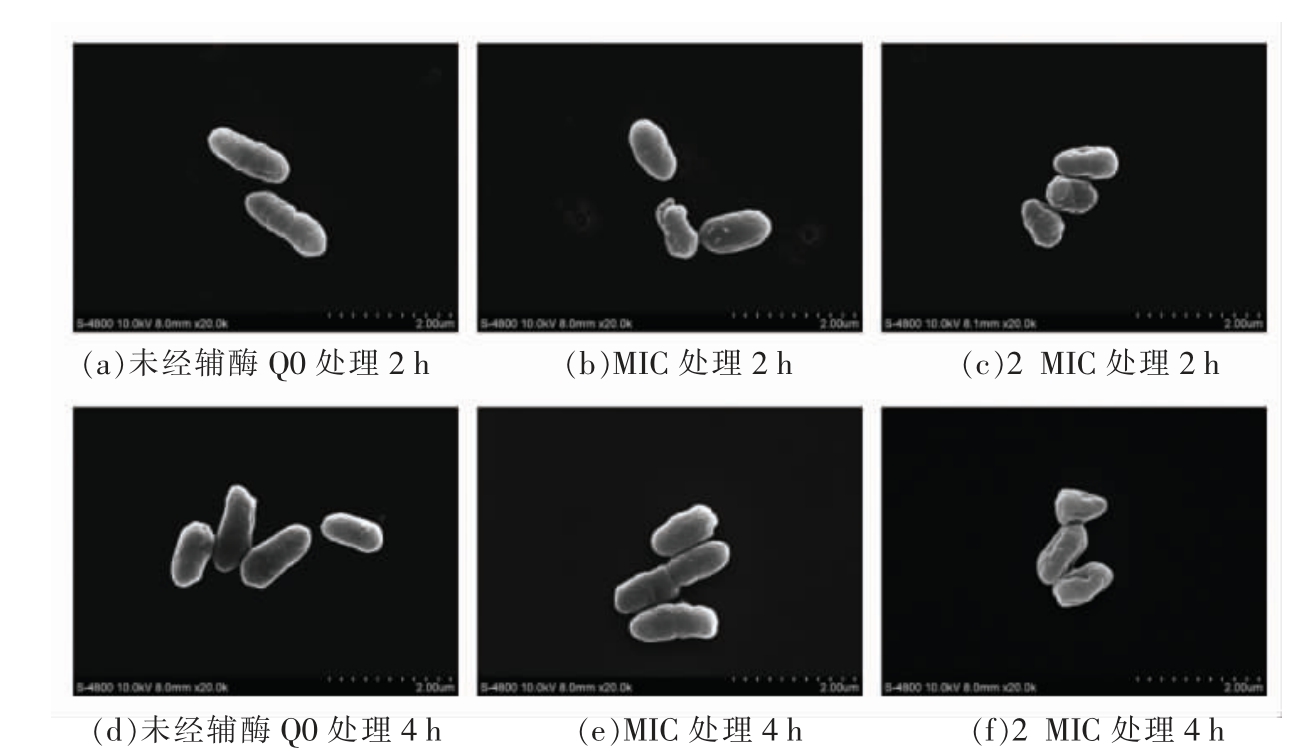
图7 场发射扫描电子显微镜观测辅酶Q0 对小肠结肠炎耶尔森氏菌ATCC 23715 细胞形态的影响(20 000×)
Fig.7 Effect of coenzyme Q0 on the cell morphology of Y.enterocolitica ATCC 23715 observed by field emission scanning electron microscope(20 000×)
3 讨论
本试验测定了辅酶Q0 对小肠结肠炎耶尔森氏菌ATCC 23715 的MIC 值为0.1 mg/mL,一些研究也报道了天然化合物对小肠结肠炎耶尔森氏菌有抑制效果,如Siddiqua 等[20]报道丁香油对小肠结肠炎耶尔森氏菌的MIC 为4.5 mg/mL,肉桂醛对小肠结肠炎耶尔森氏菌的MIC 为5 mg/mL,付宏杰[21]报道乳糖酸对小肠结肠炎耶尔森氏菌的MIC为2.5 mg/mL。因此,与其它天然化合物相比,辅酶Q0 对小肠结肠炎耶尔森氏菌具有更强的抗菌活性。
生长曲线分析显示,辅酶Q0 可以明显延长小肠结肠炎耶尔森氏菌的延滞期(图2)。与本研究结果类似,石超等[17]证明与对照组相比,浓度为1/2 MIC 的百里醌能够使阪崎克罗诺肠杆菌的生长延滞期延长6 h。Farha 等[22]报道(+)-诺卡酮能够明显降低金黄色葡萄球菌的生长速率,延长生长延滞期,并且其效果随(+)-诺卡酮浓度增加而增强。根据方太松等[23]的报道,菌体生长延滞期延长是由于受抑菌物质损伤的菌体存在修复过程,因此受损菌体的延滞期要比正常菌体的延滞期更长,而延滞期的长、短与不同浓度抑菌物质造成的细胞损伤程度有关。
辅酶Q0 对小肠结肠炎耶尔森氏菌的抑杀试验结果表明,当辅酶Q0 质量浓度等于MIC 时,在6 h 内可将LB 介质中的小肠结肠炎耶尔森氏菌浓度降低至检出限以下,因此,质量浓度为MIC 的辅酶Q0 即可达到杀灭所有菌体的效果(图3)。根据Kang 等[24]报道,在LB 介质中使用质量浓度为MIC 的没食子酸处理12 h 后,剩余活菌数量为处理前的60.65%。Lee 等[25]使用质量浓度为MIC 的苦参根正丁醇提取物处理聚核梭杆菌,细菌数量在前12 h 内明显下降后,于12~24 h 内小幅上升,说明质量浓度为MIC 的苦参根正丁醇提取物对菌体产生的损伤是可逆的,部分受损后的菌体可以自我修复并繁殖,因此该浓度下苦参根正丁醇提取物无法彻底杀菌。本研究表明质量浓度为MIC 的辅酶Q0 能够彻底抑杀菌体,产生不可逆的损伤,这与本试验得到的MIC 与MBC 数值相等的结论一致。
细胞静息膜电位是描述细胞生命活动的最重要的参数之一,与抑菌物质杀菌作用密切相关。DiBAC4(3)是一种指示膜电位变化的亲脂性阴离子荧光染料,随膜电位的变化进出细胞,维持膜内外电荷的动态平衡[26]。本研究结果表明,辅酶Q0使细胞膜显示超极化现象(图3)。Shi 等[27]也有类似的发现,阪崎克罗诺肠杆菌经浓度为MIC 的阿魏酸处理后,细菌膜电位呈现超极化现象,且质量浓度为2 MIC 的阿魏酸处理后,超极化现象更加明显;舒慧珍等[28]证明柠檬烯可使荧光假单胞菌的细胞膜显示超极化现象。Bot 等[29]表明,细胞膜出现超极化现象的原因有以下两点:其一为pH值的改变;其二为细胞膜上离子的运动受到影响,特别是K+,为保持电荷平衡,膜电位发生改变。
ATP 是细胞内最重要的供能分子,影响其各种生理过程。辅酶Q0 对小肠结肠炎耶尔森氏菌细胞内ATP 浓度影响的试验结果表明,在辅酶Q0作用下,细菌细胞内的ATP 浓度极显著降低(P<0.01)(图5)。崔海英等[30]的研究表明,经0.05%丁香精油作用1 h 后,单增李斯特菌细菌胞内ATP浓度降低了93.75%。Kang 等[31]还发现经质量浓度为0.5 mg/mL 和2 mg/mL 薄荷精油处理后,金黄色葡萄球菌的胞外ATP 浓度显著增加。辅酶Q0 作用时,细胞内ATP 水平下降,其原因可能有两方面:一是通过控制ATP 生成与消耗过程直接影响ATP 浓度,具体表现为天然活性物质作用下细菌细胞内ATP 的合成受到抑制或质子泵水解ATP速率增大,ATP 消耗加快[32]。二是天然活性物质增加了细胞膜的通透性,甚至导致细胞膜受到严重破坏,大量ATP 游离,导致胞内ATP 大量减少[33]。
为进一步探明辅酶Q0 对小肠结肠炎耶尔森氏菌的抑菌机理,本试验探究了辅酶Q0 对小肠结肠炎耶尔森氏菌ATCC 23715 细胞膜完整性的影响。结果表明,辅酶Q0 能显著破坏小肠结肠炎耶尔森氏菌细胞膜的完整性(图6)。类似地,Sun等[34]证明高浓度的花青素会导致单增李斯特菌细胞膜的局部损伤,细胞内容物向细胞外扩散。石超等[17]发现,与对照组相比,经百里醌处理的阪崎克罗诺肠杆菌细胞膜完整性极显著下降(P<0.01),经浓度为MIC 和2 MIC 的百里醌处理后,细胞膜的完整性分别降低了20%和78%。以上结果表明,辅酶Q0 对细胞膜完整性的破坏是引起辅酶Q0抑杀小肠结肠炎耶尔森氏菌的原因之一。
本研究结果表明,经辅酶Q0 作用后,小肠结肠炎耶尔森氏菌表面皱缩、菌体干瘪塌陷且形态变化呈时间和质量浓度依赖性(图7)。类似的研究也证实了天然活性物质对食源性致病菌细胞形态的影响。扫描电镜下对照组金黄色葡萄球菌表面光滑,然而经1.75 mg/mL 落叶松树皮原花青素(Larch bark proanthocyanidins,LBPC)处理12 h后,金黄色葡萄球菌表面呈现明显的囊泡或不规则突起。相同质量浓度LBPC 作用24 h 后,金黄色葡萄球菌被菌体中渗出的细胞质所包围[35]。Zhou等[36]的研究发现,牡丹花蕾提取物作用于大肠杆菌O157:H7 后,可使菌体表面塌陷,明显改变细胞的形态。此外,Zou 等[37]指出黑胡椒氯仿提取物对大肠杆菌和金黄色葡萄球菌细胞形态的影响可能与细胞膜通透性改变后低摩尔质量代谢物和其它成分的渗漏有关。因此,结合场发射扫描电镜所观察结果与上述膜电位、ATP 的研究结果推测,小肠结肠炎耶尔森氏菌经辅酶Q0 作用后细胞膜通透性和完整性发生改变使细胞内容物流出,从而使菌体表面皱褶、细胞干瘪。
4 结论
本研究结果表明辅酶Q0 对小肠结肠炎耶尔森氏菌具有良好的抑菌和杀菌作用,能够抑制其生长速率,同时能够改变细胞膜的完整性和通透性,表现为:破坏小肠结肠炎耶尔森氏菌菌体正常形态,破坏其细胞膜完整性,抑制胞内ATP 浓度,使其细胞膜超极化。综上所述,辅酶Q0 可以改变细胞膜的通透性和完整性从而达到抑杀小肠结肠炎耶尔森氏菌的目的,这为辅酶Q0 用于控制食品工业中小肠结肠炎耶尔森氏菌的污染提供了理论依据。
[1] 吴清平,胡惠娟,张菊梅.食源性小肠结肠炎耶尔森氏菌生物学特性和分子分型研究进展[J].食品科学技术学报,2014,32(4):1-7.
WU Q P,HU H J,ZHANG J M.Research progress on biological characteristics and molecular typing of food-borne Yersinia enterocolitis[J].Journal of Food Science and Technology,2014,32(4):1-7.
[2] 张宏伟,莎日娜,郑文杰,等.核酸试纸条法检测食品中小肠结肠炎耶尔森菌[J].食品研究与开发,2018,39(24):119-123.
ZHANG H W,SHA R N,ZHENG W J,et al.Detection of Yersinia enterocolitica in food by nucleic acid strip method[J].Food Research and Development,2018,39(24):119-123.
[3] KOLLER V,SEINIGE D,SAATHOFF J,et al.Impact of a combination of UV-C irradiation and peracetic acid spray treatment on Brochothrix thermosphacta and Yersinia enterocolitica contaminated pork[J].Foods,2021,10(2):204.
[4] DRAKE F N,DAVIS S,KHATIWADA J,et al.Identification and antimicrobial susceptibility of Yersinia enterocolitica found in chitterlings,raw milk and swine fecal samples[J].Advances in Microbiology,2018,8(10):804-820.
[5] 陈诗晴,王征征,姚思敏薇,等.不同杀菌方式对贮藏过程中猕猴桃低糖复合果酱品质的影响[J].食品工业科技,2018,39(5):53-58,64.
CHEN S Q,WANG Z Z,YAO S M W,et al.Effects of different sterilization methods on the quality of kiwi fruit low-sugar compound jam during storage[J].Food Industry Science and Technology,2018,39(5):53-58,64.
[6] 孔庆敏,孙波,赵晓,等.臭氧在东北酸菜杀菌工艺中的应用[J].食品科学,2016,37(12):71-75.
KONG Q M,SUN B,ZHAO X,et al.Application of ozone in the sterilization process of Northeast pickled cabbage[J].Food Science,2016,37(12):71-75.
[7] 李兴峰,刘豆,薛江超,等.天然食品防腐剂的协同抗菌作用[J].中国食品学报,2014,14(3):140-144.
LI X F,LIU D,XUE J C,et al.The synergistic effects of natural food preservatives against microorganisms[J].Journal of Chinese Institute of Food Science and Technology,2014,14(3):140-144.
[8] 杨连战,李言,钱海峰,等.植物源天然防腐剂应用及抑菌机理研究现状[J].食品与发酵工业,2021,47(1):303-308.
YANG L Z,LI Y,QIAN H F,et al.Research status of the application and antibacterial mechanism of natural preservatives from plants[J].Food and Fermentation Industry,2021,47(1):303-308.
[9] CHUANG C H,YEH S C,CHEN C J,et al.Coenzyme Q0 from Antrodia cinnamomea in submerged cultures induces reactive oxygen species-mediated apoptosis in A549 human lung cancer cells[J].Evidence -Based Complementray and Alternative Medicine,2014,2014:24678.
[10] HSEU Y C,TSAI T J,KORIVI M,et al.Antitumor properties of coenzyme Q0 against human ovarian carcinoma cells via induction of ROS-mediated apoptosis and cytoprotective autophagy[J].Scientific Reports,2017,59(1):77-86.
[11] YANG H L,LIN M W,KORIVI M,et al.Coenzyme Q0 regulates NFκB/AP-1 activation and enhances Nrf2 stabilization in attenuation of LPS-induced inflammation and redox imbalance:Evidence from in vitro and in vivo studies[J].Biochimica et Biophysica Acta,2015,1859(2):246-261.
[12] FAN Q X,ZHANG Y Y,YANG H,et al.Effect of coenzyme Q0 on biofilm formation and attachment-invasion efficiency of Listeria monocytogenes[J].Food Control,2018,90:274-281.
[13] ZHAO X C,LIU Z H,LI W L,et al.In vitro synergy of nisin and coenzyme Q0 against Staphylococcus aureus[J].Food Control,2014,46:368-373.
[14] CHEN H Q,ZHONG Q X.Lactobionic acid enhances the synergistic effect of nisin and thymol against Listeria monocytogenes Scott A in tryptic soy broth and milk[J].International Journal of Food Microbiology,2017,260:36-41.
[15] SHU Q,NIU Y W,ZHAO W J,et al.Antibacterial activity and mannosylerythritol lipids against vegetative cells and spores of Bacillus cereus[J].Food Control,2019,106:106711.
[16] 石超,郭都,张文婷,等.反式肉桂醛与温和加热结合对复原婴幼儿牛乳中阪崎克罗诺肠杆菌的抑杀作用[J].食品科学,2018,39(7):107-112.
SHI C,GUO D,ZHANG W T,et al.Inhibitor effect of trans-cinnamaldehyde combined with mild heating on the recovery of Enterobacter sakazakii in infant milk[J].Food Science,2018,39(7):107-112.
[17] 石超,孙慧慧,孙正,等.百里醌对阪崎克罗诺肠杆菌的抑制作用[J].食品科学,2018,39(1):59-68.
SHI C,SUN H H,SUN Z,et al.Inhibitory effect of thymoquinone on Enterobacter sakazakii[J].Food Science,2018,39(1):59-68.
[18] SHI C,SUN Y,ZHENG Z W,et al.Antimicrobial activity of syringic acid against Cronobacter sakazakii and its effect on cell membrane[J].Food Chemistry,2016,197:100-106.
[19] 郭都,孙慧慧,孙正,等.柠檬醛对副溶血性弧菌的抑制作用[J].食品科学,2019,40(17):113-120.
GUO D,SUN H H,SUN Z,et al.Inhibitory effect of citral on Vibrio parahaemolyticus[J].Food Science,2019,40(17):113-120.
[20] SIDDIQUA S,ANUSHA B A,ASHWINI L S,et al.Antibacterial activity of cinnamaldehyde and clove oil:Effect on selected foodborne pathogens in model food systems and watermelon juice[J].Journal of Food Science and Technology,2015,52(9):5834-5841.
[21] 付宏杰.乳糖酸抑菌性及其对小肠结肠炎耶尔森氏菌抑菌机理的研究[D].沈阳:沈阳农业大学,2018.
FU H J.Study on the bacteriostatic activity of lactose acid and its mechanism against Yersinia enterocolitica[D].Shenyang:Shenyang Agricultural University,2018.
[22] FARHA A K,YANG Q Q,KIM G,et al.Inhibition of multidrug-resistant foodborne Staphylococcus aureus biofilms by a natural terpenoid(+)-nootkatone and related molecular mechanism[J].Food Control,2020,112:107154.
[23] 方太松,吴瑜凡,石宁馨,等.食源性致病菌生长延滞期的研究进展[J].食品科学,2021,42(11):253-260.
FANG T S,WU Y F,SHI N X,et al.Research progress on growth delay of foodborne pathogenic bacteria[J].Food Science,2021,42(11):253-260.
[24] KANG J M,LIU L,LIU M H,et al.Antibacterial activity of gallic acid against Shigella flexneri and its effect on biofilm formation by repressing mdoH gene expression[J].Food Control,2018,94:147-154.
[25] LEE K Y,CHA S M,CHOI S M,et al.Antibacterial and synergistic effects of the n-BuOH fraction of Sophora flavescens root against oral bacteria[J].Journal of Oral Science,2017,59(1):77-86.
[26] SHI C,SONG K K,ZHANG X R,et al.Antimicrobial activity and possible mechanism of action of citral against Cronobacter sakazakii[J].PLoS One,2016,11(7):e0159006.
[27] SHI C,ZHANG X R,SUN Y,et al.Antimicrobial activity of ferulic acid against Cronobacter sakazakii and possible mechanism of action [J].Foodborne Pathogens &Disease,2016,13(4):196-204.
[28] 舒慧珍,唐志凌,刘雪,等.柠檬烯对荧光假单胞菌抑菌活性及机理研究[J].食品工业科技,2019,40(12):134-139.
SHU H Z,TANG L Z,LIU X,et al.Study on the antibacterial activity and mechanism of limonene against Pseudomonas fluorescens[J].Science and Technology of Food Industry,2019,40(12):134-139.
[29] BOT C,PRODAN C.Probing the membrane potential of living cells by dielectric spectroscopy[J].European Biophysics Journal,2009,38(8):1049-1059.
[30] 崔海英,周慧,宋方平,等.丁香精油对单核细胞增生性李斯特菌的抗菌性能及杀菌机制研究[J].中国食品添加剂,2015,12:65-69.
CUI H Y,ZHOU H,SONG F P,et al.Study on antibacterial activity and bactericidal mechanism of clove essential oil against Listeria monocytogenes[J].Chinese Food Additives,2015,12:65-69.
[31] KANG J M,JIN W Y,WANG J F,et al.Antibacterial and anti-biofilm activities of peppermint essential oil against Staphylococcus aureus[J].LWTFood Science and Technology,2019,101:639-645.
[32] MEMPIN R,TRAN H,CHEN C,et al.Release of extracellular ATP by bacteria during growth[J].BMC Microbiology,2013,13:301.
[33] 周慧.鼠尾草精油纳米脂质体对金黄色葡萄球菌生物膜的控制释放研究[D].镇江:江苏大学,2016.
ZHOU H.Study on controlled release of sage essential oil nanoliposomes on Staphylococcus aureus biofilm[D].Zhenjiang:Jiangsu University,2016.
[34] SUN X H,ZHOU T T,WEI C H,et al.Antibacterial effect and mechanism of anthocyanin rich Chinese wild blueberry extract on various foodborne pathogens[J].Food Control,2018,94:155-161.
[35] LI X C,HE C F,SONG L Y,et al.Antimicrobial activity and mechanism of Larch bark procyanidins against Staphylococcus aureus[J].Acta Biochimica et Biophysica Sinica,2017,49(12):1058-1066.
[36] ZHOU Y D,ZHANG Y L,ZONG H,et al.Chemical constituents,antibacterial activity and mechanism of Paeonia suffruticosa Andr.buds extract against Staphylococcus aureus and Escherichia coli O157:H7[J].Natural Product Research,2019,35(6):1005-1009.
[37] ZOU L,HU Y Y,CHEN W X.Antibacterial mechanism and activities of black pepper chloroform extract[J].Journal of Food Science and Technology,2015,52(12):8196-8203.