微乳液是由一定比例的油相、水相、表面活性剂和助表面活性剂混合后自发形成的各向同性、外观澄清透明或略带乳光的稳定热力学分散体系,其液滴粒径在10~100 nm[1]。由于其具有热力学稳定性高、粒径细小、均匀等特点,因此近年来被广泛用于药物、活性因子及功能成分的包载输送、无机纳米材料和水溶性高分子等的制备[2-3]。根据微乳液形成相态的特点,微乳液可分为WinsorⅠ型、Winsor Ⅱ型、Winsor Ⅲ型和Winsor Ⅳ型[4-5]。其中,WinsorⅠ型是上相为油相及下相为O/W 型微乳液的体系;Winsor Ⅱ型是上相为W/O 型微乳液及下相为水相的体系;Winsor Ⅲ型是上相为油相,中相为双连续型微乳相和下相为水相的体系;Winsor Ⅳ型是均匀的单一微乳液体系。油相的组成、表面活性剂的性质、油水比、温度、水相理化性质等因素均影响微乳的相行为[6-7]。
非离子表面活性剂种类繁多,化学性质稳定,具有一定的耐酸碱、盐及温度的稳定性。其中吐温类表面活性剂为聚氧乙烯去水山梨醇的部分脂肪酸酯,具有低毒、低刺激,以及良好的生物相容性,属于GB 2760-2021 《食品安全国家标准 食品添加剂使用标准》规定的食品添加剂范畴,是构建食品级微乳液应用最普遍的一类非离子表面活性剂[8-9]。吐温类表面活性剂制备微乳的难、易取决于油相的种类,一般油相脂肪酸酯链长越短形成微乳越容易[10-11]。丁酸乙酯是一种食品级风味物质,是构建微乳效果理想的一种油相。文献报道了有关吐温/丁酸乙酯食品级微乳对食品活性成份的包载增溶[12-14]。如:颜秀花等[15]以吐温/丁酸乙酯水包油微乳作为包载体,成功解决了β-胡萝卜素的水溶性差、易被氧化等不稳定性的问题。刘妙青等[16]考察了吐温80/正丁醇/丁酸乙酯/水微乳液体系对水难溶性药物槲皮素的增溶作用,结果表明,槲皮素在以丁酸乙酯为油相的微乳液和其相应的胶束溶液中溶解度明显增大,在室温和低温下放置较稳定,其外观性状和药物含量均没有明显变化。
微乳液的可稀释性是微乳液包载性能的一个重要性质[17-18]。研究表明小分子短链醇有助于形成U 型可稀释微乳通道(全稀释通道),在全稀释通道上存在由水包油-双连续-油包水微乳的微观结构变化[19]。Deng 等[20]研究百里酚在微乳液中的抑菌性和抗氧化性,在微乳区无限稀释线上随水相百分含量增大,微乳微观结构由W/O 到双连续相再到O/W 型转变,百里酚的抑菌性逐渐降低,而清除自由基能力逐渐增强。由此可见,全稀释线通道上微乳液的增溶能力及对活性成分的保护性与微乳的微观结构及界面性质密切相关。张佩华等[21]研究了以吐温为表面活性剂、单硬脂酸甘油酯为油相的微乳相行为,确定了微乳的全稀释通道配方。Kalaitzaki 等[22]研究了以吐温为表面活性剂、柠檬油为油相的微乳的相行为,并应用电子顺磁波谱探究微乳全稀释线上微乳的界面特性。
本文通过微乳液的拟三元相图探究以吐温为表面活性剂、丁酸乙酯为油相的微乳液相行为;探究表面活性剂、助表面活性剂及表面活性剂/助表面活性剂质量比(Km)对吐温-丁酸乙酯微乳相行为的影响,确定最佳吐温/丁酸乙酯食品级水包油空白微乳液配方及全稀释通道,并进一步应用电导率测定、动态光散射试验及核磁共振谱方法表征全稀释线上微乳微观结构的变化、分子的运动性及分子间相互作用,为吐温/丁酸乙酯食品微乳液的实际应用提供理论指导。
1 材料与方法
1.1 材料与试剂
吐温20、40、60、80(分析纯级),上海麦克林生化科技有限公司;乙醇(分析纯级),沧州海岳化工有限公司;丁酸乙酯(分析纯级),上海诺泰化工有限公司;丙二醇、正丁醇(分析纯级),天津市天力化学试剂有限公司。
1.2 仪器与设备
全数字AVANCE ⅢHD 500 MHz 超导核磁共振谱仪,德国Bruker 公司;马尔文NANO S90动态光散射仪,英国马尔文公司;DDS-307A 电导率仪,上海雷磁仪器厂。
1.3 方法
1.3.1 微乳液伪三元相图的绘制 以丁酸乙酯为油相,分别选择吐温80、吐温60、吐温40、吐温20为表面活性剂,选用乙醇、丙二醇、正丁醇为助表面活性剂。采用滴水法,设置表面活性剂与助表面活性剂的质量比(Km)分别为1∶4,1∶2,1∶1,2∶1 和4∶1,混合表面活性剂与助表面活性剂形成混合表面活性剂,固定油相与混合表面活性剂的总质量为1 g,将油相和混合表面活性剂按照一定质量比(1∶9,2∶8,3∶7,4∶6,5∶5,6∶4,7∶3,8∶2,9∶1)混合,水浴振荡至均匀后,间隔滴加蒸馏水,振荡,待其恢复澄清透明状态,浑浊时停止加水并记录加水总量。按照临界点油相、表面活性剂相和水相所占比例,借助Origin 8.0 软件绘制出对应的三元相图,确定微乳单相区,应用CAD 软件计算微乳单相区占三元相图总面积的比例。
1.3.2 L91 全稀释通道的微观结构及相互作用研究 根据丁酸乙酯/吐温80/乙醇/水(Km=1∶1)微乳伪三元相图,得到可无限稀释的单相微乳区域,选择混合表面活性剂与丁酸乙酯质量比9∶1 全稀释通道(L91)上不同水相质量分数单相微乳(含水量分别为0.1,0.3,0.5,0.7 和0.9),进行微乳界面分子间相互作用及微观结构研究。
NMR 试验采集自Bruker AVANCE Ⅲ 500 MHz 超导核磁共振谱仪上,采用topspin 3.2 自带标准脉冲序列进行检测。其中1D 1H NMR 谱图采用90°小角度激发,扫描次数128 次,等待时间2 s;1D 选择性NOESY 采用“selnogp”的脉冲序列,等待时间2 s,扫描次数128 次;2D DOSY 采用双相梯度激励回波的脉序“ledbpgp”进行检测,等待时间2 s,扩散时间(Δ)为200 ms,涡流延迟(δ)为5 ms,采用场16 个梯度,扫描次数32 次;横向弛豫时间采用压水的“CPMG”脉序进行检测,等待时间2 s,扫描次数32 次;纵向弛豫时间采用压水的反转恢复法“t1irpr”进行测量,等待时间2 s,扫描次数32 次。
2 结果与分析
2.1 表面活性剂链长、助表面活性剂种类及Km值对微乳相行为的影响
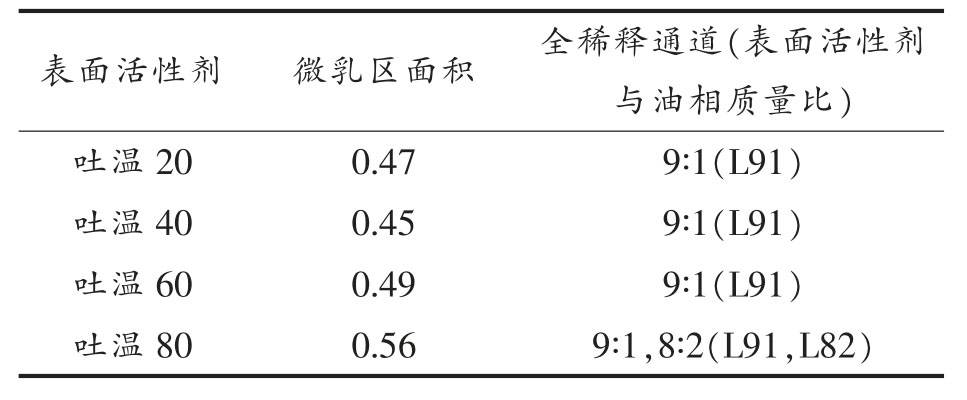
2.1.1 吐温的疏水链长及不饱和度的影响 本文首先探索了吐温的链长和不饱和度对吐温/短链醇/丁酸乙酯/水微乳体系相行为的影响。分别以吐温80、吐温60、吐温40 和吐温20 为表面活性剂,以乙醇为助表面活性剂,固定Km 值为1∶1,按1.3.1节方法配制微乳液,绘制各微乳的拟三元相图,如图1 及表1 所示。由表1 可见,吐温60 和吐温80具有最长的烷基链,其微乳区面积也相对较大,说明吐温60 和80 更易于包载油相,这显示了表面活性剂的疏水链越长越利于水包油微乳,形成更大面积的单相微乳区,这与文献报导结果一致[23]。另外,吐温80 的单相微乳区面积大于吐温60,这暗示了表面活性剂疏水链的不饱和度增大,其柔性增强,可能更易于包载油相。另外,吐温60、40、20 的全稀释通道表面活性剂与油的质量比均为9∶1(记为L91,后计法相同);吐温80 微乳液全稀释通道的表面活性剂与油的质量比8∶2 和9∶1(L82和L91),其无限稀释通道最多。这可能是由于吐温80 烷基链上有双键,具有更大的柔性,在界面吸附时可适应更大范围的液滴粒径曲率,无限稀释时可以有效包载不同粒径分布的油滴。由此可见,表面活性剂的疏水链越长不饱和度越高可能更利于水包油单相微乳区及全稀释通道的形成。
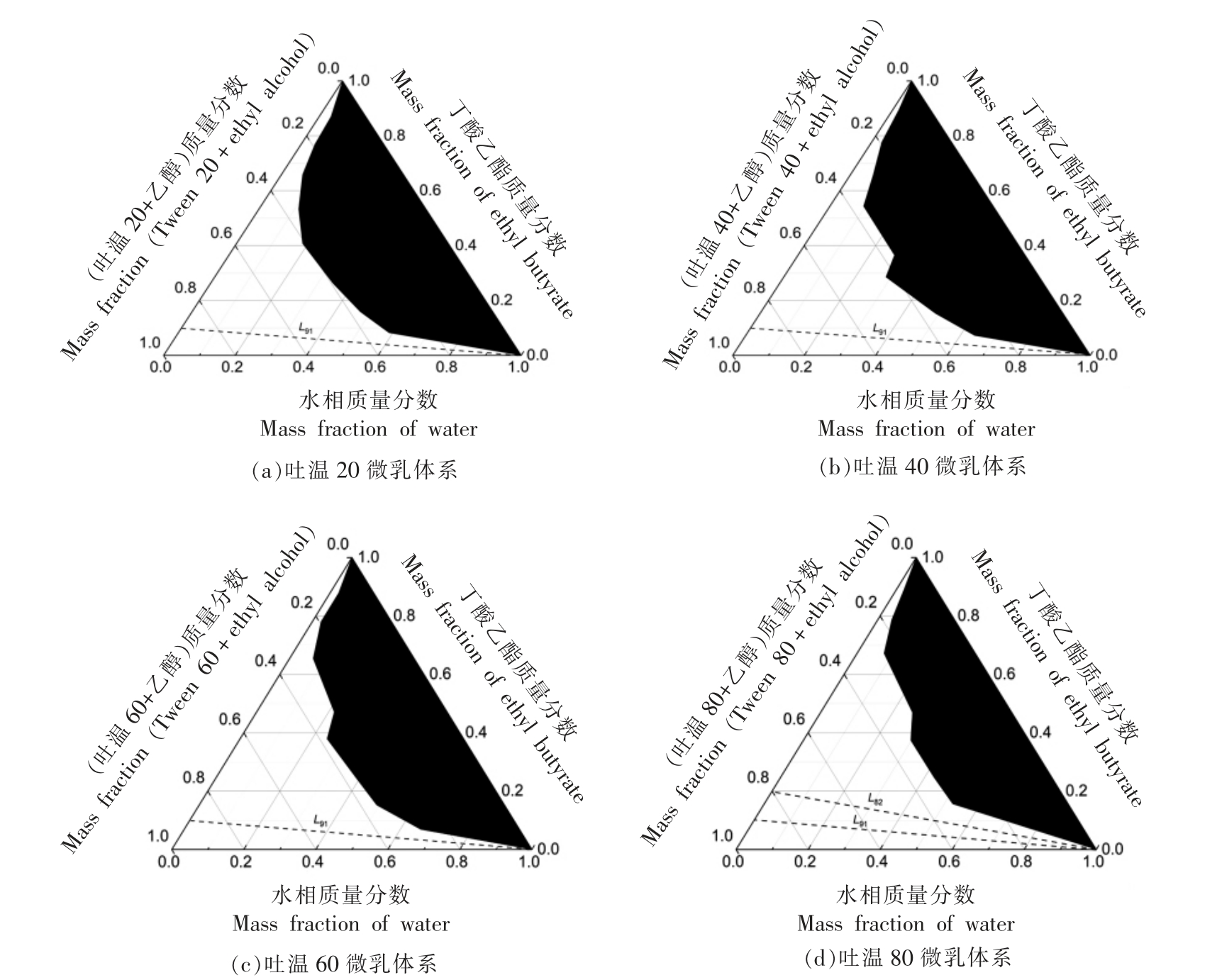
图1 不同吐温/乙醇/丁酸乙酯(Km=1∶1)/水微乳体系拟三元相图比较
Fig.1 The pseudo-ternary phase diagrams of different Tween/ alcohol/ ethyl butyrate(Km=1∶1)/ water MEs
注:黑色阴影区域为两相区,空白区域为单相微乳区。
表1 不同吐温/乙醇/丁酸乙酯/水微乳体系(Km=1∶1)单相微乳区面积(三角形面积为1)
Table 1 The single-phase area of different Tween/alcohol/ethyl butyrate/water MEs with Km as 1∶1(the triangle area is treated as 1)
2.1.2 助表面活性剂的影响 由于微乳的形成需要有短暂的负表面张力,因此常常在微乳制备过程中加入低碳链醇(C3~6)作为助表面活性剂。助表面活性剂在微乳的形成过程中的主要作用为:协助表面活性剂来降低界面张力和增加界面的流动性,以便减少微乳形成时所需的弯曲能,使微乳液滴易于形成,以及调节表面活性剂的HLB 值。本文探究了几种常用的小分子短链醇-乙醇、丙二醇、正丁醇对吐温/丁酸乙酯/水微乳相行为的影响,结果如图2 和表2 所示。结果表明,单相微乳区面积为乙醇>丙二醇>正丁醇,说明乙醇作为助表面活性剂最有利于丁酸乙酯吐温单相微乳区的形成,此结果与报导文献[24]结果一致,提示短链分子醇的链长越短,羟基数目越多,越利于单相微乳区的形成;并且乙醇及丙二醇作为助表面活性剂,微乳区均有两条无限稀释通道,而正丁醇的微乳体系没有无限稀释通道。由此可见,短链分子醇的链羟基数目的增加有利于无限稀释通道的形成。短链醇的链长越短,其分子运动性越强,在界面和水相间的交换速率越快,在油水界面更易于吸附与解析附,增强微乳界面的流动性,有效调节表面活性分子的临界堆积参数(CPP);其羟基越多,越能有效调节水油极性,增大界面上表面活性剂的HLB 值,均有助于微乳单相区及无限稀释通道的形成。

图2 吐温80/短链醇/丁酸乙酯/水微乳体系(Km=1∶1)拟三元相图比较
Fig.2 The pseudo-ternary phase diagrams of Tween 80/short-chainedalcohol/ethylbutyrate/water MEs(Km=1∶1)
注:黑色阴影区域为两相区,空白区域为单相微乳区。
表2 吐温80/短链醇/丁酸乙酯/水微乳体系(Km=1∶1)单相微乳区面积(三角形面积为1)
Table 2 The single-phase area of different Tween 80/short-chained alcohol/ethyl butyrate/water MEs with Km=1∶1(the triangle area is treated as 1)
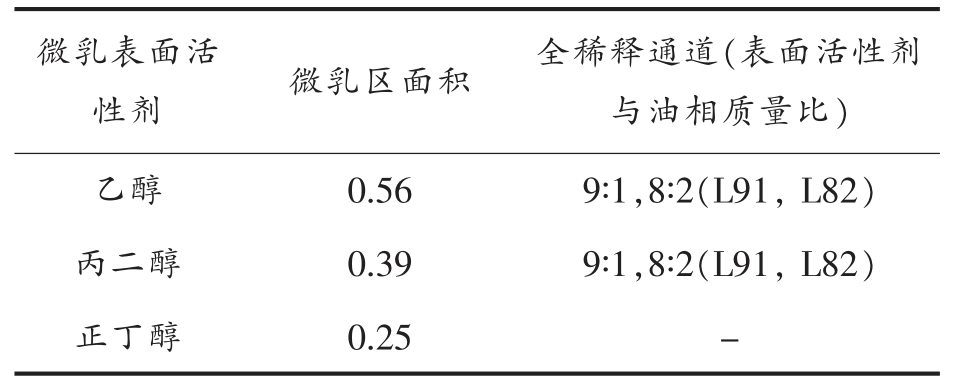
注:“-”表示无全稀释通道。
2.1.3 Km 值的影响 进一步以吐温80 为表面活性剂、乙醇作为助表面活性剂配制吐温/丁酸乙酯微乳,探究Km 值(表面活性剂与助表面活性剂质量比)对微乳相行为的影响。设置梯度Km 值为1∶4,1∶2,1∶1,2∶1 和4∶1,结果如图3 和表3 所示。结果显示,Km 值为1∶1 时微乳区面积最大,这与文献报导的大分子酯质作为油相的微乳相行为不完全一致[25],文献中大分子酯质微乳的微乳区面积随Km 值增大逐渐增大。需要注意的是,适量的小分子醇能够调整HLB 值到最优值使微乳更容易形成,而过多的乙醇则会使界面的流动性过强,并且降低了水相的极性,增加了连续相和乳滴油相之间的相互吸引力,反而降低了微乳的形成能力。丁酸乙酯是小分子油相,乙醇作为助表面活性剂后者的作用更为显著,因此吐温/乙醇/丁酸乙酯/水微乳在最佳Km 值时具有最大单相微乳区面积;另外,表面活性剂含量的增大更利用全稀释通道的形成,这与已报导文献的结果一致[25]。
表3 吐温80/乙醇/丁酸乙酯/水微乳体系在不同Km 下的单相微乳区面积(三角形面积为1)
Table 3 The single-phase area of Tween 80/ethyl alcohol/ethyl butyrate/water MEs with different Km values(the triangle area is treated as 1)
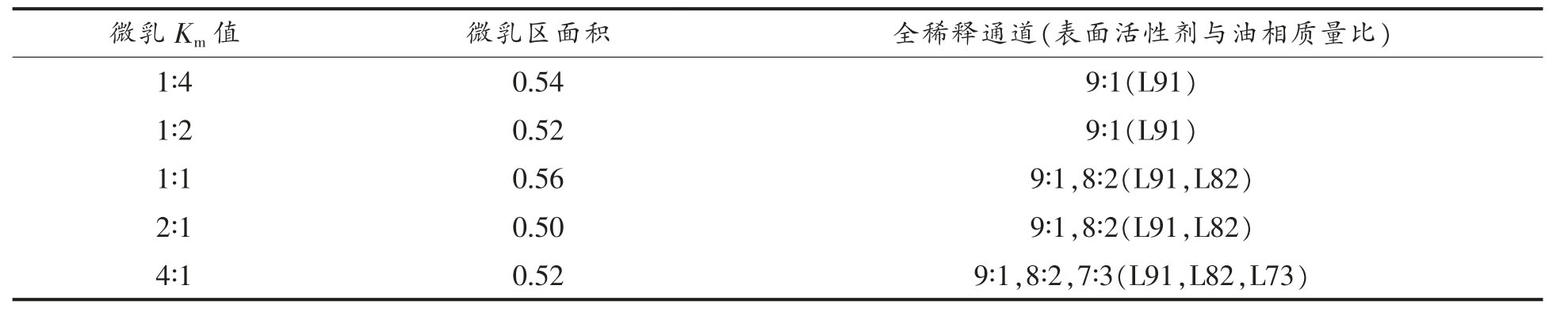
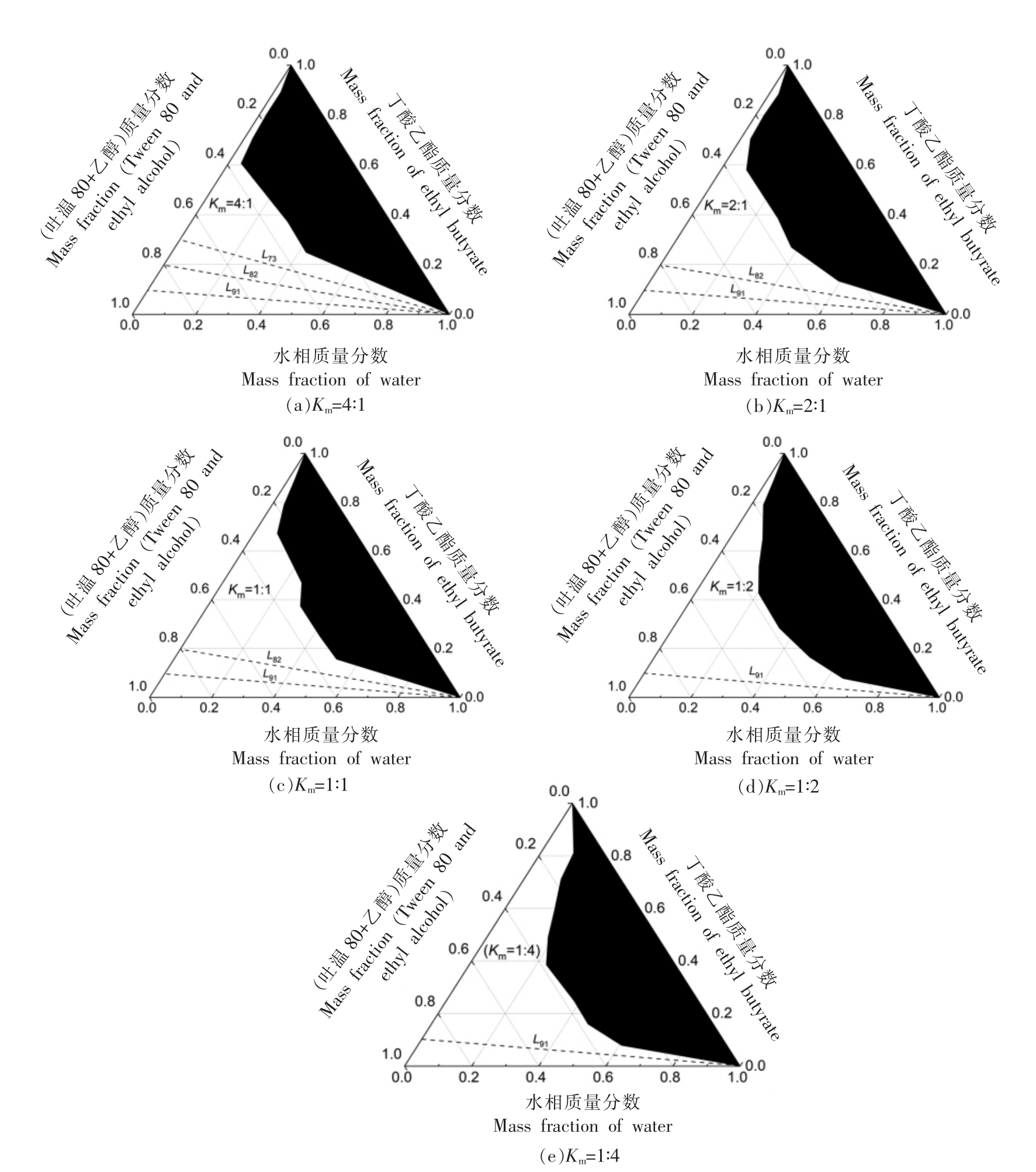
图3 吐温80/乙醇/丁酸乙酯/水微乳体系在不同Km 下的拟三元相图比较
Fig.3 The pseudo-ternary phase diagrams of Tween 80/ethyl alcohol/ethyl butyrate/water MEs under different Km values
注:黑色阴影区域为两相区,空白区域为单相微乳区。
2.2 全稀释线上微观结构变化及分子相互作用研究
根据以上吐温/丁酸乙酯水包油微乳相行为的比较,以吐温80 为表面活性剂、乙醇为助表面活性剂、Km 值为1 ∶1 进一步探究吐温80/乙醇/丁酸乙酯/水微乳体系L91 全稀释线(如图3c 所示)上微观结构的变化、分子运动性及界面分子间相互作用。
2.2.1 电导率及粒径变化 首先通过电导法监测了全稀释线上微乳体系的电导率变化,结果如图4a 所示。微乳载水量小于10%微乳呈黏稠状,电导率较小保持不变,含水量10%~50%体系电导率随之快速增大,当含水量大于50%电导率有波动下降趋势。文献[26]报导了吐温/乙醇/甘油醋酸酯/水微乳体系全稀释线上微乳结构由油包水→有序双连续结构→水包油的结构变化,图4a 电导率的变化趋势与文献结果相近,据此推导吐温/乙醇/丁酸乙酯/水L91 稀释线上可能有相同的结构变化。含水量小于10%体系为油包水结构,电导率较低;10%<水含量<50%为有序双连续结构,水作为连续相,随着含水量增大体系内聚集体数目增多,电导率逐渐增大;水含量>50%双连续结构转变为稳定的水包油液滴,继续增大水含量,聚集体浓度逐渐降低,电导率有所降低。
同时应用动态光散射试验测量了稀释线上微乳的粒径分布,结果如图4b 及表4 所示。结果表明,水含量10%~50%时体系中存在平均粒径4.2~8.7 nm 和44~51 nm 的聚集体,载水量超过70%体系中仅存在10 nm 左右聚集体。需要注意的是,动态光散射测定时需要对微乳进行稀释,因此微乳体系中实际存在聚集体平均粒径应该大于检测值,并且稀释有可能破坏较大的不规则聚集体结构。尽管如此,动态光散射显示的粒径变化趋势基本与电导结果基本一致,说明了含水量50%~70%时体系内存在微乳结构的转变,含水量超过70%微乳中存在较为单一粒径(约10 nm)的水包油肿胀胶束。
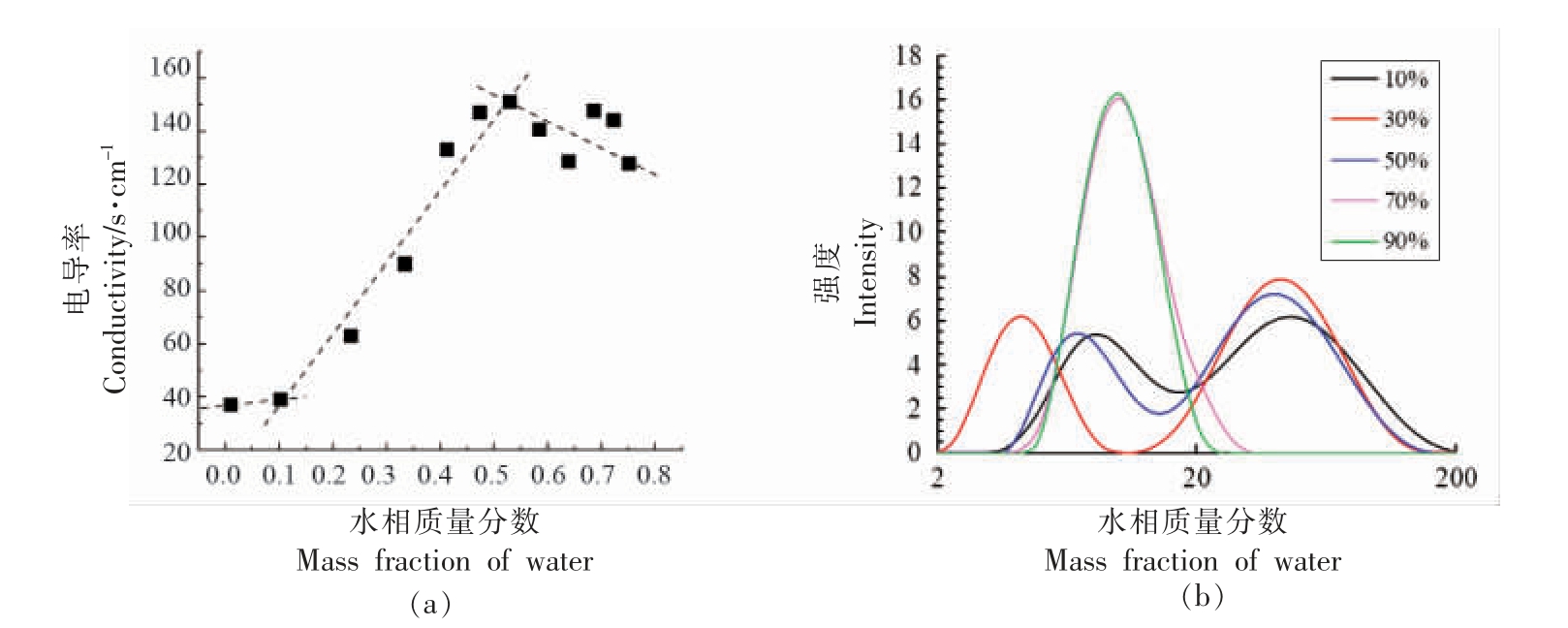
图4 吐温80/乙醇/丁酸乙酯/水微乳体系L91 全稀释线上不同含水量微乳的电导率(a)及粒径分布曲线(b)
Fig.4 The conductivity(a)and size distribution(b)of Tween 80/ethyl alcohol/ethyl butyrate/water MEs along the L91 fully dilutable line with different water contents
表4 吐温80/乙醇/丁酸乙酯/水微乳体系L91 全稀释线上不同含水量微乳的粒径分布
Table 4 The size distribution of Tween 80/ethyl alcohol/ethyl butyrate/water MEs along the L91 fully dilutable line with different water contents
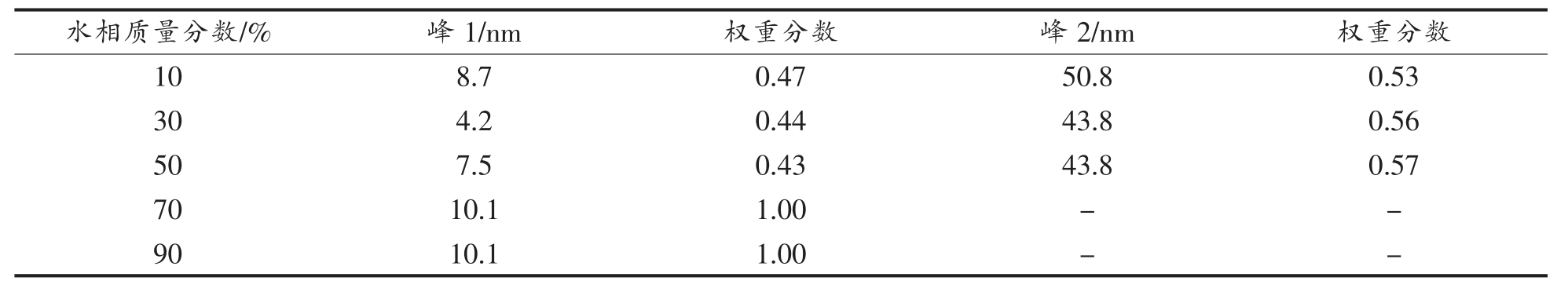
注:“-”表示无分布。
2.2.2 NMR-自扩散系数、化学位移 通过NMR一维氢谱及DOSY 试验进一步测量了L91 全稀释通道上各组分的自扩散系数,结果如图5 所示。由图5a 可见,含水量>10%水的扩散系数一直最大,可见水一直是体系的连续相,随着水含量增大体系黏度降低,水扩散系数逐渐增大。水含量10%~50%时吐温80(见图5a 中局部放大图)和丁酸乙酯的扩散系数有下降趋势,乙醇扩散系数增加趋势比较缓慢,水含量大于50%三者的扩散系数均逐渐增大,此结果支持了基于电导率和粒径分布做出的结构推测,体系中可能存在水包油(水含量<10%)→有序双连续结构(10%~50%)→水包油液滴(>50%)→水包油肿胀胶束(>70%)的结构转变。根据Kogan 等[26]对有序双连续微乳结构的表征,推测全稀释线微乳微观结构的变化示意图,如图6 所示。含水量约10%体系内形成有序的长程层状双连续结构,吐温80 吸附在界面上,丁酸乙酯包载在层状结构内,吐温80、丁酸乙酯和乙醇的扩散系数即为在双连续结构内的扩散系数,扩散速率较小。随着水含量的逐渐增大长程有序的双连续结构逐渐破坏,短程有序的双层结构逐渐形成,吐温80 和丁酸乙酯的扩散表现为在双层结构内的扩散和随着双层结构在水连续相的扩散,因此扩散系数反而降低;继续增大含水量双层结构完全被破坏(含水量30%~50%),逐渐转变为水包油微乳液滴及肿胀胶束(含水量超过50%完全转变为油包水液滴及肿胀胶束),吐温80 和丁酸乙酯的扩散主要表现为随着液滴在水连续相的扩散,随着聚集体体积的减小及体系黏度降低,各组分的扩散系数均随水含量的增大显著增大。
通过1H NMR 谱图测定了各组分质子基团化学位移的变化,结果如图5b 所示。吐温80、丁酸乙酯及乙醇的各质子基团(T7、E5 和A1),化学位移均随水含量增加化学位移向高场方向移动(其它质子变化趋势同),而含水量30%~50%时存在一个变化平台;水的化学位移在含水量10%~50%时逐渐向低场方向移动,而含水量大于50%水的化学位移不再显著变化。这显示了体系在含水量30%~50%时存在结构的转变,这支持了图6 结构转变的推测。微乳结构由液晶-层状有序双连续结构-水包油液滴变化过程中,吐温80、丁酸乙酯及乙醇一直吸附聚集体界面或包载在聚集体中,随着结构的转变聚集体的曲率增大,聚集体中各组分分子感受到的分子环境拥挤度逐渐增大疏水性逐渐增强,质子基团感受到的屏蔽作用增强,因此化学位移均向高场移动,含水量30%~50%变化平台反映了有序双连续结构向水包油液滴的过渡,即短程有序的层状结构阶段(如图6 所示)。含水量10%~50%结构转变过程中水分子不断的从疏水环境中释放,所处极性逐渐增强,化学位移向高场移动,含水量大于50%体系中水作为分散相化学位移不再改变,也暗示了此时体系中为稳定粒径的水包油液滴。
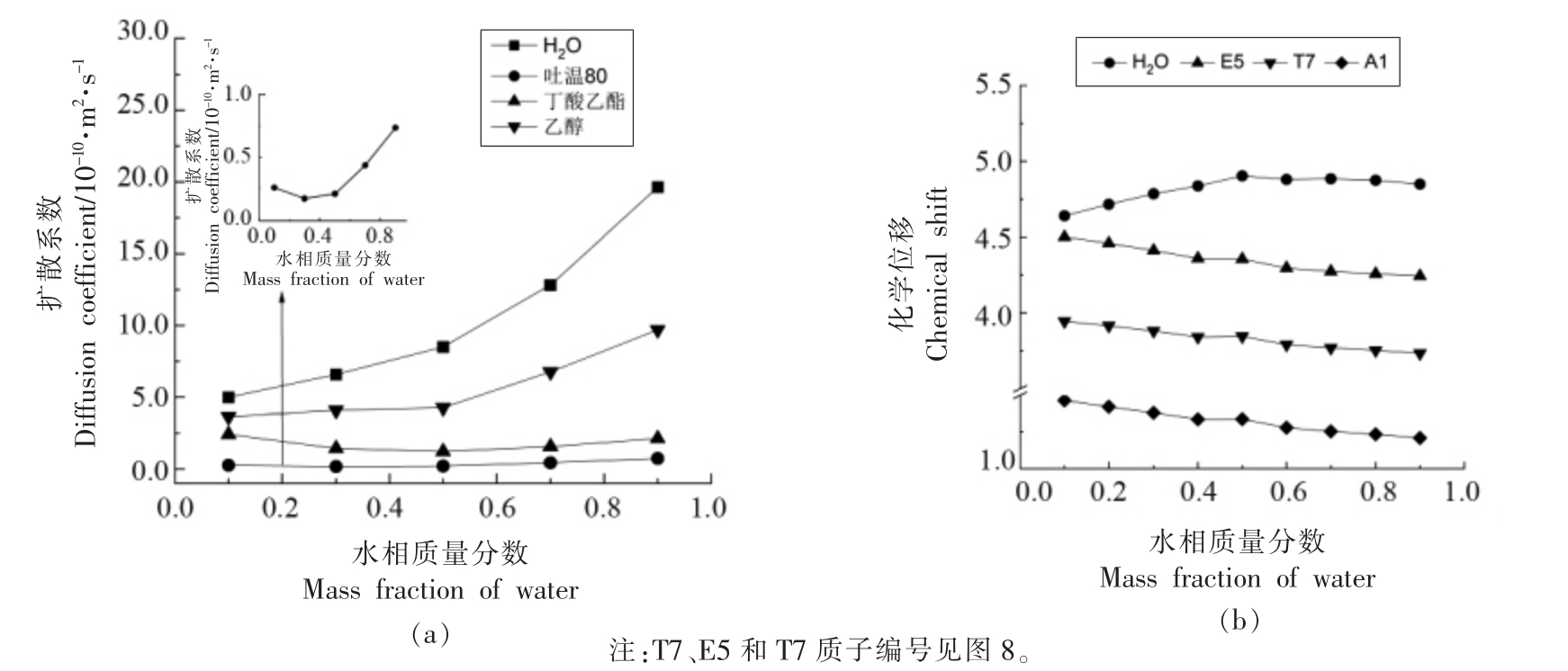
图5 吐温80/乙醇/丁酸乙酯/水微乳体系L91 全稀释线上微乳各分子的自扩散系数(a)及化学位移(b)随水含量的变化趋势
Fig.5 The variations of diffusion coefficients(a)and chemical shifts(b)of each components in Tween 80/ethyl alcohol/ethyl butyrate/water MEs along the L91 fully dilutable line with water contents increasing
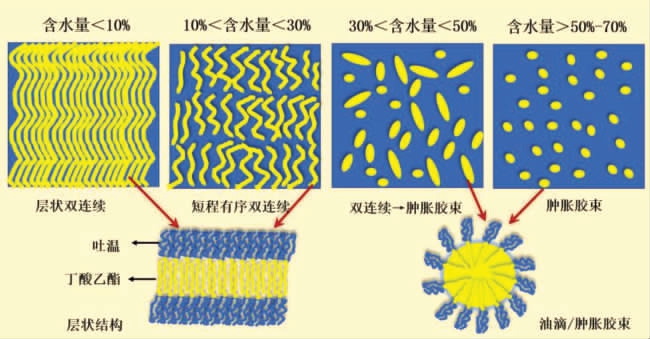
图6 吐温80/乙醇/丁酸乙酯/水微乳体系L91 全稀释线上随着水含量增加微乳可能的微观结构变化示意图[26]
Fig.6 The possible microstructure transition inside Tween 80/ethyl alcohol/ethyl butyrate/water MEs along the L91 fully-dilutable line with water contents increasing[26]
2.2.3 NMR 弛豫时间变化 核磁弛豫时间能够反映分子的运动性,进一步检测了L91 稀释线上随着结构变化各组分分子的弛豫时间T1、T2 的变化,并计算了其TR 值(T1/T2),结果如图7 所示。T1、T2、TR 的变化趋势相同,其中TR(1>TR>0)更能直接反映分子的运动受限情况,TR 值越小说明分子的运动受限性越强。由图7c 所示,吐温80 的疏水链质子T2 一直具有最小的TR 值,说明吐温80 分子疏水链嵌入界面层运动受限,而其亲水基团T7 在液滴界面的外层与水相接触,运动性较强,其TR值较T2 的大。随着水含量的增大,T2 的TR 逐渐降低,而T7 的TR 逐渐增大,这反映了微乳聚集体在结构转变过程中聚集体曲率逐渐变大,界面分子的堆积紧密度增大,因此T2 的TR 值逐渐增大,而T7 一直与水相接触,随着水相分数增大反而运动性增强;另外,丁酸乙酯的E4 随着含水量的增大TR 值也逐渐降低,说明丁酸乙酯一直被包载在界面内,随着聚集体曲率逐渐增大,其运动受限程度增强。吐温80 和丁酸乙酯TR 值的变化趋势很好的支持了图6 结构变化的推测,微乳结构由有序双连续结构→水包油液滴→肿胀胶束转变过程中聚集体曲率不断增大;含水量10%~30%乙醇A2的TR 值降低,含水量大于30%其TR 值逐渐增大,这是因为含水量10%~30%的有序层状双连续结构中,乙醇主要被吸附在界面内层或者包载在油相中,运动性受限,当水含量大于30%体系内层状结构逐渐向水包油液滴转变(图6 所示),乙醇逐渐被释放到界面外层或者水相中,运动性逐渐增强。
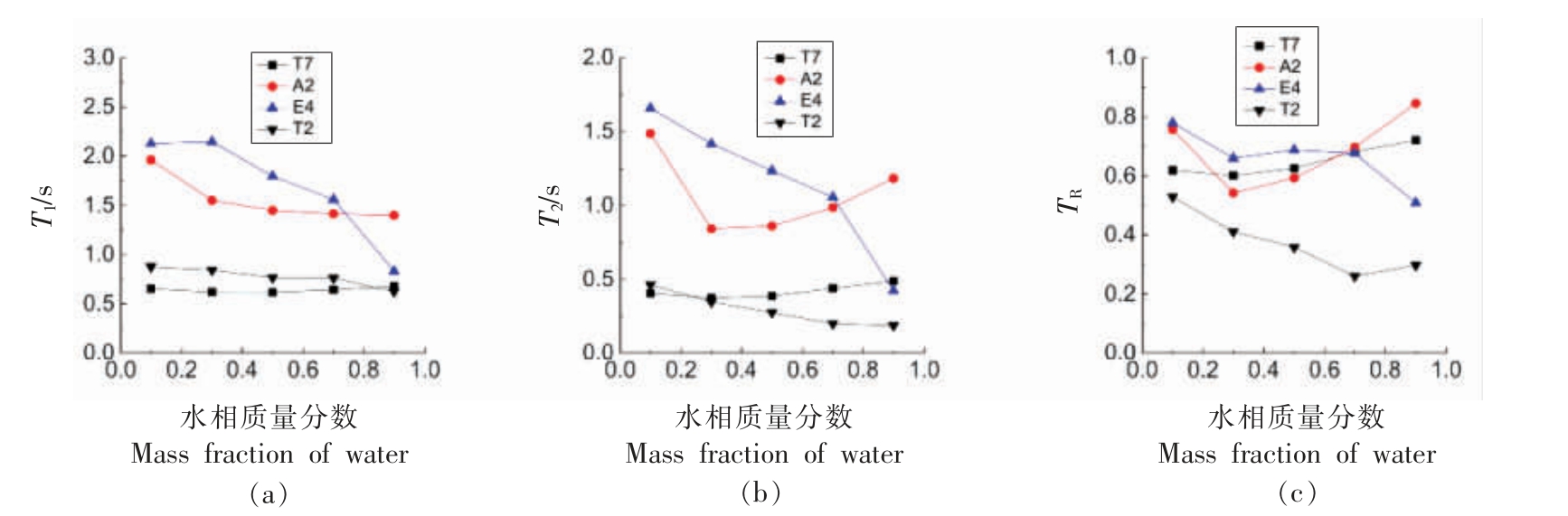
图7 吐温80/乙醇/丁酸乙酯/水微乳体系L91 全稀释线上微乳中各分子的弛豫时间T1(a)、T2(b)和TR(c)随水含量的变化趋势
Fig.7 The variations of relaxation time T1(a),T2(b)and TR(c)in the Tween 80/ethyl alcohol/ethyl butyrate/water MEs along L91 fully dilutable line with water contents increasing
注:T7、T2、E4 和A2 质子编号见图8。
2.2.4 分子间相互作用 应用一维选择性激发试验,对微乳区各组分分子进行选择性激发,进一步探究了L91 线上水含量30%体系中各组分分子间相互作用。如图8 所示,分别对微乳组分分子的质子基团进行选择性激发(红色箭头指向激发位置),与激发质子存在相互作用的质子基团会在相应化学位移处产生相关信号。如图8 所示,对丁酸乙酯的E5、E4、E3 和E1 进行选择性激发,可以观察到丁酸乙酯与自身质子基团较强的负信号相关峰、与乙醇的A1、A2 较弱的负信号相关峰及与吐温的T7 和T2 较弱的正相关信号峰,而与水质子无相关信号峰。如图6 微乳微观结构图所示,丁酸乙酯被包载在聚集体内部,与界面分子吐温80 分子及乙醇分子存在相互作用,而与水无相互作用。另外,丁酸乙酯与吐温的相关峰为正信号,说明吐温80 分子存在于较大的聚集体中。分别对T7-A2和T2-E2-A1 的重叠信号进行激发,可以观测到它们与水较强的相关信号峰,并且T7-A2-H2O 的相关信号强度比T2-A1-H2O 的更大,这说明吐温80 和乙醇均与水有相互作用,并且亲水基团T7与水相互作用更强。由此可见,选择性激发的结果很好的支撑了L91 线上含水量30%的微乳体系中存在以水为连续相的有序的层状双连续结构(图6 所示)。
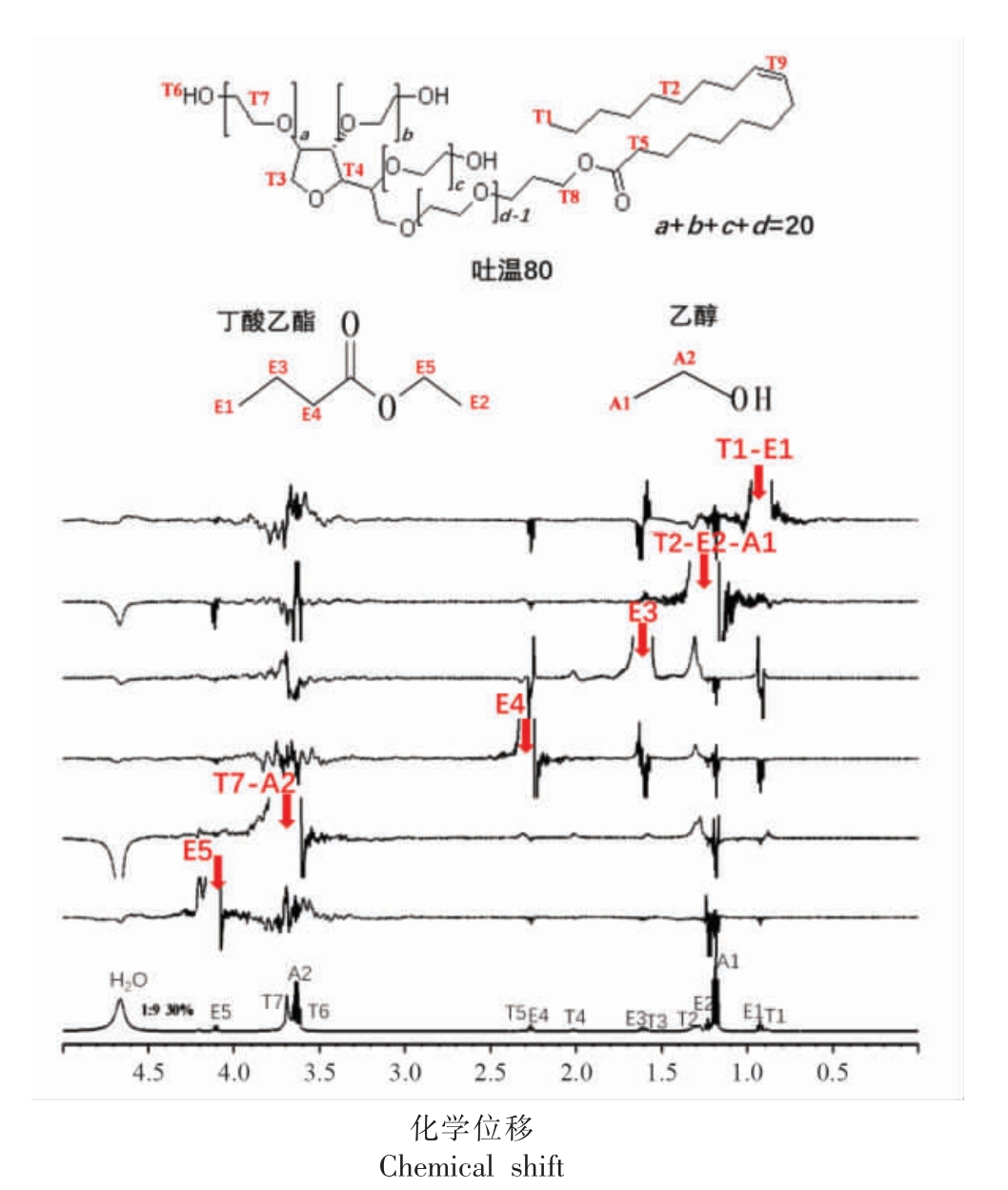
图8 吐温80/乙醇/丁酸乙酯/水微乳体系L91 全稀释线上水含量30%微乳的1D 1H NMR 谱图及各分子质子编号
Fig.8 The 1D 1H NMR spectra of Tween 80/ethyl alcohol/ethyl butyrate/water MEs with 30% water content along L91 fully dilutable line and the proton numbering
of each components
注:最下面谱图为未激发1H NMR 谱图,以上谱图为选择性激发1H NMR 谱图,红色箭头标记位置为选择性激发的信号位置。
3 结论
通过拟三元相图法探究了几种吐温乳化剂、助表面活性剂及Km 值对丁酸乙酯/吐温微乳相行为的影响,并进一步应用电导率法、动态光散射和NMR 方法探究了微乳中各组分的相互作用以及全稀释线上可能的微观结构、分子运动性及分子间相互作用。结果表明吐温80 作为表面活性剂、乙醇作为助表面活性剂微乳体系形成的单相微乳区面积最大、全稀释通道最多;Km 值越大微乳的无限稀释通道越多,在Km 值为1∶1 微乳具有最大的单相微乳区面积。在微乳的全稀释通道上随水质量分数增大,体系中可能存在油包水→有序双连续相→水包油液滴→肿胀胶束的微观结构变化;在有序双连续结构微乳中各组分间的相互作用方式为:吐温80 存在于丁酸乙酯/水界面上,亲水基团与水接触,疏水基团与丁酸乙酯油相接触,将丁酸乙酯包裹在双层结构内部,乙醇同时存在于水相或油水界面与水、油及吐温80 均有直接的分子间相互作用。
[1] GARTI N,ASERIN A.Microemulsions for solubilization and delivery of nutraceuticals and drugs[M].New York:Taylor &Francis Group,2006:345-428.
[2] FISHER S,WACHTEL E J,ASERIN A,et al.Solubilization of simvastatin and phytosterols in a dilutable microemulsion system[J].Colloids and Surfaces B:Biointerfaces,2013,107(4):35-42.
[3] FLANAGAN J,SINGH H.Microemulsions:A potential delivery system for bioactives in food[J].Critical Reviews in Food science and Nutrition,2006,46(3):221-237.
[4] 余立意,张辉,冯凤琴.食品级微乳液的研究进展[J].食品工业科技,2012,33(11):391-394.
YU L Y,ZHANG H,FENG F Q.Research progress in food-grade microemulsions[J].Science and Technology of Food Industry,2012,33(11):391-394.
[5] 邓伶俐,余立意,买尔哈巴·塔西帕拉提,等.纳米乳液与微乳液的研究进展[J].中国食品学报,2013,13(8):173-180.
DENG L L,YU L Y,TAXIPALATI M,et al.The research progress on nanoemulsion and microemulsion[J].Journal of Chinese Institute of Food Science and Technology,2013,13(8):173-180.
[6] 郑永军,王振,郑勇,等.紫苏油微乳的制备与表征[J].河南工业大学学报:自然科学版,2019,40(4):41-45,70.
ZHENG Y J,WANG Z,ZHENG Y,et al.Preparation and characterization of perilla oil microemulsion[J].Journal of Henan University of Technology(Natural Science Edition),2019,40(4):41-45,70.
[7] ZHANG H,LU Z,ZHANG L,et al.Antifungal activity of a food-grade dilution-stable microemulsion against Aspergillus niger[J].Letters in Applied Microbiology,2010,47(5):445-450.
[8] FANG W U,TIAN Y N,XIE X A,et al.Study on deposition control of Red Tea Beverage with food-grade Tween-80 microemulsion[J].Science &Technology of Food Industry,2014,35(9):264-268.
[9] KAUR G,MEHTA S K.Developments of polysorbate(Tween)based microemulsions:Preclinical drug delivery,toxicity and antimicrobial applications[J].International Journal of Pharmaceutics,2017,529(1/2):134-160.
[10] DENG L,QUE F,WEI H,et al.Solubilization of tea seed oil in a food-grade water-dilutable microemulsion[J].Plos One,2015,10(5):e0127291.
[11] ZHENG Z,LIU W,ZHAO Q,et al.Study on optimization and stability of microemulsion preparation of tomato seed oil[J].Food Industry,2018,39(4):154-158.
[12] 万紫媛,吴芳,李雁,等.吐温80/正构醇微乳体系形成过程的介观模拟[J].现代食品科技,2015,31(8):177-183,198.
WAN Z Y,WU F,LI Y,et al.Mesoscopic simulation of Tween80/n-alkanol microemulsion system[J].Modern Food Science and Technology,2015,31(8):177-183,198.
[13] 赵嘉敏,陈中,林伟锋.吐温-80 制备食品级微乳及其结构研究[J].食品与发酵工业,2010,36(10):50-54.
ZHAO J M,CHEN Z,LIN W F.Study on the formation and structural characterization of food-grade microemulsions prepared by Tween-80 [J].Food and Fermentation Industries,2010,36(10):50-54.
[14] HE J,ZHU Q,DONG X,et al.Oxyresveratrol and ascorbic acid O/W microemulsion:Preparation,characterization,anti-isomerization and potential application as antibrowning agent on fresh-cut lotus root slices[J].Food Chemistry,2017,214:269-276.
[15] 颜秀花,王正武,刘汉文.O/W 型微乳液对β-胡萝卜素增溶作用[J].食品科技,2010,35(2):40-42.
YAN X H,WANG Z W,LIU H W.Solubilization of β-carotene in oil/water microemulsion[J].Food Science and Technology,2010,35(2):40-42.
[16] 刘妙青,韩卫华,李海燕,等.O/W 型微乳液对槲皮素增溶作用的研究[J].山西化工,2007,27(3):1-3.
LIU M Q,HAN W H,LI H Y,et al.Solubilization of quercetin in oil/water microemulsion [J].Shanxi Chemical Industry,2007,27(3):1-3.
[17] ZHANG H,SHEN Y,WENG P,et al.Antimicrobial activity of a food -grade fully dilutable microemulsion against Escherichia coli and Staphylococcus aureus[J].International journal of food microbiology,2009,135(3):211-215.
[18] MEHTA S K,KAUR G,MUTNEJA R,et al.Solubilization,microstructure,and thermodynamics of fully dilutable U-type Brij microemulsion[J].Journal of Colloid and Interface Science,2009,338(2):542-549.
[19] WANG W,WEI H,DU Z,et al.Formation and characterization of fully dilutable microemulsion with fatty acid methyl esters as oil phase[J].Acs Sustain able Chemistry &Engineering,2015,3(3):443-450.
[20] DENG L,TAXIPALATI M,SUN P,et al.Phase behavior,microstructural transition,antimicrobial and antioxidant activities of a water-dilutable thymol microemulsion[J].Colloids and Surfaces B:Biointerfaces,2015,136(2015):859-866.
[21] 张佩华,梅子,傅玉颖,等.食品级单辛酸甘油酯微乳液的抑菌研究[J].食品工业科技,2013,34(16):125-130.
ZHANG P H,MEI Z,FU Y Y,et al.Antimicrobial activity evaluation of food grade glycerol monooctanoate microemulsion[J].Science and Technology of Food Industry,2013,34(16):125-130.
[22] KALAITZAKI A,XENAKIS A,PAPADIMITRIOU V.Highly water dilutable microemulsions:A structural study[J].Colloid and Polymer Science,2015,293(4):1111-1119.
[23] BAYRAK Y,ISCAN M.Studies on the phase behavior of the system non -ionic surfactant/alcohol/alkane/H2O[J].Colloids and Surfaces A Physicochemical and Engineering Aspects,2005,268(1):99-103.
[24] CHOI S Y,OH S G,BAE S Y,et al.Effect of short-chain alcohols as co-surfactants on pseudoternary phase diagrams containing lecithin[J].Korean Journal of Chemical Engineering,1999,16(3):377-381.
[25] THEVENIN M A,GROSSIORD J L,POELMAN M C.Sucrose esters/cosurfactant microemulsion systems for transdermal delivery:Assessment of bicontinuous structures[J].International Journal of Pharmaceutics,1996,137(2):177-186.
[26] KOGAN A,SHALEV D E,RAVIV U,et al.Formation and characterization of ordered bicontinuous microemulsions[J].The Journal of Physical Chemistry B,2009,113(31):10669-10678.