油浸食品因良好的风味而深受广大消费者的喜爱[1]。然而,因霉菌和枯草芽孢杆菌等有害微生物的大量繁殖而导致该类产品容易出现表面长霉、脂肪酸败和产生黏液等腐败变质现象[2],给食品安全带来严重影响。目前,预防油浸食品腐败变质的方法主要是添加丙酸钙、山梨酸钾和脱氢乙酸钠等化学防腐剂[3],虽然其能够有效控制油浸食品的腐败,但是长期摄入可能对消费者的健康造成潜在的威胁[4]。利用具有安全、高效等特点的天然抑菌剂来控制食品的腐败逐渐成为研究的热点和食品工业的发展趋势[5-6]。
ε-聚赖氨酸(ε-PL)是一种由25~30 个L-赖氨酸通过ε-氨基和α-羧基组成的异肽键连接而成的阳离子抗菌肽,具有抑菌谱广、安全性高、热稳定性好等特点[7-9]。被广泛用于肉制品、果蔬类以及面制品的防腐保鲜中[10-13]。壳聚糖和ε-PL 复合使用,通过抑制酵母菌、霉菌、大肠杆菌的生长和肌红蛋白的脂质氧化反应有效提高牛肉的货架期[14],ε-PL 通过提高酚类、黄酮类化合物以及木质素的含量延缓了苹果果实的腐败变质[15]。此外,ε-PL 还能抑制面制品中寄生曲霉(Aspergillus parasiticus)和扩展青霉(Penicillium expansum)的生长,从而延长面包的货架期[16]。然而,ε-PL 的亲水性极强[17],很难分散溶解到食用油中,极大的限制了在油浸食品中的使用,其在油浸食品中的应用问题亟待解决。
油水混溶剂是指有利于油、水两相互溶的介质,其在溶剂(分散相)中通过形成胶团、络合物以及复盐等,在一定程度上增大某些难溶性物质的溶解度,其中大部分为表面活性剂[18-19]。基于表面活性剂的乳液体系和微乳液相似,不需要外部能量输入,主要靠混溶剂(或表面活性剂)本身的作用改善油、水两相的相互分散。在高表面活性剂条件下,可形成各相同性的分散体系-微乳液[20],而低表面活性剂可形成普通油水乳化液体系。本文利用此特点,通过制备ε-PL 与低浓度表面活性剂的预混溶液,探究其在植物油中的分散特性,通过体内、外试验研究该预混溶液对油浸面制品中腐败微生物的抑制效果,以扩大ε-PL 作为天然防腐杀菌剂在食品工业中的应用范围。
1 材料与方法
1.1 材料与试剂
ε-聚赖氨酸盐酸盐(食品级),浙江新银象生物工程有限公司;吐温80、司盘80(化学纯级),上海麦克林生化科技有限公司;无水乙醇、丙三醇(分析纯级),上海凌峰化学试剂有限公司;氯化钠(分析纯级),广州光华科技有限公司;马铃薯葡萄糖琼脂(PDA)培养基、马铃薯葡萄糖肉汤(PDB)培养基,杭州微生物试剂有限公司;调味面制品(卫龙小面筋),河南卫龙食品有限公司;食用植物油、牛筋面、调味粉(食品级),市售。
1.2 设备与仪器
立式高压灭菌锅(YXQ-LS-70A),上海博迅实业有限公司;旋涡混合器(IKA lab dancer),德国IKA 公司;超净工作台(SW-CJ-1FD),苏州安泰空气技术有限公司;光学显微镜(E100),尼康仪器(上海)有限公司;脉冲震荡样品均质器(Shock-Mixer-1),广东环凯微生物科技有限公司;电子精密天平(PL-2002),梅特勒-托利多仪器(上海)有限公司;电子分析天平(AL-104),梅特勒-托利多仪器(上海)有限公司;恒温恒湿培养箱(BSC250),上海双旭电子有限公司。
1.3 试验方法
1.3.1 ETSG 的制备 选取吐温80、司盘80 为表面活性剂,按1∶1 复配,将ε-PL 配制成质量分数50%的水溶液,无水乙醇、丙三醇作为辅助剂,以提高体系的流动性。分别以体积比为1∶3 的无水乙醇和吐温作为活性剂相,体积比为1∶3 的丙三醇和ε-PL 水溶液作为水相。将活性剂相与水相分别以3∶1,2∶1,1∶1,1∶2,1∶3,1∶4 和1∶5 的比例配制,剧烈涡旋使其混合均匀。
1.3.2 ETSG 在油中的分散 将不同比例的ETSG,按质量分数1%,2%,3%的比例添加至葵花籽油中,快速涡旋使其均匀分散,25 ℃静置24 h后,在10 mL 离心管中观察溶解现象。根据ε-PL水溶液的增溶效果,选出最佳比例的ETSG,将其分别添加至不同的植物油中,观察在不同油中的增溶效果并记录。
1.3.3 优势腐败霉菌的分离、纯化及鉴定 参照徐文欢等[21]的方法,采用梯度稀释涂布平板法分离、纯化腐败调味面制品(卫龙小面筋,卫龙食品有限公司)中的霉菌,扩增其18S rDNA 序列,确定霉菌种属。
1.3.4 菌悬液及菌饼的制备 挑取分离、纯化后的霉菌孢子,接种至PDA,28 ℃倒置培养5~7 d后,取一培养好的平板,加入10 mL 无菌水,用涂布器在培养基表面刮取孢子后4 层无菌纱布过滤,转移滤液至10 mL 离心管。震荡后,用血球计数板调整其浓度为106 个/mL。用直径为8 mm 的无菌打孔器取边缘菌块作为菌饼备用[22]。
1.3.5 对菌丝生长的抑制 将ETSG 加入PDA培养基中,倒平板,待其凝固后,将菌饼接种至平板中央。28 ℃培养,每隔24 h 观察,用十字交叉法测量菌落直径。本试验以不加任何抗菌剂为空白对照,以相同浓度的ε-PL 水溶液为阳性对照。按式(1)计算菌丝相对抑制率[23]。

相对抑制率70%以上:较强抑制;相对抑制率40%~70%:中等强度抑制;相对抑制率40%以下:较弱抑制。
1.3.6 对孢子萌发的抑制 摇匀孢子悬浮液(浓度约1×106 个/mL),均匀时吸取100 μL,加入至添加了ETSG 的PDB 培养基中,控制ETSG 浓度分别为0.1%(对应链格孢霉和赭曲霉)和4%(对应土曲霉),以无菌水作空白对照(CK),同浓度的聚赖氨酸水溶液(EPL)作阳性对照。将孢子悬浮液与培养基充分混匀后,放入震荡培养箱培养(28℃,150 r/min)。每隔2 h 观察1 次。待对照组孢子萌发80%以上(芽管长度大于孢子直径时即认为萌发),在40 倍物镜下随机选取10~15 个视野观察,分别记录萌发的孢子数和观察到的孢子总数[24]。按式(2)计算孢子萌发率。
1.3.7 ε-PL 分散的W/O 溶液的应用
1.3.7.1 调味面制品的制作 称取市售牛筋面于70 ℃热水浸泡2.5 min,取出放20 min 沥干,剪碎至均匀大小,将ETSG 分别以质量分数1%,2%比例分散于葵花籽油中,调味粉与油质量比为1∶4制备成辣椒油,按辣椒油∶面筋1∶2 比例将油与面筋搅拌均匀,分装入无菌均质袋中。分别以纯葵花籽油与含活性剂(吐温80+司盘80+无水乙醇+甘油)的葵花籽油加至面筋熟食中,作为空白对照及阳性对照。
1.3.7.2 调味面制品菌种接种 采用链格孢霉T5A、赭曲霉9F 混合菌种接种,分别制备菌悬液并混合均匀,加入成品中拌匀,使最终接种的霉菌孢子量为103 个/g,装入无菌袋后密封,置25 ℃的恒温箱中储存,待对照组发生变质时,进行霉菌菌落计数。
1.3.7.3 霉菌菌落计数 分别切取10 g 不同的调味面制品样品,加入90 mL 生理盐水,于均质机中振荡均匀,取1 mL 进行10 倍稀释制成不同浓度梯度的菌液,每个样品选取2~3 个梯度。采用倾注法,于每个梯度中分别取出1 mL 至平板中心,倒入40 ℃的PDA 培养基,轻轻晃动使菌液均匀分布,待平板凝固后,置28 ℃培养箱中培养48 h,测定并记录菌落数。
1.3.8 数据统计分析 以上试验均至少重复测定3 次。全部数据采用Excel 2007 计算平均值及标准偏差,Origin 2021 软件进行作图,SPSS 25 对结果进行显著性分析。
2 结果与分析
2.1 ETSG 的制备
活性剂相与水相以不同比例混合,制得的ETSG 如图1a 所示。当活性剂相与水相比例为3∶1,2∶1 和1∶1 时,混合溶液出现明显分层现象,底部为凝胶状,不易流动。当比例为1∶2,1∶3,1∶4 和1∶5 时,混合溶液均保持透明、流动性好。25 ℃静置12 h 出现分层,使用时轻微晃动即可混合均匀。这可能与两种乳化剂复配后的HLB 值有关,吐温80 的HLB 值为15,司班80 的HLB 值4.3,两者按质量比1 ∶1 混合后,混合乳化剂理论总HLB 值在9.7 左右[25],有一定量的亲水基团,不能完全与水互溶。随着加水量的增加,存在一个转相过程,此时黏度会迅速增大,形成凝胶状,是大多非离子表面活性剂与水混溶时的普遍现象[26]。这可能是因为表面活性剂在体系中的浓度达到一定水平后,吸附的表面活性剂分子或离子已布满表面,而分散在体相外的多余分子或离子,为降低在环境中的表面能和分子间引力,相互聚集形成聚集体。继续选取活性剂相与水相比例为1∶1.25,1∶1.5,1∶1.75 配制溶液,3 种比例配制的ETSG 均没有出现底部凝胶沉淀,透明、流动性好,静置12 h分层,轻微晃动可均匀混合。

图1 不同比例ETSG 的流动性(a)、在葵花籽油中的增溶效果(b)以及在不同植物油中的溶解性(c)
Fig.1 The fluidity of different proportions of ETSG(a),the solubilization effect in sunflower oil(b)and the solubility in different vegetable oils(c)
2.2 ETSG 在油中的分散性
将(1 ∶1.25)~(1 ∶2)的ETSG 分别以1%,2%,3%(质量分数)的添加量加入葵花籽油后,于25℃静置24 h,观察其溶解情况。在油中24 h 后的分散相行为如图1b 所示。ETSG 的添加量为1%时,1∶1.25,1∶1.5 和1∶1.75 的比例均可在油中均匀分散,油溶液具有一定的透明度。当活性剂相与水相为1∶2 时,ETSG 添加量为1%时,油溶液也具有一定的透明度,然而,底部存在未溶解的水溶液小液滴。当添加量为2%时,1∶1.25 的混溶液可在油中较好地分散,其它3 种比例的油在底部沉积了未溶解的水溶液液滴,无明显的絮状沉淀。当添加量为3%时,4 种比例的ETSG 均在油中底部出现水溶液液滴的沉积,溶液不透明。
最终选取1∶1.25 的ETSG,考察其在不同植物油中的分散情况。由图1c 可知,该制剂的添加量为1%时,在葵花籽油、橄榄油中均可均匀分散,整个体系具有较好的透明性;在花生油和大豆油中,离心管底部有微量未溶解的水溶液液滴沉积。当添加量为2%时,混溶液在葵花籽油和橄榄油中仍分散均匀,溶液呈半透明状,在大豆油和花生油中小部分制剂沉积在底部,未能分散。当添加量增加至3%时,在所有植物油中均出现底部分层现象,不能均匀分散在油中。
2.3 优势腐败霉菌的分离纯化及鉴定
根据不同霉菌在培养基上的生长速度、菌落颜色及形状均不相同,对霉菌进行初步鉴定(表1,图2b)。对腐败霉菌个体形态观察可知,所分离的菌株大小符合霉菌的大小及形态(图2c)。采用18S rDNA 测序对其进行鉴定,3 株菌株的总DNA为模板的18S rDNA 条带明亮、清晰,无非特异性扩增(图2a)。根据生工生物工程股份有限公司的测序结果,在NCBI 网站内进行同源序列比对。根据同源性分析结果,选择同源性较高的不同参考菌株的序列,使用软件 Mega7.0,运用Neighbor-Joining 法构建系统发育树,结果显示菌株M-A1与链格孢霉T5A 十分相近,菌株M-A2 与赭曲霉9F 序列同源性最高,M-A3 与土曲霉YS-1-1 最为相似(表2)。
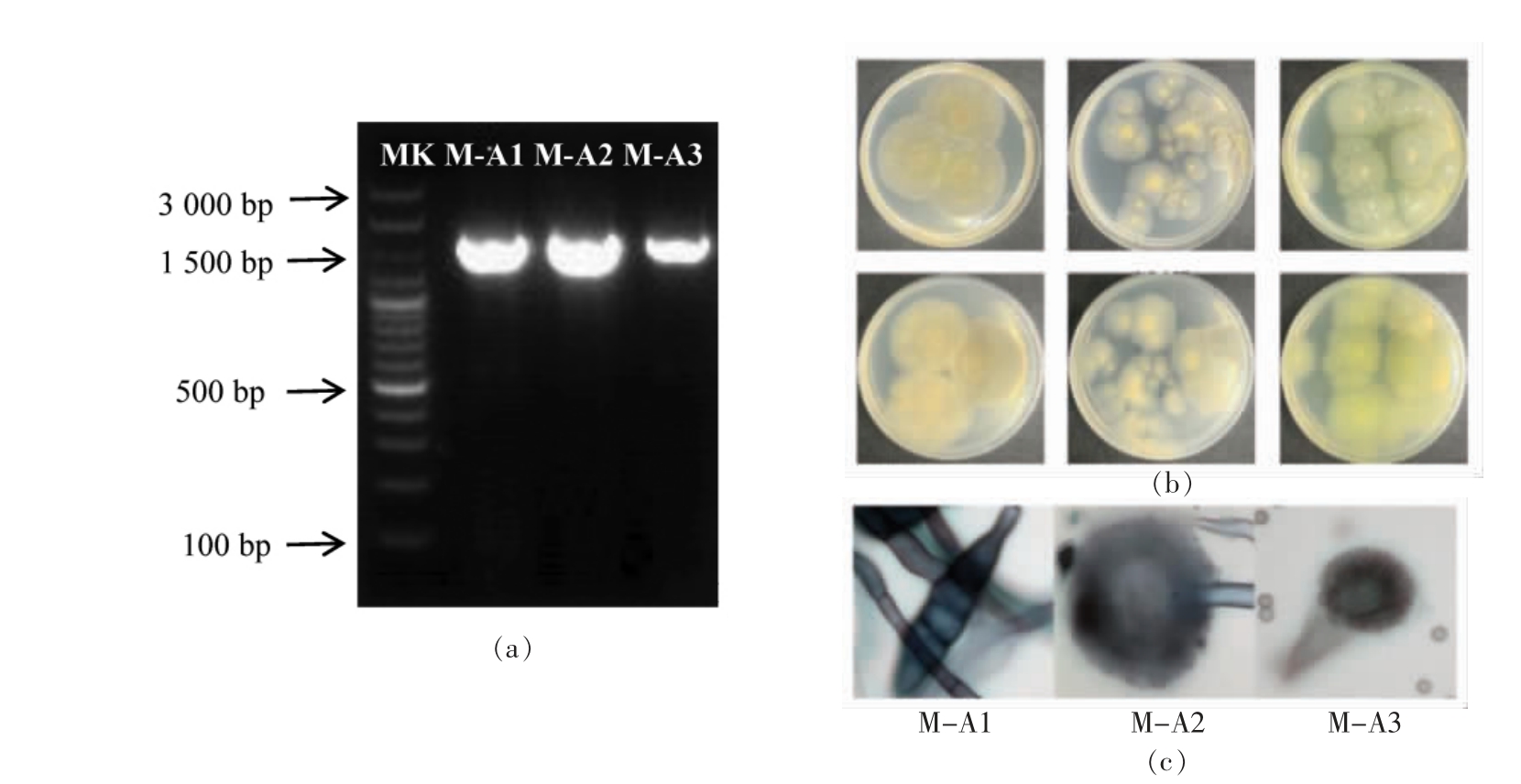
图2 试验菌株18S rDNA 基因PCR 扩增产物电泳图谱(a)、调味面制品腐败霉菌菌落(正面和反面)(b)和调味面制品腐败霉菌个体形态(c)
Fig.2 Electrophoretogram of PCR amplified product of 18S rDNA of test stains(a)、colony of the spoilage molds(front and back)(b)and morphology of the spoilage moulds in spicy gluten(c)
注:MK 表示marker,M-A1 表示链格孢霉T5A,M-A2 表示赭曲霉9F,M-A3 表示土曲霉YS-1-1。
表1 优势腐败霉菌菌落和细胞形态
Table 1 Colony and cell morphology of the spoilage moulds from spicy gluten

表2 调味面制品中腐败菌鉴定结果
Table 2 Microbial species identification after sequencing of spoilage bacteria in in spicy gluten

2.4 ETSG 对霉菌抑菌浓度的筛选
ETSG 对链格孢霉和赭曲霉的抑制效果好于土曲霉(图3,图4)。当ETSG 在培养基中体积分数为0.2%时,在5 d 生长期内可完全抑制赭曲霉的菌丝生长;体积分数为0.5%时,生长期内对链格孢霉的菌丝生长的相对抑制率在98%以上。然而,ETSG 对土曲霉的抑制率较低,在培养基中体积分数为8%时,培养期内对其菌丝生长的相对抑制率在95%以上。

图3 ETSG 对生长5 d 的霉菌菌丝生长相对抑制率的影响
Fig.3 Effect of ETSG on relative inhibitory rate of mycelium growth of mold growing for 5 d

图4 ETSG 对霉菌菌落形态的影响
Fig.4 The effect of ETSG on mold colony morphology
2.5 ETSG 对霉菌直径生长和孢子萌发的抑制
选取ETSG 对3 株霉菌的亚致死浓度,计算其中ε-PL 的浓度。制备同等浓度的ε-PL 水溶液(EPL),对比ETSG、ε-PL 水溶液(EPL)及空白对照(CK)的霉菌菌丝生长情况。结果表明,ETSG 与EPL 均对3 株霉菌生长有显著的抑制作用(P<0.05),且两组处理的菌落直径均无显著差异(P<0.05)(图5a)。表明加入表面活性剂和辅助剂对ε-PL 的抑菌活性无影响。0.1%的ETSG 处理培养5 d 后,链格孢霉和赭曲霉的菌落直径显著低于对照组83.44%和45.21%(P<0.05),经4%的ETSG处理培养5 d 后土曲霉的菌落直径显著低于对照组39.64%(P<0.05)。孢子萌发抑制结果如图5b 所示,体积分数0.1%的ETSG 处理使链格孢霉与赭曲霉的孢子萌发率分别从87.07%和85.01%降至1.91%和1.84%,体积分数4%的ETSG 处理使土曲霉的孢子萌发率从90.27%降至4.16%,显著抑制了土曲霉的孢子萌发。这可能是因为ε-PL 是带阳离子的聚合物,与微生物细胞膜表面的阴离子通过静电相互作用,破坏了细胞膜的完整性,导致胞内物质泄漏,形成空腔,ε-PL 进入细胞,与线粒体、细胞核膜结合,导致线粒体嵴模糊,细胞核消失,造成细胞代谢紊乱,使霉菌彻底死亡[27-28]。综上,ETSG 对链格孢霉和赭曲霉的菌丝和孢子抑制效果优于土曲霉,可能是因为土曲霉与抑菌剂间的静电结合效果弱,需要更多的抑菌剂才能达到相同的抑制效果。
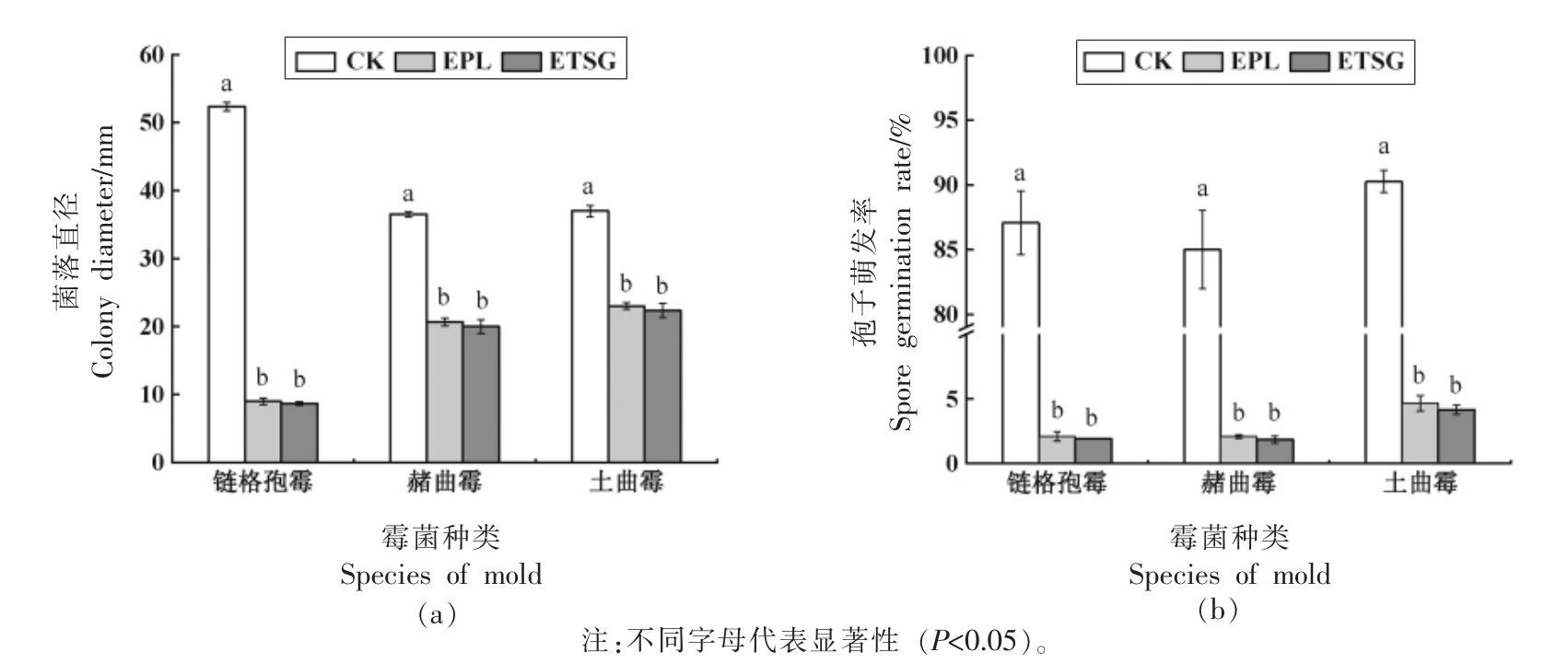
图5 抑菌剂对链格孢霉、赭曲霉、土曲霉的菌落直径(a)和孢子萌发率(b)的影响
Fig.5 Effect of bacteriostatic agent on the colony diameter(a)and spore germination rate(b)of A.sp.,A.ochraceus and A.terreus.
两种处理对3 种霉菌孢子萌发均有显著的抑制效果(P<0.05),与对菌丝生长的抑制效果相似。对3 株霉菌的孢子萌发抑制,两种处理组的抑制效果无显著差异(P<0.05),说明本试验所选油水混溶剂及辅助混溶剂,不影响ε-PL 水溶液对这3株霉菌孢子萌发的抑制效果。可见,所制备的ETSG 预混溶液不仅提高了ε-PL 在油中的增溶,而且未影响ε-PL 对霉菌孢子萌发的抑制效果。
2.6 ETSG 分散的W/O 油溶液的抑菌性
为验证ETSG 在油中分散后的抑菌效果,自制调味面制品,将链格孢霉和赭曲霉的菌悬液混合接种于调味面制品上,接种的总霉菌孢子量为103 个/g。将所有样品置于28 ℃培养箱中直到对照组变质。结果发现,空白对照组、未加ε-PL 的阳性对照组在接种3 d 后发生胀袋现象(图6),并伴有明显的腐败酸臭味。对不同处理后面筋熟食中的霉菌菌落进行计数(表3)。结果表明,处理组的霉菌菌落总数显著降低,且ETSG 浓度越大,菌落总数越少。2%的ETSG 处理后,菌落总数比对照组减少了62.5%。由此可知,ETSG 在油中分散后,对霉菌仍有显著的抑制效果。
表3 预混溶液分散后的油对调味面制品中霉菌菌落总数的影响
Table 3 Effect of ETSG-dispersed oil on the total number of mold colonies in spicy gluten


图6 接种霉菌的自制调味面制品放置3 d 的形态
Fig.6 Photos of homemade spicy gluten with molds for 3 d
3 结论
本文制备了无沉淀且透明稳定的ε-PL 与低表面活性剂的预混溶液(ETSG),解决了ε-PL 的油难溶性问题,并从腐败面筋熟食中分离出3 株腐败菌,分别为链格孢霉T5A、赭曲霉9F 和土曲霉YS-1-1。体外抑菌试验证明ETSG 可显著抑制3 株霉菌的菌丝生长和孢子萌发,体内抑菌试验表明ETSG 分散后可显著降低调味面筋制品中的霉菌菌落总数。即在增大了ε-PL 油溶性的同时,也完全保留了ε-PL 的抑菌性质。本研究可为ε-PL 的实际应用提供理论依据。
[1] ZHOU R,SUN J,QIAN H,et al.Effect of the frying process on the properties of gluten protein of you-tiao[J].Food Chemistry,2019,310:125973.
[2] OUDJEDI K,MANSO S,NERIN C,et al.New active antioxidant multilayer food packaging films containing Algerian Sage and Bay leaves extracts and their application for oxidative stability of fried potatoes[J].Food Control,2019,98:216-226.
[3] FALLEH H,JEMAA M B,SAADA M,et al.Essential oils:A promising eco-friendly food preservative[J].Food Chemistry,2020,330:127268.
[4] CAO Y,LIU H,QIN N,et al.Impact of food additives on the composition and function of gut microbiota:A review[J].Trends in Food Science &Technology,2020,99:295-310.
[5] CHUNG D H,TAE J C,&MIN S R.Citrus fruit extracts with carvacrol and thymol eliminated 7-log acid-adapted Escherichia coli O157:H7,Salmonella typhimurium,and Listeria monocytogenes:A potential of effective natural antibacterial agents[J].Food Research International,2018,107:578-588.
[6] HARICH M,MAHERANI B,SALMIERI S,et al.Evaluation of antibacterial activity of two natural bio-preservatives formulations on freshness and sensory quality of ready to eat(RTE)foods[J].Food Control,2018,85:29-41.
[7] NISHIKAWA M,OGAWA K I.Distribution of microbes producing antimicrobial Ε-poly-l-lysine polymers in soil microflora determined by a novel method[J].Applied and Environmental Microbiology,2002,68(7):3575-3581.
[8] YAN Y H,LI Y Z,ZHANG Z W,et al.Advances of peptides for antibacterial applications[J].Colloids and surfaces B:Biointerfaces,2021,202:111682.
[9] SHIH I L,SHEN M H,VAN Y T.Microbial synthesis of poly(ε-lysine)and its various applications[J].Bioresource Technology,2006,97(9):1148-1159.
[10] QIAN Y F,CHENG Y,YE J X,et al.Targeting shrimp spoiler Shewanella putrefaciens:Application of ε-polylysine and oregano essential oil in Pacific white shrimp preservation[J].Food Control,2021,123:107702.
[11] FAN K,ZHANG M,BHANDARI B,et al.A combination treatment of ultrasound and ε-polylysine to improve microorganisms and storage quality of fresh-cut lettuce[J].LWT-Food Science and Technology,2019,113:108315.
[12] LI Y N,YE Q Q,HOU W F,et al.Development of antibacterial ε -polylysine/chitosan hybrid films and the effect on citrus[J].International Journal of Biological Macromolecules,2018,118:2051-2056.
[13] YE R S,XU H Y,WAN C X,et al.Antibacterial activity and mechanism of action of ε-poly-l-lysine[J].Biochemical and Biophysical Research Communications,2013,439(1):148-153.
[14] ALIREZALU K,MOVLAN H S,YAGHOUBI M,et al.ε-Polylysine coating with stinging nettle extract for fresh beef preservation[J].Meat Science,2021,176:108474.
[15] GE Y,WEI M,LI C,et al.Reactive oxygen species metabolism and phenylpropanoid pathway involved in disease resistance against Penicillium expansum in apple fruit induced by ε-poly-L-lysine[J].Journal of the Science of Food and Agriculture,2018,98(13):5082-5088.
[16] LUZ C,CALPE J,SALADINO F,et al.Antimicrobial packaging based on -polylysine bioactive film for the control of mycotoxigenic fungi in vitro and in bread[J].Journal of Food Processing &Preservation,2018,42(1):e13370.
[17] SHAO Z P,YANG Y,FANG S,et al.Mechanism of the antimicrobial activity of whey protein -ε -polylysine complexes against Escherichia coli and its application in sauced duck products[J].International Journal of Food Microbiology,2020,328:108663.
[18] BUDKOV Y A,KOLESNIKOV A L,GEORGI N,et al.A statistical theory of cosolvent -induced coil-globule transitions in dilute polymer solution[J].Journal of Chemical Physics,2014,141(1):148.
[19] KINOSHITA M,HAYASHI T.Entropic enrichment of cosolvent near a very large solute immersed in solvent-cosolvent binary mixture:Anomalous dependence on bulk cosolvent concentration[J].Journal of Molecular Liquids,2017,247:403-410.
[20] 陈雪莲.无表面活性剂微乳及其温度响应的研究[D].无锡:江南大学,2020.
CHEN X L.Study on surfactant-free microemulsions and their temperature-responsiveness[D].Wuxi:Jiangnan University,2020.
[21] 徐文欢,吴若菡,李采婵,等.传统虾酱中酵母菌分离鉴定及碳源利用特性[J].中国食品学报,2021,21(4):303-309.
XU W H,WU R H,LI C C,et al.Isolation and identification of yeast in traditional shrimp paste and utilization characteristics of carbon source[J].Journal of Chinese Institute of Food Science and Technology,2021,21(4):303-309.
[22] 王斌,姜红,韩占红,等.采前硝普钠喷洒增强厚皮甜瓜果实的采后抗病性[J].果树学报,2019,36(11):108-115.
WANG B,JIANG H,HAN Z H,et al.Pre-harvest sodium nitroprusside sprays enhance resistance against diseases in harvested muskmelons[J].Journal of Fruit Science,2019,36(11):108-115.
[23] MARIANA A,KARAU M J,SCHUETZ A N,et al.Comparison of agar dilution to broth microdilution for testing in vitro activity of cefiderocol against gram-negative Bacilli[J].Journal of Clinical Microbiology,2020,59(1):e00966-20.
[24] LEEUWEN M V,KRIJGSHED P,WYATT T T,et al.The effect of natamycin on the transcriptome of conidia of Aspergillus niger[J].Studies in Mycology,2013,74(1):71-85.
[25] 黄芬,唐年初,郭贯新,等.食品级大豆油W/O 微乳的制备研究[J].食品工业科技,2010,31(2):230-232,235.
HUANG F,TANG N C,GUO G X,et al.Preparation of food-grade soybean oil microemulsion[J].Science and Technology of Food Industry,2010,31(2):230-232,235.
[26] 张彩虹,黄立新,谢普军,等.三种乳化剂对橄榄油乳液稳定性的影响[J].中国油脂,2021,46(3):28-33,47.
ZHANG C H,HUANG L X,XIE P J,et al.Effects of three emulsifiers on the stability of olive oil emulsion[J].China Oils and Fats,2021,46(3):28-33,47.
[27] 孟岳成,王欣伟,李延华,等.ε-聚赖氨酸对黄曲霉的作用机制初探[J].食品科技,2016,41(12):239-244.
MENG Y C,WANG X W,LI Y H,et al.Preliminary study on the mode of action of ε-polylysin against Aspergillusflavus[J].Food Technology,2016,41(12):239-244.
[28] HYLDGAARD M,MYGIND T,VAD B S,et al.The antimicrobial mechanism of action of epsilonpoly-l-lysine[J].Applied and environment microbiology,2014,80(24):7758-7770.