黑果花楸(Sorbus melanocarpa),蔷薇科,花楸属灌木,耐寒,喜潮湿环境、喜阳光。果实为紫黑色,球状,黑色果肉,味苦涩,含有膳食纤维、蛋白质、多酚等营养物质[1],是广泛用于食品、保健品、药品开发及天然色素提取的原料[2]。在国外,黑果腺肋花楸已产业化发展,花楸被制成各种商品,如果酒、果酱等,甚至作为观赏性植物,获得了巨大的经济效益,而在我国鲜为人知,花楸商品更是屈指可数,其中的功能性成分更是未被利用。花色苷作为其中的主要功能性物质,属黄酮类物质,是一种天然色素,具有抗氧化[3]、降血脂[4]、抗衰老等多种功效[5]。花色苷为众多浆果的主要功效成分,不仅是天然色素,还具有多种保健作用[6],如抗炎、抗癌等。研究表明,天然植物成分花青素可以抑制MLK3 的激活及其下游的JNK 和p38MAPK 信号级联;可以通过下调Th2 细胞因子、促炎细胞因子和COX-2 来减轻哮喘的发展;花色苷还可以通过与丝裂原活化蛋白激酶和NF-κB 信号通路相互作用而激活NRF2,从而调节氧化应激,抑制细胞凋亡,显著抑制高糖引起的内皮细胞中ROS 的升高,同时抑制抗氧化活性酶的降低。然而,花色苷易降解,且脂溶性差[7],使其应用受限[8-9]。在人体消化时,因无法通过磷脂双分子层被细胞吸收,故生物利用度也不高[10]。上述缺点极大地影响花色苷在食品、药品等领域的开发利用。这些问题亟待解决。
纳米微胶囊技术是对囊核物质进行纳米级包裹的新型技术[11]。纳米微胶囊粒子能够达到纳米水平,一般在1~1 000 nm,其颗粒微小,易于分散,溶解度及稳定性等性能均比普通胶囊更加优越[12]。利用纳米微胶囊技术对花色苷进行包封,能够显著提高其稳定性。壁材的选择对纳米微胶囊有极大的影响。壳聚糖又被称为乙酰甲壳素,具有优良的生物可接受性、生物可降解性[13],无毒、安全性等特点[14]。γ-聚谷氨酸是一种具有较好的吸附性、保水性和生物相容性及可降解等特点的绿色环保型阴离子天然聚合材料[15],经pH 驱动可与壳聚糖形成纳米粒[16]。如潘飞等[17]用壳聚糖和γ-聚谷氨酸对黑米花色苷进行包埋,制备纳米粒,结果表明包埋后缓释性增强。贺博[18]采用壳聚糖包埋蓝莓花色苷,稳定性显著提高,释放率明显降低。Mudasir 等[19]采用淀粉基纳米颗粒进行纳米封装,可保护儿茶素免受恶劣胃环境的影响,并有助于在体外消化过程中保持其生物活性。Shori 等[20]用海藻酸钠代替益生菌,用壳聚糖封装,提高了其在低酸环境下的稳定性,有助于益生菌菌株在酸性环境中的存活率。
本文从黑果腺肋花楸中提取花色苷,通过大孔树脂吸附纯化,冷冻干燥制备花色苷。以壳聚糖和γ-聚谷氨酸为壁材,对花楸花色苷进行纳米微胶囊化,使用pH 示差法分析花色苷含量。通过单因素实验和响应面试验,确定纳米微胶囊的最佳制备条件。对花色苷纳米粒粒径、Zeta 电位及微观结构进行表征。
1 材料与方法
1.1 材料与试剂
黑果腺肋花楸冻果,辽宁省海城市。壳聚糖(脱乙酰度≥95%),上海源叶生物科技有限公司;γ-聚谷氨酸(分子量>700 000),上海易恩化学技术有限公司;吐温80,上海易恩化学技术有限公司;冰乙酸(99.5%),天津福晨化学试剂有限公司。其它试剂均为国产分析纯级。
1.2 仪器与设备
MS204S/01 型电子天平,梅特勒-托利多仪器(瑞士)有限公司;可见分光光度计(V-5100),武汉高精密科学仪器有限公司;酸度计,上海精密科学仪器有限公司;激光衍射粒度分析仪(LA-920型),北京掘场汇博隆精密仪器有限公司;Zeta 电位分析仪,麦克默瑞提克(上海)仪器有限公司;热电磁力搅拌器,上海巴玖实业有限公司;数控超声波清洗器(KQ5200DB 型),昆山市超声仪器有限公司;高速冷冻离心机,日本Koki 控股有限公司;EYELA 真空冷冻干燥机(FDU-1200),北京五洲东方科技发展有限公司;
1.3 方法
1.3.1 黑果腺肋花楸花色苷纳米微胶囊的制备分别称取5,10,15,20 mg 和25 mg 壳聚糖(Chitosan,CS)溶化在10 mL 1%冰醋酸水溶解液中,搅动2 h 使其充分溶解至无沉淀,精密吸取20 mL壳聚糖溶解液于烧杯中,加入花色苷和20 mL 的吐温80 乳化剂,搅动1 h,用1 mol/L Na(OH)调节溶液pH 值至4.5,加入20 mL 聚谷氨酸(Polyglutamic acid,PGA)溶液,调整CS ∶PGA 比例为1 ∶1,2∶1,3∶1,4∶1 和5 ∶1,滴加完毕后适当搅拌(此过程需在避光环境下操作)。
1.3.2 花色苷提取率的测定 采用pH 示差法测定提取率,吸取1 mL 旋转蒸发得到的浓缩液样品,加入提前配好的pH 1.0 的氯化钾缓冲液和pH 4.5 的无水乙酸钠缓冲溶液,然后,将该样品溶液稀释200 倍,用分光光度计测定A510nm 和A700nm。花色苷含量计算公式:
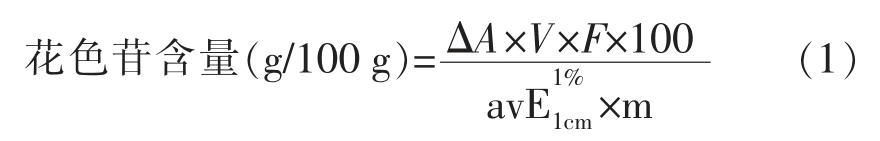
式中:ΔA=(A510nm -A700nm)pH1.0 -(A510nm -A700nm)pH4.5;V——花色苷样品体积,mL;F——稀释倍数;![]() ——平均消光系数,为98.2;m——花楸样品质量,g。
——平均消光系数,为98.2;m——花楸样品质量,g。
1.3.3 包埋率的计算 将制备的花色苷纳米悬浮液12 000 r/min 离心30 min,收集上清。根据内源乳化法[21]测定包埋前、后分离液的吸光度,花色苷包埋率计算公式:
式中:A1——包埋前分离液的吸光度;A2——包埋后分离液的吸光度。
1.3.4 单因素实验 为考察单一因素对黑果腺肋花楸花色苷纳米微胶囊包埋率的影响,在其它条件相同的情况下,分别选择不同添加量(25,30,35,40,45 mg)的花色苷提取物,不同壳聚糖质量浓度(0.5,1,2,3,4 mg/mL),不同CS ∶PGA 质量比(1∶1,2∶1,3∶1,4∶1,5∶1)和不同搅拌时间(15,30,45,60,75 min)进行研究。
1.3.5 响应面试验设计 经单因素实验分析(spss22.0),选取对纳米微胶囊包埋率影响较大的因素——花色苷添加量(A)、壳聚糖浓度(B)和搅拌时间(C),进行响应面试验条件优化设计,见表1。
表1 响应面试验因素水平设计
Table 1 Response surface test factor level design

1.4 结构表征
1.4.1 粒径及分布情况测定 用LA-920 激光粒度分析仪分析黑果腺肋花楸花色苷纳米微胶囊粒径和分布。
1.4.2 Zeta 电位分析 取定量稀释至一定倍数的黑果腺肋花楸花色苷纳米悬浮液,采用Zeta 电位分析仪测定25 ℃溶液状态下纳米粒的表面电位(Zeta),测定3 次,取平均值。
1.4.3 扫描电镜观察 通过扫描电镜观察黑果腺肋花楸花色苷纳米微胶囊的形貌。先将样品干燥处理,然后置导电胶上,喷金,加速电压为240 kV,于400 倍镜下拍照。
2 结果与分析
2.1 单因素实验结果
2.1.1 花色苷添加量对纳米微胶囊包埋率的影响
由图1 可知,花色苷添加量在25~35 mg 时,包埋率呈上升趋势;花色苷添加量大于35 mg 时包埋率开始降低,其峰值为35 mg,此时包埋率为53.3%。当花色苷添加量低于35 mg 时,芯材与壁材比例较小,未达到饱和,造成壁材的浪费;当花色苷添加量过大时,其包埋率呈下降趋势。这可能是受提取物中电解质的影响,随着花色苷浓度的增大,电解质杂质增多,电解质的静态介电常数降低,离子间的静电相互作用随浓度的增加而增加,促进了离子聚集体的形成,不利于花色苷的均匀分散,导致包埋率降低[18]。最终选择35 mg 为最佳花色苷添加量。
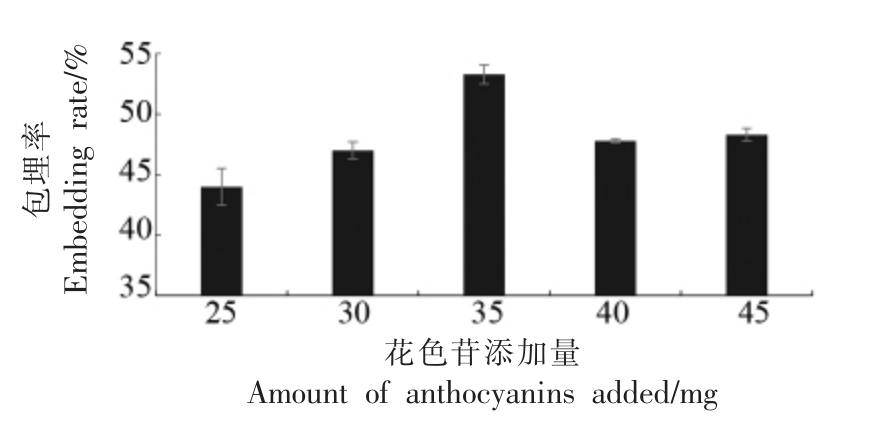
图1 花色苷添加量对包埋率的影响
Fig.1 The effect of the amount of anthocyanin extract on the embedding rate
2.1.2 壳聚糖浓度对纳米微胶囊包埋率的影响由图2 可知,壳聚糖质量浓度在0.5~2.5 mg/mL 之间,随浓度的增大包埋率先升后降,当壳聚糖浓度为1.5 mg/mL 时包埋率达到最大值50.2%。随着壁材壳聚糖浓度的增大,有利于芯材的包埋,可以适当增大包埋率。但当浓度过大时用于包埋芯材的凝胶状结构的空间体积会被壳聚糖侵占,而且过量的壳聚糖在溶液中可能会发生团聚现象,形成絮状沉淀,因此会伴随着粒径增大、包埋率降低等问题的出现[22]。因此最佳的壳聚糖质量浓度为1.5 mg/mL。
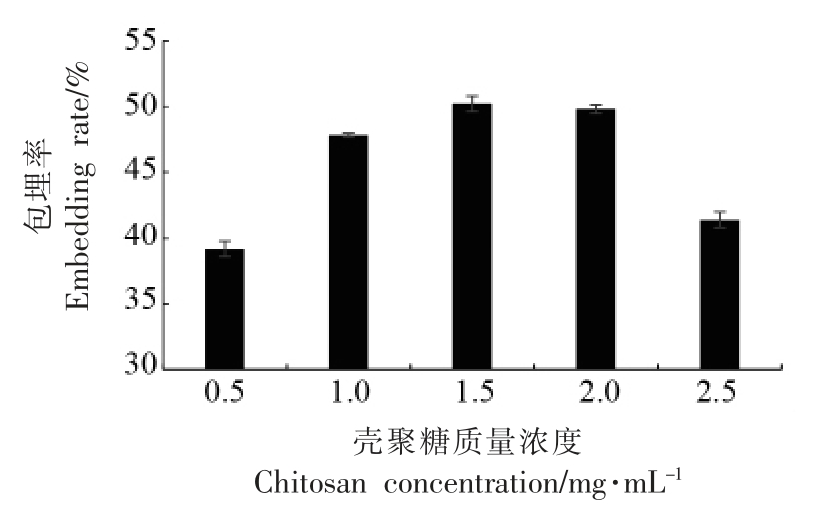
图2 壳聚糖质量浓度对包埋率的影响
Fig.2 The effect of chitosan concentration on the embedding rate
2.1.3 壳聚糖∶聚谷氨酸(CS∶PGA)质量比对纳米微胶囊包埋率的影响 CS ∶PGA 质量比对包埋率影响见图3,当CS∶PGA 质量比为2∶1 时包埋率达到最大值47.8%,整体呈先升后降的趋势,这与壳聚糖浓度的影响相同。纳米微胶囊是带正电的壳聚糖阳离子与带负电的γ-聚谷氨酸阴离子在适宜的pH 下形成稳定的纳米粒,两种离子交联的强度对微胶囊的形成具有十分重要的影响,合适的CS ∶PGA 质量比不仅能提高其交联强度,还能提高体系的稳定性,对包封率和性能造成直接影响[23]。最优的CS∶PGA 质量比为2∶1。
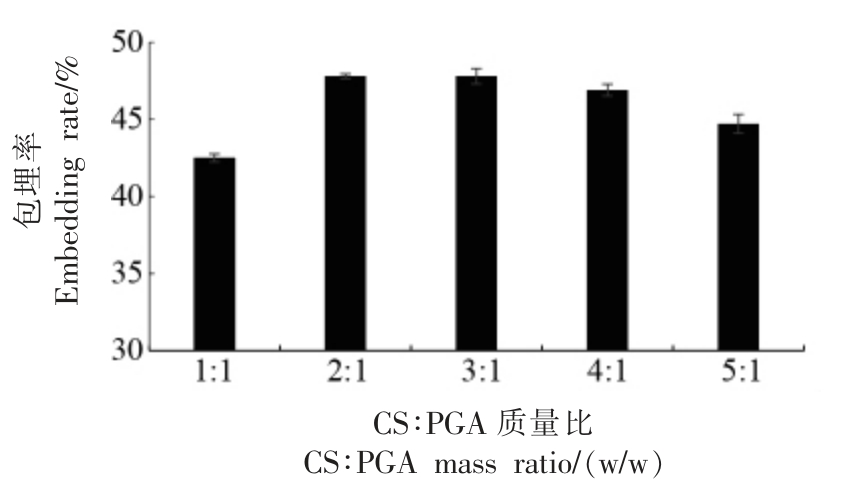
图3 CS∶PGA 质量比对包埋率的影响
Fig.3 The influence of CS∶PGA quality ratio on the embedding rate
2.1.4 搅拌时间对花楸花色苷纳米微胶囊包埋率的影响 由图4 可知,搅拌初期包埋率增大,后期开始下降,在60 min 时出现峰值。这是因为壁材与芯材的包埋是一个动态过程,溶质的分散程度对包埋率和粒径有重要影响。溶质的分散可以通过搅拌来实现,适当的搅拌时间有利于花色苷的包埋,这是因为搅拌使溶液中的溶质分散均匀,形成的纳米粒粒径较为均一。如搅拌时间过短,溶质不能均匀分散,造成包埋率较低。如搅拌时间过长时,可能因碰撞和聚集等行为破坏已成型的纳米粒结构,造成芯材的泄露。选择最优的搅拌时间为60 min。
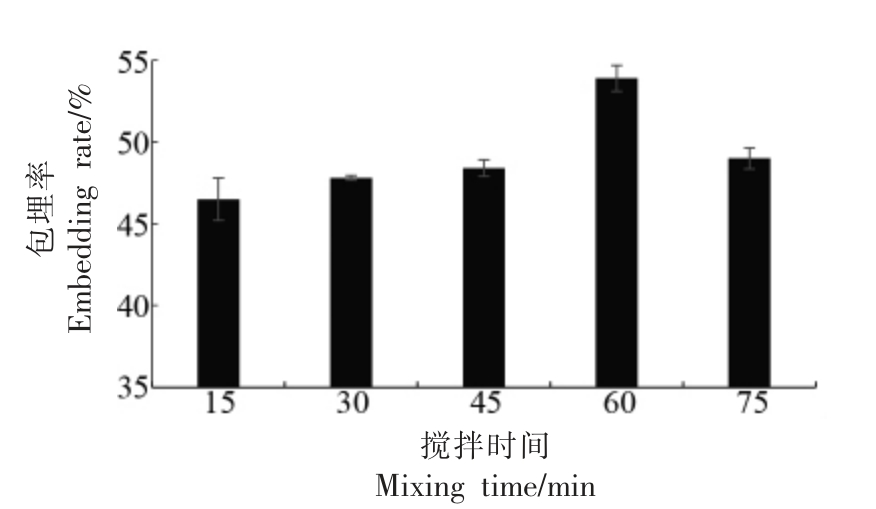
图4 搅拌时间对包埋率的影响
Fig.4 The influence of mixing time on the embedding rate
综上,从4 个单因素来看,CS∶PGA 质量比对包埋率的影响相对较小,而花色苷添加量、壳聚糖浓度和搅拌时间对包埋率影响显著。后续试验将CS∶PGA 质量比2∶1 作为固定参数,对其包埋条件进一步优化。
2.2 响应面优化试验
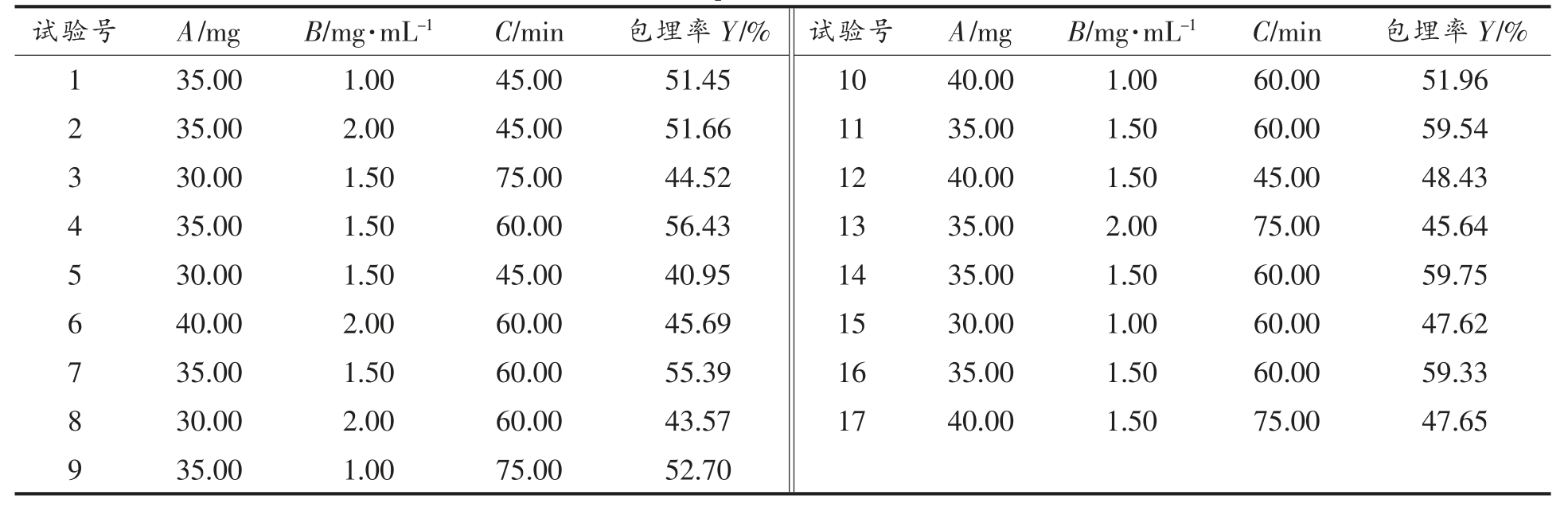
2.2.1 响应面结果与分析 根据单因素实验结果,以花色苷添加量(A)、壳聚糖浓度(B)、搅拌时间(C)为自变量,包埋率(Y)为因变量做响应面试验。利用Design-Expert 软件设计响应面试验,结果见表2。
表2 响应面试验结果
Table 2 Response surface test results
采用Design Expert 软件对表2 数据进行多元回归拟合,得到花色苷添加量、壳聚糖浓度和搅拌时间与包埋率的二次多项回归模型方程为:
Y =58.09+2.13A-2.15B-0.25C-0.55AB-1.09AC-1.82BC-7.93A2-2.95B2-4.77C2。
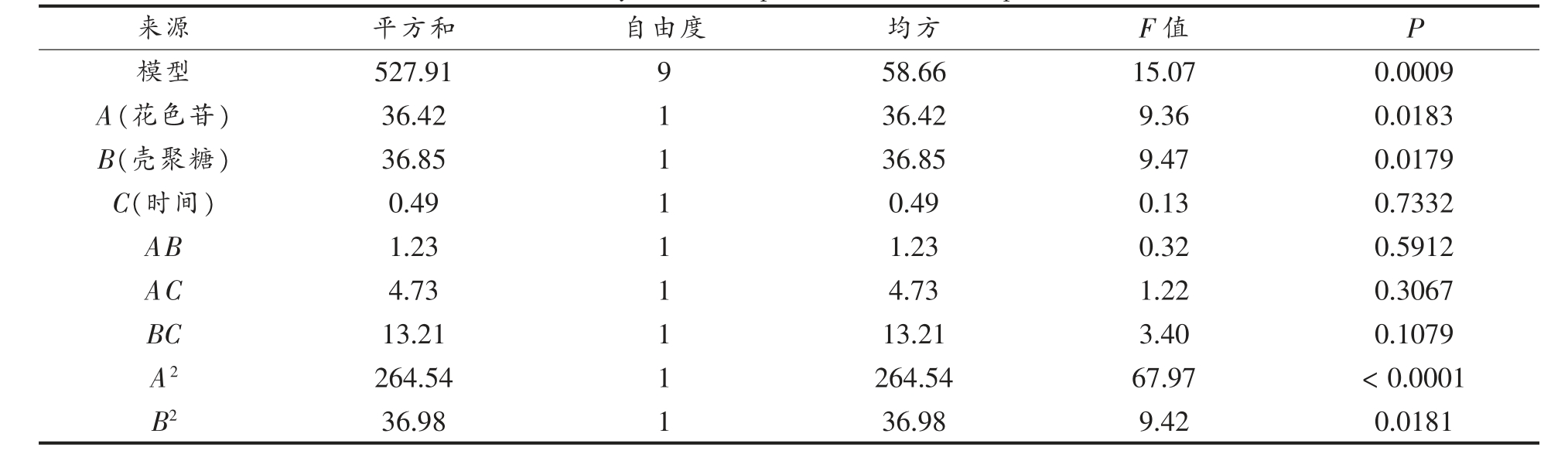
由表3 可知,回归模型差异极显著(P<0.01),失拟项P 值为0.5243,失拟项不显著(P>0.05),说明拟合充分。R2=0.9509,表明模型拟合程度好,能预测其响应值,可用该方程预测包埋率,该试验的变异系数和信噪比均符合要求。一次项A、B 对包封率影响显著(P<0.05),一次项C 对包埋率影响不显著(P>0.05);二次项中A2、B2、C2 3 个均显著,且A2 极显著(P<0.01);交互相AB、AC、BC 3 个均不显著(P>0.05)。可以看出这些因素对纳米微胶囊包埋率的影响程度不同,其中二次项A2 对纳米微胶囊包埋率影响较大。通过条件优化可生产出粒径小而包埋率高的纳米微胶囊。工艺参数对粒径和包封率影响大小排序为A>B>C。
表3 独立变量响应面模型方差分析
Table 3 Variance analysis of independent variable response surface model
(续表3)
采用Design-Expert 8.0 软件,绘制3 个因素对黑果腺肋花楸花色苷纳米微胶囊包埋率影响的等高线和响应面分析图(图5)。
图5a 是AB 交互作用的关系图,从等高线的变化规律也可看出,在花色苷提取物的添加量和壳聚糖浓度均处于较高水平时包埋率最大,而当一个因素保持在水平的较小值时,增加另一个变量也能使包埋率提高。
图5b 是AC 交互作用的关系图,可以看出当花色苷添加量接近34 mg,搅拌时间接近57 min时,黑果腺肋花楸花色苷纳米微胶囊的包埋率最高,随着这两个参数的增大,坡度变缓,且等高线图呈圆形,表明响应值对此交互作用不敏感,这与表3 分析一致,两者的交互作用不显著。
图5c 是BC 交互作用的相关图形,与其它两个图相比,其坡度最为陡峭,黑果腺肋花楸花色苷包埋率的变化区间较小,说明这两者间的交互作用最为强烈。
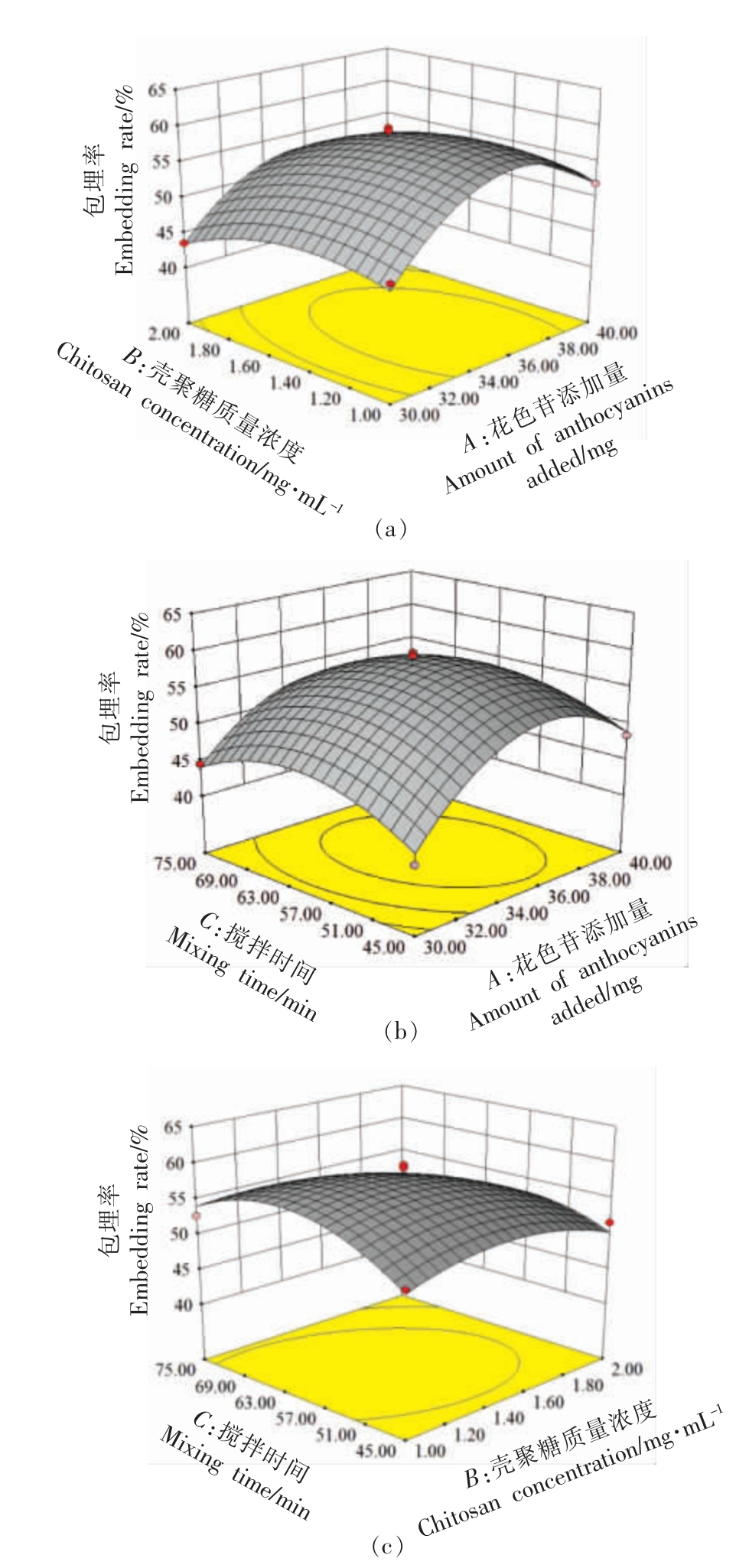
图5 花色苷添加量(a)、壳聚糖浓度(b)、搅拌时间(c)交互作用对黑果腺肋花楸花色苷纳米微胶囊包埋率影响的等高线及响应曲面
Fig.5 Contour lines and response surface of the effect of the interaction of the amount of anthocyanin extract(a),chitosan concentration(b),and stirring time(c)on the embedding rate of Sorbus melanocarpa anthocyanin nanocapsules
曲面图越陡,相互作用越强;越平坦,相互作用越弱。从响应面图可以看出。黑果腺肋花楸花色苷纳米微胶囊的包封率随靠近响应曲线中点而逐渐升高,当超过中点时,包埋率开始降低。
2.2.2 响应面模型验证 通过Design-Expert 8.0软件得到黑果腺肋花楸花色苷纳米微胶囊的最佳制备条件为:花色苷添加量35.73 mg,壳聚糖质量浓度1.31 mg/mL,搅拌时间60.48 min,在此工艺下黑果腺肋花楸花色苷纳米微胶囊的包埋率理论值58.66%。在此条件下做验证试验,根据仪器、设备的精度和操作的可行性,将工艺调整为花色苷添加量36 mg,壳聚糖质量浓度1.3 mg/mL,搅拌时间60 min。按此条件重复3 次,取平均值,得包埋率为59.54%,误差在5%内,这说明响应面优化的结果具有可信度,响应面回归模型可以准确预测花色苷纳米微胶囊的包埋率。
2.3 表征分析
2.3.1 花色苷纳米微胶囊的粒度 在理想情况下,纳米微胶囊具有较小的粒径[24]。通过激光粒度仪分析花色苷纳米微胶囊溶液颗粒的散射光强,可以看出纳米微胶囊粒度及分布规律。如图6 所示,黑果腺肋花楸花色苷纳米微胶囊的粒径分布较为均匀,平均粒径为317.5 nm。
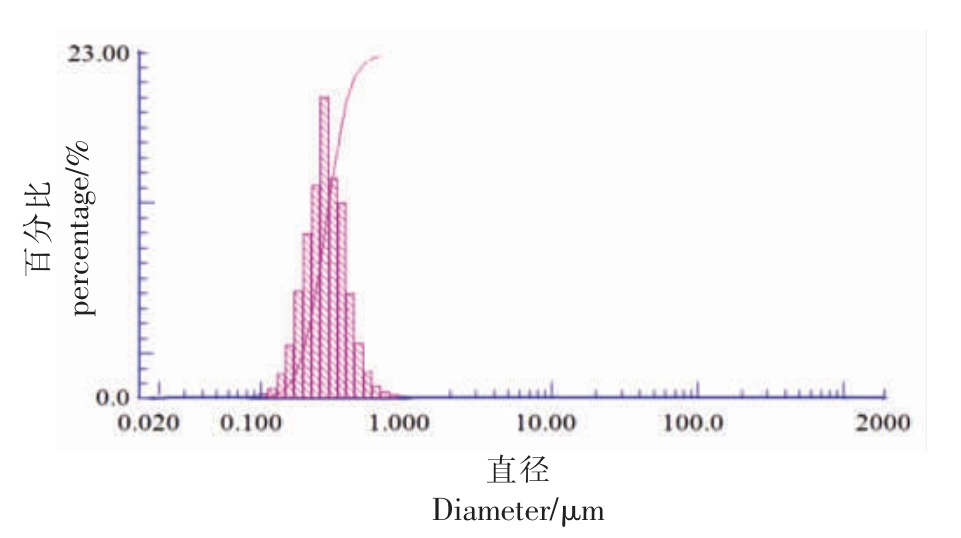
图6 花色苷纳米微胶囊的粒径分布图
Fig.6 Particle size distribution diagram of anthocyanin nanocapsules
2.3.2 花色苷纳米微胶囊的电位 Zeta 电位的意义在于它的数值与分子稳定性有关,若溶液中纳米微胶囊的Zeta 电位的绝对值较大,说明微胶囊凝胶状态较稳定;反之,说明微胶囊分散性较差,易发生凝结或凝聚。在最优条件即花色苷添加量36 mg,壳聚糖质量浓度1.3 mg/mL,搅拌时间60 min 下制备,微胶囊表面电位呈正电性,平均电位值36.7 mV,具有较好的稳定性。
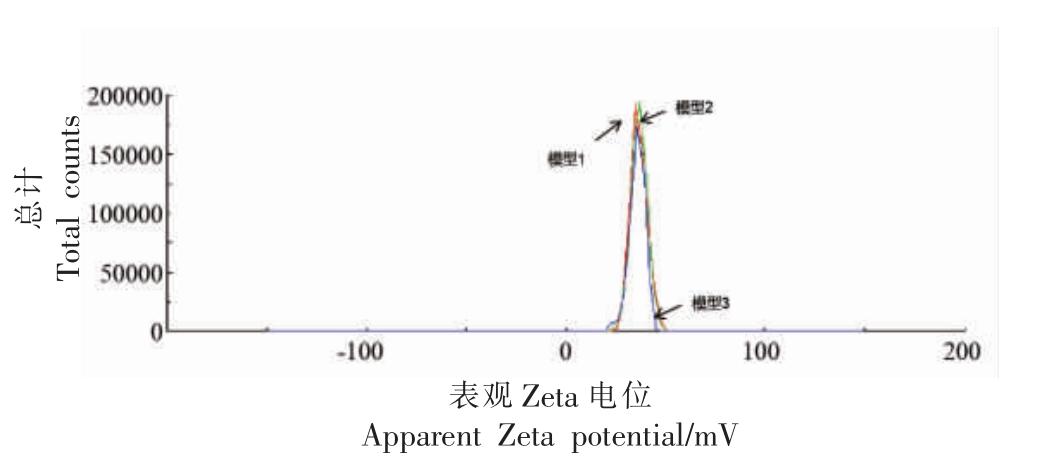
图7 花色苷纳米微胶囊电位分析图
Fig.7 Potential analysis diagram of anthocyanin nanocapsule
2.3.3 花色苷纳米微胶囊的扫描电镜分析 用扫描电镜观察处理后的花色苷纳米粒表面,在低放大倍数下能够观察到其形态和分散状态,而在高分辨率下能够观察到其结构和形貌特征,结果如图8 所示。由8a 可看出花色苷纳米粒的结构大多为规则的球形,分散较不均匀,这可能是因粒子间发生碰撞而引起的凝聚现象[27]。由8b 可知,纳米微胶囊是CS 与PGA 通过离子凝胶作用形成,其表面平整,无凹陷和褶皱。在制备过程中,纳米微胶囊容易粘连在一起,因此电镜下的粒径看上去较大。此外,离子交联是个动态过程,部分花色苷可能吸附在一起,导致纳米微胶囊呈现表面光滑、分散不均匀的较规则球状,这表明负载黑果腺肋花楸花色苷的纳米粒已经形成。

图8 花色苷纳米微胶囊的扫描电镜图
Fig.8 Scanning electron micrograph of anthocyanin nanocapsules
3 结论
以壳聚糖和聚谷氨酸为复合壁材制备纳米微胶囊。通过单因素实验和响应面试验,优化了制备花色苷纳米微胶囊的工艺条件,最优工艺是:花色苷添加量36 mg、壳聚糖质量浓度1.3 mg/mL、搅拌时间60 min、壳聚糖∶聚谷氨酸质量比2∶1、pH 4.5。在此条件下花色苷纳米微胶囊包埋率达59.54%。此包埋率虽在纳米微胶囊中属于较好,但与微米级胶囊的包埋率一般在90%以上相比,包埋率较低。对制备的纳米微胶囊进行表征,激光粒度仪显示纳米微胶囊的粒径分布较为均匀,平均粒径为317.5 nm。Zeta 电位仪显示纳米微胶囊表面电位呈正电性,平均电位值为36.7 mV。扫描电镜观察黑果腺肋花楸花色苷纳米微胶囊外表光滑,呈规则的球状。上述结果表明:所制备的纳米粒粒径较小,稳定性较好,具有较好的应用前景。后续可利用红外光谱仪分析其分子结构和包埋效果。
[1] SIDOR A,GRAMZA -MICHAŁOWSKA A.Black chokeberry Aronia melanocarpa L.-A qualitative composition,phenolic profile and antioxidant potential[J].Molecules,2019,24(20):3710.
[2] TOLI M T,JUR
M T,JUR EVI
EVI I L,KRBAV
I L,KRBAV I
I I P,et al.Phenolic content,antioxidant capacity and quality of chokeberry(Aronia melanocarpa)products[J].Food Technol Biotechnol,2015,53(2):171-179.
I P,et al.Phenolic content,antioxidant capacity and quality of chokeberry(Aronia melanocarpa)products[J].Food Technol Biotechnol,2015,53(2):171-179.
[3] 邢瑞.黑果腺肋花楸花色苷提取、抗氧化性及辐射防护作用的研究[D].广州:华南理工大学,2020.
XING R.Study on extraction,antioxidant and radioprotective effects of anthocyanins from Sorbus melanocarpa[D].Guangzhou:South China University of Technology,2020.
[4] THOMPSON K,PEDERICK W,SINGH I,e et al.Anthocyanin supplementation in alleviating thrombogenesis in overweight and obese population:A randomized,double-blind,placebo-controlled study[J].Journal of Functional Foods,2017,32:131-138.
[5] 李京城,张唐伟,兰小中,等.花色苷的生物活性及提取、分离纯化研究[J].安徽农学通报,2020,26(13):140-144.
LI J C,ZHANG T W,LAN X Z,et al.Research on the biological activity,extraction,separation and purification of anthocyanins [J].Anhui Agricultural Science Bulletin,2020,26(13):140-144.
[6] 徐僡,郑远静,高方平,等.花色苷的生物合成及其影响因素研究进展[J].江苏农业学报,2019,35(5):1246-1253.
XU Y,ZHENG Y J,GAO F P,et al.Research progress on anthocyanin biosynthesis and its influencing factors[J].Jiangsu Journal of Agricultural Sciences,2019,35(5):1246-1253.
[7] ROSA J,WEIS G,MORO K,et al.Effect of wall materials and storage temperature on anthocyanin stability of microencapsulated blueberry extract[J].LWT-Food Science and Technology,2021,142(4):111027.
[8] CRUZ L,GUIMARÃES M,ARA  JO P,et al.Malvidin 3-glucoside-fatty acid conjugates:From hydrophilic toward novel lipophilic derivatives[J].J Agric Food Chem,2017,65(31):6513-6518.
JO P,et al.Malvidin 3-glucoside-fatty acid conjugates:From hydrophilic toward novel lipophilic derivatives[J].J Agric Food Chem,2017,65(31):6513-6518.
[9] YANG W,KORTESNIEMI M,MA X Y,et al.Enzymatic acylation of blackcurrant(Ribes nigrum)anthocyanins and evaluation of lipophilic properties and antioxidant capacity of derivatives [J].Food Chemistry,2019,281:189-196.
[10] MCGHIE T K,AINGE G D,BARNETT L E,et al.Anthocyanin glycosides from berry fruit are absorbed and excreted unmetabolized by both humans and rats[J].Journal of Agricultural &Food Chemistry,2003,51(16):4539.
[11] 王慧,杨子明,周闯,等.纳米微胶囊技术及其在植物精油中的应用[J].高分子通报,2018(9):41-46.
WANG H,YANG Z M,ZHOU C,et al.Nanocapsule technology and its applications in plant essential oil[J].Polymer Bulletin,2018,(9):41-46.
[12] NILE S H,BASKAR V,SELVARAJ D,et al.Nanotechnologies in food science:applications,recent trends,and future perspectives[J].Nano-micro letters,2020,12(1):45.
[13] MOHAMMED M A,SYE DA J,WASAN K M,et al.An overview of chitosan nanoparticles and its application in non-parenteral drug delivery[J].Pharmaceutics,2017,9(4):53.
[14] 宋丽洁,郭谦,李想,等.两亲性胆酸化壳聚糖微胶囊包埋VA[J].食品科学,2018,39(5):121-127.
SONG L J,GUO Q,LI X,et al.Amphiphilic bile acidified chitosan microcapsules embedding VA[J].Food Science,2018,39(5):121-127.
[15] 贾玉萍,李秀娥,邱文旭,等.γ-聚谷氨酸的研究及应用进展[J].鲁东大学学报(自然科学版),2019,35(2):122-128.
JIA Y P,LI X E,QIU W X,et al.Research and application progress of γ-polyglutamic acid[J].Journal of Ludong University(Natural Science Edition),2019,35(2):122-128.
[16] 任东雪,陈鹏程,郑璞,等.γ-聚谷氨酸/壳聚糖纳米颗粒的制备及pH 响应释放性能[J].功能高分子学报,2020,33(1):54.
REN D X,CHEN P C,ZHENG P,et al.Preparation of γ -polyglutamic acid/chitosan nanoparticles and pH-responsive release properties[J].Journal of Functional Polymers,2020,33(1):54.
[17] 潘飞,赵磊,陈艳麟,等.壳聚糖/γ-聚谷氨酸负载黑米花色苷纳米粒的制备、表征及缓释性能[J].食品科学,2021,42(10):38-44.
PAN F,ZHAO L,CHEN Y L,et al.Preparation,characterization and sustained-release properties of chitosan/γ-polyglutamic acid loaded black rice anthocyanin nanoparticles[J].Food Science,2021,42(10):38-44.
[18] 贺博.蓝莓花色苷纳米微胶囊制备及其性能研究[D].合肥:安徽农业大学,2016.
He B.Preparation and properties of blueberry anthocyanin nanocapsules[D].Hefei:Anhui Agricultural University,2016.
[19] MUDASIR A,PRITI M,ADIL G,et al.Nano encapsulation of catechin in starch nanoparticles:Characterization;release behavior and bioactivity retention during in-vitro digestion[J].Food Chemistry,2018,270:95-104.
[20] SHORI A B.Microencapsulation improved probiotics survival during gastric transit[J].Hayati Journal of Biosciences,2017:24(1):1-5.
[21] 毛莹,帅晓艳,王惠玲,等.基于内源乳化法和喷雾干燥优化制备花色苷微胶囊及其稳定性分析[J].食品科学,2020,41(2):9.
MAO Y,SHUAI X Y,WANG H L,et al.Preparation and stability analysis of anthocyanin microcapsules based on endogenous emulsification method and spray drying optimization [J].Food Science,2020,41(2):9.
[22] FENG C,WANG Z,JIANG C,et al.Chitosan/o-carboxymethyl chitosan nanoparticles for efficient and safe oral anticancer drug delivery:In vitro and in vivo evaluation[J].International Journal of Pharmaceutics,2013,457(1):158-167.
[23] NORKAEW O,THITISUT P,MAHATHEERANONT S,et al.Effect of wall materials on some physicochemical properties and release characteristics of encapsulated black rice anthocyanin microcapsules[J].Food Chemistry,2019,294(10):493-502.
[24] XIAO J,NIAN S,HUANG Q,et al.Assembly of kafirin/carboxymethyl chitosan nanoparticles to enhance the cellular uptake of curcumin[J].Food Hydrocolloids,2015,51(10):166-175.
[25] DANIEL H P,BRUNO S C,MARIO A C V,et al.Development of chitosan and alginate nanocapsules to increase the solubility,permeability and stability of curcumin[J].Journal of Pharmaceutical Innovation,2019,14(2):132-140.
[26] VISHWAKARMA N,JAIN A,SHARMA R,et al.Lipid-based nanocarriers for lymphatic transportation[J].AAPS PharmSciTech,2019,20(2):83.
[27] MANOJLOVIC V,WINKLER K,BUNJES V,et al.Membrane interactions of ternary phospholipid/cholesterol bilayers and encapsulation efficiencies of a RIP II protein[J].Colloids Surf B Biointerfaces,2008,64(2):284-296.