我国渔业资源丰富, 水产品总产量一直处于世界前列。随着中国经济水平的不断提高,国内水产食品的消费数量呈逐年上升趋势[1],然而,食品安全风险也随之增加。 例如,在对2010—2018年连云港市531 份市售动物性水产品致病微生物污染情况的分析中发现, 该市市售水产品中均存在不同程度的致病弧菌、诺如病毒、异尖线虫污染[2]。2017—2019年从广东省水产品中检出7 种主要致病菌,其中副溶血弧菌,溶藻弧菌和沙门氏菌是主要污染源[3]。
控制食源性致病菌最传统、 最有效的方法是热加工, 然而高温会导致部分营养流失或感官质量的改变。可同时保证水产食品营养、感官和安全的非热加工技术成为水产食品加工行业的诉求。光动力技术(Photodynamic technology, PDT)是利用光敏剂在特定波长光源的激发下产生的活性氧(Reactive oxygen species, ROS)对病原体进行灭活,现被应用于多种食源性致病微生物[4-6]的控制。
溶藻弧菌(Vibrio alginolyticus, Va)是海水中的优势菌种,对人致病,水产食品中检出率较高。霍利斯格里蒙特菌(Grimontia hollisae, Gh),在水产食品中检出率一般较低, 然而该菌引起的食物中毒事件时有报道[7-9]。 PDT 灭活水产食品致病菌的研究多以副溶血弧菌(Vibrio parahaemolyticus,Vp)和创伤弧菌(Vibrio vulnificus, Vv)为对象[10-12],PDT 对Gh 和Va 的灭活作用鲜有研究报道。 本文以水溶性姜黄素为光敏剂, 在420 nm LED 蓝光激发下对Gh 和Va 进行灭活,研究其机理,为姜黄素PDT 在水产食品安全防控中的应用提供理论依据。
1 材料与方法
1.1 材料与仪器
1.1.1 菌株 霍利斯格里蒙特菌(ATCC 33564)、创伤弧菌(ATCC 27562)购自广东微生物菌种保藏中心,溶藻弧菌(CMCC 33787)由广东省出入境检验检疫局检验检疫技术中心食品实验室微生物部惠赠,副溶血弧菌(分离自上海市临床病人)由上海交通大学农业与生物学院惠赠。
1.1.2 试验试剂 水溶性姜黄素 (姜黄素含量12.9%),美国Sabinsa 公司;2216E 液体培养基,青岛高科技工业园海博生物技术有限公司; 胰酪大豆胨琼脂培养基 (Tryptose Soya Agar, TSA),广东环凯生物科技有限公司;氯化钠,广州化学试剂厂;ROS 检测试剂盒、SDS-PAGE 凝胶配制试剂盒,碧云天生物技术;Taq PCR Master Mix,生工生物工程(上海)股份有限公司;细菌DNA 提取试剂盒、琼脂糖,天根生化科技;引物,擎科生物;一次性培养皿,江苏晟康医疗用品有限公司。
1.1.3 仪器与设备 LED 光照设备(420 nm,69.97 mW/cm2)由暨南大学食品科学与工程系和光电工程系自主研发;DHP 120 恒温培养箱,上海实验仪器厂有限公司;HNYC-2102 智能恒温培养振荡器,天津欧诺仪器股份有限公司;ST16R 冷冻高速离心机、Legend Micro 17R 微量冷冻高速离心机、Evolution 220 紫外分光光度计, 赛默飞世尔科技(中国)有限公司;Infinite M200 PRO 光栅型多功能微孔板检测仪,瑞士Tecan 公司;SDS-PAGE 电泳仪,美国Bio-Rad 公司;AG 22331 Hamburg 梯度PCR 仪, 德国Eppendorf 公司;JY600+型PCR电泳仪, 北京君意东方电泳设备有限公司;Tanon 2500 凝胶图像分析系统、Tanon 5200 蛋白免疫印迹自动曝光仪,广州誉维生物科技仪器有限公司。
1.2 试验方法
1.2.1 菌种培养和菌悬液制备 将-80 ℃冻存的菌种在TSA 平板上转接2 次,挑取典型单菌落接种至10 mL 2216E 液体培养基中,37 ℃,120 r/min恒温振荡培养18~24 h,3 532×g 离心15 min 弃上清,加入10 mL PBS 重悬,制成菌悬液备用。
1.2.2 姜黄素的配制与稀释 称取0.0286 g 水溶性姜黄素粉末溶解于10 mL PBS 中制成1 mmol/L姜黄素母液,4 ℃避光保存, 按比例稀释成所需浓度工作液后用于光动力试验。
1.2.3 姜黄素的吸收光谱测量 利用紫外分光光度计在波长250 ~800 nm 范围内对浓度为50 μmol/L 和100 μmol/L 的姜黄素溶液进行全波长扫描测定。
1.2.4 姜黄素PDT 对Gh 和Va 的灭活作用 为避免试验过程中温度波动对试验的干扰,LED 光照设备全程放置在4 ℃冰箱中使用。 试验设置空白对照组(L-P-),光敏剂对照组(L-P+),光照对照组(L+P-)和光动力试验组(L+P+)。L-P-组取菌悬液与PBS 各0.5 mL 混合,不做光照处理;L-P+组取菌悬液与一次试验中所用最大浓度姜黄素溶液各0.5 mL,混合暗培养20 min,不做光照处理;L+P-组取菌悬液与PBS 各0.5 mL 混合, 光照10 min。 L+P+组,将菌悬液与姜黄素溶液(终浓度为50 μmol/L)各0.5 mL 加入12 孔板中,分别暗培养1,5,10,15 min 后在LED 光照设备下同时光照10 min 以探究暗培养时间的影响; 将菌悬液分别与不同浓度姜黄素溶液 (终浓度分别为10,25,50,100,150 μmol/L)各0.5 mL 加入12 孔板中,暗培养10 min 后光照10 min,以探究姜黄素浓度的影响;将菌悬液与姜黄素溶液(终浓度为50 μmol/L)各0.5 mL 加入12 孔板中,暗培养10 min 后,分别光照1,5,10 min 以探究光照时间的影响。
1.2.5 姜黄素PDT 对Vp 和Vv 的灭活作用 L+P+组按如下步骤处理:将Vp 和Vv 菌悬液分别与不同浓度姜黄素溶液(终浓度为50 μmol/L 和100 μmol/L)各0.5 mL 加入12 孔板中,暗培养10 min后光照10 min。L-P-、L-P+和L+P-组处理同1.2.4节。
1.2.6 平板菌落计数和灭活率计算 对处理后的菌液样品进行10 倍梯度稀释,选择3 个合适的梯度,每个梯度2 个平行。 取200 μL 稀释液于培养皿中,将冷却至55 ℃的TSA 倒平板,冷却凝固后倒置,35 ℃过夜培养并进行菌落计数。计数规则及计算方法参考GB 4789. 2-2016 《食品安全国家标准 食品微生物学检验 菌落总数测定》,所得数值做lg 处理并按式(1)计算灭活率:
式中,N——空白对照组菌落总数,CFU/mL;n——试验组菌落总数,CFU/mL。
1.2.7 光动力杀菌机理探究
1.2.7.1 菌体内ROS 测定 分别取10 mL Gh 和Va 菌悬液加入10 μL 荧光探针DCFH-DA,混匀后37 ℃培养30 min,无菌PBS 洗涤3 次。 重悬后菌液与PBS(L-P-)或不同浓度(终浓度为10,25,50,100 μmol/L)姜黄素溶液(L+P+)各0.5 mL 加入12 孔板中,暗培养10 min,LED 光照10 min,立即在488 nm 激发波长,525 nm 发射波长下测定荧光强度。 无菌对照组用PBS 替代菌悬液进行相同操作。
1.2.7.2 菌体蛋白的SDS-PAGE 分析 收集经1.2.4 节处理后L-P-和L+P+组的Va 菌液, 每个样品1 mL,PBS 洗涤3 次, 用40 μL PBS 重悬后加入10 μL 上样缓冲液,100 ℃加热10 min。 配制10%分离胶和5%浓缩胶,取5 μL 蛋白Marker 和12 μL 蛋白样品上样。 设置起始电压为80 V,样品条带进入分离胶后转120 V。指示剂迁移至距底端1~2 cm 处时停止电泳。 考马斯亮蓝染色2~4 h,脱色液漂洗至背景干净,条带清晰。蛋白免疫印迹自动曝光仪下显影并拍照。
1.2.7.3 细菌DNA 的琼脂糖凝胶电泳分析 取姜黄素PDT 处理后L-P-组、L-P+组(100 μmol/L姜黄素)、L+P-组(LED 光照10 min)和L+P+组(50 μmol/L 和100 μmol/L 姜黄素,LED 光照10 min)的Gh 和Va 菌液各5 mL, 根据细菌DNA 提取试剂盒说明提取DNA。 制备0.8%琼脂糖凝胶,将3 μL DNA 样品混合1 μL 上样缓冲液上样,80 V 电压下电泳80 min。 凝胶成像系统显影并拍照。
取培养后的Gh 和Va 菌液各4 mL 分别提取总DNA, 得DNA 溶液各4 mL。 将菌悬液和所得DNA 溶液同时做L-P-组、L-P+组 (50 μmol/L 姜黄素)、L+P-组 (LED 光照10 min) 和L+P+(50 μmol/L 姜黄素,LED 光照10 min) 处理并收集处理后样品,每个样品100 μL。 菌液样品按试剂盒说明提取DNA。 DNA 样品不做破壁,蛋白酶K 和加热处理,余下处理步骤同菌液样品。以Gh(表1)和Va(表2)的相关毒力基因引物进行PCR 扩增。扩增体系为50 μL,其中Taq PCR Mix 25 μL,前后引物各2 μL,双蒸水19 μL,DNA 模板2 μL。 反应条件为94 ℃预变性5 min;94 ℃变性30 s,60℃退火1 min,72 ℃延伸30 s,35 个循环;72 ℃终延伸10 min。制备2%琼脂糖凝胶,取5 μL 扩增产物上样,80 V 电压下电泳40 min。凝胶成像系统显影并拍照。
表1 霍利斯格里蒙特菌毒力基因引物序列
Table 1 The primer of virulence gene for Grimontia hollisae

?
表2 溶藻弧菌毒力基因引物序列
Table 2 The primers of virulence genes for Vibrio alginolyticus

基因 引物名称 引物序列(5’-3’) 片段大小/bp 参考文献tlh tlh F CGAACGAGAACGCAGACATT 108[13]tlh R CTTTGTTGATTTGATCTGGCTG Collagenase Collagenase F GTACTACGACATTGGCGAAGG 591 Collagenase R CCCGACCATACATTTCATACTG FlaA FlaA F AATCAATGGAGCGTTTGTCTTC 253 FlaA R GCTACACGTTCTGCTTTTGAGTTAG ompW ompW F TCGTGTCACCAAGTGTTTTCG 213 ompW R CGTGGCTGAATGGTGTTGC AspA AspA F GCATGGTACTCACGTAGCGG 146 AspA R CTTTCACAAGACCAGAAGAGTAACC fur fur F ATTAACCCTTTGAAGTTCGTGG 111 fur R TGACATATACTTTCCCGTTGGATC
1.3 数据处理
试验数据用SPSS Statistics 25.0 进行单因素方差分析, 显著性差异P<0.05,Microsoft Excel 2019 计算和作图。
2 结果与讨论
2.1 水溶性姜黄素的吸收波谱
图1 显示水溶性姜黄素在波长250~800 nm范围内有2 个吸收波峰, 其中最大吸收峰在420 nm 附近,与Gao 等[14]报道的水溶性姜黄素吸收波谱相似。 综上,光动力试验中采用420 nm 的蓝光LED 光源,符合姜黄素的最大吸收波长,能有效激发姜黄素发生光动力反应。

图1 水溶性姜黄素吸收光谱图
Fig.1 Absorption spectrum of water soluble curcumin
2.2 水溶性姜黄素PDT 对Gh 和Va 的灭活效果
2.2.1 暗培养时间对PDT 灭活效果的影响 在光照前提供充足的暗培养时间有助于目标菌吸附更多的光敏剂或使光敏剂与目标菌充分接触,以保证光动力作用的有效发挥。如图2 所示,随暗培养时间的延长,菌落总数整体呈不断减少趋势。当暗培养时间增加至10 min 时,光动力杀菌效果最佳,可使Gh 菌落总数降低6.20 lg(CFU/mL)。 继续延长暗培养时间至15 min, 光动力杀菌效果略有下降, 表明Gh 细胞与姜黄素的结合已经达到过饱和状态。综上,后续光动力试验中暗培养时间均采用10 min。

图2 暗培养时间对姜黄素PDT 灭活Gh 的影响
Fig.2 Effects of dark culture time on curcumin PDT inactivation of Gh
注:不同小写字母表示不同处理组间存在显著性差异
(P<0.05)。
2.2.2 姜黄素浓度对PDT 灭活效果的影响 姜黄素浓度对姜黄素PDT 灭活Gh 和Va 的影响如图3 所示。 L-P-组 (未处理)、L-P+组 (仅100 μmol/L 姜黄素处理)和L-P+组(仅10 min 光照处理)中Gh 菌落总数无显著性差异(P<0.05),Va 结果类似, 表明姜黄素或蓝光单独使用时均没有杀菌效果, 而二者都是PDT 过程中必不可少的因素。 图中数据显示该LED 光照设备能有效激发姜黄素,对Gh 和Va 产生显著地灭活作用,灭活效果随姜黄素浓度的增加而增强, 最终趋于平稳。150 μmol/L 姜黄素结合10 min 光照使Gh 和Va菌落总数分别降低7.98 lg (CFU/mL) 和7.80 lg(CFU/mL)。 同时,对比Gh 和Va 降低的菌落总数可知, 随姜黄素浓度的增加,Gh 菌落总数下降速率更快,这表明Gh 对姜黄素PDT 更加敏感。

图3 姜黄素浓度对姜黄素PDT 灭活Gh 和Va 的影响
Fig.3 Effect of curcumin concentration on curcumin PDT inactivation of Gh and Va
注:不同小写字母表示Gh 不同处理组间存在显著性差异(P<0.05);不同大写字母表示Va 不同处理组间存在显著性差异(P<0.05),下同。
2.2.3 光照时间对PDT 灭活效果的影响 光照剂量由光功率密度和光照时间共同决。研究表明,光照时间对灭活效果的影响大于光功率密度,通过延长光照时间的方式增加光照剂量, 可以更加有效地提高光动力灭活效果[15]。 采用光动力密度为69.97 mW/cm2 的LED 蓝光光源, 光照时间1,5,10 min 对应的光照剂量分别为4.20,20.99,41.98 J/cm2。 图4 表明,暗培养时间充足时,姜黄素(50 μmol/L)结合短时间(1 min)光照对Gh 和Va 的灭活作用即可达到99.99%以上。 延长光照时间可以增强PDT 灭活效果, 光照10 min 后Gh和Va 菌落总数分别降低7.26 lg(CFU/mL)和5.41 lg(CFU/mL)。

图4 光照时间对姜黄素PDT 灭活Gh 和Va 的影响
Fig.4 Effects of illumination time on curcumin PDT inactivation of Gh and Va
2.2.4 水溶性姜黄素PDT 对Vp 和Vv 灭活效果的影响 Vp 和Vv 是水产食品中的常见致病菌,其PDT 灭活作用已有较多研究。 邓曦[10]曾报道0.05 mg/mL 亚甲基蓝结合氙灯能使Vp 和Vv 分别降低约8 lg(CFU/mL)(300 J/cm2)和7 lg(CFU/mL)(360 J/cm2)。 Zhang 等[11]发现100 μg/mL 亚甲基蓝经氙灯激发后(24.996 J/cm2)对Vp 生物膜也具有良好的清除作用 【降低4.05 lg(CFU/mL)】。Wu 等[16]观察到10 μmol/L 姜黄素结合3.6 J/cm2蓝光可使Vp 减少至检测限以下【降低大于6.5 lg(CFU/mL)】。 本文结果(图5)显示,100 μmol/L 水溶性姜黄素浓度结合41.98 J/cm2 LED 蓝光分别使Vp 和Vv 菌落总数降低7.99 lg (CFU/mL)和6.89 lg(CFU/mL),灭活率高达99.99%以上,灭活效果与上述报道相似, 进一步证明本文采用的水溶性姜黄素PDT 的有效性。 同样的光动力条件(图3) 可使Gh 和Va 菌落总数分别降低7.63 lg(CFU/mL)和7.67 lg(CFU/mL),对比可知,水溶性姜黄素PDT 对Gh 和Va 的灭活作用与Vp 和Vv相近。 综上,水溶性姜黄素PDT 可同时作为Gh、Va、Vp 和Vv 的有效控制手段。

图5 姜黄素PDT 对Vp 和Vv 的灭活效果
Fig.5 Inactivation effects of curcumin PDT on Vp and Vv
2.3 姜黄素PDT 灭活Gh 和Va 的机理
2.3.1 姜黄素光动力诱导菌体内ROS 的产生
有研究发现, 在ROS 清除剂存在时,PDT 抗菌效果显著降低,而稳定剂的存在可增强其抗菌效果,表明ROS 在PDT 杀菌过程中发挥重要作用[12]。Freitas 等[17]和檀利军等[18]采用ROS 试剂盒法检测到PDT 处理可使细菌体内产生大量ROS,参考此法对Gh 和Va 进行检测(图6),结果显示,PDT 处理后菌液荧光强度较对照组显著增加, 表明PDT显著提高Gh 和Va 菌体内ROS 水平,ROS 水平与姜黄素浓度呈正相关。 这一结果与姜黄素浓度对PDT 灭活效果的影响结果相符,即随姜黄素浓度的增加,菌体内ROS 水平不断升高,菌落总数不断降低,对应灭活率不断增强。 同时,菌落计数结果表明,相同条件下,姜黄素PDT 对Gh 的灭活效果要优于Va,对比图3 和图6 结果推测,这可能是由于姜黄素PDT 诱导Gh 菌体内产生更高水平的ROS。 综上,水溶性姜黄素是一种高效光敏剂,易被目标菌吸收,由蓝光激发可以产生高水平的ROS,达到良好的灭活效果。

图6 姜黄素PDT 诱导菌体内ROS 的产生
Fig.6 ROS production in bacteria induced by curcumin PDT
2.3.2 姜黄素PDT 对菌体蛋白的降解 由ROS引起的氧化应激可破坏蛋白质、DNA 和脂类等大分子,导致生物活性改变,加速突变,最终导致细胞死亡[19]。 对细菌外膜蛋白进行SDS-PAGE 分析发现,PDT 可以对细菌外膜蛋白造成损伤[16]。 如图7 所示, 不同浓度的姜黄素PDT 均能对Va 菌体蛋白产生破坏作用,随浓度增加,降解效果增强。为更加直观反映PDT 对细菌的灭活作用,有研究进一步采用扫描电镜或原子力显微镜观察到,PDT 处理可使细菌形态改变, 甚至可以导致细胞破裂,内容物质泄露[20-21]。
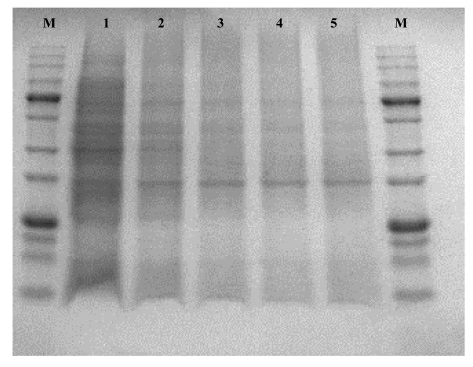
图7 PDT 处理后Va 全蛋白SDS-PAGE 分析图谱
Fig.7 SDS-PAGE analysis of Va total protein after PDT treatment
注:M 为marker (5~245 ku);轨道1 为L-P-组;轨道2~5 为L+P+组,姜黄素浓度从左至右依次为10,25,50,100 μmol/L。
2.3.3 姜黄素PDT 对细菌基因的损伤 分析图8可知,与对照组相比,L+P+组的DNA 条带出现显著降解,表明从总体水平来看,Gh(图8a)和Va(图8b) 经过姜黄素PDT 处理后,DNA 均被严重损伤。 Gong 等[22]通过琼脂糖凝胶电泳分析观察到姜黄素PDT 不仅可以损伤假单胞菌DNA,并且对RNA 也具有一定的损伤作用。

图8 姜黄素PDT 处理后Gh 和Va 总DNA 的琼脂糖凝胶电泳分析图
Fig.8 Agarose gel electrophoresis analysis of Gh and Va total DNA after curcumin PDT treatment
注:M 为marker(23 130 bp);轨道2 为L-P-组;轨道3 为L-P+组;轨道4 为L+P-组;轨道5 和6 为L+P+组,姜黄素浓度从左至右依次为100 μmol/L 和50 μmol/L。
分析光动力处理后细菌DNA 上的毒力基因发现,姜黄素PDT 处理后的Gh(图9)和Va(图10a)毒力基因条带亮度与对照组相比没有明显的减弱。 提取细菌总DNA, 进一步对裸露的细菌DNA 进行姜黄素PDT 处理后检测毒力基因(图9和图10b),结果也未观察到明显的条带降解。 这可能是由于试验中选择的毒力基因区域并非姜黄素PDT 的主要损伤位置, 也可能是因为ROS 的半衰期极短, 试验中检测的毒力基因片段长度太短(最长591 bp),PDT 产生ROS 将DNA 降解为较大的片段后,无法进一步将其完全碎片化。

图9 姜黄素PDT 处理后对Gh 毒力基因的琼脂糖凝胶电泳分析图
Fig.9 Agarose gel electrophoresis analysis of Gh virulence gene after curcumin PDT treatment
注:M 为marker(2 000 bp);轨道1 为L-P-组;轨道2 为L-P+组;轨道3 为L+P-组;轨道4 为L+P+组。

图10 姜黄素PDT 处理后Va 毒力基因的琼脂糖凝胶电泳图
Fig.10 Agarose gel electrophoresis analysis of Va virulence genes after curcumin PDT treatment
注:图(a)和(b)分别为完整Va 菌体内DNA 和裸露的DNA 上毒力基因的琼脂糖凝胶电泳图,其中M 为marker(2 000 bp);轨道1 为L-P-组;轨道2 为L-P+组;轨道3 为L+P-组;轨道4 为L+P+组。
PDT 灭活致病菌的作用机理被认为是光动力技术作用过程中所得产生ROS, 通过Ⅰ型(自由基)和Ⅱ型(单线态氧)反应途径达到灭菌目的[23-24]。本文研究结果显示,PDT 对Gh 和Va 的灭活作用机理主要是通过诱导菌体内产生高水平的ROS,严重损伤菌体蛋白和DNA,最终导致细胞死亡。 然而本文所选择的毒力基因片段经姜黄素PDT 处理后未见明显损伤, 其原因有待进一步研究探讨。
3 结论
PDT 技术(水溶性姜黄素,420 nm LED 蓝光)能够有效灭活水产食品致病菌Gh 和Va, 其灭活效果与暗培养时间、 姜黄素浓度和光照时间呈正相关。 PDT 对Gh 和Va 的灭活机理主要是通过ROS(自由基、单线态氧)的产生和强氧化作用,严重损伤菌体蛋白和DNA, 最终导致细胞死亡,达到灭菌目的。 鉴于姜黄素光动力技术对霍利斯格里蒙特菌和溶藻弧菌的高效灭活效果, 结合前期关于PDT 对于副溶血弧菌和创伤弧菌的灭活效果, 姜黄素光动力技术有可能成为一种新型潜在的水产食品致病菌灭菌技术, 用于水产食品加工安全防控。
[1] 万涌蓉. 我国城镇居民水产品消费影响机理研究[D].上海: 上海海洋大学, 2018.
WAN Y R. Analysis on influencing mechanism of China's seafoods consumption[D]. Shanghai: Shanghai Ocean University, 2018.
[2] 马会会, 徐炜, 李莉, 等. 2010-2018年连云港市531 份市售动物性水产品致病微生物污染情况[J]. 现代预防医学, 2019, 46(16): 2947-2950.
MA H H, XU W, LI L, et al. Pollution of pathogenic microorganism in 531 animal fishery products from markets of Lianyungang between 2010 and 2018[J]. Modern Preventive Medicine, 2019, 46(16): 2947-2950.
[3] 屠鸿薇, 池岚, 黄盼盼, 等. 2017-2019年广东省动物性水产品7 种致病微生物污染状况分析[J]. 食品安全质量检测学报, 2020, 11(9): 2980-2985.
TU H W, CHI L, HUANG P P, et al. Analysis of the pollution status of 7 pathogenic microorganisms in animal aquatic products in Guangdong province from 2017 to 2019[J]. Food Safety and Quality Detection Technology, 2020, 11(9): 2980-2985.
[4] PENHA C B, BONIN E, ALEX E B, et al. Photodynamic inactivation of foodborne and food spoilage bacteria by curcumin[J]. LWT, 2017, 73(1): 198-202.
[5] WU J, HOU W, CAO B B, et al. Virucidal efficacy of treatment with photodynamically activated curcumin on murine norovirus bio-accumulated in oysters[J]. Photodiagnosis and Photodynamic Therapy,2015, 12(3): 385-392.
[6] SOUZA T H S, ANDRADE G D, CABRAL F V,et al. Efficient photodynamic inactivation of Leishmania parasites mediated by lipophilic water-soluble Zn (II) porphyrin ZnTnHex-2-PyP4+[J]. Biochimica et Biophysica Acta (BBA)-General Subjects, 2021,1865(7): 129897.
[7] 郭红. 从腹泻患者粪便中分离出2 株霍利斯弧菌[J].华北煤炭医学院学报, 2004, 6(6): 707-708.
GUO H. Isolation of two Vibrio hollisae strains from feces of patients with diarrhea[J]. Journal of North China Coal Medical College, 2004, 6(6): 707-708.
[8] 徐晓红, 贾硕柱. 一起由霍利斯弧菌引起食物中毒的调查分析[J]. 中国当代医药, 2009, 16(23):144-145.
XU X H, JIA S Z. A case of food poisoning caused by Vibrio hollisae[J]. China Modern Medicine,2009, 16(23): 144-145.
[9] 江佳佳, 王晓秋, 金琰. 霍利斯弧菌引起医院感染的报道[J]. 中 华医院感染 学杂志, 2009, 19(2):240-240.
WANG J J, WANG X Q, JIN Y. A report of hos pital infection caused by Vibrio hollisae[J]. Chinese Journal of Nosocomiology, 2009, 19(2): 240-240.
[10] 邓曦. 亚甲基蓝对创伤弧菌和副溶血弧菌的光动力灭菌作用[D]. 广州: 暨南大学, 2015.
DENG X. Inactivation of Vibrio vulnificus and Vibrio parahaemolyticus by anti-microbial photodynamic technology using methylene blue[D]. Guangzhou: Jinan University, 2015.
[11] ZHANG X T, WU Q, TANG S Z, et al. Biofilm formation and methylene blue-mediated photodynamic inactivation of Vibrio parahaemolyticus in the sea food industry[J]. Nutrition & Food Science International Journal, 2020, 10(3): 555787.
[12] WONG T W, WANG Y Y, SHEU H M, et al.Bactericidal effects of toluidine blue-mediated photodynamic action on Vibrio vulnificus[J]. Antimicrobial Agents and Chemotherapy, 2005, 49(3): 895-902.
[13] 张晶, 陈佳璇, 伍业健, 等. 广州地区水产品及外环境水体溶藻弧菌污染状况与毒力相关基因分析[J].中国卫生检验杂志, 2016, 26(4): 539-541.
ZHANG J, CHEN J X, WU J Y, et al. Analysis of the contamination status and virulence -related genes of Vibrio alginolyticus in aquatic products and external environmental water in Guangzhou[J]. Chinese Journal of Health Laboratory Technology,2016, 26(4): 539-541.
[14] GAO J W, MATTHEWS K R. Effects of the photosensitizer curcumin in inactivating foodborne pathogens on chicken skin[J]. Food Control, 2020,109(1): 106959.
[15] 张晓婷. 奇异变形杆菌生物膜的形成及光动力杀菌技术研究[D]. 广州: 暨南大学, 2021.
ZHANG X T. Proteus mirabilis biofilm formation and its bactericidal effect of photodynamic technology[D].Guangzhou: Jinan University, 2021.
[16] WU J, MOU H J, XUE C H, et al. Photodynamic effect of curcumin on Vibrio parahaemolyticus[J].Photodiagnosis and Photodynamic Therapy, 2016,15(Sep.): 34-39.
[17] FREITAS M A A, PEREIRA A H C, PINTO J G,et al. Bacterial viability after antimicrobial photodynamic therapy with curcumin on multiresistant [J].Future Microbiology, 2019, 14(9): 739-748.
[18] 檀利军, 胡钰梅, 陈博文, 等. 姜黄素介导的光动力技术对副溶血性弧菌与腐败希瓦氏菌的杀灭效果[J/OL]. 食品科学, (2021-03-25)[2021-07-18]. http://kns.cnki.net/kcms/detail/11.2206.ts.20210323.1433.050.html.
TAN L J, HU Y M, CHEN B W, et al. Inactivation effect of curcumin-mediated photodynamic technology on Vibrio parahaemolyticus and Shewanella putrefaciens[J/OL]. Food Science, (2021-03-25)[2021-07-18]. http://kns.cnki.net/kcms/detail/11.2206.ts.20210323.1433.050.html.
[19] LAM P L, WONG R S M, LAM K H, et al. The role of reactive oxygen species in the biological activity of antimicrobial agents: An updated mini review[J]. Chemico-Biological Interactions, 2020, 320:109023.
[20] DENG X, TANG S Z, WU Q, et al. Inactivation of Vibrio parahaemolyticus by antimicrobial photodynamic technology using methylene blue[J]. Journal of the Science of Food and Agriculture, 2016, 96(5):1601-1608.
[21] LIN S L, HU J M, TANG S Z, et al. Photodynamic inactivation of methylene blue and tungstenhalogen lamp light against food pathogen Listeria monocytogenes[J]. Photochemistry and Photobiology,2012, 88(4): 985-991.
[22] GONG C, LI Y, GAO R, et al. Inactivation of specific spoilage organism (Pseudomonas) of sturgeon by curcumin-mediated photodynamic inactivation[J]. Photodiagnosis and Photodynamic Therapy,2020, 31(1): 101827.
[23] CIEPLIK F, DENG D M, CRIELAARD W, et al.Antimicrobial photodynamic therapy-what we know and what we don't[J]. Critical Reviews in Microbiology, 2018, 44(5): 571-589.
[24] 林少玲, 黄晨楹, 朱子瑶, 等. 非热力光动力灭菌技术在食品安全中的研究进展[J]. 中国食品学报,2018, 18(7): 323-331.
LIN S L, HUANG C Y, ZHU Z Y, et al. Research progress of non-thermal photodynamic therapy on food safety[J]. Journal of Chinese Institute of Food Science and Technology, 2018, 18(7): 323-331.