碳酸钙是一种广泛分布于大自然的无机化合物,存在于方解石、大理石等岩石内,也是骨骼及外壳的重要成分[1],可作为钙的补充剂添加于食品中。 目前国内外常用的强化钙主要为碳酸钙[2],其钙含量高,价格低廉。现在市面上的钙补充剂多为片剂,不太适用于幼儿及吞咽有困难的人群。乳液体系虽吞咽方便, 但难溶性钙盐在乳液体系中受重力和扩散力的作用[3]易在贮藏过程中析出,即沉淀。目前,国内外关于对碳酸钙制备的乳液稳定性研究尚不多见。Qu 等[4]利用麦芽糊精-酪蛋白酸钠美拉德反应产物制备S/O/W 钙微球, 通过荧光共聚焦显微镜研究麦芽糊精-酪蛋白酸钠美拉德反应产物对S/O/W 钙微球微观结构的影响, 证明S/O/W 钙微球的形成。 刘丽娅等[5]研究了酪蛋白酸钠-多糖界面相互作用及其对乳状液稳定性的影响,结果表明体系的pH 值、盐及多糖浓度显著影响蛋白-多糖复合体系的相分离行为。
明胶(Gelatin, GE)是由动物皮肤、肌腱、骨中的胶原水解得到的天然蛋白质大分子, 既含亲水基团又含亲脂基团,具有表面活性,可被用作乳化剂并形成稳定的油水界面来防止液滴在乳液中聚集[6]。 明胶具有成膜的潜力,它可以形成一种外部屏障,限制光、热和氧的影响来保护食品[7-8]。 明胶具有与表面活性剂相似的性质,然而,当其被用作单一乳化剂时,乳液倾向于形成大的液滴,且稳定性很差[9-11],限制了其在食品加工中的应用。 酪蛋白酸钠作为天然乳化剂, 在乳化过程中能够迅速吸附在油-水界面,降低界面张力并形成一个相对较厚的界面层, 通过静电排斥和空间位阻效应防止新形成的液滴絮凝和聚结, 从而延长乳液中液滴的稳定性[12]。 利用酪蛋白酸钠-明胶相互作用制备的复合生物膜或凝胶微球,在食品包装、生物医药等领域有着广泛的应用[13-15]。
本研究以食品级碳酸钙为S 相, 大豆油为O相,酪蛋白酸钠-明胶为W 相,构建S/O/W 钙-脂质微球。 研究不同质量分数明胶和不同S/O 相添加量对微球粒径、物理稳定性、流变学与微观结构的影响, 探索S/O/W 钙-脂质微球的形成规律,为设计三相(S、O、W)基质传递系统奠定理论基础。
1 材料与方法
1.1 原料与试剂
碳酸钙(食品级),河南双腾实业有限公司;金龙鱼大豆油, 益海嘉里投资有限公司; 酪蛋白酸钠, 上海麦克林生化科技有限公司;A 型明胶、磷酸氢二钠、磷酸二氢钠、氢氧化钠,国药集团化学试剂有限公司;尼罗红、尼罗蓝A,美国Sigma 公司。
1.2 仪器与设备
T-25 digital 高速分散机, 美国IKA 集团;S3500 激光粒度分析仪, 美国麦克奇有限公司;LUMiSizer 稳定性分析仪, 德国LUM 公司;Nano-ZS90 纳米激光粒度仪, 英国马尔文仪器有限公司;DHR-1 摩擦-流变仪, 美国TA 公司;MARS IQ Air 流变仪, 德国哈克公司;Rheolaser Master微流变仪,法国Formulaction 公司;FV3000 激光共聚焦显微镜,日本奥林巴斯株式会社;Helios NanoLab G3 UC 冷冻扫描电子显微镜, 美国FEI公司;Eutech pH 700 pH 计,梅特勒-托利多仪器(上海) 有限公司;TB-214 分析天平、TB-1102 电子天平,美国丹佛仪器有限公司;DF-101S 集热式恒温加热磁力搅拌器, 河南省巩义市予华仪器责任有限公司。
1.3 试验方法
1.3.1 S/O/W 乳状液的制备
1.3.1.1 酪蛋白酸钠和明胶溶液的制备 准确称取一定量的酪蛋白酸钠(NaCas)和明胶(GE),分别溶解于1 mmol/L 磷酸盐缓冲溶液中(pH 7.0),50 ℃水浴连续搅拌2 h 后于4 ℃储存过夜以确保完全溶解,分别制得质量分数10.0% NaCas 和0.1%,2.0%,4.0%,6.0%,8.0% GE 溶液,形成水相。
1.3.1.2 S/O 乳状液的制备 准确称取一定量的食品级碳酸钙粉末和大豆油, 分别作为固相和油相,二者质量比为1∶10,置于磁力搅拌器上以700 r/min 转速搅拌1 h,制得S/O 悬浮液。 用高速分散机在15 000 r/min 条件下剪切3 min, 形成S/O 粗乳状液。
1.3.1.3 S/O/W 乳状液的制备 准确称取一定量的NaCas 溶液与不同质量分数的GE 溶液以质量比1∶1 的比例混合均匀形成W 相,再加入1.3.1.2节制备的S/O 粗乳状液 (S/O 相添加量为5%,10%,15%,20%,25%),用高速分散机以15 000 r/min 的转速剪切5 min,制得S/O/W 乳状液。
1.3.2 粒径分析 采用激光粒度分析仪测定S/O/W 乳状液的粒径分布情况。 参数如下:折射率比1.51∶1,平衡时间30 s,测试温度25 ℃,重复测定3 次,结果以平均值表示。
1.3.3 Zeta 电位分析 采用激光粒度仪测定S/O/W 乳状液的Zeta 电位。 为减小多重光散射对测量的影响, 测定前需将样品用1.0 mmol/L 的磷酸盐缓冲液稀释400 倍。 参数如下:折射率比1.45∶1,平衡时间120 s,测试温度25 ℃,重复测定3 次。
1.3.4 物理稳定性分析 采用稳定性分析仪测定S/O/W 乳状液的物理稳定性。 参数如下:进样量0.4 mL,转速2 000 r/min,时间间隔10 s,谱线200条,测试温度25 ℃,重复测定3 次。
1.3.5 剪切流变特性分析 采用流变仪对S/O/W乳状液进行连续剪切试验测定其表观黏度。 参数如下:平板转子型号CC25 DIN,剪切速率2~200 s-1,测试温度25 ℃,重复测定3 次。
1.3.6 微流变特性分析 采用微流变仪分析S/O/W 乳状液的微流变特性。参数如下:激光光源650 nm,加样量20 mL,测试温度25 ℃。
1.3.7 摩擦系数分析 采用摩擦-流变仪对S/O/W 乳状液进行剪切测试。将乳状液放置在球-盘表面, 并与钢球进行剪切来模拟舌头表面和口腔上颚间的摩擦过程。 参数如下:测试压力1 N,测试温度37 ℃[16]。
1.3.8 微观结构分析
1.3.8.1 激光共聚焦显微镜 采用激光共聚焦显微镜CLSM 观察S/O/W 乳状液的微观结构。 在制备样品之前,油相用疏水性染料尼罗红染色,水相用亲水性染料尼罗蓝A 染色, 然后在4 ℃避光储存过夜。 S/O/W 乳状液制备方法同1.3.1 节。 采用10 倍目镜和60 倍物镜 (油镜) 观察来自尼罗红(激发波长488 nm) 和尼罗蓝A (激发波长635 nm)染料的荧光信号,获取显微图像后,用相应软件进行处理和分析。
1.3.8.2 冷冻扫描电子显微镜 采用冷冻扫描电子显微镜Cryo-SEM 观察S/O/W 乳状液的微观结构以获得更直观的信息。样品在液氮中预冷冻,然后转移到冷冻制备室,在真空状态下冷冻断裂、升华除冰并溅射镀铂, 最后转移到扫描电子显微镜(SEM) 样品台进行观察。 TLD 探头工作电压为2 kV,观测距离为3~5 mm。
1.4 数据分析方法
采用Origin 8.5 数据处理软件对上述数据进行处理和分析。
2 结果与讨论
2.1 明胶质量分数和S/O 相添加量对S/O/W 乳状液粒径分布的影响
不同GE 质量分数和S/O 相添加量对S/O/W乳状液粒径的影响如图1 所示。 当S/O 相添加量一定时,低质量分数GE(0.1%)形成的S/O/W 乳液粒径尺寸较大且粒径分布范围较广, 随着GE质量分数增加,平均粒径逐渐减小,粒径分布范围变窄。 这是因为当GE 质量分数较低时,乳状液只能与部分NaCas 发生相互作用,其平均粒径较大;随着GE 质量分数增加, 具有特定三维空间网络结构的微粒逐渐形成且粒径逐渐变小[17]。当GE 质量分数一定时,随着S/O 相添加量的增加,出现双峰分布,可能是形成了聚集簇,稳定性比较弱。

图1 不同质量分数明胶和不同S/O 相添加量制备的S/O/W 乳状液的粒径分布
Fig.1 Particle size distribution of S/O/W emulsion prepared with different mass fraction of gelatin and different S/O phase addition amount
2.2 明胶质量分数和S/O 相添加量对S/O/W 乳状液Zeta 电位的影响
不同GE 质量分数和S/O 相添加量对S/O/W乳状液Zeta 电位的影响如图2 所示。 无论是不同GE 质量分数还是不同S/O 相添加量,S/O/W 乳状液的Zeta 电位均为负值。然而,当S/O 相添加量一定时,随着GE 质量分数的增加,乳状液的Zeta 电位总体有所上升;当GE 质量分数一定时,随着S/O 相添加量的增加,乳状液的Zeta 电位略有上升。显然,这与NaCas 和GE 的带电性质有关。 当体系pH 值高于NaCas 的pI 值而低于GE 的pI 值时,NaCas 分子带负电,GE 分子带正电,NaCas 和GE之间发生静电吸引, 这是S/O/W 乳状液微粒形成的基础。 随着GE 质量分数的增加, 乳状液体系黏度明显上升, 说明NaCas 和GE 的交互作用增强,这是由于增多的GE 侧基(-NH3+)与NaCas 解离的负离子间静电力作用增强所致[13,18]。

图2 不同质量分数明胶和S/O 相添加量对S/O/W 乳状液Zeta 电位的影响
Fig.2 Effects of different mass fraction of gelatin and S/O phase addition amount on Zeta potential of S/O/W emulsion
2.3 明胶质量分数和S/O 相添加量对S/O/W 乳状液物理稳定性的影响
不同GE 质量分数和S/O 相添加量对S/O/W乳状液物理稳定性的影响如图3 所示。 通过软件对原始透射曲线进一步分析计算可以得到不稳定性指数,能够定量表示乳状液的物理稳定性。不稳定性指数越低,乳状液稳定性越好。由图3 可知,当S/O 相添加量一定时,随着GE 质量分数的增加,S/O/W 乳状液不稳定性指数逐渐降低, 并且在GE 质量分数为8%时取得最低值(约为0.01), 这是因为GE 质量分数较高时,S/O/W 乳状液黏度增加,所以乳液体系稳定性增加。当GE 质量分数一定时,S/O 相添加量为5%时乳液体系不稳定性指数取得最低值, 随着S/O 相添加量的增加,S/O/W 乳状液不稳定性指数上升,这是由于S/O 相增加导致固体颗粒数量相应增加,能够吸附于单位面积油滴表面的固体颗粒的量少,W 外水相含量降低,乳化效果降低,乳化剂无法完全覆盖,固体颗粒间间隙大,使油滴易于聚集,因此乳化过程结束后,油相便立即聚集析出,使之无法形成乳液, 这表明只有S/O 相在适宜的添加量才能形成相对稳定的S/O/W 乳状液[19-20]。

图3 不同质量分数明胶和不同S/O 相添加量对S/O/W 乳状液不稳定性指数的影响
Fig.3 Effects of different mass fraction of gelatin and S/O phase addition amount on instability index of S/O/W emulsion
2.4 明胶质量分数和S/O 相添加量对S/O/W 乳状液剪切流变的影响
不同GE 质量分数和S/O 相添加量对S/O/W乳状液表观黏度的影响如图4 所示。由图4 可知,随着剪切速率的增加,S/O/W 乳状液表观黏度显著降低之后逐渐平稳, 表明S/O/W 乳状液具有假塑性流体特性。 这是因为随着剪切速率增加,S/O/W 乳状液微粒的蜂窝状三维空间网络结构遭到一定程度的破坏,使其按照流动方向有序排列,流动阻力减小,表观黏度降低[21-23]。

图4 不同质量分数明胶和S/O 相添加量对S/O/W 乳状液表观黏度的影响
Fig.4 Effects of different mass fraction of gelatin and S/O phase addition amount on apparent viscosity of S/O/W emulsion
随着GE 质量分数的增加,S/O/W 乳状液微粒表观黏度有所增加。GE 分子在微粒中不仅起到增稠作用, 还是构成蜂窝状三维空间网络结构的关键,进而使S/O/W 乳状液微粒稳定性得到提升。S/O 相添加量对S/O/W 乳状液微粒表观黏度影响较小:低GE 质量分数时,随着S/O 相添加量增加,S/O/W 乳状液微粒表观黏度均较低, 显示出明显的非牛顿(剪切稀化)流动曲线,即表观黏度随着剪切速率增加而明显下降, 这主要反映了乳液液滴间的反絮凝作用[24-25];高GE 质量分数时,随着S/O相添加量增加,S/O/W 乳状液微粒表观黏度随着剪切速率的增加呈现显著降低之后略有增加的现象,乳液黏度随油相比例的增加而增加,这是由于油相本身具有一定的黏度,当增加油相比例,乳液变稠,故而黏度有所增加[1]。 上述结果表明,与S/O相添加量相比,GE 质量分数对S/O/W 乳状液微粒剪切流变的影响更大。
2.5 明胶质量分数和S/O 相添加量对S/O/W 乳状液微流变的影响
微流变技术是通过测定样品颗粒的均方根位移(MSD)表征粒子的运动轨迹。固液平衡值(SLB)是通过计算MSD 平台区的斜率得到的,它清楚地表征了流变学的特征[26],如质构、凝胶点、乳液的黏弹性等。 不同GE 质量分数和S/O 相添加量对S/O/W 乳状液微流变的影响如图5 所示。

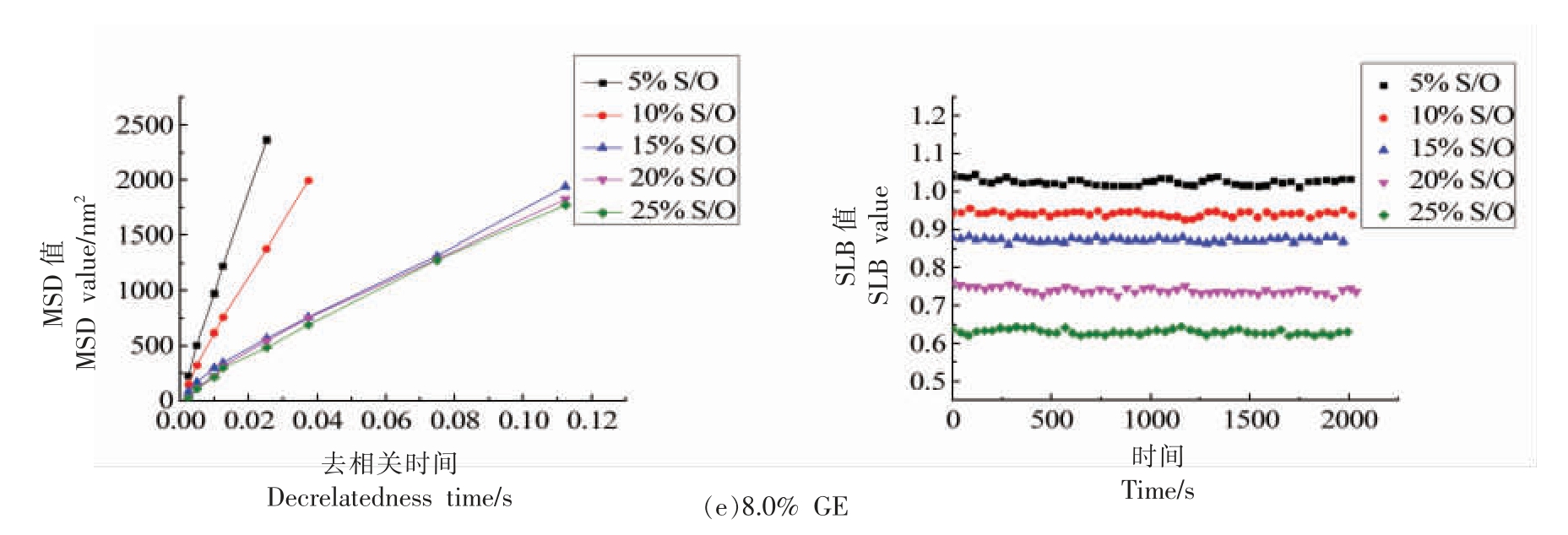
图5 不同质量分数明胶和S/O 相添加量对S/O/W 乳状液均方根位移(MSD 值)和固液平衡值(SLB 值)的影响
Fig.5 Effects of different mass fraction of gelatin and S/O phase addition amount on S/O/W emulsion root mean square displacement (MSD value) and solid-liquid equilibrium value (SLB value)
图5 显示了不同GE 质量分数和S/O 相添加量对S/O/W 乳状液微流变均方根位移(MSD)和固液平衡(SLB)值的影响。 当S/O 相添加量一定时,随着GE 质量分数增加,S/O/W 的乳状液MSD 曲线逐渐变为线性增长,属于黏性流体。 MSD 随着GE 质量分数的增大显著降低,在GE 质量分数为8%时最终MSD 值最小, 表明此时微粒已经形成完整稳定的三维空间网络结构, 因此限制了微粒布朗运动空间进而提高稳定性。 此外,S/O/W 乳状液微粒黏度随着GE 质量分数的增大显著提高,同样与剪切流变(图4)结果相符。 不同S/O 相添加量制备的S/O/W 乳状液,S/O 相含量为5%,10%和15%时MSD 曲线基本呈线性变化,这表明体系表现出黏稠的状态, 当S/O 相含量为20%和25%时,MSD 曲线出现平台区,说明乳状液的微流变行为表现为黏弹性。
此外,还可通过微流变学中的固液平衡(SLB)值来说明乳状液的黏弹特征。当SLB<0.5 时,这意味着微滴运动出现类似弹性行为。 SLB=0.5 意味着液体和固体特征平衡,当0.5<SLB<1 时,它表现出更多的液体(或黏性)行为,而SLB 超过1 意味着沉积物的发生[27]。 如图5 所示,SLB 值随着S/O/W 乳状液中S/O 相添加量的增加而逐渐减小,它表明乳状液的流变行为从黏性行为变为弹性行为;随着GE 质量分数增加,SLB 值增大,低GE 质量分数时,乳状液弹性行为占主导,高GE 质量分数时,乳状液黏性行为占主导。
2.6 明胶质量分数对S/O/W 乳状液摩擦系数的影响
摩擦学分析是将球-盘摩擦装置和流变仪进行连接,实际加载过程由流变仪完成。将S/O/W 乳状液放置在球-盘表面,并与钢球进行剪切来模拟舌头表面和口腔上颚间的摩擦过程。
不同GE 质量分数对S/O/W 乳状液摩擦系数的影响如图6 所示。 试验结果表明,S/O/W 乳状液在低剪切速率下摩擦系数较高。 随着剪切速率提高,乳液摩擦系数降低,即呈现出剪切变稀特性。随着GE 质量分数的增加, 乳状液的摩擦系数降低, 可能是NaCas 和GE 之间的协同相互作用引起S/O/W 乳状液的吸附膜性能的改变, 从而导致乳状液摩擦系数的减小。ChoiIlicka-Paszun 等[28]将感官感知与均质牛乳的黏度和摩擦系数进行关联, 试验结果表明当牛乳中脂肪的质量分数大于l%时,摩擦系数和奶油感呈现较强的线性相关性.可能的机制为摩擦表面脂肪颗粒聚集形成脂肪球,导致界面摩擦系数降低,油脂感增强。 Sonne等[29]提出的结合流变、摩擦、化学组分和颗粒特性的综合效应对添加乳清蛋白后的搅拌酸奶的乳脂状感觉进行分析,研究中强调的显著相关性包括:“颗粒度”与颗粒大小呈正相关;“口腔黏度”与流变学数据呈正相关, 与摩擦系数负相关而“乳脂状” 与颗粒大小相关的数据和摩擦学数据呈负相关。
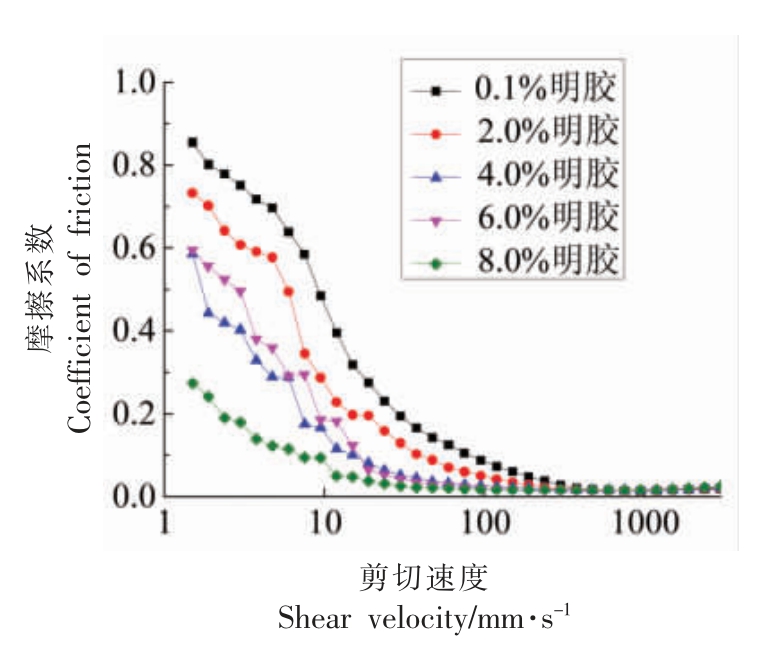
图6 不同质量分数明胶制备的S/O/W 乳液的摩擦系数
Fig.6 Friction coefficients of S/O/W emulsions prepared by different mass fraction of gelatin
注:S/O 相添加量为5%。
2.7 明胶质量分数对S/O/W 乳状液微观结构的影响
2.7.1 CLSM 微观结构 不同GE 质量分数对S/O/W 乳状液微粒CLSM 微观结构的影响如图7 所示。其中,大豆油O 相用疏水性染料尼罗红染色后在激发波长488 nm 下呈绿色,NaCas 和GE 水相用亲水性染料尼罗蓝A 染色后在激发波长635 nm 下呈红色,CaCO3 分子(无染料)呈黑色。
由图7 可知, 随着GE 质量分数的增加,S/O/W 乳状液微粒粒径有所减小,整体分布较为均匀,与图1 结果一致。 当GE 质量分数较低时,S/O/W乳状液微粒尺寸分布范围较广,此时微粒Zeta 电位较低且低质量分数GE 分子与NaCas 分子发生桥接机会少,造成乳液稳定性较差。 随着GE 质量分数增加,静电排斥力增加,分布变得均匀。 碳酸钙具有极强的亲水性,且其亲水性强于亲油性,故形成的S/O/W 钙-脂质微球的微观结构,钙包埋效果一般靠近外水相[30]。


图7 不同质量分数明胶制备的S/O/W 乳液的CLSM 微观结构
Fig.7 CLSM microstructure of S/O/W emulsions prepared by different mass fraction of gelatin
注:S/O 相添加量为5%;1. O 相用尼罗红染色;2. W 相用尼罗蓝A 染色;3. A 与B 叠加;4. 100×明场视野。
2.7.2 Cryo-SEM 微观结构 综合分析上述Zeta电位、粒径、物理稳定性以及CLSM 微观结构可以看出GE 质量分数对S/O/W 乳状液的影响更大。通过Cryo-SEM 进一步观察不同GE 质量分数构建的S/O/W 乳状液微粒, 以便更直观地研究其对乳状液的影响,结果如图8 所示。蛋白类亲水胶体明胶可以有效地增强蛋白凝胶网络密度, 使硬度及黏度显著提升[31]。当GE 质量分数较低时,S/O/W乳状液微粒尚未形成三维网络结构, 整体结构较为松散,呈片层状,乳状液液滴通过丝状物与之相连。 随着GE 质量分数增加,S/O/W 乳状液微粒逐渐形成了蜂窝状三维空间网络结构, 乳状液液滴均匀地分布其中。 这表明带正电荷的GE 分子逐渐与带负电荷的NaCas 分子形成带有高负电荷层的蜂窝状三维空间网络结构, 通过静电排斥与空间位阻共同提高微粒的稳定性。Cryo-SEM 微观结构进一步证明了GE 质量分数的增加可以促进S/O/W 乳状液微粒蜂窝状三维空间网络结构的形成,物理稳定性提高。

图8 不同质量分数明胶制备的S/O/W 乳状液的低温扫描电镜成像
Fig.8 Low-temperature scanning electron microscopy imaging of S/O/W emulsions prepared by different mass fraction of gelatin
注:S/O 相添加量为5%。
3 结论
以食品级碳酸钙为S 相,大豆油为O 相,酪蛋白酸钠-明胶为W 相,构建S/O/W 钙-脂质微球,研究多方面因素对其乳状液稳定性的影响。 研究结果表明, 添加不同质量分数的明胶均能提高S/O/W 乳液的稳定性, 且乳液粒径随明胶质量分数的增大而减小, 乳液的表观黏度、 摩擦系数均减小,微观网络结构更加致密;增大S/O 相添加量会使乳液稳定性变差、粒径分布范围增大、表观黏度略有增加。
通过研究难溶性钙盐在液态食品中的分散稳定性问题,为设计三相(S、O、W)基质传递系统奠定理论基础, 可解决固相营养素成分加工的技术难题,在食品与医药行业具有广阔的应用前景。
[1] 刘杏念, 王凌, 李斌, 等. 重质碳酸钙稳定的O/W型Pickering 乳液及其粒度效应研究[J]. 食品与机械,2019, 35(4): 20-25, 112.
LIU X N, WANG L, LI B, et al. O/W Pickering emulsions stabilized by CaCO3 and particle size effect[J]. Food & Machinery, 2019, 35(4): 20-25,112.
[2] KOPIC S, GEIBEL J P. Gastric acid, calcium absorption, and their impact on bone health[J]. Physiological Reviews, 2013, 93(1): 189-268.
[3] MCINTYRE I, O'SULLIVAN M, O' RIORDAN D.Monitoring the progression of calcium and protein solubilization as affected by calcium chelators during small-scale manufacture of casein-based food matrices[J]. Food Chemistry, 2017, 237: 597-604.
[4] QU B, ZHONG Q X. Casein-maltodextrin conjugate as an emulsifier for fabrication of structured calcium carbonate particles as dispersible fat globule mimetics[J]. Food Hydrocolloids, 2017, 66: 61-70.
[5] 刘丽娅, 赵强忠, 孔静, 等. 黄原胶对酪蛋白酸钠乳状液稳定性的影响[J]. 食品工业科技, 2012, 33(5): 83-86.
LIU L Y, ZHAO Q Z, KONG J, et al. Effect of xanthan gum on stability of sodium caseinate emulsion[J]. Science and Technology of Food Industry,2012, 33(5): 83-86.
[6] 李爱珍, 邵秀芝, 刘兰图. 明胶-壳聚糖可食性复合包装膜性能影响因素[J]. 粮食与油脂, 2009(7):17-18.
LI A Z, SHAO X Z, LIU L T. Peformance influencing factors of gelation-edible chitosan composite packaging film[J]. Cerals & Oils, 2009(7): 17-18.
[7] HUDA M K, DAS P P, BARUAH S D, et al.Polycaprolactone -blended gelatin microspheres and their morphological study[J]. J Polym Res, 2017, 24(5): 72.
[8] DAPUETO N, TRONCOSO E, MELLA C, et al.The effect of denaturation degree of protein on the microstructure, rheology and physical stability of oil-in-water (O/W) emulsions stabilized by whey protein isolate[J]. Journal of Food Engineering, 2019,263: 253-261.
[9] SURH J, DECKER E A, MCCLEMENTS D J.Properties and stability of oil-in-water emulsions stabilized by fish gelatin [J]. Food Hydrocolloids,2006, 20(5): 596-606.
[10] DICKINSON E. Interfacial structure and stability of food emulsions as affected by protein-polysaccharide interactions[J]. Soft Matter, 2008, 4(5): 932-942.
[11] ALBANO K M, CAVALLIERI Â L F, NICOLETTI V R. Electrostatic interaction between proteins and polysaccharides: Physicochemical aspects and applications in emulsion stabilization[J]. Food Reviews International, 2019, 35(1): 54-89.
[12] SURH J, DECKER E, MCCLEMENTS D. Influence of pH and pectin type on properties and stability of sodium-caseinate stabilized oil-in-water emulsions[J].Food Hydrocolloids, 2006, 20(5): 607-618.
[13] 畅芬芬, 李振方, 张涛, 等. 明胶-甘油-酪蛋白酸钠原位组装复合膜及分析[J]. 高分子材料科学与工程, 2013, 29(11): 155-158, 163.
CHANG F F, LI Z F, ZHANG T, et al. In-situ assembly of gelatin-glycerin-sodium caseinate composite membrane and its analysis[J]. Polymer Materi als Science and Engineering, 2013, 29 (11): 155-158, 163.
[14] 寻倩男, 雷桥, 包建强, 等. 明胶-酪蛋白酸钠可食性膜的包装性能研究[J]. 包装工程, 2013, 34(15):40-45.
XUN Q N, LEI Q, BAO J Q, et al. Study on packaging performance of gelatin-sodium caseinate edible membrane[J]. Packaging Engineering, 2013, 34(15): 40-45.
[15] PHAWAPHUTHANON N, YU D, NGAMNIKOM P,et al. Effect of fish gelatine-sodium alginate interactions on foam formation and stability[J]. Food Hydrocolloids, 2019, 88: 119-126.
[16] RITUJA U, CHEN J S. Smoothness as a tactile percept: Correlating 'oral' tribology with sensory measurements[J]. Food Hydrocolloids, 2019, 87:38-47.
[17] MA N N, GAO Q R, LI X Y, et al. Enhancing the physicochemical stability and digestibility of DHA emulsions by encapsulation of DHA droplets in caseinate/alginate honeycomb-shaped microparticles[J].Food & Function, 2020, 11(3): 2080-2093.
[18] CHAMBI H, GROSSO C. Edible films produced with gelatin and casein cross-linked with tranglut aminase[J]. Food Research International, 2006, 39(4): 458-466.
[19] YANG F, LIU S Y, XU J, et al. Pickering emulsions stabilized solely by layered double hydroxides particles: The effect of salt on emulsion formation and stability[J]. Journal of Colloid and Interface Science, 2006, 302(1): 159-169.
[20] YANG F, NIU Q, LAN Q, et al. Effect of dispersion pH on the formation and stability of Pickering emulsions stabilized by layered double hydroxides particles[J]. Journal of Colloid and Interface Science,2007, 306(2): 285-295.
[21] WANG X, LI X, XU D X, et al. Modulation of stability, rheological properties, and microstructure of hetero aggregated emulsion: Influence of oil content[J]. LWT - Food Science and Technology,2019, 109: 457-466.
[22] 龙肇. 蛋白质-多糖交互作用对高乳脂乳浊液稳定性的影响及作用机理研究[D]. 广州: 华南理工大学,2014.
LONG Z. Study on the effect of protein-polysaccharide interaction on the stability of high fat emulsion and the mechanism of action[D]. Guangzhou: South China University of Technology, 2014.
[23] MAIER C, ZEEB B, WEISS J. Investigations into aggregate formation with oppositely charged oil-inwater emulsions at different pH values[J]. Colloids and Surfaces B: Biointer races, 2014, 17: 368-375.
[24] VIGNATI E, PIAZZA R, LOCKHART T P. Pickering emulsions: Interfacial tension, colloidal layer morphology, and trapped-particle motion[J]. Langmuir, 2003, 19(17): 6650-6656.
[25] JUAREZ J A, WHITBY C P. Oil-in-water Pickering emulsion destabilization at low particle concentrations[J]. Journal of Colloid and Interface Science,2012, 368(1): 319-325.
[26] WANG J M, XIA N, YANG X Q, et al. Adsorption and dilational rheology of heat-treated soy protein at the oil-water interface: Relation ship to structural properties[J]. Joural of Agricultural and Food Chemistry, 2012, 60(12): 3302-3310.
[27] 许朵霞, 祖力皮亚·艾合买提, 王旭, 等. 层层组装对叶黄素乳状液环境响应物理稳定性的影响[J]. 中国食品学报, 2016, 16(5): 45-50.
XU D X, AHEMATIE Z, WANG X, et al. Effects of layer assembly on physical stability of lutein emulsion under environmental response[J]. Journal of Chinese Institute of Food Science and Technology,2016, 16(5): 45-50.
[28] CHOJNICKA-PASZUN A, DE JONGH H H J, DE KRUIF C G. Sensory perception and lubrication properties of milk: Influence of fat content[J]. International Dairy Journal, 2012, 26(1): 15-22.
[29] SONNE A, BUSCH-STOCKFISCH M, WEISS J, et al. Improved mapping of in-mouth creaminess of semi-solid dairy products by combining rheology,panicle size, and tribology data[J]. LWT - Food Science and Technology, 2014, 59(1): 342-347.
[30] MOSCHAKIS T. Microrheology and particle tracking in food gels and emulsions[J]. Current Opinion in Colloid & Interface Science, 2013, 18(4): 311-323.
[31] 庞志花, 曹金诺, 郑羽萌, 等. 不同类型亲水胶体对豆乳酸奶质构、流变学特性的影响[J]. 食品与发酵工业, 2019, 45(3): 1-6.
PANG Z H, CAO J N, ZHENG Y M, et al. Effects of different types of hydrophilic colloid on texture and rheological properties of soybean milk yoghurt[J]. Food and Fermentation Industry, 2019, 45(3): 1-6.