酒精性肝病 (Alcoholic liver disease, ALD)是长期大量饮酒引起的一种慢性肝脏疾病[1]。据世界卫生组织(WHO)统计,全球ALD 总体患病率为6%,并且各国每年在ALD 上的支出也逐年增加,占全球疾病总负担的5.1%[2]。 戒酒是目前治疗ALD 的最佳方式[3-4]。临床上可通过皮质类固醇、己酮可可碱等药物治疗ALD,然而,这些药物的副作用存在较大争议[5-6]。 ALD 患者出现的继发性营养不良,通常需要营养支持来治疗,即提供高蛋白、低脂饮食以及补充维生素和一些微量元素等[6]。
骆驼乳是一种营养均衡的全价食品, 能够提供人体所需的全部营养物质[7]。骆驼乳中蛋白质含量为2.73~3.97 g/100 mL[8],富含人体所需全部必需氨基酸,是一种完全蛋白质,且97%~98%的驼
乳蛋白能被人体吸收[9]。骆驼乳脂肪球直径小于牛乳和羊乳,更容易消化吸收。此外,其饱和脂肪酸、单不饱和脂肪酸和多不饱和脂肪酸的比值比牛乳和羊乳更接近FAO/WHO 推荐值(1∶1∶1)[10]。 骆驼乳中VC 含量是牛乳的2~3 倍[11];锌元素含量为4.67~6.94 μg/g,是牛乳的1.23 倍[12]。 体外研究显示,骆驼乳具有抗氧化[13]、抑菌消炎[14]的作用。体内试验表明骆驼乳对酒精性肝损伤具有保护作用[15-16]。然而, 上述ALD 动物模型尚不能完全模拟人类ALD 的发病特点[17-18]。 为此,本研究采用被广泛认可的NIAAA 模型,探讨骆驼乳对小鼠肝脏的保护作用, 为进一步开发保肝护肝功能性食品提供理论依据。
1 材料与方法
1.1 材料与试剂
C57BL/6NCr 小鼠【SPF 级、雄性、8~10 周龄、体质量(20±2)g】,购于北京维通利华试验动物技术有限公司, 生产许可证号:SCXK (京)2016-0006;Lieber-DeCarli (LDC) 液体饲料: 分为4%Lieber-DeCarli 酒精液体饲料和Lieber-DeCarli 对照液体饲料,南通特洛菲饲料科技有限公司,生产许可证号:苏饲证(2014)06092。
骆驼乳采自内蒙古自治区巴彦淖尔市牧区;美他多辛片(C13H18N2O6),山东齐都药业有限公司;谷丙转氨酶(Alanine aminotransferase, ALT)、谷草转氨酶(Aspartate aminotransferase, AST)、丙二醛(Malondialdehyde, MDA)、超氧化物歧化酶(Superoxide dismutase, SOD)、 谷胱甘肽(Glutathione, GSH)、甘油三酯(Triglyceride, TG)测定试剂盒, 南京建成生物工程研究所; 肿瘤坏死因子-α (Tumor necrosis factor-α, TNF-α)、 白介素-1β(Interleukin-1β, IL-1β)、白介素-6(Interleukin-6, IL-6)、白介素-10(Interleukin-10, IL-10)、 半胱天冬蛋白酶-3 (Caspase-3, Casp-3)ELISA 试剂盒,上海酶联生物科技有限公司;苏木素、伊红(Hematoxylin eosin, HE)染色液,珠海贝索生物技术有限公司;油红O 染色液,上海源叶生物科技有限公司;原位末端凋亡法(Tunel)试剂盒,瑞士Roche 公司;DAB 浓缩型试剂盒,上海长岛生物技术有限公司。
1.2 仪器与设备
Richter 液体饲料饲养瓶,南通特洛菲饲料科技有限公司;SQ510C 立式压力蒸汽灭菌器, 上海申安医疗器械厂;DK-8AXX 电热恒温水槽, 上海一恒科学仪器有限公司;5810R 台式高速冷冻离心机, 德国Eppendorf 公司;Bead Ruptor 12 组织研磨匀浆仪,美国OMNI 公司;Synergy H1 多功能微孔板检测仪,美国BioTek 公司;SQ2125 石蜡切片机、CM1850 冰冻切片机、DS-Ri2 显微图象分析系统,德国Leica 公司;ECLIPSE Ci 正置显微镜,日本Olympus 公司。
1.3 试验方法
1.3.1 骆驼乳与美他多辛溶液的配制
1) 骆驼乳 样品采集后常温离心 (3 500 r/min,40 min)、脱脂,真空冷冻干燥,乳粉置于4 ℃备用。 使用前,参考Ming 等[15]的研究按照对应剂量复原骆驼乳。 骆驼乳高剂量组(EtCM_H)、低剂量组(EtCM_L)的灌胃剂量分别为3 g/kg 和1.5g/kg。 以灌胃剂量3 g/kg 为例,当小鼠平均体质量为m0 (kg)时,每次灌胃量0.3 mL,需要配制乳液质量浓度为10 m0 g/mL,实际体质量为m (kg)的小鼠需要灌胃的体积按下式计算:
2) 美他多辛溶液 将美他多辛药片置于研钵中碾碎成粉末状,过60 目筛,筛下物按照剂量溶于灭菌ddH2O 进行灌胃, 灌胃剂量为300 mg/kg。
1.3.2 动物分组与处理 小鼠适应性饲养1 周后,随机分为对照组、模型组、骆驼乳高剂量组、骆驼乳低剂量组、阳性对照组。 分组后单笼饲养,饲喂专用饲料,专用Richter 喂养管给食,小鼠饲喂量30 mL/(只·d),不另外提供饮用水(详见表1)。每日更换专用饲料以防止酒精蒸发导致酒精浓度不足, 对本试验结果产生影响, 饲料更换时间为16:00~17:00。 试验周期为8 周。 前4 周仅饲喂专用饲料(含对照),不灌胃;后4 周饲喂方式不变,每天8:00~9:00 之间灌胃给乳或美他多辛(灌胃体积0.3 mL),每日1 次。
表1 各试验组所饲喂饲料和试验处理方式
Table 1 Feed and experimental treatments of each group

组别 简称 动物数量/只 是否过渡饲养 饲料(2~9 周) 灌胃试验对照组 Con 8 否 LDC 对照液体饲料 生理盐水(0.3 mL)模型组 Et 8 是 LDC 酒精液体饲料 生理盐水(0.3 mL)骆驼乳高剂量组 EtCM_H 8 是 LDC 酒精液体饲料 骆驼乳(剂量3 g/kg)骆驼乳低剂量组 EtCM_L 8 是 LDC 酒精液体饲料 骆驼乳(剂量1.5 g/kg)阳性对照组 Mod 8 是 LDC 酒精液体饲料 美他多辛(剂量300 mg/kg)[19]
NIAAA 模型按如下方式建立:第1 周采用过渡饲喂法[20],第2~9 周期间,Et 组接受4% LDC 酒精液体饲料饲喂8 周,对照组饲喂等热量LDC 对照液体饲料。第9 周初开始,Et 组按照5 g/kg 剂量一次性灌胃体积分数31.5%酒精溶液, 对照组灌胃等热量的麦芽糖糊精溶液[18-21](如图1 所示)。
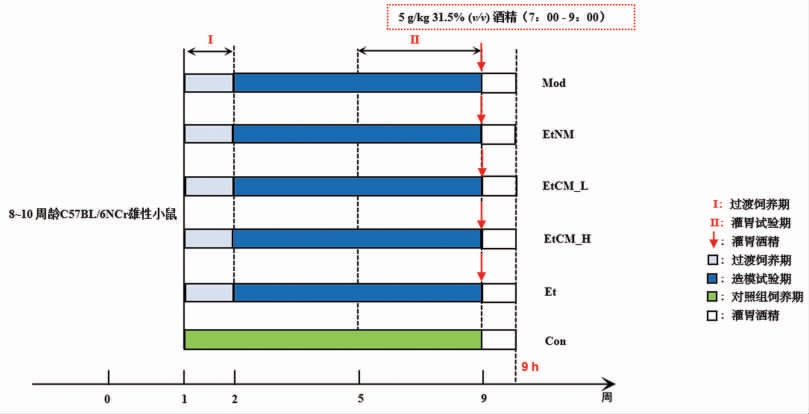
图1 动物实验简图(NIAAA 模型)
Fig.1 Animal test sketch (NIAAA model)
上述大剂量酒精溶液灌胃结束后,禁食、禁水9 h 后,利用异氟烷麻醉小鼠,摘眼球取血,采用颈椎脱臼法处死小鼠,解剖留取肝脏组织。肝左叶用于组织病理学观察, 其余肝脏用于检测肝脏指标。
1.3.3 生化指标测定 血清、 血液常温静置4 h后,离心(4 ℃,3 000 r/min,20 min)分离血清待测;准确称取0.1 g 肝组织,加入9 倍质量的预冷PBS进行匀浆,匀浆完毕后,离心(4 ℃,3 000 r/min,25 min)取上清待测。
按照试剂盒说明书, 分别检测肝损伤指标(ALT 和AST), 肝脏抗氧化指标(SOD,GSH,MDA), 肝脏炎症水平 (TNF-α,IL-1β,IL-6,IL-10)。
1.3.4 肝脏病理学检查 将新鲜的小鼠肝左叶片切成1.5 cm×1.5 cm×0.3 cm 组织块置于10%福尔马林中固定48 h。组织块经乙醇脱水,再经乙醇和二甲苯混合液脱水至透明之后, 用石蜡液浸渍3 h 后用石蜡包埋,然后切成厚度为4~7 μm 的切片。 对切片进行HE 染色,先用苏木素染色,再用伊红染色切片。最后,通过光学显微镜观察肝脏中央的图像[22]。
1.3.5 肝脏内脂肪蓄积程度的检测 按1.3.4 节切片要求将切好的组织块置于液氮表面停留30 s后放入-20 ℃冰箱,复温30 min。 用胶水包埋后切成厚度为5~7 μm 切片,将切片贴附于预先用多聚赖氨酸包被的载玻片上,立即放入固定液中固定。对切片进行油红O 染色, 先用油红O 染液10 min,再用60%异丙醇分色,之后用Mayer 苏木精复染。 最后,通过显微镜观察样本相关部位[23]。
参考试剂盒说明书,检测肝脏中TG 含量。
1.3.6 肝细胞凋亡检测 参照1.3.4 节的方法得到石蜡切片, 然后参考Tunel 试剂盒说明书进行细胞染色,先用DAB 染色,再用苏木素复染切片。在光学显微镜下,采集分析肝脏的相关部位,计算肝脏细胞凋亡率。
参考试剂盒说明书, 检测肝脏细胞凋亡活性(Casp-3)。
1.4 统计学分析
试验结果采用平均值±标准差表示。 采用SPSS 19.0 和Graphpad prism 7 统计软件对试验数据进行显著性分析和绘图。调用PROC ANOVA进行单因素平衡方差分析。 应用Duncans 法进行多重比较,通过t 检验进行显著性分析。 与正常组比较,*表示P<0.05,**表示P<0.01; 与模型组比较,#表示P<0.05,##表示P<0.01。
2 结果与分析
2.1 骆驼乳对慢性酒精性肝损伤小鼠血清ALT和AST 活力的影响
图2 结果显示,与Con 组相比较,Et 组小鼠血清中ALT 和AST 活力显著升高(P<0.01),其中Et组血清ALT 活力是Con 组的2.39 倍,表明小鼠的肝脏细胞受到损伤,该试验结果能够说明,NIAAA模型可以成功复制慢性酒精性肝损伤模型。 与Et组相比较,EtCM_H,EtCM_L 和Mod 组小鼠血清中ALT 和AST 活力均显著降低,其中EtCM_H 组血清中的ALT 和AST 活力下降程度已达到Con组的水平(P<0.01),说明骆驼乳能够在一定程度上保护小鼠肝脏免受酒精的损伤作用。
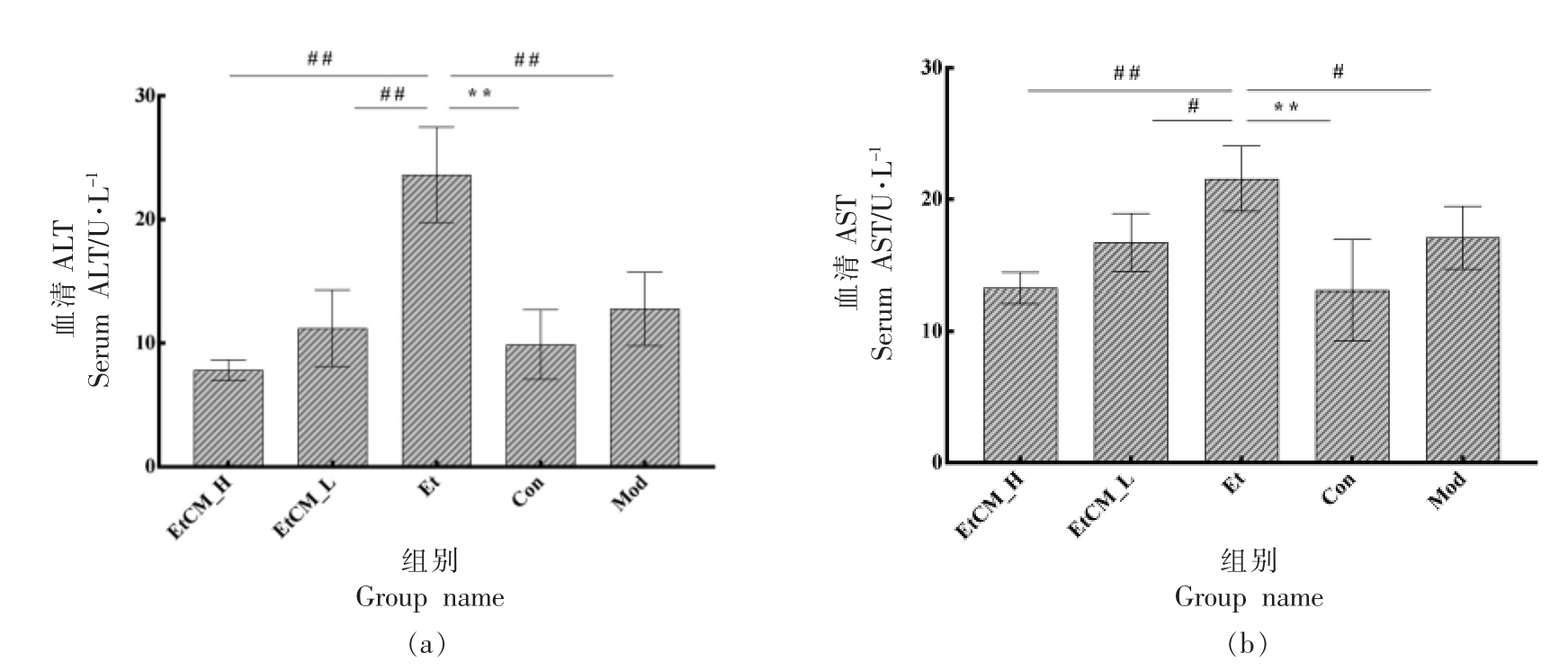
图2 骆驼乳对小鼠血清ALT 及AST 含量的影响
Fig.2 Effects of camel milk on serum ALT and AST content
2.2 骆驼乳对慢性酒精性肝损伤小鼠肝脏抗氧化能力的影响
表2 结果显示,与Con 组相比较,Et 组小鼠肝组织SOD 活力和GSH 含量显著降低 (P<0.05),MDA 含量显著升高 (P<0.05)。 与Et 组相比,EtCM_H 和EtCM_L 组小鼠肝组织SOD 活力和GSH 含量均显著升高(P<0.05),MDA 含量显著降低(P<0.05)并恢复到正常水平,且EtCM_H 组的效果最佳。 与Et 组相比,Mod 组小鼠肝组织SOD活力和GSH 含量显著升高(P<0.05),而MDA 的含量无显著变化(P>0.05)。 这一结果表明骆驼乳对酒精引起的脂质过氧化具有明显的保护作用。
表2 骆驼乳对小鼠肝组织抗氧化能力的影响
Table 2 The effect of camel milk on the antioxidant capacity of liver tissue in mice
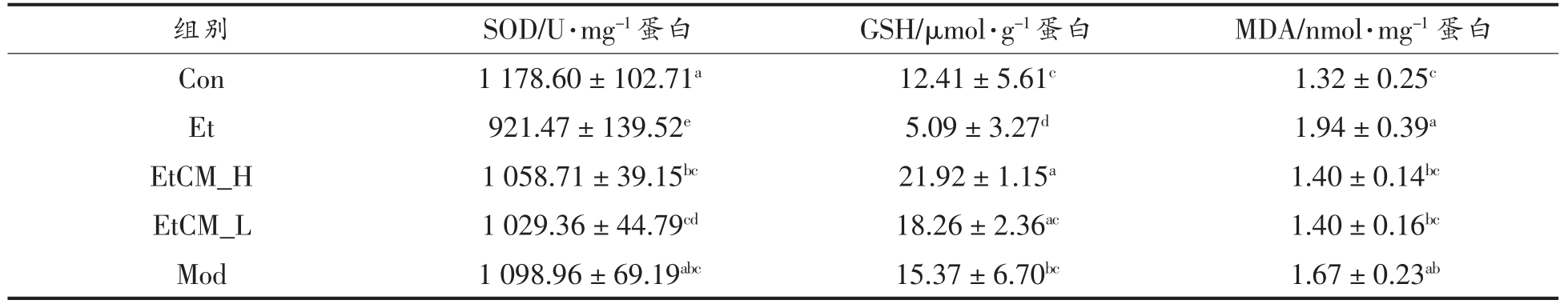
注:同列标有不同字母表示组间差异显著(P<0.05),标有相同字母表示差异不显著(P>0.05)。
组别 SOD/U·mg-1 蛋白 GSH/μmol·g-1 蛋白 MDA/nmol·mg-1 蛋白Con 1 178.60±102.71a 12.41±5.61c 1.32±0.25c Et 921.47±139.52e 5.09±3.27d 1.94±0.39a EtCM_H 1 058.71±39.15bc 21.92±1.15a 1.40±0.14bc EtCM_L 1 029.36±44.79cd 18.26±2.36ac 1.40±0.16bc Mod 1 098.96±69.19abc 15.37±6.70bc 1.67±0.23ab
2.3 骆驼乳对慢性酒精性肝损伤小鼠肝脏炎症水平的影响
图3 结果显示,与Con 组相比较,Et 组小鼠肝组织TNF-α、IL-1β 和IL-6 含量显著升高 (P<0.01),IL-10 的含量显著降低(P<0.05),表明酒精大量摄入诱导肝脏细胞释放大量炎症相关因子。与Et 组相比,EtCM_H 和EtCM_L 组小鼠肝组织TNF-α、IL-1β 和IL-6 的含量显著降低(P<0.01),IL-10 的含量显著上升 (P<0.01)。 与Et 组相比,Mod 组小鼠肝组织TNF-α(P<0.01)、IL-6(P<0.01)和IL-1β(P<0.05)的含量显著降低,IL-10 的含量显著上升(P<0.01)。 试验结果表明,骆驼乳有效减少了酒精诱导的促炎因子的分泌, 促进抗炎因子的产生,缓解了炎症反应。
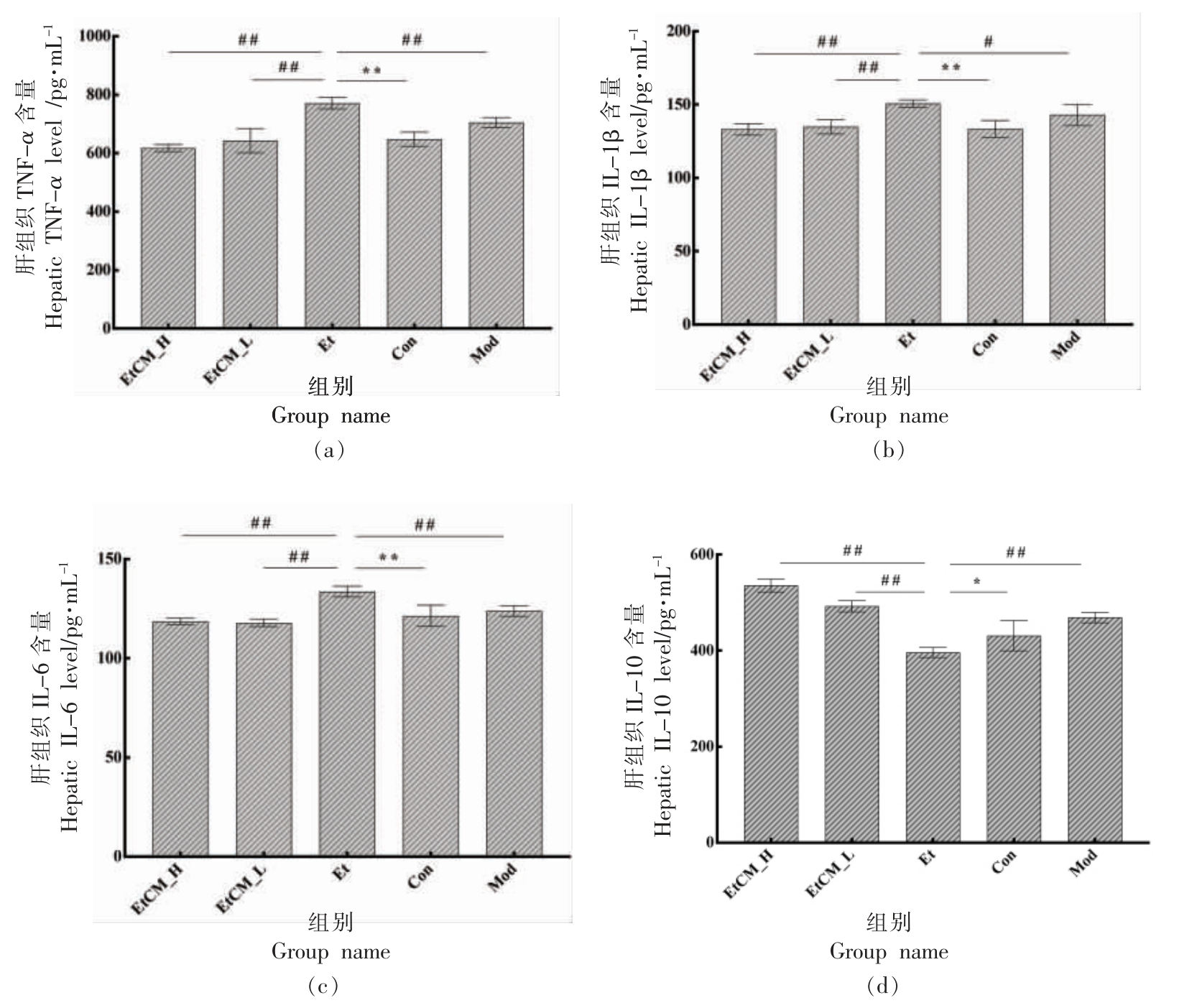
图3 骆驼乳对慢性酒精性肝损伤小鼠机体炎症反应的的影响
Fig.3 Effects of camel milk on inflammatory response in mice with chronic alcoholic liver injury
2.4 骆驼乳对慢性酒精性肝损伤小鼠肝脏组织病理学的影响
肝脏石蜡切片HE 染色能够直观反映肝脏病理损伤变化情况。 如图4 所示, 光镜下可见,Con组小鼠肝细胞中有严重水肿空泡,无病变;Et 组小鼠肝细胞中有严重脂肪性病变,有严重水肿空泡;EtCM_H 组和EtCM_L 组小鼠肝细胞中细胞排列较为规则, 有轻微脂肪病变, 部分细胞有水肿空泡;Mod 组小鼠肝细胞出现脂肪性病变,出现轻微水肿空泡,这可能是因为美他多辛灌胃剂量不足,导致药效较弱。 与Con 组相比,Et 组小鼠肝细胞有严重的脂肪性病变, 说明小鼠肝脏受到酒精的伤害;与Et 组相比,EtCM_H 组、EtCM_L 组和Mod组小鼠肝细胞脂肪性病变,肝细胞水肿现象减轻,肝小叶结构逐渐恢复正常, 特别是EtCM_H 组小鼠的干细胞排列较为规则。上述结果说明,骆驼乳和美他多辛都能够缓解乙醇引起的肝细胞脂肪病变和肝细胞水肿情况, 从而使得肝细胞的结构逐渐恢复正常。
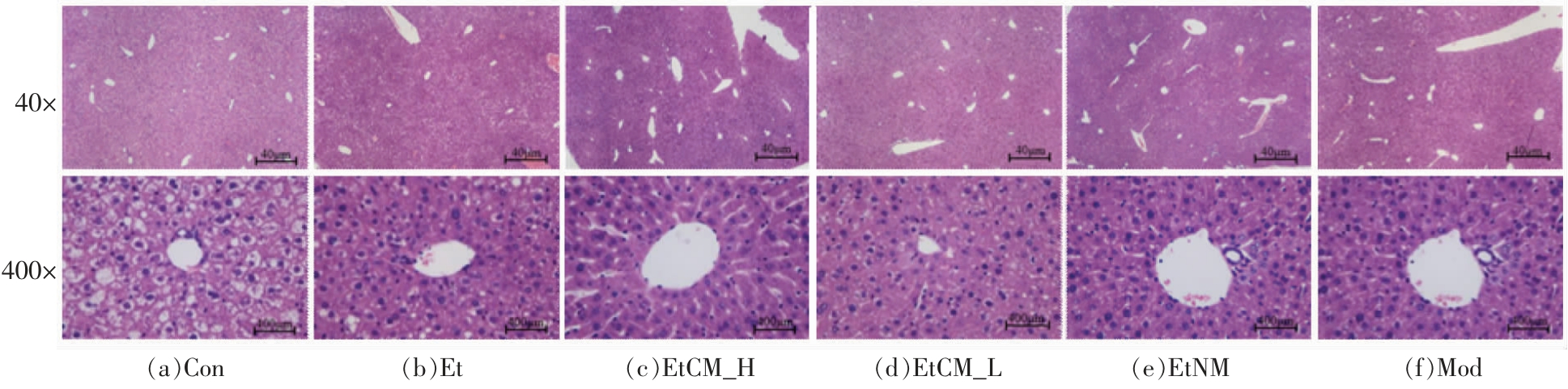
图4 骆驼乳对小鼠肝脏组织病理学的影响
Fig.4 Effects of camel milk on liver histopathology
2.5 骆驼乳对慢性酒精性肝损伤小鼠肝脏脂肪变性的影响
图5 油红O 染色结果显示,Con 组小鼠肝脏有明显小型脂肪空泡,无脂肪变性;表明等热量饲养会引起脂质蓄积。 Et 组小鼠肝脏有严重脂肪变性, 且肝脏内有大型脂肪空泡;EtCM_H,EtCM_L和Mod 组小鼠肝脏内脂肪变性不同程度减轻,其中EtCM_H 效果最佳。 该结果与HE 染色结果相一致。上述结果再一次说明,骆驼乳乳能够缓解慢性酒精性肝损伤小鼠肝细胞脂质蓄积, 并减轻脂肪变性。
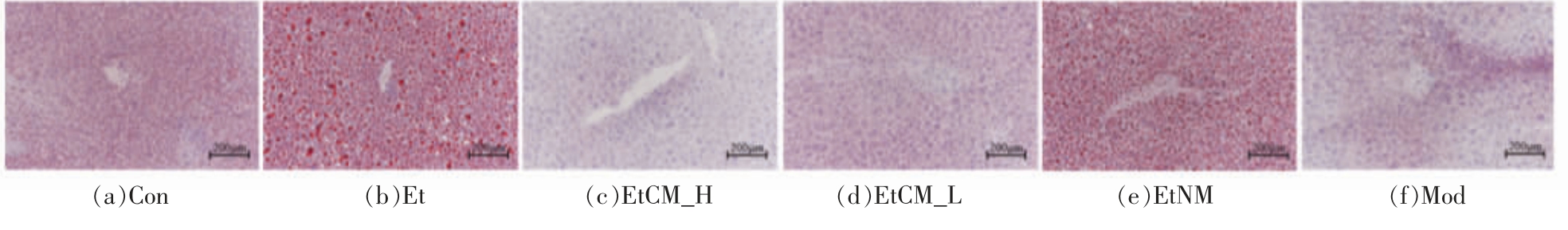
图5 骆驼乳对慢性酒精性肝损伤小鼠肝脏脂肪变性组织病理学的影响(200×)Fig.5 Effects of camel milk on histopathology of liver fatty degeneration in mice with chronic alcoholic liver injury (200×)
图6 结果显示,与Con 组相比,Et 组小鼠肝组织TG 含量显著升高(P<0.01)。 其中,Et 组小鼠肝细胞中TG 含量是Con 组的2.04 倍, 表明小鼠肝细胞中有大量脂质蓄积。 与Et 组相比,EtCM_H,EtCM_L 和Mod 组小鼠肝组织TG 的含量显著降低(P<0.01),这与油红O 染色结果一致。以上结果表明,骆驼乳对慢性酒精引起的肝组织TG 含量升高的抑制作用呈剂量依赖性。
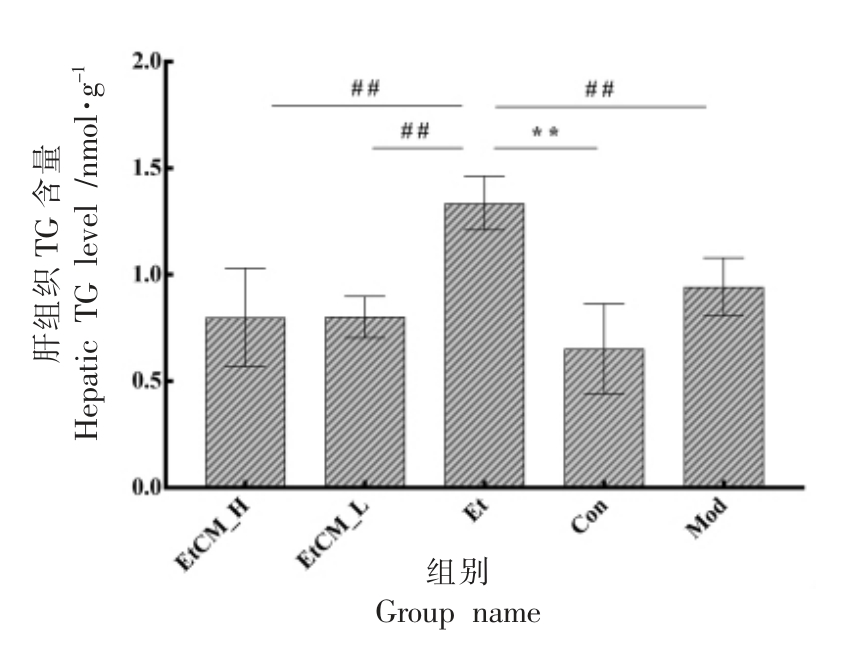
图6 骆驼乳对慢性酒精性肝损伤小鼠肝脏脂肪变性的影响
Fig.6 Effects of camel milk on hepatic steatosis in mice with chronic alcoholic liver injury
2.6 骆驼乳对慢性酒精性肝损伤小鼠肝细胞凋亡的影响
如图7 和图8b 结果所示,5 组的肝细胞凋亡率分别为Con (28.64%)、Et (48.20%)、EtCM_H(28.59%),EtCM_L(39.34%)和Mod 组(37.25%)。其中,Et 组肝细胞凋亡率最高。 各剂量组和Mod组肝细胞凋亡率较Et 组显著下降, 其中EtCM_H组肝细胞凋亡率最低(P<0.01)。
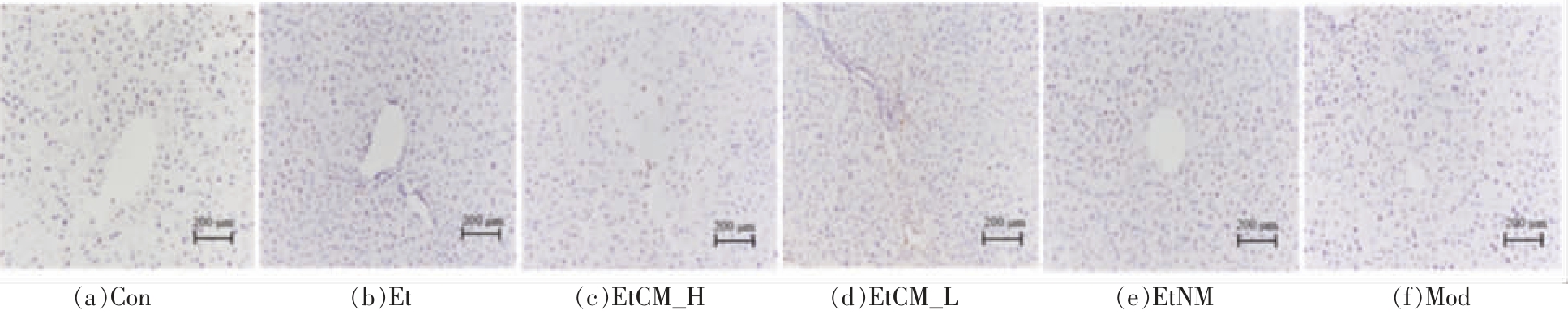
图7 骆驼乳对慢性酒精性肝损伤小鼠肝脏细胞凋亡组织病理学影响(200×)Fig.7 Effects of camel milk on histopathology of liver cell apoptosis in mice with chronic alcoholic liver injury(200×)
Casp-3 结果如图8a 所示, 与Con 组相比,Et组小鼠肝组织Casp-3 活性显著升高(P<0.01)。 与Et 组相比,EtCM_H、EtCM_L 组 (P<0.01) 和Mod组(P<0.05)小鼠肝组织Casp-3 的活性显著降低,且骆驼乳高剂量组的效果最佳。 该结果与TUNEL染色结果相一致, 表明骆驼乳能够在一定程度上改善酒精诱导的肝细胞大量凋亡的情况。
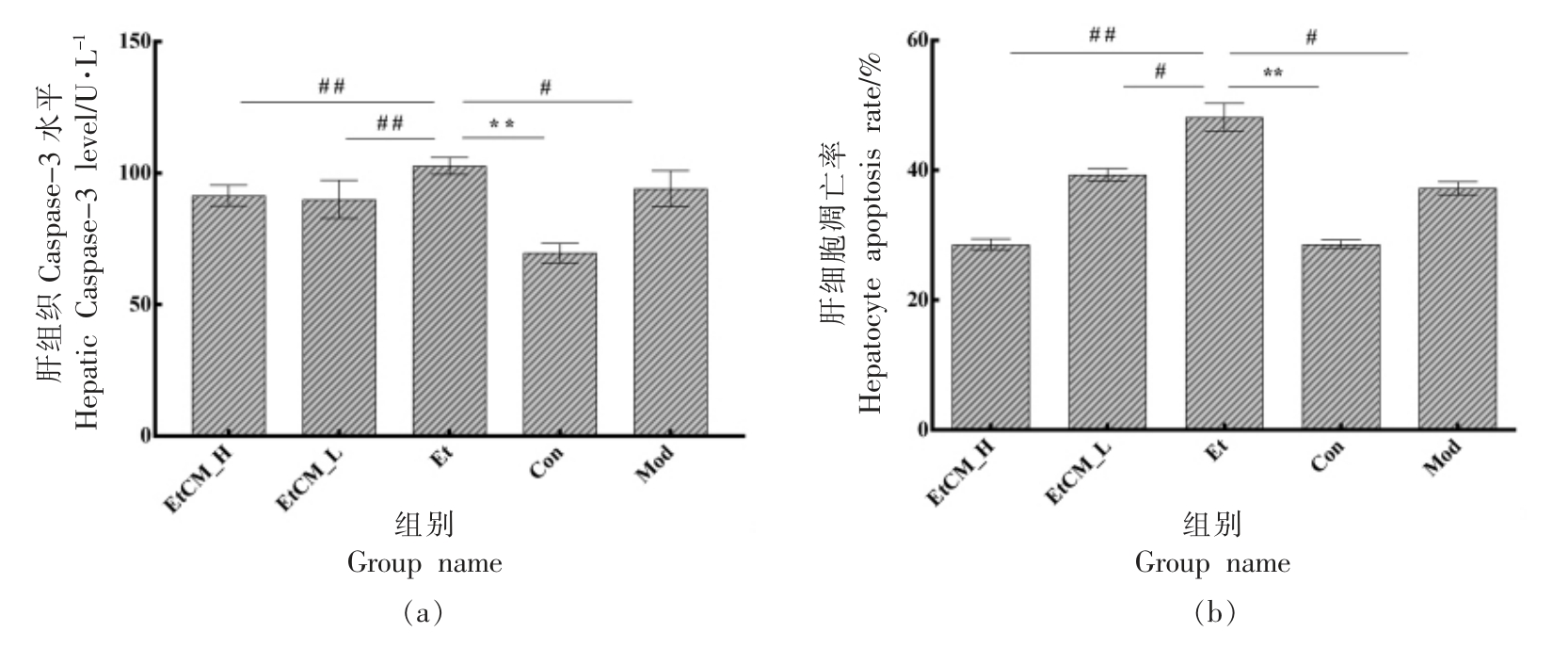
图8 骆驼乳对慢性酒精性肝损伤小鼠肝脏细胞凋亡的影响
Fig.8 Effects of camel milk on liver cell apoptosis in mice with chronic alcoholic liver injury
3 讨论
NIAAA 模型克服了小鼠厌酒性,降低了小鼠死亡率,能成功诱导酒精引起的病理性并发症[21]。NIAAA 模型与ALD 患者的饮酒模式高度相似,兼有ALD 患者多年慢性饮酒背景(慢性)和近期过度饮酒病史(急性)的特点[18]。 本试验Et 组血清ALT 和AST 活性显著升高,肝细胞发生严重的病变,表明NIAAA 模型成功建立,这与Zhang 等[24]的试验结果一致。 与Et 组相比,不同剂量骆驼乳和美他多辛能够显著降低小鼠血清ALT 和AST活性,提高肝组织抗氧化能力,改善肝脏组织学状态,这说明骆驼乳对Lieber-DeCarli 液体饲料诱导的小鼠酒精性肝损伤具有保护作用, 这与课题组先前的研究结果共同证实了骆驼乳对酒精性肝损伤具有保护作用[15]。
氧化应激是ALD 的主要发病机制之一[25]。 长期大量饮酒导致肝脏中ROS 激增,消耗大量抗氧化剂(如GSH、SOD 等),导致机体氧化-抗氧化平衡失调,引起氧化应激[26]。 过量的自由基会和脂质发生脂质过氧化反应,产生MDA 进一步加剧氧化应激[27]。 本试验结果显示,Et 组小鼠肝组织SOD活力和GSH 含量显著降低,MDA 含量显著升高;表明在Et 组小鼠体内发生了较为严重的脂质过氧化反应,这与Choi 等[28]和Xia 等[29]的试验结果一致。经不同剂量骆驼乳干预处理后,小鼠肝组织SOD 活力和GSH 含量均显著升高,MDA 含量显著降低,并恢复到正常水平,且EtCM_H 剂量组效果最佳。 这一结果表明骆驼乳对酒精引起的脂质过氧化具有明显的保护作用。近年来,关于骆驼乳的抗氧化作用已在多种干预处理模型中均有过报道。 在动物实验中,Meena 等[30]研究发现骆驼乳可改善Ⅰ型糖尿病试验大鼠的高血糖和氧化损伤。此外,与山羊、牛和水牛乳相比,只有骆驼乳可以完全改善胰腺的氧化损伤并使胰岛素水平正常化。Ming 等[15]研究发现,骆驼乳可以改善急性酒精性肝损伤小鼠的氧化损伤。 Ibrahim 等[31]研究发现骆驼乳外泌体对环磷酰胺诱导的大鼠免疫毒性和氧化应激有改善作用。在体外试验中,Ibrahim 等[32]研究发现骆驼乳含有的酪蛋白和乳清蛋白都含有具备清除自由基活性的生物活性肽。总的来说,骆驼乳能减轻慢性酒精引起的氧化损伤, 可能与它的蛋白质和外泌体有关。 酒精性脂肪肝是早期ALD 的一种表现[33],转录因子甾醇调节元件结合转录因子1c (Sterol regulatory element-binding protein 1c, SREBP-1c)和过氧化物酶体增殖物激活受体α(Peroxisome proliferator-activated receptor α, PPAR-α) 的异常表达是导致脂肪变性的直接原因[30],ROS 以及TNF-α 会损害甘油三酯的分泌和运输,加速脂肪变性[33]。 本试验中可见,Et组小鼠肝细胞中的TG 含量是Con 组的2.04 倍,油红O 染色证实了这一结果, 小鼠肝细胞内有大量脂滴积累,发生严重的脂肪变性,这与Zhang 等[24]试验结果一致。 炎症因子试验结果再一次证实酒精损害了肝细胞的甘油三酯分泌和运输, 而经骆驼乳干预处理后, 小鼠肝细胞中TG 含量显著降低。 在ALD 早期,通过膳食补充富含蛋白质、低脂肪、维生素(VC、VE 等)以及矿质元素(锌、硒等)的食物是逆转早期ALD 关键所在[6]。 骆驼乳是六高一低(高:完全蛋白、必需氨基酸、不饱和脂肪酸、VC、烟酸、钙;低:过敏原)的优质乳品。 既往研究表明,骆驼乳具有改善脂质谱的潜力[8]。 Meena等[34]研究发现,骆驼乳体外抗氧化活性比牛乳高约3 倍, 并降低胆固醇的治疗潜力比牛乳和羊乳好。 Korish 等[35]研究发现,骆驼乳能显著降低高脂饲料引起的NAFLD 大鼠的血脂指标。 乔向宇等[36]研究发现自然发酵驼乳能够减轻急性酒精所致的小鼠肝脏脂肪变性程度。 Mohammaddin 等[37]通过一项单盲随机临床试验发现骆驼乳可以替代他汀类药物治疗血脂异常。 骆驼乳减轻慢性酒精所致的脂质蓄积和脂肪变性, 可能归因于骆驼乳富含的营养物质, 而具体发挥作用的物质需要进一步试验验证。
4 结论
NIAAA 模型会导致小鼠肝脏受损,而经骆驼乳干预处理4 周后能明显降低小鼠血清指标(ALT 和AST)活力,改善肝组织脂肪病变。通过提高肝脏中SOD 活力和GSH 含量,降低MDA 含量来缓解酒精所致氧化应激损伤,并通过提高IL-10来降低TNF-α 诱导的炎症反应来减轻炎症因子造成的脂肪变性,最终改善酒精诱导的慢性ALD。
骆驼乳对Lieber-DeCarli 液体饲料诱导的小鼠酒精性肝损伤具有保护作用, 并呈现剂量依赖性特点,高剂量优于低剂量;骆驼乳可能是通过提高肝细胞抗氧化能力与增加抗炎因子能力, 促进脂肪转运, 进而使肝细胞结构和功能逐渐修复来实现的这种保护作用。
[1] SINGAL A K, BATALLER R, AHN J, et al. ACG clinical guideline: Alcoholic liver disease[J]. American Journal of Gastroenterology, 2018, 113(2): 175-194.
[2] SEITZ H K, BATALLER R, CORTEZ PINTO H,et al. Alcoholic liver disease[J]. Nature Reviews Disease Primers, 2018, 4: 16-37.
[3] ROERECKE M, VAFAEI A, HASAN O S M, et al. Alcohol consumption and risk of liver cirrhosis:A systematic review and meta-analysis[J]. American Journal of Gastroenterology, 2019, 114(10): 1574-1586.
[4] ANTON R F, LATHAM P, VORONIN K, et al.Efficacy of gabapentin for the treatment of alcohol use disorder in patients with alcohol withdrawal symptoms a randomized clinical trial[J]. Jama Internal Medicine, 2020, 180(5): 728-736.
[5] SHEN T, LIU Y, SHANG J, et al. Incidence and etiology of drug-induced liver injury in mainland China[J]. Gastroenterology, 2019, 156(8): 1-12.
[6] 中华医学会肝病学分会脂肪肝和酒精性肝病学组,中国医师协会脂肪性肝病专家委员会. 酒精性肝病防治指南 (2018年更新版)[J]. 临床肝胆病杂志,2018, 34(5): 939-946.
Fatty Liver and Alcoholic Liver Disease Group,Chinese Medical Association Hepatology Branch,Fatty Liver Disease Expert Committee of Chinese Medical Doctor Association. Guidelines for prevention and treatment of alcoholic liver disease: A 2018 update[J]. Journal of Clinical Hepatology, 2018, 34(5): 939-946.
[7] HAMMAM A R A. Compositional and therapeutic properties of camel milk: A review[J]. Emirates Journal of Food and Agriculture, 2019, 31(3): 148-152.
[8] IZADI A, KHEDMAT L, MOJTAHEDI S Y. Nutritional and therapeutic perspectives of camel milk and its protein hydrolysates: A review on versatile biofunctional properties[J]. Journal of Functional Foods,2019, 60: 1-13.
[9] HAILU Y, HANSEN E B, SEIFU E, et al. Functional and technological properties of camel milk proteins: A review[J]. Journal of Dairy Research,2016, 83(4): 422-429.
[10] 李磊, 王昆, 何静, 等. 驼、牛、羊乳中脂肪酸含量的比较分析[J]. 食品科学, 2019, 40(6): 223-227.
LI L, WANG K, HE J, et al. A comparative analysis of fatty acid profiles of camel, bovine and caprine milk[J]. Food Science, 2019, 40(6): 223-227.
[11] XU R H, XIU L, ZHANG Y L, et al. Probiotic and hepatoprotective activity of Lactobacillus isolated from Mongolian camel milk products[J]. Beneficial Microbes, 2019, 10(6): 699-710.
[12] CHEN L, LI X, LI Z M, et al. Analysis of 17 elements in cow, goat, buffalo, yak,and camel milk by inductively coupled plasma mass spectrometry(ICP-MS)[J]. Royal Society of Chemistry Advances,2020, 10(12): 6736-6742.
[13] SOLEYMANZADEH N, MIRDAMADI S, MIRZAEI M, et al. Novel β-casein derived antioxidant and ACE-inhibitory active peptide from camel milk fermented by Leuconostoc lactis PTCC1899: Identification and molecular docking[J]. International Dairy Journal, 2019, 97: 201-208.
[14] ELHAMID A M A, ELBAYOUMI M M. Effect of heat treatment and fermentation on bioactive behavior in yoghurt made from camel Milk[J]. American Journal of Food Science and Technology, 2017, 5(3): 109-116.
[15] MING L, QIAO X Y, LI Y, et al. Camel milk modulates ethanol-induced changes in the gut microbiome and transcriptome in a mouse model of acute alcoholic liver disease[J]. Journal of Dairy Science, 2020, 103(5): 3937-3949.
[16] DARWISH H A, ABD RABOH N R, MAHDY A.Camel's milk alleviates alcohol-induced liver injury in rats[J]. Food and Chemical Toxicology, 2012, 50(5): 1377-1383.
[17] LEUNG T M, LU Y K, YAN W, et al. Argininosuccinate synthase conditions the response to acute and chronic ethanol-induced liver injury in mice[J].Hepatology, 2012, 55(5): 1596-1609.
[18] BERTOLA A, MATHEWS S, KI S H, et al.Mouse model of chronic and binge ethanol feeding(the NIAAA model)[J]. Nature Protocols, 2013, 8(3): 627-637.
[19] WEN D C, HU X Y, WANG Y Y, et al. Effects of aqueous extracts from Panax ginseng and Hippophae rhamnoides on acute alcohol intoxication: An experimental study using mouse model[J]. Journal of Ethnopharmacology, 2016, 192: 67-73.
[20] LIN H, CHEN D, DU Q, et al. Dietary copper plays an important role in maintaining intestinal barrier integrity during alcohol-induced liver disease through regulation of the intestinal HIF-1 alpha signaling pathway and oxidative stress[J]. Frontiers in Physiology, 2020, 11: 1-10.
[21] BERTOLA A, PARK O, GAO B. Chronic plus binge ethanol feeding synergistically induces neutrophil infiltration and liver injury in mice: A critical role for E-selectin[J]. Hepatology, 2013, 58(5):1814-1823.
[22] KONERU M, SAHU B D, GUDEM S, et al. Polydatin alleviates alcohol-induced acute liver injury in mice: Relevance of matrix metalloproteinases(MMPs) and hepatic antioxidants[J]. Phytomedicine,2017, 27: 23-32.
[23] HAN J Y, LEE S, YANG J H, et al. Korean red ginseng attenuates ethanol-induced steatosis and oxidative stress via AMPK/Sirt1 activation[J]. Journal of Ginseng Research, 2015, 39(2): 105-115.
[24] ZHANG W, ZHONG W, SUN Q, et al. Hepatic overproduction of 13-HODE due to ALOX15 upregulation contributes to alcohol-induced liver injury in mice[J]. Scientific Reports, 2017, 7(1): 1-10.
[25] ARSENE D, FAROOQ O, BATALLER R. New therapeutic targets in alcoholic hepatitis[J]. Hepatology International, 2016, 10(4): 538-552.
[26] YU X, XU Y Y, ZHANG S S, et al. Quercetin attenuates chronic ethanol-induced hepatic mitochondrial damage through enhanced mitophagy[J]. Nutrients, 2016, 8(1): 1-14.
[27] LOUVET A, MATHURIN P. Alcoholic liver disease: Mechanisms of injury and targeted treatment[J]. Nature Reviews Gastroenterology & Hepatology,2015, 12(4): 231-242.
[28] CHOI B, CHO I J, JUNG S J, et al. Lemon balm and dandelion leaf extract synergistically alleviate ethanol-induced hepatotoxicity by enhancing antioxidant and anti-inflammatory activity[J]. Journal of Food Biochemistry, 2020, 44(8): 1-16.
[29] XIA T, ZHANG J, YAO J H, et al. Shanxi aged vinegar protects against alcohol-induced liver injury via activating Nrf2-mediated antioxidant and inhibiting TLR4-induced inflammatory response[J]. Nutrients, 2018, 10(7): 7-14.
[30] MEENA S, RAJPUT Y S, PANDEY A K, et al.Camel milk ameliorates hyperglycaemia and oxidative damage in type-1 diabetic experimental rats[J]. Journal of Dairy Research, 2016, 83(3): 412-419.
[31] IBRAHIM H, MOHAMMED-GEBA K, TAWFIC A,et al. Camel milk exosomes modulate cyclophosphamide-induced oxidative stress and immuno-toxicity in rats[J]. Food and Function, 2019, 10(11):7523-7532.
[32] IBRAHIM H R, ISONO H, MIYATA T. Potential antioxidant bioactive peptides from camel milk proteins[J]. Animal Nutrition, 2018, 4(3): 273-280.
[33] LIVERO F A, ACCO A. Molecular basis of alcoholic fatty liver disease: From incidence to treatment[J]. Hepatology Research, 2016, 46(1): 111-123.
[34] MEENA S, SINGH RAJPUT Y, SHARMA R, et al. Effect of goat and camel milk vis a vis cow milk on cholesterol homeostasis in hypercholesterolemic rats[J]. Small Ruminant Research, 2019,171: 8-12.
[35] KORISH A A, ARAFAH M M. Camel milk ameliorates steatohepatitis, insulin resistance and lipid peroxidation in experimental non-alcoholic fatty liver disease[J]. BMC Complementary and Alternative Medicine, 2013, 13: 1-16.
[36] 乔向宇, 明亮, 伊丽, 等. 自然发酵驼乳对乙醇诱导的小鼠急性肝损伤的保护作用[J]. 食品工业技,2019, 40(15): 292-297.
QIAO X Y, MING L, YI L, et al. Protective effects of naturally fermented camel milk on acute alcohol-induced liver injury in mice[J]. Science and Technology of Food Industry, 2019, 40(15): 292-297.
[37] MOHAMMADDIN A, ROHRA D K, MORTAJA S,et al. Effects of camel milk in dyslipidaemia: A randomised clinical trial[J]. International Dairy Journal, 2018, 84: 79-84.