原发性骨质疏松症从病因学分为绝经后骨质疏松症(Postmenopausal osteoporosis, PMOP)(Ⅰ型)和老年性骨质疏松症(Ⅱ型)[1]。 绝经后骨质疏松通过去势法等被国内外学者广泛研究[2-3]。 由于老年性骨质疏松症(SOP)是生物衰老在骨骼方面的一种特殊表现, 且复制SOP 动物模型的周期长,死亡率较高,因此研究SOP 较困难。 目前,D-半乳糖致雄性鼠骨质疏松动物模型是研究SOP的一个重要工具, 具有简便易行、 价格低廉的特点。 大量D-半乳糖可致睾丸功能减退,雄激素水平降低,这与衰老致性腺功能退化相似[4]。
灰树花是担子菌亚门的一种药食两用珍稀菇类,因含有丰富的多糖、蛋白质及微量元素等活性物质,已成为亚洲流行的食用菌。其蛋白质含量高达31.5%,必需氨基酸在总氨基酸中占比高达45.5%,远高于香菇、银耳、金针菇、黑木耳等常见食用菌[5]。 灰树花多肽具有抗氧化、抗菌、免疫调节、降血脂和降血糖等活性。 钙是人体必需的一种重要矿质元素,能有效防治骨质疏松[6],而日常膳食并不能满足机体每日需求量。 中国现有膳食结构的营养调查表明,我国居民钙摄入量普遍偏低,仅达钙推荐供给量(RDA)的50%左右[7]。我国市场流通钙制剂约2 700 种, 然而普遍存在生物利用度低的现象[8]。 生物活性肽具有钙元素载体的作用,可输送钙元素到人体各处,充分发挥其功能[9]。 肽与钙离子螯合形成的肽钙螯合物, 能够通过肠道对小分子肽段的吸收机制以螯合物的形式被小肠主动吸收,不易形成磷酸钙沉积物,能提高钙的生物利用度,具有双重营养功能,是一种理想的补钙制剂[10]。Bao 等[11]、张根生等[12]证明多肽钙制剂能够有效预防大鼠骨质疏松症。本文通过腹腔注射D-半乳糖建立衰老性骨质疏松大鼠模型, 结合体外Caco-2 细胞试验, 探讨灰树花多肽-钙螯合物对衰老性骨质疏松症的影响。
1 材料与方法
1.1 动物与细胞
SPF 级成年雄性ICR 小鼠50 只,每只体质量(45±5)g, 由吴氏实验动物中心提供。 许可证号:SCXK(沪)2017-0005。 Caco-2 细胞,由福州大学生物工程研究所提供。
1.2 主要试剂及仪器
灰树花,庆元县宏亿农业发展有限公司;无水乙醇、氢氧化钠(NaOH)、HCL、无水氯化钙,国药集团化学试剂有限公司;D-半乳糖,Aladdin 公司;钙测定试剂盒、血清无机磷测定试剂盒、碱性磷酸酶测试盒,南京建成生物工程研究所;DMEM 培养基,美国Hyclone 公司;特级胎牛血清,澳洲Gibco公司;1xPBS,美国Hyclone 公司;Fluo-3-Am,美国Sigma 公司。
X52 酶标仪, 美国Molecullar 公司;Alpha 1-4LD 型冻干机, 德国Christ 公司;BR 4i 型高速冷冻离心机,法国Jouan 公司;AA-6800 原子吸收分光光度计,岛津制作仪器有限公司;AL204 精密分析天平,梅特利托利多仪器(上海)有限公司;SHA.B 精达水浴恒温振荡器, 常州精达仪器制造有限公司;THZ-82 细胞培养箱,日本SANYO 公司。
1.3 方法
1.3.1 灰树花多肽-钙螯合物的制备 参考实验室前期优化条件制备灰树花多肽-钙螯合物[13]。 灰树花磨粉过40 目筛, 按料液比1∶50 加蒸馏水溶解,1 mol/L NaOH 调pH 值至10.0。置于恒温振荡器中60 ℃水浴90 min,冷却后6 层纱布过滤。 上清液用1 mol/L HCl 调pH 值至2.5。5 000 r/min 离心10 min,沉淀冷冻干燥后即灰树花蛋白。称取一定量的灰树花蛋白,按照液料比40∶1 加入超纯水进行溶解,调pH 值至7.5(复合蛋白酶最适pH),加复合蛋白酶(溶液质量分数4%), 将其放置于53 ℃水浴摇床中充分反应4 h, 沸水浴灭酶10 min,冷却至室温,离心(4 500 r/min)10 min,取上清液冷冻干燥即得灰树花多肽。 按溶液质量分数3%复溶多肽,肽钙质量比2∶1 加入无水氯化钙,充分搅拌,调节pH 值至8.0,60 ℃恒温反应60 min。反应结束后冷却至室温, 加入95%乙醇洗涤静置过夜后离心(5 000 r/min,10 min),取沉淀进行冷冻干燥,得到灰树花多肽-钙螯合物。 螯合物用火焰原子吸收光谱仪测得钙含量为7%。
1.3.2 动物分组 空白对照组(不造模+去离子水灌胃)10 只;模型对照组(造模+去离子水灌胃)10只;阳性对照组(HCaCO3,造模+高剂量碳酸钙灌胃)10 只;阳性有机钙对照组(HGCa,造模+高剂量葡萄糖酸钙灌胃)10 只; 试验组 (Hgps-Ca,造模+高剂量灰树花多肽-钙螯合物灌胃)10 只。
1.3.3 动物实验 50 只雄性ICR 小鼠,适应性饲养1 周,自由饮水饮食,室温控制在20~25 ℃,湿度60%左右。按体质量随机分为5 组,除了空白对照组外,其它5 组均给予腹腔注射120 mg/(kg d)的D-半乳糖[14],骨质疏松症模型造模;空白对照组给予腹腔注射同等剂量的生理盐水。 8 周后造模成功,空白对照组、模型对照组均给予去离子水灌胃; 阳性对照组分别给予高剂量碳酸钙(HCa-CO3),高剂量葡萄糖酸钙(HGCa)灌胃;试验组给予高剂量灰树花多肽-钙螯合物灌胃(高剂量组按生药量换算为53.2 mg/kg bw)。 饲养过程中小鼠自由进食基础饲料和自由饮用去离子水。 基础饲料为南通特洛菲LAD 0001 标准饲料。 各组连续灌胃4 周后,采血取材检测血生化指标。
1.3.4 血清样本采集及检测方法 在12 h 禁食后, 眼球取血, 将血样品转移到装有抗凝剂的2 mL 离心管中。在4 ℃下将血清离心10 min(3 000 r/min),取其上清,-20 ℃保藏备用。 用于血清指标的测定:1)血清Ca2+浓度检测:采用邻甲酚肽络合酮法测定;2) 血清P 浓度检测: 采用磷钼酸法测定;3)血清ALP 活性检测:采用微量酶标法进行测定;4)血清CAT 活性检测:检测步骤按照试剂盒说明书进行。
1.3.5 骨指标的测定 12 周实验结束后,术前小鼠禁食, 取每只小鼠左右股骨和胫骨, 去除软组织,用数字卡尺测量左股骨、左胫骨的长度直径。应用GraphPad Prism 7.0 统计软件进行方差分析。
1.3.6 细胞培养 将Caco-2 细胞置于37 ℃,体积分数5%二氧化碳培养箱中培养至20~40 代。培养基采用DMEM 加入20%胎牛血清、1%双抗[15]。细胞培养过程中每周换液2~3 次, 待贴壁细胞汇合率达到80%~90%时进行传代。弃去培养瓶中培养基, 加入适量0.25%胰蛋白酶消化2~3 min,观察细胞变圆后加入适量DMEM 培养基终止消化,按1∶3 的比例进行传代。
1.3.7 细胞毒性试验 将传代后的Caco-2 细胞培养至生长对数期, 采用胰蛋白酶对贴壁生长细胞进行消化。 并加入含有20%胎牛血清的DMEM培养液,制得细胞密度为2×104 CFU/mL 的细胞悬液。 将细胞悬液以每孔200 μL 体积接种于96 孔培养板,细胞培养箱中培养24 h 后,小心吸出培养基,向其中加入不同钙含量的灰树花多肽-钙螯合物(GPs-Ca),每个浓度设置6 孔为平行试验。空白对照组设置为只加入等量培养基, 不加入细胞悬液,也不加入样品。阴性对照组设置为只加入等量培养基, 不加样品。 阳性对照组设置为氯化钙,葡萄糖酸钙。将试验组,空白对照组,阴性对照组,阳性对照组同时置于CO2 含量为5%的细胞培养箱中37 ℃培养。 24 h 后, 每孔中加入20 μL MTT(5 mg/mL)溶液,继续孵育4 h 后弃去上清液,每孔中加入150 μL DMSO,充分震荡溶解。 采用酶标仪于波长570 nm 处测定每孔的吸光值并记录,空白孔调零[16]。 按照如下公式进行计算细胞存活率(IC):
IC(%)=(OD 试验组/OD 对照组)×100
1.3.8 GPs-Ca 对细胞钙摄取的影响 灰树花多肽-钙螯合物(GPs-Ca)的Caco-2 细胞摄取试验采用Fluo-3-AM 细胞内钙离子探针进行细胞吸收钙量的测定[17]。按5×104 CFU/mL 的细胞密度,将细胞接种于6 孔板上,将接种板置于37 ℃,CO2 含量为5%的细胞培养箱中培养7 d。 设定灰树花多肽-钙螯合物(Hgps-Ca) 试验组,CaCl2 阳性对照组,空白对照组,依据MTT 细胞毒性试验结果,考察不同钙浓度(2.5,5,7.5,10,15,20,25,30 mmol/L)的样品对细胞钙摄取的影响。 将培养14 d 的细胞上层培养液小心吸取出来, 加入新鲜的培养液与各组分样品处理1 h 后,吸去培养液,加入HBSS 缓冲液清洗3 遍后,再加入10 μmol/L Fluo-3-AM 细胞内钙离子探针作用1 h, 用HBSS 缓冲液冲洗3 遍后,移取样品至1.5 mL 离心管中,1 0000 r/min,离心5 min,吸取上清液,采用流式细胞仪对各试验组Caco-2 细胞摄取钙离子含量进行检测。
2 结果与分析
2.1 血清生化指标检测结果
D-半乳糖诱发的骨质疏松症,其突出表现即为血清钙/磷水平的显著变化。 图1 结果显示:在第4 周,高剂量碳酸钙(HCaCO3)、高剂量葡萄糖酸钙(HGCa)、高剂量灰树花多肽-钙螯合物(Hgps-Ca)喂养的小鼠血清Ca 高于模型组(P<0.05),且喂食Hgps-Ca 的小鼠血清Ca 水平略高于高剂量碳酸钙(HCaCO3)、高剂量葡萄糖酸钙(HGCa)组。试验组的血清P 水平,与模型组相比也均有显著上升(P<0.01),喂食Hgps-Ca 的小鼠血清P 水平与空白对照组比较无统计学意义(P>0.05)。 此外,模型组血清ALP 水平显著高于空白组(P<0.01),这种增加可归因于成骨细胞活跃和成骨率增加[18]。 喂食高剂量碳酸钙(HCaCO3)、高剂量葡萄糖酸钙(HGCa)、高剂量灰树花多肽-钙螯合物(Hgps-Ca)小鼠灌胃4 周后血清ALP 值均显著下降(P<0.01)。 自由基和氧化应激与骨质疏松症的发病机制有关[19],通过血清过氧化氢酶(CAT)水平的显著下降可以清楚地表明这一点。由图1d 可看出,与正常对照组相比,模型组血清CAT 水平下降约60%。Manolagas[20]报告说,过氧化氢酶的使用可以防止大鼠骨丢失, 推测具有抗氧化特性的化合物是预防和治疗骨质疏松症的最佳候选。 灌胃4 周后,小鼠血清过氧化物酶(CAT)水平几乎恢复到正常值(P>0.05)。 这一效应或可归因于富含多肽的灰树花多肽-钙螯合物部分的强抗氧化性,具有调节核因子-红细胞-2 相关因子2(Nrf2)/Kelch样ECH 相关蛋白(Keap)通路途径的作用[21]。
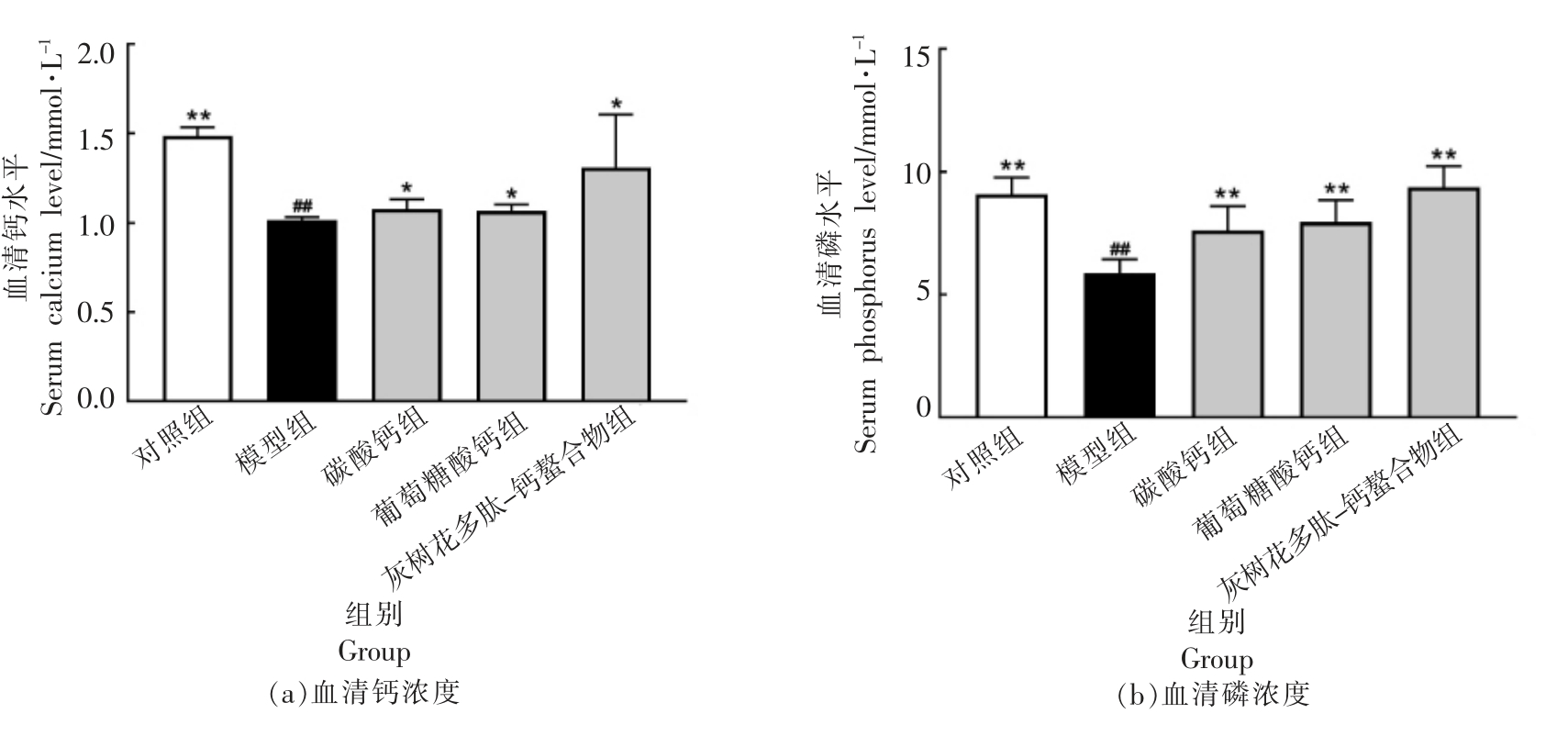
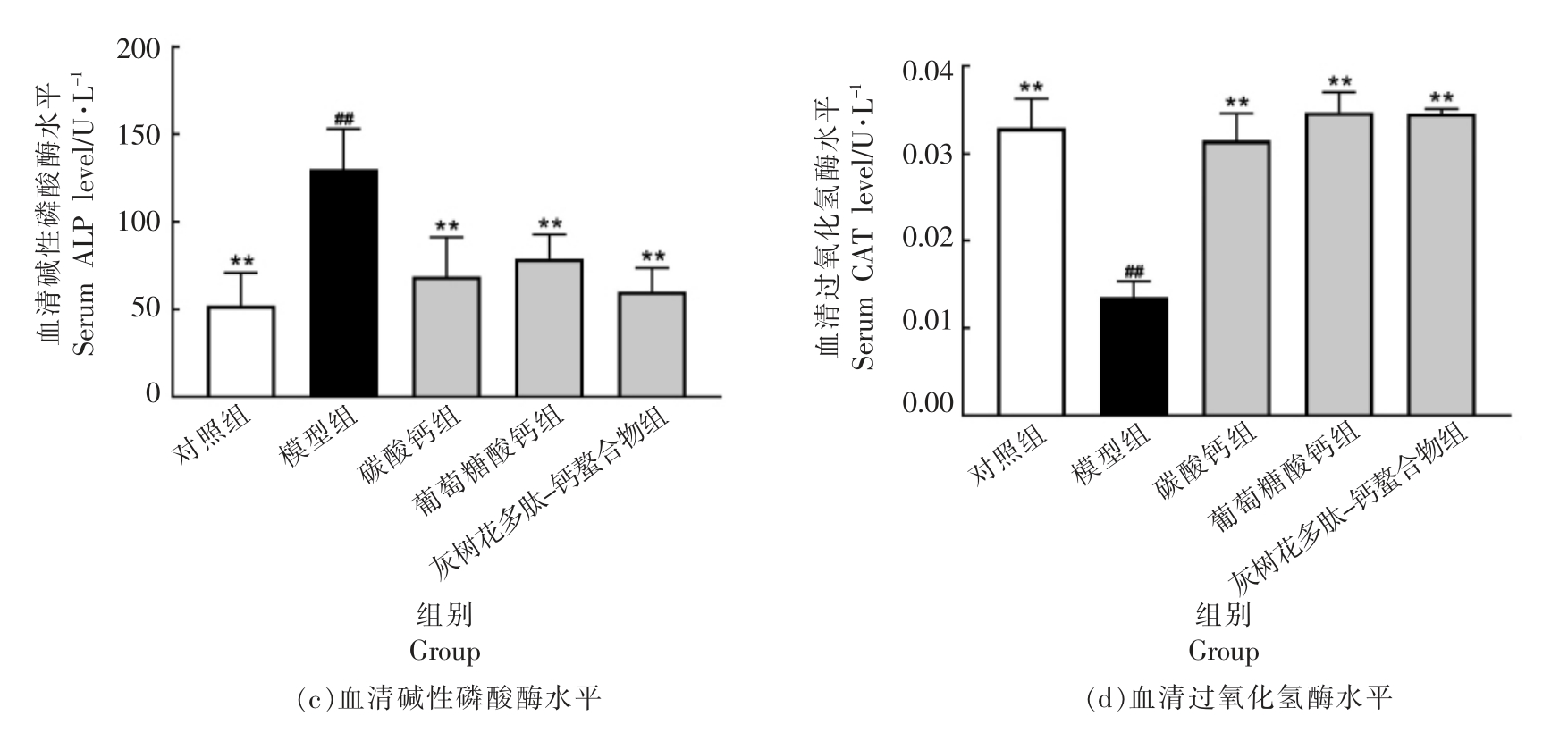
图1 各组小鼠血清生化指标
Fig.1 Biochemical parameters in the serum of mice for each group
注:*. 与模型组相比有显著性(P<0.05),**. 与模型组相比有显著性(P<0.01),##. 与空白组相比有显著性(P<0.01),下同。
2.2 骨形态检测结果
股骨指数可以反映动物体的骨骼生长状况。图2 显示了所有组的股骨和胫骨质量和长度。 在灌胃4 周结束时,各组股骨质量、长度较模型组均有所上升,无机钙源加钙组(HCaCO3)和高剂量灰树花多肽-钙螯合物组(Hgps-Ca)和模型组相比有显著差异(P<0.01),与空白对照组相比无显著性差异(P>0.05),而高剂量灰树花多肽-钙螯合物组(Hgps-Ca)更接近空白对照组。胫骨长度在各组中未观察到显著差异。高剂量灰树花多肽-钙螯合物组和葡萄糖酸钙组胫骨质量显著高于模型组(P<0.01),且与对照组相比无显著差异(P>0.05)。
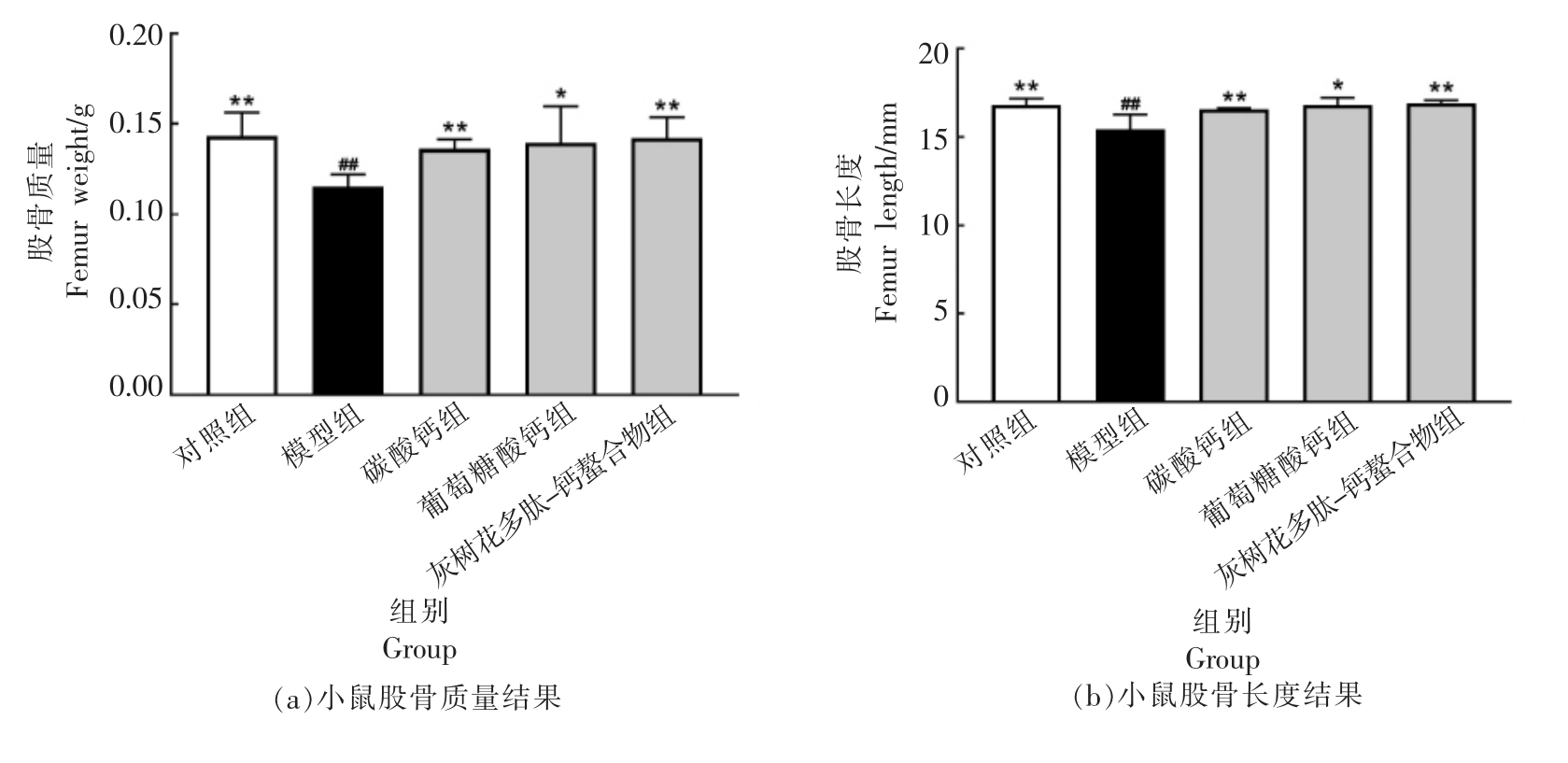
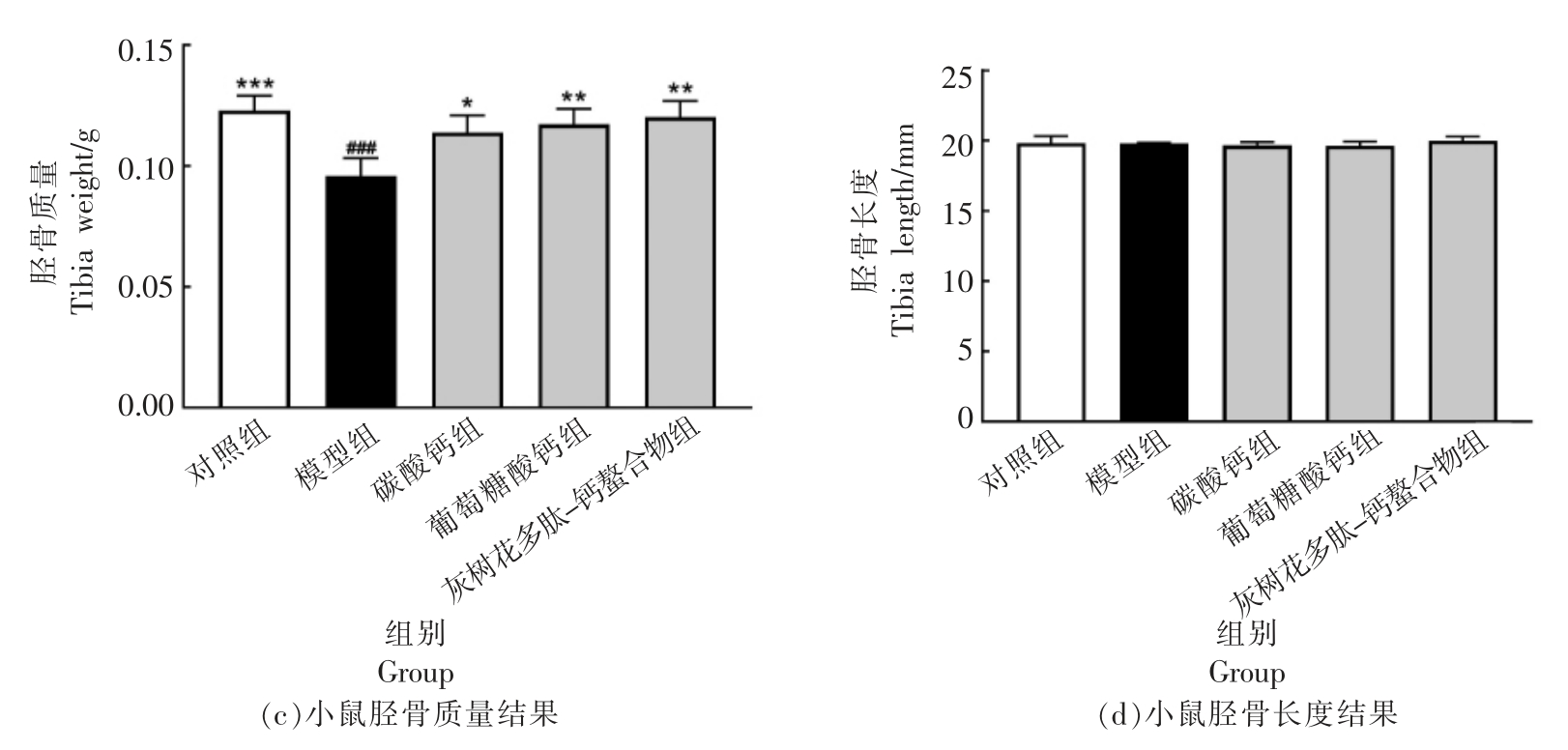
图2 各组小鼠股骨、胫骨质量及长度
Fig.2 Weight and length of femurs and tibia for each group
2.3 骨组织显微结构的观察
H & E 染色显示各组样品对股骨病理学特征的影响。 连续注射8 周D-半乳糖,小鼠骨形态特性发生显著变化。 与对照组(图3a)相比,模型组(图3b)骨小梁稀少或断裂,小梁变细,体积减小,连接减少,游离端增多,小梁数、小梁链接和小梁骨面积观察到显著减少,骨矿化受损。通过灰树花多肽-钙螯合物和葡萄糖酸钙(图3d,3e)处理后,股骨细胞系正常排列,成骨细胞较模型组有明显增加趋势,结构显著改善[22]。
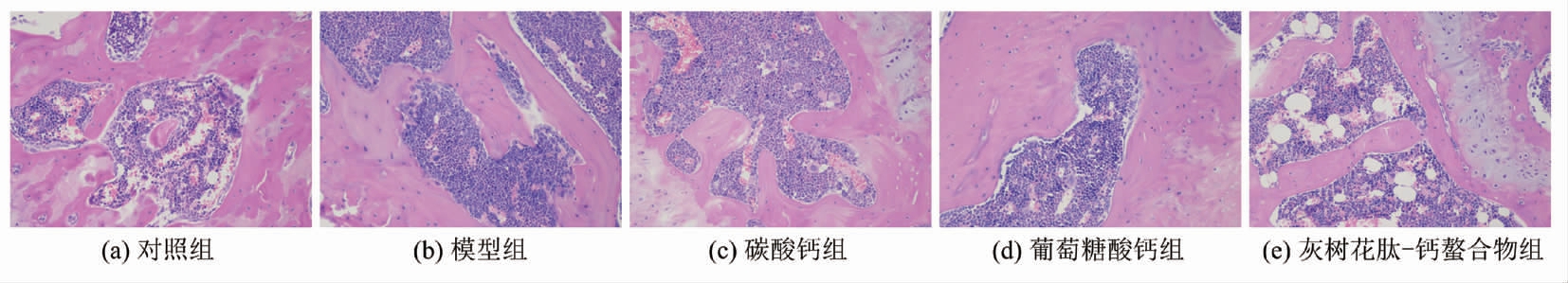
图3 各组试验小鼠股骨组织病理切片观察(200x)
Fig.3 Pathological sections of femur in experiment of mice for each group (200x)
2.4 MTT 毒性评价
由图4 可知,当多肽-钙螯合物的钙浓度小于15 mmol/L 时,Caco-2 细胞存活率均大于85%。 而相同钙浓度下(15 mmol/L),CaCl2 和葡萄糖酸钙组细胞存活率为80.91%,75.49%。 因此,肽-钙螯合物的钙浓度在0~15 mmol/L 范围均不会对Caco-2细胞造成损伤,且在相同钙浓度下,相比无机钙和葡萄糖酸钙,螯合钙对细胞造成损伤最小,存活率更高。
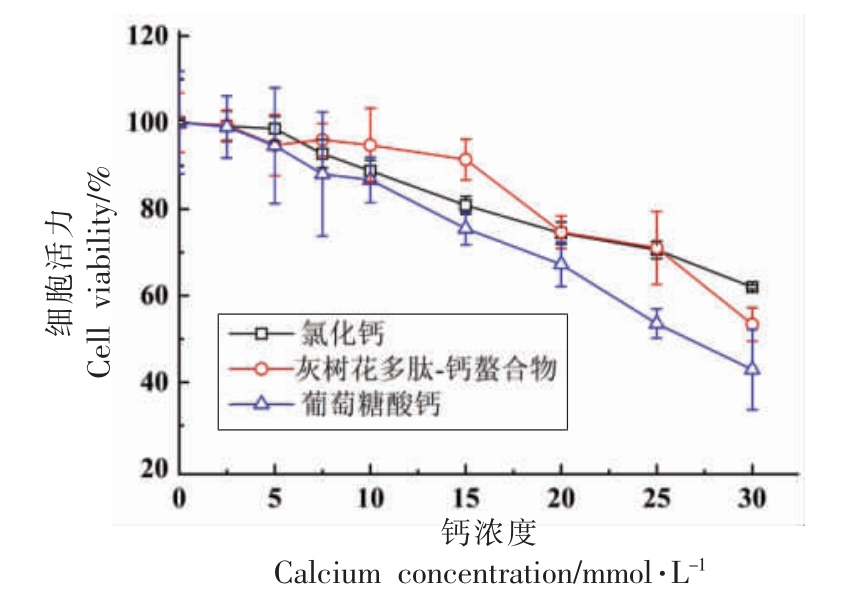
图4 不同钙浓度下Caco-2 细胞活力
Fig.4 Cell viability of Caco-2 cells in different calcium concentration
2.5 多肽促钙吸收试验
通过比较灰树花多肽-钙螯合物和CaCl2、葡萄糖酸钙在钙吸收上的差异可以明确多肽在肠道细胞中的促钙吸收作用。 由图5 可知,Caco-2 细胞对CaCl2 中钙离子的摄取率最低, 且一定浓度后吸收率变化不显著; 细胞对葡萄糖酸钙的钙吸收率略高于CaCl2。而对于多肽-钙螯合物,细胞对钙离子的摄取率随钙浓度的增大逐渐增大。 试验结果表明, 灰树花多肽与Ca2+的螯合作用能有效促进肠道细胞中钙的吸收和转运, 这与文献所述结果一致, 即多肽能与Ca2+结合产生可溶性络合物, 防止Ca2+在呈中性或弱碱性环境的小肠内沉淀,从而促进钙的吸收和利用[23]。
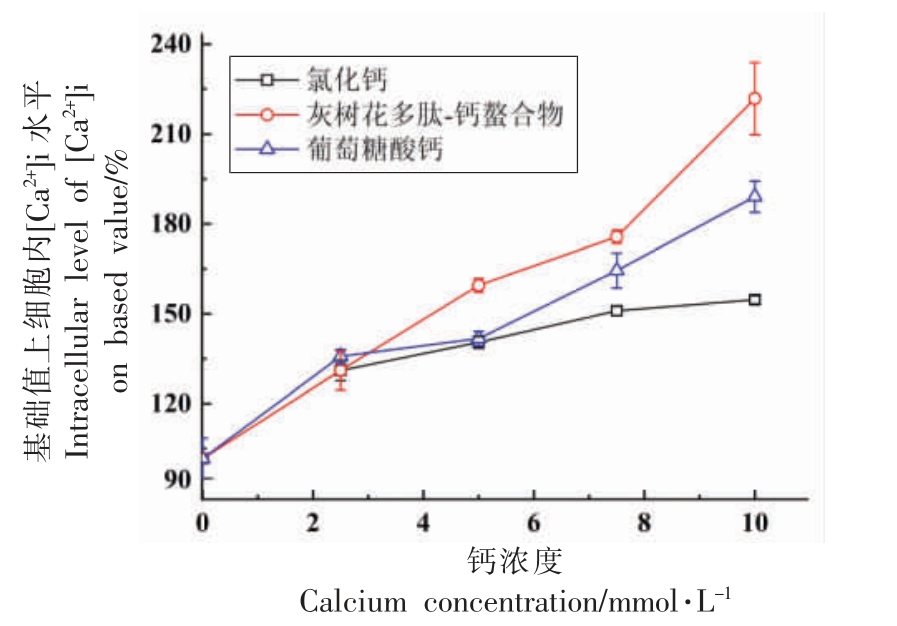
图5 不同钙浓度下细胞内[Ca2+]i 变化
Fig.5 Changes of intracellular [Ca2+]i in different calcium concentrations
3 讨论
D-半乳糖致雄性鼠骨质疏松是一个较为实用的研究衰老性骨质疏松(SOP)的动物模型,相比于其它SOP 动物模型简便易行、价格低廉。 通过持续6~10 周每天注射50~500 mg/(kg·d)[24-25]剂量的D-半乳糖,建立D-半乳糖致动物衰老模型。连续注射D-半乳糖后,睾丸功能减退,雄性激素水平降低。此外,体内产生过多的氧自由基破坏了胶原蛋白,导致各种细胞氧化损伤,影响了骨细胞的正常代谢, 造成矿物质流失, 加速雄性鼠的衰老,使其骨量减少,骨质丢失。 本研究给予ICR 小鼠120 mg/d 的D-半乳糖,持续8 周,观察到股骨体积和框架体积减小,骨孔隙率和框架密度增加,股骨细胞松散多孔,像蜂窝状,肥大软骨细胞区的显著扩张, 即在股骨近端干骺端发生小梁组织形态学变化,骨小梁数显著减少,表明衰老性骨丢失动物模型的建立。 成骨作用和溶骨作用的正常进行是维持血液中钙、 磷含量稳定的重要环节。 同样,血液中钙、磷含量的高低又直接影响骨的钙化与溶解,它们是相互影响,互相制约的,并受1,25-(OH)2D3、甲状旁腺素及降钙素等的调节和控制[26]。 碱性磷酸酶(ALP)能分解有机磷酸化合物,产生大量的无机磷酸盐离子,促使其与钙离子结合成磷酸钙而沉淀于骨组织内。 Robison[27]揭示了ALP 在骨钙化过程中起主要作用,在异常钙化的情况下,其表达升高。本研究发现模型组小鼠的几种重要矿物质如钙、 磷含量相比于同龄正常小鼠均有显著降低,血清ALP 水平显著升高。 目前,有机钙(特别是肽钙复合物)作为一种新型的钙补充剂,已成为研究热点[28-29]。灌胃4 周后,高剂量的灰树花多肽-钙螯合物处理组的小鼠血清Ca、P 水平升高,并上升到与空白对照组相当的值,这与之前的研究一致。在骨钙化过程中,ALP 起着重要作用。高血清ALP 水平可能干扰钙吸收[30]。灰树花多肽-钙螯合物饲喂的小鼠血清ALP 值低于碳酸钙组和葡萄糖酸钙组, 表明肽钙螯合的有机钙更容易被吸收和钙化。CAT 水平较模型组显著上升,表明其抗氧化能力或许对衰老性骨质疏松有一定预防作用[31-32]。Fluo-3-Am 作为一种新型的高度特异性Ca2+荧光指示剂, 可以灵敏地反映细胞内游离钙离子浓度的变化。 研究结果显示,灰树花多肽-钙螯合物相比CaCl2、 葡萄糖酸钙更易被细胞吸收。 灰树花肽-钙螯合物一方面能防止肽的水解,使钙离子在经过胃及小肠中的吸收部位时都以螯合态形式存在, 不易形成磷酸钙沉积物; 另一方面, 肽-钙螯合物也更多地利用肽转运系统吸收,从而有效提高钙的生物利用率。
4 结论
本试验采用复合蛋白酶水解灰树花蛋白制备多肽, 以多肽和CaCl2 为原料采用液体反应法合成灰树花多肽-钙螯合物,经测定,钙含量为7%。结果表明,Hgps-Ca 具备促进骨骼生长发育的作用,对D-半乳糖诱导的小鼠衰老性骨质疏松有一定改善作用。 同时体外吸收试验也进一步证实其具备促进钙吸收作用。灰树花多肽-钙螯合物促进钙吸收行使的多肽转运途径和金属离子转运途径其分子机制和转运途径仍需进一步研究。 本课题组将对灰树花多肽-钙螯合物在动物体内转运机制和病理毒理学进行深入研究。
[1] 张昌攀, 陈凯, 陈海鹏. 中西医药物治疗原发性骨质疏松症研究进展[J]. 中医药临床杂志, 2018, 30(1): 171-175.
ZHANG C P, CHEN K, CHEN H P. Research progress of traditional Chinese and western medicine in treating primary osteoporosis[J]. Clinical Journal of Traditional Chinese Medicine, 2018, 30(1): 171-175.
[2] 马娴, 傅萍, 凌博越, 等. 自然衰老法与卵巢去势法建立围绝经期小鼠模型的比较研究[J]. 中华中医药学刊, 2017, 35(3): 551-554.
MA X, FU P, LING B Y, et al. A comparative study on etablishment of perimenopausal model by natural aging method and ovarian castration method[J]. Chinese Archives of Traditional Chinese Medicine,2017, 35(3): 551-554.
[3] 唐瑞怡, 陈蓉. 骨质疏松症动物模型研究进展[J]. 中国实用妇科与产科杂志, 2014, 30(5): 383-386.
TANG R Y, CHEN R. The research process in os teoporosis animal modeling[J]. Chinese Journal of Practical Gynecology and Obstetrics, 2014, 30(5):383-386.
[4] GHANBARI S, YONESSI M, MOHAMMADIRAD A, et al. Effects of IMODTM and AngiparsTM on mouse D-galactose-induced model of aging[J]. Journal of Pharmaceutical Sciences, 2012, 20(1): 68.
[5] MENG M, CHENG D, HAN L R, et al. Isolation,purification, structural analysis and immunostimulatory activity of water-soluble polysaccharides from Grifola frondosa fruiting body[J]. Carbohydrate Polymers, 2017, 157: 1134-1143.
[6] 周建烈, 刘忠厚. 补充钙和维生素D 防治骨质疏松症的全球临床指南进展[J]. 中国骨质疏松杂志,2017, 23(3): 371-380.
ZHOU J L, LIU Z H. The progress in global clinical guidelines on the prevention and treatment of osteoporosis using calcium and vitamin D supplementation[J]. Chinese Journal of Osteoporosis, 2017,23(3): 371-380.
[7] 韩樱, 何慧, 赵宁宁, 等. 蛋清肽-钙配合物体内促钙吸收作用研究[J]. 食品科学, 2012, 33(11):262-265.
HAN Y, HE H, ZHAO N N, et al. Effect of egg white peptide binding with calcium on promotion of calcium absorption in vivo[J]. Food Science, 2012,33(11): 262-265.
[8] 蒋金来, 王令充, 吴皓, 等. 钙制剂研究进展[J]. 食品工业科技, 2012, 33(11): 379-382, 387.
JIANG J L, WANG L C, WU H, et al. Research progress in calcium preparation[J]. Science and Technology of Food Industry, 2012, 33(11): 379-382, 387.
[9] 刘冰彤, 庄永亮. 肽钙螯合物VGLPNSR-Ca 的结构表征及在Caco-2 单细胞层的促钙吸收性能[J]. 高等学校化学学报, 2019, 40(8): 1643-1648.
LIU B T, ZHUANG Y L. Structural characterization of peptide calcium chelate VGLPNSR-Ca and its calcium absorption ability in Caco-2 cell monolayer[J]. Chemical Journal of Chinese Universities, 2019,40(8): 1643-1648.
[10] 吕莹, 王若敏, 任建华, 等. 体外Caco-2 细胞模型评价不同亚基来源大豆肽-钙复合物对钙吸收的影响[J]. 中国食品学报, 2013, 13(4): 185-190.
LÜ Y, WANG R M, REN J H, et al. Effect of soybean β-conglycinin (7S) and glycinin (11S) hydrolysates on calcium transport by Caco-2 monolayer cells[J]. Journal of Chinese Institute of Food Science and Technology, 2013, 13(4): 185-190.
[11] BAO X L, LÜ Y, YANG B C, et al. A study of the soluble complexes formed during calcium binding by soybean proteinhydrolysates[J]. Food Chemistry,2008, 73(3): 117-121.
[12] 张根生, 袁超, 杨春燕, 等. 胶原多肽钙预防骨质疏松的研究[J]. 食品工业科技, 2010, 31(4): 346-348.
ZHANG G S, YUAN C, YANG C Y, et al. Study on hydrolyzed collagen in the prevention of osteoporosis[J]. Science and Technology of Food Industry,2010, 31(4): 346-348.
[13] 花朋朋, 熊煜, 于志颖, 等. 响应面法制备小球藻多肽-钙螯合物的制备工艺[J]. 农产品加工, 2019(5): 47-52.
HUA P P, XIONG Y, YU Z Y, et al. Optimization of preparation of calcium-chelated from Chlorella hydrolysis peptides by response surface[J]. Farm Products Processing, 2019(5): 47-52.
[14] HUANG Y T, TIKHONOVA M A, DING S J, et al. Effects of chronic treatment with diosgenin on bone loss in a D-galactose-induced aging rat model[J]. The Chinese Journal of Physiology, 2014, 57(3): 121-127.
[15] WEN J H, HU J F, WEI X H. Transepithelial transport of rosuvastatin and effect of ursolic acid on its transport in Caco-2 monolayers[J]. European Journal of Drug Metabolism and Pharmacokinetics,2012, 37(3): 225-231.
[16] 蔡文涛. MTT 法和CCK-8 法检测中药抗病毒活性成分细胞毒性的比较[J]. 湖北大学学报(自然科学版),2017, 39(3): 305-310.
CAI W T. The comparision of MTT and CCK-8 by detecting cytotoxicity of antiviral active components in traditional Chinese medicine[J]. Journal of Hubei University(Natural Science), 2017, 39(3): 305-310.
[17] 张四洋, 李春艳, 高建, 等. 应用Ca2+荧光探针fluo-3 和fluo-4 测定H2O2 诱导的A549 细胞凋亡过程中的[Ca2+]i 变化[J]. 中国肺癌杂志, 2014, 17(3):197-202.
ZAHNG S Y, LI C Y, GAO J, et al. Application of the Ca2+indicator fluo-3 and fluo-4 in the process of H2O2 induced apoptosis of A549 cell[J]. China Journal of Lung Cancer, 2014, 17(3): 197-202.
[18] SEIBEL M J. Biochemical markers of bone turnover:Part I: Biochemistry and variability[J]. The Clinical Biochemist Reviews, 2005, 26(4): 97-122.
[19] ZHANG D W, DENG H, QI W, et al. Osteoprotective effect of cordycepin on estrogen deficiencyinduced osteoporosis in vitro and in vivo[J]. Biomed Research International, 2015, 2015: 423869.
[20] MANOLAGAS S C. From estrogen-centric to aging and oxidative stress: A revisedperspective of the pathogenesis of osteoporosis[J]. Endocrine Reviews,2020, 31(3): 266-300.
[21] EL-BAZ F K, HUSSEIN R A, ABDEL JALEEL G A R, et al. Astaxanthin-rich Haematococcus pluvialis algal hepatic modulation in D-galactose-induced aging in rats: Role of Nrf2[J]. Advanced Pharmaceutical Bulletin, 2018, 8(3): 523-528.
[22] 李彦春, 祝德义, 靳丽强, 等. 胶原多肽钙的制备及小鼠应用试验[J]. 中国皮革, 2005, 34(15): 36-41.
LI Y C, ZHU D Y, JIN L Q, et al. Preparation of collagen polypeptide calcium and application experiments by small mice[J]. China Leather, 2005, 34(15): 36-41.
[23] 艾婷, 孟祥乐, 孙鹤闻, 等. α-乳白蛋白酶解物的钙络合特性研究[J]. 中国乳品工业, 2013, 41(9):8-10.
AI T, MENG X L, SUN H W, et al. Binding characteristics of alpha -lactalbumin hydrolysate to calcium[J]. China Dairy Industry, 2013, 41(9): 8-10.
[24] CHEN B, ZHONG Y, PENG W, et al. Age-related changes in the central auditory system: Comparison of D-galactoseinduced aging rats and naturally aging rats[J]. Brain Research, 2010, 1344: 43-53.
[25] LEI M, HUA X D, XIAO M, et al. Impairments of astrocytes are involved in the D-galactose-induced brain aging[J]. Biochemical and Biophysical Research Communications, 2008, 369(4): 1082-1087.
[26] 熊伟, 赵亮. 盐炙杜仲对衰老性骨质疏松模型大鼠血生化指标的影响[J]. 时珍国医国药, 2016, 27(11): 2623-2624.
XIONG W, ZHAO L. Effect of salt roasted Eucommia ulmoides on blood biochemical indexes in aging osteoporosis model rats[J]. Lishizhen Medicine and Materia Medica Research, 2016, 27(11): 2623-2624.
[27] ROBISON R. The possible significance of hex osephosphoric esters in ossification[J]. Biochemical Journal, 1923, 17: 286-293.
[28] LIU H, XU J, GUO S T. Soybean peptide aggregates improved calcium binding capacity[J]. LWT -Food Science and Technology, 2016, 67(3): 174-180.
[29] YANG H, AHN C, JEUNG E B. Differential expression of calcium transport genes caused by COMT inhibition in the duodenum, kidney and placenta of pregnant mice[J]. Molecular and Cellular Endocrinology, 2015, 401: 45-55.
[30] WANG L C, CHEN S Y, LIU R. A novel hydrolytic product from flesh of mactra veneriformis and its bioactivities in calcium supplement[J]. Journal of Ocean University of China, 2012, 11(3): 389-396.
[31] REITER R. Biomarkers of free radical damage: Applications in experi- mental animals and in human[J]. Free Radical Biology & Medicine, 1995, 26(1/2): 202-226.
[32] JACOBSON A, JOHANSSON S, BRANTING M, et al. Vitamin A differentially regulates RANKL and OPG expression in human osteoblasts[J]. Biochemical and Biophysical Research Communications, 2004,322(1): 162-167.