蔬菜粉是一种重要的蔬菜加工产品, 可代替新鲜蔬菜补充人体所需营养物质, 是国际畅销产品[1-2]。胡萝卜粉是一种常见的蔬菜粉,广泛地应用于馒头、面条、饼干、面包等产品中,不仅改善了产品色调值,还提高了产品营养价值[2]。 将其添加在香肠、火腿[3-4]中,可使产品口感柔和细腻,结构均匀蓬松,同时赋予食品诱人的色调值,在很大程度上减少了发色剂亚硝酸盐的用量, 提高了食品的安全性和消费者的可接受度。
胡萝卜粉属于低水分活度食品[5],由于水分含量低,干物质含量高,因此便于储存、运输和加工。以往的研究表明低水分活度条件下微生物难以生长、繁殖[6]。然而,最近研究发现,同类型粉体食品,例如香料粉,往往含有较高的微生物数量[7],这些微生物可能包括威胁人体健康的产毒致病菌[8],它们可能广泛来自植物生长、采摘、加工、储运阶段。而使用组织受损的胡萝卜片容易受微生物污染,且干燥制粉后这些微生物仍保持较高的含量。
现有的低水分食品杀菌技术包括化学处理或物理处理。 化学处理法,例如环氧乙烷、臭氧杀菌法,虽然杀菌效果好,但是可能残留化学物质危害人体健康, 因此在多数国家和地区被禁止使用[9]。相比之下,物理杀菌法不产生化学残留,是现代杀菌技术研究的重点领域之一[10]。 红外线是一种波长介于760 nm~1 mm 的非电离辐射类电磁波,可将物体表面快速加热, 之后通过热传导和热辐射使物体迅速升温[11-12]。 研究表明,红外辐射在食品粉体中具有良好的干燥及杀菌效果[13]。 近年来,将红外辐射用于杀菌的研究多有报道, 并取得了较好的效果。 毕延娣等[14-15]研究了胡萝卜粉、冬枣粉在中短波红外线处理下初始微生物的变化情况,指出中短波红外线对这些粉体食品中的微生物有显著的杀灭作用。然而,上述杀菌研究针对的初始微生物数量往往较低, 且没有考虑胡萝卜粉受污染的情况。另外,目前的红外辐射技术多与其它技术联合, 以最大程度地发挥红外辐射快速加热的优点。张鑫等[1]将脱水菠菜红外辐射180 s 后于70℃保温45 min 的杀菌效果相当于高温蒸汽处理180 s 并70 ℃热风干燥处理30 min 的效果。 Fu等[16]研究表明红外辐射和热空气联合可以显著降低葡萄籽中需氧菌和霉菌孢子的含量。 Venkitasamy 等[17-18]将红外辐射、热空气保温与回火技术相结合用于杏仁和开心果处理, 接种及天然存在的微生物含量均显著降低。 研究表明冷激处理单独作用虽不影响微生物存活数量,但与其它处理,例如射频[19]、脉冲电场[20]联用后可显著降低微生物存活数量。赵伟等[9]研究表明射频后的冷激可以将微生物从3.0 lg (CFU/g)降至1.0 lg (CFU/g)。然而,红外辐射与回火、冷激技术联合用于胡萝卜粉杀菌的研究还未见报道。
本文以高带菌量胡萝卜粉为研究对象, 首先探究了红外辐射对胡萝卜粉的杀菌工艺, 然后探讨红外辐射-回火、 红外辐射-冷激对胡萝卜粉微生物含量及其对水分活度、色调值、类胡萝卜素含量等品质的影响, 以期为果蔬粉体杀菌技术提供试验数据。
1 材料与方法
1.1 原料与试剂
胡萝卜(红森)购于北京当地超市,置于(4.0± 0.5)℃的冷库中保存。蛋白胨、平板计数琼脂、葡萄糖、马铃薯琼脂,北京陆桥技术有限责任公司;乙醇、丙酮、BHT、NaCl,国药集团化学试剂有限公司;一次性使用塑料培养皿,浙江柏美特医用塑料有限公司。
1.2 设备与仪器
红外辐射设备(1 350W),圣泰科红外科技有限公司;CPA-125 电子天平, 德国Sartorius 公司;紫外-可见光分光光度计,日本岛津公司;恒温培养摇床, 上海福玛实验设备有限公司;SW-CJ-1F超净工作台,苏州安泰空气技术有限公司;LDZX-50KBS 不锈钢立式压力蒸汽灭菌锅, 上海申安医疗器械厂;FW-100 高速万能粉碎机,天津市泰斯特仪器有限公司;BagMixer400S 拍打式均质机,法国Interscience 公司;Aqualab Pre 水分活度仪,美国Decagon 公司。
1.3 试验方法
1.3.1 胡萝卜粉制备 将胡萝卜用清水洗涤3 遍直至洗涤用水澄清透明。 然后用切片机将其切片(3 mm),在室温下放置12 h,用热泵60 ℃干燥6 h。 干胡萝卜片用万能粉碎机粉碎(20 000 r/min),粉碎3 次,每次5 s,间隔1 min,胡萝卜粉过60 目筛,密封后于4 ℃保存备用。
1.3.2 红外辐射处理 将10 g 胡萝卜粉平铺在15 cm×10 cm 的铝制正方体容器底部,当红外辐射设备温度升至100,110,120 ℃时将胡萝卜粉迅速放入设备托盘上, 在各温度下分别放置2.5,5,10 min。 红外辐射管与样品距离为80 mm。
1.3.3 红外辐射-回火联合处理 红外辐射-回火处理过程, 是指在一个完整的红外辐射处理过程中加入了一个较长时间的保温过程,在此过程中,首先胡萝卜粉进行红外辐射加热 (100 ℃,5 min;110 ℃,2.5 min), 之后迅速用铝盖将容器密封,放入70 ℃(参考Venkitasamy 等[17]的研究,70 ℃作为一个温和而有效的杀菌温度被选用于胡萝卜粉回火处理温度)热风烘箱内维持1~4 h,之后取下铝盖将胡萝卜粉放入红外辐照箱内进行第2 阶段红外辐射处理(100 ℃,5 min;110 ℃、2.5 min)并最终取出冷却至室温。 对胡萝卜粉进行微生物数量测定和品质分析。 红外100 ℃下两阶段处理标记为IR’1,110 ℃下两阶段处理标记为IR’2。
1.3.4 红外辐射-冷激联合处理 将经过100 ℃,10 min 处理(IR1)的胡萝卜粉和110 ℃,5 min 处理(IR2)的胡萝卜粉包装于聚乙烯密封袋中,放置于-20 ℃下冷激分别处理1,2,3,7 d。 对胡萝卜粉进行微生物指标及品质指标分析。
1.4 胡萝卜粉微生物指标及品质指标测定
1.4.1 胡萝卜粉中微生物数量测定 经处理的胡萝卜粉及对照胡萝卜粉 (3 g) 迅速放入含有27 mL 0.1%蛋白胨溶液的均质袋中, 用BagMixer400S 拍打式均质机以8 次/s 速度均质4 min,之后用0.1%蛋白胨溶液进行梯度稀释,取合适稀释倍数的菌悬液(1 mL)于相应的培养基中进行总菌落数计数(平板计数琼脂培养基)和霉菌、酵母数计数(葡萄糖马铃薯琼脂培养基),具体的操作方法和计数规则参照GB 4789.2-2016《食品安全国家标准 食品微生物学检验 菌落总数测定》[21]及GB 4789.15-2016 《食品安全国家标准 食品微生物学检验 霉菌和酵母计数》[22]中的方法。
1.4.2 水分活度的测定 胡萝卜粉的水分活度用Aqualab Pre 水分活度仪进行测定。
1.4.3 颜色测定 用佳能D700 单反相机对胡萝卜粉进行摄影记录,图片通过USB 接口传输至电脑,用LensEye-NET 软件对图像进行分析,以获得胡萝卜粉的L*(明暗值)、a*(红绿值)、b*(黄蓝值)。 总色差值ΔE 被应用于衡量由热处理导致的颜色变化。以未经处理的胡萝卜粉为对照,通过式(1)计算ΔE 值。
式中,L*——处理后胡萝卜粉的明暗值;a*——处理后胡萝卜粉的红绿值;b*——处理后胡萝卜粉的黄蓝值;L0*——未处理胡萝卜粉的明暗值,a0*——未处理胡萝卜粉的红绿值;b0*——未处理胡萝卜粉的黄蓝值;ΔE——处理前、 后的总色差值。
1.4.4 总类胡萝卜素含量测定 采用有机溶剂法提取脂溶性类胡萝卜素,并在波长450 nm 处测定吸光度。 本文参照了Knockaert 等[23]的方法并略有修改。 取0.5 g 胡萝卜粉加50 mL 提取液(含体积分数为50%正己烷,25%丙酮,25%乙醇, 质量分数为0.1% BHT 和0.5 g NaCl), 在磁力搅拌器上搅拌20 min 之后向上述溶液中加入15 mL 蒸馏水,搅拌10 min,将混合物放入分液漏斗,收集有机相并用正己烷定容。在波长450 nm 处测定吸光度,用正己烷加0.1% BHT 做空白。整个操作在避光条件下进行。 其含量按式(2)计算:
式中,A450nm——波长450 nm 处的吸光值;V——提取液总体积,mL;M——样品质量,g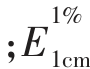 (值为2 560)——β-胡萝卜素在正己烷中的消光系数。
(值为2 560)——β-胡萝卜素在正己烷中的消光系数。
1.5 数据分析
试验重复至少3 次,用GraphPad Prism 软件(Version 8.0,美国)进行方差分析和图形绘制,当P<0.05 表明差异显著。
2 结果与讨论
2.1 红外辐射对胡萝卜粉微生物的影响
未处理及经红外处理的胡萝卜粉中细菌和霉菌、酵母的存活状况如表1 所示。结果表明胡萝卜粉初始细菌总数为8.94 lg(CFU/g),霉菌和酵母菌数为7.75 lg(CFU/g),这说明组织结构遭到破坏的胡萝卜片很容易滋生细菌和真菌, 并说明在进行非生物胁迫功能性胡萝卜粉制备时, 胡萝卜在短期贮存时需要注意微生物数量的控制[24-25]。当红外处理时间为2.5 min 时,120 ℃的细菌杀菌效果要显著高于100 ℃和110 ℃, 表明红外处理过程中温度是影响细菌杀菌效果的重要指标; 当温度一定时(100,110,120 ℃),随着红外处理时间的延长,细菌的数目显著减少。这是由于在红外辐射作用下, 样品在经历短时升温过程后温度得以维持在较高水平从而对微生物存在失活作用。 张鑫等[1]的试验结果表明,当目标温度为115 ℃、处理50 s 时,细菌总数降低了0.42 lg(CFU/g)。 Fu 等[16]的试验结果表明,当目标温度约为120 ℃(未详细标明)、处理108 s 时,葡萄籽中的总需氧菌和霉菌酵母菌分别降低了1.97 lg (CFU/g) 和0.62 lg(CFU/g)。 与上述研究结果相比,本试验相似条件下微生物的失活效率较低【目标温度120 ℃,处理2.5 min 时,细菌、霉菌和酵母分别降低0.61,0.84lg(CFU/g)】,产生这种现象可能是由于胡萝卜粉的水分活度较低所致。 已有研究表明当水分活度较低时, 红外辐射对于微生物的杀灭作用较弱[26-27]。 另外,胡萝卜粉中的微生物菌群结构不明确,可能存在着大量如蜡样芽孢杆菌[27]和片球菌[11]等耐热微生物从而限制了红外辐射的作用效果。值得注意的是, 当红外辐射120 ℃、 处理10 min时, 细菌、 霉菌和酵母的数量均低于检测限(10 CFU/g),在此条件下胡萝卜粉已经严重褐变,褐变反应产物能引起细胞毒性和DNA 损伤[28]。
表1 不同红外辐射温度和时间下胡萝卜粉中微生物存活量
Table 1 Microbial populations in carrot powders under different temperature and time of infrared radiation

注:不同大写字母表示加热温度相同,不同加热时间之间具有显著性差异(P<0.05);不同小写字母表示加热时间相同,不同温度之间具有显著性差异(P<0.05);ND 表示微生物数量低于检测限10 CFU/g。
时间/min 细菌/lg (CFU·g-1) 霉菌和酵母/lg (CFU·g-1)100 ℃ 110 ℃ 120 ℃ 100 ℃ 110 ℃ 120 ℃0.0 8.94±0.11Aa 8.94±0.11Aa 8.94±0.11Aa 7.75±0.07Aa 7.75±0.07Aa 7.75±0.07Aa 2.5 8.72±0.06Ba 8.54±0.10Ba 8.33±0.09Bb 7.07±0.24Ba 6.94±0.06Ba 6.91±0.16Ba 5.0 8.22±0.11Ca 7.36±0.15Cb 7.04±0.14Cc 6.98±0.06Ba 5.18±0.20Cb 4.45±0.02Cc 10.0 7.04±0.10Da 6.70±0.13Db ND 5.43±0.11Ca 4.32±0.06Db ND
2.2 红外辐射对胡萝卜粉品质的影响
2.2.1 水分活度的变化 由图1 可以看出, 胡萝卜粉的初始水分活度约为0.24, 此条件下微生物难以繁殖,然而微生物对热处理的抗性增加[29]。 红外辐射过程中,胡萝卜粉水分活度显著降低(P<0.05)。 在100,110,120 ℃下红外辐射处理10 min后,胡萝卜粉水分活度分别降至0.123,0.129,0.101。 水分活度是食品的重要参数,低水分活度抑制了食品品质劣变,赋予食品较长的货架期,同时也削弱了热处理对食品中微生物的灭活效果。
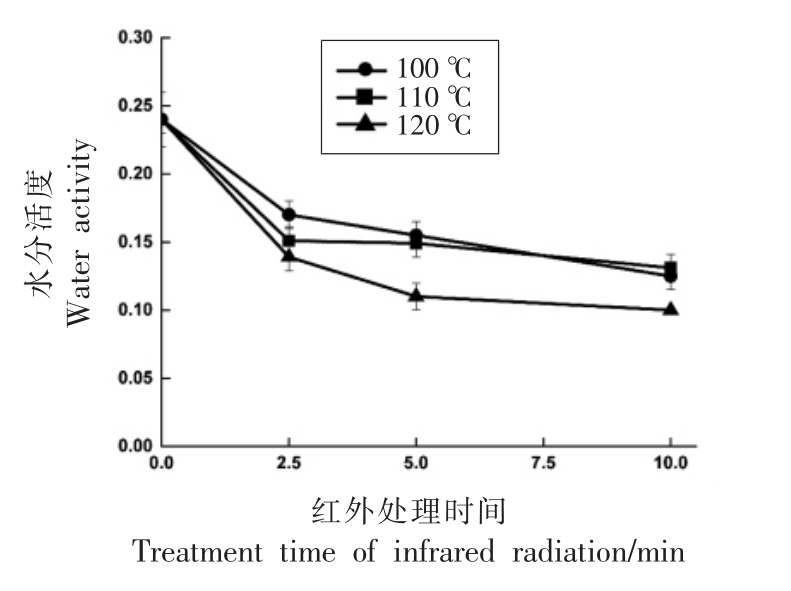
图1 红外辐射对于胡萝卜粉水分活度的影响
Fig.1 Effects of infrared radiation on water activity of carrot powders
2.2.2 色调值变化 图2 展示了胡萝卜粉色调值参数L*,a*,b*,ΔE 值在各红外处理条件下的变化情况。数据表明,红外辐射处理显著影响了胡萝卜粉的色调值(P<0.05)。当处理时间为2.5 min,相应处理温度为100,110,120 ℃时,ΔE 值分别为4.19,5.22,6.19; 而当处理时间延长至10 min,相应处理温度为100,110,120 ℃时,ΔE 值分别为9.11,8.65,33.12。胡萝卜粉的L*、 a*、 b*值在处理温度为100,110,120 ℃时无明显变化规律,而120 ℃时这些参数显著降低,表明此时萝卜粉亮度降低,红色减弱,黄色减弱。
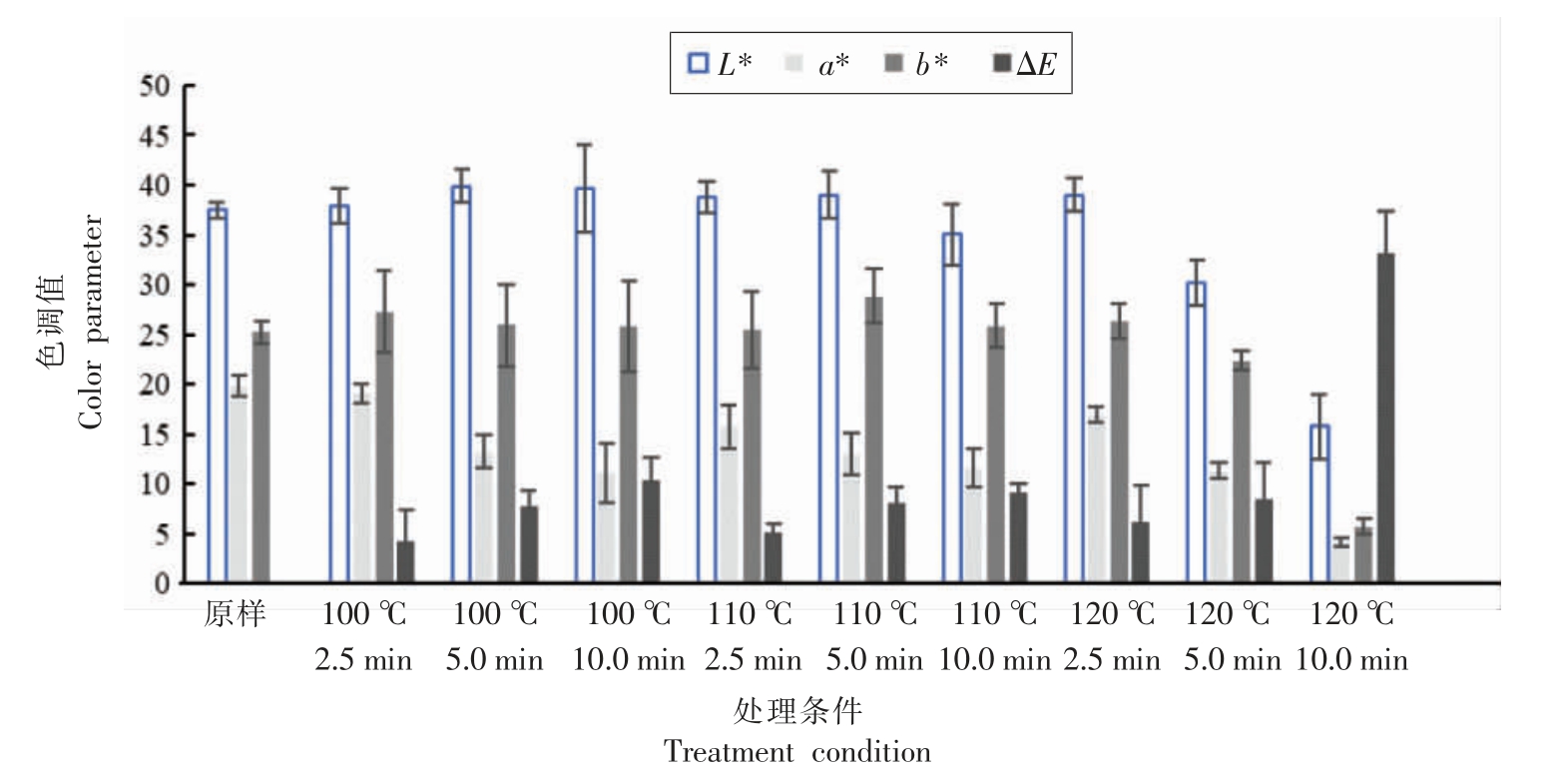
图2 红外辐射对于胡萝卜粉色调值的影响
Fig.2 Effects of infrared radiation on color parameters of carrot powders
2.2.3 总类胡萝卜素含量变化 如图3 所示,胡萝卜粉中总类胡萝卜素含量在处理前为308.8 μg/g, 胡萝卜粉中类胡萝卜素的含量随着红外辐射处理时间的延长和温度的升高而下降。 当120℃处理10 min 时, 总类胡萝卜素的含量降低至177.1 μg/g, 而当100 ℃处理10 min、110 ℃处理5 min 时,类胡萝卜素含量可分别保持在227.8 μg/g和237.7 μg/g。 类胡萝卜素具有多个共轭双键,易受到温度、光照、氧气的影响,在加工过程中热烫以及某些热杀菌措施更会加剧其含量的降低[30]。类胡萝卜素是胡萝卜中的重要呈色物质, 它的含量是影响胡萝卜粉色调值的重要因素之一。
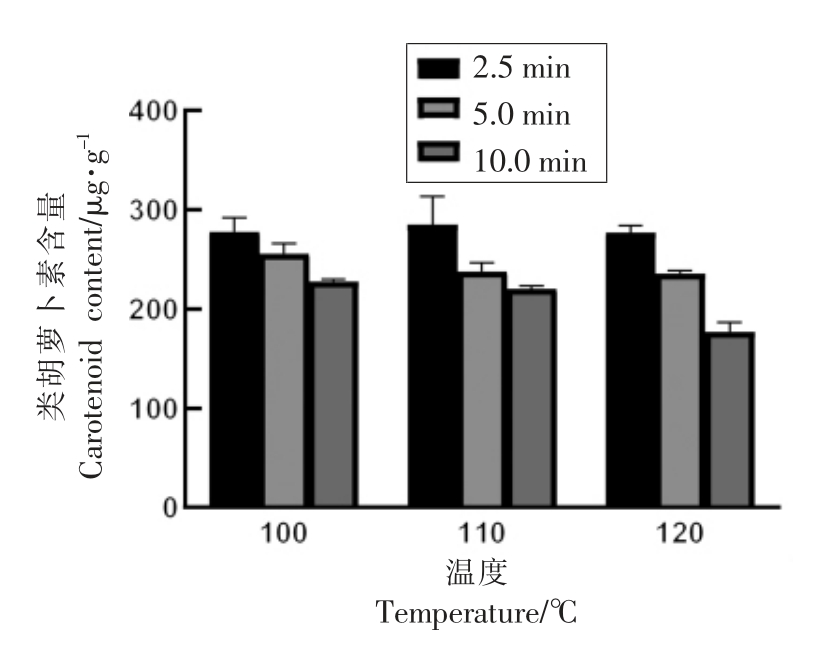
图3 红外辐射处理对胡萝卜粉类胡萝卜素含量的影响
Fig.3 Effects of infrared radiation on the carotenoid content of carrot powders
2.3 红外辐射-回火、 冷激联合杀菌技术对胡萝卜粉中微生物数量及品质的影响
2.3.1 红外辐射-回火、冷激联合杀菌技术对胡萝卜粉中微生物数量的影响 红外辐射-回火处理对胡萝卜粉中微生物数目的具体影响如图4 所示。 红外辐射-回火处理过程中(回火时间分别为1,2,3,4 h),胡萝卜粉中细菌总数没有显著减少,最终处于5.4~5.8 lg(CFU/g)范围;然而霉菌、酵母数(IR'1 处理)显著减少(P<0.05),最终处于4.5~5.0 lg(CFU/g)范围。 胡萝卜粉中微生物数目没有随着保温时间的增加而大幅减少, 这一现象可能是因为回火处理时的温度对于胡萝卜粉中的微生物来说较低,不足以使其失活[11]。Venkitasamy 等[17]报道了仅经过红外处理时开心果果壳上的屎肠球菌数量降低103 CFU/g 而红外处理加2 h 回火处理使开心果果壳上的屎肠球菌数降低了106 CFU/g [18]。Wang 等[26]用红外加热和热风保温回火处理对接种于糙米的黄曲霉孢子进行杀灭, 结果表明红外60 ℃, 回火处理2 h 可以造成黄曲霉孢子降低2.5~8.3 lg(CFU/g)。 相比于前人研究,本研究中保温处理对于胡萝卜粉中微生物杀灭作用较差。 一方面可能是由于微生物种类的差异性所致, 不同微生物的热抗性存在差异; 另一方面可能是含水量的差异性造成的, 含水量高的环境中微生物往往更容易失活而含水量低的环境中微生物的热抗性更强[31]。
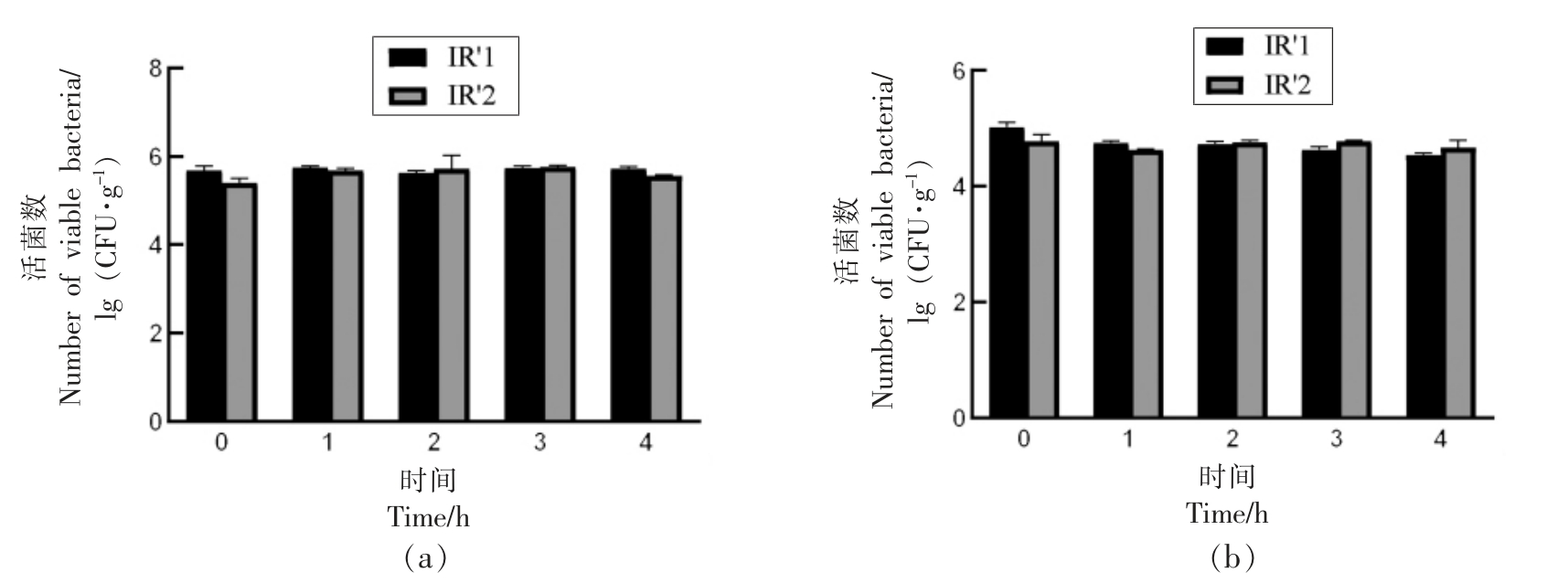
图4 红外回火处理对于胡萝卜粉中细菌(a)及霉菌、酵母(b)的影响
Fig.4 Effects of infrared radiation and tempering combination treatment on populations of bacterial (a),yeast and mold (b) in carrot powders
红外辐射-冷激处理对于胡萝卜粉的杀菌效果如图5 所示,红外-冷激处理显著降低了胡萝卜粉中的细菌总数、霉菌和酵母数(P<0.05)。 红外辐射处理 (IR1 和IR2)7 d 后的冷激贮藏最终使胡萝卜粉中细菌总数从(5.91 ± 0.07)lg (CFU/g)和(6.00 ± 0.10)lg (CFU/g) 降至 (5.66 ± 0.06) lg(CFU/g)和(5.74 ± 0.09)lg (CFU/g);同样处理条件下的霉菌、酵母菌降低了0.28 lg (CFU/g)及0.40 lg (CFU/g)。 微生物数目的降低出现在第1 天和第2 天,随后微生物数量基本保持稳定,这一结果表明红外辐射可以与冷激协同使用控制胡萝卜粉中的微生物。 已有研究表明某些技术例如脉冲电场[20]、射频[19]作用于微生物后会造成微生物亚致死损伤, 亚致死损伤的微生物在受到冷激处理后其存活率显著降低。 Ozturk 等[19]表明射频处理后-20 ℃冷激48 h 使受到射频处理的粪肠球菌和肠炎链球菌PT30 额外降低了1~2 lg (CFU/g),且冷激之前的射频处理时间越久,温度越高,冷激作用越明显。
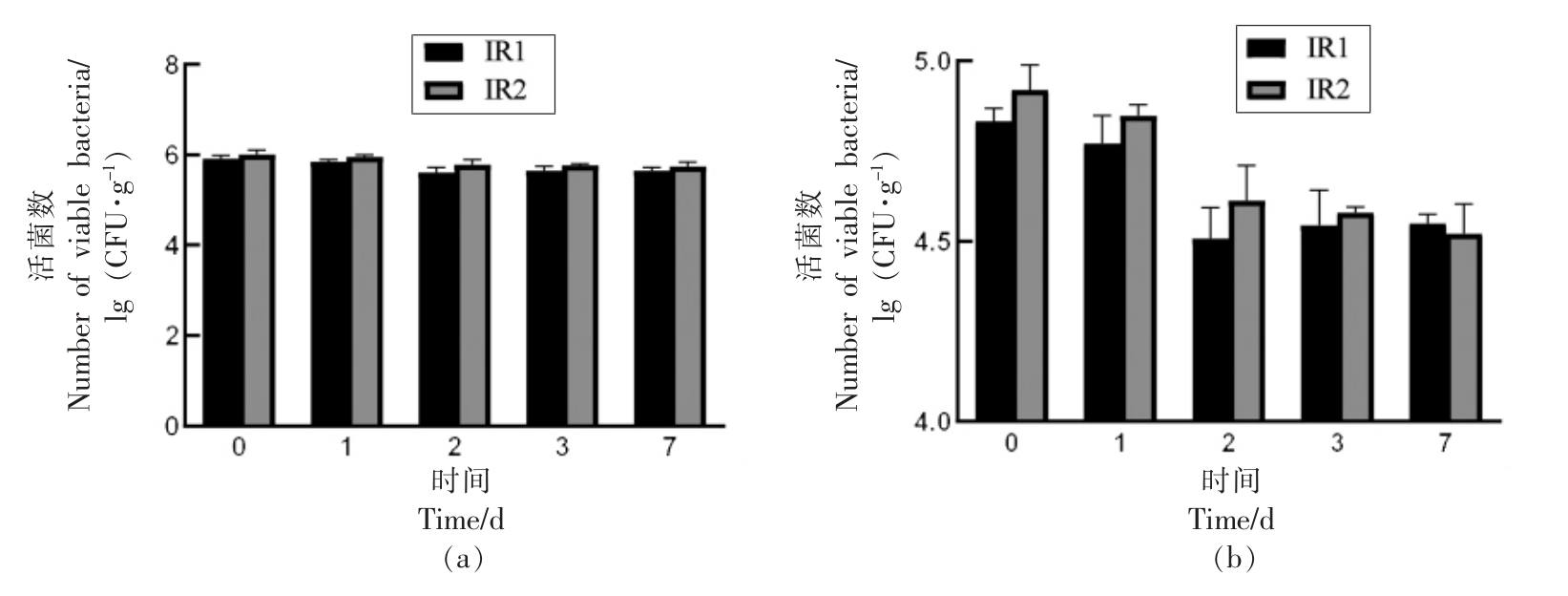
图5 红外冷激处理对于胡萝卜粉中细菌(a)及霉菌、酵母(b)的影响
Fig.5 Effects of infrared radiation and freezing combination treatment on populations of bacterial (a),yeast and mold (b) in carrot powders
2.3.2 红外辐射-回火、冷激联合杀菌技术对于胡萝卜粉水分活度的影响 红外辐射-回火、冷激处理过程中胡萝卜粉水分活度的变化如图6 所示。红外辐射-回火处理对于胡萝卜粉的水分活度影响不显著(P>0.05)。 在冷激处理过程中胡萝卜粉的水分活度逐渐上升, 水分活度上升的原因可能是由于胡萝卜粉返潮, 而此时水分活度仍然低于微生物繁殖所需最低水平。 在IR1 条件处理后冷激至第7 天,水分活度增至0.301,在IR2 条件处理后冷激至第7 天,水分活度增至0.261。
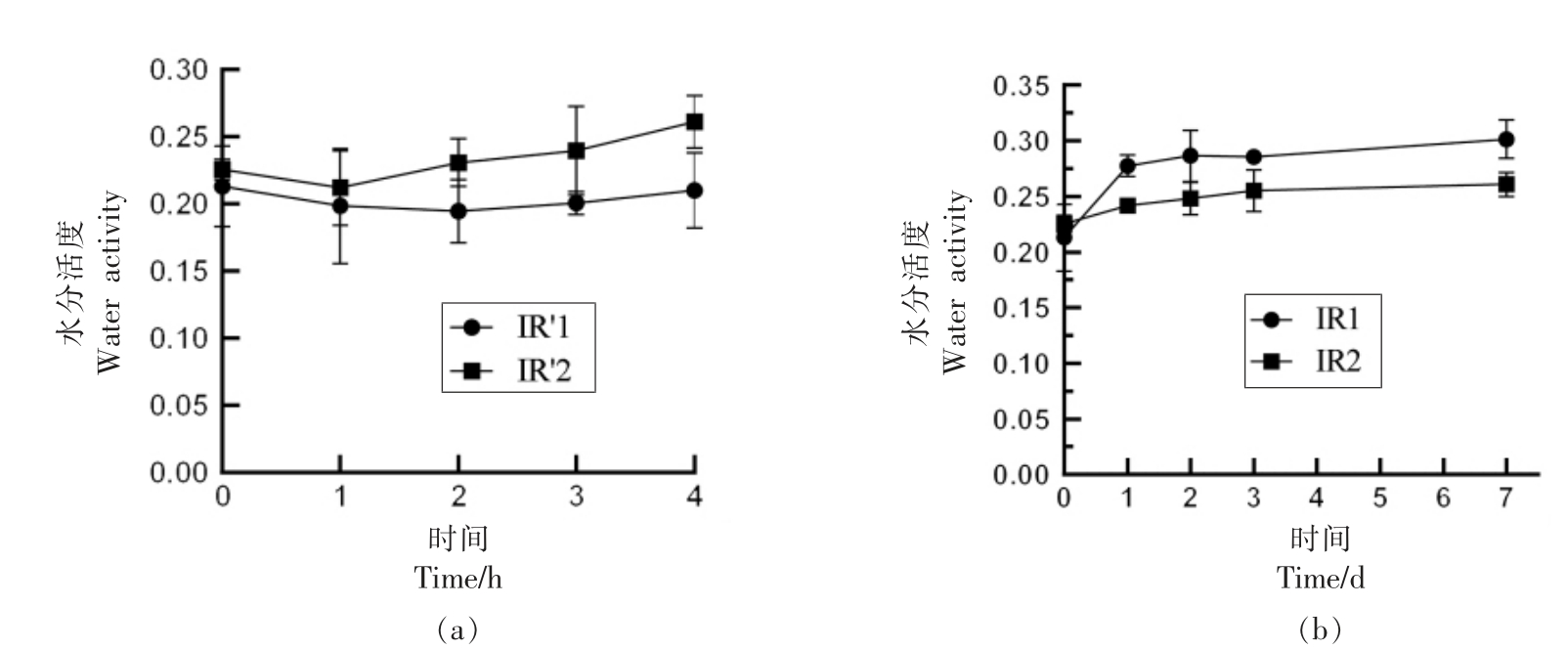
图6 红外辐射-回火(a)、冷激(b)联合处理对于胡萝卜粉水分活度的影响
Fig.6 Effects of infrared radiation and tempering (a) combined with freezing (b) on carrot powder water activity
2.3.3 红外辐射-回火、冷激联合杀菌技术对于胡萝卜粉色调值的影响 图7 表明了红外辐射-回火、冷激联合处理时胡萝卜粉的色调值变化。经一定时间的回火处理后(1~4 h)胡萝卜粉的各项色调值参数并未呈现出规律性的变化,其中L*值位于34.34~38.31,a* 值位于11.56~15.84,b* 值位于24.18~30.26,ΔE 维持在4.04~7.81。 红外辐射单独处理导致的ΔE 为5.24,6.8,由此可知,红外回火处理导致的变化在可接受范围之内。 由于在红外辐射过程中胡萝卜粉已经受较高的处理温度,易于降解的色素已被破坏, 而回火处理的温度较为温和,故胡萝卜粉颜色所受影响较弱。
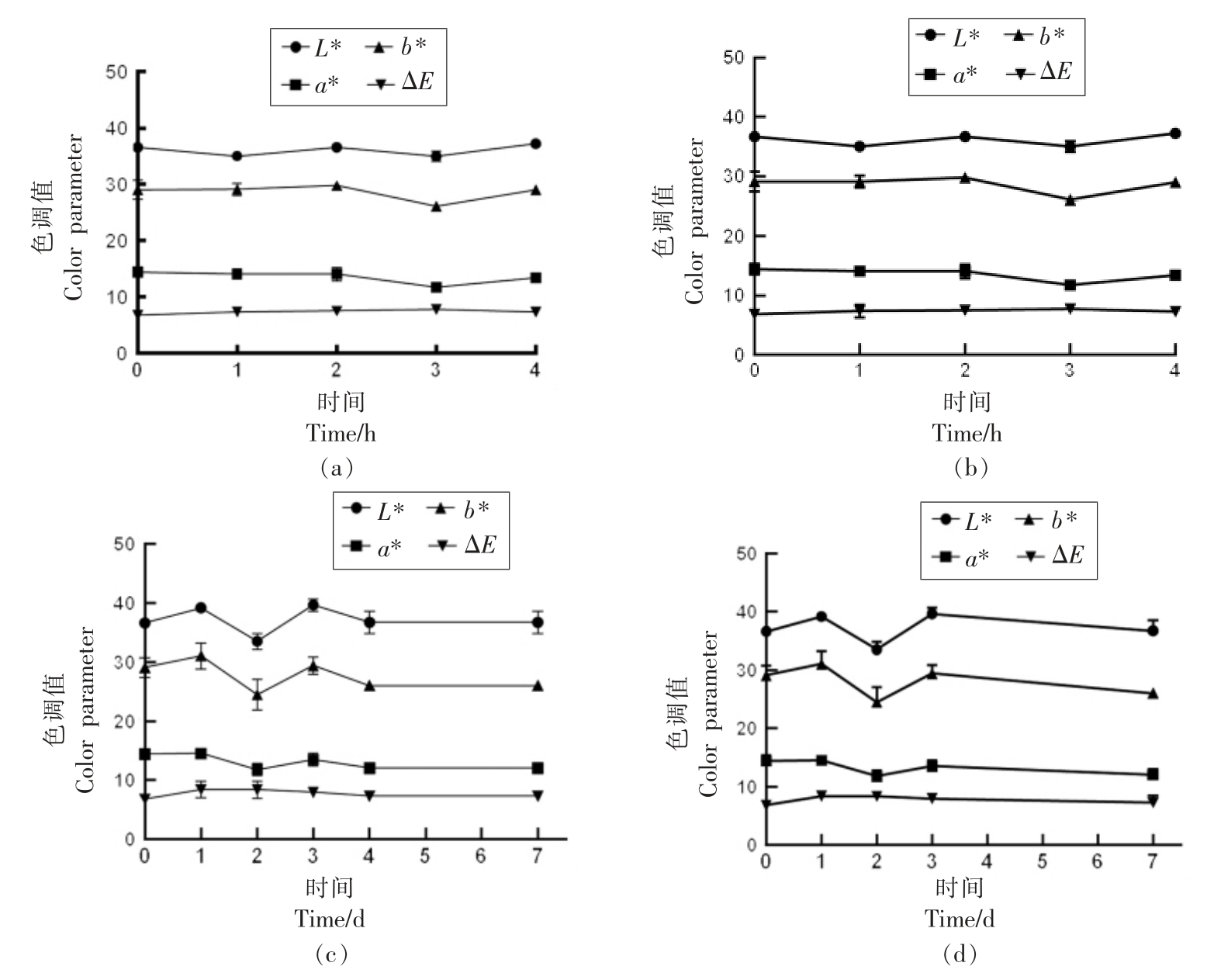
图7 红外辐射-回火(a, b)、冷激(c, d)联合处理对于胡萝卜粉色调值的影响
Fig.7 Effects of infrared radiation and tempering (a, b) combined with freezing (c, d)on color parameters of carrot powders
经冷激处理后(1~7 d)胡萝卜粉的L*值位于33.53~40.11,a*值位于11.81~16.20,b*值位于24.44~31.37,ΔE 值维持在5.24~8.41,相比于只由红外辐射处理导致的色差值5.24,6.8, 冷激阶段对于色差值的影响较小。
2.3.4 红外辐射-回火、冷激联合杀菌技术对于胡萝卜粉类胡萝卜素含量的影响 红外辐射-回火、冷激联合处理时, 胡萝卜粉中的类胡萝卜素变化如图8 所示。 回火处理时胡萝卜粉的类胡萝卜素含量显著下降(P<0.05),IR1、IR2 处理后经4 h 的回火处理,胡萝卜粉中的类胡萝卜素降低了117.1,123.75 μg/g。 这是由于回火处理时类胡萝卜素发生了氧化降解。 IR1、IR2 处理后经7 d 冷激处理,胡萝卜粉中类胡萝卜素的含量仍然可保持在280.2,273.1 μg/g, 这是因为低温延缓了类胡萝卜素的氧化降解[32]。
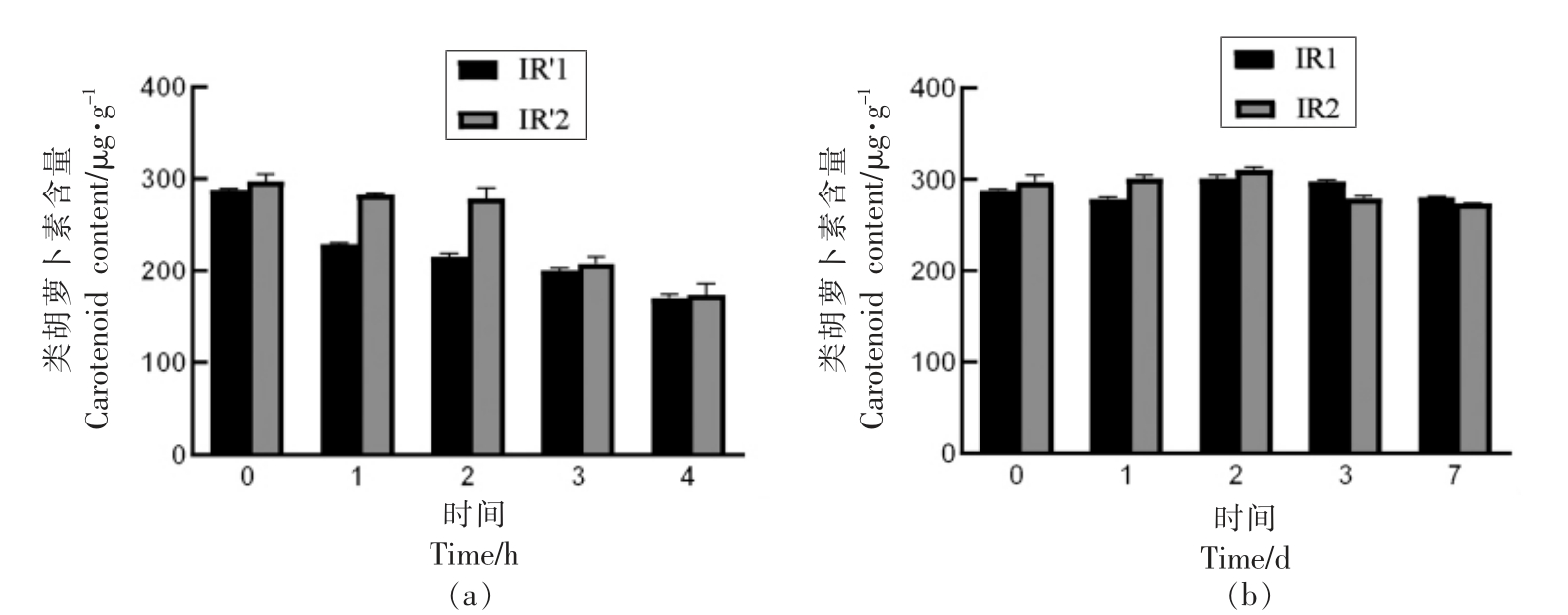
图8 红外辐射-回火(a)、冷激(b)处理对于胡萝卜粉类胡萝卜素含量的影响
Fig.8 Effects of infrared radiation and tempering (a) combined with freezing (b)on carotenoid content of carrot powders
3 结论
本文研究了红外辐射及红外-回火、冷激联合杀菌技术对于胡萝卜粉中微生物(细菌和霉菌、酵母)的灭活效果及胡萝卜粉水分活度、色调值、总类胡萝卜素含量的变化。结果表明,红外辐射处理能够显著降低胡萝卜粉中微生物数目, 其与冷激结合后存在协同效应, 且在此处理过程中胡萝卜粉的色调值及类胡萝卜素的含量并未发生显著变化。红外辐射-冷激协同效应为红外辐射联合杀菌技术研究的一个新发现。
[1] 张鑫, 曲文娟, 马海乐, 等. 脱水菠菜的催化式红外辐射灭菌研究[J]. 食品科学, 2013, 34(23):133-137.
ZHANG X, QU W J, MA H L, et al. Effectiveness of catalytic infrared radiation in the sterilization of dehydrated spinach[J]. Food Science, 2013, 34(23): 133-137.
[2] SALEHI F. Recent applications of powdered fruits and vegetables as novel ingredients in biscuits: A review[J]. Nutrire, 2020, 45(1): 1-10.
[3] 李玉邯, 陈宇飞, 杨柳, 等. 添加胡萝卜粉替代亚硝酸盐对香肠品质的影响[J]. 中国调味品, 2016,41(9): 20-23.
LI Y H, CHEN Y F, YANG L, et al. The effect of adding carrot powder as nitrite substitute on quality of sausage[J]. China Condiment, 2016, 41(9): 20-23.
[4] 王海滨, 黄泽元, 徐群英, 等. 胡萝卜复合火腿和香肠的质构特性及显微结构[J]. 农业工程学报,2008, 24(11): 288-291.
WANG H B, HUANG Z Y, XU Q Y, et al. Textural and microstructural characteristics of compound carrot hams and sausages [J]. Transactions of the Chinese Society of Agricultural Engineering, 2008,24(11): 288-291.
[5] 毕金峰, 陈瑞娟, 陈芹芹, 等. 不同干燥方式对胡萝卜微粉品质的影响[J]. 中国食品学报, 2015, 15(1): 136-141.
BI J Y, CHEN R J, CHEN Q Q, et al. Effects of different drying methods on the quality of micronized carrot powder[J]. Journal of Chinese Institute of Food Science and Technology, 2015, 15(1): 136-141.
[6] TAHERGORABI R, MATAK K E, JACZYNSKI J.Application of electron beam to inactivate Salmonella in food: Recent developments[J]. Food Research International, 2012, 45(2): 685-694.
[7] KYUNG H, RAMAKRISHNAN S R, KWON J.Dose rates of electron beam and gamma ray irradiation affect microbial decontamination and quality changes in dried red pepper (Capsicum annuum L.)powder[J]. Journal of the Science of Food and Agriculture, 2019, 99(2): 632-638.
[8] BANERJEE M, SARKAR P K. Growth and enterotoxin production by sporeforming bacterial pathogens from spices[J]. Food Control, 2004, 15(6): 491-496.
[9] 赵伟, 杨瑞金. 脱水蔬菜粉射频杀菌研究[J]. 中国农业科技导报, 2015, 17(5): 68-74.
ZHAO W, YANG R J. Studies on radio frequency heating to inactivate microorganisms in broccoli powder[J]. Journal of Agricultural Science and Technology, 2015, 17(5): 68-74.
[10] RIFNA E J, SINGH S K, CHAKRABORTY S, et al. Effect of thermal and non-thermal techniques for microbial safety in food powder: Recent advances[J].Food Research International, 2019, 126: 108654.
[11] BINGOL G, YANG J, BRANDL M T, et al. Infrared pasteurization of raw almonds[J]. Journal of Food Engineering, 2011, 104(3): 387-393.
[12] YANG J, BINGOL G, PAN Z, et al. Infrared heating for dry-roasting and pasteurization of almonds[J]. Journal of Food Engineering, 2010, 101(3): 273-280.
[13] ERDOGDU S B, ELIASSON L, ERDOGDU F, et al. Experimental determination of penetration depths of various spice commodities (black pepper seeds,paprika powder and oregano leaves) under infrared radiation[J]. Journal of Food Engineering, 2015,161: 75-81.
[14] 毕延娣, 陈芹芹, 毕金峰, 等. 中短波红外线对冬枣粉杀菌效果及品质的影响[J]. 食品与发酵工业,2016, 42(2): 125-129.
BI Y D, CHEN Q Q, BI J Y, et al. Effect of short and medium-wave infrared radiation on bactericidal countrol and quality of winter jujube powder[J]. Food and Fermentation Industries, 2016, 42(2): 125-129.
[15] 毕延娣, 陈芹芹, 毕金峰, 等. 中短波红外线对胡萝卜粉的杀菌效果及动力学分析[J]. 现代食品科技,2016, 32(6): 213-219.
BI Y D, CHEN Q Q, BI J Y, et al. Bactericidal effect and kinetics of short- and medium-wave infrared radiation on carrot powder[J]. Modern Food Science and Technology, 2016, 32(6): 213-219.
[16] FU R P, XIAO Z, PAN Z L, et al. Effects of infrared radiation combined with heating on grape seeds and oil quality[J]. Food Science and Technology International, 2019, 25(2): 160-170.
[17] VENKITASAMY C, ZHU C, BRANDL M T, et al.Feasibility of using sequential infrared and hot air for almond drying and inactivation of Enterococcus faecium NRRL B-2354[J]. LWT-Food Science and Technology, 2018, 95: 123-128.
[18] VENKITASAMY C, BRANDL M T, WANG B, et al. Drying and decontamination of raw pistachios with sequential infrared drying, tempering and hot air drying[J]. International Journal of Food Microbiology, 2017, 246: 85-91.
[19] OZTURK S, LIU S, XU J, et al. Inactivation of Salmonella Enteritidis and Enterococcus faecium NRRL B-2354 in corn flour by radio frequency heating with subsequent freezing[J]. LWT-Food Science and Technology, 2019, 111: 782-789.
[20] ZHAO W, YANG R J, WANG M. Cold storage temperature following pulsed electric fields treatment to inactivate sublethally injured microorganisms and extend the shelf life of green tea infusions[J]. International Journal of Food Microbiology, 2009, 129(2): 204-208.
[21] 国家食品药品监督管理总局, 国家卫生和计划生育委员会. 食品安全国家标准 食品微生物学检验 菌落总数测定: GB 4789.2-2016[S]. 北京:中国标准出版社, 2016: 1-4.
China Food and Drug Administration, China National Health and Family Planning Commission. National standard for food safety microbiological examination of food determination of total bacterial count: GB 4789.2-2016[S]. Beijing: China Standards Press,2016: 1-4.
[22] 国家卫生和计划生育委员会. 食品安全国家标准 食品微生物学检验 霉菌和酵母计数: GB 4789.15-2016[S]. 北京:中国标准出版社, 2016: 1-3.
China National Health and Family Planning Commission. National food safety standard microbiological examination of food mould and yeast count: GB 4789.15-2016[S]. Beijing: China Standards Press,2016: 1-3.
[23] KNOCKAERT G, LEMMENS L, VAN BUGGENHOUT S, et al. Changes in β-carotene bioaccessibility and concentration during processing of carrot puree[J]. Food Chemistry, 2012, 133(1): 60-67.
[24] SANTANA -GÁLVEZ J, PÉREZ -CARRILLO E,VELÁZQUEZ-REYES H H, et al. Application of wounding stress to produce a nutraceutical-rich carrot powder ingredient and its incorporation to nixtamalized corn flour tortillas[J]. Journal of Functional Foods, 2016, 27: 655-666.
[25] ALVARADO-RAMÍREZ M, SANTANA-GÁLVEZ J,SANTACRUZ A, et al. Using a functional carrot powder ingredient to produce sausages with high levels of nutraceuticals[J]. Journal of Food Science,2018, 83(9): 2351-2361.
[26] WANG B, KHIR R, PAN Z, et al. Effective disinfection of rough rice using infrared radiation heating[J]. Journal of Food Protection, 2014, 77(9): 1538-1545.
[27] STAACK N, AHRNÉ L, BORCH E, et al. Effects of temperature, pH, and controlled water activity on inactivation of spores of Bacillus cereus in paprika powder by near-IR radiation[J]. Journal of Food Engineering, 2008, 89(3): 319-324.
[28] 龚平, 阚建全. 美拉德反应产物性质的研究进展[J].食品与发酵工业, 2009, 35(4): 141-146.
GONG P, KAN J Q. Study on the progress of Maillard reaction products[J]. Food and Fermentation Industries, 2009, 35(4): 141-146.
[29] PODOLAK R, BLACK D G, BARACH J T, et al.Control of Salmonella and other bacterial pathogens in low moisture foods[M]. New Jersey: John Wiley& Sons, Ltd, 2017: 1-10.
[30] NGAMWONGLUMLERT L, DEVAHASTIN S, CHIEWCHAN N, et al. Plant carotenoids evolution during cultivation, postharvest storage, and food process ing: A review[J]. Comprehensive Reviews in Food Science and Food Safety, 2020, 19(4): 1561-1604.
[31] JIAO S S, ZHANG H J, HU S Z, et al. Radio frequency inactivation kinetics of Bacillus cereus spores in red pepper powder with different initial water activity[J]. Food Control, 2019, 105: 174-179.
[32] LEE E J, RAMAKRISHNAN S R, KIM G R, et al. Storage stability of soluble pigments, chlorophylls, and carotenoids in electron-beam-irradiated edible lavers (Porphyra umbilicalis) with impact on microbial safety and sensory characteristics[J]. Journal of the Science of Food and Agriculture, 2019,99(8): 3860-3870.