现代食品加工使蔬菜的消费过程更健康、营养、安全和便捷[1]。 虽然蔬菜种子中含有大量营养成分和活性物质,如脂质、蛋白质、膳食纤维等,但是大多数情况下其仍作为食品加工的副产物被废弃, 不可避免地造成一定程度的资源浪费和环境污染[2]。 西兰花是一种被广泛食用的蔬菜,其营养成分主要包括蛋白质、 维生素和硫代葡萄糖苷等[3]。除了直接食用外,其加工制品也较多,主要包括速冻、 脱水西兰花产品以及西兰花提取物产品等。在西兰花加工过程中,其种子作为一种主要副产物常常被丢弃。 西兰花种子中萝卜硫苷的含量远高于成熟植株[4],而萝卜硫苷的降解产物萝卜硫素具有较强的抗癌活性。 国内外针对西兰花种子的研究主要集中在萝卜硫苷的分离纯化及检测等方面[5-7]。脂质是种子营养物质的重要成分之一,而甘油三酯(TAG)在脂质含量中占比超过95%[8-9]。因西兰花种子中的脂类物质过去被认为是提取萝卜硫苷过程中的杂质被除去[7,10],故目前针对它的化学组成等相关研究较少。 有研究分析了西兰花种子油中游离脂肪酸组成[11-12],结果表明西兰花种子油含有约58%的芥酸,还含有一定量的亚油酸、油酸和棕榈酸等其它脂肪酸。 此前对西兰花种子油中甘油三酯的结构和组成未见研究报道, 缺乏脂肪酸侧链在甘油三酯中的连接位置等重要信息。 越来越多的证据表明:除脂肪酸组成外,脂肪酸在甘油三酯中的连接位置对其的营养价值和功能具有重要影响[13-16]。 例如,脂肪酸在甘油三酯的连接位置能改变甘油三酯的稳定性, 调控钙离子和脂肪酸的吸收,影响脂质代谢。阐明西兰花种子油中甘油三酯结构和组成能够揭示其潜在的开发利用价值, 为西兰花种子油的综合利用提供科学依据。
Buchgraber 等[9]综述了气相色谱法、高效液相色谱法、 薄层色谱法和超临界流体色谱法在甘油三酯定性、定量分析中的应用,气相色谱法不能有效分离分子质量相同的甘油三酯, 且检测过程的高温会影响不耐热长链多不饱和甘油三酯的检测,主要用于甘油三酯的定性分析;高效液相色谱分析甘油三酯的方法主要有非水反向高效液相色谱法 (Non-aqueous reverse phase high performance liquid chromatography, NARP-HPLC)和银离子高效液相色谱法 (Ag+-HPLC),NARP-HPLC无法有效分离当量碳原子数(ECN)相同的甘油三酯, 需采用NARP-HPLC 与Ag+-HPLC 联用的二维液相色谱进行分析,操作复杂且检测效率较低;超临界流体色谱(Supercritical fluid chromatography, SFC)以超临界流体作为流动相,在具有温和的检测温度和条件的同时与气相色谱一样能够使用质谱检测器。 超高效超临界流体色谱 (Ultraperformance convergence chromatography, UPC2)是一种融合了高效液相色谱技术的新一代超临界流体色谱技术, 兼具高效液相色谱和超临界流体色谱的优势,能够降低检测时间,减少有机溶剂的使用,提高检测效率[17-19]。 Zhou 等[17]采用超高效超临界流体色谱与四极杆飞行时间质谱(Quadrupole time-of-flight mass spectrometry, Q-TOF MS)联用建立一种快速检测和鉴定牛乳脂肪中甘油三酯和甘油二酯的方法, 并使用6 种甘油三酯标准品【三肉豆蔻酸酯(MMM)、三油酸酯(OOO)、1,2-二油酸-3-棕榈酸酯(OOP)、1,2-二油酸-3-亚油酸酯(OOL)、1-油酸-2,3-二棕榈酸酯(OPP)和1-棕榈酸-2-油酸-3-亚油酸酯(POL)】对检测方法的准确性进行验证。超高效超临界流体色谱-四极杆飞行时间质谱法(UPC2 Q-TOF MS)还被应用于分析葵花籽油、玉米油、大豆油[18]、橄榄油[19]中甘油三酯的结构和组成。 由于甘油三酯类物质结构高度类似,极性和其它理化性质也较为接近,高效液相色谱和超临界流体色谱均不能对甘油三酯类物质进行基线分离。然而,有研究表明[17-19],与高效液相色谱法相比, 超高效超临界流体色谱在使用更少的有机试剂和更短的分离时间的同时, 提高了对甘油三酯的分离效果, 将其与四极杆飞行时间质谱联用能够鉴定甘油三酯中脂肪酸侧链的具体连接位置。
本研究采用超高效超临界流体色谱-四极杆飞行时间质谱(UPC2 Q-TOF MS)分析西兰花种子油中甘油三酯的结构和组成, 通过质谱信息确定西兰花种子油中甘油三酯上各脂肪酸侧链的连接位置, 并用气相色谱-质谱 (Gas chromatography-mass spectrometry, GC-MS)分析西兰花种子油的游离脂肪酸组成, 以期为西兰花种子油的综合开发利用提供参考。
1 材料与方法
1.1 材料与试剂
西兰花种子油样品,美国Botanic Innovations公司;乙腈、甲醇、异丙醇和甲酸铵(均为LC-MS级), 美国Sigma Aldrich 公司; 食品级二氧化碳(纯度>99.99%),上海振信气体有限公司;氢氧化钾(分析纯级),上海迈瑞尔化学技术有限公司;三氟化硼甲醇溶液(14%),上海安谱实验科技股份有限公司;甲苯(分析纯级)、异辛烷(色谱纯级)和甲醇(色谱纯级),国药集团化学试剂有限公司。
1.2 仪器与设备
ACQUITY UPC2 超高效超临界流体色谱仪(配有二元泵、自动进样器、背压调节器);Xezo G2型四极杆飞行时间质谱仪, 美国Waters 公司;7890A-5975C 型气相色谱质谱仪,美国Agilent 公司;SWB25 型恒温水浴锅, 上海精宏实验设备有限公司;BSA224S-CW 万分之一天平, 赛多利斯(上海)贸易有限公司;Milli-Q 10 型超纯水仪,美国Millipore 公司;Allegra X-22R 型低温高速离心机,德国Beckmen 公司;涡旋混合器,德国IKA 公司。
1.3 方法
1.3.1 样品前处理
1.3.1.1 甘油三酯提纯 将10 μL 西兰花种子油加入990 μL 乙腈/甲醇/异丙醇混合液中(V 乙腈∶V 甲醇∶V 异丙醇=10∶9∶1),涡旋混合20 s。 在室温下以2 000 r/min 转速离心5 min, 弃去上清液。 用990 μL 异丙醇稀释下层液体,混匀后转移到液相小瓶供UPC2 Q-TOF MS 分析。 样品平行处理3 份。
1.3.1.2 皂化和脂肪酸甲酯化 将20 mg 种子油加入0.4 mL 甲苯和0.4 mL 0.5 mol/L KOH 甲醇溶液中,涡转混合。 在60 ℃下水浴加热10 min,冷却至室温后再加入2 mL 14% BF3-甲醇溶液,涡转混合。在60 ℃下水浴加热5 min。再次冷却后加入2 mL 异辛烷和3 mL 超纯水,充分震荡萃取后,将异辛烷层转移到气相小瓶中供GC-MS 分析。样品平行处理3 份。
1.3.2 超高效超临界流体色谱条件 色谱柱选择Waters Acquity UPC2 HSS C18 柱 (100 mm×3.0 mm×1.8 μm),柱温为30 ℃,背压为12.411 MPa,进样量为2.0 μL。流动相A 是CO2,流动相B 是甲醇,流速为1.6 mL/min。洗脱梯度为:0 min,99% A相;5 min,98.2% A 相;12 min,98% A 相;15 min,97% A 相;16 min,70% A 相;19 min,70% A相; 最后回到99% A 相重新平衡。 使用Waters 1525 泵作为补偿泵,0.1%甲酸铵-甲醇溶液作为补偿溶剂,流速为0.3 mL/min。
1.3.3 四极杆飞行时间质谱条件 采用电喷雾(ESI)离子源,正离子模式;离子源温度为120 ℃;脱溶剂温度为500 ℃;毛细管电压为3.0 kV;锥孔电压为50.0 V;源电压为80.0 V;脱溶剂气体(氮气)流速为800 L/h;碰撞气体(氩气)流速为150 L/h;使用MSE 模式采集数据,MS1 模式的碰撞能量为6 eV,MS2 模式的碰撞能量为35 eV; 扫描范围质核比为100~1 200; 采集速率为5 质谱数据点/s。
1.3.4 气相色谱和质谱条件 色谱柱:DB-23 石英毛细柱(60 m×0.25 mm,0.25 μm);载气(氦气)流速为1 mL/min;分流比为20∶1;进样量为1 μL;进样口温度230 ℃; 程序升温梯度为: 初始温度100 ℃,10.5 ℃/min 升温至184 ℃,184 ℃保 持3 min,6 ℃/min 升温至最终温度240 ℃。
质谱条件为:电子轰击(EI)离子源;电子能量70 eV;离子源温度230 ℃;扫描范围质核比为33~550;气质接口温度为280 ℃。
1.4 数据处理
使用Waters MassLynx V4.1 软件对甘油三酯数据进行采集,使用IBM SPSS 21 软件进行数据处理。 根据峰面积归一法将甘油三酯和脂肪酸的相对含量表示为平均值±标准差。
2 结果与分析
2.1 甘油三酯鉴定结果
采用UPC2 Q-TOF 法从西兰花种子油中鉴定出43 种甘油三酯。 西兰花种子油的UPC2 Q-TOF基峰强度色谱图 (Base peak intensity chromatograms, BPI)见图1。 甘油三酯分子是由一分子丙三醇和三分子脂肪酸酯化而成。 根据甘油三酯脂肪酸侧链将甘油三酯分为3 类:3 个脂肪酸侧链都相同;3 个脂肪酸侧链中有2 个侧链相同,不同的脂肪酸侧链可能连接在sn-2 位或sn-1(sn-3)位;3 个脂肪酸侧链都不同。 以下将用3 幅质谱图(图2~4)分别阐明3 类甘油三酯的鉴定方法。
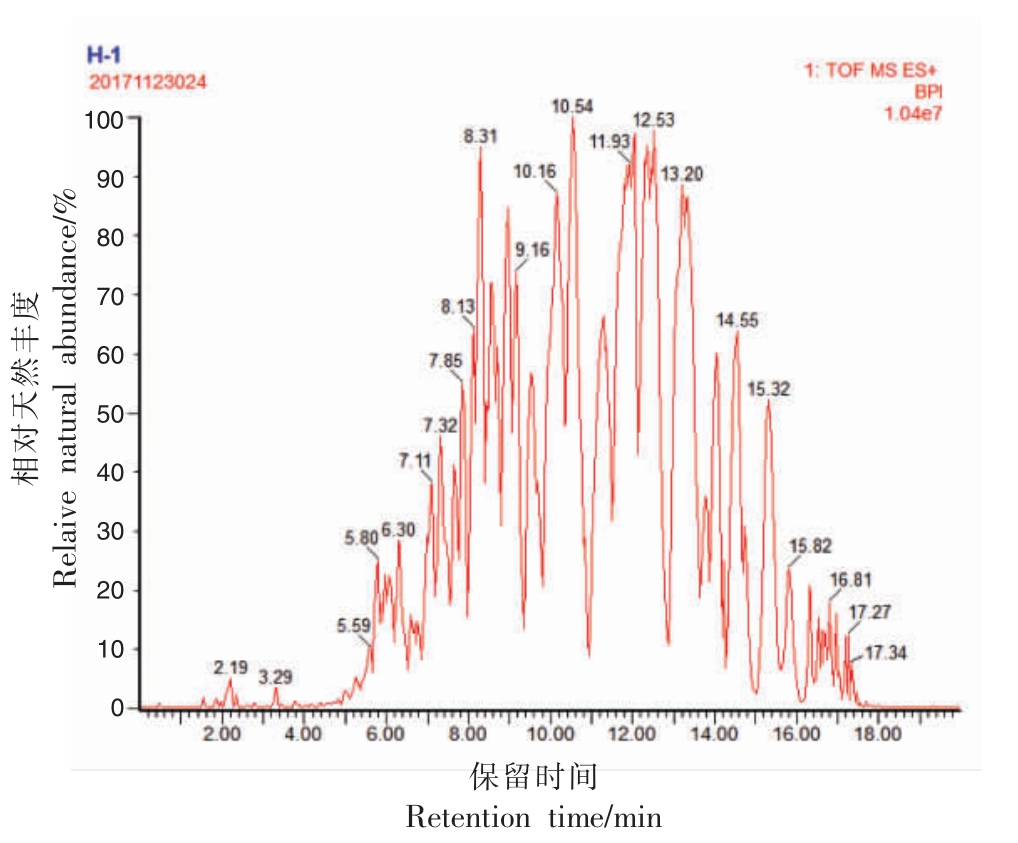
图1 西兰花种子油的UPC2 Q-TOF BPI 色谱图
Fig.1 UPC2 Q-TOF MS base peak intensity chromatogram of broccoli seed oil
以10 号峰为例阐明含有3 个相同脂肪酸侧链的甘油三酯的鉴定过程,其质谱图见图2。10 号峰准分子离子[M+NH4]+的质核比为896.7708,对应的甘油三酯分子式为C57H98O6。二级质谱中主要的二酰基子离子 [M-RCOO+H]+的质核比为599.5042,二酰基子离子为[L-L]+。 母离子和子离子质核比之差表明母离子失去的碎片离子的质核比为299.2773,对应失去的脂肪酸为亚油酸,因此10 号峰被鉴定为三油酸甘油酯(LLL)。
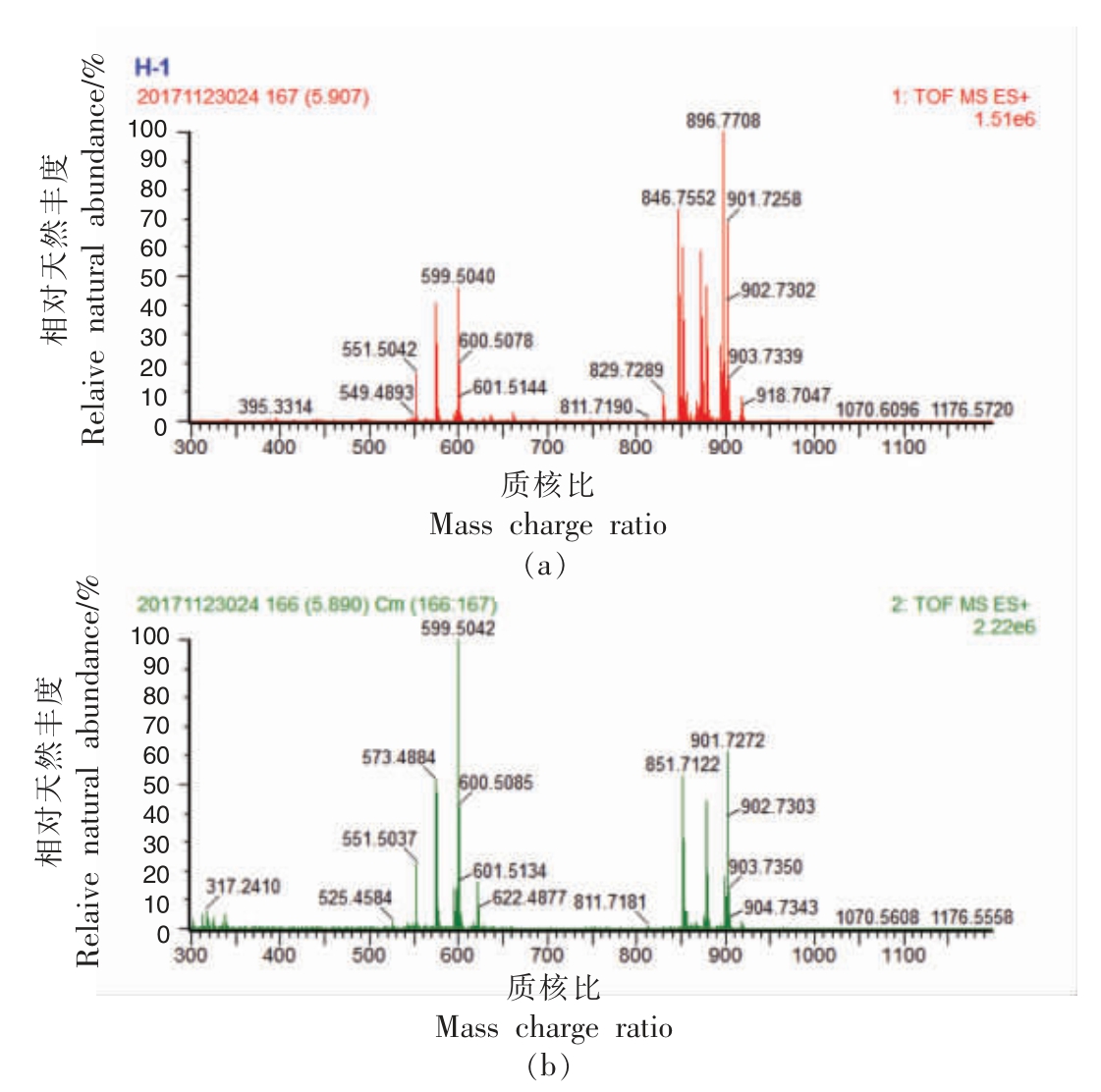
图2 三油酸甘油酯(LLL)的一级质谱图(a)和二级质谱图(b)
Fig.2 MS1 spectrum (a) and MS2 spectrum (b) of LLL
以34 号峰为例阐明含有2 个相同脂肪酸侧链和1 个不同脂肪酸侧链的甘油三酯的鉴定过程,质谱图见图3。 34 号峰准分子离子[M+NH4]+的质核比为958.8812, 对应的甘油三酯分子式为C61H112O6。 34 号峰主要的二酰基子离子有2 种,质核比为659.5982 和603.5359,对应的二酰基子离子和相对丰度分别为[O-E]+ 100%和[O-O]+54.74%,失去的脂肪酸分别为油酸和芥酸,因此该甘油三酯分子由两分子油酸、 一分子芥酸和一分子丙三醇酯化而成。 已有的研究结果表明[17-19],甘油三酯sn-2 酯键在二级质谱下更不易断裂,因此失去sn-2 脂肪酸侧链产生二酰基子离子的相对丰度小于失去sn-1 和sn-3 脂肪酸侧链产生二酰基子离子的相对丰度。 [O-E]+和[O-O]+的相对丰度之比小于2∶1,所以sn-2 位脂肪酸为油酸,34 号峰被鉴定为1,2-二油酸-3-芥酸甘油酯(OOE)。
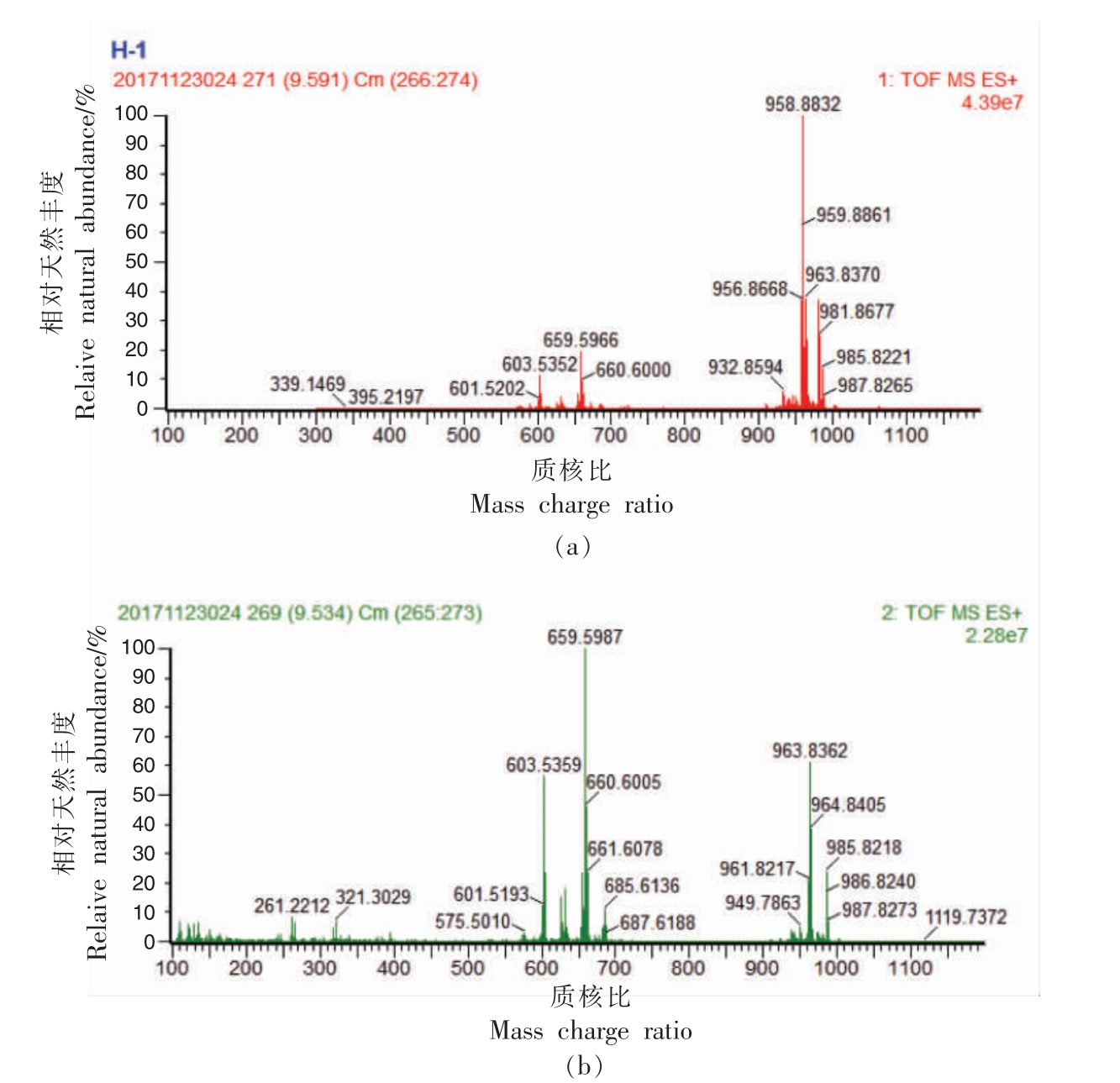
图3 1,2-二油酸-3-芥酸甘油酯(OOE)的一级质谱图(a)和二级质谱图(b)
Fig.3 MS1 spectrum (a) and MS2 spectrum (b) of OOE
以40 号峰为例阐明含有3 个不同脂肪酸侧链的甘油三酯的鉴定,质谱图见图4。40 号峰准分子离子[M+NH4]+的质核比为984.8978,对应的甘油三酯分子式为C63H114O6。 二级质谱图中二酰基子离子主要有3 种, 其质核比分别为629.5526,657.5841 和687.6307, 对应的二酰基子离子和相对丰度为 [G-L]+ 100%、[L-E]+ 93%和 [G-E]+64%。 同理,相对丰度最低的二酰基子离子[G-E]+对应脱去的亚油酸连接在sn-2 位。 在不考虑旋光异构的前提下, 芥酸连接在sn-1 和连接在sn-3是同一甘油三酯, 因此40 号峰被鉴定为1-花生烯酸-2-亚油酸-3-芥酸甘油酯(GLE)。
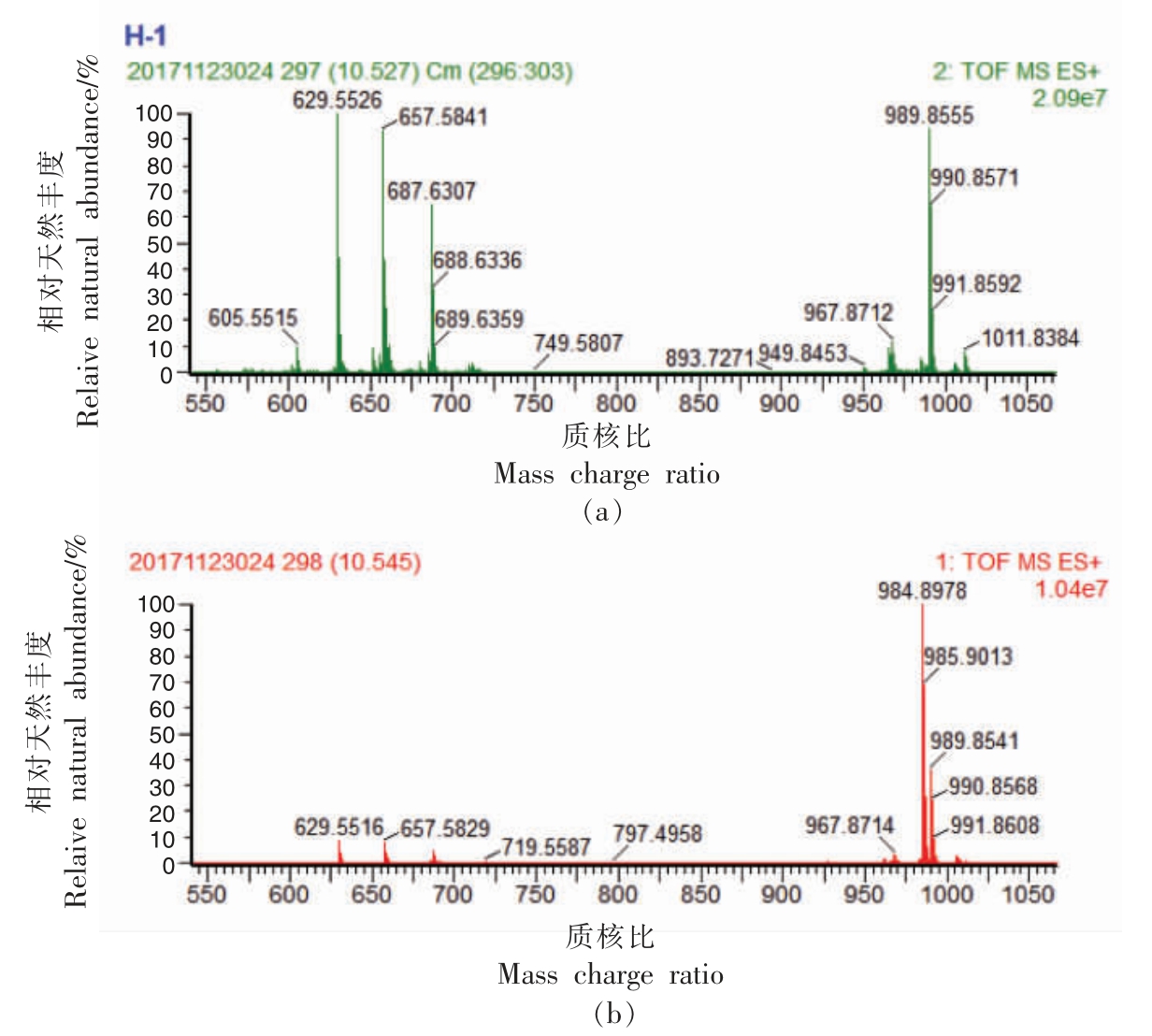
图4 三油酸甘油酯(GLE)的一级质谱图(a)和二级质谱图(b)Fig.4 MS1 spectrum (a) and MS2 spectrum (b) of GLE
本研究首次报道了西兰花种子油的甘油三酯组成,初步鉴定出西兰花种子油中含有43 种甘油三酯,甘油三酯的相对含量见表1。43 种甘油三酯中, 含量最高的6 种甘油三酯ELE、ELnE、GLnE、GLE、GOE 和LOE 占总甘油三酯的52.21%, 相对含 量分别为11.72,11.64,9.12,8.24,6.46 和5.02 g/100 g TAGs;15 种甘油三酯含有芥酸侧链,即ELE、ELnE、GLnE、GLE、GOE、LOE、PLnE、OOE、PLE、POE、LnOE、LEL、LnSE、SEO 和SLE, 占总甘油三酯的77.99%。 鉴定的43 种甘油三酯含有13对同分异构体,其具体结构分别为PLnP 和PLPo、PLnLn 和LnPoL、PLL 和POLn、POO 和PLS、LOLn和LLL、OLL 和LSLn、PGLn 和LOO、LLG 和LnLA、PLnE 和LGO、POB 和SLA、LnOE 和LEL、LOE 和LnSE、OOE 和SLE。 比较13 对同分异构体在超高效超临界流体色谱中保留时间得出, 在分子质量和不饱和度相同时,sn-2 脂肪酸侧链与sn-1/sn-3脂肪酸侧链的碳原子数和不饱和度越接近, 甘油三酯在超高效超临界流体色谱中的保留时间越短。
表1 西兰花种子油甘油三酯鉴定结构和相对含量
Table 1 Identification and relative concentration of triacylglycerols in broccoli seed oil
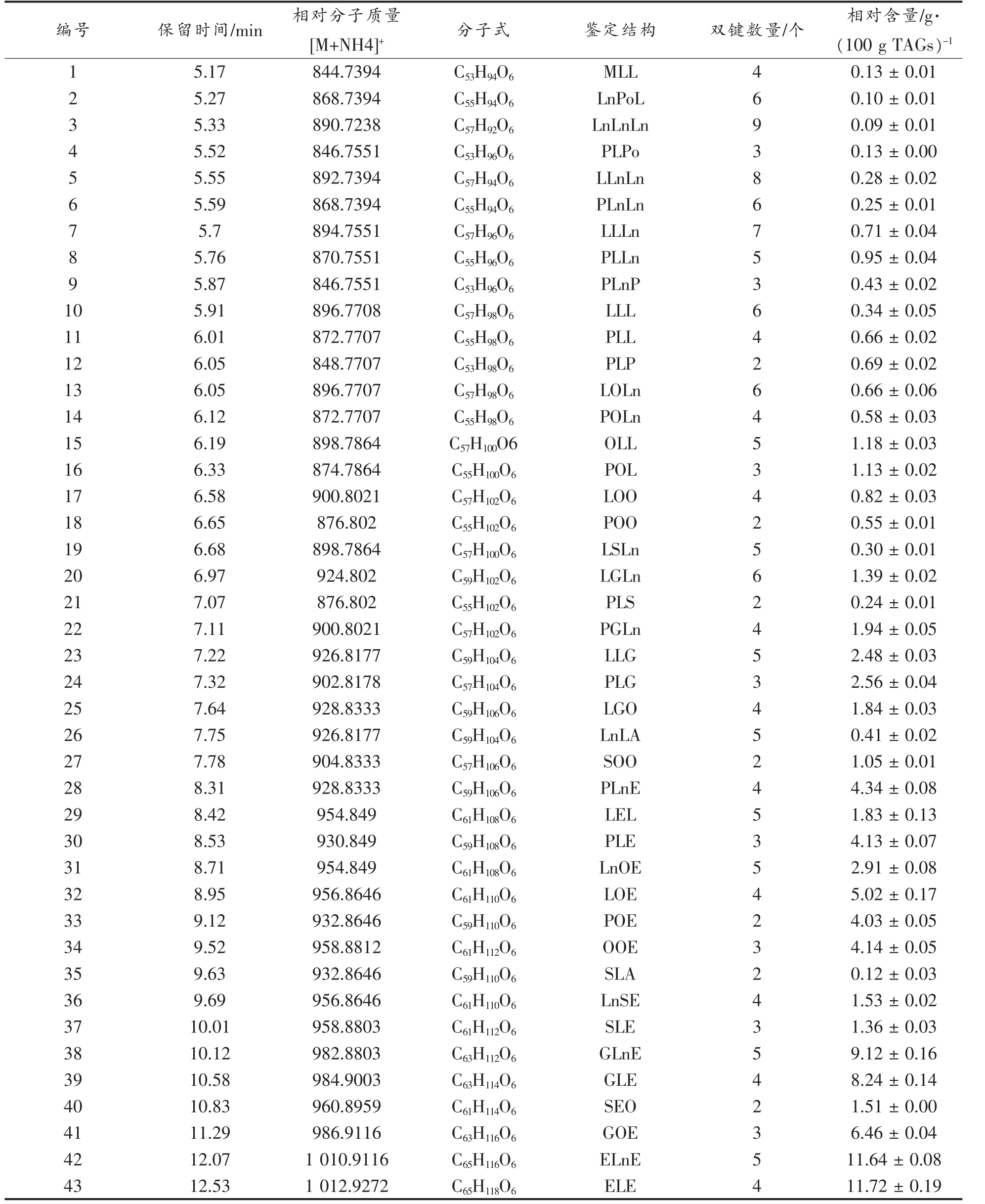
注:M 表示肉豆蔻酸;P 表示棕榈酸;Po 表示棕榈油酸;S 表示硬脂酸;O 表示油酸;L 表示亚油酸;Ln 表示亚麻酸;A 表示花生酸;G 表示花生烯酸;E 表示芥酸;X-X-Y、X-Y-X、X-X-X 和X-Y-Z 表示甘油三酯的结构, 例如,G-L-E 表示1-花生烯酸-2-亚油酸-3-芥酸甘油酯。
甘油三酯的相对含量表示为(平均值±标准差)g/100 g TAG。
编号 保留时间/min 相对分子质量[M+NH4]+ 分子式 鉴定结构 双键数量/个 相对含量/g·(100 g TAGs)-1 1 5.17 844.7394 C53H94O6 MLL 4 0.13 ± 0.01 2 5.27 868.7394 C55H94O6 LnPoL 6 0.10 ± 0.01 3 5.33 890.7238 C57H92O6 LnLnLn 9 0.09 ± 0.01 4 5.52 846.7551 C53H96O6 PLPo 3 0.13 ± 0.00 5 5.55 892.7394 C57H94O6 LLnLn 8 0.28 ± 0.02 6 5.59 868.7394 C55H94O6 PLnLn 6 0.25 ± 0.01 7 5.7 894.7551 C57H96O6 LLLn 7 0.71 ± 0.04 8 5.76 870.7551 C55H96O6 PLLn 5 0.95 ± 0.04 9 5.87 846.7551 C53H96O6 PLnP 3 0.43 ± 0.02 10 5.91 896.7708 C57H98O6 LLL 6 0.34 ± 0.05 11 6.01 872.7707 C55H98O6 PLL 4 0.66 ± 0.02 12 6.05 848.7707 C53H98O6 PLP 2 0.69 ± 0.02 13 6.05 896.7707 C57H98O6 LOLn 6 0.66 ± 0.06 14 6.12 872.7707 C55H98O6 POLn 4 0.58 ± 0.03 15 6.19 898.7864 C57H100O6 OLL 5 1.18 ± 0.03 16 6.33 874.7864 C55H100O6 POL 3 1.13 ± 0.02 17 6.58 900.8021 C57H102O6 LOO 4 0.82 ± 0.03 18 6.65 876.802 C55H102O6 POO 2 0.55 ± 0.01 19 6.68 898.7864 C57H100O6 LSLn 5 0.30 ± 0.01 20 6.97 924.802 C59H102O6 LGLn 6 1.39 ± 0.02 21 7.07 876.802 C55H102O6 PLS 2 0.24 ± 0.01 22 7.11 900.8021 C57H102O6 PGLn 4 1.94 ± 0.05 23 7.22 926.8177 C59H104O6 LLG 5 2.48 ± 0.03 24 7.32 902.8178 C57H104O6 PLG 3 2.56 ± 0.04 25 7.64 928.8333 C59H106O6 LGO 4 1.84 ± 0.03 26 7.75 926.8177 C59H104O6 LnLA 5 0.41 ± 0.02 27 7.78 904.8333 C57H106O6 SOO 2 1.05 ± 0.01 28 8.31 928.8333 C59H106O6 PLnE 4 4.34 ± 0.08 29 8.42 954.849 C61H108O6 LEL 5 1.83 ± 0.13 30 8.53 930.849 C59H108O6 PLE 3 4.13 ± 0.07 31 8.71 954.849 C61H108O6 LnOE 5 2.91 ± 0.08 32 8.95 956.8646 C61H110O6 LOE 4 5.02 ± 0.17 33 9.12 932.8646 C59H110O6 POE 2 4.03 ± 0.05 34 9.52 958.8812 C61H112O6 OOE 3 4.14 ± 0.05 35 9.63 932.8646 C59H110O6 SLA 2 0.12 ± 0.03 36 9.69 956.8646 C61H110O6 LnSE 4 1.53 ± 0.02 37 10.01 958.8803 C61H112O6 SLE 3 1.36 ± 0.03 38 10.12 982.8803 C63H112O6 GLnE 5 9.12 ± 0.16 39 10.58 984.9003 C63H114O6 GLE 4 8.24 ± 0.14 40 10.83 960.8959 C61H114O6 SEO 2 1.51 ± 0.00 41 11.29 986.9116 C63H116O6 GOE 3 6.46 ± 0.04 42 12.07 1 010.9116 C65H116O6 ELnE 5 11.64 ± 0.08 43 12.53 1 012.9272 C65H118O6 ELE 4 11.72 ± 0.19
2.2 脂肪酸组成
西兰花种子油主要脂肪酸组成及相对含量见表2。 结果表明,西兰花种子油主要含有9 种脂肪酸,其中不饱和脂肪酸有5 种,分别为油酸(C18∶1)、亚油酸(C18∶2)、二十碳烯酸(C20∶1)、芥 酸(C22∶1)和神经酸(C24∶1),占总脂肪酸含量的92.54%, 不饱和脂肪酸含量与此前研究的结果92.36%一致[12];饱和脂肪酸共有4 种,分别为棕榈酸(C16∶0)、硬脂酸(C18∶0)、花生酸(C20∶0)和山嵛酸(C22∶0),共占总脂肪酸含量的7.46%。西兰花种子油中含量最高的脂肪酸是芥酸, 其次为油酸和亚油酸, 相对含量依次为53.13,20.92 g/(100 g FAs)和11.82 g/(100 g FAs),这与此前报道的超临界CO2 萃取的西兰花种子油中脂肪酸含量(芥酸58.26%、油酸23.76%和亚油酸8.99%)接近[12]。本研究检测出的二十碳烯酸在黄忆真等[12]的研究中未检测出,而West 等[11]检测出的微量脂肪酸(肉桂酸0.05%、棕榈油酸3.33%、二十碳二烯酸0.49%、花生四烯酸0.17%、木蜡酸0.34%等)在本研究中未被检测出, 这些差异可能是不同的油脂提取方法、脂肪酸检测条件、西兰花品种和基因型等因素导致。
表2 对比了GC-MS 直接测定的脂肪酸组成与由甘油三酯组成折算的脂肪酸组成结果。 结果表明,芥酸在两类结果中均为含量最高的脂肪酸;直接测定的脂肪酸组成中脂肪酸含量由高到低依次为芥酸、油酸、亚油酸、二十碳烯酸、棕榈酸、硬脂酸、 神经酸和山嵛酸, 除油酸含量低于亚油酸外, 这种变化趋势与由甘油三酯组成折算的脂肪酸组成的变化趋势一致。 由甘油三酯折算的脂肪酸组成中不含山嵛酸和神经酸, 原因可能是部分微量含有山嵛酸和神经酸侧链的甘油三酯未被检测出或检测前已经水解。 GC-MS 测定的脂肪酸组成结果与甘油三酯中脂肪酸组成存在一定差异的原因可能是超高效超临界流体色谱-四极杆与飞行时间质谱联用法并不能检测和鉴定西兰花种子油中所有的甘油三酯, 存在部分含量极低的甘油三酯可能未被检测和甘油三酯因分离不完全而无法被鉴定的情况, 同时本研究并未对甘油二酯和甘油单酯进行检测。
表2 气相色谱测定西兰花种子油脂肪酸组成与甘油三酯折算脂肪酸组成相对含量比较
Table 2 Comparison of relative concentration of fatty acid compositions determined by GC-MS and calculated by triacylglycerols compositions in broccoli seed oil
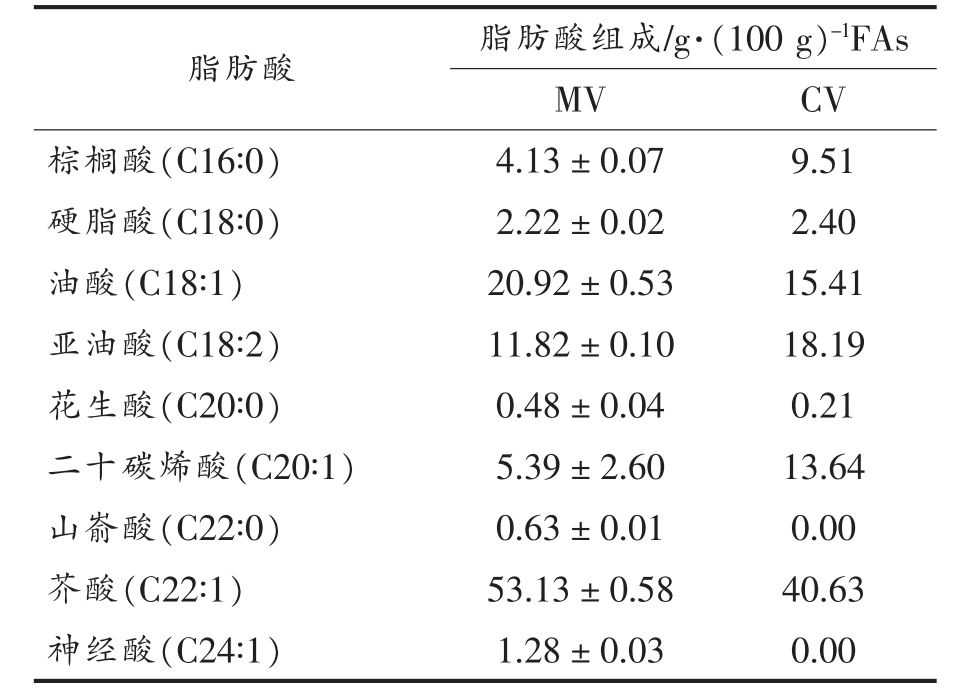
注:FA 表示脂肪酸;MV 表示气相色谱直接测定脂肪酸组成结果;CV 表示由表1 甘油三酯结果折算得到脂肪酸组成。
脂肪酸 脂肪酸组成/g·(100 g)-1FAs MV CV棕榈酸(C16∶0) 4.13±0.07 9.51硬脂酸(C18∶0) 2.22±0.02 2.40油酸(C18∶1) 20.92±0.53 15.41亚油酸(C18∶2) 11.82±0.10 18.19花生酸(C20∶0) 0.48±0.04 0.21二十碳烯酸(C20∶1) 5.39±2.60 13.64山嵛酸(C22∶0) 0.63±0.01 0.00芥酸(C22∶1) 53.13±0.58 40.63神经酸(C24∶1) 1.28±0.03 0.00
3 结论
本研究首次报道了西兰花种子油中甘油三酯的结构和组成,采用超高效超临界流体色谱-四极杆飞行时间质谱法从西兰花种子油中鉴定出43种甘油三酯,其中含有13 对同分异构体。 采用气相色谱-质谱法测定西兰花种子油的游离脂肪酸组成,并与甘油三酯中脂肪酸组成进行对比。结果表明,芥酸是GC-MS 直接测定的脂肪酸组成与由甘油三酯组成折算的两种结果中均为含量最高的脂肪酸; 直接测定的脂肪酸组成中脂肪酸含量变化趋势与由甘油三酯组成折算的脂肪酸组成的变化趋势基本一致。这表明超高效超临界流体色谱-四极杆串联飞行时间质谱系统是一种直接定性定量分析植物油中甘油三酯组成的有效手段, 是未来分析植物油等非极性复杂体系化学组成与含量的重要工具。
[1] RAGAERT P, VERBEKE W, DEVLIEGHERE F,et al. Consumer perception and choice of minimally processed vegetables and packaged fruits[J]. Food Quality and Preference, 2004, 15(3): 259-270.
[2] SARKAR A, KAUL P. Evaluation of tomato processing by-products: A comparative study in a pilot scale setup[J]. Journal of Food Process Engineering,2014, 37(3): 299-307.
[3] 吴广辉, 毕韬韬. 西兰花营养价值及深加工研究进展[J]. 农产品加工, 2015(21): 61-63.
WU G H, BI T T. Advances in nutritional value and deep processing of broccoli[J]. Farm Products Processing, 2015(21): 61-63.
[4] 江敏, 石林娟, 杨毅. 西兰花籽中萝卜硫苷的提取、分离及结构鉴定[J]. 食品科学, 2013, 34(5): 124-126.
JIANG M, SHI L J, YANG Y. Extraction, purification and identification of gulcoraphanin from broccoli seeds[J]. Food Science, 2013, 34(5): 124-126.
[5] 王见冬, 袁其朋, 钱忠明. 萝卜硫素研究进展[J]. 食品与发酵工业, 2003, 29(2): 76-80.
WANG D J, YUAN Q P, QIAN Z M. The new advances in sulforaphen[J]. Food and Fermentation Industries, 2003, 29(2): 76-80.
[6] 张婵娟, 郭晓玲, 孟青, 等. 不同品种西兰花种子中莱菔硫烷的HPLC 分析[J]. 广东药学院学报,2007, 23(5): 506-508.
ZHANG C J, GUO X L, MENG Q. HPLC analysis of sulforaphane in different kinds of broccoli seeds[J]. Journal of Guangdong College of Pharmacy,2007, 23(5): 506-508.
[7] 沈莲清, 苏光耀, 王奎武. 西兰花种子中硫苷酶解产物萝卜硫素的提纯与抗肿瘤的体外试验研究[J].中国食品学报, 2008, 8(5): 15-21.
SHEN L Q, SU G Y, WANG K W. Studies on purification and antitumor in vitro experiment of sulforaphane enzymolyzed from glucosinolate in broccoli seed[J]. Journal of Chinese Institute of Food Science and Technology, 2008, 8(5): 15-21.
[8] BEERMANN C, GREEN A, MÖBIUS M, et al.Lipid class separation by HPLC combined with GC FA analysis: Comparison of seed lipid compositions from different Brassica napus L. varieties[J]. Journal of the American Oil Chemists Society, 2003, 80(8): 747-53.
[9] BUCHGRABER M, ULLBERTH F, EMONS H, et al. Triacylglycerol profiling by using chromatographic techniques[J]. European Journal of Lipid Science and Technology, 2004, 106(9): 621-648.
[10] 林毅, 张金娟, 李晓露, 等. 西兰花种子中萝卜硫素的提取工艺研究[J]. 化学与生物工程, 2014, 31(12): 48-50.
LIN Y, ZHANG J J, LI X L, et al. Study on extraction process of sulforaphane from broccoli seeds[J]. Chemistry & Bioengineering, 2014, 31 (12):48-50.
[11] WEST L, TSUI I, BALCH B, et al. Determination and health implication of the erucic acid content of broccoli florets, sprouts, and seeds[J]. Journal of Food Science, 2002, 67(7): 2641-2643.
[12] 黄忆真, 李杰, 谈满良, 等. 西兰花籽油超临界CO2萃取工艺及脂肪酸组成分析[J]. 中国油脂, 2018,43(12): 1-4, 17.
HUANG Y Z, LI J, TAN M L, et al. Supercritical CO2 extraction of broccoli seed oil and its fatty acid composition[J]. China Oils and Fats, 2018, 43(12):1-4, 17.
[13] YOSHINAGA K, SASAKI K, WATANABE H, et al. Differential effects of triacylglycerol positional isomers containing n-3 series highly unsaturated fatty acids on lipid metabolism in C57BL/6J mice [J].Journal of Nutritional Biochemistry, 2015, 26(1):57-63.
[14] WAN J C, HU S Y, NI K F, et al. Characterisation of fecal soap fatty acids, calcium contents,bacterial community and short-chain fatty acids in sprague dawley rats fed with different sn-2 palmitic triacylglycerols diets[J]. Plos One, 2016, 11(10).
[15] YANG P Y, ZHANG H, WAN J C, et al. Dietary sn-2 palmitic triacylglycerols reduced faecal lipids,calcium contents and altered lipid metabolism in Sprague-Dawley rats[J]. International Journal of Food Science and Nutrition, 2019, 70(4): 474-483.
[16] GUO Y L, CAI Z X, XIE Y P, et al. Synthesis,physicochemical properties, and health aspects of structured lipids: A review[J]. Comprehensive Reviews in Food Science and Food Safety, 2020, 19(2): 759-800.
[17] ZHOU Q, GAO B Y, ZHANG X, et al. Chemical profiling of triacylglycerols and diacylglycerols in cow milk fat by ultra -performance convergence chromatography combined with a quadrupole timeof-flight mass spectrometry[J]. Food Chemistry, 2014,143: 199-204.
[18] GAO B Y, LUO Y H, LU W Y, et al. Triacylglycerol compositions of sunflower, corn and soybean oils examined with supercritical CO2 ultra-performance convergence chromatography combined with quadrupole time-of-flight mass spectrometry[J]. Food Chemistry, 2017, 218: 569-574.
[19] LUO Y H, ZHANG Y Q, YUAN F H, et al. Triacylglycerols composition analysis of olive oils by ultra-performance convergence chromatography combined with quadrupole time-of-flight mass spectrometry[J]. International Journal of Food Science and Technology, 2019, 54(3): 871-879.