我国是水产品的生产大国和消费大国, 水产品的安全和质量也受到人们的关注。 甲醛是水产品中经常被检出的一种化学污染物[1-2],是一种无色,具有强烈刺激气味的原生质毒物,人长期食用含有甲醛的食物,会对身体造成极大伤害,我国也早将甲醛列入农业部发布的《食品动物禁用的兽药及其化合物清单》(农业部193 号公告)禁用药物名单[3]。 水产品中甲醛来源比较复杂:一是人为添加, 不法商贩在水产保存和运输过程中添加甲醛水溶液,用于保鲜、漂白、防腐等作用;二是內源产生,水产品自身代谢过程会产生一定量的甲醛[4]。水产品中鱿鱼的甲醛含量普遍偏高, 含量高达146 mg/kg,食品安全风险比较突出[5]。
目前,甲醛的测试方法有分光光度法[6-7]、荧光法[8]、气相色谱法[9-10]、高效液相色谱法[11-15]等。 甲醛的含量测定只能说明食品中含有甲醛, 其来源却无法判定,这也是目前食品安全质量监管的难点。稳定同位素指纹分析技术可从原子角度探析化合物中元素的分布,在食品真实性鉴别、产地溯源等方面很有潜力,该技术已在小麦[16]、葡萄酒[17]、蜂蜜[18]、牛肉[19]、茶叶[20-21]等多种食品中成功应用。 目前, 同位素分析技术用于食品中甲醛来源鉴别的报道尚少, 在大气中甲醛来源分析方面有相关研究。余应新等[22-23]利用单体化合物稳定碳同位素方法研究了大气中甲醛来源的问题。 郭宋军等[24]和Guo 等 [25] 采用气相色谱/燃烧/同位素比值质谱(GC/C/IRMS)技术测定了广州市大气甲醛碳同位素组成。鱿鱼中普遍存在一定量的甲醛,内源性甲醛是由氧化三甲胺在代谢过程中转化而来 [26],其代谢效率受茶多酚、氯化钙、乳糖等影响[27-29]。关于水产品中甲醛真实来源问题, 目前还没有有效地判别方法。 利用单体化合物同位素指纹特征来表征鱿鱼中甲醛来源是一个新思路。 本文选用甲醛安全风险较高的鱿鱼为对象,建立衍生化-气相色谱/燃烧/同位素比值质谱(GC/C/IRMS)法测定鱿鱼中甲醛稳定碳同位素的方法, 为甲醛来源解析提供科学依据, 为食品质量安全监管提供技术依据。
1 材料与方法
1.1 材料与试剂
甲醛水溶液、2,4-二硝基苯肼(2, 4-Dinitrophenylhydrazine, DNPH)、 甲醛2,4-二硝基苯腙标准品 (Formaldehyde 2, 4-dinitrophenylhydrazone, FA-DNPH,99.8%),CATO 公司; 甲醛水溶液标准品(10 mg/L),First Standard 公司;正己烷、二氯甲烷、 乙酸乙酯, 国药集团化学试剂有限公司;盐酸溶液、氯化钠(分析纯级),国药集团化学试剂有限公司;国际原子能机构同位素标准物质:咖啡因 (δ13C=-19.357‰,IAEA-600)、 乙醇溶液(δ13C=-26.72‰,BCR-660)。
1.2 仪器与设备
ME204/02 分析天平, 梅特勒-托利多仪器有限公司;WNE29 恒温水浴摇床, 德国memmert 公司;S180H 超声仪, 德国Elma 公司;Allegra 64R冷冻离心机, 美国贝克曼公司;N-EVAP112 氮吹仪,美国Organomation Associates Inc 公司;e2695高效液相色谱仪, 美国Waters 公司;DeltaV 气体稳定同位素比值质谱仪(配备有Thermo 气相色谱仪、Flash 2000HT 元素分析仪), 美国赛默飞世尔科技公司。
1.3 方法
1.3.1 样品前处理 鱿鱼样品购买自6 个省9 个城市区域,内脏部分为样品A,剔除内脏剩余部分为样品B,整条鱿鱼为样品C,样品A、B、C 均切碎后研磨成泥,-20 ℃保存。衍生试剂2,4-二硝基苯肼用色谱纯的乙腈重结晶两次后用高效液相色谱检验其纯度。 将过量的纯化过的DNPH 溶于24 mL 盐酸,再加水定容至100 mL,配制得到衍生溶液。
1.3.2 FA 的含量测试 准确称取2 g 鱿鱼样品于50 mL 离心管中,加入10 mL 水,盖上盖子后超声提取30 min,9 000r/min、4 ℃高速离心10 min,取上清液于另一个干净的离心管,加入1 mL DNPH衍生溶液(根据鱿鱼样品中甲醛含量调整衍生溶液的添加量),迅速密封,将离心管置于60 ℃恒温水浴摇床衍生反应1 h, 待冷却至室温, 用0.22 μm 滤膜过滤,衍生物的含量在高效液相色谱仪中完成,工作曲线标准溶液和样品相同的衍生操作,拟定衍生物线性曲线间接计算鱿鱼样品中FA 的含量。
高效液相色谱仪工作条件如下: 化学键合C18 柱(4.6 mm×250 mm);柱温30 ℃;流动相V 乙腈∶V 水=7 ∶3;流速0.8 mL/min;进样量10 μL;紫外检测器,检测器波长355 nm。
1.3.3 FA 标准样的稳定碳同位素测试 取1 mL 37% FA 溶液于5 mL 样品顶空瓶中,加入适量的氯化钠,样品瓶置于65 ℃反应箱平衡90 min,用5 mL 气体进样针抽取2 mL 顶空气体, 通过GC/C/IRMS 测定顶空气体中FA 的稳定碳同位素比值,参 考 气CO2 的δ13CPDB 值采用乙醇 (δ13C=-26.72‰,BCR-660)矫正。
气相色谱仪工作条件如下: 测定FA 标准品时,采用HP-INNOWAX 强极性色谱柱(30 m×0.25 mm×20 μm);柱温65 ℃,进样口温度250 ℃,氦气流速1.5 mL/min。
1.3.4 甲醛2,4-二硝基苯腙的稳定碳同位素测试 向1.3.2 节衍生好的溶液中加入10 mL 的正己烷, 翻转摇匀充分萃取,4 000 r/min、4 ℃离心3 min,取上层正己烷置于50 mL 离心管中,向残留水溶液中再加入10 mL 正己烷, 再重复萃取2~3次,合并正己烷层,将萃取液置于氮吹仪吹干,用甲醇定容至1 mL, 通过GC/C/IRMS 测定甲醛2,4-二硝基苯腙的稳定碳同位素值, 参考气CO2 的δ13CPDB 值采用乙醇(δ13C=-26.72‰,BCR-660)矫正。
气相色谱仪工作条件如下:测定甲醛2,4-二硝基苯腙时,色谱柱为HP-5MS 弱极性柱(30 m×0.25 mm×20 μm):程序升温条件从50~200(20 ℃/min)~250 (3 ℃/min)~290 ℃(20 ℃/min), 保留5 min;进样口温度250 ℃,氦气流速1.0 mL/min。
1.3.5 2,4-二硝基苯肼的稳定碳同位素测试 通过百万分之一天平称取处理好的2,4-二硝基苯肼粉末0.1~2 mg 于锡杯, 通过自动进样盘进样,采用元素分析-同位素比值质谱法(EA-IRMS)测定2,4-二硝基苯肼的稳定碳同位素值。 参考气CO2 的δ13CPDB 值采用咖啡因(δ13C=-19.357‰,IAEA-600)矫正。
元素分析仪工作条件如下: 燃烧炉温度960℃,氦气流速90 mL/min,二氧化碳参考气流速180 mL/min,氧气流速230 mL/min,色谱柱温50 ℃。
1.3.6 液相衍生化过程的同位素效应试验 向离心管加入10 μL 37% FA 溶液,混匀后向其中加入1 mL 的DNPH 衍生溶液(过量),衍生、萃取及测试同1.3.2 节和1.3.4 节方法。
1.4 计算方法
Wen 等[30]通过测定DNPH 和甲醛2,4-二硝基苯腙的稳定碳同位素比值,以质量平衡方程【式(1)】 间接计算而得到FA 的稳定碳同位素比值,余应新等[22]也用该方法对大气中FA 的稳定碳同位素比值进行了分析。
式中,fFA——参加反应的甲醛的碳原子在衍生物中的占比;fDNPH——参加反应的2,4-二硝基苯肼的碳原子在衍生物中的占比;其中fFA+fDNPH=1。
2 结果与分析
2.1 仪器稳定性分析
IRMS 系统的性能优劣是确定碳稳定同位素比值能否被认可的重要指标。 验证IRMS 系统的测定稳定性, 连续10 次通入固定体积的CO2 气体,测定CO2 中δ13C,结果见表1。 其标准偏差为0.016‰,稳定性较好。
表1 IRMS 系统稳定性
Table 1 Stability of IRMS system
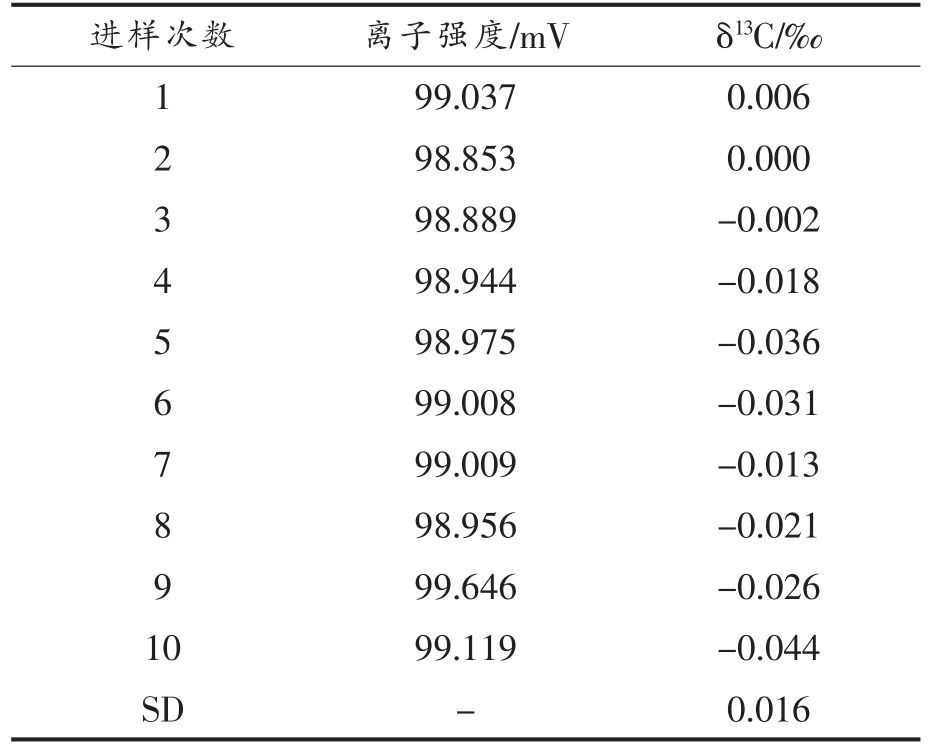
进样次数 离子强度/mV δ13C/‰1 99.037 0.006 2 98.853 0.000 3 98.889 -0.002 4 98.944 -0.018 5 98.975 -0.036 6 99.008 -0.031 7 99.009 -0.013 8 98.956 -0.021 9 99.646 -0.026 10 99.119 -0.044 SD - 0.016
2.2 FA 的δ13C 值测试结果
FA 溶液中的δ13C 值由顶空-GC/C/IRMS 法测定,直接测定FA 的灵敏度较低,需对平衡过程及条件进行优化以达到GC/C/IRMS 方法测定FA 的灵敏度。由图1a 可知,高温可以促进FA 从液相向气相扩散,提高平衡温度可以提高顶空FA 含量,然而当温度太高时,FA 的含量却有所降低, 可能太高的温度会导致顶空瓶瓶盖变形, 部分气体逸散,因此最优平衡温度为65 ℃。 FA 产生量与平衡时间的关系如图1b 所示, 反应在90 min 时基本可以达到平衡状态。 向FA 溶液中加入一定量的氯化钠可以降低FA 在水中的溶解度,提高FA 测定的灵敏度,如图1c 所示,氯化钠的最佳添加量为2 g。 从图1d 可知,FA 含量对δ13C 值的测定影响不大,3 个含量水平的FA 溶液δ13C 值标准偏差SD 仅为0.056‰。对同一含量水平的FA 测定3 次平行,其平均值为-35.937‰,SD 为0.121‰,以该值为后文中液相衍生化过程同位素效应验证试验中FA 的δ13C 值。
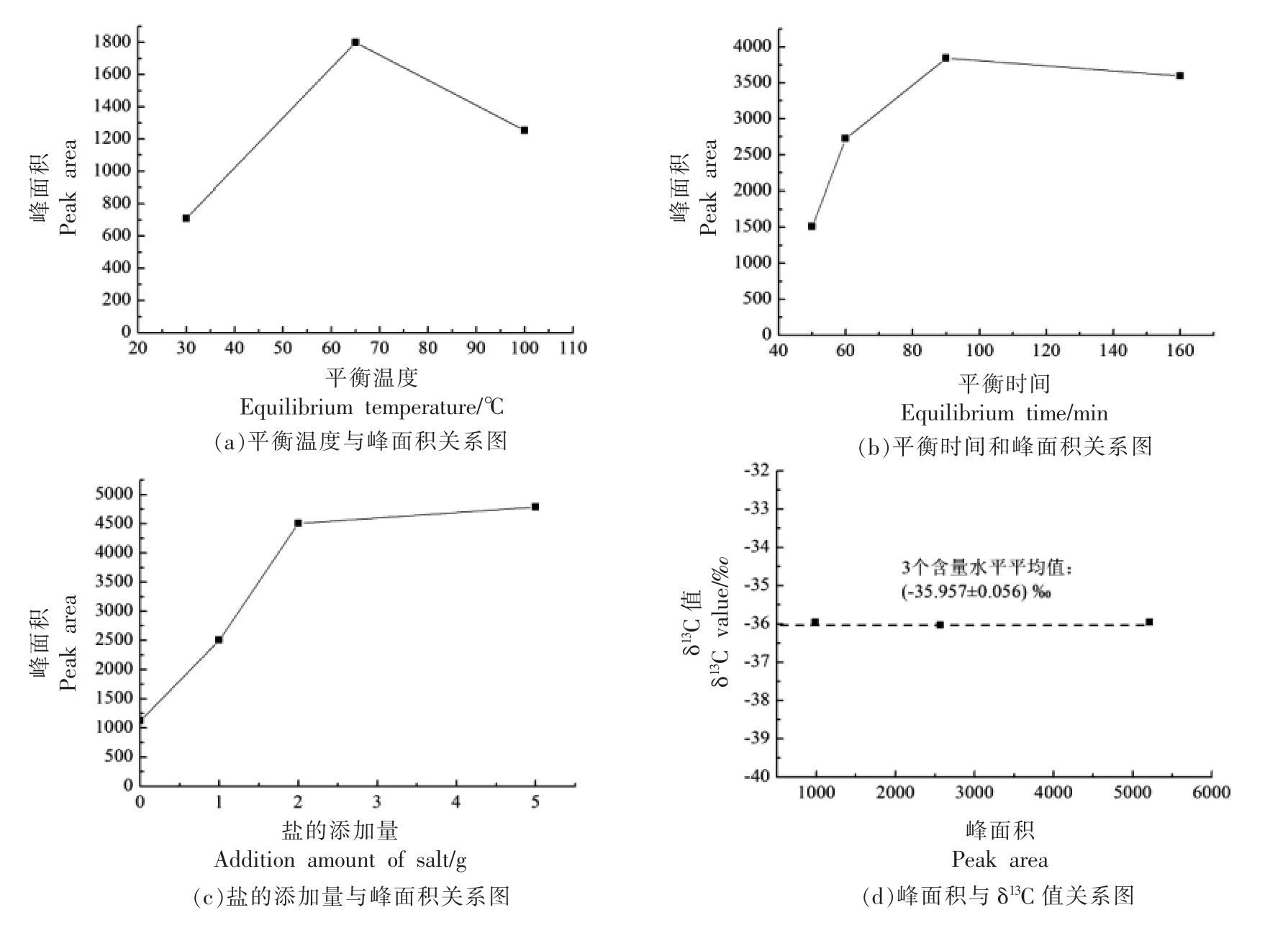
图1 FA 测试方法优化结果示意图
Fig.1 Schematic diagram of optimization results of FA test method
2.3 DNPH 的δ13C 值测试结果
DNPH 的δ13C 值由EA/IRMS 法测定, 进样5次,得到的结果如表2 所示。测定得到的δ13C 值平均值为-28.154‰,SD 为0.104‰。 本研究所用到的衍生剂均由该纯化过的DNPH 固体配制而来。
表2 DNPH 的δ13C 值结果
Table 2 Results of δ13C value of DNPH
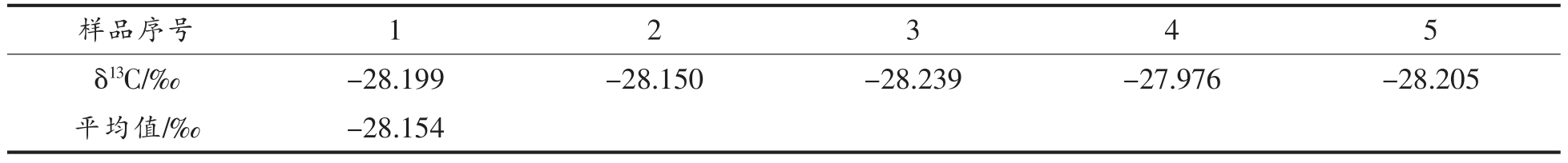
样品序号 1 2 3 4 5 δ13C/‰ -28.199 -28.150 -28.239 -27.976 -28.205平均值/‰ -28.154
2.4 甲醛2,4-二硝基苯腙的δ13C 值测试结果
甲醛2,4-二硝基苯腙标准品的δ13C 值由GC/C/IRMS 测定,其色谱峰峰形对称、尖锐。 不同质量浓度梯度(0.2~2 mg/mL)的标准溶液中甲醛2,4-二硝基苯腙的δ13C 值如图2 所示,SD 值为0.124‰,说明其δ13C 值的测定受质量浓度影响很小, 测定6 组质量浓度为0.8 mg/mL 标准溶液,甲醛2,4-二硝基苯腙的δ13C 值SD 为0.189‰,说明碳同位素测试稳定性较好。
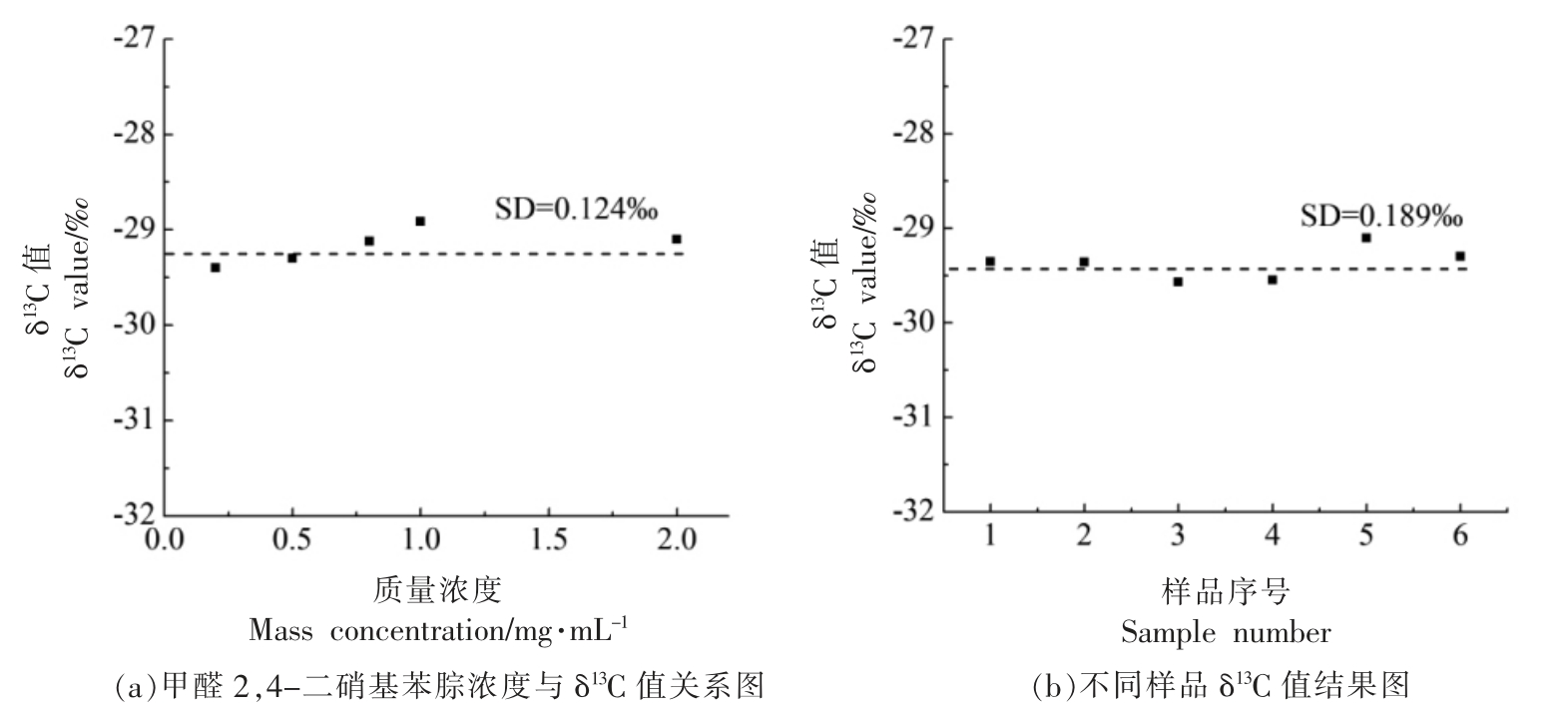
图2 甲醛2,4-二硝基苯腙δ13C 值结果示意图
Fig.2 Schematic diagram of δ13C value on formaldehyde 2,4-dinitrophenylhydrazone
对同一质量浓度下, 分别对采用二氯甲烷、甲醇、正己烷、乙腈稀释的标准溶液进行稳定碳同位素分析,δ13C 值如下表3,不同溶剂的选择对甲醛2,4-二硝基苯腙的δ13C 值无明显的影响。衍生产物可采用下表中的溶剂复溶上GC/C/IRMS 进行测试。
表3 不同溶剂稀释下甲醛2,4-二硝基苯腙的δ13C 值
Table 3 δ13C value of formaldehyde 2, 4-dinitrophenylhydrazone diluted with different solvents
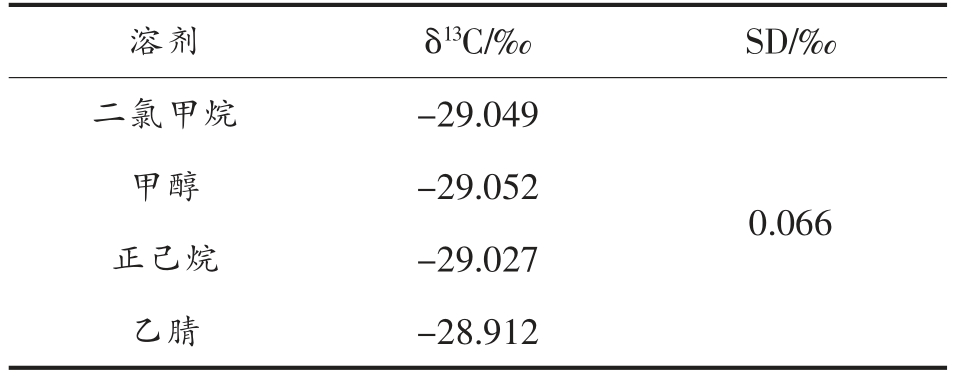
溶剂 δ13C/‰ SD/‰二氯甲烷 -29.049甲醇 -29.052正己烷 -29.027乙腈 -28.912 0.066
2.5 液相衍生化过程同位素效应试验结果
5 组液相衍生化过程的测试结果如表5 所示,由甲醛和DNPH 在酸性条件下衍生而产生的甲醛2,4-二硝基苯腙的δ13C 理论值是经质量平衡方程(1)计算而来,测定值是经GC/C/IRMS 测定得到。从表4 可知,甲醛和DNPH 的衍生化过程是符合质量平衡方程的, 衍生物δ13C 理论值和测定值差值低于0.344‰,差值SD 为0.215‰。 可以认为在DNPH 过量的情况下, 甲醛在衍生化过程中是不存在稳定碳同位素的分馏的。
表4 液相衍生化过程结果表(‰)
Table 4 The results of liquid phase derivatization process (‰)

序号 δ13CFA δ13CDNPH δ13C 甲醛2,4-二硝基苯腙理论值δ13C 甲醛2,4-二硝基苯腙测定值 Δ-35.937 -28.154 -29.266 -29.594 0.328 2-29.101 -0.165 3-29.444 0.178 4-29.610 0.344 5-29.590 0.324 1
根据Rieley[31]提出的同位素效应理论,化学反应中的同位素分馏与决定反应速率的那一级反应有关, 碳原子相连的化学键的断裂和生成才会导致碳同位素发生分馏。 FA 和DNPH 的反应如图3所示,FA 中的碳原子参与了化学键的断裂和生成,DNPH 中仅有氮原子参与了化学键的断裂和生成,2,4-二硝基苯基中无碳原子参与反应。 而且, 该反应中DNPH 是过量的,FA 是定量完全反应了, 因此整个反应过程中碳同位素丰度比没有发生改变, 可以认为甲醛液相衍生化反应无碳同位素分馏。
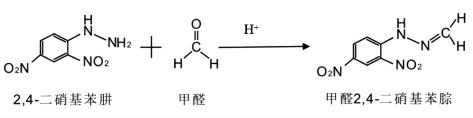
图3 衍生反应的结构式示意图
Fig.3 Structural formula schematic of the derived reaction
2.6 鱿鱼样品中FA 含量及δ13C 值测试结果分析
对市售9 个沿海城市鲜活鱿鱼中FA 含量进行测试,除去内脏的鱿鱼身体、鱿鱼全部、内脏3部分的含量分布如图4 所示。试验结果表明,鱿鱼中普遍存在一定量的FA, 其含量0.341~39.132 mg/kg。 总体来看,鱿鱼内脏中FA 的含量最高,如样品3 中内脏的FA 含量高达39.132 mg/kg,除去内脏后的身体中FA 含量为4.382 mg/kg, 说明内源性的甲醛可能主要是在鱿鱼內脏产生。 样品1例外,其内脏中FA 含量低于全部样品中FA 的含量, 可能该样品中添加了一定量的外源性FA,使得其分布异常。
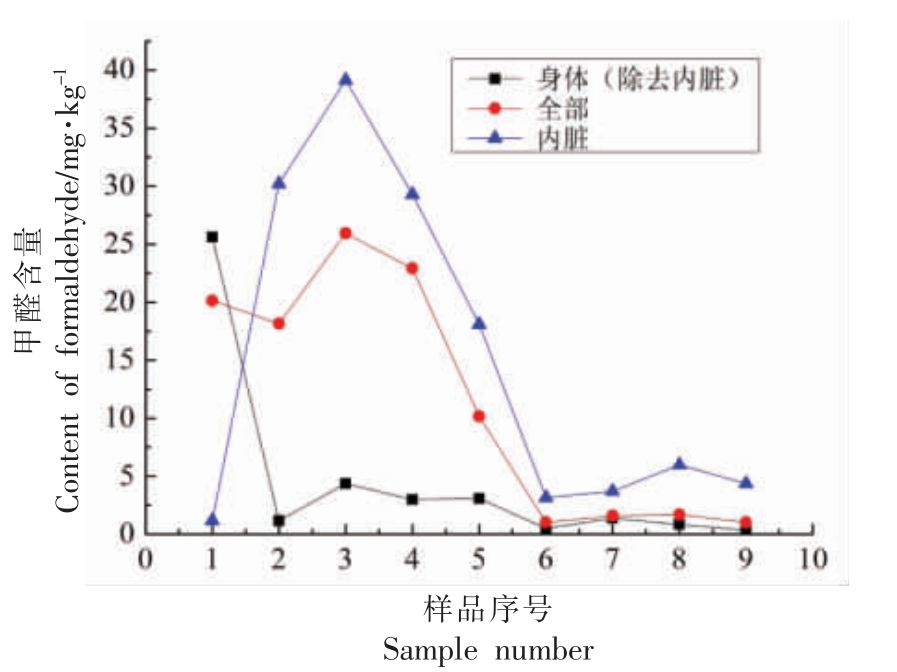
图4 鱿鱼中甲醛含量示意图
Fig.4 Diagram of formaldehyde content in squid
对FA 含量较高的2、3、4、5 4 个鱿鱼样品进一步测定衍生产物的δ13C 值, 经过质量平衡方程(1)计算得到的鱿鱼中甲醛的δ13C 值如表5 所示,不同产地鱿鱼中甲醛的δ13C 值差异最大可达23.653‰, 同位素指纹特征的差异可能是由于地域差异导致鱿鱼有机体中碳元素分布差异造成,也可能是不同样品中内外源甲醛贡献率的差异所致。
表5 鱿鱼中FA 的δ13C 值结果表(‰)
Table 5 δ13C value of FA in squid (‰)

序号 2 3 4 5甲醛2,4-二硝基苯腙δ13C 值 -31.031 -27.634 -30.927 -29.026甲醛δ13C 值 -48.167 -24.514 -47.565 -34.258
3 结论
本研究利用DNPH 与FA 在酸性条件下发生液相衍生化反应, 将易挥发的小分子FA 转化成难挥发的甲醛2,4-二硝基苯腙,在气相色谱柱上具有更好的保留与灵敏度。 通过测定衍生剂DNPH 和衍生产物甲醛2,4-二硝基苯腙的δ13C值,液相衍生化反应不产生碳同位素分馏,因此由质量平衡方程可以间接计算得到FA 的δ13C 值。该方法可用于鱿鱼中FA 的δ13C 值测定, 鱿鱼的产地以及人为添加使用FA 均会对鱿鱼中FA 的δ13C 值产生影响。 本研究为鱿鱼中甲醛的来源判别提供了新思路, 为保障水产品的质量安全提供了技术支撑。
[1] 陈金玉, 刘华, 朱晓琳, 等. 广州市市售水产品氯霉素、孔雀石绿、呋喃唑酮和甲醛残留量分析[J]. 食品安全质量检测学报, 2019, 10(17): 5609-5614.
CHEN J Y, LIU H, ZHU X L, et al. Analysis of chloramphenicol, malachite green, furazolidone and formaldehyde residues in aquatic products sold in Guangzhou in 2018-2019[J]. Journal of Food Safety and Quality, 2019, 10(17): 5609-5614.
[2] 郑智溢, 黄娇, 李珏, 等. 乐清市主要鲜活水产品甲醛残留量调查及膳食暴露风险评估[J]. 渔业研究,2018, 40(3): 217-222.
ZHENG Z Y, HUANG J, LI J, et al. Investigation on formaldehyde residues of major fresh aquatic products consumed in Yueqing City and health assessment on dietary exposure[J]. Fishery Study,2018, 40(3): 217-222.
[3] 钟崇泳. 广东省水产品流通领域中违禁药物的检测和研究[D]. 广州: 华南理工大学, 2015.
ZHONG C Y. Detection and study of prohibited drugs in aquatic products circulation in Guangdong Province[D]. GuangZhou: South China University of Technology, 2015.
[4] 李颖畅, 朱军莉, 励建荣. 水产品中内源性甲醛的产生和控制研究进展[J]. 食品工业科技, 2012, 8(33): 406-408.
LI Y C, ZHU J L, LI J R. Research progress on producing and control of endogenous formaldehyde in aquatic products[J]. Science and Technology of Food Industry, 2012, 8(33): 406-408.
[5] 张璇, 杨光昕, 韩峰, 等. 鱿鱼和龙头鱼中甲醛本底含量及变化规律研究[J]. 食品安全质量检测学报,2018, 9(2): 864-867.
ZHANG X, YANG G X, HAN F, et al. Studies on intrinsic content and change trend of formaldehyde in squid and bummalo[J]. Journal of Food Safety and Quality, 2018, 9(2): 864-867.
[6] TESHIMA N, FERNÁNDEZ S K M, UEDA M, et al. Flow injection spectrophotometric determination of formaldehyde based on its condensation with hydroxylamine and subsequent redox reaction with iron (I II)-ferrozine complex[J]. Talanta, 2011, 84(5):1205-1208.
[7] AFKHAMI A, BAGHERI H. Preconcentration of trace amounts of formaldehyde from water, biological and food samples using an efficient nanosized solid phase, and its determination by a novel kinetic method[J]. Microchimica Acta, 2012, 176 (1/2):217-227.
[8] SÁENZ M, ALVARADO J, PENAPEREIRA F, et al. Liquid -phase microextraction with in -drop derivatization combined with microvolume fluorospectrometry for free and hydrolyzed formaldehyde determination in textile samples[J]. Analytica Chimic Acta, 2011, 687(1): 50-55.
[9] 汤施展, 黄丽, 陈中祥, 等. 柱前衍生化-气相色谱法测定水产品中的游离甲醛[J]. 中国渔业质量与标准, 2016, 6(2): 51-58.
TANG S Z, HUANG L, CHEN Z X, et al. Quantification of free - formaldehyde in aquatic products by gas chromatography coupled with pro -column derivatization[J]. Chinese Fishery Quality and Standards, 2016, 6(2): 51-58.
[10] 周霞, 李双, 焦丽娟. 顶空气相色谱法测定水发食品中甲醛[J]. 营养与食品卫生, 2018, 45(10):1773-1776.
ZHOU X, LI S, JIAO L J. Determination of formaldehyde in soaked food by headspace -gas chromatography[J]. Modern Preventive Medicine, 2018,45(10): 1773-1776.
[11] 徐继松, 翟少伟, 许璐, 等. 衍生化反相高效液相色谱法检测水产品中的甲醛残留量[J]. 食品工业,2019, 40(10): 299-303.
XU J S, ZHAI S W, XU L, et al. Determination of formaldehyde residues in aquatic products with derivatization reversed-phase high performance liquid chromatography[J]. Food Service, 2019, 40(10): 299-303.
[12] 唐穗平. 柱前衍生高效液相色谱法检测水产品中甲醛的含量[J]. 食品安全质量检测学报, 2016, 7(7):2931-2936.
TANG S P. Determination of formaldehyde in aquatic products by high performance liquid chromatography with precolumn derivatization[J]. Journal of Food Safety and Quality, 2016, 7(7): 2931-2936.
[13] YU H X, LIU Y, XU M P, et al. Feasibility of micro-extraction and subsequent HPLC analysis for evaluating the extractable formaldehyde content of medium-density fiberboard[J]. European Journal of Wood and Wood Products, 2015, 73(6): 801-806.
[14] XU X, SU R, ZHAO X, et al. Determination of formaldehyde in beverages using microwave-assisted derivatization and ionic liquid-based dispersive liquid-liquid microextraction followed by high-performance liquid chromatography[J]. Talanta, 2011, 85(5): 2632-2638.
[15] WANG T, GAO X L, TONG J, et al. Determination of formaldehyde in beer based on cloud point extraction using 2,4 -dinitrophenylhydrazine as derivative reagent[J]. Food Chemistry, 2012, 131(4): 1577-1582.
[16] WADOOD S A, BOLI G, YIMIN W. Geographical traceability of wheat and its products using multielement light stable isotopes coupled with chemometrics[J]. Journal of Mass Spectrometry, 2019, 54(2):178-188.
[17] VICTOR V, ROSS S, KARINE P, et al. Strontium isotope characterization of wines from the Quebec(Canada) terroir[J]. Procedia Earth and Planetary Science, 2015, 13: 252-255.
[18] BERRIEL V, PERDOMO C H. Differentiating pasture honey from eucalyptus honey based on carbon isotopic data in Uruguay[J]. Heliyon, 2019, 5(3):e01228.
[19] ZHAO S, ZHAO Y, ROGERS K M, et al. Two new defatted beef reference materials, CAAS-1801 and CAAS-1802, for carbon and nitrogen stable isotope ratio measurements[J]. Rapid Communications in Mass Spectrometry, 2019, 33(8): 803-810.
[20] LIU Z, ZHANG Y, ZHANG Y, et al. Influence of leaf age, species and soil depth on the authenticity and geographical origin assignment of green tea[J].Rapid Communications in Mass Spectrometry, 2019,33(7): 625-634.
[21] LIU H L, ZENG Y T, YAN J N, et al. C N H O and mineral element stable isotope ratio analysis for authentication in tea[J]. Journal of Food Composition and Analysis, 2020, 91: 103513.
[22] 余应新, 文晟, 冯艳丽, 等. 大气甲醛稳定碳同位素分析方法研究[J]. 环境科学, 2006, 27(8):1495-1500.
YU Y X, WEN S, FENG Y L, et al. Stable carbon isotope analysis method for the atmospheric formaldehyde[J]. Environmental Science, 2006, 27(8): 1495-1500.
[23] 余应新, 文晟, 冯艳丽, 等. 亚硫酸氢钠和半胱胺衍生法测定大气甲醛中碳同位素的研究[J]. 分析化学, 2006, 34(6): 773-777.
YU Y X, WEN S, FENG Y L, et al. The feasibility study of carbon isotope analytical method for the atmospheric formaldehyde by sodium bisulfite[J].Chinese Journal of Analytical Chemistry, 2006, 34(6): 773-777.
[24] 郭送军, 文晟, 谭吉华, 等. 广州市大气典型羰基化合物碳同位素组成初探[J]. 环境化学, 2009, 28(2): 272-275.
GUO S J, WEN S, TAN J H, et al. The preliminary study of carbon isotopic compositions of atmospheric typical carbonyl compounds in Guangzhou[J].Environmental Chemistry, 2009, 28(2): 272-275.
[25] GUO S J, CHEN M. 13C isotope evidence for photochemical production of atmospheric formaldehyde,acetaldehyde, and acetone pollutants in Guangzhou[J]. Original Paper, 2013, 11(1): 77-82.
[26] 朱军莉, 励建荣. 秘鲁鱿鱼TMAOase 性质及其与甲醛生成相关性研究[J]. 中国食品学报, 2010, 2(10): 97-103.
ZHU J L, LI J R. Properties of trimethylamine-Noxide demethylase and relation between the enzyme and formation of formaldehyde in the squid from Peru[J]. Journal of Chinese Institute of Food Science and Technology, 2010, 2(10): 97-103.
[27] DONG L L, ZHU J L, LI X P, et al. Effect of tea polyphenols on the physical and chemical characteristics of dried-seasoned squid (Dosidicus gigas)during storage[J]. Food Control, 2013, 31(2): 286-592.
[28] 朱军利, 苗林林, 李学鹏, 等. TG-DSC 分析氯化钙抑制鱿鱼氧化三甲胺的热分解作用[J]. 中国食品学报, 2012, 12(12): 148-154.
ZHU J L, MIAO L L, LI X P, et al. Inhibition action of calcium chloride to thermal degradation of TMAO in squid by TG-DSC technique[J]. Journal of Chinese Institute of Food Science and Technology,2012, 12(12): 148-154.
[29] 陈帅, 朱军莉, 潘伟春. 乳糖对鱿鱼中氧化三甲胺热分解反应动力学的影响[J]. 现代食品科技, 2017,33(3): 116-122.
CHEN S, ZHU J L, PAN W C. Effects of galactose on the reaction kinetics of thermal degradation of MAO in squid [J]. Modern Food Science and Technology, 2017, 33(3): 116-122.
[30] WEN S, YU Y X, GUO S J, et al. Improvement of 2,4-dinitrophenylhydrazine derivatization method for carbon isotope analysis of atmospheric acetone[J].Rapid Communications in Mass Spectrometry, 2006,20(8): 1322-1326.
[31] RIELEY G. Derivatization of organic compounds prior to gas chromatographic- combustion-isotope ratio mass spectrometric analysis: Identification of isotope fractionation processes[J]. The Analyst, 1994, 119(5): 915-919.