黄酮类化合物是一类具有2-苯基色原酮结构的化合物,主要包括黄酮醇、黄烷醇、黄烷酮、黄酮、异黄酮、花青素6 大类,以结合态或游离态的形式广泛存在于水果、蔬菜、茶叶及各类植物性加工食品中,是植物多酚的重要组成部分[1-2]。大量研究表明,黄酮类化合物具有抗氧化[3]、降血脂[4]、抗癌[5]、抗炎[6]和抑菌[7]等多种功效,在预防肿瘤、心脑血管疾病和神经退行性疾病等慢性疾病方面发挥有益作用[8-9]。然而,黄酮类化合物主要以糖苷形式存在,经人体摄入后,只有5%~10%被直接吸收,生物利用度极低[10],黄酮类化合物在体内如何代谢吸收,进而发挥其多种生理功能,一直是研究人员迫切想解决的问题。近年来,众多研究表明黄酮类化合物在肠道菌群的作用下分解或代谢成游离态的黄酮小分子或次级代谢产物, 通过与胃肠道细胞表面的特定受体相结合, 影响多个基因的表达和信号转导,从而发挥其生理功能[11-13]。 本文通过广泛查阅国内外文献, 综述黄酮类化合物与肠道菌群的相互作用, 以及黄酮类化合物通过调节肠道菌群预防多种高发疾病的作用机制。
1 肠道菌群及功能
人体是一个巨大的微生态系统, 人的肠道不仅是消化吸收的重要场所, 也是人类菌群的最大储藏库[14],人体肠道里生活着大约1 000 种细菌,统称为肠道菌群,总重量约为1.5 kg,其细胞总数为1014~1015 个, 大约是人体自身细胞总数的10倍, 其编码的基因总数量是人体自身携带基因总数的100 倍左右, 因此又被称为人的“第二基因组”[15-16]。
人体肠道菌群主要包括厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、疣微菌门(Verrucomicrobia)、梭杆菌门(Fusobacteria)6 大类。其中,厚壁菌门和拟杆菌门是最主要的2 个菌门, 占整个肠道菌群的80%~90%[17]。
肠道菌群与生物体互利共生、相互依存,共同维护着整个机体的动态平衡状态。一方面,生物体能为肠道菌群的生长繁殖提供能量和营养环境,另一方面,肠道菌群也能调节和保护人体健康[18]。肠道菌群是人体重要的代谢“器官”,为代谢各个环节提供底物、酶和能量[19];肠道菌群是人体重要的“免疫屏障”,肠道黏膜屏障与人体免疫系统密不可分[20];肠道菌群及其代谢产物不仅能参与调节细胞生长发育、肠道淋巴组织的形成,更与多种疾病的发生、发展密切相关[21-22],其中最典型的就是肥胖和糖尿病[23-24]。
2 黄酮类化合物与肠道菌群的相互作用
黄酮类化合物作为功能性物质, 在人体多种生理功能的发挥主要依赖于肠道微生物的代谢转化; 同时黄酮类化合物及其代谢产物又能通过改变肠道菌群构成和酶活性进一步影响人体健康[25]。
2.1 肠道菌群对黄酮类化合物的代谢转化
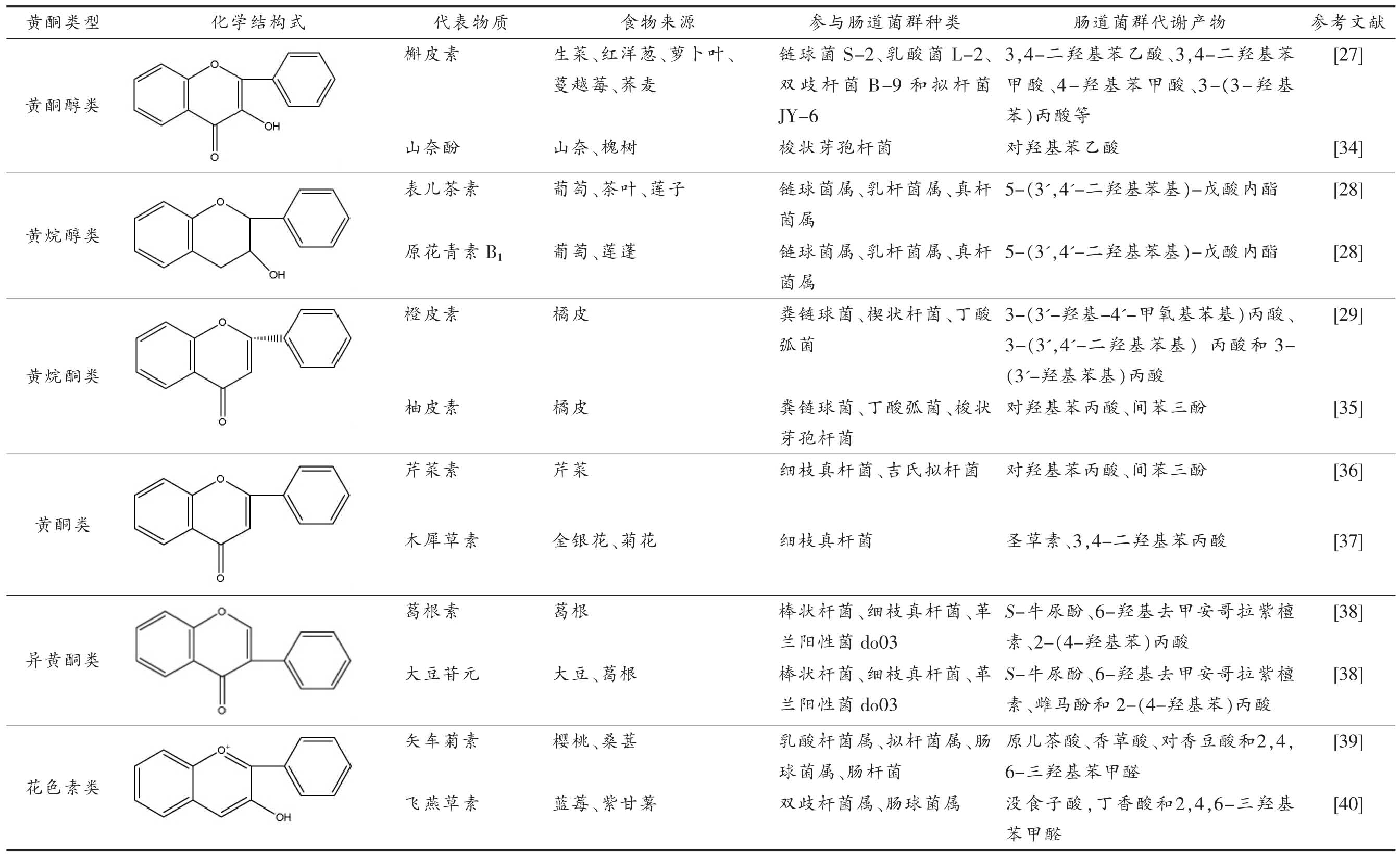
黄酮类化合物经人体摄入后, 只有极少部分能直接被十二指肠吸收进入血液, 剩余的大部分则被肠道菌群代谢及转化成酚酸等小分子[26]。 黄酮类化合物在体内的代谢, 在大多数情况下并非通过单一菌群发挥作用, 而是多种肠道微生物相互作用、 共同协作, 一起完成复杂的代谢过程。Santangelo 等[27]总结众多研究结果发现:槲皮素能在链球菌S-2、乳酸菌L-2、双歧杆菌B-9 和拟杆菌JY-6 等肠道菌群的作用下, 转化成3,4-二羟基苯乙酸、3,4-二羟基苯甲酸、4-羟基苯甲酸、3-(3-羟基苯)丙酸等小分子,从而被机体所吸收利用。Wiese 等[28]通过气质联用和液质联用对人体的血浆, 尿液和粪便检测发现,5-(3',4'-二羟基苯基)-戊酸内酯是表儿茶素和原花青素B1 摄入人体后的重要代谢物,其作用菌群包括链球菌属、乳杆菌属、真杆菌属等。 Pereira-Caro 等[29]将橙汁多酚与人粪便微生物在体外厌氧条件下培养并检测其代谢产物发现,橙皮素被粪链球菌、楔状杆菌、丁酸弧菌等分解成3-(3'-羟基-4'-甲氧基苯基)丙酸、3-(3',4'-二羟基苯基) 丙酸和3-(3'-羟基苯基)丙酸。表1 总结了参与6 大黄酮类化合物代谢的主要肠道菌群及代谢产物。
表1 参与黄酮类化合物代谢的肠道菌群种类及产物
Table 1 Species and products of gut microbiota involved in the metabolism of flavonoids
?
肠道菌群能产生多种酶系,如糖苷酶(α-鼠李糖苷酶、β-葡萄糖苷酶、β-半乳糖苷酶)、 还原酶(硝基还原酶、偶氮还原酶)、醛酸酶和羟基酶等,黄酮类化合物在这些酶的作用下发生一系列反应,其中最主要的方式为水解、还原和裂解反应。如橙皮苷,柚皮苷能被α-鼠李糖苷酶和β-葡萄糖苷酶水解为苷元。葛根素、大豆苷和黄芩苷分别被C-糖苷酶、β-糖苷酶和β-葡萄糖醛酸苷酶水解成苷元[30]。
通常情况下, 结合态的黄酮大分子在肠道菌群的作用下会首先被糖苷酶水解生成苷元, 然后经过C 环还原加氢、开环裂解等过程生成酚酮类,进一步酶解生成酚酸及乙苯衍生物[31]。 如芦丁在肠道中经α-鼠李糖苷酶和β-葡萄糖苷酶水解后去芸香糖生成槲皮素, 然后还原加氢生成二氢槲皮素, 再在异构酶的作用下形成3,4-二羟苯基-戊内酯,最后氧化开裂形成3,4-二羟基苯乙酸和间苯三酚[32]。 大豆苷在β-葡萄糖苷酶水解下生成大豆苷元,接着被大豆苷元还原酶还原成R(-)-二氢大豆苷元,然后在消旋酶作用下转变成S(-)-二氢大豆苷元,进一步在二氢大豆苷元还原酶的作用下生成S(-)-四氢大豆苷元,最后发生去酮基反应转化为S(-)-雌马酚[33]。 除此之外,儿茶素在肠道代谢过程中会发生脱羟基反应, 异黄酮还原产物会发生去酮基反应,乙酰化、甲基化和糖基化反应也常常出现在黄酮类化合物的代谢反应中。
总之, 肠道菌群能促进更多有活性的黄酮代谢产物在人体中释放, 增强黄酮成分及其代谢产物的生物活性,并降低有害物质的毒性及产生,肠道菌群对提高黄酮类化合物在体内的代谢吸收、生物利用度和功效等具有重要作用。
2.2 黄酮类化合物对肠道菌群结构及酶系统的影响
2.2.1 黄酮类化合物对肠道菌群结构的影响 黄酮类化合物调节肠道菌群结构的机制主要包括2个方面: 一方面黄酮类化合物通过破坏有害菌细胞膜的脂质双分子层或影响其细胞膜的通透性等方式抑制肠道中大肠杆菌、 金黄色葡萄球菌等有害菌群的生长[41-42],降低致病菌对机体的生物毒性; 另一方面黄酮类化合物为肠道菌群提供代谢底物, 促进双歧杆菌、 乳酸杆菌等有益菌群的生长, 从而优化肠道菌群结构, 维持肠道菌群的稳定,对健康产生积极意义[43]。 Zhao 等[44]为了评价槲皮素和白藜芦醇对肠道菌群的调节作用, 采用16S rRNA 基因测序对Wistar 大鼠检测发现:经槲皮素和白藜芦醇联合干预10 周后,厚壁菌门及厚壁菌门与拟杆菌门的比例均呈显著下降, 同时与饮食引起肥胖相关的脱硫弧菌、氨基酸球菌、红蝽菌、嗜胆菌、毛螺旋菌的相对丰度也显著降低,证明槲皮素和白藜芦醇联合使用能改善高脂饮食诱导的肥胖并有效恢复肠道菌群失调。 Tzounis 等[45]采用随机、双盲、交叉、对照干预对22 名健康志愿者研究发现,在摄入高浓度可可黄烷醇(494 mg/d)4 个周后,其体内的双歧杆菌(P <0.01)和乳酸杆菌(P <0.001)数量相对于低剂量组(23 mg/d)显著增加,而梭状芽孢杆菌数量显著减少(P <0.001),同时高剂量组血浆中甘油三酯和C 反应蛋白浓度显著降低, 提示可可黄烷醇对于调节甘油三酯和高脂血脂有重要作用。 Firrman 等[46]研究柚皮素对共生肠道微生物生长和基因表达发现: 柚皮素对链状双歧杆菌的生长有轻度增强作用, 而对粪肠球菌有严重的抑制作用,同时通过单分子RNA 测序分析, 在柚皮素的作用下链状双歧杆菌上调了参与细胞代谢、DNA 修复和分子运输的基因,下调了参与胸苷生物合成和代谢的基因; 葡萄球菌上调了参与转录和蛋白转运的通路, 下调了负责糖转运和嘌呤合成的基因。 Chen 等[47]以雄性Wistar 大鼠为研究对象, 通过试验发现补充矢车菊素能显著增加大鼠肠道中NK4A136 毛螺旋菌和放线菌的相对丰度, 从而保护3-氯-1,2-丙二醇引起的肠道黏膜损伤,抑制大鼠肠道菌群失调。表2 归纳了主要黄酮类化合物对肠道菌群结构的影响。
表2 黄酮类化合物对肠道菌群结构的影响
Table 2 Effects of flavonoids on composition of gut microbiota
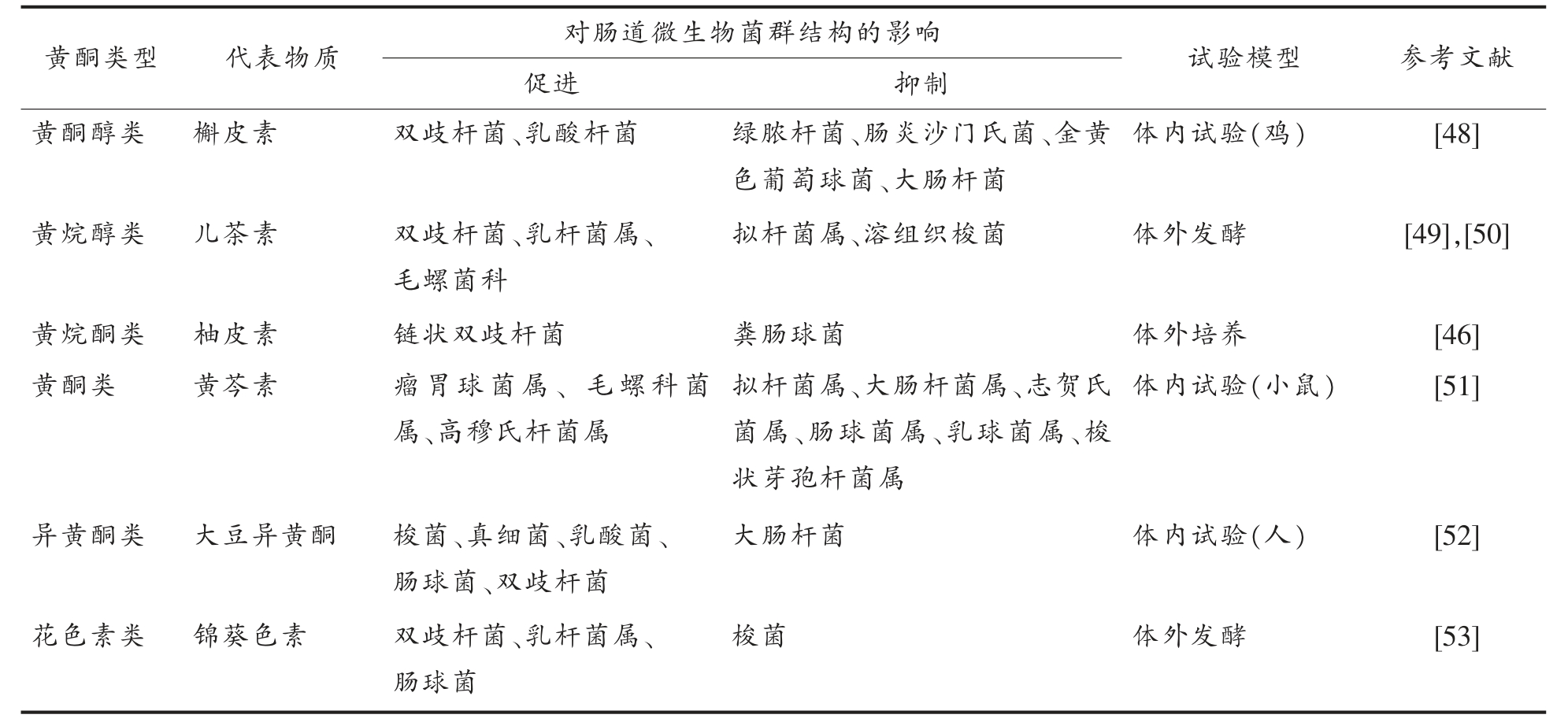
黄酮类型 代表物质 对肠道微生物菌群结构的影响 试验模型 参考文献促进 抑制黄酮醇类 槲皮素 双歧杆菌、乳酸杆菌 绿脓杆菌、肠炎沙门氏菌、金黄色葡萄球菌、大肠杆菌体内试验(鸡) [48]黄烷醇类 儿茶素 双歧杆菌、乳杆菌属、毛螺菌科拟杆菌属、溶组织梭菌 体外发酵 [49],[50]黄烷酮类 柚皮素 链状双歧杆菌 粪肠球菌 体外培养 [46]黄酮类 黄芩素 瘤胃球菌属、 毛螺科菌属、高穆氏杆菌属拟杆菌属、大肠杆菌属、志贺氏菌属、肠球菌属、乳球菌属、梭状芽孢杆菌属体内试验(小鼠) [51]异黄酮类 大豆异黄酮 梭菌、真细菌、乳酸菌、肠球菌、双歧杆菌大肠杆菌 体内试验(人) [52]花色素类 锦葵色素 双歧杆菌、乳杆菌属、肠球菌梭菌 体外发酵 [53]
2.2.2 黄酮类化合物对肠道菌群酶系统的影响肠道菌群可产生与宿主能量代谢、 物质代谢及遗传信息转运等生理过程密切相关且种类繁多的酶, 而黄酮类化合物对肠道菌群产生的酶具有调节作用,主要通过以下3 条途径:1)黄酮类化合物能直接作用于某些肠道代谢酶抑制其活性;2)黄酮类化合物通过改变肠道菌群的构成(种类和丰度), 进而使其代谢酶的种类和数量发生相应变化;3) 黄酮类化合物还能与肠道中的金属离子螯合作用生成复合物[54],抑制某些肠道菌群的生长从而影响其酶活性, 或使得某些以金属离子作为辅酶的微生物酶系由于缺乏辅基而无法合成,最终影响肠道内的一系列酶化反应[55]。Li 等[56]探究了山桑子花青素提取物在老年大鼠中通过调节肠道菌群对肠道屏障功能和消化酶活性的影响, 试验发现与对照组相比, 摄入中剂量花色素 【20 mg/(kg·d)】后对米曲霉菌、乳酸菌、拟杆菌、梭杆菌-1、拟杆菌-s24-7 和毛螺菌-NK4A136 等肠道有益菌的生长有促进作用, 而疣微菌和广古菌等有害菌的生长则被抑制;同时肠道中与消化相关的α-葡萄糖苷酶,β-葡萄糖苷酶,α-半乳糖苷酶,β-半乳糖苷酶和β-葡萄糖醛酸酶的活性均显著降低。Kravchenko 等[57]研究了槲皮素对高果糖饮食的大鼠体内细菌糖苷酶活性的影响, 结果表明加入20%的果糖溶液喂养(模型组)20 周后,其肠道内β-半乳糖苷酶,β-葡萄糖苷酶和β-葡萄糖醛酸酶的活性分别降低了35%,46%和31%,而加入槲皮素(34 mg/kg bw)共同喂养后3 种酶的活性相比模型组,分别提高了60%,100%和47%,说明槲皮素能恢复高糖饮食对大鼠盲肠菌群糖基水解酶活性的抑制作用, 其原因很可能是槲皮素能增加酶活性载体的种类。
3 黄酮类化合物通过肠道菌群干预多种疾病的机制
随着生活水平的日益提高, 肠道菌群与健康的关系越来越受到人们的关注。 在过去的十多年里,有关肠道菌群与疾病的研究急剧增多,重磅发现层出不穷。 肠道菌群不仅参与宿主的物质代谢和能量代谢, 更重要的是肠道微环境的紊乱会导致肥胖、二型糖尿病、肠道疾病及心血管疾病等的发生[58-60],甚至肠道菌群的失衡还与阿尔兹海默症、抑郁症等神经系统疾病相关[61]。 随着研究的不断深入, 大量试验证明黄酮类化合物能通过调节肠道菌群发挥其抗氧化、降血脂、调血糖、抑炎症等生理功效,从而预防多种疾病。
3.1 肥胖
肥胖作为一个全球性的公共健康问题, 在世界各国快速蔓延,中国肥胖人数已超过3 亿,高居全球榜首。近年来,越来越多的研究表明肠道菌群与肥胖的发生发展有着密切的关联。 继Gordon 教授团队在2004年首次证实了肠道菌群作为一个“内化的环境因子”能通过调控小鼠的基因表达来调节脂肪的合成与消耗后[62-63],Cani 等[64]于2007年发现肠道病原菌产生的内毒素进入血液后会引起低度慢性炎症, 进而导致小鼠肥胖和胰岛素抵抗。 2017年,Fluitman 等[65]证明肠道菌群还能间接通过信号分子(如短链脂肪酸和胆汁酸)影响能量的摄入、储存和消耗。这些研究提示肠道菌群通过直接调控宿主代谢基因及相关信号分子、 诱发慢性炎症,进而促进脂肪合成和抑制脂肪消耗,并对胰岛素受体和血管造成损伤, 最终导致肥胖及相关代谢疾病的发生和发展。
近年来, 通过黄酮类化合物调节肠道菌群治疗肥胖的研究不断增多。 Masumoto 等[66]发现添加0.5%苹果原花青素喂养20 周后不仅减轻了高脂肪/高蔗糖喂养C57BL/6J 肥胖小鼠的体重和慢性炎症(脂多糖的合成和肠道通透性),而且还降低了与胰岛素抵抗相关内源性代谢物的水平。 进一步利用16S rRNA 基因测序显示, 苹果原花青素显著降低了厚壁菌门/拟杆菌门的比例,并使阿克曼氏菌的比例增加了8 倍。 说明苹果原花青素能通过调节肠道菌群和肠道代谢组对超重和代谢综合征产生有益的影响。 Cheng 等[67]和Zhang 等[68]在研究(-)-表没食子儿茶素3-O-(3-O-甲基)没食子酸酯(EGCG3"Me)作用于高脂膳食诱导的肥胖小鼠模型发现:EGCG3"Me 能促进短链脂肪酸的生成, 诱导双歧杆菌和乳杆菌/肠球菌组的增殖,并抑制普雷沃氏菌属、 溶组织梭状芽孢杆菌和梭状真杆菌的生长,同时EGCG3"Me 能有效减轻小鼠体重,改善肠道生态紊乱,显著降低厚壁菌门和拟杆菌门的比例,说明EGCG3"Me 能通过调节肠道菌群,促进肠道生态平衡并改善宿主肥胖。
3.2 二型糖尿病
二型糖尿病 (Type 2 diabetes mellitus,T2DM)是由于胰岛β 细胞被破坏,胰岛素分泌减少或胰岛素抵抗引起的糖脂代谢疾病。 T2DM 同样与肠道菌群关系紧密, 人体肠道微生物组成和多样性变化,如拟杆菌门与厚壁菌门比值降低、产丁酸盐菌减少等,与T2DM 的严重程度密切相关[69]。Larsen 等[70]采用实时定量PCR 和16S rRNA 基因测序对比正常组和T2DM 组(年龄和身体质量指数不同的成年男性各18 名)肠道菌群发现:T2DM组的厚壁菌门细菌数量明显减少, 拟杆菌门细菌数量显著增多, 拟杆菌门与厚壁菌门比值与血糖浓度呈显著正相关, 同时β-变形菌类高度富集,且与血糖呈显著正相关。 此外肠道菌群失调会产生内毒素,引起持续性炎症反应,造成胰岛β 细胞功能和糖代谢紊乱。 研究发现黄酮类能通过调节肠道菌群的组成和抑制炎症从而改善T2DM。Anhê 等[71]研究了蔓越莓提取物(CE,主要成分为黄酮醇和原花青素)对高脂/高糖诱导的糖尿病小鼠的影响。 通过口服糖耐量试验发现,CE 能改善小鼠的高胰岛素血症,并提升胰岛素耐受量,降低胰岛素抵抗, 同时CE 还降低了肠道中甘油三酯含量, 减轻了肠道炎症和氧化应激。 此外, 通过16S rRNA 测序发现CE 处理显著增加了阿克曼氏菌在元基因组样本中的比例, 说明CE 改善高脂/高糖饮食引起的二型糖尿病与阿克曼氏菌在肠道菌群中的比例显著增加有关。
3.3 肠易激综合症
肠易激综合症 (Irritable bowel syndrome,IBS)是一种肠道功能紊乱型疾病,患病率约为5%~10%,除了表现为腹部疼痛,大便性状或次数的改变,还常见有焦虑和抑郁等心理症状。 IBS 可源于肠脑沟通紊乱,导致胃肠运动障碍、内脏高敏和大脑变化、菌群失调、黏膜和免疫功能紊乱等也是潜在因素[72],然而其确切的发病机制尚不清楚,且缺乏明确的生物学标记[73]。 Malinen 等[74]通过实时荧光定量PCR 检测发现:IBS 患者相比对照组表现为肠道中乳酸菌数明显下降, 而便秘型IBS 患者表现为韦永氏球菌数大量增加。Verdú 等[75]发现相比健康小鼠,IBS 小鼠肠道中出现低水平炎症,且乳酸菌和拟杆菌显著减少,而肠杆菌大量增多。Igwe 等[76]总结了前人的试验结果指出花青素能通过促进肠道中双歧杆菌的增长并抑制溶组织梭状芽孢杆菌,从而预防肠易激综合征。
3.4 心血管疾病
心血管疾病(Cardiovascular disease, CVD)是由心脏及血管病变引起的一系列疾病, 包括高血压、冠心病、心律失常和心肌病等。 临床试验和流行病学研究表明, 肠道菌群组成的变化与心血管系统的病理有关(如血栓形成)[77],不仅如此肠道菌群代谢产物的变化也被认为是CVD 发展的主要促成因素。 肠道菌群还通过toll 样受体2(TLR2) 调控肝脏合成和血浆中血管性血友病因子(VWF)水平,并导致小鼠血栓生长缺陷[78]。 此外,肠道来源的内源性内毒素,如脂多糖、吲哚酰硫酸盐和对甲酚硫酸盐在动脉粥样硬化等的发生发展过程中发挥重要作用。 长期食用富含黄酮的食物可以预防CVD,Jeong 等[79]发现长期食用槲皮素改善了db/db 小鼠的高血糖和血脂异常, 并降低心血管并发症的风险。 然而,槲皮素预防CVD的机制尚不清楚。Parkar 等[80]在体外模拟人类结肠发现, 槲皮素能减少厚壁菌门/拟杆菌门的比值,同时Leone 等[81]还发现槲皮素能调节瘤胃球菌属,而瘤胃球菌产生的丁酸盐可以调节小鼠肝脏昼夜节律,进而影响CVD 的发展,说明黄酮类化合物能调节核心肠道菌群的组成, 并与生物钟相互作用,从而在抑制CVD 的发展中发挥重要作用。
3.5 阿尔茨海默症
阿尔茨海默症 (Alzheimer disease, AD),又称老年痴呆,是一种典型的神经退行性疾病,主要表现为渐进性记忆衰退、 认知和语言障碍及人格改变等症状,严重影响社交与生活。临床前和流行病学证据表明肠道菌群在宿主认知和AD 的发生和发展中发挥作用。肠道菌群能通过“微生物-脑-肠轴(脑肠轴)”影响人的认知和行为,肠道菌群中的某些细菌(如枯草杆菌和大肠杆菌)可分泌大量的淀粉样蛋白, 它很容易通过体循环在大脑中积累,参与AD 发病机制相关信号通路的调节[82-83]。此外, 肠道菌群失调会引起肠道和血脑屏障的通透性增加, 细菌产生的脂多糖和内毒素会增加炎症细胞因子水平,造成系统性炎症,同时炎症因子从肠道转移到大脑,不仅损害血脑屏障,而且通过启动免疫原性反应使神经细胞变性, 最终导致神经损伤和退化[84]。 目前有关黄酮类化合物通过肠道菌群干预AD 的报道虽然较少, 但黄酮类化合物在调节肠道菌群和抑制炎症方面的功效暗示其在预防AD 和其它神经退行性疾病中极具潜力。Wang 等[85]通过给雄性Sprague-Dawley 大鼠口服葡萄籽提取物(GSPE,主要成分为儿茶素、表儿茶素及两者的衍生物、原花青素),研究其肠道菌群代谢物在阿尔茨海默症淀粉样蛋白寡聚衰减中的作用, 试验发现:GSPE 处理后显著增加了大鼠脑内3-羟基苯甲酸和3-(3'-羟基苯基) 丙酸的含量,且两者能够有效地干扰淀粉样蛋白肽(A 羟丙基蛋白)组装成神经毒素A 聚集体,说明GSPE 在预防AD 的发生和发展中具有潜在作用。
4 结语
现代社会经济发展不断加快, 人们生活水平日益提高, 随之而来的高压力快节奏的生活方式以及高脂高糖的饮食习惯,使得肥胖、高血压,糖尿病,心血管疾病等的发病率急剧升高,严重威胁着人们的生活和健康。 黄酮类化合物作为一类安全低毒的天然活性成分, 被广泛用作功能性膳食补充剂来预防和辅助治疗疾病, 然而极低的生物利用率使其在研究和临床应用中严重受阻。 近年来,随着人们对肠道菌群的深入研究,使我们对黄酮类化合物在体内的代谢和功能发挥有了新的认识。 一方面黄酮类化合物能通过肠道菌群的代谢转化,进而被人体吸收,发挥多种生理功效;另一方面黄酮类化合物及其代谢产物又会通过影响肠道菌群的组成、 功能及酶的活性进而影响人体健康。总体来看,黄酮类化合物作用肠道菌群干预疾病的研究还处于起步阶段, 只是简单的将肠道菌群的种类、丰度及功能基因的变化与代谢标记物、病理指标等信息直接关联得出结论, 缺乏系统性的研究和证据, 因此仍然存在大量问题需要进一步探索。 相信随着高通量测序技术和生物信息学工具的快速发展,宏基因组学、蛋白质组学、代谢组学等多组学的联合应用, 将会对黄酮类化合物的代谢机制以及肠道菌群与宿主之间的相互作用有更全面深入的理解[86],也将有助于人们更好地利用植物中的黄酮类化合物预防、 缓解甚至治疗多种疾病。可以展望,通过精准营养和个性化膳食来调控或重建合理的肠道菌群, 将会成为果蔬营养与人类健康研究的新方向。
[1] SANTOS-BUELGA C, FELICIANO A S. Flavonoids:From structure to health issues[J]. Molecules, 2017,22(3): 477.
[2] ALSEEKH S, PEREZ DE SOUZA L, BENINA M,et al. The style and substance of plant flavonoid decoration; towards defining both structure and function[J]. Phytochemistry, 2020, 17: 112347.
[3] THILAKARATHNA S H, RUPASINGHE H P.Flavonoid bioavailability and attempts for bioavailability enhancement[J]. Nutrients, 2013, 5(9): 3367-3387.
[4] MULVIHILL E E, BURKE A C, HUFF M W. Citrus flavonoids as regulators of lipoprotein metabolism and atherosclerosis[J]. Annual Review of Nutrition,2016, 36: 275-299.
[5] GAN R Y, LI H B, SUI Z Q, et al. Absorption,metabolism, anti-cancer effect and molecular targets of epigallocatechin gallate (EGCG): An updated review[J]. Critical Reviews in Food Science and Nutrition, 2018, 58(6): 924-941.
[6] MALEKI S J, CRESPO J F, CABANILLAS B. Anti-inflammatory effects of flavonoids[J]. Food Chemistry, 2019, 299: 125124.
[7] FARHADI F, KHAMENEH B, IRANSHAHI M, et al. Antibacterial activity of flavonoids and their structure-activity relationship: An update review[J].Phytotherapy Research, 2019, 33(1): 13-40.
[8] SÁNCHEZ M, ROMERO M, GÓMEZ-GUZMÁN M,et al. Cardiovascular effects of flavonoids[J]. Current Medicinal Chemistry, 2019, 26(39): 6991-7034.
[9] MAHER P. The potential of flavonoids for the treatment of neurodegenerative diseases[J]. International Journal of Molecular Sciences, 2019, 20(12): 3056.
[10] GONZALES G B, SMAGGHE G, GROOTAERT C,et al. Flavonoid interactions during digestion, absorption, distribution and metabolism: A sequential structure-activity/property relationship-based approach in the study of bioavailability and bioactivity[J]. Drug Metabolism Reviews, 2015, 47(2): 175-190.
[11] 杨艳, 杨荣玲, 邹宇晓, 等. 肠道微生物菌群生物转化天然多酚类化合物研究进展[J]. 食品科学,2014, 35(17): 319-325.
YANG Y, YANG R L, ZOU Y X, et al. Recent advances in biotransformation of natural polyphenols by gut microflora[J]. Food Science, 2014, 35(17):319-325.
[12] ESSER D, GELEIJNSE J M, MATUALATUPAUW J C, et al. Pure flavonoid epicatechin and whole genome gene expression profiles in circulating immune cells in adults with elevated blood pressure:A randomised double -blind, placebo -controlled,crossover trial[J]. PLoS One, 2018, 13(4): e0194229.
[13] BARRERA-REYES PK, HERNÁNDEZ-RAMÍREZ N, CORTÉS J, et al. Gene expression changes by high-polyphenols cocoa powder intake: A randomized crossover clinical study[J]. European Journal of Nutrition, 2019, 58(5): 1887-1898.
[14] 赵立平, 张晨虹, 费娜, 等. 以肠道菌群为靶点的代谢病营养干预研究进展[J]. 中国食品学报, 2014,14(1): 1-5.
ZHAO L P, ZHANG C H, FEI N, et al. Research development in gut microbiota -targeted nutritional intervention of metabolic diseases[J]. Journal of Chinese Institute of Food Science and Technology,2014, 14(1): 1-5.
[15] BÄCKHED F, LEY R E, SONNENBURG J L, et al. Host-bacterial mutualism in the human intestine[J]. Science, 2005, 307(5717): 1915-1920.
[16] QIN J, LI R, RAES J, et al. A human gut microbial gene catalogue established by metagenomic sequencing[J]. Nature, 2010, 464(7285): 59-65.
[17] ECKBURG P B, BIK E M, BERNSTEIN C N, et al. Diversity of the human intestinal microbial flora[J]. Science, 2005, 308(5728): 1635-1638.
[18] KÅHRSTRÖM C T, PARIENTE N, WEISS U. Intestinal microbiota in health and disease [J]. Nature,2016, 535(7610): 47.
[19] MORRISON D J, PRESTON T. Formation of short chain fatty acids by the gut microbiota and their impact on human metabolism[J]. Gut Microbes, 2016,7(3): 189-200.
[20] THAISS C A, ZMORA N, LEVY M, et al. The microbiome and innate immunity[J]. Nature, 2016,535(7610): 65-74.
[21] CANI P D. Human gut microbiome: Hopes, threats and promises[J]. Gut, 2018, 67(9): 1716-1725.
[22] DE CLERCQ N C, GROEN A K, ROMIJN J A,et al. Gut microbiota in obesity and undernutrition[J].Advances in Nutrition, 2016, 7(6): 1080-1089.
[23] ABENAVOLI L, SCARPELLINI E, COLICA C, et al. Gut microbiota and obesity: A role for probiotics[J]. Nutrients, 2019, 11(11): 2690.
[24] BORDALO TONUCCI L, DOS SANTOS K M, DE LUCES FORTES FERREIRA C L, et al. Gut microbiota and probiotics: Focus on diabetes mellitus[J]. Critical Reviews in Food Science and Nutrition,2017, 57(11): 2296-2309.
[25] 杨华, 叶发银, 赵国华. 膳食多酚与肠道微生物相互作用研究进展[J]. 食品科学, 2015, 36(3): 223-227.
YANG H, YE F Y, ZHAO G H. Advances in interactions between gut microflora and dietary polyphenols[J]. Food Science, 2015, 36(3): 223-227.
[26] FENG X, LI Y, BROBBEY OPPONG M, et al.Insights into the intestinal bacterial metabolism of flavonoids and the bioactivities of their microbe-derived ring cleavage metabolites[J]. Drug Metabolism Reviews, 2018, 50(3): 343-356.
[27] SANTANGELO R, SILVESTRINI A, MANCUSO C.Ginsenosides, catechins, quercetin and gut microbiota: Current evidence of challenging interactions[J].Food and Chemical Toxicology, 2019, 123: 42-49.
[28] WIESE S, ESATBEYOGLU T, WINTERHALTER P, et al. Comparative biokinetics and metabolism of pure monomeric, dimeric, and polymeric flavan-3-ols: A randomized cross-over study in humans[J].Molecular Nutrition & Food Research, 2015, 59(4): 610-621.
[29] PEREIRA-CARO G, BORGES G, KY I, et al. In vitro colonic catabolism of orange juice (poly)phenols[J]. Molecular Nutrition & Food Research, 2015, 59(3): 465-475.
[30] KIM D H, JUNG E A, SOHNG I S, et al. Intestinal bacterial metabolism of flavonoids and its relation to some biological activities [J]. Archives of Pharmacal Research, 1998, 21(1): 17-23.
[31] 潘亚平, 张振海, 丁冬梅, 等. 黄酮类化合物肠道细菌生物转化的研究进展[J]. 中国中药杂志, 2013,38(19): 3239-3245.
PAN Y P, ZHANG Z H, DING D M, et al. Advance in studies on biotransformation of flavonoids by intestinal bacteria[J]. China Journal of Chinese Materia Medica, 2013, 38(19): 3239-3245.
[32] HEIN E M, ROSE K, VAN'T SLOT G, et al. Deconjugation and degradation of flavonol glycosides by pig cecal microbiota characterized by fluorescence in situ hybridization (FISH)[J]. Journal of Agricultural and Food Chemistry, 2008, 56(6): 2281-2290.
[33] MAYO B, VÁZQUEZ L, FLÓREZ A B. Equol: A bacterial metabolite from the daidzein isoflavone and its presumed beneficial health effects[J]. Nutrients,2019, 11(9): 2231.
[34] AA L X, FEI F, QI Q, et al. Rebalancing of the gut flora and microbial metabolism is responsible for the anti-arthritis effect of kaempferol[J]. Acta Pharmacologica Sinica, 2020, 41(1): 73-81.
[35] CHEN T, WU H, HE Y, et al. Simultaneously quantitative analysis of naringin and its major human gut microbial metabolites naringenin and 3-(4'-hydroxyphenyl) propanoic acid via stable isotope deuterium-labeling coupled with RRLC-MS/MS method[J]. Molecules, 2019, 24(23): 4287.
[36] WANG M, FIRRMAN J, LIU L, et al. A review on flavonoid apigenin: Dietary intake, ADME, antimicrobial effects, and interactions with human gut microbiota[J]. Biomed Research International, 2019,2019: 7010467.
[37] BRAUNE A, GÜTSCHOW M, ENGST W, et al.Degradation of quercetin and luteolin by Eubacterium ramulus[J]. Applied and Environmental Microbiology, 2001, 67(12): 5558-5567.
[38] BRAUNE A, BLAUT M. Deglycosylation of puerarin and other aromatic C-glucosides by a newly isolated human intestinal bacterium[J]. Environmental Microbiology, 2011, 13(2): 482-494.
[39] CHEN Y, CHEN H, ZHANG W J, et al. Correction: Bioaccessibility and biotransformation of anthocyanin monomers following in vitro simulated gastric-intestinal digestion and in vivo metabolism in rats[J]. Food & Function, 2020, 11(7): 6692.
[40] CHEN Y, LI Q, ZHAO T, et al. Biotransformation and metabolism of three mulberry anthocyanin monomers by rat gut microflora[J]. Food Chemistry,2017, 237: 887-894.
[41] XIE Y X, YANG W J, TANG F, et al. Antibacterial activities of flavonoids: Structure-activity relationship and mechanism[J]. Current Medicinal Chemistry, 2015, 22(1): 132-149.
[42] SIRK T W, FRIEDMAN M, BROWN E F. Molecular binding of black tea theaflavins to biological membranes: Relationship to bioactivities[J]. Journal of Agricultural and Food Chemistry, 2011, 59(8):3780-3787.
[43] 卢烽, 廖小军, 胡小松, 等. 多酚对肠道微生物影响的研究进展及对多酚指示菌的探讨[J]. 食品工业科技, 2018, 39(16): 330-335.
LU F, LIAO X J, HU X S, et al. Research advances in the effect of polyphenols on the gut microbes and the discuss about microbes which will appear as polyphenols[J]. Science and Technology of Food Industry, 2018, 39(16): 330-335.
[44] ZHAO L, ZHANG Q, MA W N, et al. A combination of quercetin and resveratrol reduces obesity in high-fat diet-fed rats by modulation of gut microbiota[J]. Food & Function, 2017, 8(12): 4644-4656.
[45] TZOUNIS X, RODRIGUEZ-MATEOS A, VULEVIC J, et al. Prebiotic evaluation of cocoa-derived flavanols in healthy humans by using a randomized,controlled, double -blind, crossover intervention study [J]. American Journal of Clinical Nutrition,2011, 93(1): 62-72.
[46] FIRRMAN J, LIU L, ARGOTY G A, et al. Analysis of temporal changes in growth and gene expression for commensal gut microbes in response to the polyphenol naringenin[J]. Microbiology Insights, 2018,11: 1-12.
[47] CHEN G W, WANG G, ZHU C J, et al. Effects of cyanidin -3 -O -glucoside on 3 -chloro -1,2 -propanediol induced intestinal microbiota dysbiosis in rats[J]. Food and Chemical Toxicology, 2019, 133:110767.
[48] WANG S A, YAO J Y, ZHOU B, et al. Bacteriostatic effect of quercetin as an antibiotic alternative in vivo and its antibacterial mechanism in vitro[J].Journal of Food Protection, 2018, 81(1): 68-78.
[49] TZOUNIS X, VULEVIC J, KUHNLE G G, et al.Flavanol monomer-induced changes to the human faecal microflora [J]. British Journal of Nutrition,2008, 99(4): 782-792.
[50] ZHANG X, ZHU X L, SUN Y K, et al. Fermentation in vitro of EGCG, GCG and EGCG3"Me isolated from Oolong tea by human intestinal microbiota[J]. Food Research International, 2013, 54 (2):1589-1595.
[51] 王睿, 王霖, 魏广义, 等. 黄芩素调节肠道菌群并改善小鼠化疗诱导性肠黏膜炎的作用及其机制[J].药学学报, 2020, 55(5): 868-876.
WANG R, WANG L, WEI G Y, et al. The effect and mechanism of baicalein on regulating gut microbiota and improving chemotherapy-induced intestinal mucositis in mice[J]. Acta Pharmaceutica Sinica,2020, 55(5): 868-876.
[52] CLAVEL T, FALLANI M, LEPAGE P, et al.Isoflavones and functional foods alter the dominant intestinal microbiota in postmenopausal women[J].Journal of Nutrition, 2005, 135(12): 2786-2792.
[53] HIDALGO M, ORUNA-CONCHA M J, KOLIDA S,et al. Metabolism of anthocyanins by human gut microflora and their influence on gut bacterial growth[J]. Journal of Agricultural and Food Chemistry,2012, 60(15): 3882-3890.
[54] RASMUSSEN S E, FREDERIKSEN H, STRUNTZE KROGHOLM K, et al. Dietary proanthocyanidins:Occurrence, dietary intake, bioavailability, and protection against cardiovascular disease[J]. Molecular Nutrition & Food Research, 2005, 49(2): 159-174.
[55] 肖俊松, 单静敏, 曹雁平, 等. 多酚通过肠道菌群调节能量代谢研究进展[J]. 食品科学, 2012, 33(3): 300-303.
XIAO J S, SHAN J M, CAO Y P, et al. Research progress in regulation of energy metabolism by polyphenols via intestinal flora [J]. Food Science,2012, 33(3): 300-303.
[56] LI J, WU T, LI N, et al. Bilberry anthocyanin extract promotes intestinal barrier function and inhibits digestive enzyme activity by regulating the gut microbiota in aging rats[J]. Food & Function, 2019,10(1): 333-343.
[57] KRAVCHENKO L V, AVREN'EVA L I, GUSEVA G V, et al. Effects of polyphenols on activity of glycosyl hydrolases in the cecum of rats fed obesity inducing diets[J]. Voprosy Pitaniia, 2019, 88(3):63-68.
[58] 陈卫, 田培郡, 张程程, 等. 肠道菌群与人体健康的研究热点与进展[J]. 中国食品学报, 2017, 17(2): 1-9.CHEN W, TIAN P J, ZHANG C C, et al. New progress of research on gut microbiota and human health[J]. Journal of Chinese Institute of Food Science and Technology, 2017, 17(2): 1-9.
[59] COLLINS S M. A role for the gut microbiota in IBS[J]. Nature Reviews Gastroenterology & Hepatology,2014, 11(8): 497-505.
[60] BATTSON M L, LEE D M, WEIR T L, et al. The gut microbiota as a novel regulator of cardiovascular function and disease[J]. Journal of Nutritional Biochemistry, 2018, 56: 1-15.
[61] LUCA M, DI MAURO M, DI MAURO M, et al.Gut microbiota in Alzheimer's disease, depression,and type 2 diabetes mellitus: The role of oxidative stress[J]. Oxidative Medicine and Cellular Longevity,2019, 2019: 4730539.
[62] BÄCKHED F, DING H, WANG T, et al. The gut microbiota as an environmental factor that regulates fat storage[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004,101(44): 15718-15723.
[63] BÄCKHED F, MANCHESTER J K, SEMENKOVICH C F, et al. Mechanisms underlying the resistance to diet-induced obesity in germ-free mice[J]. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(3): 979-984.
[64] CANI P D, AMAR J, IGLESIAS M A, et al.Metabolic endotoxemia initiates obesity and insulin resistance[J]. Diabetes, 2007, 56(7): 1761-1772.
[65] FLUITMAN K S, DE CLERCQ N C, KEIJSER B J F, et al. The intestinal microbiota, energy balance,and malnutrition: Emphasis on the role of shortchain fatty acids[J]. Expert Review of Endocrinology and Metabolism. 2017, 12(3): 215-226.
[66] MASUMOTO S, TERAO A, YAMAMOTO Y, et al.Non-absorbable apple procyanidins prevent obesity associated with gut microbial and metabolomic changes[J]. Scientific Reports, 2016, 6: 31208.
[67] CHENG M, ZHANG X, MIAO Y J, et al. The modulatory effect of (-)-epigallocatechin 3-O-(3-O-methyl) gallate (EGCG3″Me) on intestinal microbiota of high fat diet-induced obesity mice model[J].Food Research International, 2017, 92: 9-16.
[68] ZHANG X, CHEN Y H, ZHU J Y, et al. Metagenomics analysis of gut microbiota in a high fat dietinduced obesity mouse model fed with (-)-epigallocatechin 3-O-(3-O-methyl) gallate (EGCG3″Me)[J].Molecular Nutrition & Food Reseach, 2018, 62(13): e1800274.
[69] 袁宵潇, 罗飞宏. 肠道菌群与肥胖、糖尿病关系的研究进展[J]. 医学综述, 2020, 26(2): 346-350.
YUAN X X, LUO F H. Research progress in gut microbiota and its effects on diabetes and obesity[J].Medical Recapitulate, 2020, 26(2): 346-350.
[70] LARSEN N, VOGENSEN F K, VAN DEN BERG F W, et al. Gut microbiota in human adults with type 2 diabetes differs from non-diabetic adults[J].PLoS One, 2010, 5(2): e9085.
[71] ANHÊ F F, ROY D, PILON G, et al. A polyphenol-rich cranberry extract protects from diet-induced obesity, insulin resistance and intestinal inflammation in association with increased Akkermansia spp.population in the gut microbiota of mice[J]. Gut,2015, 64(6): 872-883.
[72] CHEY W D, KURLANDER J, ESWARAN S. Irritable bowel syndrome: A clinical review[J]. JAMA, 2015,313(9): 949-958.
[73] CANAVAN C, WEST J, CARD T. The epidemiology of irritable bowel syndrome[J]. Clinical Epidemiology, 2014, 6: 71-80.
[74] MALINEN E, RINTTILÄ T, KAJANDER K, et al.Analysis of the fecal microbiota of irritable bowel syndrome patients and healthy controls with realtime PCR[J]. American Journal of Gastroenterology,2005, 100(2): 373-382.
[75] VERDU E F, BERCIK P, VERMA-GANDHU M,et al. Specific probiotic therapy attenuates antibiotic induced visceral hypersensitivity in mice[J]. Gut,2006, 55(2): 182-190.
[76] IGWE E O, CHARLTON K E, PROBST Y C, et al. A systematic literature review of the effect of anthocyanins on gut microbiota populations[J]. Journal of Human Nutrition and Dietetics, 2019, 32(1):53-62.
[77] KIOUPTSI K, REINHARDT C. Contribution of the commensal microbiota to atherosclerosis and arterial thrombosis[J]. British Journal of Pharmacology, 2018,175(24): 4439-4449.
[78] JÄCKEL S, KIOUPTSI K, LILLICH M, et al. Gut microbiota regulate hepatic von Willebrand factor synthesis and arterial thrombus formation via tolllike receptor-2[J]. Blood, 2017, 130(4): 542-553.
[79] JEONG S M, KANG M J, CHOI H N, et al.Quercetin ameliorates hyperglycemia and dyslipidemia and improves antioxidant status in type 2 diabetic db/db mice [J]. Nutrition Research and Practice,2012, 6(3): 201-207.
[80] PARKAR S G, TROWER T M, STEVENSON D E.Fecal microbial metabolism of polyphenols and its effects on human gut microbiota[J]. Anaerobe, 2013,23: 12-19.
[81] LEONE V, GIBBONS S M, MARTINEZ K, et al.Effects of diurnal variation of gut microbes and high-fat feeding on host circadian clock function and metabolism[J]. Cell Host & Microbe, 2015, 17(5): 681-689.
[82] JIANG C M, LI G N, HUANG P R, et al. The gut microbiota and Alzheimer's disease[J]. Journal of Alzheimers's Disease, 2017, 58(1): 1-15.
[83] DEANE R, DU YAN S, SUBMAMARYAN R K, et al. RAGE mediates amyloid-beta peptide transport across the blood-brain barrier and accumulation in brain[J]. Nature Medicine, 2003, 9(7): 907-913.
[84] QUIGLEY E M M. Microbiota-brain-gut axis and neurodegenerative diseases[J]. Current Neurology and Neuroscience Reports, 2017, 17(12): 94.
[85] WANG D J, HO L, FAITH J, et al. Role of intestinal microbiota in the generation of polyphenolderived phenolic acid mediated attenuation of Alzheimer's disease β -amyloid oligomerization [J].Molecular Nutrition & Food Reseach, 2015, 59(6):1025-1040.
[86] 郑艺, 张家超, 郭壮, 等. 基于高通量测序技术分析肠道菌群及其影响因素的研究进展[J]. 中国食品学报, 2014, 14(11): 157-164.
ZHENG Y, ZHANG J C, GUO Z, et al. Research progress on high-throughput sequencing to analysis the diversity of gut microbiota and its influence factors[J]. Journal of Chinese Institute of Food Science and Technology, 2014, 14(11): 157-164.