细菌生长和繁殖的过程中会向外界分泌特定的信号分子——自诱导物(Autoinducer, AI)[1]。 随着细菌菌体数量的增大,信号分子逐渐增多,当其浓度达到最小临界阈值时, 便可被相应的胞外受体所感知,进而启动相关基因的表达,激活相应的代谢通路,调节菌群的生理化特性,这种现象被称为群体感应(Quorum sensing, QS)[2]。 细菌的多种功能特性均受QS 调控, 包括生物被膜的形成、菌体的运动、毒素的分泌、抗生素以及细菌素的产生等[3]。
目前,在医疗卫生、食品加工等领域防治有害菌污染的主要方式是使用消毒剂及抗生素,然而,长期过量使用这些制剂极易导致耐药菌株的产生, 探寻新型有害菌防治策略显得尤为重要。 QS系统可通过受体蛋白与信号分子结合而调节菌体的功能特性。鉴于此,干扰信号分子与受体蛋白之间的互作可作为有害菌防治的新靶点。 对细菌QS系统开展研究,既有助于抑制有害菌的生长,也有助于缓解耐药菌株的产生给人们带来的防治压力。
群体感应抑制剂(Quorum-sensing inhibitors,QSIs) 是一类能够干扰细菌种间或种内信息传递与交流的物质,它不杀死有害菌,而是抑制QS 所调控的功能特性[4]。 由于信号分子在细菌QS 系统中作为重要信使存在, 因此QSIs 通过干扰QS 信号分子合成、 降解信号分子以及与信号分子竞争结合受体蛋白3 个途径阻断细菌QS 系统[5]。 QSIs的探究与挖掘己成为微生物领域研究的热点,这将为开发新型抗菌剂开辟了新思路。
1 群体感应系统
QS 系统一般由信号分子、特异性受体蛋白和下游调控蛋白3 部分组成,分为种内和种间QS 系统[6]。基于信号分子种类的不同,可将QS 系统分为4 大类:存在于革兰氏阴性菌种内,由N-酰基高丝氨酸内酯类 (N-Acyl homoserine lactone,AHL) 及其衍生物类信号分子介导的QS 系统;存在于革兰氏阳性菌种内, 由寡肽类信号分子(Autoinducing peptides, AIP)介导的双组分QS 系统;革兰氏阴性菌和革兰氏阳性菌中同时存在的,由自诱导物-2(Autoinducer-2, AI-2)信号分子介导的LuxS/AI-2 QS 系统; 普遍存在于大肠杆菌属、沙门氏菌属和克雷伯菌属中由自诱导物-3(Autoinducer-3, AI-3)信号分子介导的AI-3/肾上腺素/去甲肾上腺素QS 系统[7-9]。
1.1 AHLs 介导的革兰氏阴性菌QS 系统
AHLs 的典型特征是由一个高丝氨酸内酯环和一个酰胺链组成, 酰胺链上的碳原子数为4~18,个别AHLs 在C-3 位有取代基(氢、羟基、羰基),自然界发现的最小的AHLs 为丁基高丝氨酸内酯(Butyl-Homoserine lactone, C4-HSL),最长为C18-HSL, 其特异性由酰胺链的长度及酰胺链C-3 位上取代基团的性质决定[10]。 侧链短、分子质量小的AHLs 可以自由扩散方式进出细胞膜内、外,然而当侧链碳基超过8 个时,需要借助载体蛋白转运至胞外。 铜绿假单胞菌和费氏弧菌均是利用AHLs 来调控QS 的革兰氏阴性菌, 而且它们QS 系统的调控通路与机制也探究的比较明晰,具有代表性,在本文作为革兰氏阴性菌典型QS 系统进行介绍。
1.1.1 费氏弧菌QS 系统 QS 系统最早是在费氏孤菌中发现,近年来,在大肠杆菌、根癌农杆菌、胡萝卜软腐欧文氏菌、 绿脓假单胞杆菌等细菌中都发现有与之极为相似的QS 系统, 其由LuxI 和LuxR 两种蛋白调控, 故被称为LuxI/R-AHLs 型QS,其信号分子为3-oxo-C6-HSL[11]。 LuxI 是一类调节信号分子合成的胞内蛋白酶, 可催化载体蛋白的侧链酰基与S-腺苷甲硫氨酸(SAM)上的高丝氨酸相结合,生成3-oxo-C6-HSL[12]。3-oxo-C6-HSL 是费氏弧菌特有的自诱导物, 具有水溶性且分子质量小的特点,能够自由地进出于细胞膜,随着细菌密度增加,3-oxo-C6-HSL 会逐渐增多,达到一定的浓度阈值后, 便结合到特异性受体蛋白上,激活转录调控因子LuxR。 随后,LuxR-HSL 蛋白复合体与luxICDABE 操纵子上游20 bp 长度的lux box 结合,激活luxICDABE 操纵子,从而启动某些功能基因的表达,此外,LuxR-HSL 蛋白复合体还与luxR 启动子结合,抑制luxR 的转录,间接下调luxICDABE 的表达[12-14]。 值得一提的是,在LuxI/R-AHLs 型QS 系统中,信号分子AHLs 具有特异性,这使得多种微生物共存的复杂环境中,每种细菌都能精准识别自身特定的信号分子。然而,每一种细菌并不是仅有一套LuxI/R-AHLs, 而是含有多套LuxI/R-AHLs QS 系统, 它们各自负责亦或是共同调控某种功能, 并且也会和其它类型的QS 协同作用。

图1 费氏弧菌LuxI/R QS 系统[13]
Fig.1 The LuxI/R quorum sensing system of Vibrio fischeri[13]
1.1.2 铜绿假单胞菌QS 系统 铜绿假单胞菌的QS 系统是细菌生理代谢系统里最复杂的系统之一, 目前所知的主要有3 种:LasR-LasI、RhlRRhlI、假单胞菌喹诺酮信号(Pseudomonas quinolone signal, PQS), 它们彼此独立而又相互关联[15]。 LasR-LasI 系统由转录激活因子LasR 和AHLs 合成酶LasI 组成,LasI 指导信号分子3OC12-HSL(PAI 1)的合成,信号分子合成后分泌到胞外,当累积到一定的浓度后,能够被LasR 感知并结合成形成复合物LasR-3OC12-HSL, 激活靶基因的转录, 促进毒力基因如lasB、lasA、aprA、toxA 和las I 的表达[16-17]。 RhlR-RhlI 系统由转录激活因子RhIR 和AHLs 合成酶RhlI 组成,RhlI指导信号分子C4-HSL(PAI 2)的合成,在细胞浓度较高时,C4-HSL 与RhlR 结合形成RhlR-C4-HSL 复合物激活靶基因的转录,促进蛋白酶、弹性蛋白酶的合成以及绿脓菌素、几丁质、氰化物等毒素的分泌[17-18]。
PQS 是在2-庚基-3-羟基-4-喹诺酮(2-heptyl-3-hydroxy-4-quinolone, HHQ)的基础上形成的,并且和LasR-LasI、RhlR-RhlI 系统的AHLs 的信号具有相似的化学结构[19]。PQS-QS 系统由操纵子pqsABCDE、phnAB、pqsRH 组成, 对绿脓菌素、弹性蛋白水解酶、 细胞毒性凝集素的合成和生物膜形成以及铁平衡起着重要的调节作用。 pqs-ABCDE 操纵子产生烷基-4-(1H) 喹诺酮类化合物【alkyl-4-(1H)-quinolones, AQS】,包括PQS 和HHQ。 phnA、phnB 基因编码合成邻氨基苯甲酸盐(Anthranilate),其可被PqsA 激活,形成邻氨基苯甲酰辅酶A, 这是启动QS 系统合成AQS 的第一步[20]。 PqsB、PqsC 和PqsD 是载体蛋白合酶,它们能将苯甲酸转化为HHQ;PqsH 是黄素依赖型单加氧酶,可将HHQ 的3’端氢化;PqsE 是一种硫酯酶,由pqsABCDE-phnAB 操纵子的第5 位基因编码合成,可调控铜绿假单胞菌分泌主要毒素-绿脓杆菌素[21-22]。 当信号分子达到一定浓度时,HHQ 与转录调控因子PqsR(也称MvfR)结合,随后PqsRHHQ 复合体激活pqsABCDE-phn AB 操纵子的转录,编码合成与AQS 形成相关的酶,从而触发所有QS 系统的正向调控[23]。 pqsR 和pqsH 基因能够 被LasR-3OC12-HSL 激活, 而pqsABCD 和pqsR 又能被RhlR-C4-HSL 抑制,PqsR-AQS 信号分子AQS 的分泌能够进一步上调rhlI 和rhlR 的表达[24-25]。 因此,PQS 系统与Las 和Rhl 系统是紧密联系的。 3 套QS 系统之间的信号因子相互联系,形成紧密而又高效的信号传递与交流的通路,共同调节菌体生理特性。
1.2 AIP 介导的革兰氏阳性菌QS 系统
自诱导肽(Autoinducing peptides, AIPs)为革兰氏阳性菌QS 的主要信号分子, 其大多为5~26个氨基酸残基排列而成的直线状或环状结构[26]。AIPs 具有体积小、高稳定性、高保守性的特点,然而其不能自由穿过菌体的细胞膜,需借助ABC 转运系统(ATP-binding-cassette)或其它膜通道转运蛋白到达胞外发挥作用[27]。 金黄色葡萄球菌和粪肠球菌是革兰氏阳性菌双组分QS 系统的典型菌株,以下介绍其QS 系统及作用机理。
1.2.1 金黄色葡萄球菌QS 系统 金黄色葡萄球菌是一种常见的食源性致病菌, 作为革兰氏阳性菌QS 系统的典型代表, 其辅助基因调控(Accessory gene regulator, Agr)QS 系统通过双组分系统(Two component system, TCS),调节毒素的分泌以及生物膜的形成。Agr QS 系统所利用的AIPs信号分子,由AgrD 编码后,经过AgrB 修饰成包含8~9 个氨基酸和1 个硫代内酯环的结构, 随后通过细胞膜上的ABC 转运系统协助跨越细胞膜到胞外[28]。 当胞外AIPs 积累到一定阈值时,就会被细胞膜上组氨酸激酶感应器(AgrC)感知并结合,之后膜蛋白AgrC 磷酸化, 并使得反应调控因子AgrA 发生磷酸化,磷酸化的AgrA-P 与Agr QS 中的主要靶启动子P2 和P3 相结合,诱导RNAII 和RNAIII 转 录,RNAII 由agrABCD 4 个 基因组成,对金黄色葡萄球菌自身QS 循环起到正反馈调节,RNAIII 对金黄色葡萄球菌毒素的产生具有重要的调节作用,如溶血素、肠毒素、入侵相关的蛋白酶[29-31]。

图2 铜绿假单胞菌Las-Rhl-PQS QS 系统[25]
Fig.2 The Las-RHL-PQS quorum sensing system of Pseudomonas aeruginosa[25]

图3 金黄色葡萄球菌Agr QS 系统及其4 种AIP 信号分子结构[31]
Fig.3 The Agr quorum sensing system and the molecular structures of the four AIP signals in Staphylococcus aureus[31]
1.2.2 粪肠球菌QS 系统 粪肠球菌是一种广泛分布于自然环境、 人和动物胃肠道中的条件致病菌, 约占所有肠球菌感染的80%, 能引发尿道感染、腹部和盆腔感染以及外科术后的感染等[32]。 粪肠球菌致病性和毒素的产生与自身具有的粪肠球菌反应调节器(Enterococcus faecalis system regulator, Fsr)QS 系统密切相关, 其QS 系统利用11个氨基酸组成的大环AIP-明胶酶生物合成信息素(Gelatinase biosyn thesis-activating pheromone,GBAP)来激活Fsr 依赖的基因,这种肽的特点是在Ser3 的侧链与Met11 的羧基之间形成内酯大环键[33]。 Fsr QS 系统由fsrABCD 4 个基因组成,fsrD 编码FsrD 蛋白,FsrD 蛋白经过fsrB 编码合成的膜蛋白FsrB 加工之后,形成成熟的GBAP 并释放到胞外,随着菌体数量的增加,GBAP 会逐渐在胞外积累,当GBAP 浓度达到一定阈值时,会被传感器组氨酸激酶FsrC 识别, 使其发生磷酸化,并进一步使反应调节器FsrA 发生磷酸化; 随后,磷酸化的FsrA 与fsrB 及gelE 上游启动子区域相结合,从而激活fsrB-fsrC 和gelE-sprE 转录,合成明胶酶和丝氨酸蛋白酶, 直接影响粪肠球菌黏附能力和生物膜的形成, 从而诱导QS 系统的正向调控;当菌体数量减少,周围GBAP 浓度低于特定值时,FsrA 会抑制fsrB-fsrC 和gelE-sprE 基因的表达[34-36]。 粪肠球菌Fsr QS 系统涉及该菌多方面的生理特征:蛋白质周转、生物膜形成和毒素产生。
1.3 AI-2 介导的种间QS 系统
AHLs 和AlPs 在不同细菌间具有很强的特异性, 然而在革兰氏阴性菌和阳性菌中还普遍存在一类AI-2 型信号分子,其结构为呋喃酰硼酸二酯[37]。 细菌能够以AI-2 为媒介来感知外界不同种类细菌的数量,从而调节自身的生理变化,即菌体间能通过AI-2 来传递种间的信息。目前研究的热点集中在致病菌中AI-2 调控的QS 系统,随着研究的深入, 发现在非致病菌和益生菌中也利用这种“通用”信号分子调节种间的交流并表达生理特性[38],包括生物膜的形成、毒素的分泌、生物发光以及细菌素的合成等。 AI-2 虽在各类细菌中的合成路径大致相同, 但信号传递和感知的机制却有很大的差别,当前研究证实的AI-2 受体蛋白为沙门氏菌和大肠埃希氏菌的LsrB 蛋白以及哈维氏弧菌的LuxP 蛋白[39]。

图4 粪肠球菌Fsr QS 系统[33]
Fig.4 The Fsr quorum sensing system of Enterococcus faecalis[33]

图5 AI-2 合成途径[44]
Fig.5 The synthesis pathway of AI-2[44]
1.3.1 AI-2 合成途径 AI-2 是S-腺苷甲硫氨酸(S-Adenosylmethionine, SAM) 循环的代谢产物,其合成依赖LuxS 和S-腺苷同型半胱氨酸核苷酶(S-Adenosylhomocysteine nucleosidase, pfs)的作用[40]。 在AI-2 合成过程中,SAM 在甲基转移酶的催化下去除一个甲基形成S-腺苷同型半胱氨酸(S-Adenosylhomocysteine, SAH),SAH 有2 种 代谢去向:1)在SAH 水解酶的作用下,一步反应直接转化为同型半胱氨酸(Homocysteine),此过程不产生AI-2;2)SAH 在Pfs 的作用下, 降解为S-核糖同型半胱氨酸 (S-Ribosylhomocysteine, SRH)和腺嘌呤,随后,再由LuxS 催化SRH 中的硫醚键断裂,生成4,5-二羟基-2,3-戊二酮(DPD)和同型半胱氨酸,DPD 是AI-2 的前体分子, 具有高活性,能够自身环化形成AI-2,而生成的同型半胱氨酸在S-腺苷甲硫氨酸合成酶F/K(MetF/K)催化下得到甲基重新生成SAM 再次进入代谢循环[41-43]。
1.3.2 哈维氏弧菌QS 系统 哈维氏弧菌QS 系统主要有3 种酶调控:LuxM、LuxS 和CqsA, 分别负责合成自诱导剂HAI-1 即3-羟基丁酰高丝氨酸内酯 (N-[3-hydroxybutanoyl]-homoserine lactone)、AI-2(呋喃酰硼酸二酯)和CAI-1【(Z)-3-aminoundec-2-en-4-one,Ea-C8-CAI-1】,3 种不同的AIs 具有不同的信息传递功能:HAI-1 主要由哈维氏弧菌产生, 用于种内交流;AI-2 介导种间的信息交流;CAI-1 在多种弧菌中均能产生,对弧菌间的QS 起重要作用[45-46]。 自诱导剂可以被细胞表面相应的受体蛋白 (LuxN、LuxQ 和CqsS)所识别[47]。在低密度细胞水平,受体蛋白(LuxN、LuxQ和CqsS)自磷酸化,触发LuxU 介导的LuxO 磷酸化, 磷酸化的LuxO 与σ54 结合, 促进sRNAs(Qrr1-5)的转录,sRNAs 与Hfq 共同作用,破坏和降解主调控因子LuxR 的mRNA,从而阻止转录调控因子LuxR 的表达;在高密度细胞水平,自诱导剂被相应的受体蛋白(LuxN、LuxQ 和CqsS)感知并结合, 使得受体蛋白从激酶向磷酸酶的状态进行转变, 导致LuxO 去磷酸化, 转变为不能促进sRNAs 转录的非活性形式, 从而降低了AphA 的产生, 增加了主调节因子LuxR 的合成, 诱导QS系统所调控的各种功能基因的表达[48-50]。
1.4 AI-3/肾上腺素/去甲肾上腺素介导的QS 系统
近年来有研究发现,在LuxS 蛋白发生突变的大肠杆菌中,虽不能合成AI-2 信号分子,却产生了一种不同于AI-2 的新型信号分子——AI-3,以维持种间信息的交流,其结构目前尚不明确,但发现肾上腺素 (Epinephrine, EPi)/去甲肾上腺素(Norepinephrine, NE) 能促进肠出血性大肠杆菌毒素的分泌, 即肾上腺素和去甲肾上腺素能够替代AI-3 行使功能[51]。 因此可以推断:AI-3 在结构上与肾上腺素/去甲肾上腺素相似。 大肠杆菌利用不同的QS 系统来调控生物膜的形成、菌体的运动以及毒素的分泌, 除AI-2/LuxS QS 系统外,AI-3型QS 系统可通过肾上腺素、 去甲肾上腺素以及QseABCEF 操纵子来调节QS[52]。
AI-3 一般存在于肠致病性大肠杆菌(Enteropathogenic Escherichia coli, EPEC)、 肠出血性大肠杆菌 (Enterohemorrhagic E. coli,EHEC)、克雷伯菌属 (Klebsiella sp.)、 沙门氏菌属(Salmonella sp.)和志贺氏菌属(Shigella sp.)等致病菌中[53]。以EHEC 的AI-3/肾上腺素/去甲肾上腺素介导的QS 系统为例: 组氨酸激酶感受器QseC是EHEC 的全局调控因子,调控细胞新陈代谢、毒素分泌、运动性以及应激反应。 当EPi/NE/AI-3 被QseC 感知后,促使反应调节器(Response regulator, RR)QseB、QseF、KdpE 磷酸化,QseB 激活编码鞭毛和菌毛基因的转录,QseF 协调编码黏附脱落(Attaching and effacing, AE)损伤和应激反应基因的转录,KdpE 调节编码钾摄取、 渗透压浓度和AE 损伤基因的转录[52,54];QseE 感知Epi 和NE,以及环境中的磷酸盐和硫酸盐, 却不能感知AI-3,QseC 激活QseE/F 的转录。在EPi/NE/AI-3 的信号级联中,QseE 位于QseC 的下游,QseE/F 调节参与应激(SOS)反应和志贺毒素分泌基因的表达,以及编码其它TCS 基因的转录;QseA 由AI-3/EPi/NE 信号级联激活,其在提高肠出血性大肠杆菌的毒力方面起重要作用,QseA 激活转录调控因子、sRNAs、AE 损伤以及EHEC 特有染色体区域——O 岛[55-56]。

图6 哈维氏弧菌QS 系统[48]
Fig.6 The quorum sensing system of Vibrio harveyi[48]
注:H. 组氨酸;D. 天冬氨酸;PP. 周质;CM. 细胞膜;CP. 细胞质;虚线表示磷酸转移;箭头表示正调节;柱状线表示负调节。

图7 出血性大肠杆菌中肾上腺素/NE/AI-3 QS 系统[52]
Fig.7 The epinephrine/NE/AI-3 quorum sensing system in hemorrhagic Escherichia coli[52]
注:箭头表示正调节,柱状线表示负调节。
2 群体感应淬灭
QS 是细菌通过释放、识别和响应信号分子来进行信息交流的一种方式[57]。 许多研究表明,浮游菌体一旦形成生物膜后, 细菌对传统抗生素的抵抗能力最高可提升1 000 倍, 这是因为细菌生物膜产生的胞外多聚物基质(多糖、蛋白质、脂质、DNA)可以形成一道天然的屏障,再加上自身分泌的毒素以及抗生素, 保护细菌在外界环境发生不利变化的情况下依然能够生长和繁殖, 这使得致病菌和腐败菌的防控变得极其困难[58]。 阻止致病菌和腐败菌QS 信号分子的产生和积累,阻止其被受体蛋白识别和结合,就可以干扰QS 系统,防止其形成生物膜,抑制其毒素产生。 因此,具有群体感应淬灭(Quorum quenching, QQ)作用的QSIs逐渐被发掘,并成为有害菌防控研究的热点[59-60]。
QSIs 根据结构的不同可分为呋喃酮类、 内酯类、取代的HSL 类、AIP 类等。 根据来源的不同可以分为天然QSIs 和人工合成QSIs, 而天然QSIs包括:非肽类小分子化合物、AIP 类似物的肽类化合物和QS 淬灭酶,其来源可分为动物类、植物类、原核生物类、海洋生物类以及真菌类[61-62]。 目前常用的QSIs 为人工合成类,其主要优点是具有很强的QS 信号通路干扰能力, 缺点是大多具有毒性,有些甚至具有致癌性, 不能用于食品生产过程中致病菌和腐败菌的防治。 从天然食材或药食同源性材料中提取QSIs, 以及从微生物的次生代谢产物中挖掘QSIs,将是未来QSIs 在食品生产中防控有害菌的发展方向。
QSIs 与抗生素相比, 可有效缓解细菌耐药性的问题, 这是因为其可以扰乱致病菌毒力因子的正常表达, 特异地抑制致病菌的致病性且不杀死细菌,不会对菌体造成选择性的压力[63]。QSIs 主要有3 种作用机制[64-65]:一是阻断QS 信号分子合成, 可通过清除底物或降低信号分子合成酶的活性等方式来实现;二是降解QS 信号分子,使其在胞外难以达到受体蛋白所能感知的浓度阈值;三是抑制受体蛋白的活性, 引入信号分子类似物与信号分子竞争结合位点,阻断QS 通路。 以AHLLuxI/LuxR 调控机制为例,如图8 所示。
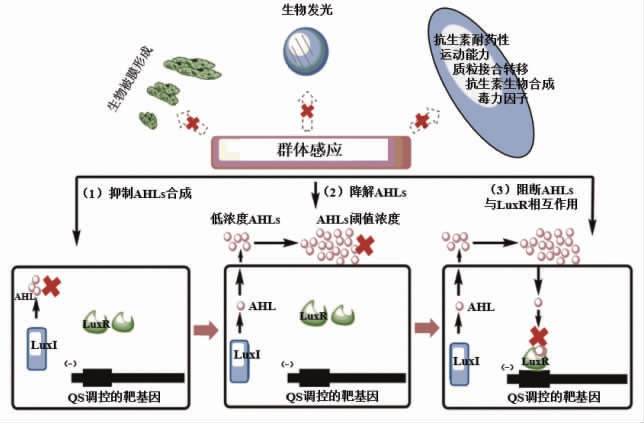
图8 QSIs 作用机制[65]
Fig.8 The mechanisms of quorum sensing inhibitors[65]
2.1 阻断QS 信号分子合成
QS 信号分子的合成需要多种酶的参与,如AI-2 合成依赖LuxS 和pfs 两种酶的作用,AHLs的合成依赖酰基载体蛋白 (Acyl carrier protein,ACP)、烯基-酰基载体蛋白还原酶和AHL 合成酶的作用[66]。 因此,在信号分子的合成过程中,只要降低相关蛋白或酶的活性,便可阻断信号分子,淬灭QS 系统。 Cui 等[67]研究发现甲壳乳杆菌ZHG2-1 发酵液粗提物对铜绿假单菌生物膜有明显的清除作用,RT-qPCR 分析表明, 粗提物下调信号分子合成基因lasI/R 和rhlI/R 表达,抑制蛋白酶、几丁质酶、绿脓杆菌素、鼠李糖脂等毒素的产生。 Li等[68]探究L-香芹酮对蜂房哈夫尼菌QS 的影响,经L-香芹酮处理之后,菌体运动、群集能力、生物膜形成、AHLs 产量下降, 研究证实L-香芹酮与LuxI 蛋白和LuxR 蛋白具有很强的结合能力,结合后抑制其活性,干扰信号分子AHLs 合成,淬灭QS 系统。
2.2 降解QS 信号分子
QS 淬灭酶是一类能够降解信号分子,防止信号分子在胞外积累的酶。 目前,AIPs 和AI-2 降解酶的种类很少,而AHLs 降解酶种类却极为丰富,主要分为3 类:AHL 内酯酶水解内酯环, 产生N-酰基高丝氨酸;AHL 酰胺酶水解AHL 的酰胺键,并将其分解成脂肪酸和高丝氨酸内酯;AHL 氧化还原酶氧化或还原酰胺键, 氧化主要发生在酰基链的w-1、w-2、w-3 位的碳上, 还原是将C3 位的羧基还原为羰基[69]。 Pan 等[70]从海洋细菌中筛选出具有AHLs 降解能力的假交替单胞菌MQS005,通过全基因组学测序发现PvdQ 型酰胺酶基因APTM01, 构建含该基因的大肠杆菌BL21 表达宿主, 该酶能 降解C10-HSL、C12-HSL 和OC12-HSL。Anandan 等[71]在苏云金芽孢杆菌KMCL07 中发现一种属于金属-β-内酰胺超家族的QS 淬灭酶——AiiA 内酰胺酶,该酶与C4-HSL、C6-HSL、3-oxo-C12-HSL 具有很强的亲和力, 与AHLs 信号分子结合并使其失活, 显著抑制铜绿假单胞菌PAO1 生物膜形成和毒素的分泌。 目前,降解信号分子的酶具有活性不稳定、专一性不高的缺点,因此,需进一步分离鉴定稳定性强的酶,或通过分子工程提高其性能。
2.3 QS 信号分子类似物竞争结合受体蛋白
修饰AHLs 酰基侧链和内酯后形成的AHLs类似物、AIPs 类似物、AI-2 和DPD 类似物, 可与天然信号分子竞争结合受体蛋白, 抑制下游调控蛋白,淬灭QS 系统[63]。Liu 等[72]设计合成新型L-高丝氨酸内酯类似物, 其对铜绿假单胞菌PAO1 生物膜形成、菌体运动、毒素分泌等QS 表观特征具有不同程度的抑制作用, 该类似物与信号分子3OC12-HSL 竞争性结合LasR, 抑制了lasR、rhl、PQS 系统相关基因的表达,从而淬灭QS 系统。 Li等[73]研究邻氨基苯甲酸甲酯对温和气单胞菌QS淬灭作用, 发现其与信号分子C4-HSL 具有相同的蛋白结合位点-LuxR,与LuxR 形成的复合物稳定,可作为信号分子竞争性抑制剂。 Park 等[74]设计合成3-(二溴甲基) 异苯并呋喃-1 (3H)-酮【3-(dibromomethylene)isobenzofuran-1 (3H)-one】衍生物,对牙周病原体信号分子AI-2 活性和生物膜形成具有显著的抑制作用,这种化合物与AI-2 具有相似的环状结构, 与AI-2 竞争性结合受体蛋白,进而淬灭QS 系统。
3 群体感应的应用与展望
1) 利用群体感应防治腐败菌 在牛奶、水果、蔬菜等食品加工、贮藏、运输过程中所发生的腐败变质的现象大多有QS 系统的参与,其调控与食品腐败变质有关的微生物的蛋白质分解酶、脂肪水解酶、纤维素酶、果胶酶以及生物膜的形成。因此,使用QSIs 如QS 淬灭酶,从抑制腐败菌生物膜形成、 淬灭腐败相关酶的活性等多方面阻碍食品腐败进程,这为提高食品质量、保障食品安全提供了新的思路。
2) 利用群体感应防控致病菌 目前因长期使用抗生素已经导致大量致病菌形成的耐药性,这对未来致病菌感染的治疗与防控是极其不利的。 随着对QS 系统机理研究的深入和全面,可利用天然产物或人工合成具有强大QS 淬灭能力的新型QSIs,有效抑制致病菌分泌的致病毒素、破坏致病菌生物膜的形成以及改善受感染者自身的免疫系统,更为重要的是,QSIs 可缓解传统抗生素对致病菌施加的选择性生存的压力, 从而防止耐药性菌株的出现。
3) 利用群体感应调控生物合成 以生物合成的方式进行食品原辅料的生产与加工是未来大量生产目的产物最为经济、环保的方式。在生物合成过程中,人工代谢通路的设计与构建,可使发酵工程菌高效合成大量的重组蛋白,然而,如果对生物反应的代谢通路过度改造, 比如在发酵起始就启动蛋白的表达, 将会对菌体的生长繁殖带来很大的压力,菌体无法正常生长,甚至会引起毒素的分泌,影响了产品的产量和质量。在工程途径中引入QS 系统,通过对周围环境中菌体浓度进行实时的感知,全面且高效地调节目的基因的表达,能够对菌体生长繁殖过程中所发生的变化进行及时有效的调控,具有动态性和通用性的优点。 因此,在生物合成技术的研究中,将QS 系统与发酵工程相融合的思路,开辟了一个全新的微生物研究方向。
QS 是微生物研究的新兴研究方向,未来充满着机遇与挑战,现阶段对于许多种细菌QS 系统的机制,尚未得到全面而深入的研究。 另外,虽然目前研究所得到的QSIs 种类很多,然而其稳定性以及QS 淬灭效果并不理想,尤其是人工合成的QSI具有毒性,难以应用在食品领域,因此,未来研究趋向于从天然食材或药食同源性材料、 微生物的次生代谢产物中挖掘QSIs, 以及建立新型高效的QSIs 筛选体系,从而得到QS 淬灭性强、无毒、无污染的新型QSIs。相信在未来随着组学、分子生物学和合成生物学等技术的成熟,我们将会对QS 系统有全新的认识和应用。
[1] MILLER M B, BASSLER B L. Quorum sensing in bacteria[J]. Annual Review of Microbiology, 2001,55(1): 165-199.
[2] WATERS C M, BASSLER B L. Quorum sensing:Cell-to-cell communication in bacteria[J]. Annual Review of Cell and Developmental Biology, 2005,21(1): 319-346.
[3] PAPENFORT K, BASSLER B L. Quorum sensing signal-response systems in gram-negative bacteria[J].Nature Reviews Microbiology, 2016, 14(9): 576-588.
[4] LOU Z, WANG H, TANG Y, et al. The effect of burdock leaf fraction on adhesion, biofilm formation,quorum sensing and virulence factors of Pseudomonas aeruginosa[J]. Journal of Applied Microbiology, 2017, 122(3): 615-624.
[5] PALUCH E, REWAKSOROCZYNSKA J, JEDRUSIK I, et al. Prevention of biofilm formation by quorum quenching[J]. Applied Microbiology and Biotechnology, 2020, 104(5): 1871-1881.
[6] 王志航, 冯雪, 李树仁, 等. 细菌群体感应通讯系统淬灭及应用[J]. 药物生物技术, 2018, 25(5):70-74.
WANG Z H, FENG X, LI S R, et al. Research and application of quorum quenching in bacteria[J].Pharmaceutical Biotechnology, 2018, 25(5): 70-74.
[7] 丁婷, 李婷婷, 王当丰, 等. 水产品腐败菌群体感应系统及群体感应抑制剂研究进展[J]. 生物加工过程, 2019, 17(3): 227-235.
DING T, LI T T, WANG D F, et al. Research progress in quorum sensing of spoilage organisms of aquatic products[J]. Chinese Journal of Bioprocess Engineering, 2019, 17(3): 227-235.
[8] TURAN N B, CHORMEY D S, BUYUKPINAR C,et al. Quorum sensing: Little talks for an effective bacterial coordination[J]. Trends in Analytical Chemistry, 2017, 91(6): 1-11.
[9] 励建荣. 海水鱼类腐败机制及其保鲜技术研究进展[J]. 中国食品学报, 2018, 18(5): 1-12.
LI J R. Research progress on spoilage mechanism and preservation technology of marine fish[J]. Journal of Chinese Institute of Food Science and Technology, 2018, 18(5): 1-12.
[10] 郭冰怡, 董燕红. 细菌群体感应抑制剂研究进展[J].农药学学报, 2018, 20(4): 408-424.
GUO B Y, DONG Y H. Research progress on inhibitors toward quorum sensing system[J]. Chinese Journal of Pesticide Science, 2018, 20(4): 408-424.
[11] ALI Y M, TAZIR K. Stochastic simulation of quorum sensing in Vibrio fischeri based on P system[J].Evolving Systems, 2019, 10(2): 167-177.
[12] KALIA V C. Quorum sensing inhibitors: An overview[J]. Biotechnology Advances, 2013, 31(2):224-245.
[13] KERSTIN R, ANKE S, VOLKHARD H. Interfering with bacterial quorum sensing [J]. Perspectives in Medicinal Chemistry, 2016, 8(2): 1-15.
[14] KIMURA Y, TASHIRO Y, SAITO K, et al. Directed evolution of Vibrio fischeri LuxR signal sensitivity[J]. Journal of Bioscience and Bioengineering,2016, 122(5): 533-538.
[15] LEE J, ZHANG L. The hierarchy quorum sensing network in Pseudomonas aeruginosa[J]. Protein &Cell, 2015, 6(1): 26-41.
[16] CHATTERJEE M, D'MORRIS S, PAUL V, et al.Mechanistic understanding of phenyllactic acid mediated inhibition of quorum sensing and biofilm devel opment in Pseudomonas aeruginosa[J]. Applied Microbiology and Biotechnology, 2017, 101(22): 8223-8236.
[17] 周朋, 王喆, 包美娇, 等. 微生物群体感应系统的调控机制及应用研究进展[J]. 生物加工过程, 2019,17(3): 236-243.
ZHOU P, WANG Z, BAO M J, et al. Progress in the regulation mechanism and application of microbial quorum sensing system[J]. Chinese Journal of Bioprocess Engineering, 2019, 17(3): 236-243.
[18] WEI Q, BHASME P, WANG Z G, et al. Chinese medicinal herb extract inhibits PQS-mediated quorum sensing system in Pseudomonas aeruginosa[J].Journal of Ethnopharmacology, 2020, 248 (19):112272-112281.
[19] LI W R, ZENG T H, XIE X B, et al. Inhibition of the pqsABCDE and pqsH in the pqs quorum sensing system and related virulence factors of the Pseudomonas aeruginosa PAO1 strain by farnesol[J].International Biodeterioration & Biodegradation,2020, 151(7): 104956-104967.
[20] ZHANG C, PARRELLO D, BROWN P J, et al. A novel whole-cell biosensor of Pseudomonas aeruginosa to monitor the expression of quorum sensing genes[J]. Applied Microbiology and Biotechnology,2018, 102(14): 6023-6038.
[21] GARCIAREYES S, SOBERONCHAVEZ G, COCOTLYANEZ M, et al. The third quorum-sensing system of Pseudomonas aeruginosa: Pseudomonas quinolone signal and the enigmatic PqsE protein[J].Journal of Medical Microbiology, 2020, 69(1): 25-34.
[22] FONG J, MORTENSEN K T, NORSKOV A, et al.Itaconimides as novel quorum sensing inhibitors of Pseudomonas aeruginosa[J]. Frontiers in Cellular and Infection Microbiology, 2019, 8(1): 443-453.
[23] BALDELLI V, D'ANGELO F, PAVONCELLO V, et al. Identification of FDA -approved antivirulence drugs targeting the Pseudomonas aeruginosa quorum sensing effector protein PqsE[J]. Virulence, 2020,11(1): 652-668.
[24] BARIS G, DIDEM B, NUZHET C S. Pseudomonas aeruginosa quorum sensing and biofilm inhibition[J].Quorum Sensing, 2019, 10(4): 227-256.
[25] YAN S M, WU G. Can biofilm be reversed through quorum sensing in Pseudomonas aeruginosa[J]. Frontiers in Microbiology, 2019, 8(7): 1582-1590.
[26] PANG X Y, LIU C P, LYU P C, et al. Identification of quorum sensing signal molecule of Lactobacillus delbrueckii subsp. bulgaricus[J]. Journal of Agricultural and Food Chemistry, 2016, 64(49):9421-9427.
[27] JOHANSEN P, JESPERSEN L. Impact of quorum sensing on the quality of fermented foods[J]. Current Opinion in Food Science, 2017, 13(2): 16-25.
[28] GLESS B H, BOJER M S, PENG P, et al. Identification of autoinducing thiodepsipeptides from Staphylococci enabled by native chemical ligation[J].Nature Chemistry, 2019, 11(5): 463-469.
[29] PENG P, BALDRY M, GLESS B H, et al. Effect of co-inhabiting coagulase negative staphylococci on S. aureusagr quorum sensing, host factor binding,and biofilm formation[J]. Frontiers in Microbiology,2019, 10(9): 2212-2225.
[30] SALAM A M, QUAVE C L. Targeting virulence in Staphylococcus aureus by chemical inhibition of the accessory gene regulator system in vivo[J]. Msphere,2018, 3(1): 1-17.
[31] VASQUEZ J K, BLACKWELL H E. Simplified autoinducing peptide mimetics with single-nanomolar activity against the Staphylococcus aureus AgrC quorum sensing receptor [J]. ACS Infectious Diseases,2019, 5(4): 484-492.
[32] ALI L, GORAYA M U, ARAFAT Y, et al. Molecular mechanism of quorum-sensing in Enterococcus faecalis: Its role in virulence and therapeutic approaches[J]. International Journal of Molecular Sciences, 2017, 18(5): 960-978.
[33] MCBRAYER D N, CAMERON C D, GANTMAN B K, et al. Rational design of potent activators and inhibitors of the Enterococcus faecalis Fsr quorum sensing circuit[J]. ACS Chemical Biology, 2018, 13(9): 2673-2681.
[34] MCBRAYER D N, GANTMAN B K, TAL-GAN Y.N-Methylation of amino acids in gelatinase biosynthesis-activating pheromone identifies key site for stability enhancement with retention of the Enterococcus faecalis Fsr quorum sensing circuit response[J]. ACS Infectious Diseases, 2019, 5(6): 1035-1041.
[35] MCBRAYER D N, GANTMAN B K, CAMERON C D, et al. An entirely solid phase peptide synthesisbased strategy for synthesis of gelatinase biosynthesis-activating pheromone (GBAP) analogue libraries:Investigating the structure -activity relationships of the Enterococcus faecalis quorum sensing signal[J].Organic Letters, 2017, 19(12): 3295-3298.
[36] LITTLEWOOD S, TATTERSALL H, HUGHES C S,et al. The gelatinase biosynthesis -activating pheromone binds and stabilises the FsrB membrane protein in Enterococcus faecalis quorum sensing[J].Febs Letters, 2019, 594(3): 553-563.
[37] 刘昀阁, 罗欣, 董鹏程, 等. 基于群体感应的单增李斯特菌生物膜形成与控制研究进展[J]. 食品科学,2019, 40(21): 303-310.
LIU J G, LUO X, DONG P C, et al. Biofulm formation and control of Listeria monocytogenes based on quorum sensing: A review [J]. Food Science,2019, 40(21): 303-310.
[38] 蔡针华, 程娜, 贾震虎, 等. 群体感应信号分子AI-2 高产乳酸菌株筛选及特性研究[J]. 食品与发酵工业, 2018, 44(1): 66-71.
CAI Z H, CHENG N, JIA Z H, et al. Screening and characterization research of quorum sensing signaling molecule AI-2 high-yield Lactobacillus strains[J]. Food and Fermentation Industries, 2018, 44(1): 66-71.
[39] ZAITSEVA Y V, LIPASOVA V A, PLYUTA V A,et al. Effect of inactivation of luxS gene on the properties of Serratia proteamaculans 94 strain[J].Folia Microbiologica, 2019, 64(3): 265-272.
[40] SONG X D, LIU C J, HUANG S H, et al.Cloning, expression and characterization of two Sribosylhomocysteine lyases from Lactobacillus plantarum YM-4-3: Implication of conserved and divergent roles in quorum sensing[J]. Protein Expression and Purification, 2018, 145(5): 32-38.
[41] GU Y, LI B, TIAN J J, et al. The response of LuxS/AI-2 quorum sensing in Lactobacillus fermentum 2-1 to changes in environmental growth condi tions[J]. Annals of Microbiology, 2018, 68(5): 287-294.
[42] 李鹏飞, 武瑞赟, 李平兰. 细菌群体感应及其调控应激反应的研究进展[J]. 生物加工过程, 2019, 17(3): 310-315.
LI P F, WU R Y, LI P L. Advances in bacterial quorum sensing and its regulation of stress responses[J]. Chinese Journal of Bioprocess Engineering,2019, 17(3): 310-315.
[43] GU Y, WU J, TIAN J, et al. Effects of exogenous synthetic autoinducer-2 on physiological behaviors and proteome of lactic acid bacteria[J]. ACS Omega,2020, 5(3): 1326-1335.
[44] CAGNO R D, ANGELIS M D, CALASSO M, et al. Proteomics of the bacterial cross-talk by quorum sensing[J]. Journal of Proteomics, 2011, 74(1): 19-34.
[45] JUNG K, BRAMEYER S, FABIANI F, et al. Phenotypic heterogeneity generated by histidine kinasebased signaling networks[J]. Journal of Molecular Biology, 2019, 431(23): 4547-4558.
[46] MONTANCHEZ I, KABERDIN V R. Vibrio harveyi: A brief survey of general characteristics and recent epidemiological traits associated with climate change[J]. Marine Environmental Research, 2020,154(2): 104850-104864.
[47] AQAWI M, GALLILY R, SIONOV R V, et al.Cannabigerol prevents quorum sensing and biofilm formation of Vibrio harveyi[J]. Frontiers in Microbiology, 2020, 11(5): 858-870.
[48] NICOLA L, YEN S J, KIRSTEN J. Activity, abundance, and localization of quorum sensing receptors in Vibrio harveyi[J]. Front Microbiol, 2017, 8(4):858-870.
[49] MUKHERJEE S, BASSLER B L. Bacterial quorum sensing in complex and dynamically changing environments[J]. Nature Reviews Microbiology, 2019, 17(6): 371-382.
[50] BALL A S, CHAPARIAN R R, VAN KESSEL J C, et al. Quorum sensing gene regulation by LuxR/HapR master regulators in vibrios[J]. Journal of Bacteriology, 2017, 199(19): 5-17.
[51] 邓曌曦, 音建华, 汪海峰. 乳酸菌群体感应与其肠道生物膜形成的研究进展[J]. 微生物学报, 2018,58(11): 1970-1978.
DENG Z X, YIN J H, WANG H F. Progress in research on quorum sensing and intestinal biofilm formation of Lactobacillus[J]. Acta Microbiologica Sinica, 2018, 58(11): 1970-1978.
[52] KENDALL M M. Interkingdom chemical signaling in enterohemorrhagic Escherichia coli O157:H7[J]. Advances in Experimental Medicine and Biology,2016, 874(2): 201-213.
[53] 李点, 董明盛, 张秋勤. 肠杆菌科细菌群体感应系统的研究进展[J]. 生物加工过程, 2020, 18(2):193-199.
LI D, DONG M S, ZHANG Q Q. Research progress in quorum sensing system in Enterobacteriaceae[J]. Chinese Journal of Bioprocess Engineering,2020, 18(2): 193-199.
[54] MOOKHERJEE A, SINGH S, MAITI M K. Quorum sensing inhibitors: Can endophytes be prospective sources[J]. Archives of Microbiology, 2018, 200(2):355-369.
[55] YEO K J, PARK J W, KIM E H, et al. Characterization of the sensor domain of QseE histidine kinase from Escherichia coli[J]. Protn Expression &Purification, 2016, 126(10): 122-126.
[56] CHATTERJEE R, SHREENIVAS M M, SUNIL R,et al. Enteropathogens: Tuning their gene expression for hassle-free survival[J]. Frontiers in Microbiology,2019, 9(1): 3303-3319.
[57] KAREB O, AIDER M. Quorum sensing circuits in the communicating mechanisms of bacteria and its implication in the biosynthesis of bacteriocins by lactic acid bacteria: A review[J]. Probiotics and Antimicrobial Proteins, 2020, 12(1): 5-17.
[58] BRINDHADEVI K, LEWISOSCAR F, MYLONAKIS E, et al. Biofilm and quorum sensing mediated pathogenicity in Pseudomonas aeruginosa[J]. Process Biochemistry, 2020, 96(9): 49-57.
[59] 吴荣, 顾悦, 张悦, 等. 群体感应抑制剂及其在食品保藏中的应用研究进展[J]. 生物加工过程, 2019,17(3): 264-270.
WU R, GU Y, ZHANG Y, et al. Quorum sensing inhibitors and application in food preservation [J].Chinese Journal of Bioprocess Engineering, 2019,17(3): 264-270.
[60] ZHANG J J, FENG T, WANG J Y, et al. The mechanisms and applications of quorum sensing(QS) and quorum quenching (QQ)[J]. Journal of Ocean University of China, 2019, 18(6): 1427-1442.
[61] SONG H Y, ZHANG J B, QU J L, et al. Lactobacillus rhamnosus GG microcapsules inhibit Escherichia coli biofilm formation in coculture[J].Biotechnology Letters, 2019, 41(8/9): 1007-1014.
[62] 朱军莉, 冯立芳, 王彦波, 等. 基于细菌群体感应的生鲜食品腐败机制[J]. 中国食品学报, 2017, 17(3): 225-234.
ZHU J L, FENG L F, WANG Y B, et al.Spoilage mechanism of fresh food based on bacterial quorum sensing[J]. Journal of Chinese Institute of Food Science and Technology, 2017, 17(3): 225-234.
[63] SAURAV K, COSTANTINO V, VENTURI V, et al.Quorum sensing inhibitors from the sea discovered using bacterial N -acyl -homoserine lactone -based biosensors[J]. Marine Drugs, 2017, 15(3): 53-71.
[64] 肖梦圆, 武瑞赟, 谭春明, 等. 群体感应系统及其抑制剂对细菌生物被膜调控的研究进展[J]. 食品科学, 2020, 41(13): 227-234.
XIAO M Y, WU R Y, TAN C M, et al. Recent advances in understanding the role of quorum sensing system and quorum sensing inhibitors in regulating bacterial biofilm formation [J]. Food Science,2020, 41(13): 227-234.
[65] HUANG J H, SHI Y H, ZENG G M, et al. Acylhomoserine lactone-based quorum sensing and quorum quenching hold promise to determine the performance of biological wastewater treatments: An overview[J]. Chemosphere, 2016, 15(8): 137-151.
[66] 齐莉莉, 陈炳, 王进波. 群体感应抑制剂研究进展[J]. 生命的化学, 2016, 36(3): 311-314.
QI L L, CHEN B, WANG J B. Research progress on inhibitors toward quorum sensing system [J].Chemistry of Life, 2016, 36(3): 311-314.
[67] CUI T Q, BAI F L, SUN M T, et al. Lactobacillus crustorum ZHG 2-1 as novel quorum-quenching bacteria reducing virulence factors and biofilms formation of Pseudomonas aeruginosa[J]. Lwt-Food Science and Technology, 2020, 117(2): 18696-18703.
[68] LI T T, MEI Y C, HE B B, et al. Reducing quorum sensing -mediated virulence factor expression and biofilm formation in Hafnia alvei by using the potential quorum sensing inhibitor L-carvone[J].Frontiers in Microbiology, 2019, 9(1): 3324-3334.
[69] SIKDAR R, ELIAS M. Quorum quenching enzymes and their effects on virulence, biofilm, and microbiomes: A review of recent advances[J]. Expert Review of Anti -infective Therapy, 2020, 18 (12):1221-1233.
[70] PAN Y L, WANG Y B, YAN X Q, et al. Quorum quenching enzyme APTM01, an acylhomoserine-lactone acylase from marine bacterium of Pseudoalteromonas tetraodonis strain MQS005[J]. Current Microbiology, 2019, 76(12): 1387-1397.
[71] ANANDAN K, VITTAL R R. Quorum quenching activity of AiiA lactonase KMMI17 from endophytic Bacillus thuringiensis KMCL07 on AHL -mediated pathogenic phenotype in Pseudomonas aeruginosa[J].Microbial Pathogenesis, 2019, 132(7): 230-242.
[72] LIU H Y, GONG Q H, LUO C Y, et al. Synthesis and biological evaluation of novel L-homoserine lactone analogs as quorum sensing inhibitors of Pseudomonas aeruginosa[J]. Chemical & Pharmaceutical Bulletin, 2019, 67(10): 1088-1098.
[73] LI T T, SUN X J, CHEN H T, et al. Methyl anthranilate: A novel quorum sensing inhibitor and anti-biofilm agent against Aeromonas sobria[J]. Food Microbiology, 2020, 86(4): 11356-11364.
[74] PARK J S, RYU E, LI L, et al. New bicyclic brominated furanones as potent autoinducer-2 quorum-sensing inhibitors against bacterial biofilm formation[J]. European Journal of Medicinal Chemistry,2017, 137(9): 76-87.