蛋白质是肉制品中重要的功能和营养物质,在肉制品加工和存储过程中起着重要作用,对肉制品的质构、风味和营养具有重要的影响。肌原纤维蛋白(MP),是动物肌肉中重要的蛋白之一,它主要由肌球蛋白、肌动蛋白和肌动球蛋白等组成。肌原纤维蛋白具有良好的凝胶能力,可通过热诱导过程形成稳定的凝胶网络结构,决定着肉制品的质构特性。Xiong 等[1]把肌原纤维蛋白加热形成凝胶的过程总结为两步:首先小分子蛋白加热变性,聚合形成长链或支链,其次长链大分子间进行交联聚合,形成三维网状凝胶结构,并具有溶胀或吸收溶剂的能力。影响肌原纤维蛋白理化和凝胶性质的因素有很多,如pH 值、离子强度、离子种类等[2-4]。在肉制品加工中,植物蛋白或多糖等物质经常作为辅料被添加到肉制品中,既可以作为脂肪的替代品保持肉制品的乳化特性,减少脂肪的摄入,促进人体营养均衡,又可以促进肉蛋白形成稳定的凝胶结构,提高肉制品的质构特性和保水性,同时可以有效降低生产成本,现已成为肉制品领域的研究热点。瓜尔胶、黄原胶、卡拉胶等多糖[5-6]经常作为肉制品天然的增稠剂和乳化剂,改善肉类的乳化、凝胶特性,减少肉制品的蒸煮损失,被广泛应用。
可得然胶(CUD)是一种由葡萄糖通过β-(1→3)-糖苷键形成的大分子多糖,它是由微生物(如粪产碱杆菌)产生的水不溶性多糖[7]。可得然胶在国内的研究较少。2012年我国规定可得然胶可作为食品添加剂添加到食品中[8]。由于其独特的热凝胶特性,在食品工业,尤其是在肉制品生产中具有良好的应用,例如Lee 等[9]将可得然胶添加到香肠中,改善了低脂和低盐香肠的保水能力和质构特性。可得然胶还具有良好的稳定性,在不同的加热温度下可形成不同特性的凝胶,将其悬浊液加热到55~65 ℃,冷却后可以得到热可逆的低强度凝胶,这种凝胶的强度较低,重新加热凝胶会融化恢复成原来分散的水溶液状态;将可得然胶悬浊液加热到80 ℃以上时,能够形成牢固并有弹性的热不可逆凝胶[10],在130 ℃以下继续升高温度,凝胶强度继续上升。
本试验以猪肉肌原纤维蛋白为研究对象,建立可得然胶与肌原纤维蛋白共混体系,研究可得然胶对肌原纤维蛋白理化和凝胶性质的影响,为可得然胶在肉制品加工中的应用提供理论基础。
1 材料与方法
1.1 材料与试剂
猪里脊肉,购于北京市物美超市。食品级可得然胶,购于山东国立生物科技有限公司。
1.2 仪器与设备
Synergy H4 酶标仪,美国Bio Tek 公司;TA Discovery DHR-2 流变仪,美国TA 公司;TA-XT Plus 型质构仪,英国Stable Micro Systems 公司;S-8020 电子扫描显微镜,日本Hitachi 公司;NMI20-040H-1 低场核磁共振仪,中国纽迈分析仪器股份有限公司;Nicolet iS10 FTIR 傅里叶变换红外光谱仪,美国赛默飞世尔科技公司;AM-3匀浆机,日本NIHONSEIKI KAISHA。
1.3 试验方法
1.3.1 猪里脊肉中肌原纤维蛋白的提取 参考赵冰等[11]的方法并有所改动,将解冻好的猪里脊肉切小块,将其与4 倍体积磷酸盐缓冲液(0.1 mol/L NaCl,2 mmol/L MgCl2,1 mmol/L EDTA,10 mmol/L Na2HPO4,pH 7.0)混合后高速(10 000 r/min)匀浆60 s,4 ℃冷冻离心10 min,取沉淀,重复上述步骤4 次,最后一次匀浆液用4 层纱布过滤,并用0.1 mol/L HCl 将pH 值调至6.0。滤液4 ℃冷冻离心(15 000×g)10 min,将沉淀4 ℃冷藏保存,保质期为2 d。采用双缩脲法测得肌原纤维蛋白的浓度。
1.3.2 肌原纤维蛋白与可得然胶共混体系的制备 将肌原纤维蛋白用磷酸盐缓冲液 (0.6 mol/L NaCl,2 mmol/L MgCl2,1 mmol/L EDTA,10 mmol/L Na2HPO4,pH 7.0)稀释至20 mg/mL,用稀释好的蛋白溶液将可得然胶质量浓度调整为0,0.2,0.4,0.6,0.8,1.0 mg/mL (可得然胶添加量分别为肌原纤维蛋白浓度的0,1%,2%,3%,4%,5%),使用匀浆机高速匀浆60 s,将二者充分混匀,得到最终的共混体系。
1.3.3 肌原纤维蛋白理化性质的测定
1.3.3.1 表面疏水性的测定 用1-苯胺基-8-萘磺酸盐 (ANS) 作为疏水荧光探针测定表面疏水性[12]。用含有0.6 mol/L NaCl(pH 7.0)的Tris-HCl缓冲液将肌原纤维蛋白溶液稀释至0.1,0.2,0.3,0.4,0.5 mg/mL,用稀释好的蛋白溶液配制不同添加量的CUD-MP 共混体系。各样品分别取5 mL,与25 μL 含8 mmol/L ANS (pH 7.0) 的Tris-HCl缓冲液涡旋混合,黑暗中反应15 min 后,用Synergy H4 BioTek 酶标仪测量ANS 复合蛋白的荧光强度 (激发和发射波长分别为390 nm 和470 nm)。以荧光强度为横坐标,蛋白质浓度为纵坐标,得到的曲线斜率为蛋白质表面疏水性。
1.3.3.2 乳化能力的测定 使用浊度法[13]测定混合乳液的乳化性能。将肌原纤维蛋白溶液的浓度调整为1 mg/mL,使用该蛋白溶液配制不同添加量的CUD-MP 共混体系。取8 mL 混合溶液和2 mL 玉米油用高速匀浆机以10 000 r/min 匀浆1 min。然后取50 μL 距离匀浆杯底部0.5 cm 的混合溶液,并分散到5 mL 0.1% SDS 中。10 min 后重复上述操作。使用紫外可见分光光度计在500 nm处测量吸光度,并将0.1% SDS 溶液用作空白。混合溶液的乳化活性(EAI)和乳化稳定性(ESI)用以下公式表示:

式中:A0 和A10——在0 min 和10 min 时溶液的吸光度;C——肌原纤维蛋白的质量浓度,mg/mL;φ——乳状液的油体积分数,%;dilution——稀释倍数。
1.3.3.3 SDS-PAGE 凝胶电泳 SDS-PAGE 用于分析MP 与不同浓度可得然胶之间的交联。使用12%的分离胶和5%的浓缩胶进行电泳分析。
1.3.4 肌原纤维蛋白凝胶特性的测定
1.3.4.1 流变性的测定 采用TA DHR-2 流变仪测定样品的流变特性。试验参数为:上下板狭缝为1 mm,剪切频率为0.1 Hz,将待测样品从25 ℃加热到95 ℃,升温速率为2 ℃/min。
1.3.4.2 凝胶强度的测定 将肌原纤维蛋白溶于磷酸盐缓冲液(含0.1 mol/L NaCl)中制成溶胶,使其质量浓度达到40 mg/mL,用其配制可得然胶质量浓度分别为0,0.4,0.8,1.2,1.6,2.0 mg/mL 的混合溶胶(可得然胶添加量为肌原纤维蛋白质量浓度的0,1%,2%,3%,4%,5%),匀浆机高速匀浆60 s 使二者混合均匀。将混合液80 ℃水浴加热30 min 后,立即用流水冷却至室温,4 ℃冷藏过夜。
采用配备有P/0.5 型号圆柱探针的TA-XT Plus 型质构仪检测样品的凝胶强度,试验参数为:测试前速度1.0 mm/s;测试速率0.5 mm/s;返回速率10.0 mm/s;触发力5.0 g;测试循环次数1 次;测试距离10 mm,样品测定前需在室温下静置1 h。
1.3.4.3 持水性(WHC) 混合凝胶的持水性通过离心法[14]测定。将凝胶样品装入离心管中,在4 ℃下以4 000×g 离心15 min,称取离心前后的质量。持水性表示为最终质量与离心前质量的百分比。
1.3.4.4 T2 弛豫时间分布情况 参照周凤超等[15]的方法并有所改动。利用NMI20-040H-1 低场核磁共振仪对混合凝胶的水分组成及分布进行分析。将约2 g 的凝胶样品放入15 mm 的核磁管中进行试验。仪器自带分析软件测定凝胶的T2 弛豫时间并进行反演,计算各样品T2 弛豫时间分布以及峰面积比例。
1.3.5 肌原纤维蛋白结构的测定
1.3.5.1 微观结构的测定 根据Jia 等[16]的试验方法观察凝胶的微观结构。将混合凝胶样品在2.5%戊二醛中固定过夜,依次使用30%,50%,70%,80%,90%的乙醇和无水乙醇各脱水10 min。然后将样品冷冻干燥、溅射喷金处理后,通过在20 kV电压下运行的Hitachi S-8020 电子扫描显微镜进行观察、拍照。
1.3.5.2 傅里叶红外光谱二级结构分析 采用Nicolet iS10 FTIR 红外光谱对混合凝胶的二级结构进行分析,并使用MONIC 软件对数据进行傅里叶去卷积处理,分析肌原纤维蛋白α 螺旋、β 折叠、β 转角和无规卷曲等蛋白质二级结构的含量及变化。
1.4 数据统计方法
每个试验重复3 次,做3 次平行,采用SPSS 26 软件进行数据处理,使用Duncan(D)检验数据平均值之间的显著性差异(P<0.05)并进行方差分析(ANOVA),采用Origin 2018 软件进行作图。
2 结果与分析
2.1 肌原纤维蛋白与可得然胶共混体系表面疏水性分析
表面疏水性对于稳定蛋白质三级结构和控制疏水基团在蛋白质分子中的分布起着重要作用[17]。如图1所示,肌原纤维蛋白和可得然胶混合体系的表面疏水性随着可得然胶添加量的增加而显著降低(P<0.05)。通常认为肌原纤维蛋白的结构保持折叠状态,并且疏水性氨基酸嵌入蛋白分子内部。当蛋白质被加热,其天然结构展开,疏水基团暴露[18]。可得然胶存在时,其与暴露出的疏水基团结合,之后,疏水反应导致蛋白质-多糖聚集体的形成,使得表面疏水性降低,提高了肌原纤维蛋白的稳定性。当可得然胶添加量为肌原纤维蛋白浓度的5%时,其占据了共混体系的大部分空间,加热使得可得然胶和蛋白质分子之间相互作用,形成新的分子间化学键,例如氢键作用[19]。有研究表明,肌原纤维蛋白表面疏水性降低的主要原因推测为多糖与蛋白质反应程度的增加和蛋白质的热变性[20]。

图1 可得然胶添加量对肌原纤维蛋白表面疏水性的影响
Fig.1 Influence of curdlan addition on surface hydrophobicity of MP
2.2 肌原纤维蛋白与可得然胶共混体系乳化性分析
图2表示不同添加量的可得然胶对MP 乳化性能的影响,随着可得然胶添加量的增加,共混体系的乳化性能均优于对照组(纯MP)。当可得然胶添加量为肌原纤维蛋白浓度的2%时,共混体系的乳化活性和乳化稳定性显著提高(P<0.05),分别比对照组增加了4.15%和68.2%。可得然胶作为一种稳定剂,具有与疏水性物质结合的能力[21],能够分散到MP 溶液体系中吸水融胀,促进蛋白质和油脂的结合,使共混体系形成更稳定的乳液。同时,可得然胶附着到MP 表面,降低了表面疏水性,改变了肌原纤维蛋白原有的空间位阻,有助于油脂在蛋白周围形成稳定的大分子膜,因此使得MP 的乳化能力显著提高。
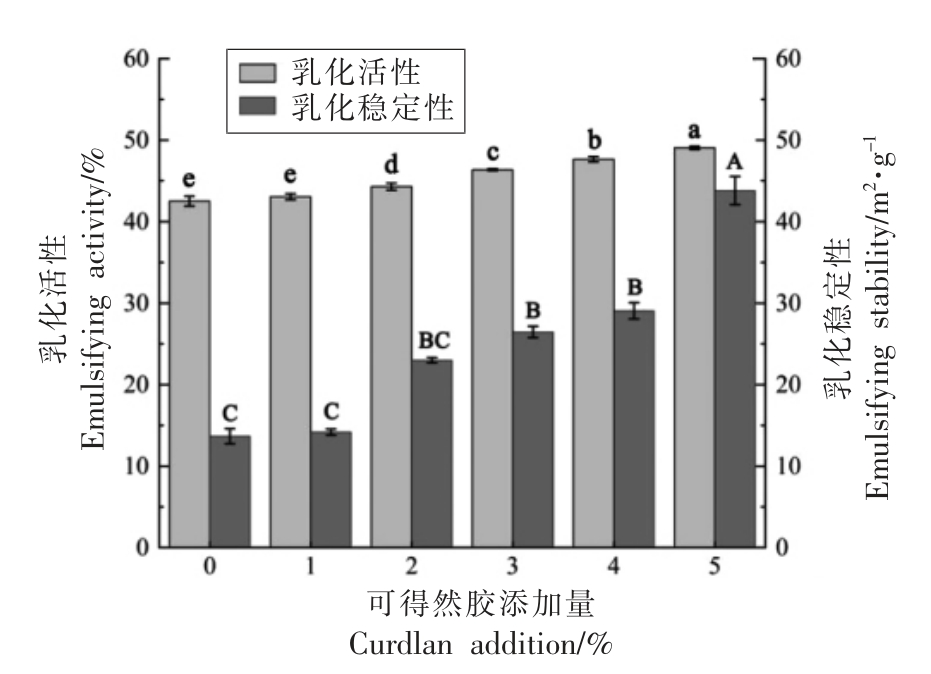
图2 可得然胶添加量对肌原纤维蛋白乳化性的影响
Fig.2 Influence of curdlan addition on emulsifying ability of MP
2.3 肌原纤维蛋白与可得然胶共混体系SDSPAGE 分析
肌原纤维蛋白的理化性质和凝胶特性受到肉类产品中各种蛋白质相互作用的影响。运用SDSPAGE 方法分析共混体系中MP 成分的变化,由图3可知,MP 包含肌球蛋白重链(MHC)和肌动蛋白(Actin)作为主要蛋白质,它们的分子质量分别约为210 ku 和48 ku。随着可得然胶添加量的增加,观察到MHC 带强度几乎没有变化,与Hu 等[22]的研究结果一致。研究人员表明,在蛋白质凝胶化过程中,主要涉及4 种主要的化学键类型:氢键、离子键、疏水相互作用和共价键[23]。由于疏水作用呈减少的趋势,故推测尽管可得然胶对MP 凝胶强度产生了增强作用,但在两者之间仅存在弱键,而这些弱键会被电泳过程中使用的SDS 破坏,所以条带变化并不明显。Choi 等[24]指出,添加某一多糖不会影响肌原纤维蛋白热诱导凝胶的电泳带型。试验结果表明,可得然胶对与MP 凝胶特性的优化不是由于肌球蛋白重链热解产生的疏水片段,而可能是由二者相互作用产生的弱键(例如氢键)引起的。

图3 可得然胶添加量对肌原纤维蛋白交联性的影响
Fig.3 Influence of curdlan addition on MP crosslinking
2.4 肌原纤维蛋白与可得然胶共混体系流变性分析
图4表示不同可得然胶添加量与MP 共混体系的储能模量(G′)变化图。从图中可以看出,对照组(纯MP) 的G′曲线,其转变峰出现在大约55℃,其后G′值迅速下降。这是由于肌球蛋白头部变性而产生的结果,意味着蛋白质网络被破坏,形成弱凝胶网络结构。可得然胶的添加改变了肌原纤维蛋白的动态流变过程,Cardoso 等[25]的研究也证实了这一现象。与对照组相比,G′的值随着可得然胶添加量的增加而增加。尽管可得然胶的存在增加了G′的值,但是G′的整体曲线并未改变。因此,当凝胶形成时,肌原纤维蛋白仍然在复合体系中占主导地位。当加热温度高于60 ℃时,复合体系的G′要显著高于对照组(P<0.05),这表明,可得然胶能够增强MP 的热稳定性。当其添加量为肌原
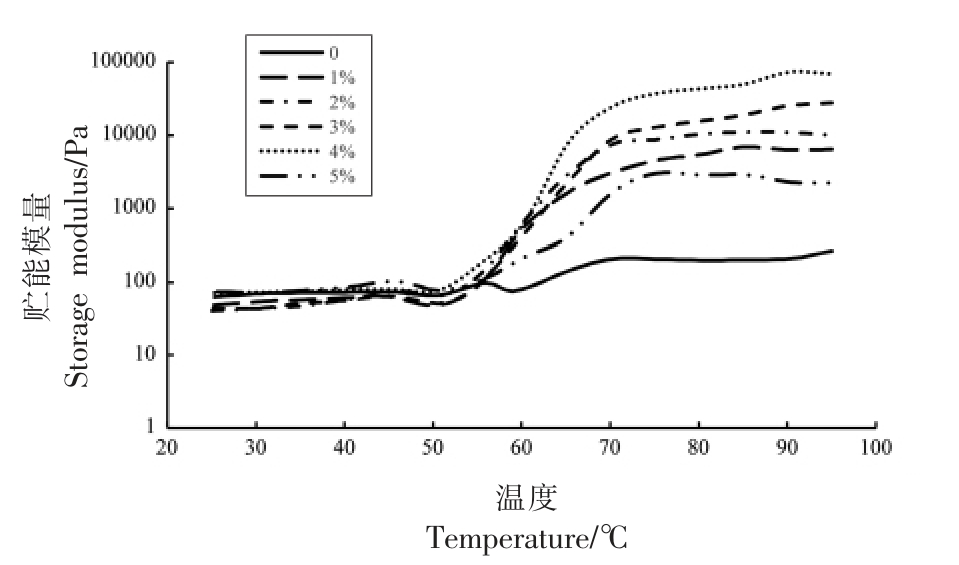
图4 可得然胶添加量对肌原纤维蛋白凝胶储能模量的影响
Fig.4 Influence of curdlan addition on G′ of MP gels
注:由左到右依次为marker、0~5%可得然胶添加量的肌原纤维蛋白样品。纤维蛋白浓度的1%~4%时,可得然胶对凝胶网络的形成有积极作用,而添加肌原纤维蛋白浓度5%比例的可得然胶,则会干扰MP 的共价交联,破坏蛋白质凝胶形成过程而导致较差的凝胶强度[26]。
图5表示不同可得然胶添加量与MP 共混体系的损失模量(G″)变化图。随着温度的升高,对照组G″迅速上升,并在约55 ℃时出现峰值,然后立即在60 ℃下降到最小值,随后温度从60 ℃升高到95 ℃,该值稳定。研究表明,由于可得然胶的增稠作用,提高了MP 凝胶的黏度,在加热形成混合不可逆凝胶时,可得然胶和MP 相邻分子之间存在氢键,也可能提高黏度[27]。但是,当肌原纤维蛋白中可得然胶的添加量增大到蛋白浓度的5%时,其G″值相较于添加了4%蛋白浓度的可得然胶显著下降(P<0.05),这可能由于过量的可得然胶吸水膨胀,导致与MP 结合部分减少,黏度降低。在加热过程中,G′和G″均相对于对照组显著增加(P<0.05),并且G′的增加量远大于G″,这表明弹性是复合凝胶的主要特征。Jiang 等[28]认为,流变性结果可以表示肌原纤维蛋白凝胶的典型特征,与本试验结论一致。
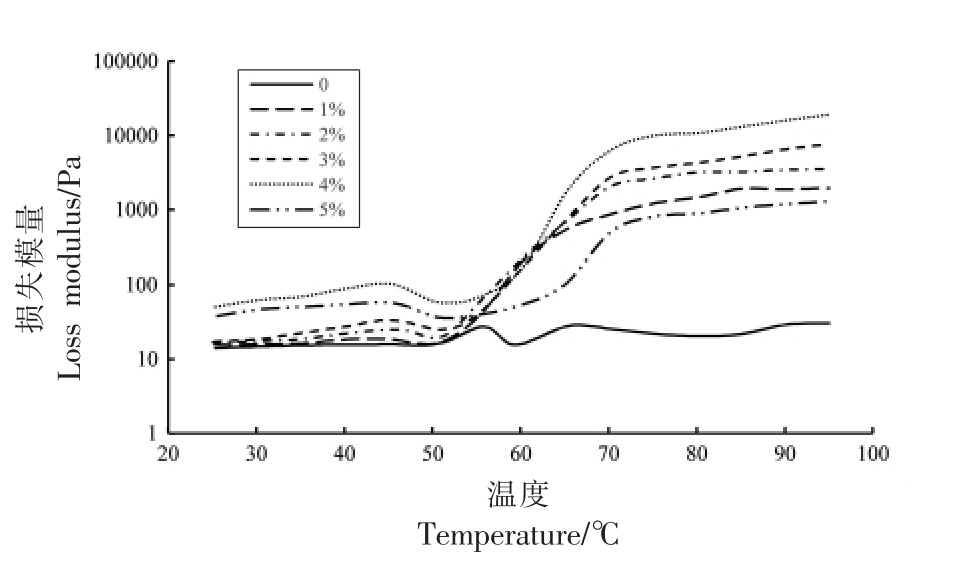
图5 可得然胶添加量对肌原纤维蛋白凝胶损失模量的影响
Fig.5 Influence of curdlan addition on G″of MP gels
2.5 肌原纤维蛋白与可得然胶共混体系凝胶强度分析
凝胶强度通常用于客观评估MP 在形成凝胶时聚集和固定水的能力。图6表示不同可得然胶添加量对MP 凝胶强度的影响。如图,凝胶强度呈先上升后下降的趋势。当可得然胶添加量为肌原纤维蛋白浓度的2%时,混合体系的凝胶强度相较于对照组显著提高(P<0.05)。当添加量为蛋白浓度的4%时,其凝胶强度最大,比对照组提高了235%。在可得然胶添加量为1%~4%的范围内,其与MP 结合不仅能很好地与其中的蛋白质发生相互作用,还能够在加热过程中吸收体系中的游离水,增加复合凝胶网络中的交联密度,从而形成有序且稳定的三维凝胶结构,改善其凝胶特性。但超出蛋白浓度4%的添加量则会产生负面影响,原因一方面可能是可得然胶吸水后加热溶胀并聚集,占据了较大的空间,从而可能导致MP 蛋白失水皱缩[24],使得凝胶强度变差;另一方面,可得然胶分子质量较高,高浓度的可得然胶可能会阻碍MP分子的交联,干扰凝胶的形成从而降低凝胶强度[29]。本试验中凝胶强度的结果与流变性G′结果相符。因此,适量添加可得然胶对于现实的肉类生产具有重要意义。
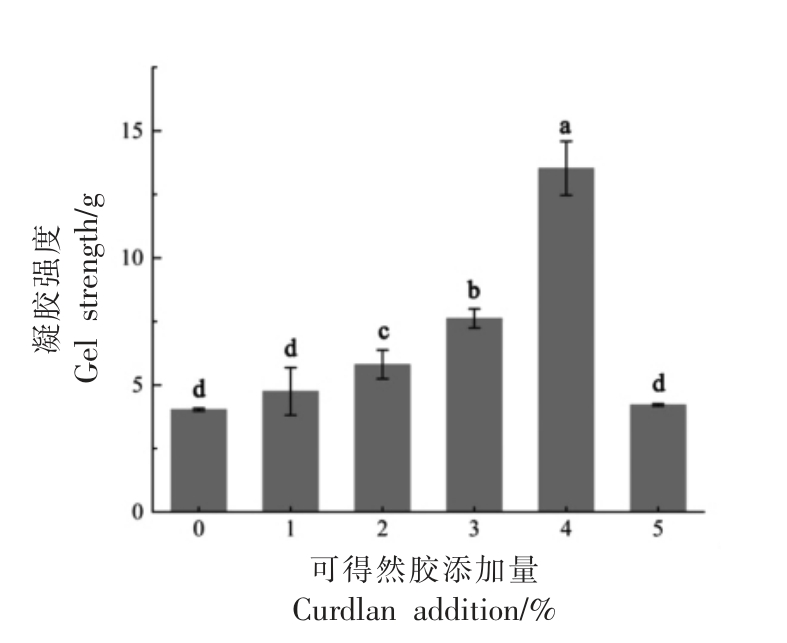
图6 可得然胶添加量对肌原纤维蛋白凝胶强度的影响
Fig.6 Influence of curdlan addition on gel strength
2.6 肌原纤维蛋白与可得然胶共混体系持水性分析
持水性可以表示肌肉在某些特定条件下与水结合的能力,它通常用于评估肉和肉制品的质量。可得然胶对肌原纤维蛋白持水性的影响如图7所示。与对照组凝胶相比,添加肌原纤维蛋白浓度1%的可得然胶能够使得持水性显著增加15%(P<0.05)。随后可得然胶浓度的增加与持水性成正比。但当可得然胶添加量为蛋白浓度的5%时,持水性略微减少却仍比纯MP 高。MP 凝胶的保水能力可能受许多因素影响,包括水合,氢键和疏水相互作用[30]。可得然胶本身的吸水性能可能是影响复合蛋白质体系持水性的一个因素。复合凝胶中持水性的增加表明,可得然胶可能会在加热过程中吸收凝胶网络中的自由水[31],从而可以促进MP和可得然胶之间的相互作用以形成更紧凑的三维网络。但较高浓度可得然胶的稀释作用可能会在一定程度上降低肌原纤维蛋白中水结合位点的数量,从而降低蛋白与水分子之间的结合和相互作用能力,导致持水性略下降。通常,黏度与MP 凝胶的保水性有关[24],本试验中持水性结果与流变性G″结果一致。
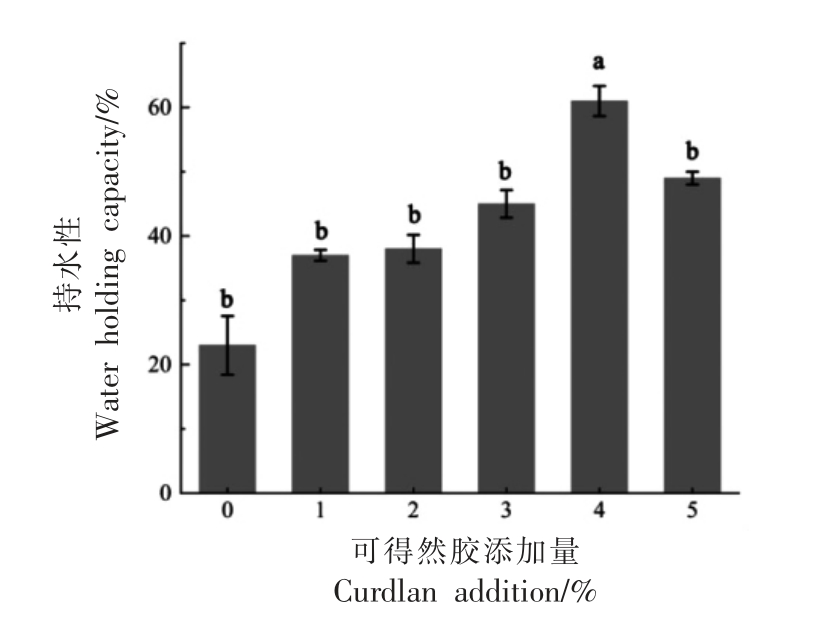
图7 可得然胶添加量对肌原纤维蛋白凝胶持水性的影响
Fig.7 Influence of curdlan addition on water holding capacity
2.7 肌原纤维蛋白与可得然胶共混体系水分组成及分布情况
利用低场核磁共振能够分析可得然胶-肌原纤维蛋白复合体系内的水分分布和迁移情况[32]。图8表示肌原纤维蛋白典型T2 弛豫时间分布图,4 个峰出现的时间分别0.1~1 ms (T2b)、1~100 ms(T21)、100~1 000 ms(T22)、1 000~10 000 ms(T23),由于第2 和第3 个峰的弛豫时间相近,故4 个峰分别代表凝胶中的3 种不同状态,即结合水、不易流动水和自由水,与韩芳蕊等[33]的研究结果一致。

图8 肌原纤维蛋白凝胶典型T2 弛豫时间分布图
Fig.8 Typical distribution of T2 relaxation time in MP gels
由表1可见:可得然胶添加量为蛋白浓度的1%~4%时,混合凝胶中T21、T22 弛豫时间均显著下降(P<0.05)。Gravelle 等[34]的研究表示,T2 弛豫时间表明物质与其周围化学环境的相互作用程度,其中较短的弛豫时间表明交换过程更快,相互作用也更强。试验结果说明可得然胶的存在稳定了混合体系的水分分布,使得MP 与可得然胶相互作用增强,不易流动水分子的移动性降低。但当可得然胶添加量为蛋白浓度的5%时,混合凝胶中T21、T22、T23 弛豫时间增加但相比对照组不显著(P>0.05),其原因可能是过量的可得然胶吸水膨胀,使得肌原纤维蛋白分子间的距离增加,水分更多得以自由水的形式表现出来。Han 等[35]的研究证明,NMR 结果与持水性结果具有正相关性,与本试验的研究结果相符。
表1 可得然胶添加量对肌原纤维蛋白凝胶T2 弛豫时间的影响
Table 1 Effect of addition of curdlan on T2 relaxation time of myofibrillar protein gel

注:同列小写字母不同表示差异显著(P<0.05),下同。
可得然胶添加量/% T2b/ms T21/ms T22/ms T23/ms 0 0.32±0.07a 30.78±4.23a 204.33±2.99a 527.5±0.03d 1 0.20±0.05a 19.34±1.43b 174.58±2.47b 1 096.08±23.27c 2 0.17±0.03a 15.88±0.90c 156.17±5.65c 1 844.27±32.57a 3 0.15±0.05a 12.37±1.31d 131.97±0.76d 1 672.50±49.52b 4 0.10±0.04a 10.58±0.99d 86.20±0.10e 1 418.71±96.01c 5 0.14±0.04a 27.65±.2.22a 171.30±4.90b 1 283.58±283.13c
峰面积百分比可以表示不同试验条件下某状态水分所占的比例,从而推断水分的迁移情况[36]。由表2可知:纯MP 凝胶的不易流动水占比最高,这是因为在加热条件下,肌原纤维蛋白发生变性交联聚集,并与水分子发生相互作用,形成了三维网络结构,自由水在此网络结构中转化成不易流动水,被固定在凝胶体系中。随着可得然胶添加量的增加,T2b 峰面积比例(P2b)和对照组相比变化不显著(P>0.05)且其占峰面积的比例很小,因此持水性的变化与该水分关系不大;P22 先显著上升(P<0.05),当可得然胶添加量为5%时,该值又下降;P23 的变化趋势和P22 相反。结果表明,可得然胶的存在使得混合体系中的自由水向不易流动水转化。Li 等[37]认为P22 的增加即水分从肌原纤维蛋白外部迁移到凝胶网络结构中,使得持水性得到改善。
表2 可得然胶添加量对猪肉肌原纤维蛋白凝胶T2 弛豫时间峰面积百分比的影响
Table 2 Effect of addition of curdlan on the percentage of the T2 relaxation time peak area of myofibrillar protein
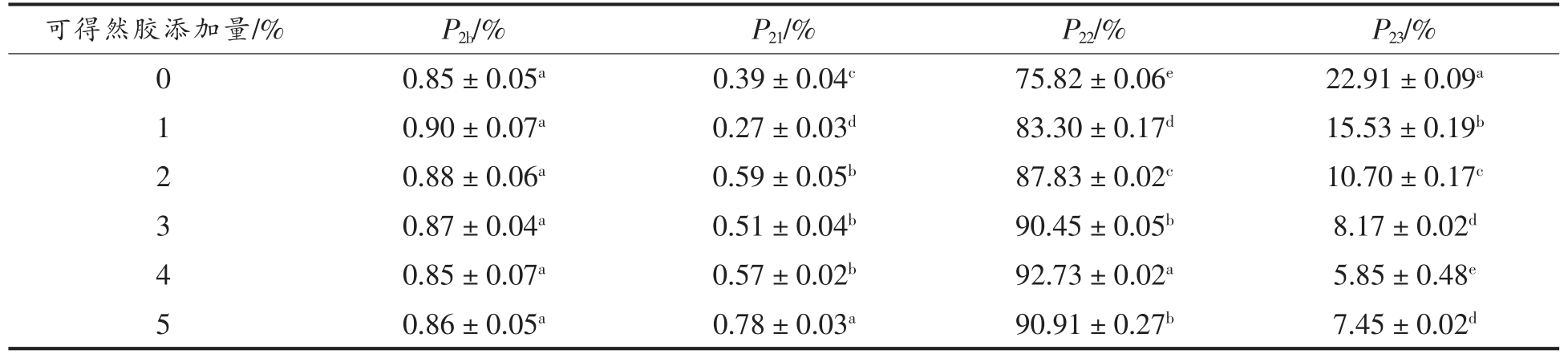
可得然胶添加量/% P2b/% P21/% P22/% P23/%0 0.85±0.05a 0.39±0.04c 75.82±0.06e 22.91±0.09a 1 0.90±0.07a 0.27±0.03d 83.30±0.17d 15.53±0.19b 2 0.88±0.06a 0.59±0.05b 87.83±0.02c 10.70±0.17c 3 0.87±0.04a 0.51±0.04b 90.45±0.05b 8.17±0.02d 4 0.85±0.07a 0.57±0.02b 92.73±0.02a 5.85±0.48e 5 0.86±0.05a 0.78±0.03a 90.91±0.27b 7.45±0.02d
2.8 肌原纤维蛋白与可得然胶共混体系微观结构分析
利用扫描电子显微镜检测样品的分子结构,如图9所示,纯MP 凝胶(a)显示出粗糙的三维结构,该三维结构是由较大体积的蛋白质聚集体交联形成的。在这种条件下,其凝胶强度和持水能力较低。当添加可得然胶后,可得然胶分子分布在蛋白质凝胶基质中,与蛋白互相缠绕,使得蛋白分子之间的孔径变小,形成了相对坚固的混合三维结构,从而提高了凝胶强度。添加肌原纤维蛋白浓度4%可得然胶的样品(e)孔径最小,分子最均匀细致,与蛋白质交联最为明显,说明其与水结合的能力也最强,与本试验持水性结果一致。Chantrapornchai 等[38]证明,具有相对较小孔隙的网络结构表现出较高的持水能力。可得然胶作为一种膳食纤维多糖对增强肉制品功能方面起着关键作用,作为鸭肌肉凝胶中的脂肪替代物能够增加鸭肉的质构特性[39]。除此之外,可得然胶由于其良好的胶凝特性,可作为一种凝胶增强剂来弥补猪肉肌原纤维蛋白凝胶质地较差的情况[40]。

图9 可得然胶添加量对肌原纤维蛋白微观结构的影响
Fig.9 Influence of curdlan addition on MP microstructure
注:a~f 表示不同可得然胶添加量(0,1%,2%,3%,4%,5%)的肌原纤维蛋白样品。
2.9 肌原纤维蛋白与可得然胶共混体系二级结构分析
不同可得然胶添加量对MP 二级结构的影响如表3所示。由表可知,β 折叠在二级结构中占比最大,是维持可得然胶和肌原纤维蛋白凝胶复合体系的主要二级结构,可能由于蛋白质加热形成凝胶的过程中,α 螺旋和β 转角转化为β 折叠。此外,随着可得然胶添加量的增加,α 螺旋呈现先下降后上升的趋势,王未君[41]的研究表明,蛋白质二级结构α 螺旋的比重提高,有利于蛋白凝胶持水性的增强。本试验结果说明可得然胶的存在可能对蛋白质天然二级结构具有保护作用。
表3 可得然胶-肌原纤维蛋白共混体系二级结构分析
Table 3 Analysis of the secondary structure of curdlan-myofibrillar protein mixed system
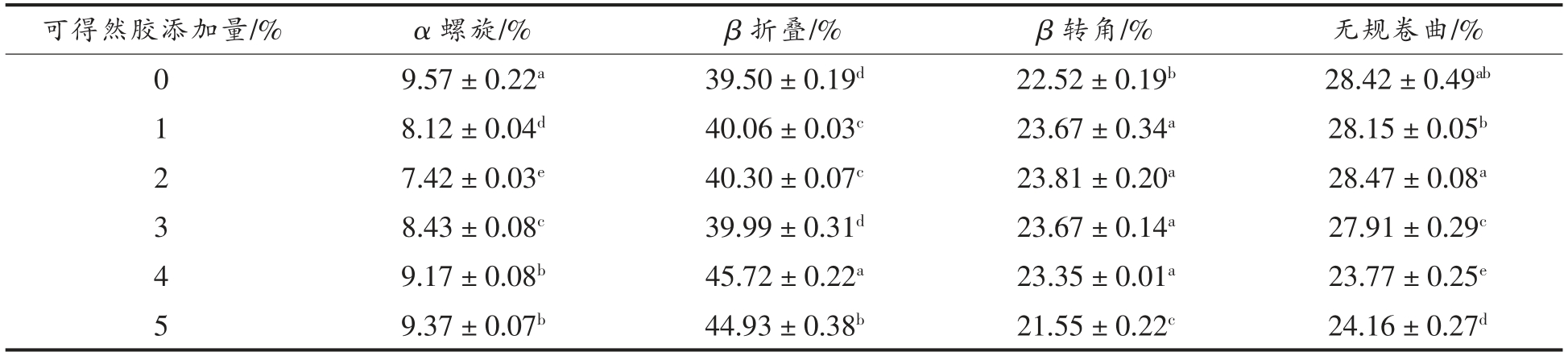
?
3 结论
可得然胶的添加降低了肌原纤维蛋白的表面疏水作用,提高了MP 的乳化能力。在可得然胶添加量为肌原纤维蛋白浓度的1%~4%时,加热成胶的过程其能够吸收共混体系中的自由水,转化成不易流动水,使MP 形成更加致密的三维网络结构,增强MP 的凝胶强度,改善持水性。并且可得然胶能够保护MP 的二级结构,提高MP 的热稳定性。

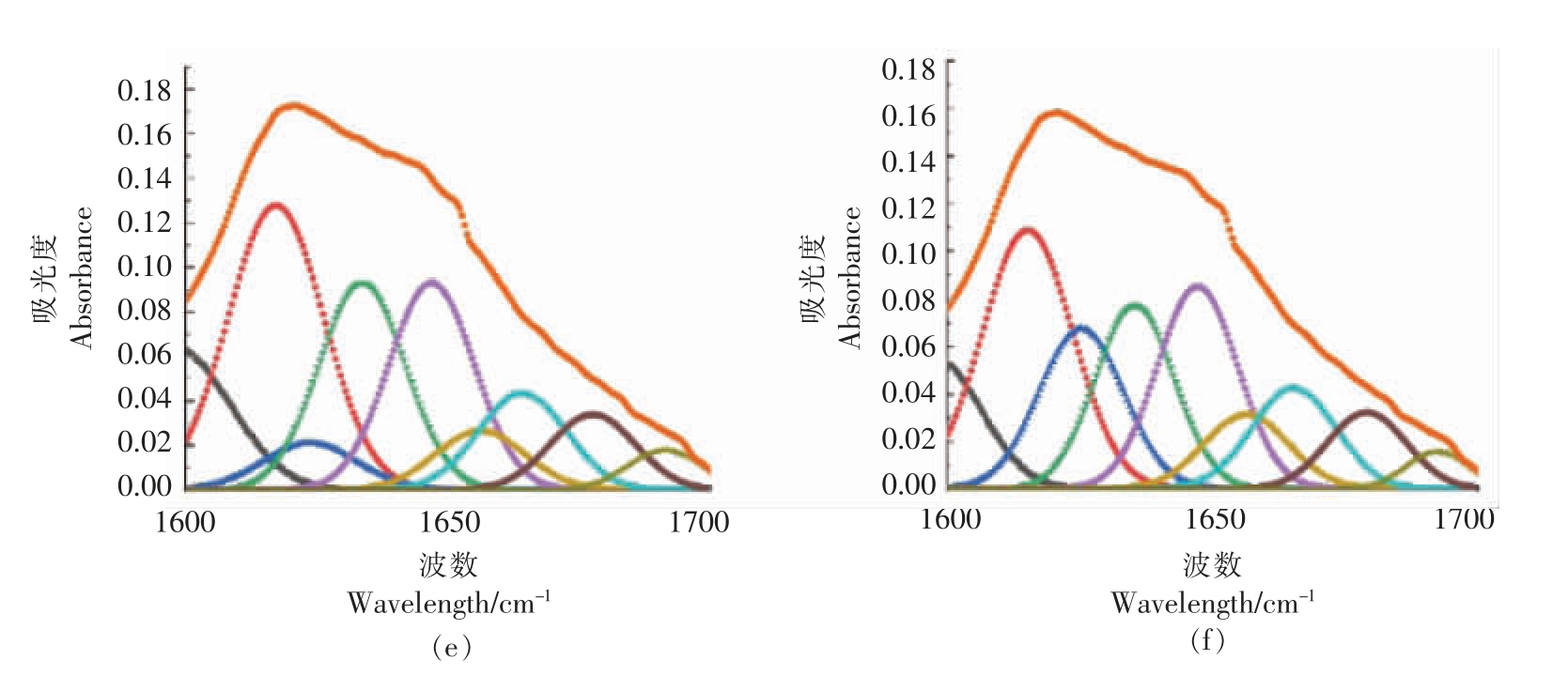
图10 可得然胶添加量对肌原纤维蛋白二级结构的影响
Fig.10 Effect of addition of curdlan on the secondary structure of myofibrillar protein
注:a~f 表示不同可得然胶添加量(0,1%,2%,3%,4%,5%)的肌原纤维蛋白样品。
通过研究发现,可得然胶可以与肌原纤维蛋白形成稳定的共混体系,通过热诱导作用形成稳定的凝胶特性,从而提高肉制品的质构品质。目前,可得然胶在肉制品中的应用与其它多糖相比还较少,研究可得然胶与肌原纤维蛋白共混体系凝胶形成机理可以从微观层面阐述可得然胶对肉制品质构提升的作用,为可得然胶在肉制品中的进一步推广奠定基础。
[1]XIONG Y L,BLANCHARD S P,OOIZUMI T,et al.Hydroxyl radical and ferryl-generating systems promote gel network formation of myofibrillar protein[J].Journal of Food Science,2010,75(2):215-221.
[2]潘丽华.不同理化条件下亚麻籽胶对肌原纤维蛋白凝胶特性的影响[D].南京:南京农业大学,2016.
PAN L H.Effect of flaxseed gum on thermal gelling properties of porcine myofibrillar protein at different physicochemical conditions[D].Nanjing:Nanjing Agricultural University,2016.
[3]李德阳,侯雅文,黄颖,等.NaCl 对大菱鲆肌原纤维蛋白特性的影响[J].食品科学,2018,39(16):61-67.
LI D Y,HOU Y W,HUANG Y,et al.Effect of NaCl on properties of myofibrillar protein from turbot(Scophthalmus maximus)[J].Food Science,2018,39(16):61-67.
[4]姜国川,王丽岩,刘亚春,等.改性处理对猪肌原纤维蛋白结构及凝胶特性的影响[J].食品科学,2019,40(19):89-95.
JIANG G C,WANG L Y,LIU Y C,et al.Effect of modification on the structure and gel properties of porcine myofibrillar protein[J].Food Science,2019,40(19):89-95.
[5]费立天.瓜尔胶、黄原胶乳化液性质研究及对肌原纤维蛋白乳化性和凝胶性的影响[D].扬州:扬州大学,2018.
FEI L T.Study on the properties of guar and xanthan gum emulsion and its effect on emulsifying property and gelation of myofibrillar protein [D].Yangzhou:Yangzhou University,2018.
[6]VERBEKEN D,NEIRINCK N,MEEREN P V D,et al.Influence of κ-carrageenan on the thermal gelation of salt-soluble meat proteins[J].Meat Science,2005,70(1):161-166.
[7]HARADA T.Special bacterial polysaccharides and polysaccharases[J].Biochemical Society Symposium,1983,48:97-116.
[8]中华人民共和国卫生部.食品安全国家标准 食品添加剂 可得然胶:GB 28304-2012[S].北京:中国标准出版社,2012:8.
Ministry of Hygiene,Peoples' Republic of China.State criteria for food safety Food additive Curdlan:GB 28304-2012[S].Beijing:Standards Press of China,2012:8.
[9]LEE C H,CHIN K B.Evaluation of various salt contents on quality characteristics with or without curdlan of pork myofibrillar protein gels and the development of low-salt pork sausages[J].International Journal of Food Science & Technology,2019,54(2):550-557.
[10]FUNAMI T,YADA H,NAKAO Y.Thermal and rheological properties of curdlan gel in minced pork gel[J].Food Hydrocolloids,1998,12(1):55-64.
[11]赵冰,李素,张顺亮,等.蛋白氧化对肌原纤维蛋白凝胶构效关系的影响[J].食品科学,2018,39(3):55-61.
ZHAO B,LI S,ZHANG S L,et al.Effect of protein oxidation on the structure-activity elationship of myofibrillar protein gels[J].Food Science,2018,39(3):55-61.
[12]WANG S X,ZHANG Y M,CHEN L,et al.Dosedependent effects of rosmarinic acid on formation of oxidatively stressed myofibrillar protein emulsion gel at different NaCl concentrations[J].Food Chemistry,2018,243(15):50-57.
[13]XU Y J,DONG M,TANG C B,et al.Glycationinduced structural modification of myofibrillar protein and its relation to emulsifying properties[J].Lwt-Food Science and Technology,2020,117 (5):108664.
[14]杜洪振,陈倩,杨振,等.预热处理大豆蛋白对鲤鱼肌原纤维蛋白凝胶和流变学特性的影响[J].食品科学,2019,40(12):55-61.
DU H Z,CHEN Q,YANG Z,et al.Effect of preheated soy proteins on gelling and rheological properties of common carp myofibrillar protein[J].Food Science,2019,40(12):55-61.
[15]周凤超,林国荣,汪秀妹,等.改性马铃薯淀粉对肌原纤维蛋白凝胶特性的影响[J].食品科学,2020,41(4):86-95.
ZHOU F C,LIN G R,WANG X M,et al.Influence of modified potato starch on gelation properties of myofibrillar protein[J].Food Science,2020,41(4):86-95.
[16]JIA N,WANG L T,SHAO J H,et al.Changes in the structural and gel properties of pork myofibrillar protein induced by catechin modification[J].Meat Science,2017,127:45-50.
[17]LI F F,WANG B,LIU Q,et al.Changes in myofibrillar protein gel quality of porcine longissimus muscle induced by its stuctural modification under different thawing methods[J].Meat Science,2019,147:108-115.
[18]TARTAGLIA G G,CAVALLI A,PELLARIN R,et al.The role of aromaticity,exposed surface,and dipole moment in determining protein aggregation rates[J].Protein Science,2010,13(7):1939-1941.
[19]WANG Z J,LI Y,JIANG L Z,et al.Relationship between secondary structure and surface hydrophobicity of soybean protein isolate subjected to heat treatment[J].Journal of Chemistry,2014,2014:1-10.
[20]NASROLLAHZADEH F,VARIDI M,KOOCHKI A,et al.Effect of microwave and conventional heating on structural,functional and antioxidant properties of bovine serum albumin-maltodextrin conjugates through Maillard reaction[J].Food Research International,2017,100:289-297.
[21]WONG S S,NGIAM Z R J,KASAPIS S,et al.Novel sulfation of curdlan assisted by ultrasonication[J].International Journal of Biological Macromolecules,2010,46(3):385-388.
[22]HU Y Q,LIU W J,YUAN C H,et al.Enhancement of the gelation properties of hairtail (Trichiurus haumela) muscle protein with curdlan and transglutaminase[J].Food Chemistry,2015,176:115-122.
[23]YONGSAWATDIGUL J,CARVAJAL P,LANIER T C.Surimi Gelation Chemistry[M].Florida:CRC Press,2005.
[24]CHOI Y S,CHOI J H,HAN D J,et al.Effects of rice bran fiber on heat-induced gel prepared with pork salt-soluble meat proteins in model system[J].Meat Science,2011,88(1):59-66.
[25]CARDOSO C,RIBEIRO B,MENDES R.Effects of dietary fibre and microbial transglutaminase addition on the rheological and textural properties of protein gels from different fish species[J].Journal of Food Engineering,2012,113(4):520-526.
[26]LI Q R,WANG P S,MIAO S,et al.Curdlan enhances the structure of myosin gel model[J].Food Science & Nutrition,2019,7(6):2123-2130.
[27]AZARIKIA F,ABBASI S.Mechanism of soluble complex formation of milk proteins with native gums(tragacanth and Persian gum)[J].Food Hydrocolloids,2016,59:35-44.
[28]JIANG J,XIONG Y L.Extreme pH treatments enhance the structure-reinforcement role of soy protein isolate and its emulsions in pork myofibrillar protein gels in the presence of microbial transglutaminase[J].Meat Science,2013,93(3):469-476.
[29]TAKAHASHI F,HARADA T,KOREEDA A,et al.Structure of curdlan that is resistant to (1→3)β-DGlucanase[J].Carbohydrate Polymers,1986,6(6):407-421.
[30]WU C H,YUAN C H,CHEN S G,et al.The effect of curdlan on the rheological properties of restructured ribbonfish (Trichiurus spp.) meat gel[J].Food Chemistry,2015,179:222-231.
[31]WEI Y,ZHANG T,YU F Q,et al.Effects of curdlan on the texture and structure of Alaska pollock surimi gels treated at 120 ℃[J].International Journal of Food Properties,2018,21(1):1778-1788.
[32]GROSSI A,OLSEN K,BOLUMAR T,et al.The effect of high pressure on the functional properties of pork myofibrillar proteins [J].Food Chemistry,2016,196:1005-1015.
[33]韩芳蕊,陈涵,王霖,等.甘薯膳食纤维对肌原纤维蛋白保水性和凝胶特性的影响[J].南京农业大学学报,2019,42(5):932-939.
HAN F R,CHEN H,WANG L,et al.Effect of sweet potato dietary fiber on water holding capacity and gelling properties of myofibrillar proteins[J].Journal of Nanjing Agricultural University,2019,42(5):932-939.
[34]GRAVELLE A J,MARANGONI A G,BARBUT S.Insight into the mechanism of myofibrillar protein gel stability:Influencing texture and microstructure using a model hydrophilic filler[J].Food Hydrocolloids,2016,60:415-424.
[35]HAN M Y,WANG P,XU X L,et al.Low-field NMR study of heat-induced gelation of pork myofibrillar proteins and its relationship with microstructural characteristics[J].Food Research International,2014,62:1175-1182.
[36]PEARCE K L,ROSENVOLD K R,ANDERSEN H J,et al.Water distribution and mobility in meat during the conversion of muscle to meat and ageing and the impacts on fresh meat quality attributes-A review[J].Meat Science,2011,89(2):111-124.
[37]LI C L,PENG A,HE L C,et al.Emulsifying properties development of pork myofibrillar and sacroplasmic protein irradiated at different dose:A combined FT-IR spectroscopy and low-field NMR study[J].Food Chemistry,2018,252:108-114.
[38]CHANTRAPORNCHAI W,MCCLEMENTS D J.Influence of NaCl on optical properties,large-strain rheology and water holding capacity of heat-induced whey protein isolate gels [J].Food Hydrocolloids,2002,16(5):467-476.
[39]CHEN C G,WANG R,SUN G J,et al.Effects of high pressure level and holding time on properties of duck muscle gels containing 1% curdlan[J].Innovative Food Science & Emerging Technologies,2010,11(4):538-542.
[40]CAI Z X,ZHANG H B.Recent progress on curdlan provided by functionalization strategies[J].Food Hydrocolloids,2017,68:128-135.
[41]王未君.多糖对瘦肉丸及肌原纤维蛋白特性影响的研究[D].无锡:江南大学,2014.
WANG W J.The effect of polysaccharide on the characteristics of lean pork meatballs and myofibrillar protein[D].Wuxi:Jiangnan University,2014.