油茶(Camellia oleifera Abel)是山茶科山茶属常绿灌木或中乔木,为中国特有木本油料树种,与油橄榄、油棕、椰子并称为世界四大木本油料植物[1]。茶油是由油茶籽加工提炼得到的一种颜色透明、色泽较浅、气味芳香的植物油,是一种优质的食用油。茶油的脂肪酸组成与橄榄油相似,也是唯一能与橄榄油媲美的植物油,素有“东方橄榄油”之称[2]。茶油具有多种药理活性和食疗价值,可以调节血脂,降低胆固醇含量,高含量的不饱和脂肪酸可以起到清除组织中自由基的作用,对紫外线具有较强的吸收能力,可以减少色素沉积,起到抗衰老的功效[3-4]。DHA 是大脑皮质、中枢神经系统和视网膜的重要构成成分,在体内水平的高、低直接影响脑细胞的增殖、神经传导、突触的生长和发育,它可以防治心脑血管疾病,并具有提高智力及保护视网膜的作用[5-6]。近年来,国家大力发展油茶种植产业,茶油的综合利用得到人们的关注,然而,目前主要作为食用油,深度加工产品开发利用不足,产品形式单一。本文采用茶油为基础原料,通过添加DHA 藻油研发一种茶油配方,以无特定病原体(Specific Pathogen Free,SPF)级初断乳昆明小鼠为试验对象,研究含不同剂量DHA 藻油的茶油对小鼠空间和学习记忆能力、组织发育和脑组织生化指标的影响,为DHA 藻油在茶油中的应用提供科学依据。
1 材料与方法
1.1 材料与试剂
茶油,六安市山美生物科技有限公司;DHA藻油(DHA 含量为40%),嘉必优生物技术股份有限公司;4%多聚甲醛,赛维尔生物科技有限公司;鱼油软胶囊(DHA 含量为15%),汤臣倍健股份有限公司;生理盐水,上海康宁药业有限公司;MDA(丙二醛)试剂盒、T-AOC(总抗氧化能力)试剂盒、CAT(过氧化氢酶)试剂盒、A-ChE(乙酰胆碱酯酶)试剂盒、TP(总蛋白)试剂盒,南京建成生物技术有限公司。
SPF 级雄性初断乳昆明小鼠,体重(18.62±1.23)g,购自安徽医科大学实验动物中心。实验室室温控制在(24±2)℃,相对湿度50%~60%,光照12/24 h,适应性饲养1 周后用于试验。其中,每天将1 粒鱼油软胶囊取出内容物于10 mL 离心管中,准确添加1.5 mL 蒸馏水超声成乳液用于动物实验。含DHA 藻油的茶油制备工艺:在40 ℃条件下,将不同剂量的DHA 藻油与茶油混合置于烧杯中,于200 r/min 均匀搅拌10 min,取样进行动物实验。分组与饲食配方如表1所示。
表1 小鼠试验分组及饲食配方
Table 1 Groups and formulas of mice experiments

注:-表示空白。
?
在喂养时间为4 周时,通过随机数字法从每组中随机选择5 只小鼠,进行Morris 水迷宫行为学测试。
1.2 仪器与设备
JAG135 电子天平,梅特勒-托利多仪器上海有限公司;3K15 低温冷冻离心机,美国Sigma 公司;BSG-26 电热恒温水浴锅,上海一恒科学仪器有限公司;BCD-221L 超低温冰箱,江苏美菱冰箱有限公司;C2201 超声波清洗器,上海杰理科技有限公司;UV-1600 紫外可见分光光度计,北京瑞利分析仪器公司;Leica EG1150H 石蜡包埋机、Leica RM2235 组织切片机,德国徕卡公司。
1.3 测定方法
1.3.1 Morris 水迷宫实验 Morris 水迷宫(Morris water maze MWM)实验是用来研究小鼠空间记忆能力和学习能力的装置,由英国心理学家Morris在20世纪80年代初进行设计[7]。包括圆形水池、自动录像记录系统、图像采集和分析软件4 个部分。池壁标注4 个入水点并将其均分为4 个象限,随机选择1 个象限中央作为平台放置点。利用啮齿动物在水中逃避的行为表现一种学习能力,通过向水中平台游往的行为体现空间记忆能力。试验总历时6 d,共两个阶段[8]:
1)定位航行实验 (Place navigation) 训练开始时将平台放置在一个固定象限,再将小鼠依次从池壁4 个象限的起始点面对池壁放入水池,从刚入水时启动计时,到找到平台的这段时间被称为逃避潜伏期(Escape lateney)。当小鼠爬上平台,使其停留15 s,若在100 s 时间内没有找到平台,那么试验者就将其引导到平台上,逃避潜伏期记录为100 s,记录4 次训练的平均值作为当天逃避潜伏期。汇总数据后将第5 天的逃避潜伏期作为最终成绩研究小鼠的学习记忆能力。
2)空间探索实验 (Spastial probe) 在实验进行的第6 天移开平台,将小鼠从距离原先平台位置对立象限的池壁处放入水中,开始进行空间探索实验。记录小鼠在100 s 内穿过原先平台位置的次数,用来考查小鼠的空间记忆能力。
1.3.2 脑组织苏木精-伊红 (Hematoxylin-eosin HE)染色 在解剖的过程中,即刻提取各组别小鼠的大脑组织,用4%多聚甲醛固定,放在冰箱保存备用[9]。操作步骤如下:
1)石蜡切片脱蜡至水 依次将切片放入二甲苯Ⅰ20 min-二甲苯Ⅱ20 min-无水乙醇Ⅰ5 min-无水乙醇Ⅱ5 min-75%酒精5 min,自来水洗。
2)苏木素染色 切片入苏木素染液染3~5 min,自来水洗,分化液分化,自来水洗,返蓝液返蓝,流水冲洗。
3)伊红染色 切片依次入85%、95%的梯度酒精脱水各5 min,入伊红染液中染色5 min。
4)脱水封片 切片依次放入无水乙醇I 5 min-无水乙醇II 5 min-无水乙醇Ⅲ5 min-二甲Ⅰ5 min-二甲苯Ⅱ5 min 透明,中性树胶封片。
5)显微镜镜检,图像采集分析 细胞核呈蓝色,细胞质呈红色。
1.3.3 海马组织尼氏染色 水迷宫实验后,各组小鼠麻醉后解剖,取出各组别小鼠的大脑组织,用4%多聚甲醛固定,将冠状面切片[10]。具体操作步骤如下:
1)石蜡切片脱蜡至水 依次将切片放入二甲苯Ⅰ20 min-二甲苯Ⅱ20 min-无水乙醇Ⅰ5 min-无水乙醇Ⅱ5 min-75%酒精5 min,自来水洗。
2)甲苯胺蓝染色 组织切片入染液 2~5 min,水洗,0.1%的冰醋酸稍分化,自来水洗终止反应,显微镜下控制分化程度,自来水洗后,将切片置于烤箱烤干。
3)透明封片 切片入干净的二甲苯透明10 min,中性树胶封片。
4)显微镜镜检,图像采集分析 脑组织尼氏体呈深蓝色,背景淡蓝色。
1.3.4 视网膜过碘酸-雪夫 (Periodic acid-schiff PAS)染色 在解剖的过程中,即刻提取小鼠各组的眼睛组织,用4%多聚甲醛固定,放在冰箱保存备用[11]。具体操作步骤如下:
1)取材 取视神经功能正常的小鼠眼球,用4%多聚甲醛固定12 h 以上。
2)剥离 从4%多聚甲醛中取出眼球,用PBS 洗涤除去固定液,再放入盛有PBS 溶液的培养皿中。将眼球取出,用食指和拇指夹住眼球,用针头扎使房水流出,剪开虹膜后轻轻剥出角膜和晶状体,再浸入PBS 溶液之中漂洗后均匀分成3~4 份,用镊子剥离出视网膜层后在PBS 溶液中浸洗一段时间。
3)消化 用粗口玻璃吸管吸出步骤2 中的视网膜,放入装有胰酶消化液玻璃小瓶中,于37℃烤箱过夜消化,时间22~24 h。
4)吹打 采用粗口玻璃吸管,吸出1 瓣视网膜,放入装满纯水的培养皿中,吹打视网膜几次,转入装有热水的培养皿中,再去除黏附细胞直至呈现透明状。
5)铺片 用玻璃吸管吸取透明的视网膜血管网,使血管网完全展开在玻片上,自然晾干。
6)PAS 染色 视网膜毛细血管呈红色,细胞核呈蓝色。
1.3.5 脑组织MDA、T-AOC、CAT 和A-ChE 测定方法 从冰柜中取出脑组织解冻,准确称取0.1 g,按1∶9(质量体积比)加入生理盐水,置于高速匀浆机内充分研磨使细胞破碎,所得匀浆在3 500 r/min 离心10 min,取上清液参照试剂盒上的方法进行操作[12]。TP 总蛋白采用考马斯亮蓝法试剂盒检测,各组通过TP 进行归一化处理。
1.4 数据处理
用SPSS22.0 软件作单因素方差分析,结果用平均数±标准差表示,并用origin 9.0 软件进行绘图。当P<0.05 时,差异性显著,当P<0.01,差异性极显著。
2 结果与分析
2.1 Morris 水迷宫实验结果
从图1可知,含DHA 藻油的茶油低、中、高剂量组小鼠的逃避潜伏期分别从空白组的(26.47±1.6)s 缩短到(14.77±1.94)s(P<0.01)、(12.13±2.17)s(P<0.01)和(14.03±2.05)s(P<0.01),中剂量组相对于阴性组具有极显著差异(P<0.01);阳性对照组的逃避潜伏期缩短至(16.99±1.16)s(P<0.01),与阴性组相比具有显著性差异(P<0.05)。从图中可知,阴性组相较于空白组,逃避潜伏期缩短,穿越平台次数增加,均具有显著性(P<0.05)。这是因为茶油具有良好的抗氧化能力,可以清除脑组织中的自由基,长期食用可以起到保护脑细胞的效果,有利于增强记忆力,这与参考文献[3]中的结论一致。其中,中剂量组的小鼠跨越平台次数从空白组的(2.87±0.47)增加到(9.67±1.94)(P<0.01),阴性组与空白组相比具有显著性差异(P<0.05),阳性组和茶油低、高剂量组相较于空白组具有极显著性差异(P<0.01),并且中剂量组相比阴性组具有极显著性差异(P<0.01)。上述结果表明,与空白组相比,阳性组和茶油各剂量组小鼠的逃避潜伏期均呈现下降趋势(P<0.05,P<0.01),茶油组随着剂量的增加,逃避潜伏期明显缩短,穿越平台次数增加。但高剂量组的效果不及中剂量组,说明适当的DHA 藻油剂量范围内的茶油摄入可以增强小鼠的学习记忆能力和空间记忆能力,过量的DHA 藻油的茶油摄入反而不具有良好的效果。
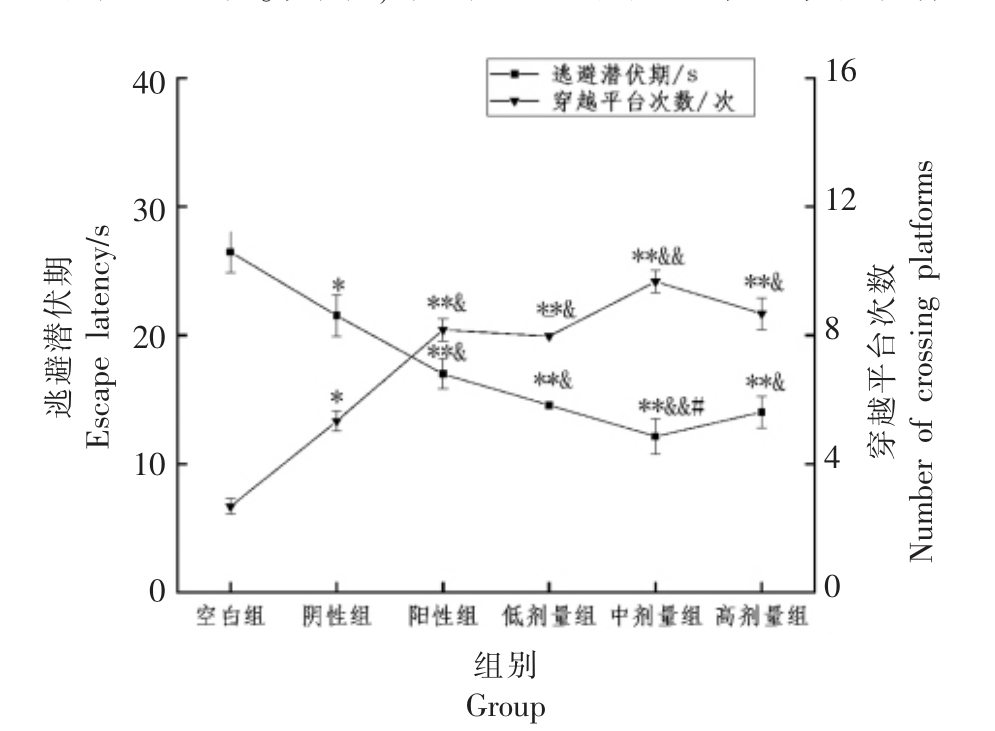
图1 各组别小鼠逃避潜伏期和穿越平台次数
Fig.1 Escape latency and number of crossing platforms in each group of mice
注:与空白组比较,**P<0.01,*P<0.05;与阴性组比较,&&P<0.01,&P<0.05;与阳性组比较,##P<0.01,#P<0.05。
2.2 小鼠脑组织HE 染色结果
由图2可知,茶油各剂量组具有完整的细胞结构、紫色的细胞核且细胞质分布较为均匀,具有规则的细胞形状,呈现正常的状态,并且不具有炎症细胞感染的症状,视野中海马结构完整,齿状回(Dentate gyrus DG) 区可见较多锥体细胞固缩深染,嗜碱性增强;空白组视野中海马结构完整,CA1 区及DG 区可见有锥体细胞固缩深染,细胞形状不规则(黑色箭头);阴性组细胞形态正常,但零星出现白色斑点,是因为切片时在脱蜡溶剂中停留时间过短产生的,并不影响脑组织细胞结构整体形态。阳性组细胞结构较为清晰,细胞核形状完整,结构规则,染色均匀,但局部皮层可见淤血(红色箭头)。综合以上所述,中剂量组具有更加完整的脑组织细胞结构,无皮层淤血现象,CA1 区和DG 区细胞形状规则,嗜碱性增加(脑组织中的核糖体、细胞核等数量更多),观察清晰,更有利于小鼠脑组织的发育。
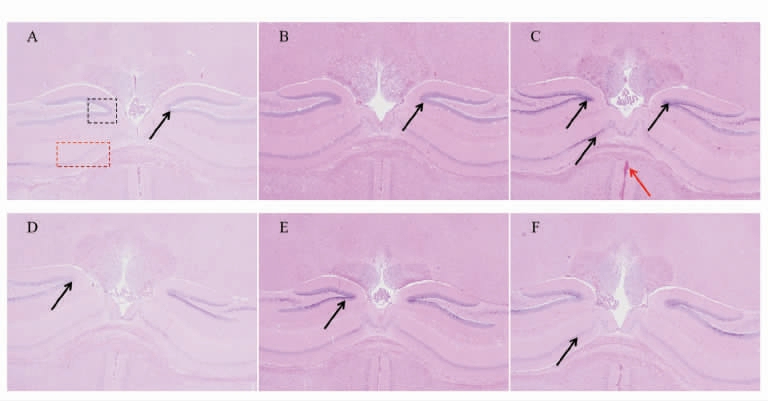
图2 小鼠脑组织HE 染色(40×)
Fig.2 HE staining of mice brain tissue (40×)
注:1.A:空白组;B:阴性组;C:阳性组;D:低剂量组;E:中剂量组;F:高剂量组;2.红色框为CA1 区,黑色框为DG 区。
2.3 小鼠海马神经组织尼氏染色结果
由图3可知,小鼠海马组织尼氏染色结果显示,阴性组海马区与空白组相比,尼氏体略有增加;阳性组相较于空白组,海马组织细胞数量增多,形态更加完整,排列也更加有序;茶油各剂量组相较于空白组,细胞数量并无减少,神经元结构无变性部分,锥体细胞、神经元和颗粒细胞连接紧密,排列较为整齐,尼氏体较为明显。其中尼氏体是海马神经元内合成蛋白质的重要部位,茶油中、高剂量组尼氏体丰富,形状、数量和分布位置合理,说明中、高剂量DHA 藻油的茶油具有促进脑组织海马区细胞及神经元的发育,而海马区是帮助处理学习和记忆的区域,当一个短期记忆被重复提及后会被海马区转存进入大脑皮层[13],所以茶油组小鼠海马的发育也说明了Morris 水迷宫实验中结果的准确性。
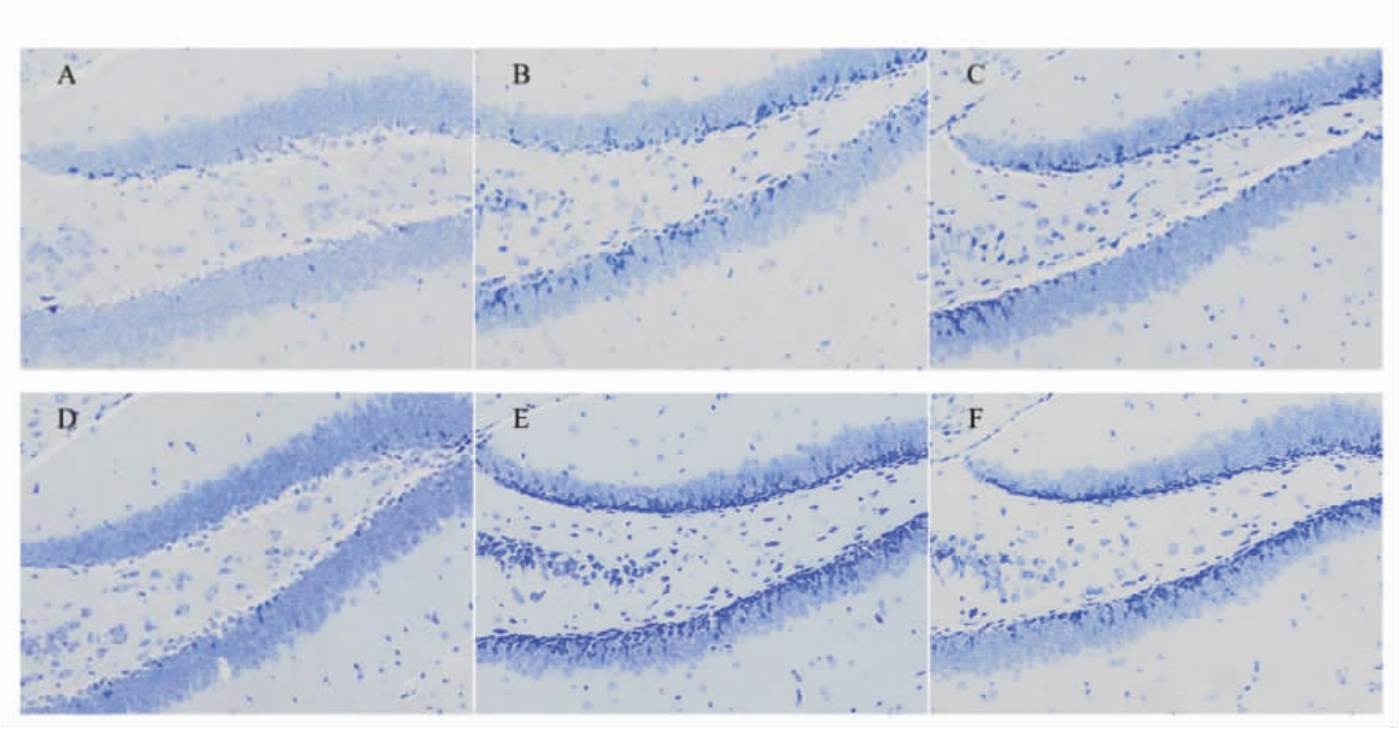
图3 小鼠海马组织尼氏染色(200×)
Fig.3 Nissl staining of mice hippocampus (200×)
注:A:空白组;B:阴性组;C:阳性组;D:低剂量组;E:中剂量组;F:高剂量组。
2.4 小鼠眼球视网膜PAS 染色结果
由图4可知,空白组小鼠视网膜铺片染色后结构正常,血管略细,可观察到细胞整体形态;阴性组与空白组相比无明显差别;其中阳性组细胞结构分层清晰,无水肿现象,视网膜血管分布均匀,走向规则,有部分扭曲和聚集的现象,主要是视网膜细胞数量增多,枝节血管增加导致。茶油各剂量组视网膜细胞间隙正常,无增大现象,各层细胞排列整齐,可清晰的观察到视网膜血管的分布及延伸方向,分支清晰完整,无断裂现象发生。细胞核可较为清晰的显示,细胞整体形态清晰,血管密度适中。其中中、高剂量组视网膜血管分层清晰,空间分布均匀,具有更规则的走向[14-15]。说明含DHA 藻油的茶油组可以起到促进小鼠视网膜细胞发育的效果。
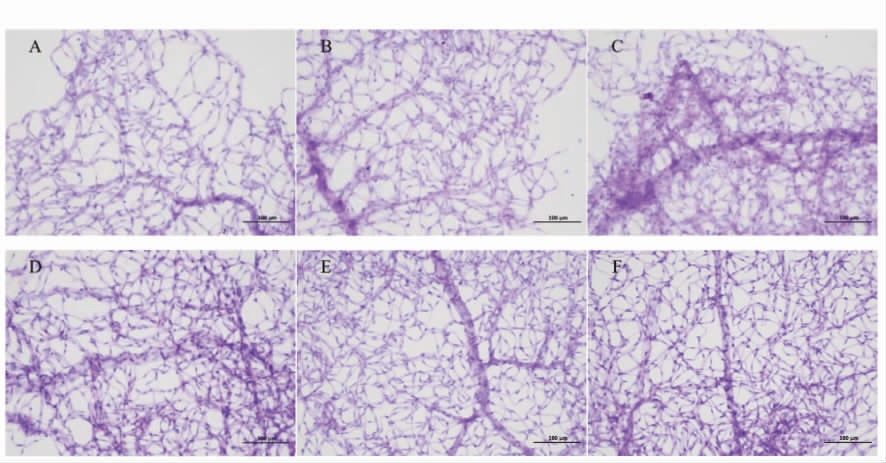
图4 小鼠视网膜铺片PAS 染色(200×)
Fig.4 PAS staining of mice retina spread (200×)
注:A:空白组;B:阴性组;C:阳性组;D:低剂量组;E:中剂量组;F:高剂量组。
2.5 小鼠大脑组织MDA、T-AOC、CAT 和AChE 活性测定结果
MDA 是膜脂质过氧化最重要的产物之一,它的产生还可以加剧膜的损伤[16]。由表2可知,与空白组相比,阴性组具有显著性差异(P<0.05),阳性组和茶油各剂量组具有极显著性差异 (P<0.01);与阴性组相比,茶油各剂量组均具有显著性差异(P<0.01);与阳性组相比,茶油各剂量组均具有显著性差异 (P<0.01)。随着茶油中DHA 剂量的增加,小鼠脑组织中MDA 含量呈现先降低而后升高的趋势,说明含DHA 藻油的茶油在一定剂量范围内可以促进对机体脂质的保护,但是当不饱和脂肪酸含量增加时,氧化可能性增强,这种保护作用就会被解除[13]。
表2 各组别对小鼠脑组织中MDA、T-AOC、CAT 和A-ChE 活性水平的影响
Table 2 Effects of each group on the activity levels of MDA,T-AOC,CAT and A-ChE in mice brain tissue
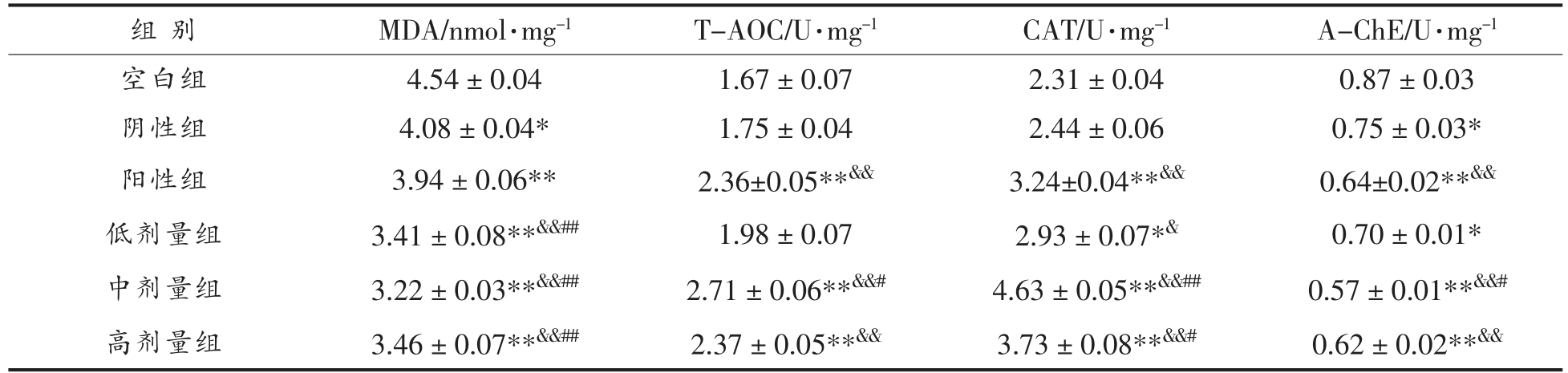
注:与空白组比较,**P<0.01,*P<0.05;与阴性组比较,&&P<0.01,&P<0.05;与阳性组比较,##P<0.01,#P<0.05。
?
T-AOC 是组织中各种抗氧化物质和抗氧化酶等总抗氧化能力[17]。与空白组相比,阴性组和低剂量组没有显著性差异(P>0.05),阳性组和中、高剂量组具有极显著性差异(P<0.01),与阳性组相比,茶油中剂量组具有显著性差异(P<0.05)。说明相比于茶油,随着DHA 剂量的增加,活性物质含量增高,T-AOC 的活性逐渐增强,剂量越高,效果就越明显,对脑组织抗氧化活性具有一定的促进作用,但是当DHA 剂量过多时,抗氧化能力反而有所下降。
CAT 酶促活性为大脑组织提供了抗氧化防御机制[18]。与空白组相比,阴性组没有显著性差异(P>0.05),茶油低剂量组具有显著性差异(P<0.05),阳性组和茶油中、高剂量组具有极显著性差异(P<0.01);与阳性组相比,茶油低剂量组没有显著性差异(P>0.05),中剂量组具有极显著性差异(P<0.01),高剂量组具有显著性差异(P<0.05)。这说明含DHA 藻油的茶油能显著性的增强小鼠脑组织中的CAT 活性,且随着剂量的增加,其CAT 活性也呈现先增强后降低的趋势,这与脑组织中总抗氧化能力的检测结果一致。
A-ChE 在生物神经传导中是一种关键性酶,与动物学习和记忆能力关系密切[19]。结果显示,与空白组相比,阴性组和低剂量组具有显著性差异(P<0.05),阳性组和中、高剂量组具有极显著性差异(P<0.01)。中剂量组相对于阳性组具有显著性差异(P<0.05)。说明含DHA 藻油的茶油可以抑制乙酰胆碱酯酶的活性,降低小鼠脑组织分解乙酰胆碱的能力,间接的增加脑部乙酰胆碱的含量,从而有利于神经信号在突触间的传递[20],最终体现为小鼠学习能力和空间能力的增强,这与水迷宫实验结果相符合。
3 结论
通过Morris 水迷宫实验发现,茶油各剂量组小鼠的逃避潜伏期均呈现下降趋势,穿越平台次数增加,说明含DHA 藻油的茶油的摄入可以增强小鼠的学习记忆能力和空间记忆能力。
组织染色结果显示茶油组小鼠脑组织中具有完整的细胞结构、紫色的细胞核且细胞质分布较为均匀,海马组织细胞数量增多,尼氏体丰富,视网膜血管分布均匀,无扭曲和聚集的现象,走向规则,血管密度适中。说明含DHA 藻油的茶油摄入可以促进小鼠脑部及视网膜的发育。虽然高剂量组有利于海马区神经元的发育,但脑组织中MDA含量相较于中剂量组含量更高,过多的DHA 摄入会引起脑组织产生较多的脂质过氧化物。中剂量组具有更完整的脑组织结构,综合水迷宫实验及组织染色结果,认为中剂量组更有利于小鼠脑部及视网膜的发育。
[1]木沐.世界四大木本油料发展现状[J].中国林业产业,2019(11):28-31.
MU M.Development status of four major woody oil plants in the world[J].China Forestry Industry,2019(11):28-31.
[2]郭浪,陈杰山.茶油医疗保健功效及产品研发进展[J].世界最新医学信息文摘,2019,19(81):38-39.
GUO L,CHEN J S.Medical and health care effect of tea-seed oil and product research progress[J].World Latest Medicne Information,2019,19(81):38-39.
[3]WENG M H,CHEN S Y,LI Z Y,et al.Camellia oil alleviates the progression of Alzheimer's disease in aluminum chloride-treated rats[J].Free Radical Biology and Medicine,2020,152(4):411-421.
[4]陈柏林.南带油茶油脂品质特征研究[D].长沙:中南林业科技大学,2018.
CHEN B L.Study on the characteristics of Camellia oil in South Belt area[D].Changsha:Central South University of Forestry and Technolog,2018.
[5]李鹤,胡文忠,姜爱丽,等.不同来源DHA 提取技术及其在食品工业中的应用进展[J].食品工业科技,2017,38(7):390-394.
LI H,HU W Z,JIANG A L,et al.Advance in different sources of DHA separation and extraction technology and its application in food industry[J].Science and Technology of Food Industry,2017,38(7):390-394.
[6]CAO H T,LI M Y,LI G Y,et al.Retinoid X Receptor α Regulates DHA-dependent spinogenesis and functional synapse formation in vivo[J].Cell Reports,2020,31(7):107649.
[7]胡小东,关浩,杨立山.Morris 水迷宫在筛选急性CO 中毒迟发性脑病模型中的应用[J].宁夏医科大学学报,2020,42(1):25-29.
HU X D,GUAN H,YANG L S.Application of morris water maze in screening acute CO poisoning delayed encephalopathy model[J].Journal of Ningxia Medical University,2020,42(1):25-29.
[8]朱滢桔.持续与间歇跑台运动对大鼠空间学习记忆及海马、皮质氧化抗氧化能力的机制研究[D].昆明:云南师范大学,2017.
ZHU Y J.Effect of continuous and intermittent treadmill exercise on spatial learning and memory and the antioxidant capacity of hippocampus and cortex in SD rats[D].Kunming:Yunan Normal University.2017.
[9]郭海波,全睿,王慧.冰冻切片和苏木精-伊红染色在大鼠脑组织中的应用[J].实用医技杂志,2019,26(1):98-99.
GUO H B,QUAN R,WANG H.Application of frozen section and hematoxylin-eosin staining in rat brain tissue[J].Journal of Practical Medical Techniques,2019,26(1):98-99.
[10]孙迪.砷暴露对小鼠海马星形胶质细胞GFAP 和S-100β 表达及神经元尼氏小体的影响[D].沈阳:中国医科大学,2010.
SUN D.Influence of arsenic exposure on astrocytic GFAP and S-100β expression and neuronic Nissl body in the hippocampus of mice[D].Shenyang:China Medical University,2010.
[11]郭承伟,朱晓林,郭超红,等.大黄胶囊对糖尿病大鼠视网膜血管保护作用的研究[J].中医药导报,2018,24(24):88-91.
GUO C W,ZHU X L,GUO C H,et al.Effect of Dahuang Zhechong Pills on retinal capillary pericytes apoptosis in diabetic rats[J].Guiding Journal of Traditional Chinese Medicine and Pharmacy,2018,24(24):88-91.
[12]郑操,陈涛,田华,等.含DHA 藻油的大豆调和油对SD 大鼠大脑皮层组织抗氧化能力和过氧化反应的影响[J].中国油脂,2017,42(10):84-86.
ZHENG C,CHEN T,TIAN H,et al.Effect of soybean blend oil containing DHA algae oil on antioxidant capacity and peroxidation of cerebral cortex of SD rat[J].China Oils and Fats,2017,42(10):84-86.
[13]王丽梅,叶诚,郭艳芬,等.DHA 油与其他4 种油脂对大鼠空间学习记忆、脂质过氧化及其血脂水平的影响[J].中国油脂,2013,38(3):34-38.
WANG L M,YE C,GUO Y F,et al.Effect of five kinds of oils on spatial learning and memory ability lipid peroxidation and serum lipid level in rats[J].China Oils and Fats,2013,38(3):34-38.
[14]邸莎.基于PRC2/p38 MAPK 通路探讨益气通络方防治糖尿病视网膜病变的作用机制[D].北京:中国中医科学院,2020.
DI S.Explore the mechanism of Yiqi Tongluo formula in preventing and treating diabetic retinopathy based on PRC2/p38 MAPK pathway[D].Beijing:China Academy of Chinese Medical Sciences,2020.
[15]逄冰.益气温阳通络法预防糖尿病大鼠视网膜病变发生的作用及机制研究[D].北京:中国中医科学院,2018.
FENG B.Study on the mechanism of preventing rats from diabetic retinopathy by booting Qi,warming Yang and dredging collaterals princiole[D].Beijing:China Academy of Chinese Medical Sciences,2018.
[16]GARCIA D,LIMA D,SILVA D G H,et al.Decreased malondialdehyde levels in fish (Astyanax altiparanae) exposed to diesel:Evidence of metabolism by aldehyde dehydrogenase in the liver and excretion in water[J].Ecotxicology and Environmental Safety,2020,190:110107.
[17]VIRUN V,KAMONWAN K,THANET S.Comparative analysis of plasma total antioxidant capacity in patients with hyperglycemia and hyperglycemia plus dyslipidemia [J].Diabetes & Metabolic Syndrome:Clinical Research Reviews,2019,13(1):90-94.
[18]TRUJILO V,MACCHIONE A F,ALBRECHT P A,et al.Learning experiences comprising central ethanol exposure in rat neonates:Impact upon respiratory plasticity and the activity of brain catalase[J].Alcohol,2020,88:11-27.
[19]NAGUMO M,NINOMIYA M,OSHIMA N,et al.Comparative analysis of stilbene and benzofuran neolignan derivatives as acetylcholinesterase inhibitors with neuroprotective and anti-inflammatory activities[J].Bioorganic & Medicinal Chemistry Letters,2019,29(17):2475-2479.
[20]杨彭,黄健,韩敏,等.石杉碱甲对帕金森病模型大鼠乙酰胆碱酯酶及ATP 酶活性的影响[J].重庆医学,2017,46(22):3132-3135.
YANG P,HUANG J,HAN M,et al.Effects of Huperzine A on the activities of acetylcholinesterase and ATPase in Parkinson's disease model rats[J].Chongqing Medicine,2017,46(22):3132-3135.