人体内的微生物群落独特而复杂,肠道菌群形成多样而稳定的动态平衡,可调节宿主稳态,对人体健康非常重要[1]。2001年,世界卫生组织(WHO)和粮农组织(FAO)提出一个定义:“当摄入足够数量时,需要对宿主产生足够益处的活性微生物,称为益生菌”[2-4]。2020年,中国食品科学技术学会发布了益生菌科学共识,提出益生菌需要具备3 个特征,第一需要足够的数量,第二需要对人体健康产生益处,第三必须是活性的微生物[5]。
双歧杆菌是人体的胃肠道中具有代表性的一类有益的微生物,其具有免疫调节,改善肠道、生物性屏障和抗肿瘤等多种重要的生理功能,对人体的健康具有重要的作用[6]。本研究所用乳双歧杆菌(Bifidobacterium lactis)Probio-M8,分离自内蒙古呼和浩特市健康妇女母乳[7]。Liu 等[8]在2020年研究了乳双歧杆菌Probio-M8 具有良好的胃肠消化耐受特性。2020年,翟云等[9]对免疫抑制模型大鼠灌服乳双歧杆菌Probio-M8,结果发现可以提高大鼠的特异性和非特异性免疫应答调控的能力,说明灌服益生菌对免疫抑制大鼠的免疫调节有一定的促进作用。熊涛等[10]发现副干酪乳杆菌属于乳杆菌属的酪乳杆菌群,广泛存在于传统发酵乳制品和人体胃肠道中,不仅具有十分良好的耐酸耐胆盐的能力及较强的黏附功能;而且还能耐受人体胃肠道的防御机制并可在肠道内定殖。本研究用副干酪乳杆菌(Lactobacillus paracasei)PC-01分离自西藏拉萨地区当雄县龙仁乡酸牦牛奶[11]。发酵乳是将益生菌传递到人体胃肠道的理想载体,是益生菌在功能食品领域的重要应用形式[12]。
本文研究益生菌发酵乳发酵过程中的微流变学特性,微流变的灵敏度较高,通过对发酵乳体系中粒子运动的追踪来表征该样品的黏弹性变化,在不破坏发酵乳结构的情况下研究发酵乳样品的流变特性。测定发酵过程和贮藏期间的活菌数、pH 值、滴定酸度、黏度和持水性,评价添加益生菌对产品稳定性的影响,为工业生产提供理论依据。
1 材料与方法
1.1 材料与仪器
1.1.1 试验菌种和培养基 本研究所用基础发酵剂(保加利亚乳杆菌ND02 和嗜热链球菌ND03)、乳双歧杆菌Probio-M8 和副干酪乳杆菌PC-01 直投式发酵剂,均由内蒙古农业大学乳品生物技术与工程教育部重点实验室、农业农村部奶制品加工重点实验室提供。
1.1.2 主要试验材料 牛乳,蒙牛乳业有限公司;白砂糖,广西凤糖有限公司;MRS 肉汤培养基,英国Oxoid 公司;L-半胱氨酸盐酸盐,北京酷来搏科技有限公司;万古霉素,陆桥技术有限公司。
1.1.3 主要仪器与设备 黏度计DV-2T 型,Brookfield 公司;pH 计FE28 型,梅特勒(上海)有限公司;微流变仪Rheolaser Master,法国Formulaction 公司;超净工作台(SJ-CJ-2FDQ),苏州苏洁净化设备有限公司;高压均质机SPXAPV1000型,上海欧河机械设备有限公司;水浴锅,一恒科技有限公司。
1.2 试验方法
1.2.1 发酵乳制备 将6%(质量分数) 白砂糖溶解于94%(质量分数)牛乳中,加热至65 ℃,均质(20 MPa)后,于95 ℃、5 min 杀菌,冷却到37 ℃接种益生菌和发酵剂。各试验组发酵剂接种情况如表1。将样品于37 ℃恒温发酵至pH 4.50 为终点,冰水浴冷却,置于4 ℃后熟24 h 和贮藏28 d,发酵过程中每间隔2 h 取发酵乳样检测,贮藏期间每隔7 d 取样品进行贮藏指标的检测。
表1 试验分组明细
Table 1 Experiment grouping details
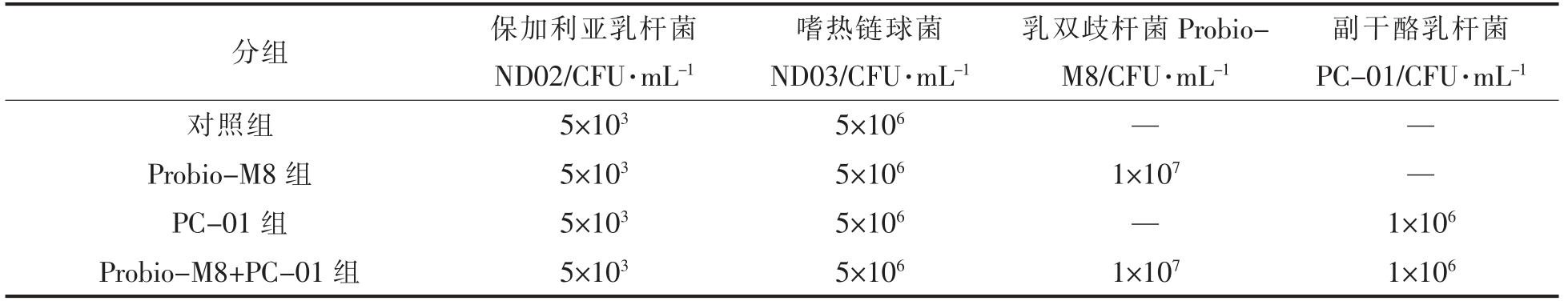
乳双歧杆菌Probio-M8/CFU·mL-1副干酪乳杆菌PC-01/CFU·mL-1对照组 5×103 5×106 — —Probio-M8 组 5×103 5×106 1×107 —PC-01 组 5×103 5×106 — 1×106 Probio-M8+PC-01 组 5×103 5×106 1×107 1×106分组 保加利亚乳杆菌ND02/CFU·mL-1嗜热链球菌ND03/CFU·mL-1
1.2.2 微流变特性的测定 取接种发酵剂后的乳样品20 mL,倒入无菌微流变仪专用玻璃管(内径27.5 mm),迅速将玻璃管转移至测定槽中,流变仪设置为37 ℃。每1 min 测量1 次,至发酵终点。原始数据的收集和分析在仪器上的软件进行。
1.2.3 活菌数的测定 本试验采用的是平板倾注法计活菌数。发酵乳样品中乳双歧杆菌Probio-M8采用ML 固体培养基进行选择培养,37 ℃培养72 h;副干酪乳杆菌PC-01 采用固体培养基MRS-V(万古霉素10 mg/L) 进行选择培养,37 ℃培养72 h;均在厌氧条件下培养[13]。
1.2.4 酸度的测定 采用FE28 型pH 计直接测定pH 值;滴定酸度根据GB 5413.34-2010 中“乳和其它乳制品酸度的测定”的方法,每个样品测定3 组平行[14]。
1.2.5 黏度的测定[15] 将发酵乳样品放置室温后,利用DV-2T 黏度计测发酵乳样品,3 次平行。测定条件:选择4#转子,转速设定为100 r/min,扭矩为10%~100%,测定时间是30 s。
1.2.6 持水性的测定 称取20 g 发酵乳样品,放置在有定量滤纸的玻璃漏斗中,室温下静置120 min 后收集滤液,立即称取滤液的质量[16]。计算公式:
1.2.7 数据分析 本试验的样品每组均至少测定3 次平行,结果用“平均值±方差”表示,采用SPSS分析各样本间的差异,P<0.05 表示差异显著;作图采用Origin 2018 软件进行绘制。
2 结果与分析
2.1 固液平衡值的检测结果
本研究采用多频扩散波谱法对添加不同益生菌发酵乳的凝胶过程进行了微流变学特征分析。随着时间的推移,EI 与弹性模量成正比,MVI 与黏性模量成正比,FI 反映微观粒子运动的快慢,SLB 与发酵乳产品的黏弹性性能成正比,并给出了类固液比[17]。固液平衡值(SLB)直接表现了产品偏向于固态或者液态与时间对应的函数关系,当0
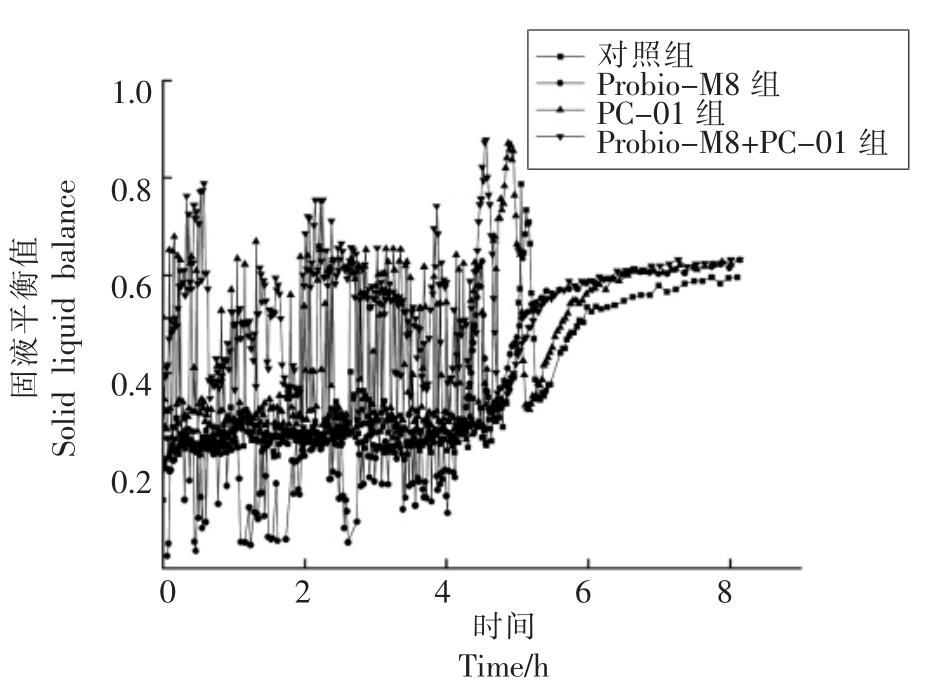
图1 发酵过程中固液平衡值的变化
Fig.1 Changes of solid liquid balance (SLB)during fermentation
2.2 弹性因子的检测结果
弹性因子(EI)作为时间的函数可直接反映弹性模量,即储能模量在一定时间内的变化性,可快速、简便地表征一个样品的弹性模量。EI 值越大,说明发酵乳样品的凝胶结构就越强,样品也就会越稳定[20]。发酵过程中弹性因子变化如图2所示,发酵乳样品的弹性因子在最初4.5 h 内保持了稳定,但FI、SLB 和MVI 值在此期间处于较大程度的波动状态,因为酪蛋白没有形成凝胶的网状结构,样品表现为高流动性的低弹性、低黏度的不稳定状态[21]。4.5 h 开始Probio-M8 组和Probio-M8+PC-01 组EI 出现拐点迅速垂直上升,到达凝胶点。PC-01 组和对照组5 h 左右呈现相同趋势,这进一步说明添加益生菌提前了EI 的变化。随着发酵时间的延长,发酵乳中酪蛋白完全解离并迅速聚集形成凝胶结构,EI 值达到最大[22]。添加Probio-M8 和Probio-M8+PC-01 组EI 值迅速上升,EI 值变化显著快于PC-01 组和对照组,各组EI值迅速达到最高后略微下降直至发酵终点,这可能是因为形成不稳定的凝胶结构。对照组的EI 值最大,Probio-M8+PC-01 组EI 值最小,这可能是添加益生菌在一定程度上降低了发酵乳的弹性,与蔡淼等[23]的研究结果一致。
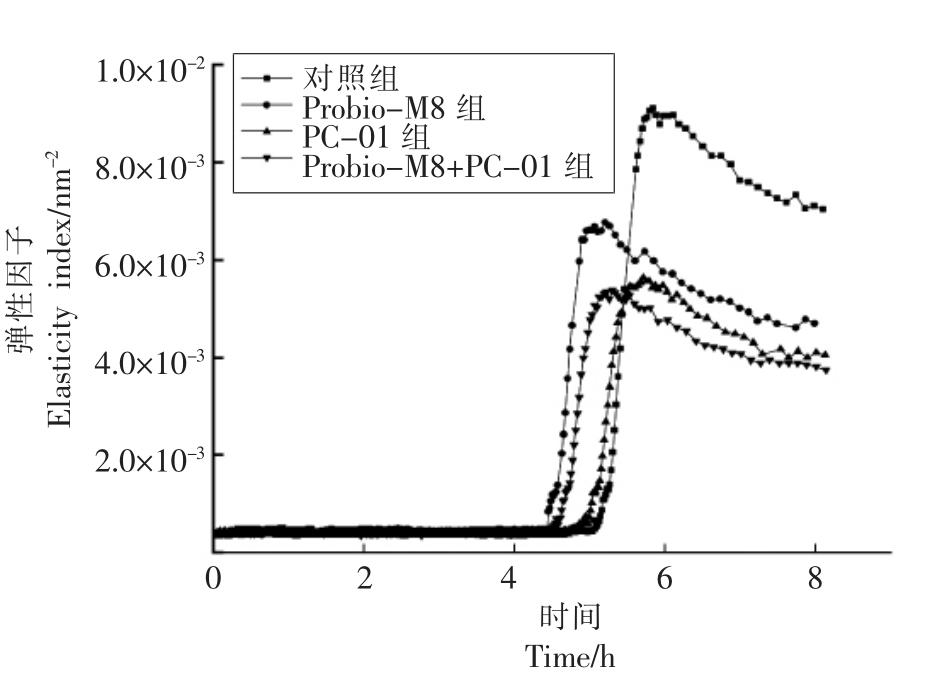
图2 发酵过程中弹性因子(EI)的变化
Fig.2 Changes of elasticity index (EI)during fermentation
2.3 黏性因子的检测结果
黏性因子(MVI)反映样品在微米尺度的黏性特征[24]。黏性因子作为一个时间的函数能直接表示黏性模量,黏性因子可以显示发酵乳黏度的变化[18]。发酵过程中黏性因子的变化如图3所示,从发酵开始到4.5 h 左右,各组MVI 值在同一时期保持在一定水平波动,这是因为凝胶网络结构没有形成,为低黏度的初始停滞阶段[25]。Probio-M8组和Probio-M8+PC-01 组在4.5 h 后,样品MVI呈迅速上升趋势,这可能是酪蛋白胶粒开始逐渐的解离,乳液中凝胶逐渐开始形成,因此发酵乳进入了黏度快速变化的阶段,随后各组发酵乳样品的黏性因子快速的增加到最大,进入了高黏度阶段[26];PC-01 组和对照组在5 h 左右出现同样的趋势。Probio-M8 组、PC-01 组和Probio-M8+PC-01组产黏速度相对更快,说明添加益生菌可以加快产黏速度。发酵终点时,网络结构形成后各组最终形成了稳定的凝胶结构,发酵乳样品的黏稠度无明显差异。

图3 发酵过程中黏性因子(MVI)的变化
Fig.3 Changes of macroscopic viscosity index (MVI)during fermentation
2.4 流动因子的检测结果
流动因子(FI)的变化能反映发酵乳样品中微观粒子运动的快慢,高流动因子(约10 Hz)表明此时样品为液态性质,低流动因子(约10-2 Hz)表明样品为固态性质,FI 值越大则粒子运动越快,流动性越强[27]。发酵过程中流动因子的变化由图4可知,从发酵开始到4.5 h,各组FI 值处于波动状态属于液态性质,4.5 h 后Probio-M8 组和Probio-M8+PC-01 组出现拐点,FI 值由102 Hz 直线下降至10-1 Hz 后平缓下降,达到10-2 Hz 后基本保持不变,样品具有较高的黏性液体性质,PC-01 组和对照组在5 h 后也出现相同的趋势。到发酵终点,对照组的FI 最低,与MVI 结果相对应。
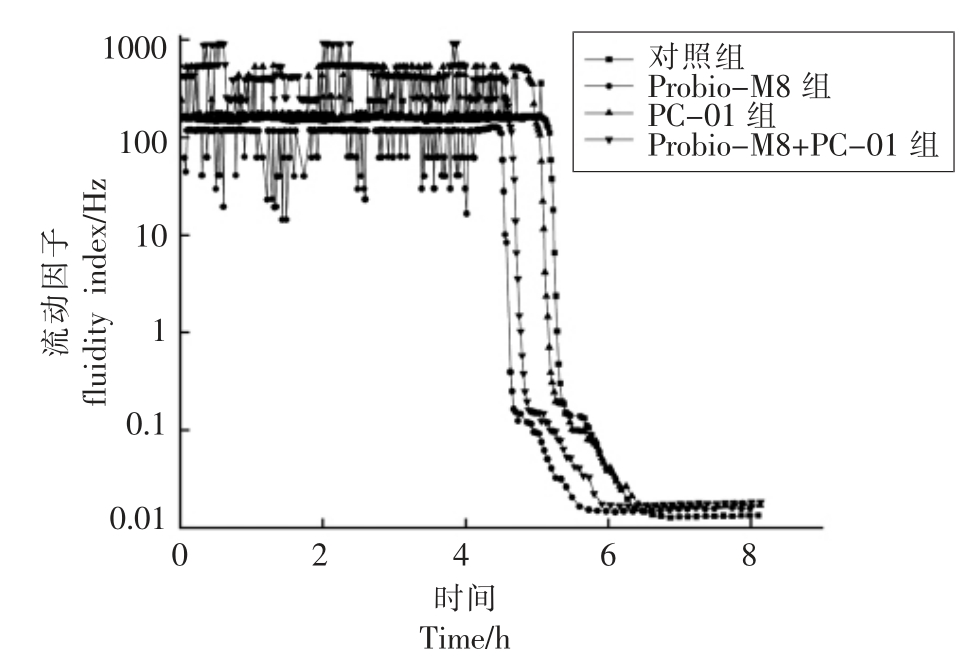
图4 发酵过程中流动因子(FI)的变化
Fig.4 Changes of fluidity index (FI)during fermentation
2.5 活菌数的变化
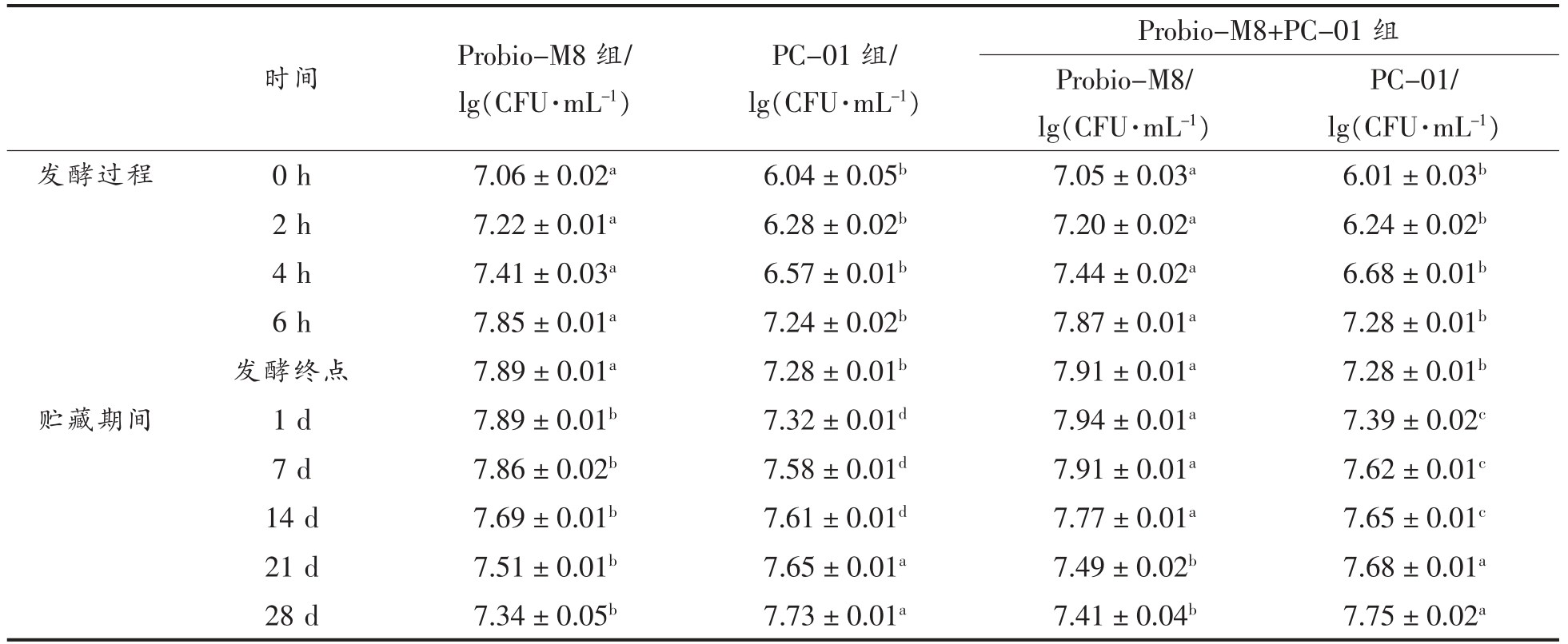
发酵过程及贮藏期间活菌数的变化由表2所示,发酵过程,发酵中的活菌数均呈上升趋势(P<0.05),在发酵终点时Probio-M8 组活菌数达到(7.89±0.01)lg (CFU/mL),PC-01 组副干酪乳杆菌PC-01 的活菌数达到 (7.28±0.01)lg(CFU/mL);Probio-M8+PC-01 组两种益生菌的活菌数与Probio-M8 组和PC-01 组的活菌数差异不显著。在贮藏1~14 d 时,Probio-M8 的活菌基本保持不变,14 d 后呈下降趋势(P<0.05),在贮藏28 d 时活菌数达到(7.34±0.05)lg(CFU/mL);值得关注的是:PC-01 在贮藏1~28 d 中活菌数在持续上升(P<0.05),在贮藏28 d 时活菌数达到 (7.75±0.02)lg(CFU/mL),PC-01 的活菌数显著高于Probio-M8,这可能是因为PC-01 具有更好的耐酸特性,在贮藏过程中副干酪乳杆菌PC-01 保持更好的活力。本试验证明应用乳双歧杆菌Probio-M8 和副干酪乳杆菌PC-01 在发酵乳中保持益生菌活力的稳定性,可以充分保证益生功效的发挥。
表2 发酵及贮藏过程中发酵乳活菌数的变化
Table 2 During storage and fermentation viable count changes of fermented milk
注:不同小写字母代表差异显著性,P<0.05。
时间 Probio-M8 组/lg(CFU·mL-1)PC-01 组/lg(CFU·mL-1)Probio-M8+PC-01 组Probio-M8/lg(CFU·mL-1)PC-01/lg(CFU·mL-1)发酵过程 0 h 7.06±0.02a 6.04±0.05b 7.05±0.03a 6.01±0.03b 2 h 7.22±0.01a 6.28±0.02b 7.20±0.02a 6.24±0.02b 4 h 7.41±0.03a 6.57±0.01b 7.44±0.02a 6.68±0.01b 6 h 7.85±0.01a 7.24±0.02b 7.87±0.01a 7.28±0.01b发酵终点 7.89±0.01a 7.28±0.01b 7.91±0.01a 7.28±0.01b贮藏期间 1 d 7.89±0.01b 7.32±0.01d 7.94±0.01a 7.39±0.02c 7 d 7.86±0.02b 7.58±0.01d 7.91±0.01a 7.62±0.01c 14 d 7.69±0.01b 7.61±0.01d 7.77±0.01a 7.65±0.01c 21 d 7.51±0.01b 7.65±0.01a 7.49±0.02b 7.68±0.01a 28 d 7.34±0.05b 7.73±0.01a 7.41±0.04b 7.75±0.02a
2.6 酸度的变化
pH 值和滴定酸度影响益生菌在发酵及贮藏过程中的生存能力,影响发酵乳制品的质量,产酸是酸奶发酵剂的主要功能[28]。由图5所示,pH 值在发酵期间各组均呈快速下降的趋势 (P<0.05)。在发酵初期(0~2 h),生长速度缓慢,酸度变化不大。发酵2 h 后,菌株进入对数生长期,增长速度加快,酸度变化明显,由于乳酸菌代谢乳糖,产生大量乳酸,促进pH 值加速下降[29]。各组达到发酵乳发酵终点pH 4.5 所用的时间,由快到慢分别是Probio-M8 组和Probio-M8+PC-01 组(7.5 h)、PC-01 组(8 h)和对照组(8.5 h),在贮藏期间按各组pH 值在4.2~4.3 之间,变化不明显;在发酵过程中TA 迅速上升(P<0.05),发酵终点滴定酸度平均值为85.25 °T,发酵酸度适中。在4 ℃贮藏期间,TA稍有下降,但变化幅度小,最终稳定在100°T 以内。研究表明,添加益生菌株缩短发酵时间、产酸速率变快,贮藏期间添加益生菌发酵乳的pH 值和滴定酸度没有显著变化,未增加后酸,说明益生菌适宜在发酵乳中生产应用。
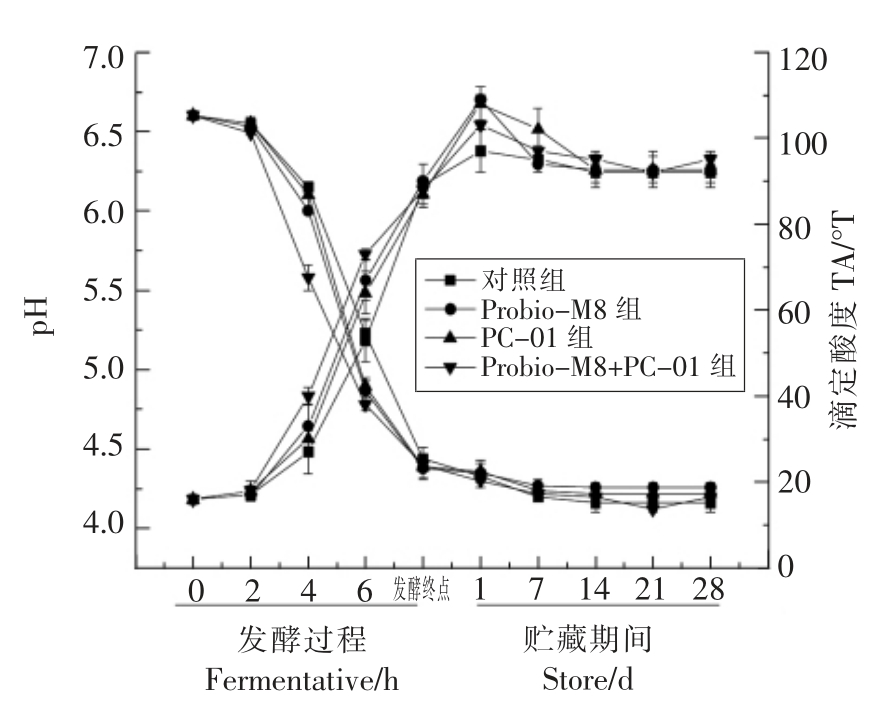
图5 发酵及贮藏过程中发酵乳酸度的变化
Fig.5 Acidity changes of fermented milk during fermentation and storage
2.7 黏度的变化
发酵乳是不可逆的凝胶,黏度是反映发酵乳品质的重要指标,适当的黏度能够产生良好的感官品质[30]。贮藏过程中发酵乳黏度的变化如图6所示,在贮藏期间,加益生菌组的黏度均高于对照组(P<0.05),随着贮藏时间的延长,黏度首先上升后下降。Probio-M8 组在贮藏期间黏度明显高于其它3 组,贮藏7 d 时黏度最大,最大黏度为1 140 mPa·s,在贮藏28 d 时黏度为1 000 mPa·s。添加Probio-M8 和PC-01 可显著提高贮藏过程中发酵乳的黏度,从而改善产品品质。
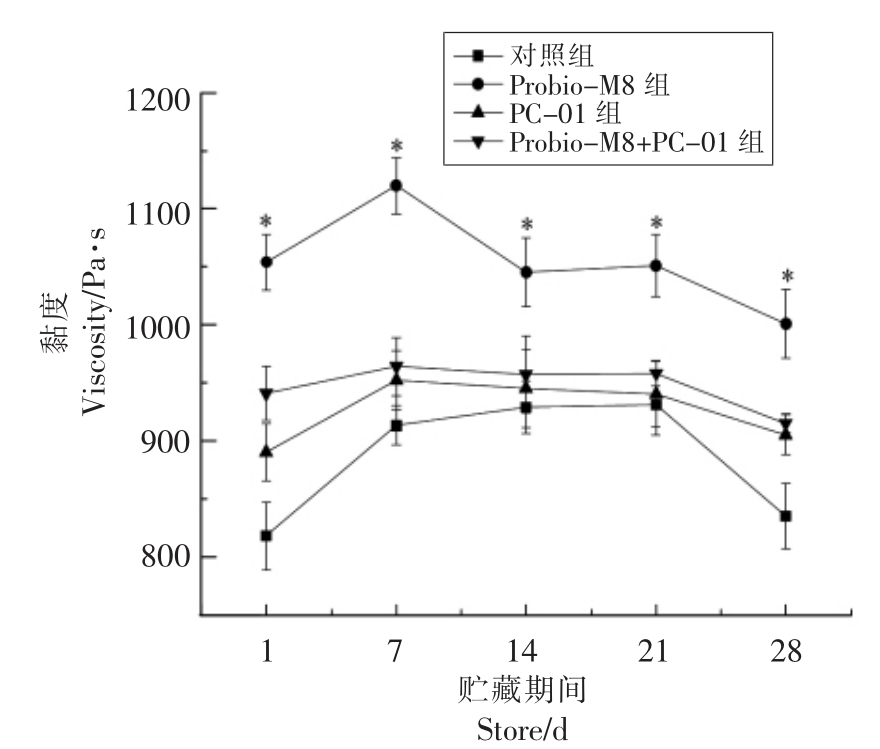
图6 贮藏期间发酵乳黏度的变化
Fig.6 Viscosity changes of fermented milk during storage
注:“*”代表差异显著性,P<0.05。
2.8 持水性的变化
贮藏期间发酵乳持水性的变化如图7所示,发酵乳持水性的强弱与发酵乳的组织状态有关,持水能力强,则发酵乳的组织状态好,可以防止乳清析出。贮藏期间,添加益生菌的发酵乳持水性显著升高(P<0.05),Probio-M8 组最高,平均持水性为54.5%±0.58%。研究表明添加益生菌Probio-M8和PC-01 有利于发酵乳产品凝胶结构的稳定性,有利于提高产品品质。

图7 贮藏期间发酵乳持水性的变化
Fig.7 Water capacity of fermented milk during storage
注:不同小写字母代表差异显著性,P<0.05。
3 结论
本文通过分析益生菌乳双歧杆菌Probio-M8和/或副干酪乳杆菌PC-01 发酵乳在发酵及贮藏过程中的微流变特性、酸度、持水力、pH 值、活菌数和黏度的变化。研究表明添加乳双歧杆菌Probio-M8 和副干酪乳杆菌PC-01 均可加快发酵乳的凝乳速度,同时缩短了发酵时间。添加益生菌后发酵乳凝胶具有较高的固液平衡值和较低的弹性因子,对微观黏度因子和流动因子没有影响。乳双歧杆菌Probio-M8 和/或副干酪乳杆菌PC-01 在贮藏28 d 时的活菌数均大于107 CFU/mL,具有良好稳定性。贮藏期间添加益生菌的发酵乳pH 值和滴定酸度没有显著变化,但黏度和持水性显著升高。因此,乳双歧杆菌Probio-M8 和副干酪乳杆菌PC-01 应用于发酵乳加工中具有良好的应用前景。
[1]SANDERS M E,MERENSTEIN D J,REID G,et al.Probiotics and prebiotics in intestinal health and disease:from biology to the clinic[J].Nature Reviews.Gastroenterology & Hepatology,2019,16(10):605-616.
[2]HILL C,GUARNER F,REID G,et al.Expert consensus document:The International Scientific Association for Probiotics and Prebiotics consensus statement on the scope and appropriate use of the term probiotic[J].Nature Reviews Gastroenterology &Hepatology,2014,11(8):506-514.
[3]DIXIT Y,WAGLE A,VAKIL B.Patents in the Field of Probiotics,Prebiotics,Synbiotics:A Review[J].Journal of Food Microbiology Safety & Hygiene,2016,1(2):1-13.
[4]SUEZ J,ZMORA N,SEGAL E,et al.The pros,cons,and many unknowns of probiotics[J].Nature Medicine,2019,25(5):716-729.
[5]中国食品科学技术学会益生菌分会.益生菌的科学共识 (2020年版)[J].中国食品学报,2020,20(5):303-307.
Probiotics Society of the Chinese Institute of Food Science and Technology.Scientific Consensus on Probiotics (2020)[J].Journal of Chinese Institute of Food Science and Technology,2020,20(5):303-307.
[6]朱军伟,杭锋,王钦博,等.双歧杆菌在乳制品中研究与应用进展[J].广东农业科学,2015,42(2):98-103.
ZHU J W,HANG F,WANG Q B,et al.Research and application progress of Bifidobacterium in dairy products[J].Guangdong Agricultural Tural Science,2015,42(2):98-103.
[7]ZHANG W,WANG Y,LI K,et al.Modulation of fatty acid metabolism improves oxygen tolerance of Bifidobacterium animalis ssp.lactis probio-M8 [J].Journal of Dairy Science,2020,103(10):8791-8795.
[8]LIU W,CHEN M,DUO L,et al.Characterization of potentially probiotic lactic acid bacteria and bifidobacteria isolated from human colostrum[J].Journal of Dairy Science,2020,103(5):4013-4025.
[9]翟云,王雅菲,托娅.乳双歧杆菌M8 对免疫抑制模型大鼠免疫功能的影响[J].吉林大学学报(医学版),2020,46(3):582-588.
ZHAI Y,WANG Y F,TUO Y.Effect of Bifidobacterium lactis M8 on immune function of immunosuppressive model rats[J].Journal of Jilin University(Medicine Edition),2020,46(3):582-588.
[10]熊涛,刘妍妍,黄涛,等.副干酪乳杆菌NCU622耐酸耐胆盐及其黏附性能[J].食品科学,2015,36(5):93-98.
XIONG T,LIU Y Y,HUANG T,et al.Acid,Bile tolerance and adhesion properties of Lactobacillus paracasei NCU622[J].Food Science,2015,36(5):93-98.
[11]刘晓军,马杰,张凌宇,等.一株分离自酸牦牛奶的副干酪乳杆菌及其应用:CN111575207A[P].2020-08-25.
LIU X J,MA J,ZHANG L Y,et al.A Lactobacillus paracasei isolated from sour yak milk and its application:CN111575207A[P].2020-08-25.
[12]李楠,刘振民.益生菌与功能发酵乳开发研究进展[J].乳业科学与技术,2020,43(3):31-38.
LI N,LIU Z M.Probiotics and development of functional yogurt:A review of recent progress[J].Journal of Dairy Science and Technology,2020,43(3):31-38.
[13]ASHRAF R,SHAH N P.Selective and differential enumerations of Lactobacillus delbrueckii subsp.bulgaricus,Streptococcus thermophilus,Lactobacillus acidophilus,Lactobacillus casei and Bifidobacterium spp.in yoghurt[J].Food Microbiol,2011,149(3):194-208.
[14]中华人民共和国卫生部.食品安全国家标准 乳和乳制品酸度的测定:GB 5413.34-2010[S].北京:中国标准出版社,2010.
Ministry of Health of the People's Republic of China.National food safety standards determination of acidity of milk and dairy products:GB 5413.34-2010[S].Beijing:China Standards Press,2010.
[15]靳汝霖.具有优良发酵特性嗜热链球菌的筛选及其发酵乳中关键性风味物质的研究[D].呼和浩特:内蒙古农业大学,2018.
JIN R L.Screening for streptococcus thermophilus having desirable fermentation properties and the study of their flavor characteristics[D].Hohhot:Inner Mongolia Agricultural University,2018.
[16]SAHAN N,YASARK,HAYALOGLU A.Physical,chemical and flavour quality of non-fat yogurt as affected by a β-glucan hydrocolloidal composite during storage[J].Food Hydrocolloids,2008,22(7):1291-1297.
[17]TITAPICCOLO G,CORREDIG M,ALEXANDER M.Acid coagulation behavior of homogenized milk:Effect of interacting and non-interacting droplets observed by rheology and diffusing wave spectroscopy[J].Dairy Science & Technology,2011,91 (2):185-201.
[18]ROHART A,MICHON C,CONFI A,et al.valuation of ready-to-use SMLS and DWS devices to study acid-induced milk gel changes and syneresis[J].Dairy Science & Technology,2016,96 (4):459-475.
[19]LAZARIDOU A,SERAFRIMIDOU A,BILIADERIS C G,et al.Structure development and acidification kinetics in fermented milk containing oat β-glucan,a yogurt culture and a probiotic strain[J].Food Hydrocolliod,2014,39(8):204-214.
[20]刘贺,庚平,万娇,等.蛋白酶对豆浆凝胶过程微流变性质的影响[J].食品科学,2016,37(3):1-5.
LIU H,GENG P,WAN J,et al.Effects of proteases on microrheological characteristics of soymilk gel[J].Food Science,2016,37(3):1-5.
[21]HE J,HAN Y,LIU M,et al.Effect of 2 types of resistant starches on the quality of yogurt[J].Journal of Dairy Science,2019,102(5):1-9.
[22]王雅楠,韩育梅,何君.添加益生元对酸乳凝胶过程及微观结构的影响[J].食品科学,2019,40(15):100-105.
WANG Y N,HAN Y M,HE J.Effect of prebiotics addition on gelation process and microstructure of yogurt[J].Food Science,2019,40(15):100-105.
[23]蔡淼,郝晓娜,罗天淇,等.植物乳杆菌YW11 胞外多糖对酸乳加工特性的影响[J].食品科学,2021,42(14):39-45.
CAI M,HAO X N,LUO T Q,et al.Processing properties of yogurt affected by the exopolysaccharide produced by Lactobacillus plantarum YW11[J].Food Science,2021,42(14):39-45.
[24]ZHU Q,QIU S,ZHANG H,et al.Physical stability,microstructure and micro-rheological properties of water-in-oil-in-water (W/O/W) emulsions stabilized by porcine gelatin[J].Food Chemistry,2018,253(7):63-70.
[25]孙健,牛天娇,常圆圆,等.琼脂-牛乳蛋白酸凝胶微流变特征研究[J].农业机械学报,2018,49(2):334-338.
SUN J,NIU T J,CHANG Y Y,et al.Microrheological characteristics of agar-milk protein acid-induced gels[J].Transactions of the Chinese Society for Agricultural Machinery,2018,49(2):334-338.
[26]ZHANG Y,LI Y,WAN P,et al.Rnnet-induced coagulation properties of yak casein micelles:A comparison with cow casein micelles[J].Food Research International,2017,102(9):25-31.
[27]罗天淇,蔡淼,张敏,等.辅助发酵菌株对发酵乳品质的影响[J].乳业科学与技术,2019,42(3):1-8.
LUO T Q,CAI M,ZHANG M,et al.Effects of adjuvant starter cultures on the quality of fermented milk[J].Journal of Dairy Science and Technology,2019,42(3):1-8.
[28]MISHAR S,MISHAR H N.Effect of synbiotic interaction of fructooligosaccharide and probiotics on the acidification profile,textural and rheological characteristics of fermented soy milk[J].Food & Bioprocess Technology,2013,6(11):3166-3176.
[29]DAN T,JIN R,REN W,et al.Characteristics of milk fermented by Streptococcus thermophilus MGA45-4 and the profiles of associated volatile compounds during fermentation and storage [J].Molecules (Basel,Switzerland),2018,23(4):864-878.
[30]ZHOU T,HUO R,KWOK L,et al.Effects of applying Lactobacillus helveticus H9 as adjunct starter culture in yogurt fermentation and storage[J].Journal of Dairy Science,2019,102(1):223-235.