绿原酸(Chlorogenic acid,CGA)是由咖啡酸(Caffeic acid)与奎尼酸(Quinic acid)反应生成的缩酚酸,是植物体在有氧呼吸过程中产生的一种苯丙素类化合物。CGA 属于酚酸类物质,是一种有效的抗氧化剂,它在天然植物中广泛存在,其中杜仲、金银花、咖啡中含量相对较高[1]。CGA 还具有抗病毒、保肝利胆、降血压和降血脂等生物活性[2-3]。除了多种生物活性外,有研究表明它在食品保鲜方面也有效,如桃贮藏[4]和生鸡冷藏[5]。目前,CGA作为天然活性成分,成为食品领域研究的热点。
小分子活性成分与血清白蛋白的结合,不仅影响血清白蛋白的活性,还对其本身活性有一定影响。牛血清白蛋白(Bovine serum albumin,BSA)具有良好的物理特性及稳定性,且与人血清白蛋白(Human serum albumin,HSA)具有76%的结构同源性,近年来许多研究将其作为HSA 的模型蛋白[6]。BSA 作为重要转运蛋白,能与外源性和内源性小分子物质特异性结合。BSA 由3 个同源结构域(I,II,III)组成,每个结构域都由亚结构域A和B 组成[7]。每个位点都包含疏水性空腔,使BSA能够容纳和运输各种分子[8]。其中,亚结构域IIA和IIIA 是配体结合的两个主要位点[9]。此外,BSA因具有成本低、现成可用的优点而被广泛研究。Yao 等[10]通过多光谱和对接模拟得出CGA 可能通过与Cd2+形成氢键来减少Cd2+与BSA 的相互作用的结论。
食品中所含蛋白质不仅能够提供人体所需多种营养元素,而且决定食品的色泽、气味、口感、状态等感官品质。目前各种加工处理技术对蛋白质功能性质的影响是国内外研究的热点领域。近年来,超声波处理具有穿透力强、方向性好、能量大,且低成本、无害、环保等特点而作为一种新型的冷处理改性技术快速发展。有研究发现提高超声频率对食品中蛋白质的疏水性有影响[11]。也有研究表明软超声处理可以导致红酒中酚类物质增加[12]。然而,对于超声波处理对食品中蛋白质与多酚的结合作用的影响尚缺乏研究。本研究旨在通过多光谱法分析超声波处理对CGA 与BSA 结合作用的影响。
1 材料与方法
1.1 材料与试剂
BSA(99%),北京百灵威科技有限公司;CGA(98%)、布洛芬 (Ibuprofen,IBU 98%)、华法林(Warfarin,WARF 98%),生工生物工程(上海)有限公司;无水乙醇、磷酸氢二钠、柠檬酸等为分析纯试剂。试验用水为去离子水。
1.2 仪器与设备
F-7000 荧光分光光度计,日本日立高新技术公司;FE20K 实验室pH 计、ML104 电子天平,梅特勒-托利多仪器(上海) 有限公司;UV-2700 紫外-可见光分光光度计,日本SHIMADZU 公司;Milli-Q Reference 型超纯水机,德国默克密理博有限公司。
1.3 方法
1.3.1 溶液的配制 BSA 用水配制成浓度为1.2×10-6 mol/L 的储备液,CGA 先用无水乙醇溶解再加水配制成3.6×10-5 mol/L 的储备液(醇量不可超过储备液的20%),6.0×10-6 mol/L 的WARF 和IBU储备液同样以水为溶剂,0.2 mol/L 的磷酸缓冲液(pH 4.0):由磷酸氢二钠与柠檬酸溶液在pH 计上调节得到。上述溶液均置于4 ℃冰箱保存。
1.3.2 CGA 与BSA 结合的荧光光谱 准确移取2 970,2 945,2 920,2 895,2 870,2 845,2 820,2 795 μL PBS 缓冲溶液到1~8 编号的离心管中,再分别加入30 μL 1.2×10-6 mol/L 的BSA 标准溶液,最后在每个离心管中加入3.6×10-5 mol/L CGA标准溶液至3 mL,振荡混匀备用。上述样品配制6 组,均分为两份,分别置于25 ℃和37 ℃下反应30 min。接着再从每份中取两组样品,分别经超声频率40 kHz 和53 kHz 处理30 min,剩余样品继续在原温度下反应30 min。每次测样前先取300 μL样品润洗标准石英比色皿3 次,接着取2 mL 样品于比色皿中进行扫描(下同)。设定激发波长280 nm,激发光栅为2.5 nm,发射光栅为5 nm,测定290~450 nm 的荧光光谱并记录。
1.3.3 CGA 与BSA 结合的同步荧光光谱 样品配制及处理同1.3.2 节。设定发射波长215 nm,200~350 nm 为激发波长扫描范围,测定每组样品的同步荧光光谱并记录;发射波长260 nm,200~350 nm 为激发波长扫描范围,测定每组样品的同步荧光光谱并记录。
1.3.4 CGA 与BSA 结合位点研究 准确移取2 945,2 920,2 895,2 870,2 845,2 820,2 795,2 770 μL PBS 缓冲溶液和30 μL 1.2×10-6 mol/L 的BSA标准溶液到1~8 编号的离心管中,再分别加入25 μL 7.2×10-4 mol/L WARF 储备液,充分振荡混匀并反应15 min 后,均加入3.6×10-5 mol/LCGA 标准溶液至3 mL,混均后置于25 ℃反应30 min。上述样品配制两组,其中一组在超声频率40 kHz 下反应30 min,另一组继续在原温度下反应30 min。设定激发波长280 nm,激发光栅为2.5 nm,发射光栅为5 nm,测定290~450 nm 的荧光光谱并记录。数据处理时以未加入WARF 的样品的荧光光谱数据为对照绘制猝灭率随CGA 浓度变化的图像。将标记物换为IBU 后重复上述步骤。
1.3.5 CGA 与BSA 结合的紫外-可见吸收光谱样品配制同1.3.2 节 上述样品配制3 组,一组置于25 ℃反应30 min,另外两组分别在超声频率为40,53 kHz 下处理30 min。设定狭缝宽度5 nm,狭缝间隔0.5 nm,测定250~500 nm 的紫外光谱并进行记录。
1.3.6 统计分析 每个试验重复3 次,结果表示为 ±s。采用Origin V9.0 做图。采用SAS 8.0 软件(SAS Institute Inc.,NC,美国)的一般线性模型(GLM)进行方差分析。邓肯氏多重检验用来确定数据间的差异,显著水平为P<0.05。
±s。采用Origin V9.0 做图。采用SAS 8.0 软件(SAS Institute Inc.,NC,美国)的一般线性模型(GLM)进行方差分析。邓肯氏多重检验用来确定数据间的差异,显著水平为P<0.05。
2 结果与分析
2.1 超声处理对CGA 与BSA 荧光发射光谱的影响
荧光光谱法广泛用于研究蛋白质荧光团对猝灭剂的可及性。BSA 含有的氨基酸残基可以吸收电磁辐射而受到激发,当激发光源停止时,残基因吸收能量产生荧光。其中Trp 荧光的量子产率和发射最大波长对环境的极性和其生物大分子的结构变化非常敏感[13]。荧光猝灭是指分子间相互作用(如能量转移、激发态反应、碰撞猝灭和基态络合物形成)导致荧光团荧光的减少[14]。
由图1可知,温度及超声频率不同,CGA 对BSA 的猝灭效果也不同。CGA 在340 nm 左右诱导BSA 发射信号的浓度依赖性降低[15]。不同条件下的荧光图谱峰形均无明显变化,随CGA 浓度的升高,BSA 的荧光强度降低,峰形均出现红移,说明CGA 的加入使荧光物质的极性增强,CGA-BSA复合物影响了BSA 的三级结构[16]。25 ℃、40 kHz时,峰值较未超声组有轻微降低;但53 kHz 时,峰值显著下降 (P<0.05)。37 ℃、40 kHz 时,CGA 与BSA 作用后的荧光强度有所下降,但53 kHz 时变化不大。在25 ℃、53 kHz 时,CGA 对于BSA 的荧光强度影响最大。
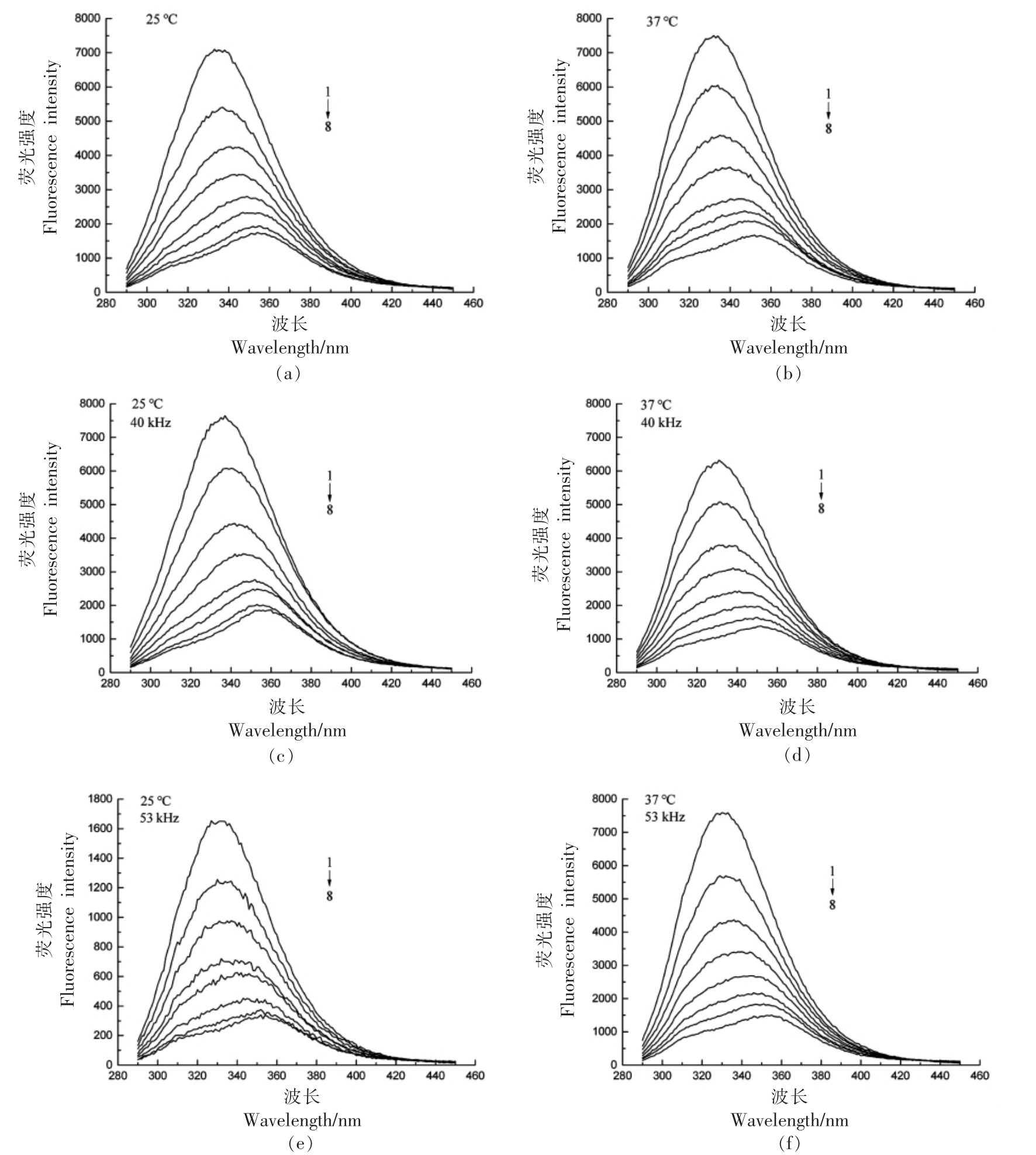
图1 不同温度下超声频率对CGA 与BSA 作用的荧光光谱的影响
Fig.1 Effect of ultrasonic frequency on fluorescence spectra of CGA and BSA at different temperature
注:BSA 浓度为1.2×10-6 mol/L;CGA 浓度1→8 依次为(0,0.6,1.2,1.8,2.4,3.0,3.6,4.2)×10-6 mol/L。
2.2 超声处理对CGA 与BSA 同步荧光光谱的影响
同步荧光光谱通常用来研究蛋白质与配体相互作用的相关构象变化,主要是测定酪氨酸(Tyrosine,Tyr)残基与色氨酸(Tryptophan,Trp)残基的荧光强度[17]。当激发和发射波长的差值Δλ 设置为15 nm 和60 nm 时,同步荧光可分别提供Tyr 和Trp 残基的特征信息[18]。
由图2、图3可知,随CGA 浓度的升高,Trp与Tyr 的荧光强度均降低,峰形基本无变化,但峰值均发生蓝移,表明BSA 的Trp 与Tyr 残基附近的微环境疏水性增强。CGA 可能通过与Trp 和Tyr结合来诱导BSA 的构象变化,即CGA 与BSA 的结合位置可能在Trp 和Tyr 残基附近。25 ℃、40 kHz 时,Tyr 与Trp 峰值无明显变化 (P>0.05),而53 kHz 时,Tyr 与Trp 峰值均显著降低 (P<0.05);37 ℃、40 kHz 时,峰值无明显变化(P>0.05),而53 kHz 时,Tyr 与Trp 峰值均升高,说明猝灭效果有所下降。在25 ℃、53 kHz 时,CGA 对BSA 的同步荧光强度影响最大。
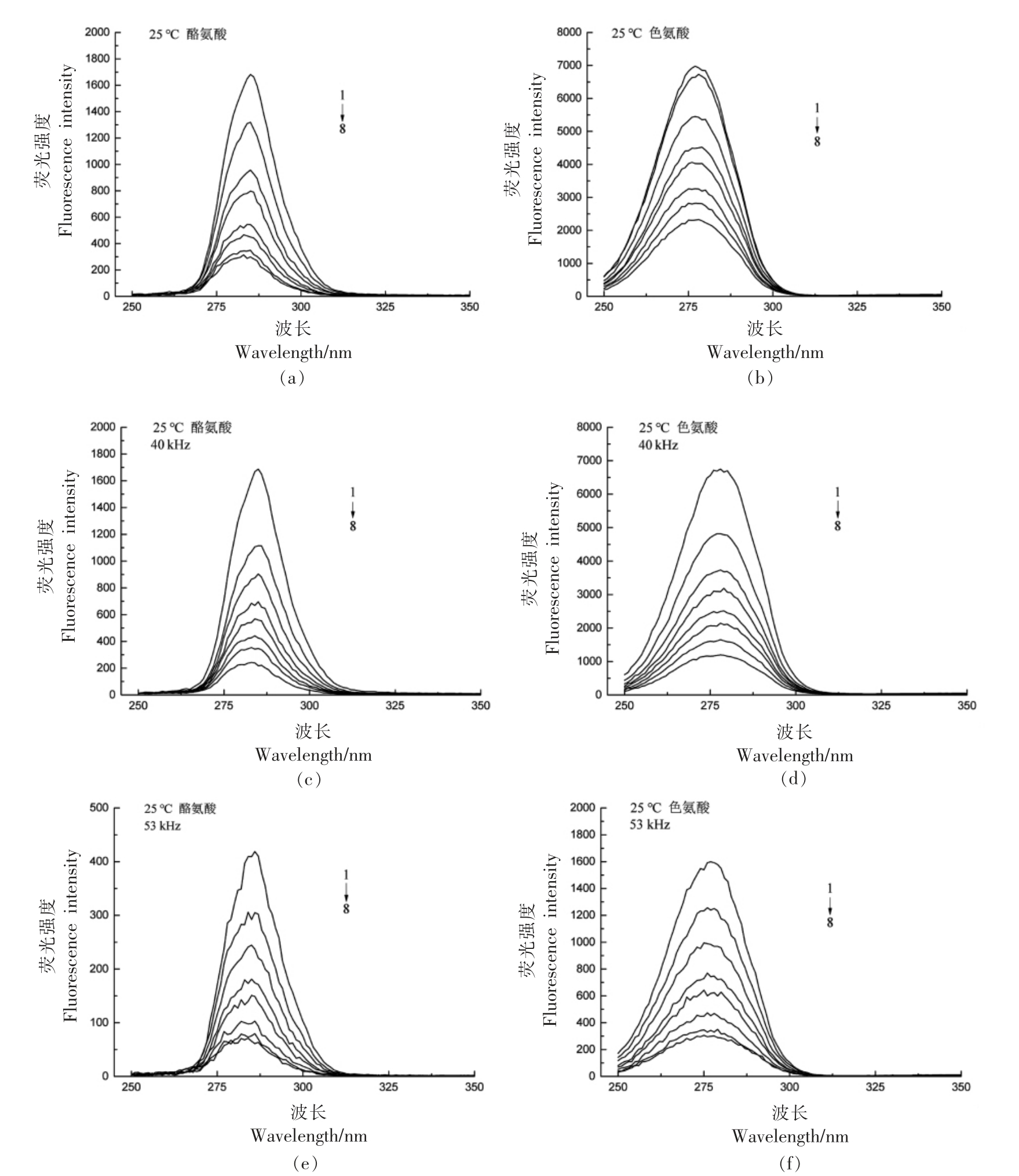
图2 25 ℃时超声频率对CGA 与BSA 作用的同步荧光光谱的影响
Fig.2 Effect of ultrasonic frequency on synchronous fluorescence spectra of CGA and BSA at 25 ℃
注:BSA 浓度为1.2×10-6 mol/L;CGA 浓度1→8 依次为(0,0.6,1.2,1.8,2.4,3.0,3.6,4.2)×10-6 mol/L。
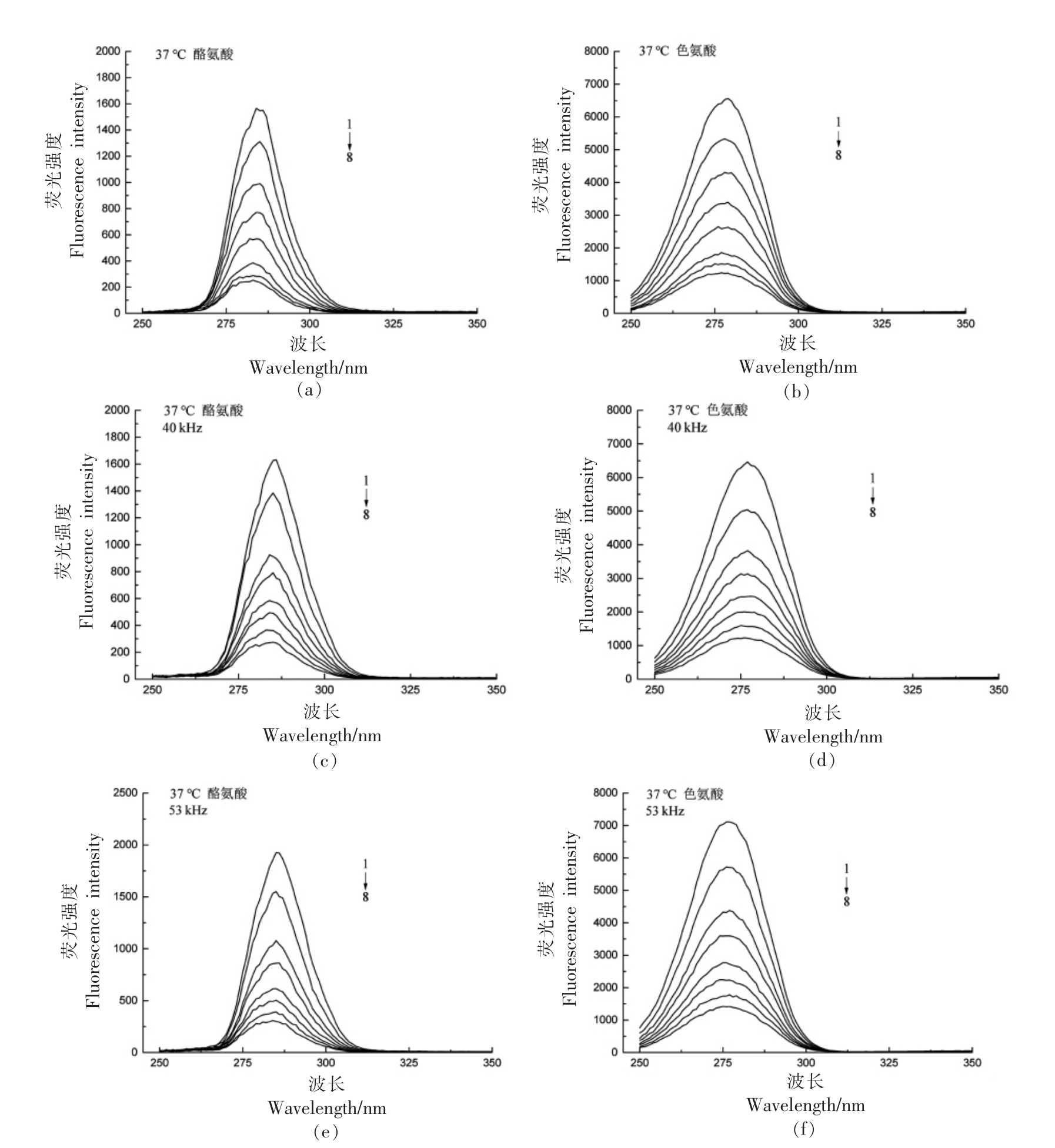
图3 37 ℃时超声频率对CGA 与BSA 作用的同步荧光光谱的影响
Fig.3 Effect of ultrasonic frequency on synchronous fluorescence spectra of CGA and BSA at 37 ℃
注:BSA 浓度为1.2×10-6 mol/L;CGA 浓度1 →8 依次为(0,0.6,1.2,1.8,2.4,3.0,3.6,4.2)×10-6 mol/L。
2.3 荧光猝灭机理
本文中荧光猝灭机理由Stern-Volmer 方程(1)和Acharya 方程(2)来进行描述[19]。
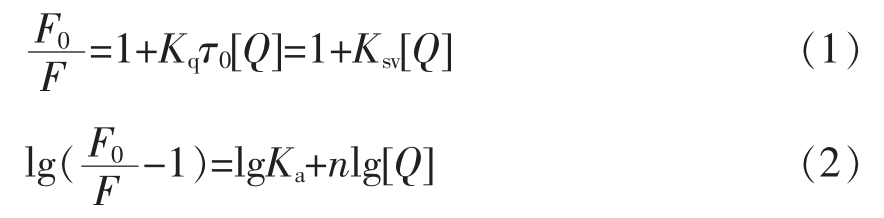
式中:F0——未加入CGA 时BSA 的荧光峰值;F——加入CGA 后BSA 的荧光峰值;[Q]——CGA 的浓度,mol/L;τ0——荧光分子平均寿命,s,BSA 的τ0 约为10-8 s;Kq——生物分子的猝灭速率 常 数,L/(mol·s);Ksv——Stern-Volmer 猝灭常数,L/mol;Ka——Acharya 结合常数,L/mol。
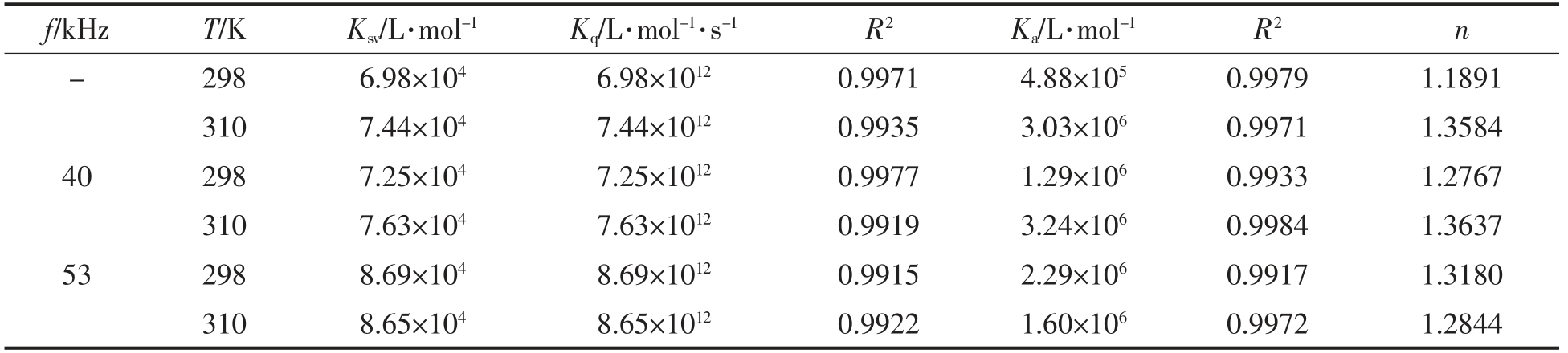
由表1可知,CGA 与BSA 作用的猝灭速率常数Kq 大于1012 L/(mol·s),远大于最大动态猝灭的Kq 值,说明CGA 与BSA 形成了复合物且为静态猝灭[20-21],许多以往的研究也证明了如茶多酚等多酚类物质与血清白蛋白发生静态猝灭作用[22],因此结果可靠;温度一定时,随超声频率的升高,CGA 对于BSA 的猝灭常数Ksv 增大;25 ℃时,经超声处理后的结合常数Ka 明显升高(P<0.05),说明超声处理促进CGA 与BSA 的结合。37 ℃、40 kHz时,结合常数Ka 相较未超声处理有所增大,但53 kHz 时却又降低,说明超声处理超过一定频率,反而会对CGA 与BSA 的结合产生抑制作用。
表1 CGA 与BSA 相互作用的荧光猝灭常数
Table 1 Fluorescence quenching constants of BSA by CGA
?
2.4 热力学性质
蛋白质与小分子间的主要作用力类型为:范德华力、氢键、静电相互作用以及疏水相互作用等[23]。根据Van's Hoff 方程(3)和热力学方程(4)分别计算反应的焓变ΔH、吉布斯自由能ΔG 和熵变ΔS,并比较在频率40,53 kHz 处理后数值的变化情况。
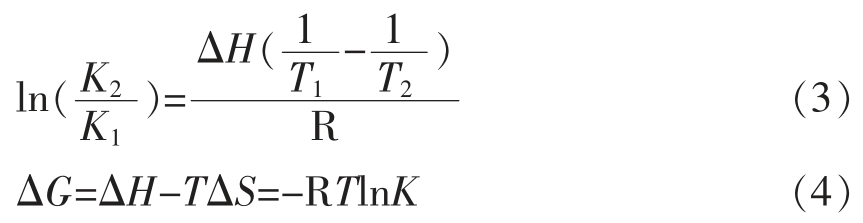
式中:K1、K2 为T1、T2 时的结合常数;ΔG——吉布斯自由能,kJ/mol;ΔH——焓变,kJ/mol;ΔS——熵变,J/(mol·K)。当ΔS 和ΔH 均大于0时,分子间作用力为疏水相互作用;当ΔH≈0,ΔS>0 时,为静电相互作用;当ΔS 和ΔH 均小于0时则为氢键和范德华力[24-25]。
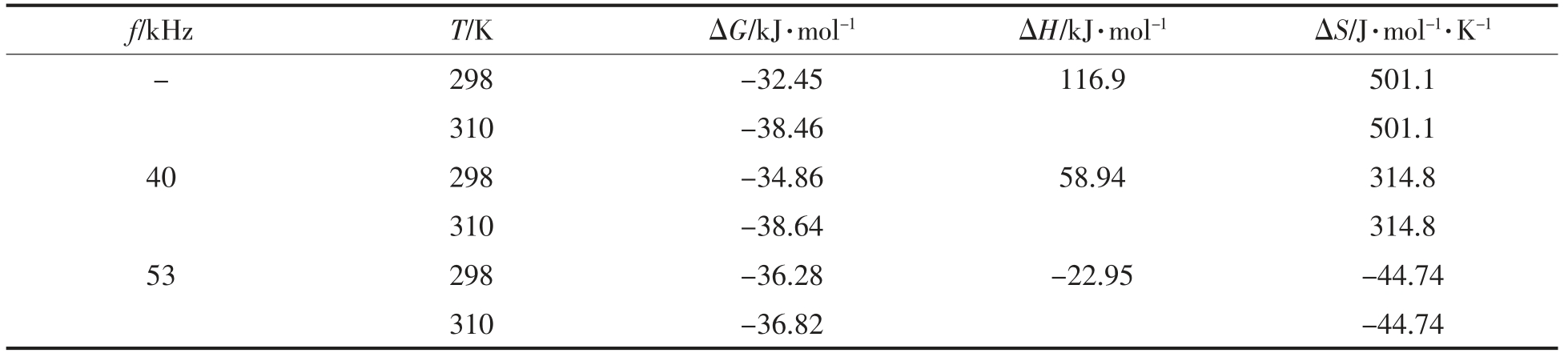
由表2可知,25 ℃时,反应的ΔH<0,ΔG<0,ΔS<0,说明CGA 与BSA 的作用过程是一个熵减少,分子结合后自由能升高的自发放热反应,结合前人的研究推断此时分子间作用力为氢键。随超声频率的升高,ΔH、ΔG 和ΔS 均减小,由此可知随超声频率的升高,其自发反应越发强烈,放出的热能也更高。37 ℃时,反应的ΔH>0,ΔG<0,ΔS>0,说明该过程是一个熵增加的自发吸热反应,同时自由能降低,作用力为疏水相互作用。超声频率变化,反应所吸收的热量也随之改变。
表2 CGA 与BSA 相互作用的热力学常数
Table 2 Thermodynamic constants of the interactions between CGA and BSA
f/kHz T/K ΔG/kJ·mol-1 ΔH/kJ·mol-1 ΔS/J·mol-1·K-1-298-32.45 116.9 501.1 310-38.46 501.1 40 298-34.86 58.94 314.8 310-38.64 314.8 53 298-36.28-22.95-44.74 310-36.82-44.74
2.5 结合位点的研究
WARF 和IBU 能与BSA 的子域ⅡA(Sudlow's site I)和子域ⅢA(Sudlow's site II)特异结合[26]。通过比较猝灭率推断CGA 与BSA 的结合位点。
由图4内插图可知,标记物的加入导致猝灭率降低,因此判断在未超声处理时CGA 与BSA相互作用的结合位点在子域ⅡA 和子域ⅢA 之间。由图5内插图可知,40 kHz 时,加入标记物后,猝灭率在低CGA 浓度下无明显变化,而随CGA浓度升高猝灭率又明显降低,说明超声可改变CGA 在低浓度下的结合位点,而对高浓度CGA 与BSA 的结合位点无影响。
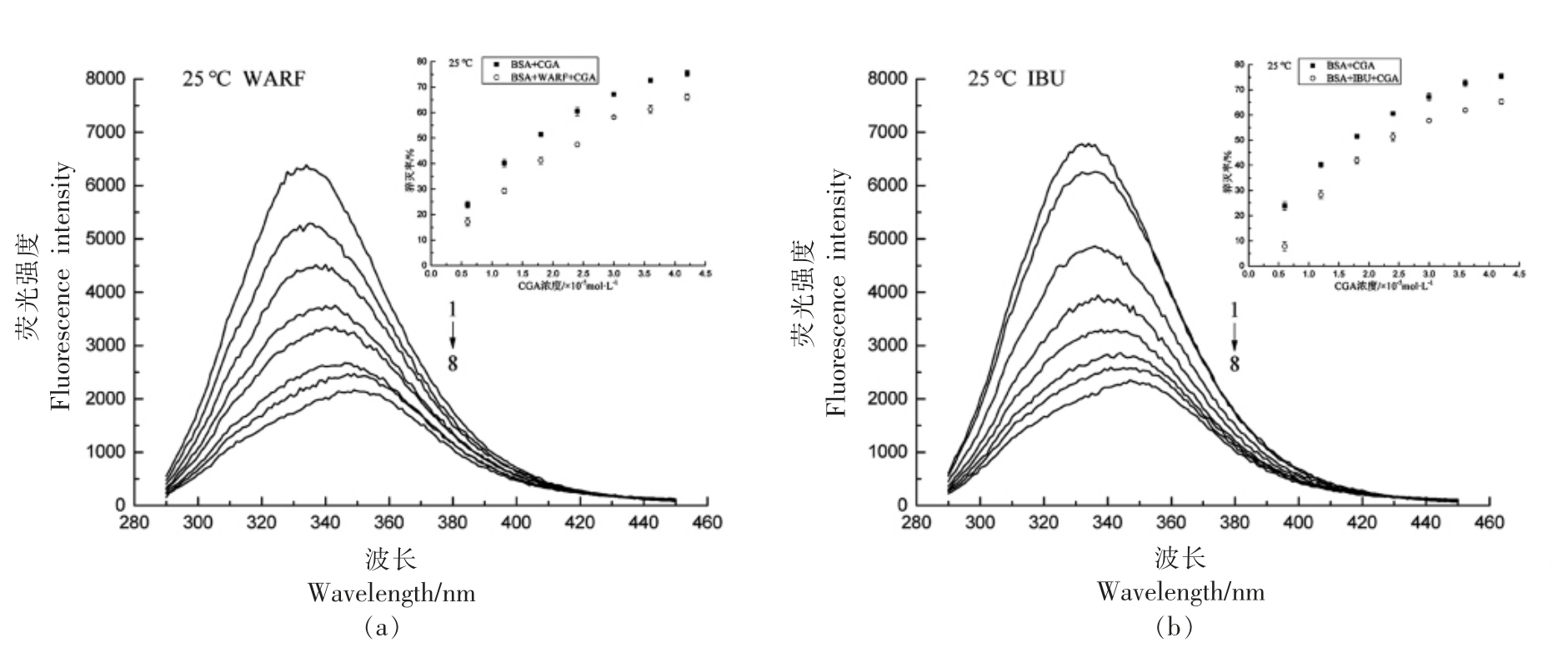
图4 WARF 与IBU 对于CGA 与BSA 作用的荧光光谱的影响
Fig.4 Effects of WARF and IBU on fluorescence spectra of CGA and BSA
注:WARF 浓度6.0×10-6 mol/L;IBU 浓度6.0×10-6 mol/L;BSA 浓度1.2×10-6 mol/L;CGA 浓度1→8 依次为(0,0.6,1.2,1.8,2.4,3.0,3.6,4.2)×10-6 mol/L。

图5 40 kHz 超声下WARF 与IBU 对于CGA 与BSA 作用的荧光光谱的影响
Fig.5 Effects of WARF and IBU on fluorescence spectra of CGA and BSA under 40 kHz ultrasonic treatment
注:WARF 浓度6.0×10-6 mol/L;IBU 浓度6.0×10-6 mol/L;BSA 浓度1.2×10-6 mol/L;CGA 浓度1→8 依次为(0,0.6,1.2,1.8,2.4,3.0,3.6,4.2)×10-6 mol/L。
2.6 超声处理对CGA 与BSA 紫外光谱的影响
紫外-可见吸收光谱法广泛用于探索蛋白质的结构变化和研究蛋白质配体复合物的形成,是通过分析蛋白质Trp 和Tyr 残基周围的变化来研究蛋白质与配体相互作用的有效工具[26]。CGA 与BSA 的反应产物对于紫外光的吸收具有专一性,即一定结构的分子只可以吸收一定的能量,这样就可以通过紫外光谱来研究其产物的结构特点及其特性。
由图6可知,25 ℃时,紫外光谱峰形无变化,随CGA 浓度的升高,吸光度值增大。在静态猝灭中,猝灭剂和蛋白质之间形成复合物。而在动态猝灭中,猝灭剂与蛋白质发生碰撞扩散。动态猝灭只影响荧光分子的激发态,而不影响荧光物质的紫外吸收光谱的变化[27]。结果再次证实了CGA 与BSA 的相互作用是通过静态猝灭机制实现的。未超声的吸光度峰值比超声后的大,紫外吸收光谱发生15 nm 的蓝移,说明超声处理后CGA 与BSA反应的产物发生部分解离,生成了新的物质;同时超声处理导致BSA 的结构骨架变得舒展,二级构象发生改变,微环境疏水性减小。同时,也有研究表明超声处理同样会迫使β-乳球蛋白的二、三级结构发生改变[28]。
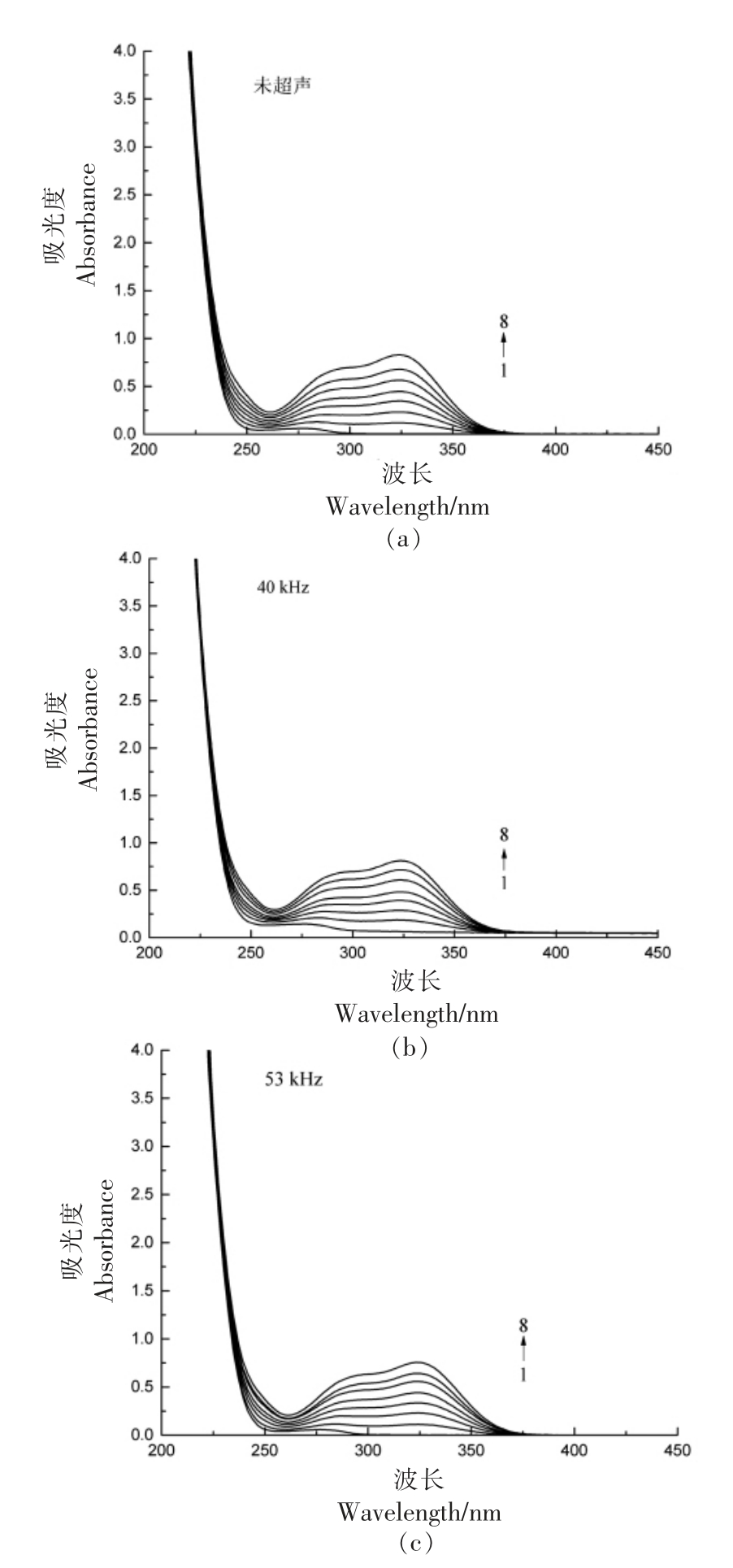
图6 25 ℃时超声频率对CGA 与BSA 作用的紫外-可见吸收光谱的影响
Fig.6 Effect of ultrasonic frequency on UV-vis absorption spectra of CGA and BSA at 25 ℃
注:BSA 浓度为1.2×10-6 mol/L;CGA 浓度1→8 依次为(0,0.6,1.2,1.8,2.4,3.6,4.2)×10-6 mol/L。
3 结论
CGA 可与BSA 发生结合作用且自发进行,猝灭类型为静态猝灭。CGA 与BSA 作用的结合位点在亚结构域ⅡA 和亚结构域ⅢA 之间,且CGA 在浓度低时与BSA 的结合位点受超声处理影响。25℃时,CGA 与BSA 的反应是一个熵减少的自发放热反应,作用力为氢键和范德华力;37 ℃时是一个熵增加的自发吸热反应,作用力为疏水相互作用,因此温度可能改变CGA 与BSA 结合的作用力。超声处理可使CGA-BSA 复合物的构象发生一定改变,并且对CGA 与BSA 的结合起增强作用。超声处理不会影响CGA 与BSA 结合的作用力类型,只影响反应的强度,但可能对CGA 在BSA 上的结合位点造成一定影响。经超声处理后,CGABSA 复合物发生部分分解,BSA 的二级构象发生变化,使BSA 的氨基酸残基的微环境发生改变,即极性增强,疏水性变小。研究结果表明CGA 与BSA 的相互作用受超声处理的影响,且不同超声频率影响不同。在生产加工中选择合适的处理条件及处理方式可以达到一定的目的。本研究结果将为超声处理对蛋白质与配体结合的影响提供有益的参考。
[1]KARAR M G E,MATEI M F,JAISWAL R,et al.Neuraminidase inhibition of Dietary chlorogenic acids and derivatives-potential antivirals from dietary sources[J].Food & Function,2016,7(4):2052-2059.
[2]赵惠茹,路荣荣,靖会,等.金银花中绿原酸超声提取工艺的优化[J].化工科技,2018,26(6):22-26.
ZHAO H R,LU R R,JING H,et al.Optimization of extraction technology of chlorogenic acid from Lonicera japonica by ultrasonic method[J].Science &Technology in Chemical Industry,2018,26 (6):22-26.
[3]王晓梅,奚宇,范新光,等.绿原酸的生物利用率和抗氧化活性研究进展[J].中国食品学报,2019,19(1):271-279.
WANG X M,XI Y,FAN X G,et al.Research progress on bioavailability and antioxidant activity of chlorogenic acid[J].Journal of Chinese Institute of Food Science and Technology,2019,19(1):271-279.
[4]JIAO W,SHU C,LI X X,et al.Preparation of a chitosan-chlorogenic acid conjugate and its application as edible coating in postharvest preservation of peach fruit[J].Postharvest Biology and Technology,2019,154(4):129-136.
[5]SUN Z L,ZHANG X X,WU H H,et al.Antibacterial activity and action mode of chlorogenic acid against Salmonella Enteritidis,a foodborne pathogen in chilled fresh chicken[J].World Journal of Microbiology and Biotechnology,2020,36(2):24.
[6]PAWAR S K,NAIK R S,SEETHARAMAPPA J.Exploring the binding of two potent anticancer drugs bosutinib and imatinib mesylate with bovine serum albumin:spectroscopic and molecular dynamic simulation studies[J].Analytical & Bioanalytical Chemistry,2017,409(27):6325-6335.
[7]TOMASZ J,RODRIGUEAS L R,ZANETA C.Study of metal-lipopeptide complexes and their selfassembly behavior,micelle formation,interaction with bovine serum albumin and biological properties[J].Journal of Molecular Liquids,2018,268:743-753.
[8]OSBORN B L,OLSEN H S,NARDELLI B,et al.Pharmacokinetic and pharmacodynamic studies of a human serum albumin-interferon-α fusion protein in cynomolgus monkeys[J].Journal of Pharmacology &Experimental Therapeutics,2002,303(2):540-548.
[9]RABBANI G,AHN S N.Structure,enzymatic activities,glycation and therapeutic potential of human serum albumin:A natural cargo [J].International Journal of Biological Macromolecules,2019,123:979-990.
[10]YAO C Y,DING Y X,LI P F,et al.Effects of chlorogenic acid on the binding process of cadmium with bovine serum albumin:A multi-spectroscopic and docking study[J].Journal of Molecular Structure,2019,1204(15):127531.
[11]O'SULLIVAN J,MURRAY B,FLYNN C,et al.The effect of ultrasound treatment on the structural,physical and emulsifying properties of animal and vegetable proteins[J].Food Hydrocolloids,2016,53:141-154.
[12]MASUZAWA N,OHDAIRA E,IDE M.Effects of ultrasonic irradiation on phenolic compounds in wine[J].Japanese Journal of Applied Physics,2000,39(5):2978-2979.
[13]STOJADINOVIC M,RADOSAVLJEVIC J,OGNJENOVIC J,et al.Binding affinity between dietary polyphenols and β-lactoglobulin negatively correlates with the protein susceptibility to digestion and total antioxidant activity of complexes formed[J].Food Chemistry,2013,136(3/4):1263-1271.
[14]ZHANG Y Z,ZHOU B,ZHANG X P,et al.Interaction of malachite green with bovine serum albumin:Determination of the binding mechanism and binding site by spectroscopic methods[J].Journal of Hazardous Materials,2009,163(2/3):1345-1352.
[15]VIOLETTA M,TIMEA B,GABRIELLA B,et al.Interactions of casticin,ipriflavone,and resveratrol with serum albumin and their inhibitory effects on CYP2C9 and CYP3A4 enzymes[J].Biomedecine &Pharmacotherapie,2018,107:777-784.
[16]WU W H,KONG X Z,ZHANG C M,et al.Improving the stability of wheat gliadin nanoparticleeffect of gum arabic addition[J].Food Hydrocolloids,2018,80(7):78-87.
[17]黄朝波,徐晗,杨明冠,等.光谱法和分子对接研究红斑红曲胺与牛血清白蛋白相互作用[J].光谱学与光谱分析,2019,39(10):3102-3108.
HUANG C B,XU H,YANG M G,et al.The interaction between rubropunctamine and bovine serum albumin using spectrometry and molecular docking[J].Spectroscopy and Spectral Analysis,2019,39(10):3102-3108.
[18]SAHA S,CHOWDHURY J.Binding interaction of juglone with lysozyme:Spectroscopic studies aided by in silico calculations[J].Journal of Photochemistry& Photobiology B Biology,2019,193:89-99.
[19]TANG B,HUANG Y M,MA X L,et al.Multispectroscopic and docking studies on the binding of chlorogenic acid isomers to human serum albumin:Effects of esteryl position on affinity[J].Food Chemistry,2016,212:434-442.
[20]KOHLMANN T,NAUMANN R,KERZIG C,et al.Combined static and dynamic quenching in micellar systems-closed-form integrated rate laws verified with a versatile probe[J].Physical Chemistry Chemical Physics,2017,19(13):8735-8741.
[21]赵刚,顾佳丽,励建荣.胭脂红与牛血清白蛋白相互作用的光谱学研究[J].中国食品学报,2017,17(5):270-275.
ZHAO G,GU J L,LI J R.Spectroscopic analysis on the interaction of ponceau 4R and bovine serum albumin[J].Journal of Chinese Institute of Food Science and Technology,2017,17(5):270-275.
[22]BOSE A.Interaction of tea polyphenols with serum albumins:A fluorescence spectroscopic analysis[J].Journal of Luminescence,2016,169:220-226.
[23]RAHAYU P P,ANDRIANI R D,MALIGAN J M.Molecular docking studies and physicochemical properties on the interaction of xanthone with whey protein (β-lactoglobulin and α-lactalbumin)[J].IOP Conference Series Earth and Environmental Science,2020,443(1):012011.
[24]王晨,谢岩黎,范亭亭.花青素与小麦蛋白相互作用及对蛋白质结构的影响[J].食品科学,2019,40(20):60-66.
WANG C,XIE Y L,FAN T T.Interactions of Cyanidin-3-O-Glucoside with gliadin and glutenin and their effects on protein structure[J].Food Science,2019,40(20):60-66.
[25]ZHANG H M,WU P R,WANG Y Q,et al.Affinity of miriplatin to human serum albumin and its effect on protein structure and stability[J].International Journal of Biological Macromolecules,2016,92:593-599.
[26]BENVIDI A,REZAEINASAB M,GHARAGHANI S,et al.Experimental and theoretical investigation of interaction between bovine serum albumin and the mixture of caffeic acid and salicylic acid as the antioxidants[J].Electrochimica Acta,2017,255:428-441.
[27]TANG L,LI S,BI H N,et al.Interaction of cyanidin-3-O-glucoside with three proteins[J].Food Chemistry,2016,196:550-559.
[28]李雪,涂宗财,齐午城,等.超声波处理对β-乳球蛋白结构和抗原性的影响[J].食品工业科技,2016,37(18):106-110.
LI X,TU Z C,QI W C,et al.Effect of ultrasound treatment on structure and antigenicity of βlactoglobulin[J].Science and Technology of Food Industry,2016,37(18):106-110.