新生儿(neonate,newborn)是指从出生断脐到生后28 d 内的婴儿,是胎儿出生后生理功能调节并适应宫外环境的一个特殊阶段,具有生长发育速度快,消化能力弱,免疫力低的特点[1-4]。世界卫生组织(Word Health Organization,WHO)报道母乳喂养是新生儿最理想的喂养方式。而当母乳不足或无法进行母乳喂养时,配方食品显得至关重要。
配方液态乳是一种无需冲调、健康卫生、可直接食用的新型配方食品,是新生儿的最佳选择[5]。目前,我国配方液态乳处于起步阶段,主要是超高温灭菌(Ultra-high temperature,UHT) 的12~24个月龄的婴儿配方乳[6]。新生儿免疫力较低,对配方食品的安全性要求高,UHT 之后仍有一些热稳定性细菌和酶存活,容易导致配方乳品质劣变,影响新生儿的生长发育[7]。瓶内灭菌(Retort),工艺条件一般为118~122 ℃、15~20 min[8],是一种医院用于早产儿配方乳灭菌的方式,在日本已广泛用于生活无法自理的老年人肠内配方液态乳的灭菌。Retort 是一个比UHT 更安全的杀菌过程,然而Retort 较高的温度和较长的时间会导致较多营养物质的损失[9-10]。近年来,Hope 等[11]用121 ℃、5 min 的Retort 对捐赠母乳灭菌,与保持巴氏灭菌(holder pasteurization)相比,其宏量营养素的损失小,然而赖氨酸和维生素B1 的含量有所减少。Yasuhiro 等[12]将121 ℃、10 min 的Retort 肠内配方液态乳与UHT 肠内配方液态乳进行对比,两种肠内配方液态乳对小鼠增重效果相同,说明Retort工艺营养物质损失较小。上述两个文献的Retort的灭菌时间虽然都低于通常的时间范围,但是均达到货架期内稳定的效果。适当降低Retort 的灭菌温度,既可减少营养物质损失,又可满足微生物安全的要求,具有实用价值。
本研究在低于一般的Retort 工艺参数条件下,通过单因素实验和正交试验优化Retort 工艺,使产品体系更加稳定,在确保新生儿配方液态乳安全性的同时,最大程度地降低营养物质损失。通过体系的优化确定最优的Retort 工艺,以提升产品稳定性,使其微生物安全性更高,体系微观结构更好。
1 材料与方法
1.1 材料与试剂
生牛乳,购自东北农业大学附近超市;脱脂乳,使用脱脂机制备;乳清蛋白粉,恒天然商贸(上海)有限公司;乳糖,山东萍聚科技有限公司;脱盐乳清粉,法国EUROSERUM 公司;低聚果糖,阳湖生物技术有限公司;低聚半乳糖,量子高科集团有限公司;复配植物油,秦皇岛金海特种食用油工业有限公司;DHA 和ARA,湖北福星生物科技有限公司;复配维生素和复配矿物质,北京金康普食品科技有限公司;尼罗红,上海源叶生物科技有限公司。
1.2 仪器与设备
容量250 mL 玻璃瓶,徐州宏华玻璃科技有限公司;菌落总数测试片,广东达元绿洲食品安全科技股份有限公司;Mastersizer 2000 激光粒度仪,英国马尔文仪器有限公司;RST-CC 流变仪,美国博勒飞公司;PRODUCT-YS3010 色差仪,深圳三恩时科技有限公司;激光扫描共聚焦显微镜,德国Leica 公司;EVO MA 25/LS 25 扫描电子显微镜,德国卡尔蔡司公司;Scientz-150 高压均质机,宁波新芝生物科技股份有限公司;GF54DA 高压灭菌器,致微(厦门)仪器有限公司;超高温灭菌设备,上海沃迪科技有限公司。
1.3 方法
1.3.1 Retort 工艺流程 工艺流程为:生牛乳→过滤净化→与粉状原料(乳糖、浓缩乳清蛋白WPC 80 粉)和水溶性配料(食品添加剂)混合→预热溶解(至80~85 ℃)→加入脂溶性配料(需要先将脂溶性维生素、油和长链多不饱和脂肪酸溶于乳化剂)→充分混合定容→均质 (10~50 MPa)→包装(每个玻璃瓶装200 mL 配方液态乳)→瓶内灭菌(105~125 ℃,6~14 min)→冷却→检验→成品。
1.3.2 单因素实验 Chiewchan 等[13]研究了均质压力和灭菌条件对高脂椰子奶稳定性的影响,并用黏度来表征高脂椰子奶的稳定性,结果表明高脂椰子奶的黏度越大稳定性越好。因此,本研究以黏度作为Retort 液态乳稳定性的指标。
1.3.2.1 均质压力的选取 均质压力选取10,20,30,40,50 MPa,灭菌温度110 ℃,灭菌时间10 min,测定新生儿配方液态乳的黏度,选取单因素最优均质压力。
1.3.2.2 灭菌温度的选取 灭菌温度选取105,110,115,120,125 ℃,均质压力30 MPa,灭菌时间10 min,测定新生儿配方液态乳的黏度,选取单因素最优灭菌温度。
1.3.2.3 灭菌时间的选取 灭菌时间选取6,8,10,12,14 min,均质压力30 MPa,灭菌温度110℃,测定新生儿配方液态乳的黏度,选取单因素最优灭菌时间。
1.3.3 正交试验 以均质压力、灭菌温度和灭菌时间为正交试验因素,根据单因素实验,确定因素水平的取值范围。采用三因素三水平正交试验优化Retort 工艺。正交试验因素水平见表1。
表1 正交试验因素水平表
Table 1 Factors and levels of orthogonal experiment
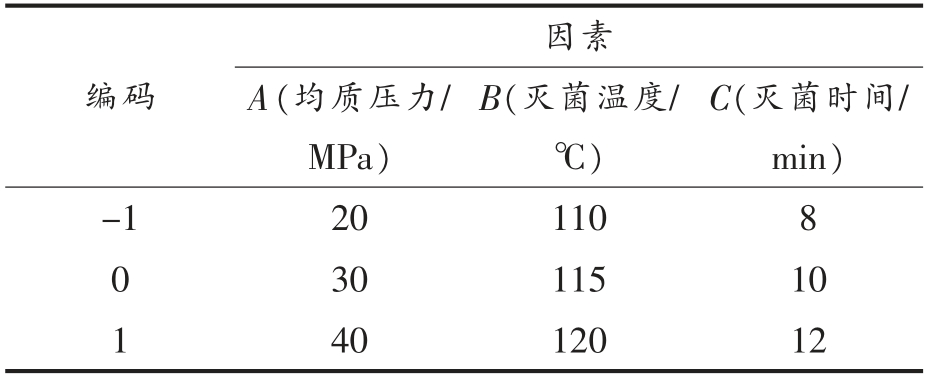
编码因素A(均质压力/MPa)C(灭菌时间/min)-1 20 110 8 0 30 115 10 1 40 120 12 B(灭菌温度/℃)
1.3.4 单因素与正交优化工艺生产的配方液态乳稳定性的比较
1.3.4.1 黏度 黏度是牛乳流变特性中最具代表
性的指标,与产品稳定性有关,可用来评价产品的品质,黏度越大体系越稳定,黏度越小体系越不稳定。采用RST-CC 流变仪,恒温25 ℃,剪切速率从0/s 上升到2 000/s,然后从2 000/s 下降到0/s,剪切速率上升和下降所需时间都是3 min(总时间为6 min)。ηa=τ/γ=kγn-1 其中ηa 是表观黏度(Pa·s),τ 是剪切应力(Pa),γ 是剪切速率(s-1),k 是稠度系数(Pa·sn),n 是流变指数[14]。
1.3.4.2 粒径 粒径是评价乳状液最重要的指标之一,产品的稳定性与粒径大小成反比,粒径越小体系越稳定,反之,粒径越大产品稳定性越差。使用Mastersizer 2000 激光粒度仪进行样品颗粒的平均粒径测定,参照Nobuhara 等[15]的方法进行调整,取175 μL 的样品用蒸馏水稀释200 倍进行测量,所有测量均在25 °C 下进行3 次。样品使用1.450 的折射率,蒸馏水使用1.331 的折射率。
1.3.4.3 ΔE 美拉德反应是热处理过程中最常见的化学反应,影响产品的感官品质与安全性,ΔE是美拉德反应的重要衡量指标,ΔE 越大,美拉德反应越强烈,ΔE 越小,美拉德反应越不剧烈。参照宋铮等[16]的方法进行ΔE 测定,使用色差计在室温下进行ΔE 测量,首先将色差计预热30 min,打开颜色管理软件,采用CIELAB 系统进行颜色校准,先进行黑板校准,再进行白板校准。将样品倒入玻璃比色杯中,把玻璃比色杯插入黑室中并连接至色差计,确定样品ΔE 的变化。L*值是亮度的度量,范围从黑度(0)到白度(100);a*值的范围从绿色(-60)到红色(+60),b*值的范围从蓝色(-60)到黄色(+60)[17]。对每个样品一式3 份进行ΔE 测量,并使用平均值。
1.3.5 生牛乳、UHT 纯牛乳和Retort 液态乳微生物安全性 本研究比较了生牛乳、UHT 新生儿配方液态乳和优化后的Retort 新生儿配方液态乳的菌落总数和嗜热需氧芽孢数,以对比优化后的瓶内灭菌工艺与UHT 工艺的微生物安全性。
1.3.5.1 菌落总数
1)样品处理 取25 mL 的样品放入225 mL的灭菌磷酸缓冲稀释液中,制成1∶10 的样品稀释液。用无菌吸管吸取1 mL 的1∶10 样品稀释液,加入9 mL 的灭菌磷酸缓冲稀释液中,制成1∶100 的样品稀释液。再用无菌吸管吸取1 mL 的1∶100 样品稀释液,加入9 mL 的灭菌磷酸缓冲稀释液中,制成1∶1 000 的样品稀释液。注意每次稀释都需要换一只无菌吸管。
2)接种 将菌落总数测试片(BB202)置于平坦的试验台面上,揭开上层膜,用无菌吸管吸取1 mL 的样品稀释液缓慢滴加到菌落总数测试片上,然后再将上层膜缓慢盖下,静置10 s。每个稀释度接种两片菌落总数测试片,同时用磷酸缓冲液做两片空白对照。
3)培养 将菌落总数测试片堆叠在一起(堆叠片数不超过12 片)放到自封袋中并封口,将透明面朝上,水平放置在恒温培养箱中。培养温度为(36±1)℃,培养时间为15~24 h。
4)计数 若只有一个稀释度的菌落总数在适宜计数范围内,计算此稀释度的两个菌落总数测试片上菌落数的平均值,再将平均值乘以相应的稀释倍数,作为每毫升样品中菌落总数;若有两个连续稀释度的菌落总数测试片的菌落数在适宜计数范围内,按(1)计算:
式中:N——样品中菌落数;Σc——测试片上菌落总数之和;n1——第1 个适宜稀释度测试片数;n2——第2 个适宜稀释度测试片数;d——稀释因子(第一稀释度)。
1.3.5.2 嗜热需氧芽孢数 嗜热需氧芽孢数可以反映乳制品的卫生指标,大量嗜热需氧芽孢会导致乳产品变质,影响新生儿的生长发育。根据中华人民共和国农业行业标准NY/T 1331-2007《乳与乳制品中嗜冷菌、需氧芽孢及嗜热需氧芽孢数的测定》进行嗜热需氧芽孢总数测定。
1.3.6 生牛乳、Retort 液态乳和UHT 液态乳的蛋白质和脂肪微观结构 为了探究Retort 和UHT对新生儿配方液态乳蛋白质和脂肪球的影响,使用SEM 和CLSM 分别观察蛋白质的交联程度和脂肪的数量和尺寸。
1.3.6.1 蛋白质微观结构 将Retort 液态乳冷冻干燥为粉末,将冻干的乳粉末用金铂碳溅射仪喷金,使用扫描电镜观察蛋白质微观结构。调节最佳视野,分别在200 倍、800 倍、1 500 倍和3 000 倍数下进行观察[18]。
1.3.6.2 脂肪微观结构 使用激光扫描共聚焦显微镜观察液态乳的脂肪球,试验方法参考Okada等[19]的方法,取1 mL 样品加入40 μL 尼罗红染色液,混合均匀后染色30 min,取5 μL 染色的乳液样品于载玻片上,盖上盖玻片并用甘油密封,在激发光波长488 nm 处,放大倍数400 倍下进行扫描观察。
1.3.7 统计分析 每组试验重复3 次,采用SPSS对试验数据进行方差分析和显著性分析;采用Origin 软件制图。
2 结果与分析
2.1 单因素实验结果与分析
2.1.1 均质压力 如图1所示(图中同曲线上不同字母表示差异显著,下同),随着均质压力的增加,新生儿配方液态乳的黏度先增加后减小,均质压力在30 MPa 时,黏度达到最大为0.00708 Pa·s。黏度越大,说明新生儿配方液态乳的体系越稳定。因此,选取30 MPa 作为单因素最适均质压力,选取20,30,40 MPa 作为正交试验因素水平。
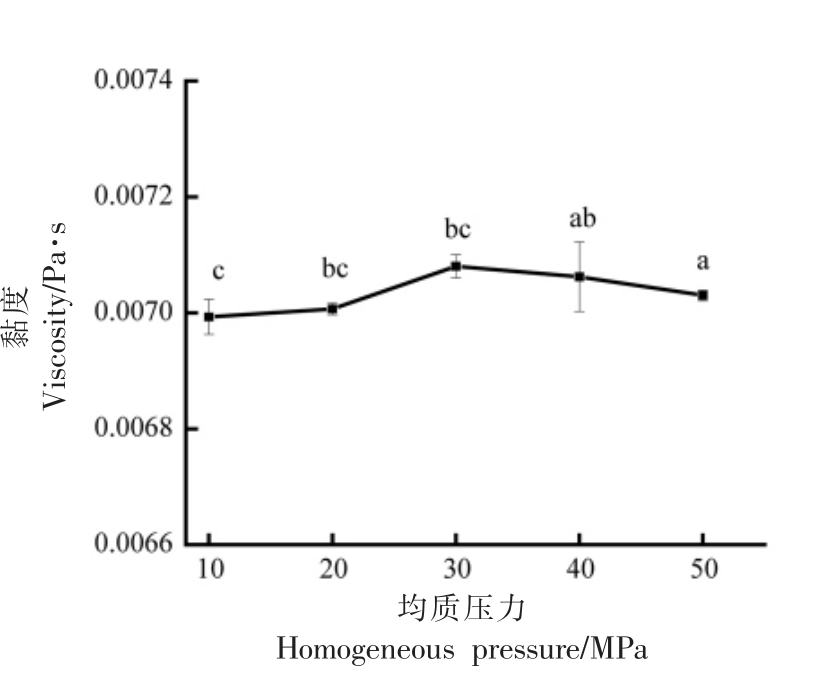
图1 均质压力对新生儿配方液态乳黏度的影响
Fig.1 Effect of homogeneous pressure on viscosity of liquid newborn formula
2.1.2 灭菌温度 如图2所示,随着灭菌温度的升高,新生儿配方液态乳的黏度呈先上升后下降的趋势。灭菌温度从105 ℃到115 ℃时,黏度缓慢上升,当灭菌温度在115 ℃时,黏度达到最大为0.07101 Pa·s,当灭菌温度达到120 ℃之后,黏度快速下降。这可能是由于灭菌温度过高,蛋白质变性程度增加,变性的蛋白质吸附在乳脂肪球膜表面,导致脂肪球带电量减小,黏度下降。因此,选取115 ℃作为单因素最适灭菌温度,选取110,115,120 ℃作为正交试验因素水平。

图2 灭菌温度对新生儿配方液态乳黏度的影响
Fig.2 Effect of sterilization temperature on viscosity of liquid newborn formula
2.1.3 灭菌时间 如图3所示,随着灭菌时间增加,新生儿配方液态乳的黏度呈先上升后减小的趋势。灭菌时间在6 min 到8 min 时,黏度缓慢增加,8 min 后黏度显著增加(P<0.05),当灭菌时间在10 min 时,黏度最大为0.00702 Pa·s,灭菌时间在10 min 后,黏度下降,这可能是由于灭菌时间较长,导致变性的蛋白质吸附到脂肪球膜表面,使表面的电荷量减小,黏度降低。因此,选取10 min为单因素最适灭菌时间,选取8,10,12 min 作为正交试验因素水平。
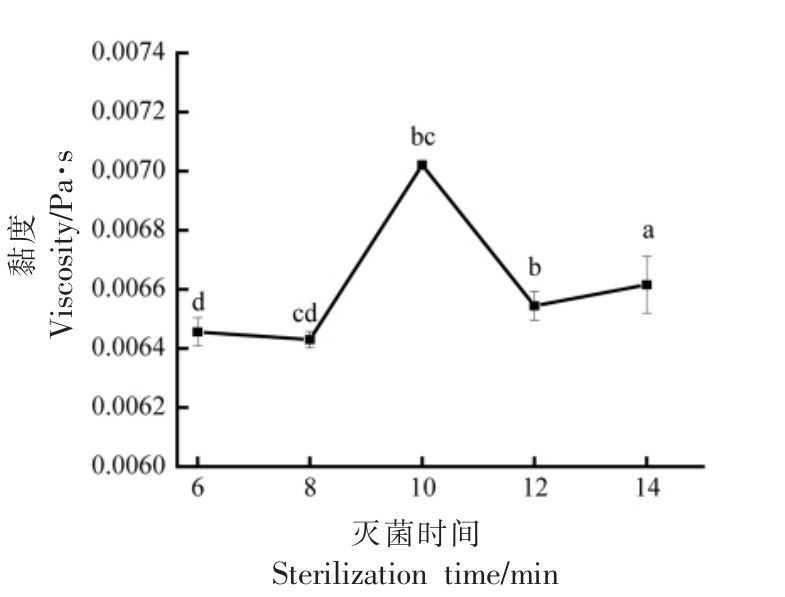
图3 灭菌时间对新生儿配方液态乳黏度的影响
Fig.3 Effect of sterilization time on viscosity of liquid newborn formula
2.2 正交试验结果与分析
由表2可知,影响新生儿配方液态乳黏度的因素主次顺序为B>C>A,即灭菌温度>灭菌时间>均质压力。优化后的条件组合为A1B2C1,即均质压力为20 MPa,灭菌温度115 ℃,灭菌时间8 min。
表2 正交试验结果
Table 2 Orthogonal test results

试验号 均质压力/MPa 灭菌温度/℃ 灭菌时间/min 黏度/Pa·s 1-1-1-1 0.00747 2-1 0 0 0.00728 3-1 1 1 0.00698 4 0-1 0 0.00702 5 0.00720 6 0 1-1 0.00708 0 0 1
2.3 单因素与正交优化工艺生产的配方液态乳稳定性比较
(续表2)

试验号 均质压力/MPa 灭菌温度/℃ 灭菌时间/min 黏度/Pa·s 7 1-1 1 0.00708 8-1 0.00717 9 1 1 0 0.00707 1 0 k1 0.00724 0.00721 0.00724 k2 0.00712 0.00722 0.00714 k3 0.00711 0.00704 0.00709 R 0.00013 0.00018 0.0015因素主次顺序 B>C>A优组合 A1B2C3
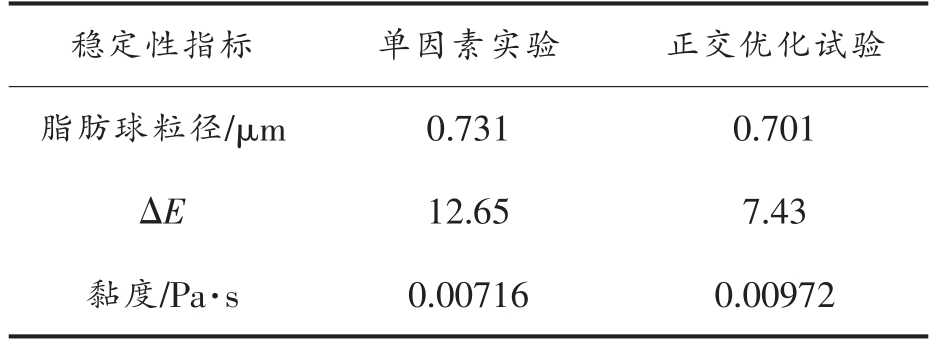
表3为单因素和正交优化工艺生产的配方液态乳的粒径、ΔE 和黏度结果。单因素工艺下的配方乳粒径为0.731 μm,ΔE 为12.65,黏 度为0.00716 Pa·s。正交优化工艺条件下的配方乳粒径为0.701 μm,ΔE 为7.43,黏度为0.00972 Pa·s,正交优化完成的瓶内灭菌新生儿配方液态乳稳定性更好,故最优工艺条件为均质压力为20 MPa,灭菌温度115 ℃,灭菌时间8 min。
表3 单因素和正交优化的产品稳定性比较
Table 3 Comparison of product stability between single factor and orthogonal optimization
?
2.4 生牛乳、Retort 液态乳和UHT 液态乳的微生物安全性分析
2.4.1 菌落总数 表4为Retort 液态乳和UHT液态乳的菌落总数,由表4可知,Retort 液态乳的菌落总数为0 CFU/mL,UHT 液态乳的菌落总数为0.91 CFU/mL。我国婴幼儿配方食品的菌落总数要小于1 000 CFU/mL[20],Retort 液态乳和UHT 液态乳的菌落总数符合此要求,并且Retort 液态乳的菌落总数显著小于UHT 液态乳(P<0.05),这说明Retort 液态乳的微生物安全性高于UHT 液态乳。
表4 生牛乳、Retort 液态乳和UHT 液态乳的菌落总数
Table 4 Aerobic plate count in raw milk,Retort liquid formula and UHT liquid formula

?
2.4.2 嗜热需氧芽孢 表5为Retort 液态乳和UHT 液态乳的嗜热需氧芽孢数,由表5可知,Retort 液态乳的嗜热需氧芽孢数为479.33 CFU/mL,UHT 液态乳的嗜热需氧芽孢数为713.00 CFU/mL。2013年美国乳业孢子研讨会提出,UHT 全脂配方乳中嗜热需氧芽孢数要小于2 000 CFU/g[21],本研究的Retort 液态乳和UHT 液态乳均符合此要求。Retort 液态乳的嗜热需氧芽孢显著少于UHT 液态乳(P<0.05),这说明Retort 液态乳的微生物安全性更高。
表5 生牛乳、Retort 液态乳和UHT 液态乳的嗜热需氧芽孢数
Table 5 Thermophilic aerobic bacterial spores in raw milk,Retort liquid formula and UHT liquid formula
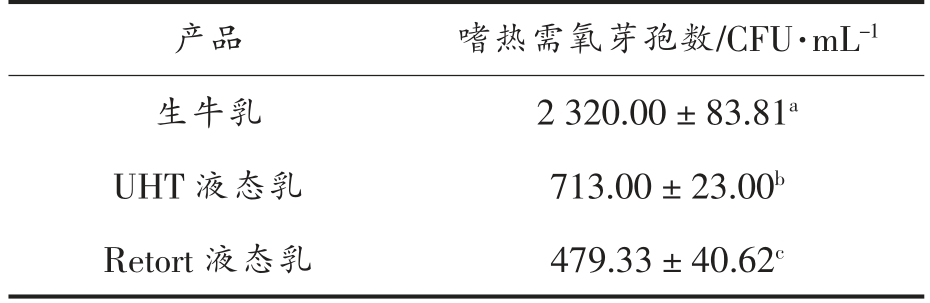
注:同一列数据右上标不同字母说明它们之间具有显著性差异(P<0.05)。
?
2.5 生牛乳、Retort 液态乳和UHT 液态乳的微观结构分析
2.5.1 蛋白质微观结构分析 乳蛋白的微观结构如图4所示,图a1~a4 为生牛乳的蛋白形态扫描电子显微镜结果,图a1 和a2 观察到蛋白表面没有蜂窝状的孔径,图a3 和a4 观察到生牛乳具有少量的蛋白聚集和交联。图b1~b4 为Retort 液态乳的蛋白形态扫描电子显微镜结果,图b1 观察到蛋白表面具有少量的孔径,图b2~b4 观察到蛋白质之间发生了聚集,形成了致密的网状结构。图c1~c4 为UHT 液态乳的蛋白形态扫描电子显微镜结果,图c1~c4 为UHT 新生儿配方液态乳的蛋白形态扫描电子显微镜结果,图c1 和图c2 观察蛋白质表面具有少量的蜂窝状孔径,图c3 和图c4观察到蛋白质之间交联没有形成致密的规则结构,具有大小不一的孔径。这可能是由于灭菌过程中温度上升至130 ℃时酪蛋白开始变性,变性的酪蛋白与酪蛋白以及酪蛋白与乳清蛋白之间形成聚合物,交联程度增加,孔径大小不一致[22]。根据图a2、b2 和c2 比较发现Retort 液态乳的蛋白交联结构与生牛乳更加相似。根据图b3、b4 与c3、c4比较发现Retort 液态乳的乳蛋白微观结构比UHT配方乳蛋白质微观结构更加致密,这可能是Retort灭菌温度低于UHT,这导致乳清蛋白变性较多,酪蛋白变性较少,变性的酪蛋白与乳清蛋白之间通过稳定的二硫键结合形成网状结构,酪蛋白均匀分布在该网状结构中,使形成的网状结构更致密,孔径较小,结构更稳定[23-24]。
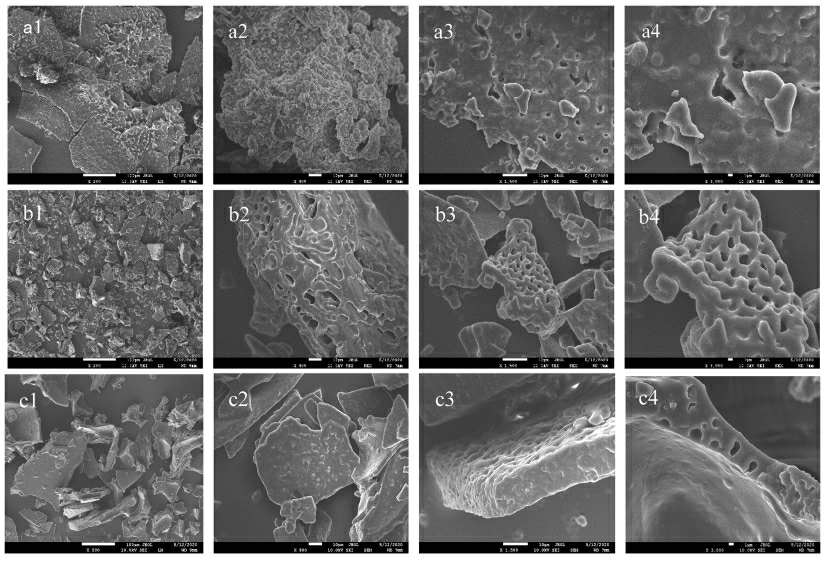
图4 Retort 液态乳和UHT 纯牛乳的乳蛋白微观结构图
Fig.4 Microstructure of Retort liquid formula and UHT pure milk
注:a1~a4.生牛乳;b1~b4.Retort 液态乳;c1~c4.UHT 液态乳;a1~c1 放大倍数为200 倍;a2~c2 放大倍数为800 倍;a3~c3 放大倍数为1 500 倍;a4~c4 放大倍数为3 000 倍。
2.5.2 脂肪球微观结构分析 使用激光扫描共聚焦显微镜进行脂肪球的微观结构分析,从图5a 可以看出,生牛乳中脂肪小球均匀分布并且没有聚集。图5b 为Retort 液态乳脂肪球观察结果,与生牛乳相比,Retort 液态乳出现了较多尺寸较小的脂肪球,这可能是由于新生儿配方乳中添加了复配植物油使脂肪球数量增多,然后经过均质使脂肪球尺寸减小。图5c 为UHT 液态乳脂肪球观察结果,与生牛乳和Retort 液态乳相比,脂肪球数量减少,尺寸增大,这可能是由于UHT 灭菌温度较高,灭菌过程导致脂肪球聚集,从而导致脂肪球尺寸增加[25]。

图5 Retort 液态乳和UHT 纯牛乳的脂肪球激光共聚焦扫描显微镜图
Fig.5 CLSM images of fat globules Retort liquid formula and UHT pure milk
注:图像为400 倍下拍摄。
3 结论
对新生儿配方液态乳的Retort 工艺进行研究,通过单因素实验和正交试验确定最佳Retort工艺为:均质压力20 MPa,灭菌温度115 ℃,灭菌时间8 min。优化完成的Retort 新生儿配方液态乳体系更加稳定,菌落总数为0 CFU/mL,嗜热需氧芽孢数较低。与UHT 液态乳相比蛋白质变性程度较小,脂肪球数量较多,尺寸较小。优化完成的瓶内灭菌工艺更适合用于新生儿配方液态乳的灭菌,Retort 液态乳为新生儿提供了营养丰富的母乳替代品。
[1]胡亚美,江载芳.诸福棠实用儿科学:第8 版[M].北京:人民卫生出版社,2015:422-425.
HU Y M,JIANG Z F.Zhu Futang practice of pediatrics:8th Edition[M].Beijing:People's Medical Publishing House Co.,Ltd.,2015:422-425.
[2]桂永浩,薛辛东.儿科学:第3 版[M].北京:人民卫生出版社,2015:2-3.
GUI Y H,XUE X D.Pediatrics[M].Beijing:People's Medical Publishing House Co.,Ltd.,2015:2-3.
[3]李冬.提高家属护理技能对新生儿健康的意义[J].临床合理用药杂志,2013,6(18):145-145.
LI D.The implications of improving family care skills for newborn health[J].Chinese Journal of Clinical Rational Drug Use,2013,6(18):145-145.
[4]LAOURA A.Maternal leukocytes and infant immune programming during breastfeeding[J].Trends in Immunology,2020,41(3):225-239.
[5]高松柏.婴儿配方乳的发展趋势[J].中国乳品工业,2003,31(1):45-49.
GAO S B.The trend of infant formula process[J].China Dairy Industry,2003,31(1):45-49.
[6]崔东影.巴氏杀菌婴儿配方乳的研制[D].哈尔滨:东北农业大学,2019:3-5.
CUI D Y.Development of pasteurized infant formula milk[D].Harbin:Northeast Agricultural University,2019:3-5.
[7]RICHARDS M,DE KOCK H L,BUYS E M,et al.Multivariate accelerated shelf-life test of low fat UHT milk[J].International Dairy Journal,2014,36(1):38-45.
[8]MONTAGNE D H,DAEL P V,SKANDERBY M,et al.Dairy Powders and Concentrated Products:Chapter 9:Infant Formulae-Powders and Liquids[M].West Sussex:Blackwell Publishing Ltd.2009,294-332.
[9]JELEN P.Advanced dairy chemistry[J].International Dairy Journal,2005,15(2):189.
[10]JUKKOLA A,ROJAS O J.Milk fat globules and associated membranes:Colloidal properties and processing effects[J].Advances in Colloid and Interface Scienc0e,2017,245:92-101.
[11]HOPE L,KENNETH V,MONTNAN W G.et al.Nutritional comparison of raw,holder pasteurized and shelf-stable human milk products[J].Journal of Pediatric Gastroenterology and Nutrition,2018,67(5):649-653.
[12]YASUHIRO,TAKEDA,MASAYUKI,et al.Effects of sterilization process on the physicochemical and nutritional properties of liquid enteral formula[J].Food Science and Technology Research,2015,21(4):573-581.
[13]CHIEWCHAN N,PHUNGAMNGOEN C,SIRIWATTANAYOTHIN S.Effect of homogenizing pressure and sterilizing condition on quality of canned high fat coconut milk[J].Journal of Food Engineering,2006,73(1):38-44.
[14]ADAMS M C,HURT E E,BARBANO D M.Effect of ceramic membrane channel geometry and uniform transmembrane pressure on limiting flux and serum protein removal during skim milk microfiltration[J].Journal of Dairy Science,2015,98(11):7527-7543.
[15]NOBUHARA T,MATSUMIYA K,NAMBU Y,et al.Stabilization of milk protein dispersion by soybean soluble polysaccharide under acidic pH conditions[J].Food Hydrocolloids,2014,34(1):39-45.
[16]宋铮,迟雪露,潘明慧,等.巴氏杀菌乳在保质期内感官品质的稳定性分析[J].中国乳品工业,2019,47(3):8-12.
SONG Z,CHI X L,PAN M H,et al.Stability analysis of sensory quality of pasteurized milk during shelf life[J].China Dairy Industry,2019,47(3):8-12.
[17]KARLSSON M A,LANGTON M,INNINGS F,et al.Changes in stability and shelf-life of ultra-high temperature treated milk during long term storage at different temperatures[J].Heliyon,2019,5(9):e02431.
[18]JEAN K,RENAN M,FAMELART M H,et al.Structure and surface properties of the serum heatinduced protein aggregates isolated from heated skim milk[J].International Dairy Journal,2006,16(4):303-315.
[19]OKADA Y,HAYASHI S.Ultrafast superresolution fluorescence imaging with spinning disk confocal microscope optics[J].Molecular Biology of the Cell,2015,26(9):1743-1751.
[20]刘晓毅.国内外乳品微生物控制要求[J].中国乳品工业,2012,40(4):39-41,44.
LIU X Y.Microbiological criteria of dairy in domestic and international[J].China Dairy Industry,2012,40(4):39-41,44.
[21]WATTERSON M J,KENT D J,BOOR K J,et al.Evaluation of dairy powder products implicates thermophilic sporeformers as the primary organisms of interest[J].Journal of Dairy Science,2014,97(4):2487-2497.
[22]WANG T T,GUO Z W,LIU Z P,et al.The aggregation behavior and interactions of yak milk protein under thermal treatment[J].Journal of Dairy Science,2016,99(8):6137-6143.
[23]蒋姗姗,程建军,李东飞,等.聚合乳清浓缩蛋白对凝固型酸奶品质特性的影响[J].中国乳品工业,2017,45(6):15-18.
JIANG S S,CHENG J J,LI D F,et al.Effect of polymerized whey protein concentrate on quality of set yogurt[J].China Dairy Industry,2017,45(6):15-18.
[24]周志伟,许永红,FAERGEMAND M,等.脱脂乳的不同热处理对其酸奶凝胶流变学性质的影响[J].中国乳品工业,2000,28(5):6-9.
ZHOU Z W,XU Y H,FAERGEMAND M,et al.Effect of forewarming on rheological properties of acid skim milk gel[J].China Dairy Industry,2000,28(5):6-9.
[25]杨楠,梁琪,杨敏,等.不同加热温度对牦牛乳酪蛋白的影响[J].食品科学,2013,34(19):14-18.
YANG N,LIANG Q,YANG M,et al.Effect of heating temperature on casein in yak milk[J].Food Science,2013,34(19):14-18.