高血压是一种常见慢性疾病,影响着31%的成人人口,与心血管疾病的发生密切相关,世卫组织(WHO)统计显示心血管疾病在全球致死率排名第一[1-2]。血管紧张素转化酶(angiotensin-converting enzyme,ACE) 在调节血压平衡起重要作用,其作用于肾素-血管紧张素-醛固酮系统和激肽释放酶-激肽系统。可将血管紧张素Ⅰ转化为血管紧张素Ⅱ,同时促进醛固酮分泌使血压升高,并能使具有血管舒张的缓激肽失活,导致血管收缩和血压升高[3]。ACE 抑制剂广泛应用于高血压的治疗,然而常用的抑制剂如卡托普利、赖诺普利、依那普利等药物[4]具有损害肾功能,引发高血钾症,使血管水肿等副作用,亟需寻找更安全、有效、无副作用的ACE 抑制剂。研究者发现从天然食品中分离出来的生物活性肽类与ACE 抑制剂有相似的作用,是良好的ACE 抑制剂替代品,这些肽通常在母体蛋白中不起作用,但母体蛋白水解后得到的部分肽段则表现出类激素活性[5-6]。目前已从粮油作物[7-8]、乳制品[9]、海洋生物等[10]中获得了食源性ACE 抑制肽,虽然这些生物活性肽的功效没有临床药物好,但是其安全、副作用小,易吸收,来源广泛,且成本较低,因而成为一大研究热点。
马面鱼为杂食性近底层鱼类,其肉质细嫩、口感鲜美、营养价值高,深受人们喜爱,常用来加工成生鱼片,最高年产量达36.0×104 t[11]。在加工过程中产生的副产物通常用来制胶、制革或提取氨基酸等低附加值产品的生产。副产物中马面鱼皮富含胶原蛋白,由胶原蛋白水解而来的多肽具有降血压、抗氧化、预防骨质疏松等多种效用。据文献报道胶原蛋白是良好的ACE 抑制肽来源,胶原蛋白含有30%以上的疏水氨基酸及丰富的羟脯氨酸,结构中疏水氨基酸能增强其活性,羟脯氨酸可提高其在肠道消化中的稳定性[12-14]。有学者从海洋生物副产物中提取出活性较高的ACE 抑制肽,而未见关于马面鱼皮胶原蛋白ACE 抑制肽的研究。本研究以马面鱼皮胶原蛋白为原料制备较高活性ACE 抑制肽,并研究其结构及ACE 抑制活性的稳定性,为马面鱼皮的深度开发及高值化利用提供一定的理论依据。
1 材料与方法
1.1 材料与试剂
马面鱼皮收集于宁波路林市场,清洗后沥干,剪成2 cm×2 cm 小块,置于-20 ℃保存备用;胶原蛋白,由马面鱼皮酸法提取所得;木瓜蛋白酶、胰蛋白酶、碱性蛋白酶、菠萝蛋白酶、中性蛋白酶、酸性蛋白酶、胃蛋白酶,北京Solarbio 公司;蛋白酶P“天野”6G、蛋白酶N“天野”、蛋白酶A“天野”2G、蛋白酶M“天野”G,日本Amano 公司;马尿酰-组氨酸-亮氨酸 (N-hippury1-His-Leu tetrahydrate,HHL)、血管紧张素转化酶(ACE),美国Sigma 公司;Sephadex G-15 葡聚糖凝胶,美国GE 公司;乙腈(HPLC 级),美国Sigma 公司;其它试剂均为国药分析。
1.2 仪器与设备
1900PC 型紫外-可见分光光度计,上海析谱仪器有限公司;UPLC-MS,沃特世(Waters)科技有限公司;高效液相色谱仪,沃特世(Waters)科技有限公司;HH-4 数显控温水浴锅,上海维诚仪器有限公司;ALPHA2-4 冷冻干燥仪,CHRIST;冷冻离心机5804R,德国Eppendorf 公司;Labscale 小型切向流超滤,密理博中国有限公司。
1.3 试验方法
1.3.1 高效液相色谱法测定血管紧张素转化酶抑制剂的活性 参照朱国萍等[15]的方法略微调整,样品处理:往样品管和空白管加入5 μL ACE 溶液,分别往样品管和空白管加入10 μL 样品液和缓冲液,37 ℃温育5 min 后加入50 μL 6 mmol/L HHL 溶液,于37 ℃恒温水浴锅中反应30 min,加入85 μL 1 mol/L HCL 中止反应,用0.22 μm 有机滤膜过滤后上样至高效液相色谱进行分析,测定溶液中马尿酸峰的面积。色谱条件:色谱柱:SunfireTM C18(150×4.6 I.D,5 μm)色谱柱。流动相A:乙腈,B:含0.05%(体积分数)TFA 和0.1%(体积分数)三乙胺的超纯水;等度洗脱(A/B,25/75,V/V);流速:0.5 mL/min;检测波长:228 nm;进样量:20 μL。
式中:A——空白对照组中马尿酸的峰面积,mAU·min;B——添加马面鱼皮胶原活性肽组中马尿酸的峰面积,mAU·min。
1.3.2 水解度的测定 水解度的测定参考赵新淮等[16]的方法。标准曲线制作方法如下:将Gly 干燥,配制成20 mg/mL 溶液,再稀释成含量为2~20 μg/mL 的溶液。各取2 mL 稀释液(空白管加蒸馏水),加入1 mL 茚三酮显色剂,混匀,15 min 沸水浴后,冷水中冷却。每管分别加入5 mL 40%乙醇混匀,放置15 min,以空白管调零并于570 nm 测吸光值A。
按标准曲线的测定步骤测定酶解液中-NH2含量(mmol/L),用蒸馏水代替酶解液做空白试验,用标准曲线计算酶解蛋白液中-NH2 含量(mmol/L)。
计算公式:

式中:h——水解后每克蛋白质被裂解的肽键的物质的量,mmol;htot——每克原料蛋白质的肽键的物质的量,mmol。
1.3.3 不同酶对胶原蛋白水解的影响 在各酶最适温度和pH 值下,用木瓜蛋白酶(55 ℃,pH 7)、胰蛋白酶(40 ℃,pH 8)、碱性蛋白酶(40 ℃,pH 10)、菠萝蛋白酶(55 ℃,pH 7)、中性蛋白酶(40℃,pH 7)、酸性蛋白酶(50 ℃,pH 2.2)、胃蛋白酶(50 ℃,pH 2.2)、蛋白酶P “天野”6G (50 ℃,pH 7)、蛋白酶N“天野”(40 ℃,pH 8)、蛋白酶A“天野”2G(50 ℃,pH 8)、蛋白酶M“天野”G(50 ℃,pH 4.5),在底物质量分数为1%,加酶量为2 000 U/g条件下,酶解4 h,以ACE 抑制率为主要指标,水解度(DH)为参考筛选出最佳用酶。
1.3.4 单因素试验 以ACE 酶活性抑制率和水解度为指标,考察水解时间(1,2,3,4,5 h),底物质量分数(1%,2%,3%,4%,5%),酶用量(1 200,2 400,3 600 U/g),对马面鱼皮胶原蛋白酶解的影响。
1.3.5 复合酶解 根据单因素结果选取最佳条件进行组合酶解试验,酶解条件如表1。
表1 复合酶酶解条件
Table 1 The hydrolysis conditions of composite enzyme

酶解条件 温度/℃ pH 值 酶用量/U·g-1 底物质量分数/% 时间/h蛋白酶N “天野”4胰蛋白酶 4蛋白酶N“天野”+胰蛋白酶 6先蛋白酶N“天野”后胰蛋白酶 先4 后4先胰蛋白酶后蛋白酶N“天野” 先4 后4 40 8.0胰蛋白酶为1 200 U/g蛋白酶N“天野”为2 400 U/g 4
1.3.6 超滤分离 将酶解液过0.45 μm 滤膜后,依次通过截留分子质量为10,8,5 ku 的超滤膜,得到分子质量分别为<5 ku,5~8 ku,8~10 ku,>10 ku 4 个级分,将各级分冷冻干燥,测定其ACE 抑制率。
1.3.7 凝胶柱层析分离 用Sephadex G-15(2 cm×50 cm I.D.) 凝胶柱对超滤所得的抗氧化活性较好的级分进一步分离纯化。洗脱为超纯水,流速0.3 mL/min,上样质量浓度20 mg/mL,上样量5 mL,检测波长220 nm,收集各洗脱峰,冻干后测定各组分ACE 抑制率。
1.3.8 高活性马面鱼皮胶原蛋白肽的HPLC 分析 色谱柱:Symmetry C18 柱 (4.6 mm×150 mm I.D.,5 μm);流动相:超纯水(A),乙腈(B);洗脱条件:0~15 min,0%~5%,15~30 min,5%~20%,30~40 min 20%~40%,40~41 min,40%~0%;流 速0.5 mL/min。检测波长220 nm;进样量10 μL。
1.3.9 高活性马面鱼皮胶原蛋白肽的UPLC-MS分析 色谱柱:Waters Acquity UPLC BEH C18 colum (50 mm×2.1 mm,1.7 μm)。洗脱条件:0.1%(体积分数)甲酸水溶液(A);乙腈(B);0~40 min,0~40%,40~42 min,40%~0;流速0.3 mL/min;进样量5 μL。质谱条件:电喷雾电离源,正离子模式,扫描分子质量100~2 000 u,毛细管电压3 000 V,锥孔电压40 V,喷雾35 psi,脱气温度350 ℃,离子源温度120 ℃,N2 流速900 L/h。
1.3.10 温度对马面鱼皮胶原蛋白肽ACE 抑制率的影响 取一定量的样品用去离子水配制成2 mg/mL 的溶液,分别在20,40,60,80,100 ℃条件下保温2 h,快速冷却至室温,测定ACE 抑制率并计算ACE 抑制活性保持率。
1.3.11 pH 值对马面鱼皮胶原蛋白肽ACE 抑制率的影响 取一定量的样品分别用pH 值为2,4,6,8,10 的缓冲液配制成2 mg/mL 的溶液,在40℃条件下保温2 h,用冷水浸泡使快速恢复至室温,测定其ACE 抑制率并计算ACE 抑制活性保持率。
1.3.12 体外模拟胃肠道消化对马面鱼皮胶原蛋白肽ACE 抑制率的影响 参考Zhu 等[17]的方法,体外模拟胃液消化:样品用pH 2.0 的0.1 mol/L KCl-HCl 缓冲液配制成5 mg/mL 的溶液,按酶与底物质量比为1∶100 加入胃蛋白酶,振荡混匀后在37 ℃下恒温水浴3 h,沸水浴灭酶5 min,用NaOH 溶液调节pH 值到8.0,取一半消化液离心(10 000 r/min,25 min),取上清,测定ACE 抑制率并计算ACE 抑制活性保持率。
体外模拟肠液消化:剩余一半消化液按酶与底物质量比为1∶100 加入胰蛋白酶,振荡混匀后在37 ℃下恒温水浴4 h,灭酶,离心,取上清,测定ACE 抑制率并计算ACE 抑制活性保持率。
1.4 数据处理与分析
使用GraphPad Prism 软件绘图,SPSS Statistics 软件进行Duncan(D)方差分析,显著性水平为P<0.05,数据以平均值±标准偏差表示。
2 结果与分析
2.1 不同酶对马面鱼皮胶原蛋白的酶解效果
由图1可知,马面鱼皮胶原蛋白经不同酶水解后,蛋白酶N“天野”2G 酶解产物对ACE 的抑制率最高胰蛋白酶次之,但由蛋白酶N“天野”2G所制备的酶解产物水解度显著性低于胰蛋白酶。酶解产物水解度差异较大但ACE 抑制能力相近,可能是由于其氨基酸组成和序列不同,蛋白酶具有专一性其只能作用于特定的位点。研究发现复合酶解可得到结构组成更丰富的肽链,可能能够提高生物活性肽活性,本研究选择胰蛋白酶和蛋白酶N“天野”2G 进行复合酶解试验,优化制备工艺。

图1 不同酶对水解度和ACE 抑制率的影响
Fig.1 Effect of different enzyme on the degree of hydrolysis and angiotensin-converting enzyme inhibitory activity
2.2 酶解工艺优化
2.2.1 单因素实验
2.2.1.1 底物质量分数、加酶量、酶解时间对蛋白酶N“Amano”2G 酶解的影响 由图2可知,用蛋白酶N“天野”2G 水解马面鱼皮胶原蛋白所得产物水解度随底物质量分数增大和时间的延长而增大后趋于平缓,在加酶量1 200~2 400 U/g 无显著性差异,3 600 U/g 时显著性增大;其对ACE 抑制率随底物质量分数的变化趋势与水解度相近,在4%达最大值;随加酶量的增加显著性下降;由图2b 可知在水解初期ACE 抑制率无显著性变化,3 h 时显著性增大,4 h 后呈下降趋势。综合水解度和ACE 抑制率考虑,蛋白酶N“天野”2G最佳水解条件为:底物质量分数4%,加酶量1 200 U/g,酶解时间4 h。
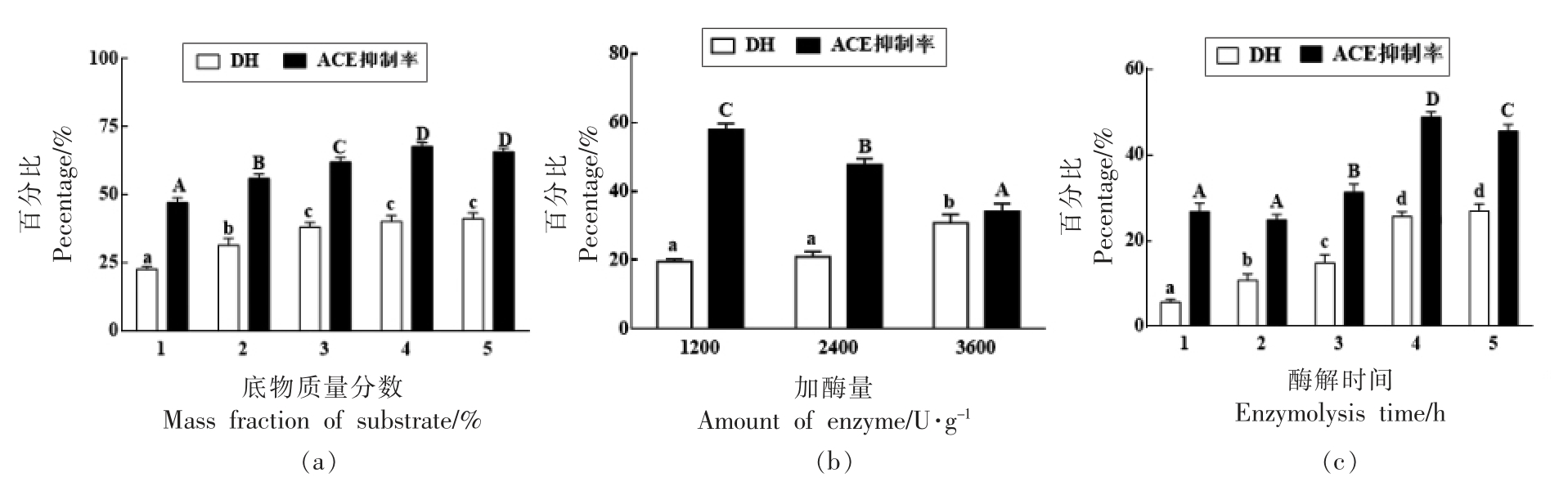
图2 底物质量分数、加酶量、酶解时间对蛋白酶N“天野”2G 酶解的影响
Fig.2 Effect of substrate concentration,amount and time on Protease N “Amano” 2G enzymatic hydrolysis
注:小写字母表示DH 差异显著,P<0.05;大写字母表示ACE 抑制率差异显著,P<0.05。
2.2.1.2 底物质量分数、加酶量、酶解时间对胰蛋白酶酶解的影响 由图3可知,用胰蛋白酶水解马面鱼皮胶原蛋白所得产物水解度和ACE 抑制率受底物质量分数影响变化趋势一致,在4%时ACE 抑制活性最强;加酶量增大水解度和ACE 抑制率增大,但当大于2 400 U/g 后ACE 抑制率显著性下降;在水解初期1~3 h 内水解度无显著性差异,后有上升趋势,其对ACE 抑制率随时间延长其变化趋势较水解度明显,先上升后下降,在4 h 时达最大值。综上,胰蛋白酶的最佳水解条件为:加酶量2 400 U/g,底物质量分数4%,酶解时间4 h。
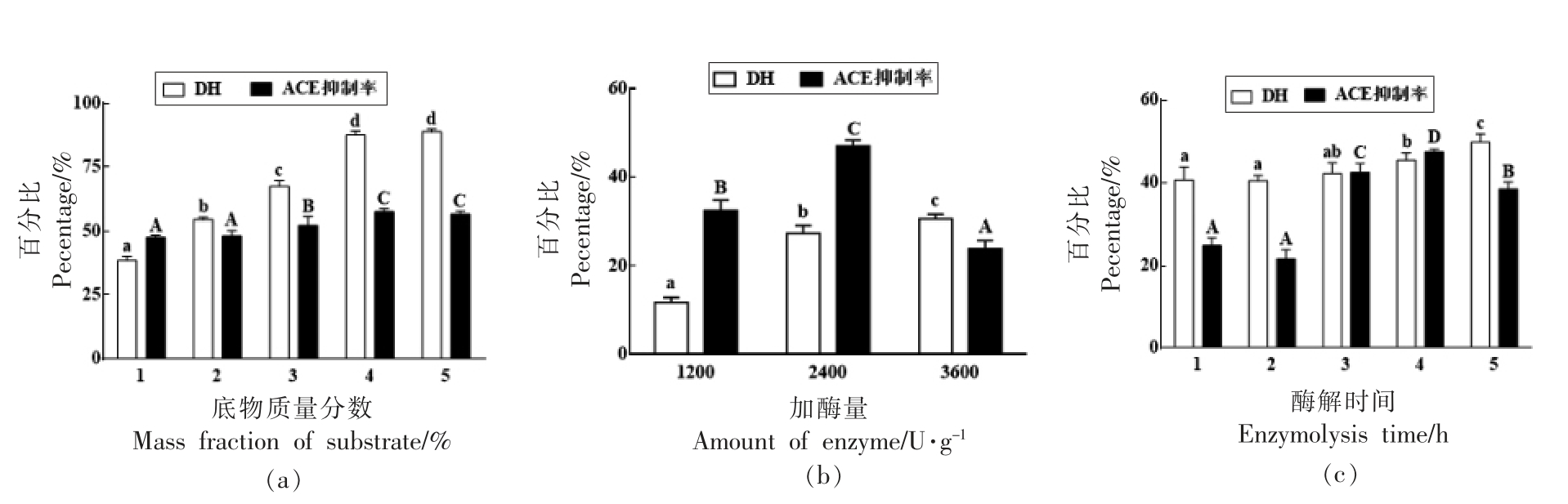
图3 底物质量分数、加酶量、酶解时间对typsin 酶解的影响
Fig.3 Effect of substrate concentration,amount and time on typsin enzymatic hydrolysis
注:小写字母表示DH 差异显著,P<0.05;大写字母表示ACE 抑制率差异显著,P<0.05。
通过以上试验发现,当加酶量固定时,底物质量分数增加水解度及ACE 抑制率都显著性上升,但达到一定浓度后无显著性变化,可能是由于底物过多,与酶接触的几率大大减小,使酶解效果降低[18]。加酶量持续增大时水解度显著提高,但当水解度过大时,ACE 抑制率反而下降,酶解过程是一个复杂的动态过程,酶在不断的寻找底物中特异的酶切位点,可能是由于前期产生的ACE 抑制肽被水解成低活性的肽段或者氨基酸失去了对ACE抑制活性[19]。在水解初期底物质量分数较高,酶的作用有限水解度与ACE 抑制率无明显变化,中期底物与酶充分接触,更多的肽被释放出来,水解度与ACE 抑制率显著性上升,当水解进行到后期,水解度持续升高但ACE 抑制率明显下降,可能是由于此时原料已被完全反应,酶继续水解小肽[20]。
2.2.2 复合酶水解工艺的确定 为了得到高活性ACE 抑制肽,基于单因素的基础上进行了双酶混合酶解及二步酶解试验。由图4可知,试验组3 的ACE 抑制率最高,即在蛋白酶N“天野”用量1 200 U/g,胰蛋白酶用量为2 400 U/g,底物质量分数4%,温度40 ℃,pH 8 的条件下,蛋白酶N“天野”和胰蛋白酶混合酶解4 h。
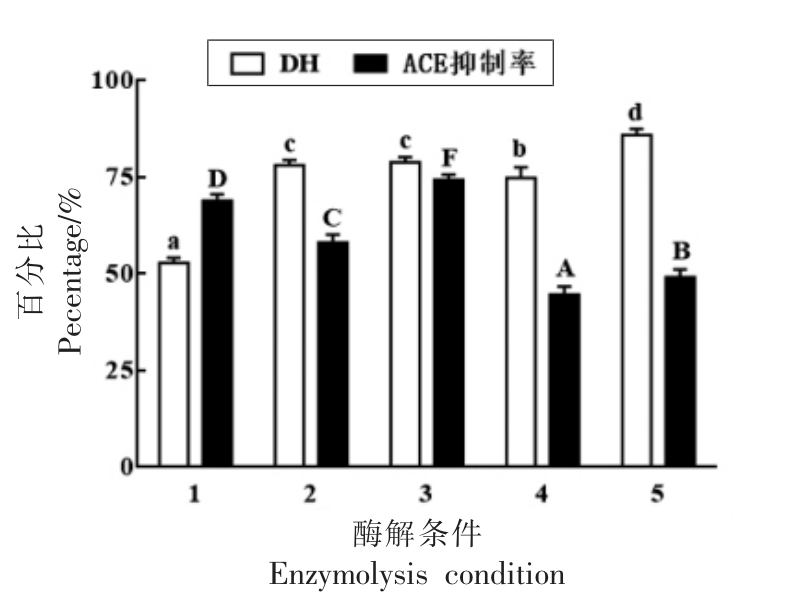
图4 复合酶酶解对酶解度和ACE 抑制率的影响
Fig.4 Effect of using mixed enzymes hydrolysis on degree of hydrolysis and angiotensin-converting enzyme inhibitory activity
注:1:蛋白酶N“天野”酶解;2:胰蛋白酶酶解;3:蛋白酶N“天野”+胰蛋白酶复合酶解;4:先蛋白酶N“天野”后胰蛋白酶复合酶解;5:先胰蛋白酶后蛋白酶N“天野”复合酶解。小写字母表示DH 差异显著,P<0.05;大写字母表示ACE 抑制率差异显著,P<0.05。
2.3 马面鱼皮胶原蛋白ACE 抑制肽的分离纯化
2.3.1 超滤分离 由表2可知低分子质量肽段ACE 抑制率高于大分子质量肽段,a 级分得率最高,ACE 抑制率也最高,说明有效的ACE 活性成分集中在小于5 ku 分子质量物质中。Natesh 等[21]的研究表明由2~12 个氨基酸组成的小分子质量肽段比大分子质量肽段更容易与ACE 活性位点结合,表现出更强的ACE 抑制活性。
表2 超滤分离组分及其抗氧化活性
Table 2 Ultrafiltration separation components and their antioxidant activity

?
2.3.2 凝胶柱层析分离 用Sephadex G-15 葡聚糖凝胶柱将超滤所得级分中抗氧化活性较强的a级分进一步分离,其洗脱曲线如图5a 所示。经凝胶过滤分离后,得到a1、a2、a3 3 个级分,a1 出峰最早说明其分子质量较大,a3 出峰最晚说明分子质量较小。由图5b 可知,分离所得各组分表现出不同的ACE 抑制活性,a1、a2、a3 对ACE 的抑制率均显著高于分离前,分别为46.52%,43.9%,43.33%,3 个级分ACE 抑制率无显著性差异(P>0.05)。
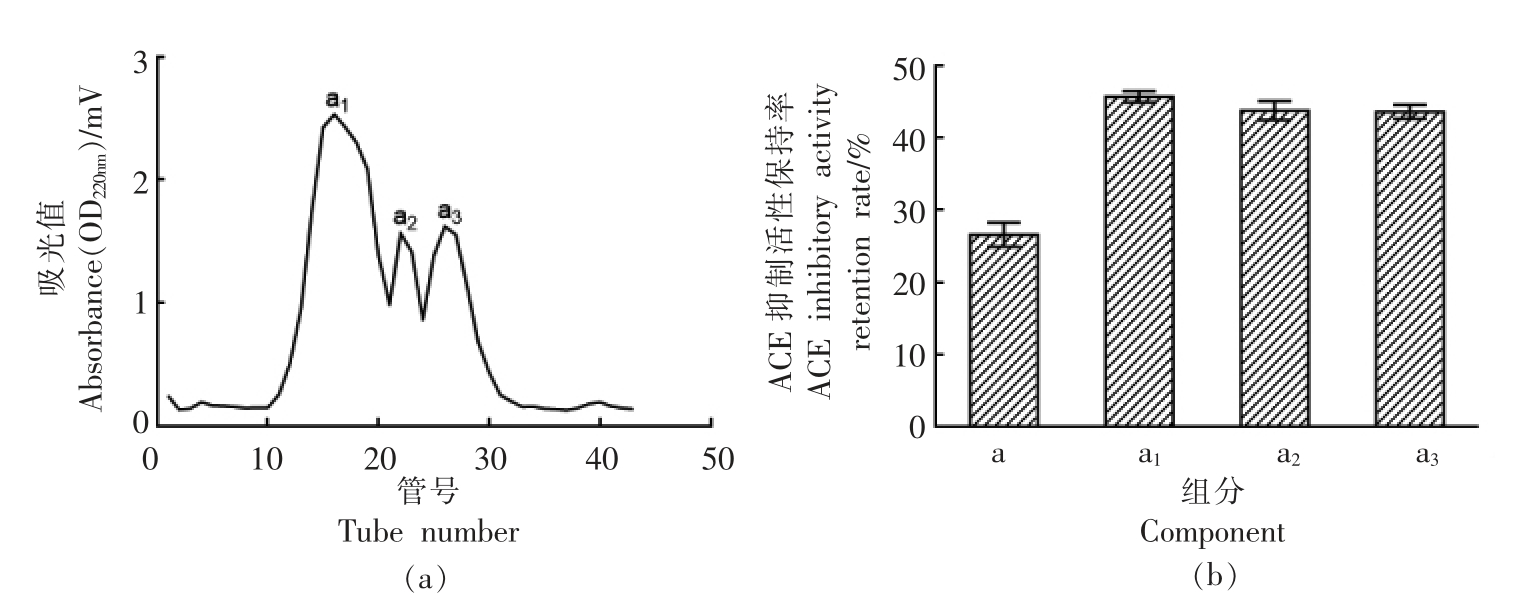
图5 凝胶过滤分离色谱及各组分抗氧化活性
Fig.5 Chromatogram of gel filtration column and the antioxidant activity of each component
2.4 马面鱼皮ACE 抑制肽活性稳定性研究
2.4.1 pH 值对马面鱼皮胶原蛋白ACE 抑制肽稳定性的影响 由图6可知,a1、a2、a3 在不同pH 值下的ACE 抑制活性保持率趋势基本一致,在pH 2~8 时ACE 抑制活性略有下降,但保留了90%左右的活性。pH 值增大至10 时,其ACE 抑制活性保持率显著性降低为原来的80%左右,可能是强碱条件下,肽易发生消旋反应,使肽链结构改变从而活性降低[20]。总体来看a1、a2 比a3 较为稳定,在酸性和碱性条件下能保持较高活性。
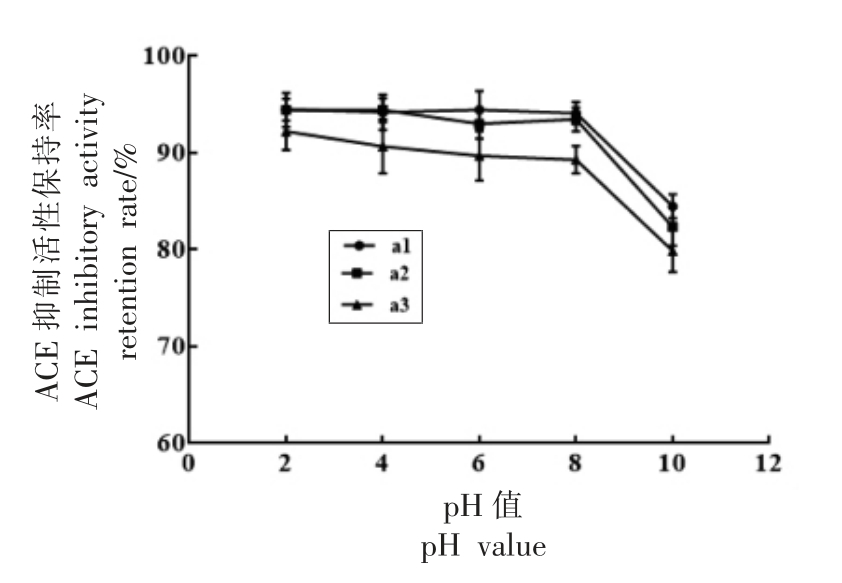
图6 pH 值对ACE 抑制肽a1、a2、a3 活性稳定性的影响
Fig.6 Effects of pH on the ACE inhibitory activity stability of a1,a2,a3
2.4.2 温度对马面鱼皮胶原蛋白ACE 抑制肽稳定性的影响 如图7所示,温度的升高对马面鱼皮胶原ACE 抑制肽活性有一定程度的影响,胶原蛋白活性肽a1、a2、a3 的ACE 抑制活性随温度升高逐渐降低,但其活性均保留有90%以上,a1 活性保持率始终较a2、a2 高。杨锋等[22]的研究也发现醋蛋多肽ACE 抑制活性对热不稳定,在100 ℃时活性仅保持了60%左右。也有研究表明ACE 抑制肽在高温下活性升高,可能是高温使肽链分解生成新的肽段与之产生协同效应,从而提高ACE 抑制活性[23];而陈秋銮等[18]制备的牡丹籽ACE 抑制肽活性几乎不受温度的影响,有较强的热稳定性。多肽活性的改变可能与高温改变肽链C 端序列有关,C 端序列是影响ACE 结合的重要因素[24]。相对而言,马面鱼皮胶原ACE 抑制肽热稳定性较高,能够在加工热处理中保持较高的活性,是一种良好的ACE 抑制剂。
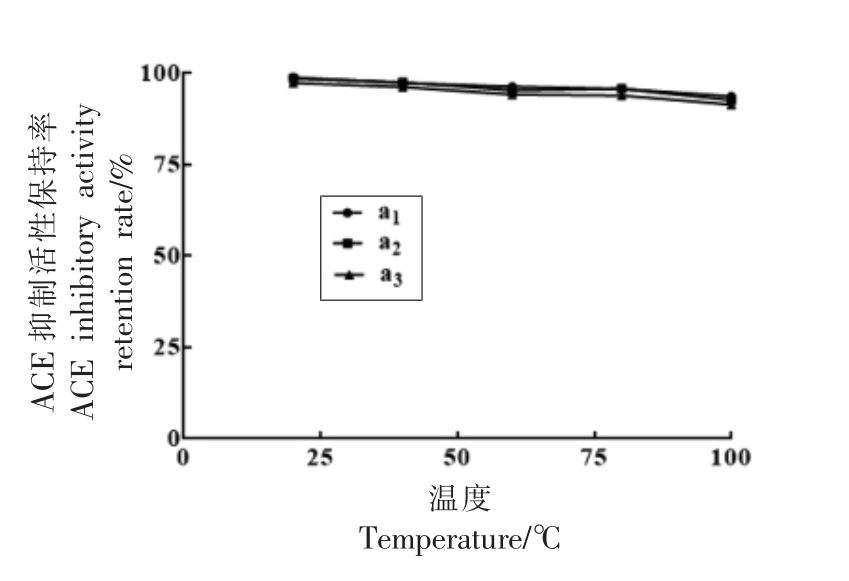
图7 温度对ACE 抑制肽a1、a2、a3 活性稳定性的影响
Fig.7 Effects of temperature on the ACE inhibitory activity stability of a1,a2,a3
2.4.3 体外模拟胃肠消化对马面鱼皮胶原蛋白ACE 抑制肽稳定性的影响 由图10可知,马面鱼皮胶原ACE 抑制肽经胃消化道模拟消化后活性均有下降,a1、a2 较a3 稳定活性均保留为原来的90%左右,而a3 经胃模拟消化后仅保留有82.26%的活性。经肠模拟消化后a1、a2、a3 ACE 抑制活性保留率分别为79.76%,73.32%,71.43%,由此可见a1 较为稳定。消化后ACE 抑制活性降低,可能是由于消化过程中胰蛋白酶和胃蛋白酶继续对肽链水解,生成低活性或无活性的肽段或氨基酸。a1 较a2、a3 稳定可能是因为其胃蛋白酶和胰蛋白酶酶切位点少,或者是因其分子质量较大经水解后生成了具有ACE 抑制活性的短肽。

图8 体外模拟胃肠消化对ACE 抑制肽a1、a2、a3活性稳定性的影响
Fig.8 Effects of gastrointestinal digestion on the ACE inhibitory activity stability of a1,a2,a3

图10 马面鱼皮胶原蛋白ACE 抑制肽主成分质谱图
Fig.10 MS spectra of major ingredient of ACE inhibitory peptides
2.5 马面鱼皮胶原蛋白ACE 抑制肽的分析
综合pH 值、温度、体外模拟胃肠道消化试验发现,a1 稳定性及活性均较好,其HPLC 及UPLCMS 分析表明(见图9),级分a1 纯度较高,分析其不同的碎片离子片段,发现m/z 为329.2 的离子信号最强,其中m/z 为272.2 的碎片离子由m/z 为329.2 的碎片离子裂解形成,而m/z 为173.1 的碎片离子是由m/z 为272.2 的碎片裂解产生的。329.2的离子碎片与272.2 的离子碎片的m/z 差值为57,由此可推断多肽末端有一个甘氨酸,而272.2的离子碎片与173.1 的碎片的m/z 差值为99.1,可推断出为一个缬氨酸,而m/z 为173.1 正好是一个丙氨酸分子质量,因此可推断出此物质可能为一个三肽,其结构可能为Gly-Val-Ala 或Ala-Val-Gly。大量研究表明活性肽的C 末端为疏水性氨基酸可增强ACE 抑制活性,Yu 等[25]对21 中大西洋鲑鱼活性肽进行构效学研究发现,肽链中疏水氨基酸与芳香族氨基酸的含量与ACE 抑制活性呈正相关。Jocksan 等[26-27]认为当C 端倒数第2 个氨基酸为脂肪族氨基酸(Val、Ala、Pro 等)时ACE 活性较强。所制备的ACE 抑制肽中Ala 和Val 为疏水氨基酸,Val 位于C 末端倒数第2 位,综上所述马面鱼皮胶原蛋白ACE 抑制肽结构基本符合目前研究报道的构效学特征,从而呈现出较高的ACE 抑制活性。
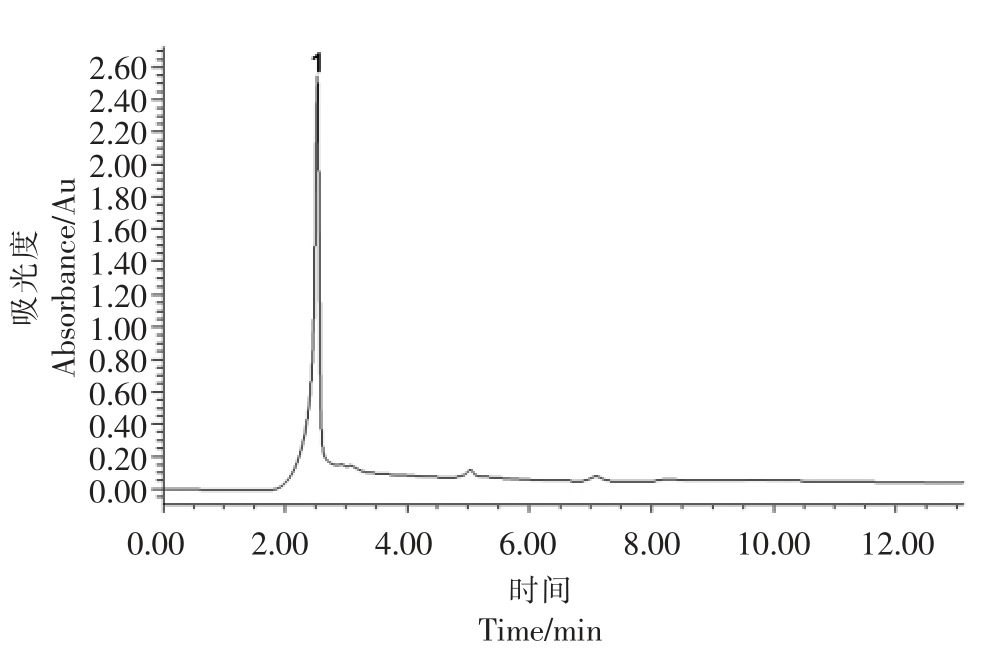
图9 高效液相分离色谱图
Fig.9 HPLC chromatogram
3 结论
以马面鱼皮为原料,在制备胶原蛋白的基础上,通过酶解法制备有ACE 抑制活性的生物活性多肽。结果表明,利用双酶混合法可制备出活性较高的ACE 抑制肽,当蛋白酶N“天野”2G 用量1 200 U/g,胰蛋白酶用量2 400 U/g,底物质量分数为4%在温度40 ℃,pH 8 的条件下混合酶解4 h时所制备的酶解产物ACE 抑制率最高。酶解产物经超滤分离后,得到的4 个级分中,分子质量小于5 ku 的级分得率最高,其ACE 抑制率也最高,说明ACE 抑制活性物质分子质量分布主要在5 ku以下。对a 级分进行凝胶过滤分离得到3 个级分(a1、a2、a3),它们对ACE 抑制率比分离前提高了两倍左右,其中a1 级分的ACE 抑制率最高,为46.52%。考察不同pH 值、温度及体外模拟胃肠消化对a1、a2、a3 活性的影响,发现所制备的ACE 抑制肽在酸性和弱碱性条件下较为稳定,随温度的升高活性略有下降,但仍能保留90%左右的活性,说明温度对其活性影响不大;经体外模拟胃液消化后,其活性降低了10%左右,模拟肠液消化后活性继续下降,其中a3 下降最为明显,仅保持了71.4%的活性,而级分a1 最为稳定,HPLC 及UPLC-MS 分析表明,所制备的a1 纯度较高,其氨基酸序列可能为Gly-Val-Gla 或Gla-Val-Gly。
[1]JOCKSAN M C,EDGAR E H,FÁTIMA R C,et al.Insertions of antihypertensive peptides and their applications in pharmacy and functional foods [J].Applied Microbiology and Biotechnology,2019,103(6):2493-2505.
[2]ORGANIZATION W H.Global status report on noncommunicable diseases 2014[J].Women,2011,47(26):2562-2563.
[3]YU D Y,WANG C,SONG Y F,et al.Discovery of novel angiotensin-converting enzyme inhibitory peptides from todarodes pacificus and their inhibitory mechanism:In silico and in vitro studies [J].International Journal of Molecular Sciences,2019,20(17):4159.
[4]CHANIKAN S,MONISOLA A,NATTA L,et al.Identification of antihypertensive peptides from mung bean protein hydrolysate and their effects in spontaneously hypertensive rats[J].Journal of Functional Foods,2020,64:1-10.
[5]MARTIN M,DEUSSEN A.Effects of natural peptides from food proteins on angiotensin converting enzyme activity and hypertension[J].Critical Reviews in Food Science and Nutrition,2019,59(8):1264-1283.
[6]YU Z P,WU S J,ZHAO W Z,et al.Identification of novel angiotensin I-converting enzyme inhibitory peptide from collagen hydrolysates and its molecular inhibitory me chan ism[J].International Journal of Food Science and Technology,2020,55(9):3145-3152.
[7]张艳,刘志伟.分步酶解法制备菜籽降血压肽[J].食品科学,2013,34(3):228-232.
ZHANG Y,LIU Z W.Preparation of antihypertensive peptides from rapeseed protein by dual-enzyme method[J].Food Science,2013,34(3):228-232.
[8]张孟凡,敬思群,郑力,等.葵花籽粕ACE 抑制肽分离纯化及其性质研究[J].粮食与油脂,2020,33(4):44-48.
ZHANG M F,JING S Q,ZHENG L,et al.Isolation-purification and characterization of ACE inhibitory peptides from sunflower seed meal [J].Cereals & Oils,2020,33(4):44-48.
[9]刘文颖,周明,冯晓文,等.乳清低聚肽的血管紧张素转化酶抑制作用及其稳定性研究[J].食品与发酵工业,2020,46(16):24-29,36.
LIU W Y,ZHOU M,FENG X W,et al.Study on stability and ACE inhibitory activity of whey oligopeptides[J].Food and Fermentation Industries,2020,46(16):24-29,36.
[10]石杰,宿瑞奇,张文婷,等.三斑海马蛋白ACE 抑制肽的制备及其二级结构的研究[J].食品研究与开发,2020,41(9):38-44.
SHI J,SU R Q,ZHANG W T,et al.Preparation and the secondary structure of angiotensin I-Con verting enzyme (ACE) inhibitory peptide from the seahorse protein [J].Food Research and Development,2020,41(9):38-44.
[11]郑元甲,洪万树,张其永.中国主要海洋底层鱼类生物学研究的回顾与展望[J].水产学报,2013,37(1):151-160.
ZHENG Y J,HONG W S,ZHANG Q Y.Review and prospects for resource biology of main marine demersal food fishes along the coastal waters of China [J].Journal of Fisheries of China,2013,37(1):151-160.
[12]王晓丹,薛璐,胡志和,等.ACE 抑制肽构效关系研究进展[J].食品科学,2017,38(5):305-310.
WANG X D,XUE L,HU Z H,et al.Progress in research on structure-activity relationship of ACE inhibitory peptides[J].Food Science,2017,38(5):305-310.
[13]刘轶,马良,张宇昊.胶原ACE 抑制肽研究进展[J].食品科学,2013,34(13):350-355.
LIU Y,MA L,ZHANG Y H.Research advances in ACE inhibitory peptides from collagen[J].Food Science,2013,34(13):350-355.
[14]MANTAKA T,CRISTIAN D G,NUALPUN S,et al.Purification and characterization of angiotensin-co nverting enzyme inhibitory peptides from Nile tilapia(Oreochromis niloticus) skin gelatine produced by an enzymatic membrane reactor[J].Journal of Functional Foods,2017,36:243-254.
[15]朱国萍,章超桦,曹文红,等.虾头自溶产物中ACE 抑制肽的分离鉴定[J].水产学报,2013,37(4):631-640.
ZHU G P,ZHANG C H,CAO W H,et al.Isolation and identification of ACE inhibitory peptides from the autolysis product of shrimp head (Litopenaeus vannamei)[J].Journal of Fisheries of China,2013,37(4):631-640.
[16]赵新淮,冯志彪.大豆蛋白水解物水解度测定的研究[J].东北农业大学学报,1995,26(2):178-181.
ZHAO X H,FENG Z B.A study on the determination of the degree of hydrolysis in soy protein hydrolysates[J].Journal of Northeast Agricultural University,1995,26(2):178-181.
[17]ZHU C Z,ZHANG W G,KANG Z L .Stability of an antioxidant peptide extracted from Jinhua ham[J].Meat Science,2014,96(2):783-789.
[18]陈秋銮,陈雪芹,马倩,等.酶解法制备牡丹籽ACE 抑制肽及其稳定性[J].食品工业科技,2020,41(19):149-156.
CHEN Q L,CHEN X Q,MA Q,et al.Preparation and stability of ACE inhibitory peptides from peony seed by enzymatic hydrolysis[J].Science and Technology of Food Industry,2020,41(19):149-156.
[19]苑园园,于宏伟,田益玲,等.酶法制备牡蛎ACE抑制肽的条件优化[J].中国食品学报,2013,13(3):115-121.
YUAN Y Y,YU H W,TIAN Y L,et al.Enzymatic preparation of angiotensin I-converting enzyme inhibitory peptides derived from oyster[J].Journal of Chinese Institute of Food Science and Technology,2013,13(3):115-121.
[20]周剑敏,尹方平,于晨,等.高粱碱溶蛋白ACE 抑制肽的制备及其稳定性研究[J].中国粮油学报,2019,34(8):66-72.
ZHOU J M,YIN F P,YU C,et al.Preparation and stability of ACE inhibitory peptides derived from sorghum protein[J].Journal of the Chinese Cereals and Oils Association,2019,34(8):66-72.
[21]NATESH R,SCHWAGER S L U,STURROCK E D,et al.Crystal structure of the human angiotensin-co nverting enzyme-lisinopril complex[J].Nature,2003,421(6922):1427-1429.
[22]杨锋,陈锦屏,吴莉莉.醋蛋多肽血管紧张素转化酶抑制活性的稳定性研究[J].食品工业科技,2012,33(11):151-153,156.
YANG F,CHEN J P,WU L L.Study on angiotensin converting enzyme inhibitory activity stability of vinegar-egg peptide [J].Science and Technolo gy of Food Industry,2012,33(11):151-153,156.
[23]刘鑫烔,宋铖铖,乔变文,等.两种皮氏蛾螺ACE抑制肽的稳定性和抑制活性[J].食品工业科技,2020,41(19):7-12,19.
LIU X T,SONG C C,QIAO B W,et al.Research on the stability of two ACE inhibitory peptides from volutharpa ampullaceal perryi[J].Science and Technology of Food Industry,2020,41(19):7-12,19.
[24]WU W,YU P P,ZHANG F Y,et al.Stability and cytotoxicity of angiotensin-I-converting enzyme inhibitory peptides derived from bovine casein [J].Journal of Zhejiang University-Science B (Biomedi cine & Biotechnology),2014,15(2),1-10.
[25]YU Z P,CHEN Y,ZHAO W Z,et al.Identification and molecular docking study of novel angiotensin-converting enzyme inhibitory peptides from Salmo salar using in silico methods[J].Journal of the Science of Food and Agriculture,2018,98(10):3907-3914.
[26]JOCKSAN M C,EDGAR E H,FÁTIMA R C,et al.Insertions of antihypertensive peptides and their applications in pharmacy and functional foods [J].Applied Microbiology and Biotechnology,201 9,103(6):2493-2505.
[27]林凯,韩雪,张兰威,等.ACE 抑制肽构效关系及其酶法制备的研究进展[J].食品科学,2017,38(3):261-270.
LIN K,HAN X,ZHANG L W,et al.Progress in structure-activity relationship and enzymatic preparation of ACE inhibitory peptides[J].Food Science,2017,38(3):261-270.