莲(Nelumo nucifera Gaertn.),睡莲科莲属,多年生水生植物,具备观赏、食用等多种经济价值[1],其种植范围主要分布在我国湖南、湖北、浙江、江苏等地区。莲子中含有丰富的营养物质及功能成分,包括原花青素、生物碱、维生素、水溶性多糖等[2]。新鲜莲子因口感脆嫩、风味独特,还具有抗氧化、保肝等功效而受到广大消费者的喜爱[3-4]。
鲜莲采收多在7~9月的高温季节,采后极易发生褐变、衰老等品质劣变。常温下鲜莲的货架期仅为3~5 d,若不经保鲜处理4~5 h 后品质就将严重下降[5-7]。因此,该产业急需安全有效的高品质保鲜技术。王建辉等[8]研究表明,4 ℃的贮藏条件与25 ℃的相比能明显延长鲜莲的货架期;朱雁青[9]研究认为,在常温条件(25 ℃)下6-BA 处理可延长鲜莲的保鲜期。王瑶等[10]研究表明,0.25 mmol/L NO 处理可有效保持鲜莲及莲子品质,常温货架期可延长2~3 d。隋棠等[11]利用气调箱结合低温,使得鲜莲贮藏期比常规包装延长1 周。Li[12-13]等研究表明0.5 μL/L 1-MCP 处理可维持采后鲜莲较好的营养品质和抗氧化性,且后期发现1-MCP 结合漆蜡处理可延缓莲子细胞壁的降解,保持细胞完整性,从而延缓采后衰老。
水杨酸(salicylic acid,SA)是植物体内的一种小分子酚类物质,被认为是一种新的植物激素和内源激发子,可参与植物体内信号转导并调节生理、生化过程[14-15]。大量国内外研究表明,SA 可以延缓果实衰老并延长货架期,诱导植物提高抗病性,增强抗逆性[16-17]。付云云等[18]研究表明SA 可以显著抑制子姜采后失重和硬度变化,延缓总酚、姜辣素等含量下降;王云香等[19]研究表明SA 可以保持西葫芦采后品质,并提高其抗氧化能力。亦有研究表明SA 处理有利于延长香蕉[20]、菠萝[21]、桃[22]等的贮藏期。然而,水杨酸对鲜莲的保鲜作用尚未见研究报道。
本试验以“十里荷一号”鲜莲为试验材料,采用不同浓度(0.2,0.4 mmol/L 和0.6 mmol/L)SA 溶液处理,研究其对鲜莲采后品质及抗氧化酶活性的影响,以期为鲜莲采后保鲜技术研发提供理论参考。
1 材料与方法
1.1 材料与试剂
鲜莲采摘于浙江省杭州湾里塘莲藕专业合作社,采后2 h 内运回实验室。挑选大小均一、无明显机械损伤、八成熟的鲜莲作为试验材料。
水杨酸、碘、碘化钾、乙醚、硫代巴比妥酸等均为分析纯试剂,上海源叶生物科技有限公司;草酸为分析纯试剂,国药集团化学试剂有限公司;氢氧化钠为分析纯试剂,西陇科学股份有限公司;磷酸二氢钠、磷酸氢二钠、苯酚、浓硫酸、酒石酸钾钠、亚硫酸钠、乙醇、福林酚、三氯乙酸、过氧化氢等均为分析纯试剂,上海凌锋化学试剂有限公司;3,5-二硝基水杨酸为分析纯试剂,生工生物工程股份有限公司;碳酸钠为分析纯试剂,无锡市晶科化工有限公司;愈木创酚、邻苯二酚均为分析纯试剂,上海麦克林生化科技有限公司。
1.2 仪器与设备
CR-400 手持色差仪,日本柯尼卡美能达公司;Cintra404 紫外分光光度计,澳大利亚GBC 公司;UV 9000 紫外-可见分光光度计,上海元析仪器有限公司;LB20T 手持糖度计,广州市速为电子科技有限公司;Bifugo stratos 高速冷冻离心机,美国Thermo 公司;XMTD-8222 水浴锅,上海精宏实验设备有限公司;MRC-250B 智能人工气候箱,上海百典仪器设备有限公司。
1.3 试验方法
以清水浸泡为对照(CK),分别将鲜莲浸入0.2,0.4,0.6 mmol/L 3 个浓度的水杨酸溶液中,浸泡3 min,自然晾干,将每组样品装于PE 保鲜袋中挽口贮藏(20±1 ℃),每袋6 个鲜莲,每个处理重复3 次。贮藏期间每2 d 取样1 次,取样至10 d。每次取样测定莲房及莲子色泽、呼吸速率后,去除莲房、莲子皮、莲芯并切除莲子两端各2~3 mm 后,迅速冷冻于液氮中,于-80 ℃存放,用于测定后续相关指标。
1.4 品质指标测定
1.4.1 色差的测定 用全自动色差计测定,仪器采用标准白板校正。其中,L*表示明度,a*和b*表示色度。将鲜莲外表侧面分为3 等份,每等份测定1 次。取每个鲜莲中间及边缘莲子共4 颗进行测定,每个处理取6 个鲜莲,取平均值。
1.4.2 呼吸强度的测定 参考曹健康等[23]的方法并略有改动。取10.0 mL 0.4 mo1/L NaOH 放入培养皿中,将培养皿放到干燥器底部,放置隔板,装入6 个鲜莲,封盖。密闭0.5 h 后取出培养皿,将碱液移入三角瓶中,加入5.0 mL 饱和BaCl2 溶液和2 滴酚酞指示剂,用0.2 mo1/L 草酸溶液滴定,用同样方法作空白滴定。
1.4.3 褐变度的测定 参考Sun 等[24]的方法并略有改动。称取1.0 g 莲子样品,加入5 mL 0.1 mol/L磷酸缓冲液(pH 6.8)匀浆,4 ℃、10 000 r/min 离心20 min。取上清液于410 nm 处测定吸光值,计算褐变度。
褐变度=10×A410nm
1.4.4 可溶性固形物的测定 称取1.0 g 莲子样品,加入1 mL 蒸馏水,研磨,纱布过滤,滤液于4℃,4 000 r/min 条件下离心15 min,所得上清液用手持糖度计测定,读取数值。
1.4.5 可溶性糖的测定 采用苯酚-硫酸法测定可溶性糖。称取0.5 g 莲子样品,加入5 mL 蒸馏水,沸水浴30 min,冷却后过滤,将滤液转移至100 mL 容量瓶中,将滤渣重新转入试管中,加5 mL 蒸馏水,继续煮沸提取10 min,过滤,滤液合并,定容100 mL,即可溶性糖提取液。在25 mL 刻度试管中加入0.5 mL 提取液,依次加入1.5 mL 蒸馏水,1 mL 90 g/L 苯酚溶液,摇匀,再加入5.0 mL浓硫酸,立即充分振荡,室温下静置30 min。测定该溶液于波长485 nm 处的吸光值。
1.4.6 还原糖的测定 采用3,5-二硝基水杨酸法测定还原糖。称取0.5 g 莲子样品,加入蒸馏水定容25 mL,溶液于80 ℃恒温浸提30 min。取出冷却,过滤至100 mL 容量瓶中,蒸馏水反复冲洗滤渣,定容100 mL,即还原糖提取液。于25 mL 刻度试管中加入2 mL 样品提取液和1.5 mL 3,5-二硝基水杨酸溶液,混匀,沸水浴5 min,冷却后,用蒸馏水定容刻度。测定反应液于540 nm 处的吸光度值。
1.4.7 淀粉含量的测定 采用碘-淀粉比色法测定淀粉含量。称取1.0 g 莲子样品于烧杯中,用50 mL 乙醚分3~5 次混匀、过滤,滤渣用50 mL 80%乙醇分3~5 次混匀、过滤,将滤渣转移至小烧杯中,加入少量蒸馏水,沸水浴30 min,转移至100 mL 容量瓶中定容,最后在660 nm 处测定吸光值。
1.4.8 总酚含量的测定 采用福林酚法测定总酚含量。称取1.0 g 莲子样品,加入5 mL 60%乙醇溶液,在25 ℃条件下取液浸提2 h,于10 000 r/min、4 ℃条件下离心20 min。于25 mL 具塞试管中加入2 mL 上清液和3 mL 福林酚试剂,摇匀静置5 min,加入6 mL 7.5%碳酸钠溶液,用蒸馏水定容25 mL,25 ℃下暗反应2 h,于波长760 nm 处测定其吸光度。
1.4.9 丙二醛含量的测定 丙二醛(MDA)含量的测定采用硫代巴比妥酸比色法。称取1.0 g 莲子样品,加入5 mL 10%三氯乙酸溶液,于4 ℃、12 000 r/min 条件下离心20 min,收集上清液。取2 mL 上清液,加入2 mL 6.7 g/L 硫代巴比妥酸溶液,混匀后沸水浴20 min,冷却后分别测定450,532 和600 nm 处吸光度值。

式中:C——反应混合液中MDA 浓度,mmol/L;V——样品提取液总体积,mL;Vs——测定时所取样品提取液体积,mL;m——样品质量,g。
1.4.10 POD 活性的测定 过氧化物酶 (POD)活性测定参考吴松霞等[25]方法并略有改动。称取1.0 g 莲子于10 mL 离心管,立即加5 mL 0.1 mol/L 磷酸缓冲液(pH 6.8),于12 000 r/min、4 ℃条件下离心25 min,取上清液,即酶提取液。反应体系:0.3 mL 酶液+0.3 mL 6 mmol/L 愈创木酚+2.4 mL 5 mmol/L H2O2,以蒸馏水作为对照,测定混合液反应15 s 后在470 nm 处3 min 内的吸光度值变化。
1.4.11 PPO 活性的测定 多酚氧化酶 (PPO)活力测定参考Zauberman 等[26]的方法并稍作修改。3 mL 反应体系:0.2 mL 酶液+2.8 mL 10 mmol/L 邻苯二酚,以蒸馏水作为对照,测定混合液反应15 s后在420 nm 处3 min 内的吸光度值变化。
1.4.12 CAT 活性的测定 称取1.0 g 莲子于10 mL 离心管,立即加5 mL 0.1 mol/L 磷酸缓冲液(pH 7.5,含5 mmol/L DTT 和5% PVP),于12 000 r/min、4 ℃条件下离心25 min,取上清液,即酶提取液。3 mL 反应体系:2.9 mL 20 mmol/L H2O2+100 μL 酶提取液,以蒸馏水作为对照,测定混合液反应15 s 后在240 nm 处3 min 内的吸光度值变化。
1.4.13 SOD 活性的测定 采用南京建成生产的SOD 试剂盒测定,通过预试验,将SOD 抑制率控制在45%~50%之间,然后按照试剂盒说明书依次加入试剂至测定管和对照管中,混匀,37 ℃恒温水浴40 min,加入显色剂,室温放置10 min,于550 nm 处测吸光度值。
1.5 数据处理
所有数据测定3 次,采用Excel 2010 软件进行数据统计,Origin Pro 2017 软件进行数据图表制作,采用SPSS 24.0 软件的Duncan's 法进行数据显著差异分析(P<0.05)。
2 结果与分析
2.1 SA 处理对莲蓬及莲子色泽的影响
如表1所示,L*、a*、b*值分别代表莲蓬及莲子的表面明亮、红绿和黄蓝程度,其中a*、b* 值的绝对值越大颜色越深。贮藏期间莲蓬的a*绝对值缓慢下降,与0 d 相比,贮藏末期各处理组分别下降了46.77%(CK),45.57%(0.2 mmol/L),28.51%(0.4 mmol/L),50.12%(0.6 mmol/L),0.4 mmol/L 处理组与其它处理组之间存在显著性差异 (P<0.05)。鲜莲的L*值呈下降趋势,在贮藏末期,L*值的范围在41.74~43.44 之间,各处理组间无显著性差异。鲜莲的b*值逐渐降低,表明莲蓬由绿色向黄色转变,在贮藏末期10 d,0.4 mmol/L 处理组与对照组(CK)、0.2 mmol/L 处理组差异显著(P<0.05)。莲子皮的色泽变化与莲蓬的变化趋势类似,在贮藏末期SA 处理组与CK 组的L*值无显著性差异;贮藏2~10 d,0.4 mmol/L 处理组的a*值与CK 组具有显著性差异(P<0.05);在整个贮藏期间,0.4 mmol/L 处理组b* 值与其它处理组有显著差异(P<0.05)。
表1 水杨酸处理对采后鲜莲色泽的影响
Table 1 Effect of SA treatment on the color of fresh lotus

注:不同小字母表示不同处理间差异显著(P<0.05)。
?
2.2 SA 处理对鲜莲呼吸速率的影响
如图1所示,鲜莲的呼吸速率呈先降后升的趋势,CK 和0.2 mmol/L SA 处理组第6 天时降到最低,随后迅速上升,而0.4 mmol/L 和0.6 mmol/L处理组则在第4 天降到最低,然后上升。在整个贮藏期间,0.4 mmol/L SA 处理组的呼吸强度显著低于CK 组(P<0.05)。
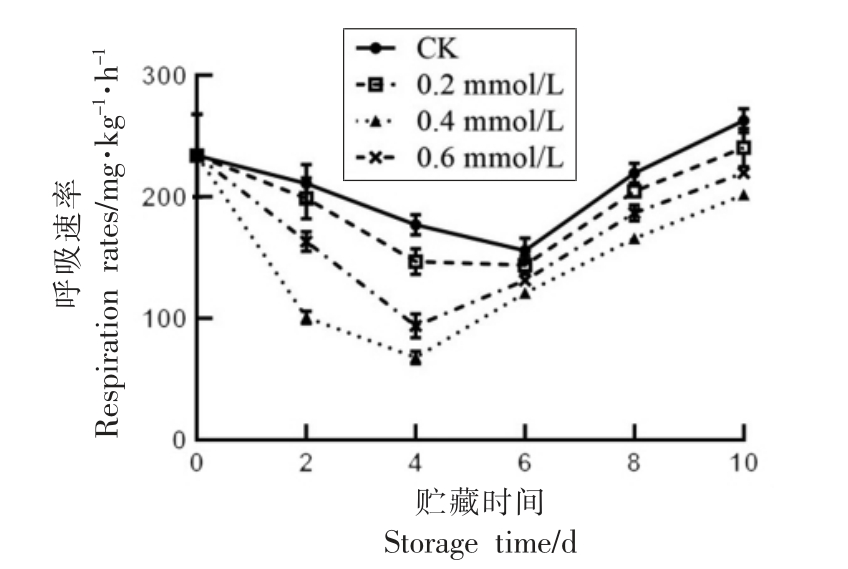
图1 水杨酸处理对鲜莲呼吸速率的影响
Fig.1 Effect of SA treatment on respiration rate of lotus pods
2.3 SA 处理对莲子褐变度的影响
由图2可知,整个贮藏期间莲子的褐变度呈上升趋势,在0~4 d,莲子的褐变程度变化小,贮藏4 d 时CK、0.2 mmol/L 处理组褐变度开始快速上升,而0.4 mmol/L 和0.6 mmol/L 处理组缓慢上升;第10 天时CK、0.2 mmol/L 和0.6 mmol/L 处理 组褐变度分别比0.4 mmol/L 处理组高46.23%,24.68%,27.27%,且0.4 mmol/L 处理组在整个贮藏期间始终保持较低水平,显著低于其它处理组(P<0.05)。

图2 水杨酸处理对莲子褐变度的影响
Fig.2 Effect of SA treatment on browning degree of lotus seeds
2.4 SA 处理对莲子可溶性固形物(SSC)的影响
可溶性固形物是果蔬采后营养物质变化的综合表现,是判断果蔬品质的重要因素之一。如图3所示,随着贮藏时间的延长,莲子的SSC 含量呈先降后升的趋势,在贮藏0~4 d 各处理间无明显变化;在第4 天时CK 组迅速上升,而SA 处理组变化较为缓慢,且在贮藏4~10 d,0.4 mmol/L 处理组SSC 含量维持较低水平,显著低于对照组(P<0.05)。

图3 水杨酸处理对莲子SSC 含量的影响
Fig.3 Effect of SA treatment on SSC content of lotus seeds
2.5 SA 处理对莲子还原性糖和可溶性糖的影响
由图4a 可知,贮藏期间,莲子还原糖含量总体呈先迅速下降后缓慢上升的趋势,其中CK 和0.2 mmol/L 处理组在第2 天分别降低80.47%和72.58%,0.4 mmol/L 和0.6 mmol/L 处理组还原性糖含量则在第4 天分别降低68.24%和72.58%。贮藏10 d,CK、0.2 mmol/L 和0.6 mmol/L 处理组含量分别比0.4 mmol/L 处理组降低46.75%,31.17%和13.85%,且CK 组含量显著低于0.4 mmol/L 处理组(P<0.05)。
如图4b 所示,可溶性糖含量变化趋势与还原糖变化趋势相似,呈先下降后上升的趋势,在第4天降至最低。贮藏末期,CK 组可溶性糖含量为初始值的88.06%,显著高于SA 处理组(P<0.05),0.4 mmol/L 处理组的可溶性糖含量显著低于其它处理组(P<0.05),为初始值的42.54%。由此可见,0.4 mmol/L SA 处理可抑制莲子可溶性糖的积累。
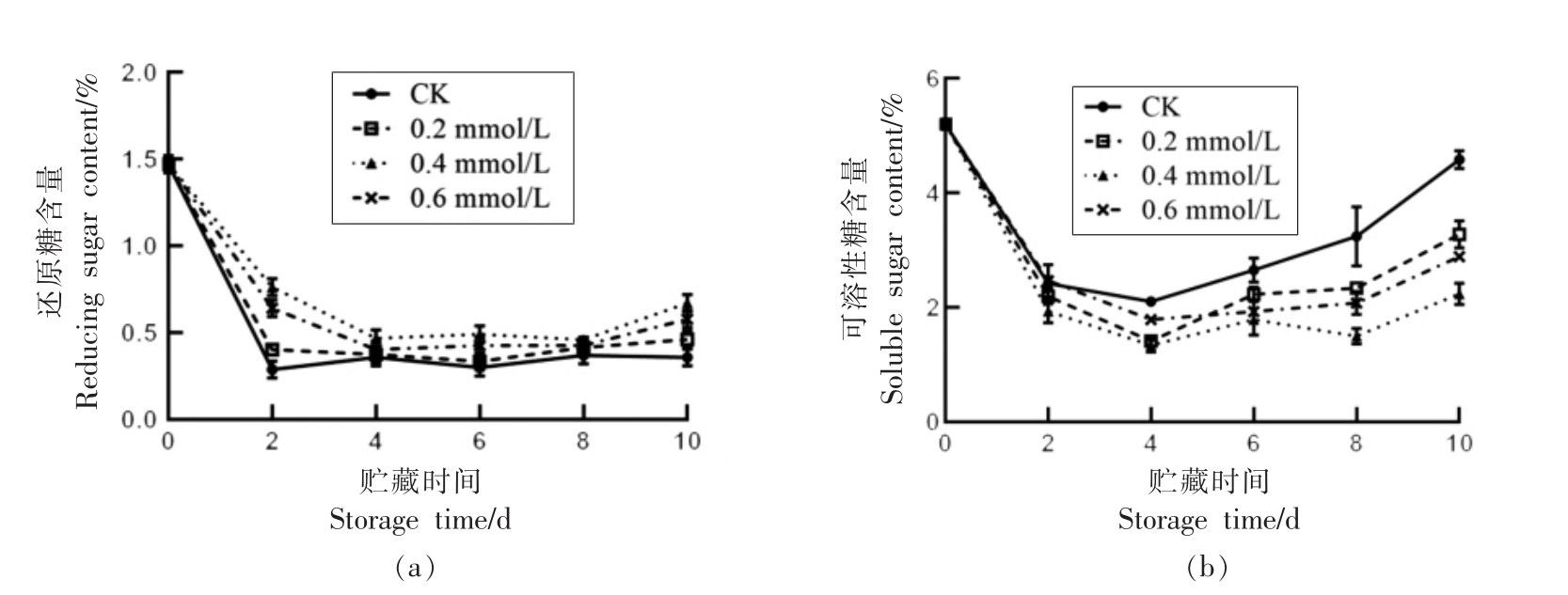
图4 水杨酸处理对莲子还原糖(a)和可溶性糖(b)含量的影响
Fig.4 Effect of SA treatment on reducing sugar (a) and soluble sugar (b) content of lotus seeds
2.6 SA 处理对莲子淀粉的影响
淀粉是植物体内储存能量的主要形式之一。如图5所示,莲子的淀粉含量在贮藏期间总体呈先上升后下降的趋势。贮藏0~6 d,SA 处理组莲子淀粉不断积累,第6 天淀粉含量开始下降,而CK组莲子淀粉含量在第8 天下降。贮藏4~10 d,0.4 mmol/L 处理组的莲子淀粉含量显著高于CK、0.2 mmol/L 处理组(P<0.05),说明0.4 mmol/L SA 处理可有效减缓莲子内部淀粉的消耗。
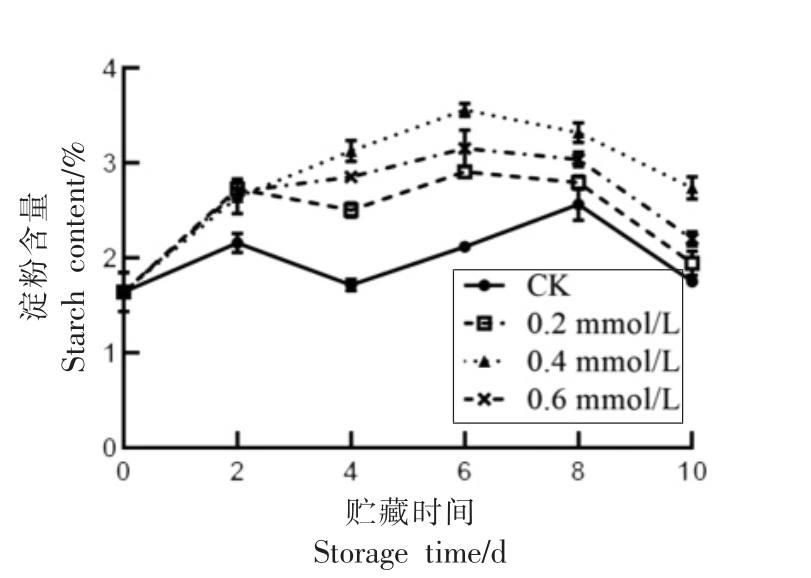
图5 水杨酸处理对莲子淀粉含量的影响
Fig.5 Effect of SA treatment on starch content of lotus seeds
2.7 SA 处理对莲子总酚的影响
酚类物质是引起植物发生褐变的重要底物,主要是由多酚氧化酶催化酚类物质转变为醌类,进而形成黑褐色物质[1]。如图6可知,随着贮藏时间的延长,总酚含量逐渐降低。贮藏期间,0.4 mmol/L 处理组总酚含量显著高于CK 组(P<0.05),略高于0.2 mmol/L 和0.6 mmol/L 处理组,差异不显著。贮藏末期CK,0.2,0.4,0.6 mmol/L 处理组分别较初期降低40.91%,35.51%,33.98%,38.44%。试验结果表明,0.4 mmol/L SA 处理对维持莲子较高的总酚含量具有积极作用。
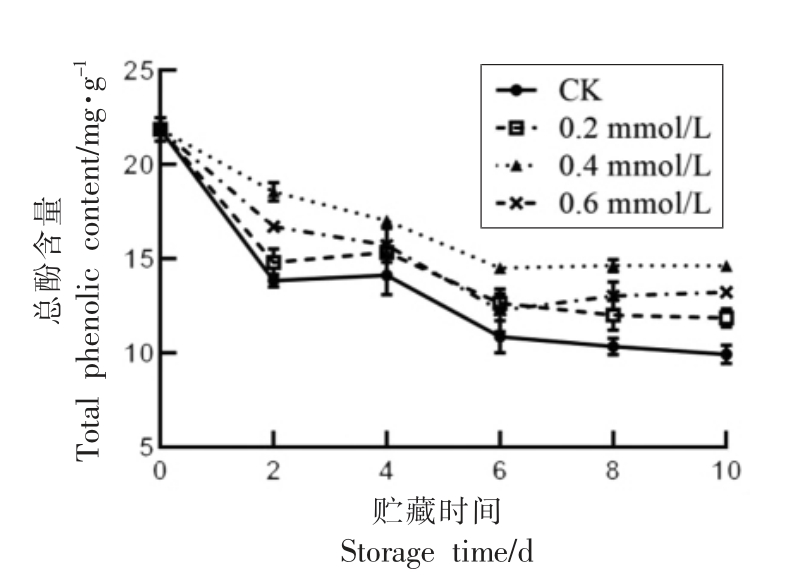
图6 水杨酸处理对莲子总酚含量的影响
Fig.6 Effect of SA treatment on total phenol content of lotus seeds
2.8 SA 处理对莲子丙二醛的影响
丙二醛(MDA)是果蔬膜脂过氧化的主要产物之一,通常用来反映细胞膜脂过氧化程度。如图7所示,整个贮藏期间MDA 含量先下降后上升,且CK 组的MDA 含量显著高于SA 处理组(P<0.05)。贮藏末期 (10 d)SA 处理组MDA 含量分别为CK组 的25.24%(0.2 mmol/L),23.42%(0.4 mmol/L),28.12%(0.6 mmol/L),且各处理组间差异显著(P<0.05)。试验结果表明,SA 处理可有效抑制鲜莲内MDA 含量的增加,降低细胞的膜脂质过氧化程度。

图7 水杨酸处理对莲子MDA 含量的影响
Fig.7 Effect of SA treatment on MDA content of lotus seeds
2.9 SA 处理对莲子PPO、POD 的影响
由图8a 可知,贮藏期间莲子POD 活性整体呈上升趋势,CK 组活性上升较快,而SA 处理组的变化趋势较为平缓,在贮藏4~10 d 时0.4 mmol/L 处理组的POD 活力低于其它处理组(P<0.05)。由图8b 可知,莲子PPO 活力总体呈先升后降的趋势,CK 组0.2 mmol/L 和0.6 mmol/L 处理组在贮藏前期差异不显著,而0.4 mmol/L 处理组的PPO活力始终显著低于其它处理组(P<0.05)。由此说明,0.4 mmol/L SA 处理可有效抑制贮藏期间莲子POD、PPO 活性,从而延缓鲜莲采后褐变等衰老现象的发生。
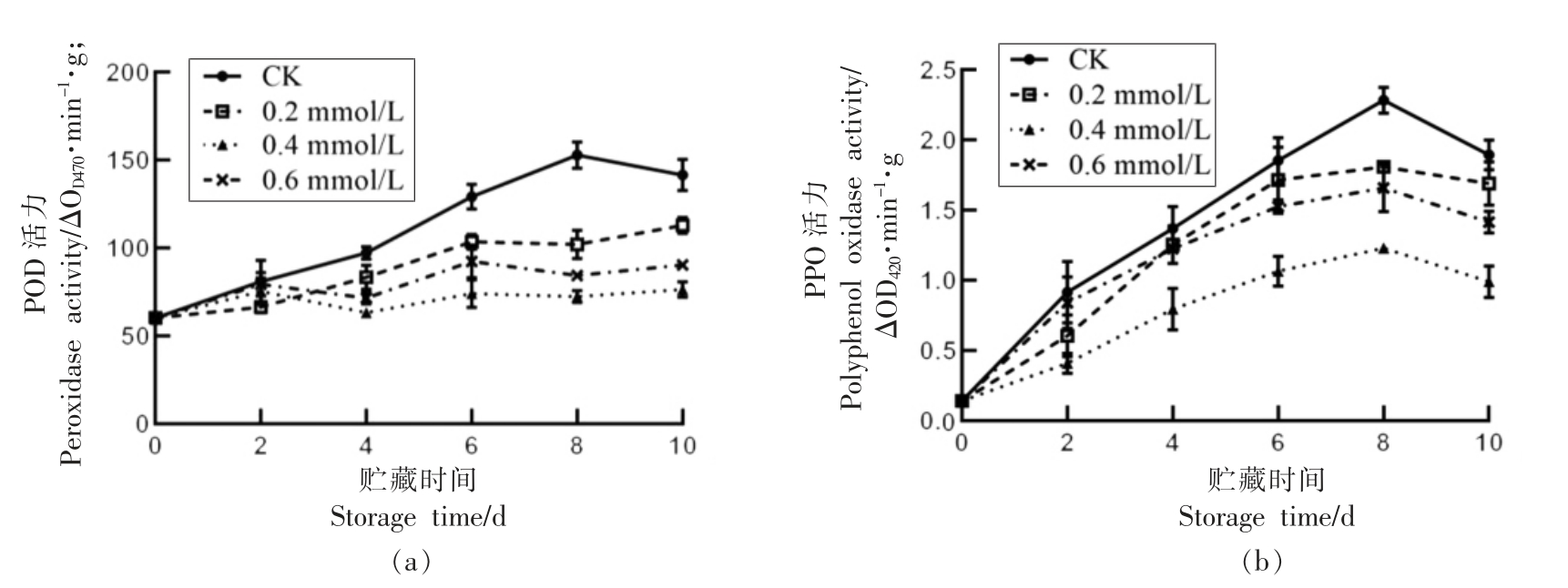
图8 水杨酸处理对莲子POD(a)和PPO(b)活性的影响
Fig.8 Effect of SA treatment on POD (a) and PPO (b) activities of lotus seeds
2.10 SA 处理对莲子SOD、CAT 活性的影响
如图9a 可知,莲子SOD 活性在贮藏前2 d急剧下降,随后迅速上升,其活性在第2 天分别下降 3.62% (CK),2.15% (0.2 mmol/L),0.80% (0.4 mmol/L),1.84%(0.6 mmol/L),且整个贮藏期间0.4 mmol/L 处理组的活性始终高于其它处理组,除第2 天外,均呈显著性差异(P<0.05)。由图9b 可知,贮藏0~6 d 莲子CAT 活力呈上升趋势,在第6 天达到峰值,之后不断下降。其中0.4 mmol/L 处理组较CK 组CAT 活力下降较为缓慢,且活力显著高于其它处理组(P<0.05)。由此说明,SA 处理可提高莲子SOD 和CAT 活性,维持较高的抗氧化能力。
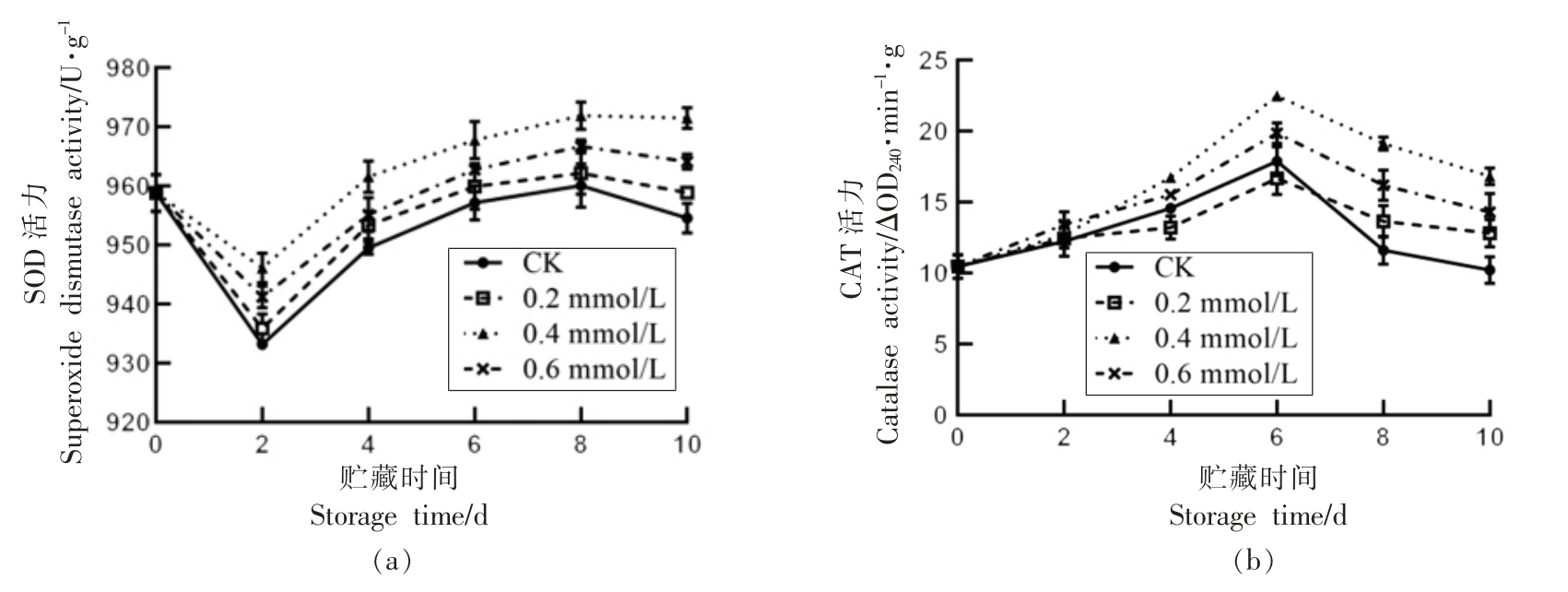
图9 水杨酸处理对莲子SOD(a)和CAT(b)活力的影响
Fig.9 Effect of SA treatment on SOD (a) and CAT (b) activities of lotus seeds
3 讨论与结论
鲜莲采后具有较强的呼吸作用,加快了鲜莲及莲子的褐变及腐烂,这是其货架期短的主要原因。本试验表明0.4 mmol/L 水杨酸(SA)处理可以抑制采后鲜莲的呼吸作用,延缓鲜莲及莲子的褐变,维持其营养品质,从而延长其货架期。这与赵洪薇[27]使用水杨酸处理可抑制甜瓜褐变,提高甜瓜耐贮藏性的研究结果一致。
莲子中含有丰富的糖、淀粉等碳水化合物,且淀粉含量变化可直接影响莲子品质[28]。本研究中莲子淀粉含量随贮藏时间呈缓慢上升再下降的趋势,还原糖和可溶性糖含量则呈现先下降后缓慢上升的趋势,其原因可能是在贮藏过程中莲子淀粉被淀粉酶降解为蔗糖、麦芽糖及葡萄糖等可溶性糖,然后被水解为还原糖[29]。贮藏前期还原糖和可溶性糖含量急剧减少,也可能有鲜莲为适应外部环境增强呼吸消耗的原因[30]。莲子可溶性固形物含量先下降后上升的变化也可能是淀粉含量变化所致,这与周宏胜等[31]的研究结果类似。本试验结果表明,与CK 组(对照)相比,SA 处理可显著抑制莲子淀粉的降解,并保持较低的可溶性固形物含量。
当植物受到外界不良环境协迫时,会引发MDA 累积而加速植物细胞膜脂过氧化,破坏细胞膜的功能和完整性[32]。本研究中,莲子的MDA 含量在贮藏期间呈先降后升的趋势,在贮藏中后期,0.4 mmol/L SA 处理显著抑制了莲子MDA 含量的生成。由此表明SA 可有效抑制莲子膜脂过氧化,延缓莲子的衰老。石亚莉[33]研究表明SA 处理能够抑制苹果在冷藏过程中MDA 的合成和积累,降低细胞膜脂受损的程度。这与SA 处理提高莲子的抗氧化性,清除细胞活性氧的积累有关。在植物的成熟衰老过程中自身抗氧化系统发挥重要作用,可以平衡并减少过量活性氧对植物的伤害,植物抗氧化系统主要由SOD、CAT、POD 等抗氧化酶组成[34]。本研究结果表明0.4 mmol/L SA 处理可维持莲子较高的SOD 和CAT 活性,提高了莲子的抗氧化性。Tareen 等[35]研究表明SA 处理可提高采后桃果实抗氧化相关酶(SOD、CAT、POD)的活性;陈双颖等[36]利用SA 处理提高鲜切青花菜的抗氧化活性。在贮藏过程中莲皮黄化和莲子褐变是最明显的变化,而莲子褐变与PPO 和POD 所致酶促褐变密切相关,在贮藏过程中莲子PPO 活性呈上升趋势,POD 活性呈先升后降趋势,其中0.4 mmol/L SA 处理组显著抑制了PPO 和POD 活性,从而延缓了莲子褐变。Ding 等[37]研究表明SA 处理可以抑制桃果实PPO 活性。本研究与上述结论相似,研究结果显示SA 处理可延缓鲜莲采后贮藏期间SOD、CAT、POD 活性的下降,并抑制PPO 的活性,其中0.4 mmol/L SA 处理组效果最为显著。
综上所述,0.4 mmol/L SA 处理可有效维持鲜莲采后的外观品质,抑制鲜莲呼吸作用,减缓莲子淀粉、还原糖等的消耗,有效维持莲子SOD、CAT、POD 等抗氧化酶活性,减少MDA 的积累,减轻膜质过氧化的伤害,同时显著抑制PPO 活性的上升,从而抑制褐变程度,保持较好的贮藏品质,延长货架期。
[1]孙凤杰.CPPU 处理对莲子采后品质及莲皮叶绿素代谢的影响[D].沈阳:沈阳农业大学,2018.
SUN F J.Effect of CPPU treatment on postharvest quality of lotus seeds and chlorophyll metabolism of lotuseel[D].Shenyang:Shenyang Agricultural University,2018.
[2]黄秀琼,卿志星,曾建国.莲不同部位化学成分及药理作用研究进展[J].中草药,2019,50(24):6162-6180.
HUANG X Q,QING Z X,ZENG J G.Research advances on chemical constituents and pharmacological effects of various parts of Nelumbo nucifera[J].Chinese Traditional and Herbal Drugs,2019,50(24):6162-6180.
[3]BHAT R,SRIDHAR K R.Influence of ionizing radiation and conventional food processing treatments on the status of free radicals in lotus seeds:An ESR study[J].Journal of Food Composition & Analysis,2011,24(4/5):563-567.
[4]MAN J M,CAI J W,CAI C H,et al.Comparison of physicochemical properties of starches from seed and rhizome of lotus [J].Carbohydrate Polymers,2012,88(2):676-683.
[5]王凌云,杨梦飞,郑寨生,等.不同温度条件对鲜食莲子品质的影响[J].现代农业科技,2013(23):296,299.
WANG L Y,YANG M F,ZHENG Z S,et al.Effects of different temperature conditions on the quality of fresh lotus seeds[J].Modern Agricultural Science and Technology,2013(23):296,299.
[6]郑天闻,徐婷婷,范亚苇,等.莲子多酚氧化酶的酶学性质[J].食品工业科技,2014,35(2):162-165,170.
ZHENG T W,XU T T,FAN Y W,et al.Enzymatic properties of polyphenol oxidase from lotus seed[J].Science and Technology of Food Industry,2014,35(2):162-165,170.
[7]高建晓,王毓宁,李鹏霞,等.漆蜡涂膜对鲜莲蓬采后褐变的影响[J].食品科学,2016,37(18):275-282.
GAO J X,WANG Y N,LI P X,et al.Effects of lacquer wax coating on postharvest browning of fresh lotus pods[J].Food Science,2016,37(18):275-282.
[8]王建辉,靳娜,刘永乐,等.低温处理对湘莲采后生理变化的影响[J].食品科学,2014,35 (18):209-213.
WANG J H,JIN N,LIU Y L,et al.Effect of low temperature on postharvest physiology of Xiang lotus seeds[J].Food Science,2014,35(18):209-213.
[9]朱雁青.6-BA 对采后鲜莲蓬营养物质及抗氧化性的影响[D].扬州:扬州大学,2015:4-5.
ZHU Y Q.Effects of 6-BA on nutrient substances and antioxidant of postharvest fresh lotus [D].Yangzhou:Yangzhou University,2015:4-5.
[10]王瑶,罗淑芬,胡花丽,等.外源NO 处理对采后鲜莲子品质及乙烯代谢的影响[J].现代食品科技,2019,35(11):100-108.
WANG Y,LUO S F,HU H L,et al.Effects of exogenous NO treatment on the postharvest quality and ethylene metabolism of fresh lotus seeds [J].Modern Food Science and Technology,2019,35(11):100-108.
[11]隋棠,李志文,张瑛,等.箱式气调对鲜食鲜莲贮藏品质和生理的影响[J].保鲜与加工,2018,18(6):31-38.
SUI T,LI Z W,ZHANG Y,et al.Effect of boxtype modified atmosphere technology on storage quality and physiological of fresh lotus[J].Storage and Process,2018,18(6):31-38.
[12]LI P X,GAO J X,HU H L,et al.Postharvest senescence of fresh lotus pods and seeds is delayed by treatment with 1-methylcyclopropene[J].Annals of Applied Biology,2016,169(3):440-452.
[13]LI P X,Hu H L,LUO S F,et al.Shelf life extension of fresh lotus pods and seeds (Nelumbo nucifera Gaertn.) in response to treatments with 1-MCP and lacquer wax[J].Postharvest Biology and Technology,2017,125(5):140-149.
[14]向娟,潘绍坤,鲁荣海,等.水杨酸处理对低温胁迫豇豆幼苗生理生态特性的影响[J].江苏农业科学,2019,47(21):220-223.
XIANG J,PAN S K,LU R H,et al.Impacts of salicylic acid treatments on eco-physiological characteristics of cowpea seedlings under low temperature stress[J].Jiangsu Agricultural Sciences,2019,47(21):220-223.
[15]MO Y W,GONG D Q,LIANG G B,et al.Enhanced preservation effects of sugar apple fruits by salicylic acid treatment during post-harvest storage[J].Journal of the Science of Food and Agriculture,2008,88(15):2693-2699.
[16]ZHANG Y C,ZOU Y N,LIU L P,et al.Common mycorrhizal networks activate salicylic acid defense responses of trifoliate orange (Poncirus trifoliata)[J].Journal of Integrative Plant Biology,2018,61(10):1099-1111.
[17]MARIANA R S V,JAVIER P.Salicylic acid beyond defence:its role in plant growth and development[J].Journal of Experimental Botany,2011,62(10):3321-3338.
[18]付云云,蒋成,闫小倩,等.水杨酸处理对仔姜保鲜效果的影响[J].食品与机械,2019,35(4):157-162.
FU Y Y,JIANG C,YAN X Q,et al.Effect of salicylic acid treatment on fresh-keeping of baby gingers[J].Food and Machinery,2019,35(4):157-162.
[19]王云香,顾思彤,左进华.水杨酸处理对西葫芦采后品质和抗氧化能力的影响[J].食品工业科技,2018,39(19):292-296,314.
WANG Y X,GU S T,ZUO J H.Effect of salicylic acid treatment on postharvest quality and antioxidant capacity of summer squash[J].Science and Technology of Food Industry,2018,39(19):292-296,314.
[20]SRIVASTAVA M K,DWIVEDI U N.Delayed ripening of banana fruit by salicylic acid[J].Plant Science,2000,158(1/2):87-96.
[21]SANGPRAYOON P,SUPAPVANICH S,YOURYON P,et al.Efficiency of salicylic acid or methyl jasmonate immersions on internal browning alleviation and physicochemical quality of Queen pineapple cv.‘Sawi’ fruit during cold storage[J].Journal of Food Biochemistry.2019,43(12):e13059.
[22]KHADEMI Z,ERSHADI A.Postharvest application of salicylic acid improves storability of peach(Prunus persica cv.Elberta) fruits[J].International Journal of Agriculture and Crop Sciences,2013,5(6):651-655.
[23]曹建康,姜微波,赵玉梅.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社,2007:24.
CAO J K,JIANG W B,ZHAO Y M.Experiment guidance of postharvest physiology and biochemistry of fruits and vegetables[M].Beijing:China Light Industry Press,2007:24.
[24]SUN Y,ZHANG W,ZENG T,et al.Hydrogen sulfide inhibits enzymatic browning of fresh-cut lotus root slices by regulating phenolic metabolism[J].Food Chemistry,2015,177(15):376-381.
[25]吴松霞,郜海燕,刘瑞玲,等.苹果多酚处理对鲜切芋艿品质的影响[J].食品科学,2019,40(13):245-251.
WU S X,GAO H Y,LIU R L,et al.Effects of different concentrations of apple polyphenols on quality of fresh-cut taro (Colocasia esculenta (L.)Schott)[J].Food Science,2019,40(13):245-251.
[26]ZAUBERMAN G,FUCHS Y,ROT I,et al.Chilling injury,peroxidase,and cellulase activities in the peel of mango fruit at low temperature[J].Hortence,1988,23(4):732-733.
[27]赵洪薇.壳寡糖、水杨酸处理提高甜瓜耐贮性及其机理研究[D].乌鲁木齐:新疆农业大学,2016.
ZHAO H W.Studies on the mechanism of improving the resistance of postharvest muskmelons with chitosan oligosaccharide and salicylic acid[D].Urumqi:Xinjiang Agricultural University,2016.
[28]ZHANG Y,ZENG H,WANG Y,et al.Structural characteristics and crystalline properties of lotus seed resistant starch and its prebiotic effects[J].Food Chemistry,2014,155:311-318.
[29]PERONI-OKITA F H G,SIMO R A,CARDOSO M B,et al.In vivo degradation of banana starch:Structural characterization of the degradation process[J].Carbohydrate Polymers,2010,81(2):291-299.
[30]LUO Z S,XU X L,CAI Z Z,et al.Effects of ethylene and 1-methylcyclopropene (1-MCP) on ligni?cation of postharvest bamboo shoot [J].Food Chemistry,2007,105:521-527.
[31]周宏胜,孙凤杰,罗淑芬,等.氯吡苯脲处理对采后鲜莲保鲜效果的影响[J].食品科学,2018,39(15):225-232.
ZHOU H S,SUN F J,LUO S F,et al.Effect of CPPU treatment on the postharvest quality of lotus pods[J].Food Science,2018,39(15):225-232.
[32]WANG L J,CHEN S J,KONG W F,et al.Salicylic acid pretreatment alleviates chilling injury and affects the antioxidant system and heat shock proteins of peaches during cold storage[J].Postharvest Biology and Technology,2006,41(3):244-251.
[33]石亚莉.SA 对苹果采后灰霉病抗性诱导及保鲜效果研究[D].杨凌:西北农林科技大学,2017.
SHI Y L.Effects of SA induced resistance to gray mold and storage preservation in postharvest apple[D].Yangling:Northwest A&F University,2017.
[34]DUAN X W,LIU T,ZHANG D D,et al.Effect of pure oxygen atmosphere on antioxidant enzyme and antioxidant activity of harvested litchi fruit during storage[J].Food Research International,2011,44(7):1905-1911.
[35]TAREEN M J,ABBASI N A,HAFIZ I A.Postharvest application of salicylic acid enhanced antioxidant enzyme activity and maintained quality of peach cv."Flordaking"fruit during storage[J].Scientia Horticulturae,2012,142:221-228.
[36]陈双颖,赵习姮,刘洪竹,等.水杨酸和H2O2 处理对鲜切青花菜抗氧化特性的影响[J].食品科学,2015,36(2):260-264.
CHEN S Y,ZHAO X H,LIU H Z,et al.Effect of salicylic and H2O2 treatment on antioxodative properties of fresh-cut broccoli florets[J].Food Science,2015,36(2):260-264.
[37]DING Z S,TIAN S P,MENG X H,et al.Hydrogen peroxide is correlated with browningin peach fruit stored at low temperature[J].Frontiers of Chemical Science and Engineering,2009,3(4):363-374.