南美白对虾(Litopenaeus vannamei Boone)又称为凡纳滨对虾,在全球水产养殖虾中占据重要地位[1]。因其生长迅速、肉质鲜美、营养丰富而深受消费者的喜爱,在我国养殖规模日益壮大,逐渐成为我国主要的养殖虾类[2]。南美白对虾组织中富含蛋白质和水分,在微生物的作用下,南美白对虾体内的酪氨酸酶易被激活,从而导致“黑变现象”,严重影响对虾的品质[3-4]。酪氨酸酶(EC1.14.18.1),又称为多酚氧化酶,在生物体的内黑色素合成过程中,作为关键限速酶发挥着重要作用[5-10]。在黑色素合成过程中,酪氨酸酶能催化L-酪氨酸,经两次转化形成高活性物质多巴醌,多巴醌在经一系列自发的化学反应后,转化成黑色素和其它酚类化合物,从而导致南美白对虾及其它水产品黑变[10-15]。建立一种科学有效的方法用于检测南美白对虾及其它水产品中的酪氨酸酶含量,对于实现对它们的质量监测具有重要意义,同时也可为其质量评价提供新参考标准。
目前,人们已建立起多种方法体系用于酪氨酸酶活性的检测,主要分为三大类:比色法[16-19]、电化学法[14,20-22]和荧光法[23-28]。这些方法在操作性、灵敏度、准确性等方面均具有一定优势。其中电化学法是更为理想的一种方法,在自动化程度和检测速度以及复杂体系的实时监测等方面优势较为突出[29]。
多金属氧酸盐(POMs)是一类具有强大的抗氧化能力和良好的电子传输能力的纳米级无机过渡金属-氧簇[30-32]。此类物质具有均一且确定的无机多聚体结构,稳定性和耐热性良好,具有优良的氧化-还原性质[33-35],经多电子氧化还原过程后,可保持结构不变,这种优良的性质决定其在电化学领域的重要作用[36]。
本文合成了H8[P2Mo17Ni(OH2)O61]、H8[P2Mo17Cr(OH2)O61]、H8[P2Mo17Co(OH2)O61]、H6[P2Mo18O62](分别简写为P2Mo17Ni、P2Mo17Cr、P2Mo17Co、P2Mo18)4 种Dawson 型多金属氧酸盐,采用电化学法研究4 种过Dawson 型多金属氧酸盐对酪氨酸酶的电化学传感,以期建立一种新型酪氨酸酶水平的检测方法,用于南美白对虾及其它水产品中酪氨酸酶的检测,以实现它们的质量评价。
1 试验部分
1.1 主要试剂
酪氨酸酶,Sigma-Aldrich 公司;硫酸镍、氯化铵、硫酸钴、硫酸铬、钼酸钠、磷酸、盐酸、硫酸,磷酸氢二钠、磷酸二氢钠、氯化钠、氯化钾等,西陇化工股份有限公司;无水乙醚、无水乙醇、氯化钾、铁氰化钾、亚铁氰化钾,国药集团化学试剂有限公司;以上试剂均为分析纯级。氧化铝粉,天津艾达恒晟科技有限公司,纯度为99.9%。
1.2 主要仪器设备
Cintra 2020 型紫外-可见分光光度计,澳大利亚GBC 仪器公司;Nicolet Avatar 330 型傅里叶变换红外光谱仪,美国Thermo Electron 公司;Φ5 mm 玻碳电极、232 型饱和甘汞电极、铂丝电极,武汉高仕睿联科技有限公司;PGSTAT302N 型电化学工作站,瑞士万通中国有限公司。
1.3 试验方法
1.3.1 Dawson 型过渡金属取代磷钼酸和磷钼酸母体的合成与表征 Dawson 型磷钼酸母体的合成过程分为两步,首先将10 g Na2MoO4·2H2O 溶于45 mL 水中,加入1.5 mL 85% H3PO4 和8 mL浓盐酸,加热回流8 h。冷却后加10 g NH4Cl,待固体析出后抽滤。称取所得固体,溶解于蒸馏水中,加浓HCl,用乙醚(铵沉淀∶蒸馏水∶浓盐酸∶无水乙醚=5∶10∶6∶6 的比例进行萃取)萃取,用蒸馏水重结晶,得H6[P2Mo18O62](P2Mo18)晶体[37]。
3 种过渡金属取代磷钼酸的制备方法参照文献[38],向100 mL 水中加人0.01 mol 可溶性过渡元素化合物(硫酸镍、硫酸钴、硫酸铬),在磁力搅拌下分别向溶液中加人25 mL 0.02 mol 的磷酸二氢钠溶掖,在pH 计监侧下,缓慢滴加1∶1 硫酸,调到pH=4,蒸后加人75 mL 0.17 mol 的Na2MoO4溶液,再用1∶1 硫酸调到pH=3.6,回流8 h,冷却后,转移到分液漏斗中,用乙醚萃取法可制得过渡金属取代磷钼酸的醚合物,分离出醚合物后,真空干燥后即得到样品。用蒸馏水对所得样品进行重结晶。
将上述合成的化合物通过紫外分光光度技术(UV)和傅里叶变换红外光谱技术(IR)进行结构表征,并与文献数据进行对比,以判断合成物质是否为所需化合物。
1.3.2 过渡金属取代的磷钼酸及母体对酪氨酸酶的电化学传感 玻碳电极的预处理:将玻碳电极分别用不同粒径的氧化铝粉(粒径分别为1.0,0.3和0.05 μm)进行抛光处理,然后分别在超纯水、无水乙醇中超声清洗3~5 min。随后将电极置于2.5 mmol/L 的[Fe(CN)6]3-/4-溶液(含0.1 mol/L KCl 溶液)中进行循环伏安扫描,以验证电极是否抛光合格。其中以玻碳电极为工作电极,饱和甘汞电极为参比电极,铂丝电极为辅助电极,电势范围为-0.2 V~+0.8 V,扫速为100 mV/s。一般而言,所得循环伏安图中氧化还原峰的电位差在80 mV 左右时即认为电极抛光合格[14]。
1)多金属氧酸盐溶液浓度与其峰电流的关系 在反应体系中加入4 mL 不同浓度 (1~5 mmol/L)的多金属氧酸盐溶液,在相同条件下,进行循环伏安扫描。观察4 种多金属氧酸盐作用下所得循环伏安图中响应峰电流的变化规律,研究磷钼酸溶液的浓度与其响应峰电流之间的线性关系。
2)扫速对其峰电流的影响 在反应体系中加入4 mL 4 mmol/L 多金属氧酸盐溶液,在电势范围为-0.4 V~+0.6 V 的条件下,分别在10~200 mV/s 的扫速下进行循环伏安扫描,研究不同扫速下对应响应峰电流的变化关系。
3)4 种化合物对酪氨酸酶的催化作用 在反应体系中加入4 mL 4 mmol/L 多金属氧酸盐溶液,加入0.4 mL 不同浓度的酪氨酸酶溶液,使得反应体系中酪氨酸酶终浓度分别为0,24.46,40.30,56.48,72.56,88.77 U/mL 在扫速为50 mV/s,电势范围为-0.4~+0.6 V 的条件下,进行循环伏安扫描。将不同浓度酪氨酸酶作用下所得的循环伏安图叠加,观察其规律,得到响应峰电流与酪氨酸酶之间的关系曲线,进一步研究过渡金属取代的磷钼酸及母体对酪氨酸酶的电化学传感。
1.3.3 计时安培曲线测定 采用计时安培曲线的方法,对P2Mo17Ni 进行进一步的研究,考察该试验方法的检测灵敏度和检出限。由于P2Mo17Ni 水溶液的循环伏安图中第一还原峰在-0.25 V 附近,因此,在-0.25 V 的恒定电位下,向反应体系中加入4 mL 4 mmol/L P2Mo17Ni 水溶液,随后在磁力搅拌的作用下,每隔30 s 向反应体系中加入0.4 mL 40.305 U/mL 酪氨酸酶溶液,根据计时安培曲线中所得的响应电流,得到响应电流与其对应酪氨酸酶浓度的线性关系,计算该方法的检测灵敏度和检测限。
1.3.4 样品的检测 南美白对虾样品检测液的制备方法参照Nirmal 等 [39] 的方法作适当修改,取100 g 南美白对虾,加入3 倍南美白对虾质量的50 mmol/L 磷酸缓冲液(0.5 mol/L NaCl、0.2% Brij 35,pH 7.5)中,用组织捣碎机充分捣碎,静置后离心(8 000 r/min,30 min),所得上清液即为样品检测液,将上清液置于-20 ℃的冰箱中备用。
1)P2Mo17Ni 水溶液对南美白对虾中酪氨酸酶的检测 取南美白对虾样品检测液,将其稀释成不同倍数(稀释倍数为0,5,10,50),在反应体系中加入4 mL P2Mo17Ni 水溶液,再加入0.4 mL不同稀释倍数的南美白对虾样品检测液,在50 mV/s 扫速下,获得不同稀释倍数的南美白对虾样品检测液的循环伏安图,电势范围为:-0.4 V~+0.6 V。然后根据响应电流计算出不同稀释倍数的南美白对虾样品检测液中的酪氨酸酶。
2)加标回收试验 在上述试验条件下,通过对同稀释倍数的南美白对虾样品检测液的加标回收试验来验证本试验方法的可行性。分别取稀释5 倍的南美白对虾样品检测液各0.2 mL,再加入0.2 mL 不同浓度为酪氨酸溶液,使得反应体系中的酪氨酸酶含量(去除南美白对虾样品中的酪氨酸酶含量)分别为10,15,20 U/mL,采用该试验方法进行加标回收试验,根据检出的结果与酪氨酸酶的添加量,计算回收率。
3)P2Mo17Ni 水溶液对酪氨酸酶的催化作用的稳定性和选择性 用P2Mo17Ni 水溶液对稀释5倍的南美白对虾样品检测液进行选择性试验,评估了可能干扰P2Mo17Ni 水溶液对酪氨酸酶的催化作用的几种物质。以判断P2Mo17Ni 水溶液对酪氨酸酶的催化作用的选择性和结果的可靠性,进一步分析该试验方法的可行性。
2 结果与分析
2.1 Dawson 型过渡金属取代磷钼酸和磷钼酸母体的结构表征
3 种Dawson 型过渡金属取代磷钼酸和磷钼酸母体的红外和紫外表征数据如表1所示。由红外光谱数据可知,4 种化合物在700~1 100 cm-1 之间均出现了4 个特征峰,分别为:在1 065 cm-1 附近的P-Oa 键拉伸振动吸收峰,在960 cm-1 附近的Mo-Od 键拉伸振动吸收峰,在900 cm-1 附近的Mo-Ob-Mo 键拉伸振动吸收峰和在800 cm-1 附近的Mo-Oc-Mo 键拉伸振动吸收峰。由紫外光谱数据可知,所合成的化合物在210 nm 附近均具有一个特征吸收峰,对应于Od-Mo 的电荷跃迁。结果表明,所合成的化合物均具有Dawson 型多金属氧酸盐的结构,其结果与参考文献相符[37-38]。
表1 4 种多金属氧酸盐的红外和紫外表征数据
Table 1 Infrared and ultraviolet characterization data of four polyoxometalates

?
2.2 4 种化合物对酪氨酸酶的催化作用
2.2.1 浓度对多金属氧酸盐水溶液电化学响应电流的影响 分别扫描不同浓度下的P2Mo17Ni、P2Mo17Cr、P2Mo17Co、P2Mo18 的循环伏安图,研究浓度对多金属氧酸盐水溶液的电化学性质的影响,结果如图1a~1d 所示。由图1可以看出4 种化合物的循环伏安图均存在3 对氧化还原峰(I-I',IIII',III-III'),分别对应于2-,2-和4-电子转移[40]。以3 mmol/L 浓度下P2Mo17Cu 的循环伏安图为例,平均峰电位E1/2=(Epa+Epc)/2 分别是:206 mV (II'),-122 mV(II-II'),-212 mV(III-III'),对应的氧化峰与还原峰之间的电位差(ΔEp)分别为46,49 和59 mV。计算发现,其它浓度下P2Mo17Cu 以及其它化合物的对应氧化峰还原峰之间的电位差均小于60 mV,表明这4 种化合物的氧化还原过程均是可逆的。由图1可知,随着4 种化合物浓度的不断增大,对应的氧化还原峰电流逐渐增强,化合物浓度与其对应的响应峰电流之间呈现出良好的线性关系。化合物浓度由1 mmol/L 变化至5 mmol/L 时,对应循环伏安图中多金属氧酸盐的特征氧化还原峰也逐渐明显,当化合物浓度达到5 mmol/L 时最为显著。但考虑到高浓度下多金属氧酸盐水溶液体系的稳定性欠佳的问题,因此为了保证试验的稳定性和检测灵敏度,选择4 mmol/L作为后续试验的最佳浓度较为合适。

图1 浓度对多金属氧酸盐水溶液电化学响应电流的影响
Fig.1 The effect of concentration on the electrochemical response current of polyoxometalates solution
注:图中直线1~9 代表化合物浓度分别为:1,1.5,2,2.5,3,3.5,4,4.5,5 mmol/L;电势:-0.4 V~+0.6 V;扫速:50 mV/s。
2.2.2 扫速对多金属氧酸盐水溶液电化学响应电流的影响 将化合物在不同扫速下的循环伏安图叠加,研究扫速对多金属氧酸盐水溶液的电化学性质的影响,结果如图2a~2d 所示。由图2可以看出4 种化合物在不同扫速下的循环伏安图中均存在3 对氧化还原峰(I-I',II-II',III-III'),随着扫速的不断增大,4 种化合物的氧化还原峰电流也不断增强。并且随着扫速的不断增大,4 种化合物的氧化峰电位均向正方向移,而对应的还原峰电位均向负方向移,表明这4 种化合物的氧化还原过程符合可逆但非典型的氧化还原过程。由插图可知,峰电流与扫描速度的平方根呈现良好的正比例关系,说明4 种化合物的氧化还原过程均为扩散控制过程[40]。

图2 扫速对多金属氧酸盐水溶液电化学响应电流的影响
Fig.2 The effect of scanning speed on electrochemical response current of polyoxometalates solution
注:图中直线1~20 代表扫速分别为:10,20,30,40,50,60,70,80,90,100,110,120,130,140,150,160,170,180,190,200 mV/s;电势:-0.4 V~+0.6 V;化合物浓度:4 mmol/L。
2.2.3 4 种化合物对酪氨酸酶的催化作用 分别在不同化合物中加入不同浓度的酪氨酸酶溶液,通过扫描加入酪氨酸酶溶液的多酸化合物的循环伏安图,从而分析化合物对酪氨酸酶的催化作用,结果如图3a~3d 所示。由图能够看出,随着酪氨酸酶浓度不断增加,对应循环伏安图中氧化还原峰电流均呈现减弱趋势,即4 种多金属氧酸盐作为既具有氧化作用又具有还原作用的双功能催化剂,在酪氨酸酶的氧化还原过程中发挥着重要作用。由插图可知,响应电流与酪氨酸酶的浓度之间具有良好的线性关系,计算得到响应电流与酪氨酸酶加入量的线性曲线分别为:I(P2Mo17Ni,II)=0.0006986c-0.2497;I(P2Mo17Cr,II')=-0.0005002c+0.07183;I(P2Mo17Co,II)=0.0008365c-0.2758;I(P2Mo18,II)=0.0002783c-0.1906。计算出最低检出限分别为X (S/N=3)=4.971,14.48,10.26,17.74 U/mL。结果表明,4 种多金属氧酸盐对酪氨酸酶均具有较好的电化学催化效果,其中P2Mo17Ni 水溶液对酪氨酸酶的催化效果是4 种化合物中最优的,可用该化合物催化下不同浓度的酪氨酸酶的线性曲线作为标准曲线,用于检测水产品中的酪氨酸酶的含量,从而实现对水产品的品质评价。

图3 化合物催化不同浓度酪氨酸酶溶液的循环伏安图
Fig.3 Cyclic voltammograms of compounds catalyzed by different concentrations of tyrosinase solutions
注:图中直线1~6 代表酪氨酸酶浓度分别为:0,24.46,40.30,56.48,72.56,88.77 U/mL;电势:-0.4 V~+0.6 V;扫速:50 mV/s。
2.3 P2Mo17Ni 水溶液催化酪氨酸酶的计时安培曲线
P2Mo17Ni 溶液催化酪氨酸酶的计时安培曲线如图4所示。从图4可以看出,随着酪氨酸酶溶液的加入,计时安培曲线中的响应电流呈现阶跃性增大趋势,电流响应的时间为30 s。即响应电流随着酪氨酸酶含量的增大而增大。由计时安培曲线可得在3.66~26.87 U/mL 范围内的线性曲线为I=0.00848c-1.20101,R2=0.997,最低检出限(S/N=3)为0.4095 U/mL。
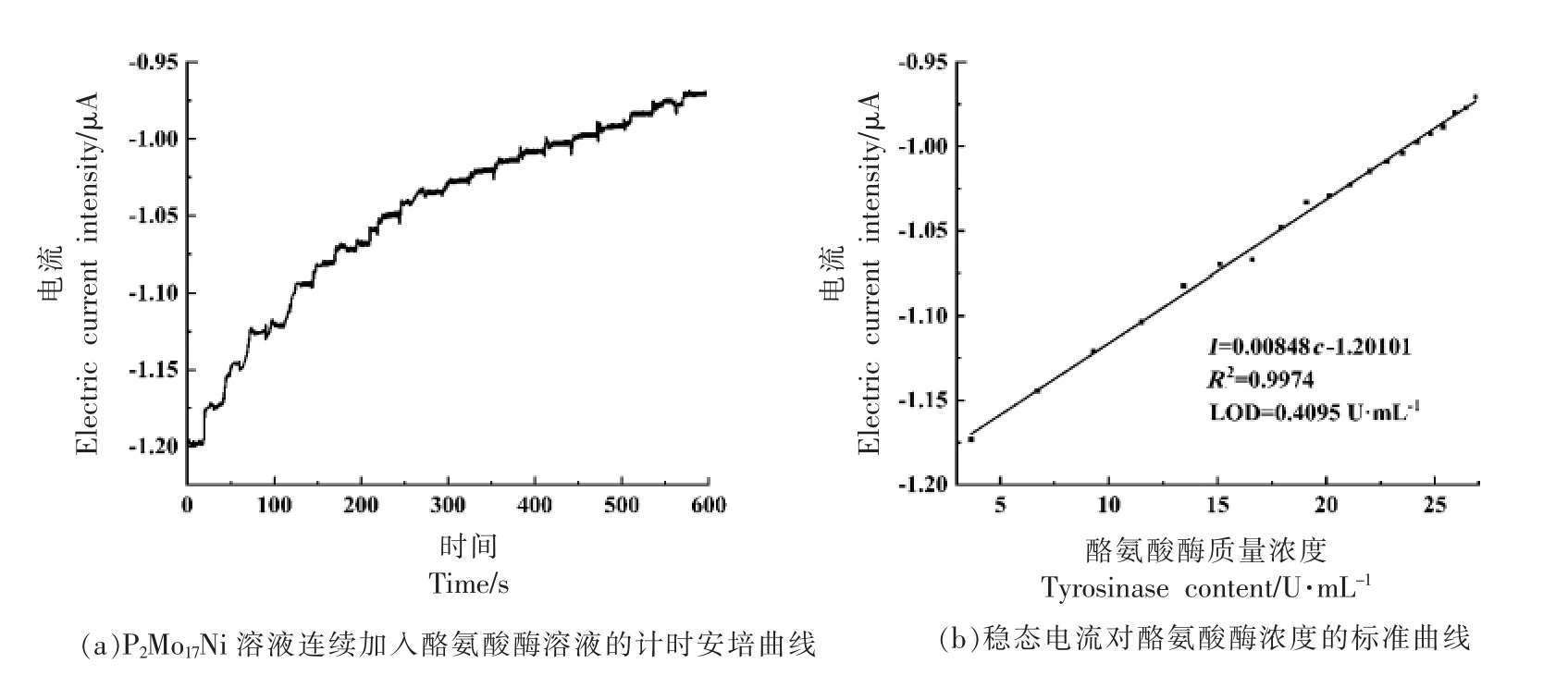
图4 计时安培曲线
Fig.4 Chronoampere curve
2.4 样品检测
2.4.1 P2Mo17Ni 水溶液对南美白对虾中酪氨酸酶的检测 通过对不同稀释倍数的南美白对虾样品检测液在相同条件下的循环伏安扫描,根据所得响应电流可以计算出不同稀释倍数的南美白对虾样品检测液中的酪氨酸酶,结果如表2所示。不同稀释倍数的南美白对虾样品检测液中酪氨酸酶的含量分别为166.0762,32.6894,15.8246,3.0283 U/mL,其计算结果RSD 均低于5.0%。这些结果表明,P2Mo17Ni 水溶液可用于南美白对虾中酪氨酸酶含量的检测分析。
表2 P2Mo17Ni 溶液对南美白对虾中酪氨酸酶的检测结果
Table 2 Test results of tyrosinase in Litopenaeus vannamei Boone with P2Mo17Ni solution
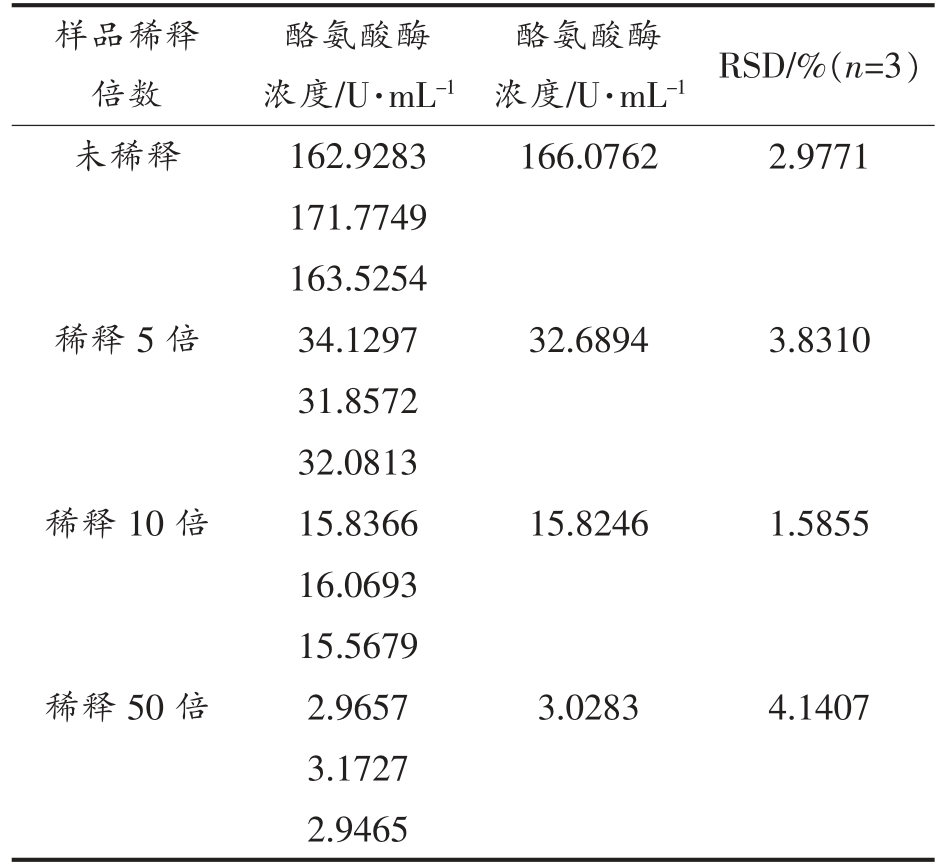
样品稀释倍数酪氨酸酶浓度/U·mL-1酪氨酸酶浓度/U·mL-1 RSD/%(n=3)未稀释 162.9283 166.0762 2.9771 171.7749 163.5254稀释5 倍 34.1297 32.6894 3.8310 31.8572 32.0813稀释10 倍 15.8366 15.8246 1.5855 16.0693 15.5679稀释50 倍 2.9657 3.0283 4.1407 3.1727 2.9465
2.4.2 加标回收试验 通过向相同体系中加入已知量的酪氨酸溶液,在相同条件下分别进行循环伏安扫描,根据检出的结果与实际酪氨酸酶的添加量计算回收率。由表3可知,采用本试验方法测得的3 组样品回收率分别为98.0477%,99.5872%,98.8489%,3 组样品的RSD 值均在合理范围之内(RSD<5%),说明P2Mo17Ni 水溶液对南美白对虾中酪氨酸酶的检测具有良好的可靠性。
表3 加标回收试验结果
Table 3 Result of spike and recovery test
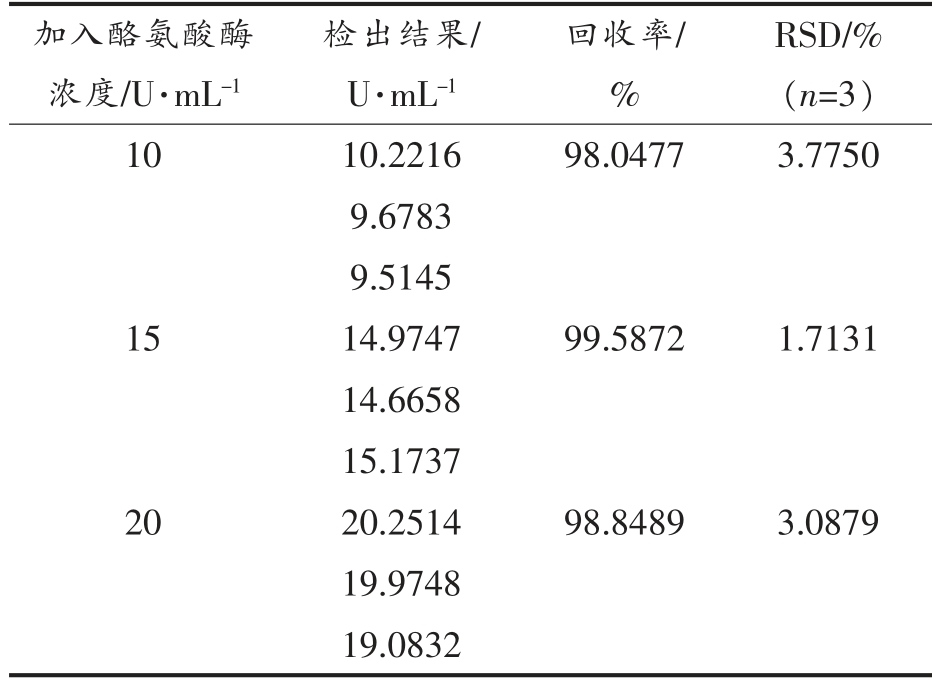
加入酪氨酸酶浓度/U·mL-1 RSD/%(n=3)10 10.2216 98.0477 3.7750 9.6783 9.5145 15 14.9747 99.5872 1.7131 14.6658 15.1737 20 20.2514 98.8489 3.0879 19.9748 19.0832检出结果/U·mL-1回收率/%
2.4.3 P2Mo17Ni 水溶液对酪氨酸酶的催化作用的稳定性和选择性 当电极在P2Mo17Ni 水溶液中,在-0.4 V~+0.6 V 的电位范围内,扫速为50 mV/s的条件下扫描80 圈,其阴极电流下降不到10%。因而可以说明P2Mo17Ni 溶液在对酪氨酸酶进行检测的过程中具有较好的稳定性。
用P2Mo17Ni 溶液对稀释5 倍的南美白对虾样品检测液进行选择性试验,评估了可能干扰P2Mo17Ni 溶液对酪氨酸酶的催化作用的几种物质。试验结果如图所示。结果表明:在允许相对误差±5.0%以内,200 倍的葡萄糖、氯化镁,150 倍的氯化钠,100 倍的氯化钾,50 倍的氯化钙,硫酸钠,抗坏血酸(VC),硫酸铜,硫酸亚铁加入到含有稀释5 倍的南美白对虾样品检测液的体系中,在此体系中只检测到硫酸亚铁到相对微弱的氧化峰,其它物质未检测到峰,并且没有影响酪氨酸酶还原峰电流的大小,所以该方法具有较好的选择性。
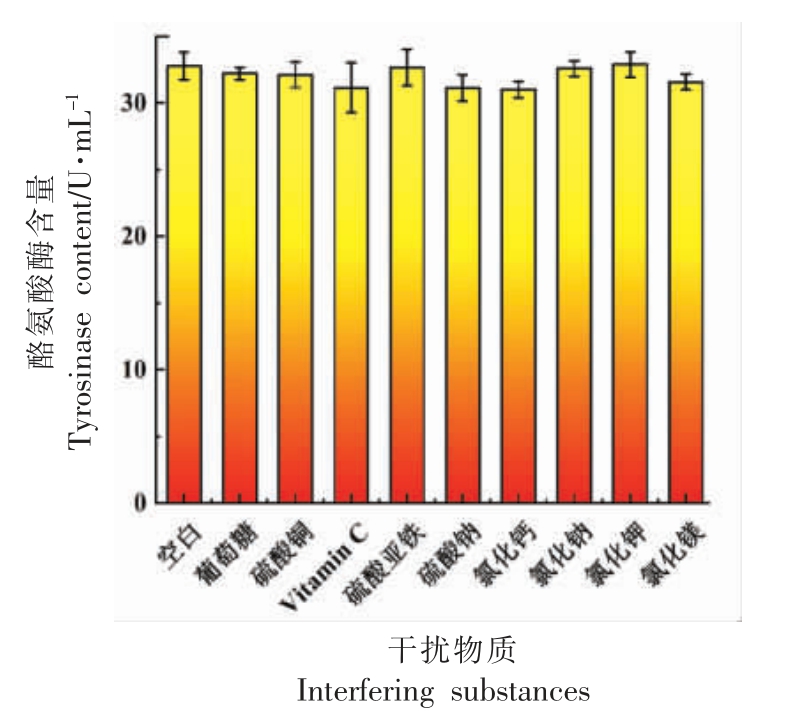
图5 不同干扰物质对P2Mo17Ni 水溶液催化酪氨酸酶的电化学稳定性的影响
Fig.5 The influence of different interfering substances on the electrochemical stability of P2Mo17Ni aqueous solution catalyzed by tyrosinase
3 结论
本文研究了P2Mo17Ni、P2Mo17Cr、P2Mo17Co 和P2Mo18 4 种Dawson 型多金属氧酸盐,分别研究了多酸浓度、循环伏安扫速对这4 种化合物水溶液电化学响应电流的影响,以及多金属氧酸盐水溶液对酪氨酸酶的催化作用。结果表明4 种化合物的氧化还原过程均属于扩散控制过程。根据响应电流与酪氨酸酶加入量浓度的线性曲线,可以得到4 种化合物对酪氨酸酶的检出限(S/N=3)分别为4.971(P2Mo17Ni);14.48(P2Mo17Cr);10.26(P2Mo17Co);17.74(P2Mo18)U/mL。由检出限分析可知,P2Mo17Ni 的检测效果是4 种化合物中最优的。通过计时安培曲线可知,在3.66~26.87 U/mL 范围内,P2Mo17Ni 对酪氨酸酶的最低检出限(S/N=3)可至0.4095 U/mL,并且该检测方法对酪氨酸酶具有较好的选择性,抗干扰能力强,稳定性良好。将此方法应用于南美白对虾中酪氨酸酶含量的检测,回收率为98.0477%~99.5872%,表明方法的准确性好,应用前景较为可观,有望用于食品质量安全领域,建立一种新型水产品质量的监测方法。
[1]OKPALA C O R,CHOO W S,DYKES G A.Quality and shelf life assessment of Pacific white shrimp (Litopenaeus vannamei) freshly harvested and stored on ice[J].LWT-Food Science and Technology,2014,55(1):110-116.
[2]WACHIRASIRI K,WANLAPA S,UTTAPAP D,et al.Use of amino acids as a phosphate alternative and their effects on quality of frozen white shrimps(Penaeus vanamei) [J].LWT-Food Science and Technology,2016,69:303-311.
[3]NIRMAL N P,BENJAKUL S,AHMAD M,et al.Undesirable enzymatic browning in crustaceans:Causative effects and its inhibition by phenolic compounds[J].Critical Reviews in Food Science and Nutrition,2015,55(14):1992-2003.
[4]叶日英,孙力军,王雅玲,等.冷藏凡纳滨对虾色差值与若干典型质量性状的灰色关联分析[J].中国食品学报,2018,18(3):205-210.
YE R Y,SUN L J,WANG Y L,et al.Grey relational analysis between chromatism and some representative qualitative traits of litopenaers vannamei in refrigeration[J].Journal of Chinese Institute of Food Science and Technology,2018,18(3):205-210.
[5]LIN Y F,HU Y H,LIN H T,et al.Inhibitory effects of propyl gallate on tyrosinase and its application in controlling pericarp browning of harvested longan fruits[J].Journal of Agricultural and Food Chemistry,2013,61(11):2889-2895.
[6]CARCELLI M,ROGOLINO D,BARTOLI J,et al.Hydroxyphenyl thiosemicarbazones as inhibitors of mushroom tyrosinase and antibrowning agents[J].Food Chemistry,2020,303:125310.
[7]RAMSDEN C A,RILEY P A.Tyrosinase:The four oxidation states of the active site and their relevance to enzymatic activation,oxidation and inactivation[J].Bioorganic and Medicinal Chemistry,2014,22(8):2388-2395.
[8]YAN X,LI H X,ZHENG W S,et al.Visual and fluorescent detection of tyrosinase activity by using a dual-emission ratiometric fluorescence probe[J].Analytical Chemistry,2015,87(17):8904-8909.
[9]ZHANG Z,HUBER D J,QU H,et al.Enzymatic browning and antioxidant activities in harvested litchi fruit as influenced by apple polyphenols[J].Food Chemistry,2015,171:191-199.
[10]CHEN B N,XING R,WANG F,et al.Inhibitory effects of α-Na8SiW11CoO40 on tyrosinase and its application in controlling browning of fresh-cut apples[J].Food Chemistry,2015,188:177-183.
[11]TINELLO F,LANTE A.Evaluation of antibrowning and antioxidant activities in unripe grapes recovered during bunch thinning[J].Australian Journal of Grape and Wine Research,2017,23(1):33-41.
[12]KUIJPERS T F M,VAN HERK T,VINCKEN JP,et al.Potato and mushroom polyphenol oxidase activities are differently modulated by natural plant extracts[J].Journal of Agricultural and Food Chemistry,2014,62(1):214-221.
[13]ZHANG L,ZHAO X,TAO G J,et al.Investigating the inhibitory activity and mechanism differences between norartocarpetin and luteolin for tyrosinase:A combinatory kinetic study and computational simulation analysis[J].Food Chemistry,2017,223:40-48.
[14]谢乐芳.多金属氧酸盐及其修饰电极对酪氨酸酶的电化学传感[D].厦门:集美大学,2018.
XIE L F.Electrochemical sensing on tyrosinase by polyoxome talates and their modified electrodes[D].Xiamen:Jimei University,2018.
[15]李莉莉,邓阳阳,谢乐芳,等.钒取代的Dawson 型磷钼酸对酪氨酸酶的抑制作用[J].应用化学,2018,35(4):436-441.
LI L L,DENG Y Y,XIE L F,et al.Inhibitory effect of vanadium-substituted Dawson type phosphomolybdic acid on tyrosinase[J].Chinese Journal of Applied Chemistry,2018,35(4):436-441.
[16]LI S,MAO L,TIAN Y,et al.Spectrophotometric detection of tyrosinase activity based on boronic acid-functionalized gold nanoparticles[J].Analyst,2012,137(4):823-825.
[17]LEI C,ZHAO X E,SUN J,et al.A simple and novel colorimetric assay for tyrosinase and inhibitor screening using 3,3′,5,5′-tetramethylbenzidine as a chromogenic probe[J].Talanta,2017,175:457-462.
[18]LIU B W,HUANG P C,LI J F,et al.Colorimetric detection of tyrosinase during the synthesis of kojic acid/silver nanoparticles under illumination[J].Sensors and Actuators B:Chemical,2017,251:836-841.
[19]ZHAO J,BAO X,WANG S,et al.In situ fluorogenic and chromogenic reactions for the sensitive dual-readout assay of tyrosinase activity[J].Analytical Chemistry,2017,89(19):10529-10536.
[20]YILDIZ H B,FREEMAN R,GILL R,et al.Electrochemical,photoelectrochemical,and piezoelectric analysis of tyrosinase activity by functionalized nanoparticles[J].Analytical Chemistry,2008,80(8):2811-2816.
[21]LI D,GILL R,FREEMAN R,et al.Probing of enzyme reactions by the biocatalyst-induced association or dissociation of redox labels linked to monolayer-functionalized electrodes[J].Chemical Communications,2006,1(48):5027-5029.
[22]SHAH B,CHEN A.Novel electrochemical approach for the monitoring of biodegradation of phenolic pollutants and determination of enzyme activity[J].Electrochemistry Communications,2012,25(1):79-82.
[23]AO H,QIAN Z,ZHU Y,et al.A fluorometric biosensor based on functional Au/Ag nanoclusters for real-time monitoring of tyrosinase activity[J].Biosensors and Bioelectronics,2016,86:542-547.
[24]QU Z Y,NA W D,LIU X T,et al.A novel fluorescence biosensor for sensitivity detection of tyrosinase and acid phosphatase based on nitrogendoped graphene quantum dots[J].Analytica Chimica Acta,2018,997:52-59.
[25]LI H H,LIU W,ZHANG F Y,et al.Highly selective fluorescent probe based on hydroxylation of phenylboronic acid pinacol ester for detection of tyrosinase in cells[J].Analytical Chemistry,2018,90(1):855-858.
[26]WU X,LI L,SHI W,et al.Near-infrared fluorescent probe with new recognition moiety for specific detection of tyrosinase activity:design,synthesis,and application in living cells and zebrafish[J].Angewandte Chemie-International Edition,2016,55(47):14728-14732.
[27]TENG Y,JIA X,LI J,et al.Ratiometric fluorescence detection of tyrosinase activity and dopamine using thiolate-protected gold nanoclusters[J].Analytical Chemistry,2015,87(9):4897-4902.
[28]MA X G,GAO W Y,HALAWA M I,et al.Lucigenin fluorescent assay of tyrosinase activity and its inhibitor screening [J].Sensors and Actuators B:Chemical,2019,280:41-45.
[29]闫旭.新型纳米传感器的制备及其在农药检测中的应用研究[D].长春:吉林大学,2017.
YAN X.Fabrication and applications of novel nanosensor in pestiside detection[D].Changchun:Jilin University,2017.
[30]LI Y,CHANG X R,SANG X J,et al.Keggintype polyoxometalate modified Ag/graphene composite materials for electrocatalytic water oxidation[J].European Journal of Inorganic Chemistry,2019,2019(31):3597-3604.
[31]GAO J,MIAI J,LI Y,et al.Dye-sensitized polyoxometalate for visible-light-driven photoelectrochemical cells[J].Dalton Transactions,2015,44(32):14354-14358.
[32]MA P,HU F,WANG J,et al.Carboxylate covalently modified polyoxometalates:From synthesis,structural diversity to applications[J].Coordination Chemistry Reviews,2019,378:281-309.
[33]GAO W,ZHOU Q,FU Z,et al.Research on electro-triggered luminescent switching behaviors of film materials containing green luminescence Tbpolyoxometalate[J].Electrochimica Acta,2019,317:139-145.
[34]SONG Y F,TSUNASHIMA R.Recent advances on polyoxometalate-based molecular and composite materials[J].Chemical Society Reviews,2012,41(22):7384-7402.
[35]BOSKOVIC C.Rare earth polyoxometalates[J].Accounts of Chemical Research,2017,50(9):2205-2214.
[36]ÖZLEM A Y,KARDAS F,AKYILDIRIM O,et al.Sensitive voltammetric sensor based on polyoxometalate/reduced graphene oxide nanomaterial:Application to the simultaneous determination of L-tyrosine and L-tryptophan [J].Sensors and Actuators B:Chemical,2016,233:47-54.
[37]CHOI J H,PARK D R,PARK S,et al.Scanning tunneling microscopy study of H6+xP2Mo18-xVxO62 (x=0-3)wells-dawson heteropolyacid catalysts:Correlation of NDR peak voltage with reduction potential and oxidation catalysis[J].Catalysis Letters,2011,141(6):826-832.
[38]高丽华,赵月,赵慧珍,等.Dawson 结构钼磷过渡元素三元杂多酸稳定性的研究[J].哈尔滨师范大学自然科学学报,1993,9(2):52-56.
GAO L H,ZHAO Y,ZHAO H Z,et al.Studies on the stability of transition molybdophosphoric heteropolyacids having Dawson structure[J].Natural Sciences Journal of Harbin Normal University,1993,9(2):52-56.
[39]NIRMAL N P,BENJAKUL S.Inhibition kinetics of catechin and ferulic acid on polyphenoloxidase from cephalothorax of Pacific white shrimp (Litopenaeus vannamei)[J].Food Chemistry,2012,131(2):569-573.
[40]WANG B X,DONG S J.Electrochemical study of isopoly and heteropoly oxometallate film modified microelectrodes:Part 5.Preparation and electrochemical behaviour of a 2:18-molybdodiphosphate anion monolayer modified electrode[J].Journal of Electroanalytical Chemistry,1992,328(1/2):245-257.