母乳以配方奶粉和牛乳不可替代的营养价值而被视为婴幼儿的最佳食物。母乳与其它乳制品最重要的差别就在于所含寡糖的种类和含量不同,在母乳中所含有的母乳寡糖 (human milk oligosaccharides,HMOs) 在非人类乳汁中的含量及复杂性均大大下降。研究表明,HMOs 不仅能提供婴幼儿生长所需的基本营养,而且具有维持肠道菌群的生态平衡的益生性[1]、调节免疫系统[2]、抵抗病原体侵染[3]以及促进新生儿大脑早期发育[4]的功能。其中,2'-岩藻糖乳糖(2'-fucosyllactose,2'-FL) 和乳酰-N-新四糖 (lacto-N-neotetraose,LNnT)均被美国食品药品监督管理局(FDA)和欧洲食品安全局(EFSA)批准作为营养强化剂添加到婴幼儿食品中[4]。
HMOs 的核心结构约有20 种,由核心结构经过岩藻糖基化和唾液酸化,构成丰富多样的HMOs[5]。其中,LNnT 是HMOs 重要的核心结构,也是最简单的type 2 型糖,由半乳糖(Gal)、N-乙酰葡萄糖胺(GlcNAc)和葡萄糖(Glc)组成,结构为Gal β1-4 GlcNAc β1-3 Gal β1-4 Glc (见图1)。此外,LNnT 还可以通过岩藻糖基化和唾液酸化产生多种衍生物(见图1),包括乳酰-N-岩藻糖五糖(lacto-N-fucopentaose,LNFP)、乳酰-N-新岩藻糖五糖 (lacto-N-neofucopentaose,LNnFP)、乳酰-N-新二岩藻糖六糖 (lacto-N-neodifucohexaose,LNnDFH)和唾液酸乳酰-N-四糖(ialyllacto-N-tetraose,LST)。
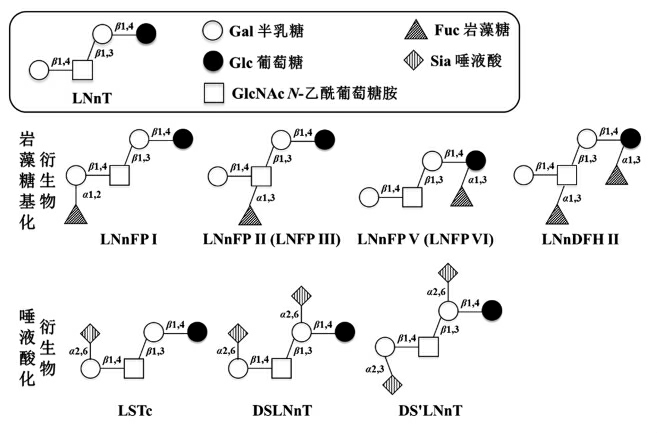
图1 乳酰-N-新四糖及其主要衍生物结构
Fig.1 Structures of LNnT and its main derivatives
LNnT 的合成方法主要有化学合成和生物合成。常规化学合成方法步骤冗杂,副产物多,产物收率低,而生物合成因底物可再生性、反应特异性和环境友好性的优势而被视为体外合成LNnT 及其它HMOs 的最具前景的方法。
1 生理功能
1.1 益生元功能
HMOs 在口腔及小肠中难以消化,由此得以进入肠道中被其中的有益菌群所利用,从而具有益生元功能[4]。在37 ℃厌氧条件下补充含有LNnT的混合低聚糖培养婴儿肠道中的双歧杆菌(Bifidobacterium infantis),结果表明其确实能够促进双歧杆菌的生长和代谢活动[6]。随后对无菌小鼠的饲喂试验发现,与不添加LNnT 的对照组相比,添加LNnT 的试验组的肠道菌群中的双歧杆菌无论是数量还是种群丰度都有了显著提升,证实了LNnT 对促进肠道内的双歧杆菌的生长具有独特的优势[7]。而后通过给6 个婴儿补充含有LNnT 的HMOs 混合物,发现他们在3 个月大时,益生菌的定殖率增加,而病原菌定殖率下降,由此证实LNnT 在婴儿体内确实具有益生效应[1]。
1.2 免疫调节功能
目前已有大量研究报道LNnT 及其衍生物可通过增加Gr1+细胞和抗原提呈细胞(antigenic presenting cells,APC) 的数量来激发2 型免疫。Terrazas 等[8]揭示了LNnT-葡聚糖能有效地促进小鼠的抑制性细胞及未成熟的骨髓细胞的增殖,从而诱导T 细胞增殖分化产生IL-13、IL-4 和IL-10及限制INF-的产生,最终激发2 型免疫。以树突状细胞为代表的APCs,因具有多种糖类抗原受体也能够激活Th2 免疫。LNFP III 被发现可通过与曼氏血吸虫(Schitosoma mansoni)虫卵抗原的特异性结合诱发Th2 免疫[9],也可激活小鼠骨髓来源的树突状细胞而诱发Th2 免疫[2]。
1.3 抗病原体及毒素功能
由于HMOs 与靶细胞表面的受体具有相似的糖链结构,因此既可与受体直接结合,又可以伪装成受体直接与病原体及毒素结合,从而阻遏其与靶细胞的结合[10]。体外实验证实了LNnT 及其唾液酸化衍生物能够阻断肺炎链球菌(Streptococcus pneumonia)与肠上皮细胞的黏附从而抑制肺炎链球菌性肺炎的发生。动物模型试验发现LNnT 和LSTc 能减少在肺炎链球菌肺部的定植并持续抑制其黏附[11],且在补充LNnT 后的30 min 内,肺炎链球菌的黏附率就会降低[12]。
1.4 调节肠道细胞增殖分化
2008年来,Kuntz 等[13-14]发现了从母乳中分离出的寡糖可以调节肠道细胞的增殖和分化。Holscher 等[15]通过对LNnT、2'-FL 和6'-唾液酸乳糖(6'-sialylactose,6'-SL) 的体外研究发现这3种主要的HMOs 均可抑制细胞增殖,但抑制增殖所需的阈值剂量随着HMOs 的种类和细胞类型的不同而改变。
2 生物合成
化学法合成LNnT 需要引入保护基团[16],步骤繁冗,且存在保护不到位、后续脱除不彻底及发生其它副反应的问题,而且常需要使用有毒有害试剂。相比之下,生物法合成由于酶与底物的特异性高、合成步骤简化和副产物少,更适合大规模的工业化生产,成为了LNnT 及其它HMOs 的极具前景的绿色合成方式。
2.1 酶法合成
乳酰-N-三糖II(lacto-N-triose II,LNT II)是合成LNnT 的常见前体。可先合成LNT II,再通过将半乳糖以β-1,4 键连接至受体底物上,实现由LNT II 到LNnT 的转化(见图2)。
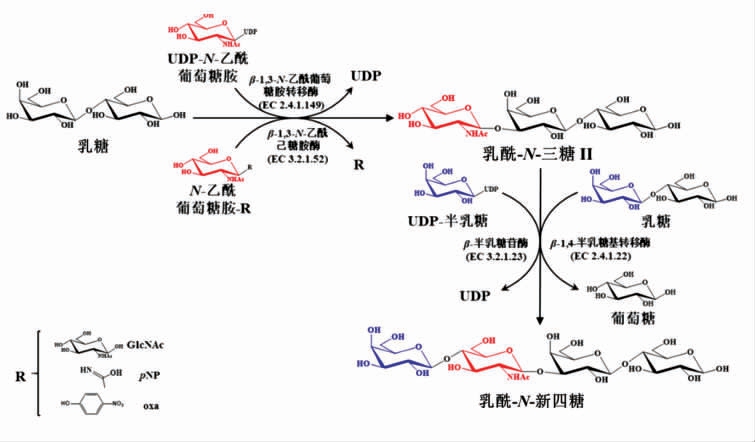
图2 酶法合成乳酰-N-三糖II 及向乳酰-N-新四糖的酶法转化
Fig.2 Enzymatic synthesis of LNT II and its further conversion to LNnT
2.1.1 酶法合成LNT II 哺乳动物来源的β-1,3-N-乙酰葡萄糖胺转移酶(β-1,3-GnT)(EC 2.4.1.149) 能够催化来源于尿苷-5'-二磷酸-GlcNAc(UDP-GlcNAc)的N-乙酰葡萄糖胺(GlcNAc)转移至N-乙酰乳糖胺衍生物末端的3'-OH 位置形成N-乙酰乳糖胺聚糖链[17]。当以乳糖为受体,UDP-GlcNAc 的GlcNAc 为供体时,即可合成LNT II。1983年Yates 等[18]首次报道了使用人血清中的β-1,3-GnT 作为催化剂,合成了微摩尔规模的LNT II。Murata 等[19]使用牛血清提取的β-1,3-GnT 和商业化的UDP-GlcNAc 进一步优化了合成步骤,合成了毫摩尔规模的LNT II。
脑膜炎奈瑟氏球菌(Neisseria meningitidis)来源的β-1,3-N-乙酰葡萄糖胺转移酶(LgtA)具有广泛的受体谱,而且以乳糖为受体时比活力是哺乳动物来源的β-1,3-GnT 的75 倍以上[20]。在添加LgtA 的化学酶法[21]和一锅多酶(OPME)[5]系统中合成了LNT II。其中OPME 系统以GlcNAc 和乳糖为底物,得到了1.5 g 的LNT II [5]。而利用来源于幽门螺杆菌 (Helicobacter pylori) 的LgtA 催化GlcNAc 和乳糖生成了高达88%产率的LNnT[22]。
在酶的挖掘过程中发现,在β-N-乙酰己糖胺酶的13 个候选物中,11 种具有转糖基化活性,其中来源于两歧双歧杆菌(Bifidobacterium bifidum)的β-N-乙酰基己糖胺酶 (BbhI)(EC 3.2.1.52)的催化活性最高。后续试验还进一步发现了以硝基苯N-乙酰基-β-D-葡萄糖胺 (pNP-β-GlcNAc 或pNP-NAG)为供体,乳糖为受体时LNT II 的合成效率最高,达到了44.9%[23]。Schmölzer 等[24]还成功构建了BbhI 的突变体D746E,其转糖基化的选择性相对于产物水解的选择性高出了13 倍,选择另一种有效供体N-乙酰基-D-氨基葡萄糖1,2-恶唑啉(N-acetyl-D-glucosamine 1,2-oxazoline,NAG-oxa) 与乳糖反应仅1 h 就得达到了约为90%的产率,表明该突变体具有的应用潜力。将该糖合酶固定于琼脂糖珠填充的固定床中形成了LNT II 的连续合成方法,LNT II 的生产率为80~100 mmol/(L·min-1) [25]。还有其它细菌来源的β-N-乙酰基己糖胺酶在LNT II 的生产中也具有应用潜力,如从土壤样品中筛选出的两种酶分别以GlcNAc2 和乳糖为底物时产率分别为2%和8%[26],以及从Tyzzerella nexilis 中鉴定出的一种新型酶以pNP-β-GlcNAc 和乳糖为底物时产率为57.2%[27]。
2.1.2 酶法转化LNT II 生成LNnT 一些β-半乳糖苷酶可以催化半乳糖基从乳糖转移至LNT II从而合成LNnT。来源于圆环芽孢杆菌(Bacillus circulans) 的β-半乳糖苷酶就可以催化得到基于LNT II 为19%的产率[19]。来源于圆环芽孢杆菌ATCC 31382 的BgaD-D,来源于嗜热栖热菌HB27(Thermus thermos-philes)的Ttβ-gly 和来源于激烈热球菌DSM 3638(Pyrococcus furiosus)的CelB 合成LNnT 的产率基于乳糖分别为7.1%,5.2%和1.0%,基于LNT II 分别为1.4%,1.0%和0.2%[28],而且提高底物浓度可使BgaD-D 的催化活性进一步提高,基于乳糖的产率为17.3%[27]。
商业化的β-1,4-半乳糖基转移酶(EC 2.4.1.22)[21]和来源于脑膜炎奈瑟氏球菌的β-1,4-半乳糖基转移酶(LgtB)[22]已成功用于以UDP-半乳糖和LNT II 为底物合成LNnT,其中纯化后的LgtB催化产率高达93%。
2.2 代谢工程合成
与酶法合成相似,LNnT 的代谢工程合成也需要先合成LNT II,而LgtA 作为代谢通路中的关键酶,负责催化外源添加的乳糖和内源合成的UDPGlcNAc 反应生成LNT II。基于LNT II 生物合成途径的构建,将LgtB 引入到工程菌株中,催化LNT II 的半乳糖基化,产生LNnT(见图3)。
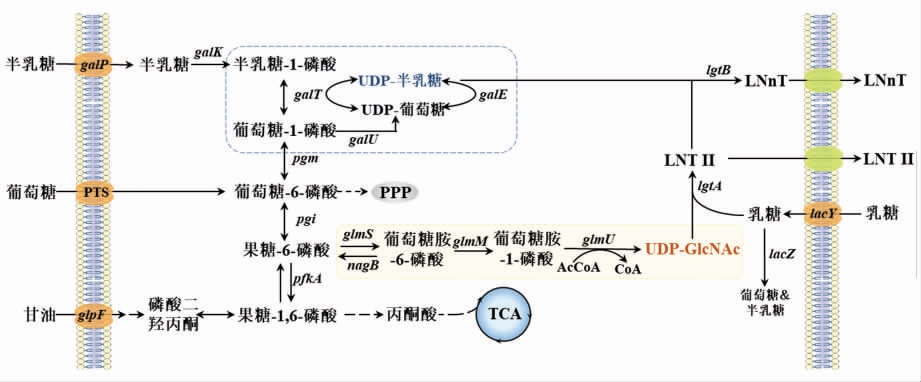
图3 乳酰-N-三糖II 及乳酰-N-新四糖在大肠杆菌内的生物合成途径
Fig.3 Biosynthesis pathway of LNT II and LNnT in E.coli
乳糖转运酶(LacY) 能够将乳糖转运到细胞中,β-半乳糖苷酶(LacZ)的缺失抑制了乳糖水解,大肠杆菌JM109 是LacZ 缺失且含有LacY (lacY+lacZ-)的菌株,当将脑膜炎奈瑟氏球菌的lgtA 基因以质粒为载体导入其中时,通过分批补料可高效生产LNT II,产量为6 g/L。当来源于脑膜炎奈瑟氏球菌的LgtB 与LgtA 共表达时,LNT II 进一步转化为LNnT 和副产物乳酰新六糖 (lacto-neohexaose,LNnH),得到高达5 g/L 的总产量[29]。
Baumgärtner 等[30]通过对脑膜炎奈瑟氏球菌来源的lgtA 进行染色体整合,构建了无质粒的工程化lacY+ lacZ- 大肠杆菌菌株来合成LNT II。之后以葡萄糖为主要碳源合成了1.906 g/L 的LNT II,以甘油为主要碳源合成了2.465 g/L 的LNT II,结果表明甘油作为碳源优于葡萄糖。之后进一步试验发现以半乳糖作为唯一碳源的分批补料培养得到了12.72 g/L 的LNT II[31]。
目前已在枯草芽孢杆菌中构建了UDP-半乳糖和UDP-GlcNAc 的两个前体供应的代谢通路,实现了合成LNnT 的关键前体的供应平衡。在枯草芽孢杆菌中共表达LacY、LgtA 和LgtB 高效地合成了LNnT,通过分批补料培养得到了4.52 g/L的LNnT 和2.64 g/L 的LNT II[32]。又利用成簇的规律间隔成簇短回文重复序列干扰(CRISPRi)的策略下调了涉及竞争途径的基因,微调了LNT II 和LNnT 的代谢通路,最终分批补料培养得到了5.41 g/L 的LNnT 和2.98 g/L 的LNT II[33]。
3 衍生化
HMOs 被划分为非岩藻糖基化的中性HMOs、岩藻糖基化HMOs 及唾液酸化HMOs。其中岩藻糖基化HMOs 约占所有HMOs 的35%~50%,唾液酸化约占总量的12%~14%,且其各种HMOs 的生理活性得到了广泛的研究验证。LNnT 利用α-L-岩藻糖苷酶(EC3.2.1.-)或α-岩藻糖基转移酶(EC 2.4.1-)催化岩藻糖残基以α1,2 和α1,3 键连接到半乳糖、葡萄糖或GlcNAc 残基上得到岩藻糖基化的衍生物,主要有LNnFP I,LNnFP II(LNFP III),LNnFP V(LNFP VI)和LNnDFH II。LNnT 利用唾液酸糖苷酶(EC 3.2.1.18)和唾液酸转移酶(SiaT,EC 2.4.99-) 催化唾液酸残基以α2,3 和α2,6 键连接到半乳糖残基上构成唾液酸化的寡糖,主要有LSTa 和α-2,6-二唾液酸-N-新四糖(DSLNnT)。
3.1 岩藻糖基化
α-L-岩藻糖苷酶(EC3.2.1.-)主要作用是催化α-L-岩藻糖苷的水解,但同时也显示出了催化岩藻糖基转移到低聚糖的糖合酶活性。来源于B.bifidum 的L-1,3/4-L-岩藻糖苷酶(EC 3.2.1.111)(BbAfcB) 能够以LNnT 为受体合成LNFP III,来源于产气荚膜梭菌(Clostridium perfringen) 的酶(CpAfc2)具有相同的催化能力且合成的LNFP III产率更高[34]。来源于婴儿长双歧杆菌亚种(Bifidobacterium longum subsp.infantis) 的α-L-岩藻糖苷酶(BiAfcB)也被改造为α-1,3/4-L-转岩藻糖苷酶用于LNFP III 合成[35]。一项专利报道了Bi-AfcB 的高效突变体,以LNnT 和3-FL 为底物,催化合成LNFP III 的活性提高了7 300 倍[36]。
岩藻糖基转移酶(EC 2.4.1-)可以催化L-岩藻糖基从鸟苷二磷酸(GDP)-岩藻糖转移至受体。来自幽门螺杆菌的α-1,3-岩藻糖基转移酶(Hp3FT) 在以GDP-岩藻糖为供体,LNnT 为受体时能够生成LNFP III 并进一步岩藻糖基化为LNnDFH II[22,37]。来源于幽门螺杆菌UA948 的α-1,3/4-岩藻糖基转移酶(HP3/4FT)能从岩藻糖和其它受体出发产生LNFP III、LNDFH II 和LNnDFH II[38]。幽门螺杆菌DSM6709 来源的FucT III 对LNnT 表现出高效特异性,在合成LNFP VI 后可进一步岩藻糖基化为LNnDFH II[39]。脆弱类杆菌(Bacteroides fragilis) 来源的Bf13FT能够催化GDP-岩藻糖将岩藻糖基转移到乳糖和N-乙酰乳糖胺(LacNAc)上,生成LNnFP II(LNFP III)、LNnFP V 和LNnDFH II[40]。
在构建了LNnT 生物合成代谢工程菌的基础上,进一步引入编码特定岩藻糖基转移酶的基因可在体内实现LNnT 的岩藻糖基化。通过向已构建GDP-岩藻糖从头合成代谢途径的工程菌中引入fucT、futA 和futB 这3 个H.pylori 26695 来源的α-1,3-岩藻糖基转移酶基因,合成了多种岩藻糖基化的LNnT 衍生物[41-42]。结果发现,futT 的导入得到了3 g/L 的LNnFP V,同时产生了少量的LNnDFH II[41]。futA 的导入得到了1.7 g/L LNnFP V,futB 的导入得到了LNnFP V、LNnFP II 和LNnDFH II[42]。通过增加GDP-岩藻糖途径并表达FutC 同样实现了LNnT 的工程菌体内的岩藻糖基化,提纯后得到了3 g 低聚糖,其中LNnFP I 的含量为57%[43]。
3.2 唾液酸化
唾液酸糖苷酶主要作用是催化去除末端唾液酸基残基的反应,部分唾液酸糖苷酶对特定的供体和受体底物也表现出一定的转唾液酸的活性[44],例如在转唾液酸糖苷酶的催化作用下,成功地以LNnT 和N-乙酰神经氨酸(NeuAc)为底物合成了衍生物LSTd[45]。
唾液酸转移酶(SiaTs) 催化唾液酸从供体胞苷-5'-单磷酸 (CMP)-N-乙酰神经氨酸(NeuAc)转移至各种受体上。McArthur 等[46]通过诱变筛选得到具有α-2,6-SiaT 催化活性的P34H/M144L突变体,可以同时产生LSTc βProN3 和DSLNnT βProN3。有专利报道构建了莱氏发光菌(Photobacterium leiognathi)α-2,6-SiaT 的多位点变异体,提高了其生产LSTc 的转移酶活性、区域选择性和热稳定性,用该高效突变体催化LNnT 合成LSTc 的最大转化率可达55%左右[36]。某些SiaTs还能催化合成LNnT 双唾液酸化衍生物,如淡色光细菌(Photobacterium damselae)来源的α-2,6-唾液酸转移酶Pd2,6ST 可以催化NeuAc 和LNnT合成达到了克规模的DSLNnT[47-48]。
4 结语
食品工业的任务随着社会的发展而变化,如今人们对食品的需求已转变为高品质的营养健康,为了更好地模拟母乳,完善婴幼儿配方奶粉的功能供给,母乳寡糖的相关研究目前处于火热阶段。由于一锅多酶体系和代谢工程的发展,LNnT及其它HMOs 的生物合成虽然已取得了重大进展,但依然处于低产率、低效价及低生产率的阶段,远不足以支撑规模化的工业生产。
UDP-半乳糖、UDP-GlcNAc、GDP-岩藻糖和CMP-NeuAc 等核苷酸糖的合成被认为是代谢途径中的限速步骤,需要进一步地研究以提高这些核苷酸糖的再生。此外,寡糖合成过程的部分中间产物对细胞生长具有影响,可以通过对代谢途径的动态调节等手段来平衡细胞生长HMOs 生产。目前酶法合成LNnT 及其衍生物的研究较多,尤其是包含关键糖基转移酶和前体生成酶的一锅多酶反应,该方法在实现HMOs 的高产中具有巨大潜力,但关键酶在工程菌内的可溶性表达和催化效率问题亟待解决,还需挖掘新的糖基转移酶和糖苷酶。定向挖掘得到的酶可通过理性设计、半理性设计或定向进化策略提高其转糖基化效率和热稳定性,以实现HMOs 的高效生产。
综上所述,两种生物合成方法都具有其独特的优势,酶法合成复杂的HMOs 可能更具潜力,但简单HMOs 的合成代谢工程优势更显著。而随着近年来对LNnT 及其衍生物的生理功能的揭示,HMOs 的需求量将会迅速增长。
[1]PUCCIO G,ALLIET P,CAJOZZO C,et al.Effects of infant formula with human milk oligosaccharides on growth and morbidity:A randomized multicenter trial [J].J Pediatr Gastroenterol Nutr,2017,64(4):624-631.
[2]THOMAS P G,CARTER M R,ATOCHINA O,et al.Maturation of dendritic cell 2 phenotype by a helminth glycan uses a Toll-like receptor 4-dependent mechanism[J].J Immunol,2003,171(11):5837-5841.
[3]EL-HAWIET A,KITOVA E N,KLASSEN J S.Recognition of human milk oligosaccharides by bacterial exotoxins[J].Glycobiology,2015,25(8):845-854.
[4]PEREZ-ESCALANTE E,ALATORRE-SANTAMARIA S,CASTANEDA-OVANDO A,et al.Human milk oligosaccharides as bioactive compounds in infant formula:Recent advances and trends in synthetic methods[J].Crit Rev Food Sci Nutr,2022,62(1):181-214.
[5]MCARTHUR J B,YU H,CHEN X.A bacterial β1-3-galactosyltransferase enables multigram-scale synthesis of human milk lacto-N-tetraose (LNT)and its fucosides[J].Acs Catal,2019,9(12):10721-10726.
[6]PRIETO P.In vitro and clinical experiences with a human milk oligosaccharide,lacto-N-neotetraose,and fructooligosaccharides[J].Foods Food Ingredients J Jpn,2005,210(11):1018.
[7]MARCOBAL A,BARBOZA M,SONNENBURG E D,et al.Bacteroides in the infant gut consume milk oligosaccharides via mucus-utilization pathways[J].Cell Host Microbe,2011,10(5):507-514.
[8]TERRAZAS L I,WALSH K L,PISKORSKA D,et al.The schistosome oligosaccharide lacto-N-neotetraose expands Gr1 (+) cells that secrete anti-inflammatory cytokines and inhibit proliferation of naive CD4 (+) cells:A potential mechanism for im mune polarization in helminth infections[J].J Immunol,2001,167(9):5294-5303.
[9]OKANO M,SATOSKAR A R,NISHIZAKI K,et al.Lacto-N-fucopentaose III found on Schistosoma mansoni egg antigens functions as adjuvant for proteins by inducing Th2-type response[J].J Immunol,2001,167(1):442-450.
[10]NEWBURG D S,RUIZ-PALACIOS G M,MORROW A L.Human milk glycans protect infants against enteric pathogens[J].Annu Rev Nutr,2005,DOI:10.1146/annurev.nutr.25.050304.092553.
[11]IDÄNPÄÄN-HEIKKILÄ I,SIMON P M,ZOPF D,et al.Oligosaccharides interfere with the establishment and progression of experimental Pneumococcal pneumonia[J].J Infect Dis,1997,176(3):704-712.
[12]TONG H H,MCIVER M A,FISHER L M,et al.Effect of lacto-N-neotetraose,asialoganglioside-GM1 and neuraminidase on adherence of otitis media-associated serotypes of Streptococcus pneumoniaeto chinchilla tracheal epithelium [J].Microb Pathog,1999,26(2):111-119.
[13]KUNTZ S,KUNZ C,RUDLOFF S.Oligosaccharides from human milk induce growth arrest via G2/M by influencing growth-related cell cycle genes in intestinal epithelial cells[J].Br J Nutr,2009,101(9):1306-1315.
[14]KUNTZ S,RUDLOFF S,KUNZ C.Oligosaccharides from human milk influence growth-related characteristics of intestinally transformed and non-transformed intestinal cells[J].Br J Nutr,2008,99(3):462-471.
[15]HOLSCHER H D,DAVIS S R,TAPPENDEN K A.Human milk oligosaccharides influence maturation of human intestinal Caco-2Bbe and HT-29 cell lines[J].J Nutr,2014,144(5):586-591.
[16]BANDARA M D,STINE K J,DEMCHENKO A V.The chemical synthesis of human milk oligosaccharides:Lacto-N-tetraose (Gal β1→3 GlcNAc β1→3 Gal β1→4 Glc)[J].Carbohydr Res,2019,DOI:10.1016/j.carres.2019.107824.
[17]VAN DEN EIJNDEN D H,KOENDERMAN A H,SCHIPHORST W E.Biosynthesis of blood group iactive polylactosaminoglycans.Partial purification and properties of an UDP-GlcNAc:N-acetyllactosaminide β1,3-N-acetylglucosaminyltransferase from Novikoff tumor cell ascites fluid[J].J Biol Chem,1988,263(25):12461-12471.
[18]YATES A D,WATKINS W M.Enzymes involved in the biosynthesis of glycoconjugates[J].A UDP-2-acetamido-2-deoxy-d-glucose:β-d-galactopyranosyl-(1→4)-saccharide (1→3)-2-acetamido-2-deoxy-βd-glucopyranosyltransferase in human serum[J].Carbohydr Res,1983,120:251-268.
[19]MURATA T,INUKAI T,SUZUKI M,et al.Facile enzymatic conversion of lactose into lacto-N-tetraose and lacto-N-neotetraose[J].Glycoconjugate Journal,1999,16(3):189-195.
[20]BLIXT O,VAN DIE I,NORBERG T,et al.Highlevel expression of the Neisseria meningitidis lgtA gene in Escherichia coli and characterization of the encoded N-acetylglucosaminyltransferase as a useful catalyst in the synthesis of GlcNAc β1 →3Gal and GalNAc β1→3Gal linkages[J].Glycobiology,1999,9(10):1061-1071.
[21]RENAUDIE L,DANIELLOU R,AUGE C,et al.Enzymatic supported synthesis of lacto-N-neotetraose using dendrimeric polyethylene glycol[J].Carbohydr Res,2004,339(3):693-698.
[22]CHEN C C,ZHANG Y,XUE M Y,et al.Sequential one-pot multienzyme (OPME) synthesis of lacto-N-neotetraose and its sialyl and fucosyl derivatives[J].Chem Commun,2015,51(36):7689-7692.
[23]CHEN X,XU L,JIN L,et al.Efficient and regioselective synthesis of β-GalNAc/GlcNAc-lactose by a bifunctional transglycosylating β-N-acetylhexosaminidase from Bifidobacterium bifidum[J].Appl Environ Microbiol,2016,82(18):5642-5652.
[24]SCHMÖLZER K,WEINGARTEN M,BALDENIUS K,et al.Glycosynthase principle transformed into biocatalytic process technology:Lacto-N-triose II production with engineered exo-hexosaminidase [J].ACS Catal,2019,9(6):5503-5514.
[25]RUZIC L,BOLIVAR J M,NIDETZKY B.Glycosynthase reaction meets the flow:Continuous synthesis of lacto-N-triose II by engineered β-hexosaminidase immobilized on solid support[J].Biotechnol Bioeng,2020,117(5):1597-1602.
[26]NYFFENEGGER C,NORDVANG R T,ZEUNER B,et al.Backbone structures in human milk oligosaccharides:trans-glycosylation by metagenomic β-N-acetylhexosaminidases[J].Appl Microbiol Biotechnol,2015,99(19):7997-8009.
[27]LIU Y H,WANG L,HUANG P,et al.Efficient sequential synthesis of lacto-N-triose II and lacto-N-neotetraose by a novel β-N-acetylhexosaminidase from Tyzzerella nexilis[J].Food Chem,2020,DOI:10.1016/j.foodchem.2020.127438.
[28]ZEUNER B,NYFFENEGGER C,MIKKELSEN J D,et al.Thermostable β-galactosidases for the synthesis of human milk oligosaccharides[J].N Biotechnol,2016,33(3):355-360.
[29]PRIEM B,GILBERT M,WAKARCHUK W W,et al.A new fermentation process allows large-scale production of human milk oligosaccharides by metabolically engineered bacteria[J].Glycobiology,2002,12(4):235-240.
[30]BAUMGARTNER F,CONRAD J,SPRENGER G A,et al.Synthesis of the human milk oligosaccharide lacto-N-tetraose in metabolically engineered,plasmid-free E.coli[J].Chembiochem,2014,15(13):1896-1900.
[31]BAUMGARTNER F,SPRENGER G A,ALBERMANN C.Galactose-limited fed-batch cultivation of Escherichia coli for the production of lacto-N-tetraose[J].Enzyme Microb Technol,2015,DOI:10.1016/j.enzmictec.2015.04.009.
[32]DONG X,LI N,LIU Z,et al.Modular pathway engineering of key precursor supply pathways for lacto-N-neotetraose production in Bacillus subtilis[J].Biotechnol Biofuels,2019,DOI:10.1186/s13068-019-1551-3.
[33]DONG X M,LI N,LIU Z M,et al.CRISPRiguided multiplexed fine-tuning of metabolic flux for enhanced lacto-N-neotetraose production in Bacillus subtilis[J].J Agr Food Chem,2020,68(8):2477-2484.
[34]ZEUNER B,MUSCHIOL J,HOLCK J,et al.Substrate specificity and transfucosylation activity of GH29 α-l-fucosidases for enzymatic production of human milk oligosaccharides[J].N Biotechnol,2018,DOI:10.1016/j.nbt.2017.12.002.
[35]SAUMONNEAU A,CHAMPION E,PELTIER-PAIN P,et al.Design of an α-L-transfucosidase for the synthesis of fucosylated HMOs [J].Glycobiology,2016,26(3):261-269.
[36]CHAMPION E,MCCONNELL B,DEKANY G,et al.Ternary mixtures of 6'-SL,LNnT and LST c:United States,10695359[P].2016-06-09.
[37]BAI J,WU Z,SUGIARTO G,et al.Biochemical characterization of Helicobacter pylori α1-3-fucosyltransferase and its application in the synthesis of fucosylated human milk oligosaccharides[J].Carbohydr Res,2019,DOI:10.1016/j.carres.2019.05.007.
[38]YU H,LI Y,WU Z,et al.H.pylori α1-3/4-fucosyltransferase (Hp3/4FT)-catalyzed one-pot multienzyme (OPME) synthesis of Lewis antigens and human milk fucosides[J].Chem Commun (Camb),2017,53(80):11012-11015.
[39]TSAI T W,FANG J L,LIANG C Y,et al.Exploring the synthetic application of Helicobacter pylori α1,3/4-fucosyltransferase FucT III toward the syntheses of fucosylated human milk glycans and Lewis antigens[J].ACS Catal,2019,9(12):10712-10720.
[40]HUANG H H,FANG J L,WANG H K,et al.Substrate characterization of Bacteroides fragilis α1,3/4-fucosyltransferase enabling access to programmable one-pot enzymatic synthesis of KH-1 antigen[J].ACS Catal,2019,9(12):11794-11800.
[41]DUMON C,PRIEM B,MARTIN S L,et al.In vivo fucosylation of lacto-N-neotetraose and lacto-Nneohexaose by heterologous expression of Helicobacter pylori α-1,3 fucosyltransferase in engineered Escherichia coli[J].Glycoconjugate J,2001,18(6):465-474.
[42]DUMON C,SAMAIN E,PRIEM B.Assessment of the two Helicobacter pylori α-1,3-fucosyltransferase ortholog genes for the large-scale synthesis of Lewis x human milk oligosaccharides by metabolically engineered Escherichia coli[J].Biotechnol Prog,2004,20(2):412-419.
[43]DUMON C,BOSSO C,UTILLE J P,et al.Production of Lewis x tetrasaccharides by metabolically engineered Escherichia coli[J].Chembiochem,2006,7(2):359-365.
[44]ZHANG X,LIU Y,LIU L,et al.Microbial production of sialic acid and sialylated human milk oligosaccharides:Advances and perspectives [J].Biotechnol Adv,2019,37(5):787-800.
[45]JOHNSON K F.Synthesis of oligosaccharides by bacterial enzymes[J].Glycoconjugate J,1999,16(2):141-146.
[46]MCARTHUR J B,YU H,ZENG J,et al.Converting Pasteurella multocida α2-3-sialyltransferase 1(PmST1)to a regioselective α2-6-sialyltransferase by saturation mutagenesis and regioselective screening[J].Org Biomol Chem,2017,15(7):1700-1709.
[47]YU H,LAU K,THON V,et al.Synthetic disialyl hexasaccharides protect neonatal rats from necrotizing enterocolitis[J].Angew Chem Int Ed Engl,2014,53(26):6687-6691.
[48]YU H,YAN X,AUTRAN C A,et al.Enzymatic and chemoenzymatic syntheses of disialyl glycans and their necrotizing enterocolitis preventing effects[J].J Org Chem,2017,82(24):13152-13160.