细菌通常附着于物体的表面,如生物体、塑料、不锈钢、玻璃等,并由胞外分泌物聚集形成复杂的群落组织,即生物膜,也称为生物被膜[1]。细菌能够通过生物膜在较短的时间内黏附于设备及容器内,给食品工业带来严峻的挑战[2]。生物膜中的细菌有着良好的生存环境,且受外界的不良因素(紫外线、抗生素、消毒剂的处理等[3])影响较小,使得细菌难以消除。另外,一些微生物生物膜的形成有益于食品工业,例如,乳酸菌形成的生物膜在发酵乳制品和醋酸饮料方面有着很好的应用[4]。
水产品营养丰富,脂肪含量低,蛋白含量高[5],失去生命后成为微生物生长良好的“培养基”。一些腐败微生物的生长是引起水产品腐败的主要原因[6],这些微生物通常称为特定腐败微生物(specific spoilage organisms,SSOs)[7-8]。其能够分解水产品中的氨基酸和蛋白质,产生挥发性硫化物、胺、三甲胺、有机酸和一些腐败代谢产物,产生不良气味并使水产品腐败[9]。目前,低温冷藏水产品中的SSOs 主要有希瓦氏菌属(Shewanella spp.)、假单胞菌属 (Pseudomonas spp.) 和气单胞菌属(Aeromonas spp.)[10-11]。SSOs 生物膜的存在,使其抗逆性增强并加速了水产品的腐败[12]。深入研究腐败菌生物膜调控机制将有助于阻断生物膜的形成,解释细菌的耐药性,为延长水产品货架期提供理论基础。
1 水产品腐败菌生物膜的形成过程
1.1 水产品腐败菌生物膜的组成
在水产品加工环境中,腐败菌易形成生物膜黏附于水产品和加工设备的表面[13]。与一般微生物类似,腐败菌生物膜主要由菌体和胞外聚合物(extracellular polymeric substances,EPS) 组成。EPS 为生物膜内的菌体提供了利于生长的环境。EPS 占生物膜中有机物含量的50%~80%,主要由胞外多糖、蛋白质和胞外DNA(extracellular DNA,eDNA)组成[14]。胞外聚合物为生物膜提供了许多有益的功能,如促进细菌细胞间的聚集性和结构完整性,提供对压力的耐受性,EPS 还可以作为营养,有助于细胞对有机物的吸附和遗传物质的交换[1]。此外,一些细菌的胞外多糖中还存在大量编码黏附蛋白的基因,能够生成黏附素,有利于细菌进一步与基质黏附产生生物膜[15]。还有研究表明,缺乏基因组编码的噬菌体不能形成生物膜,表明了eDNA 在生物膜形成过程中起着重要的作用[16]。
1.2 腐败菌生物膜的形成过程
目前,腐败菌形成生物膜的过程大致相同,包括嗜水单气胞菌、荧光假单胞菌、希瓦氏菌等[17-19]。其形成主要分4 个步骤(见图1)。第一步为菌体的初始黏附,浮游的细菌附着在生物或非生物表面,腐败菌可以通过鞭毛聚集在一起进行吸附,而一些无鞭毛的菌体则通过沉降作用黏附到水产品表面。此外,腐败菌还可以利用锚定在细胞壁上的黏附蛋白进一步进行吸附,例如,在腐败希瓦氏菌中可通过黏附蛋白LapA 进行吸附[20]。同样,在荧光假单胞菌中也通过LapA 和LapG 帮助菌体黏附[21]。但这时附着的细胞还未形成完整的生物膜。第二步为细胞的增殖、微菌落的形成,初始黏附后,这些细胞迅速增殖,形成小菌落。这是个不可逆的过程,这时候腐败菌开始产生胞外多糖、蛋白质和eDNA,此过程较短,能否顺利的进行是影响生物膜成熟的重要因素[22]。第三阶段是生物膜的成熟,生物膜形成蘑菇状的三维结构和胞外基质,此时,生物膜的成分是复杂的,水、蛋白质和胞外多糖作为生物膜的“骨架结构”,eDNA 则作为“填充物”填充其中[23]。生物膜的成熟也使菌体与外界的物质交换更为缓慢,同时,有害物质不易接触到菌体。最后一个阶段是生物膜的解散,生物膜内的糖和蛋白质的分解酶将生物膜降解,随后菌体从生物膜中解散并且重新恢复浮游状态。目前这个阶段的研究还较少,有研究表明此过程有可能是因为菌体生存条件的恶化而引发[24]。Qin 等[24]认为嗜水气单胞菌生物膜的解散不是被动行为,而是有利于发现新的生存环境的自发行为。

图1 腐败菌生物膜形成的过程
Fig.1 The process of spoilage bacteria biofilm formation
2 水产品腐败菌生物膜形成的调控机制
目前对水产品中3 种最常见腐败菌(希瓦氏菌、荧光假单胞菌和嗜水单气胞菌)生物膜形成的调控机制还处于起步阶段,水产品中的腐败菌形成生物膜的过程涉及到大量基因的表达、蛋白的黏附以及调控因子和信号分子的调控作用[25]。下面,对水产品中常见的3 种腐败菌生物膜形成机制分别进行阐述。
2.1 希瓦氏菌
2.1.1 c-di-GMP 信号因子 第二信使环二鸟苷酸(c-di-GMP)普遍存在于细菌中,其能够调控菌体生物膜的形成和细胞分裂等生命活动,对革兰氏阴性菌生物膜的形成有重要的调控作用[26]。其一般规律为:胞内c-di-GMP 含量较高时,菌体则以生物膜形成存在;含量较低时,则以浮游状态形式存在。c-di-GMP 由两分子GTP 在二鸟苷酸环化酶(diguanylate cyclase,DGC)催化下合成,并在磷酸二酯酶(phosphodiesterases,PDE)的催化下降解,DGC 和PDE 分别具有保守催化位点Gly-Gly-Asp-Glu-Phe(GGDEF)和Glu-Ala-Leu(EAL)[27]。腐败希瓦氏菌存在能够编码DGC 和PDE 的多种基因,从而调控菌体的生物膜(见图2)。此外,一些研究中提到外界因素会影响DGC 和PDE 的合成,并且环境因素越复杂,调控c-di-GMP 的因子越多,最终菌体越能适应复杂的环境[28]。如在腐败希瓦氏菌(S.putrefaciens)CN32,一个对氧敏感的DGC 在有氧情况下能促进生物膜的形成,在有氧条件下,DGC 合成c-di-GMP,并调节编码黏附蛋白BpfA 的bpfA 操纵子的转录[29]。相反,转录阻遏因子FlrA 在缺乏c-di-GMP 的情况下会结合到bpfA 的操纵子区并抑制其转录,FlrA 还作为细菌鞭毛运动的调节因子调控细菌的运动[30]。当c-di-GMP 处于较高浓度时会与FlrA 结合为复合物,从而阻止FlrA 对bpfA 操纵子的结合[31]。大量的DGC 和PDE 的存在显示了腐败希瓦氏菌中c-di-GMP 在生物膜调控中的作用。目前,已发现生物膜的调控因子还较少,仍需更多的研究来揭示该菌生物膜形成的分子机制。
2.1.2 群体感应(QS) QS 是细菌细胞间的交流系统,能够调节细菌群体行为,如生物发光、生物膜形成和产毒等。根据信号分子的不同,可将QS分为3 种:LuxI/R 型信号系统,是大部分革兰氏阴性菌的QS 系统,以高丝氨酸内酯类化合物(N-acyl-homoserine lactones,AHLs)作为信号分子;小分子多肽型信号系统,该系统由寡肽类(Autoinducing peptides,AIPs)物质作为信号分子介导,存在于革兰氏阳性菌中;LuxS/AI-2 型信号系统,是由呋喃硼酸二酯类(Autoinducer-2,AI-2)介导的QS 系统[32]。此外,还存在其它信号分子,如二酮哌嗪类化合物(Diketopiperazines,DKPs),可同时对种间和种内进行QS 调节[33]。通常,在希瓦氏菌中一般是由AHLs 和DKPs 信号分子介导的QS。
Jie 等[34]发现从腐败的虾中分离出来的波罗的海希瓦氏菌虽然不能产生AHLs,但是能够感知其它细菌产生的AHLs 信号分子,并且通过受体系统LuxR 协调细菌细胞的行为。在大黄鱼分离的波罗的海希瓦氏菌中,存在DKPs 信号分子来调节LuxR 介导的QS 系统[35]。该菌还存在LuxS/AI-2 型QS 系统,AI-2 会抑制竞争细菌的生长,但是对生物膜的形成无显著作用[36]。张笑笑[37]发现DKPs-LuxR 型QS 系统可通过调控pomA 基因的表达来促进波罗的海希瓦氏菌生物膜的形成 (见图2)。还有一些学者研究了添加信号分子对菌种间生物膜形成的影响,Zhu 等[38]从凡纳滨对虾分离的腐败希瓦氏菌和波罗的海希瓦氏菌进行共培养时发现,两种菌存在着某种合作关系,加强了致腐性,在添加QS 信号分子cyclo-(L-Pro-L-Leu) 后,促进了两菌生物膜的生长。
希瓦氏菌生物膜调控的大致机制可用图2表示。
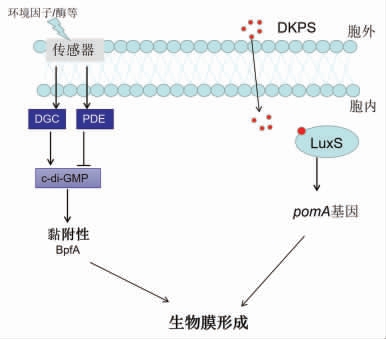
图2 希瓦氏菌生物膜的调控机制
Fig.2 Regulation mechanism of Shewanella biofilm
2.2 荧光假单胞菌
2.2.1 c-di-GMP 在荧光假单胞菌中,当反应调节因子促进PDE 合成,胞内的c-di-GMP 被降解,同f 腐败希瓦氏菌类似,低浓度的c-di-GMP 会抑制黏附蛋白的合成,但机制有所差别:鲑鱼中的荧光假单胞菌存在c-di-GMP 的受体蛋白LapD、蛋白酶LapG 和黏附蛋白LapA,当c-di-GMP 浓度较低时,LapG 会降解LapA,使菌体失去黏附性,不利于生物膜的生长;当c-di-GMP 浓度较高时,c-di-GMP 会与受体蛋白LapD 形成复合体,此复合体能与LapG 结合使其失去活性,从而促进黏附蛋白LapA 的合成[39]。此外,高浓度的c-di-GMP还利于生物膜中胞外多糖的合成[40](图3)。
2.2.2 QS 在荧光假单胞菌中,QS 调节系统属于LuxI/R 型和LuxS/AI-2 型信号系统。唐蓉[41]在冷藏的腐败大黄鱼中的优势腐败菌荧光假单胞菌PF07 检测到了AHLs 信号分子 (含有C4-HSL、C10-HSL 和C14-HSL 3 种信号分子)。通过比较敲除luxI 和luxR 基因的缺陷株和野生株的相关基因,发现缺陷株中多糖合成的相关基因下调,导致c-di-GMP 含量降低的相关基因上调,最终阻碍了生物膜的形成。同样是该QS 系统,Liu 等[42]研究发现RpoS 调控因子可直接调节AHLs 因子的合成,从而增强菌体的致腐能力,但未对生物膜进行考察。毕伟伟[43]研究发现Rpos 对大黄鱼源腐败菌荧光假单胞菌的生物膜的形成有促进作用。还有一些研究了荧光假单胞菌和波罗的海希瓦氏菌共培养时的生物膜特征,混合菌的生物膜量要低于单种荧光假单胞菌,表明二者共培养存在某种竞争作用[44]。这可能是因为波罗的海希瓦氏菌不产生AHLs,但却消耗或者抑制了荧光假单胞菌产生的AHLs,因而也抑制了波罗的海希瓦氏菌生物膜的产生[44](图3)。
2.2.3 双组分调控系统(TCS) TCS 是细菌细胞将环境信号转化为化学信号的一种调控方式,由能感应环境信号的组胺酸激酶 (histidine kinase,HK)和与之共轭的调节蛋白(regulatory proteins,RP)组成。在腐败菌荧光假单胞菌中,双组分调控系统为GacS-GacA。Cheng 等[45]使用荧光假单胞菌的gacS 突变体的转录谱分析表明,该TCS 会促进胞外多糖的合成和c-di-GMP 信号分子相关基因的表达。同样,在荧光假单胞菌F113 中,GacSGacA 系统的破坏会导致菌体运动性增加,生物膜的合成遭到破坏[46]。RNA 小分子RsmA 和RsmZ的转录受到GacS-GacA 系统的激活,从而抑制运动基因的转录并且促进生物膜胞外多糖的合成,最终促进生物膜的合成[47]。
荧光假单胞菌生物膜调控的大致机制可用图3表示。
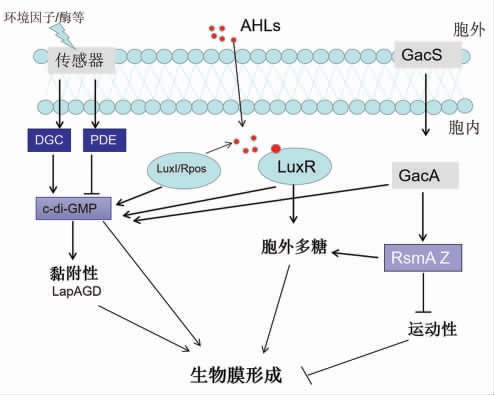
图3 荧光假单胞菌生物膜的调控机制
Fig.3 Regulation mechanism of Pseudomonas fluorescens biofilm
2.3 嗜水单气胞菌(Aeromonas hydrophila)
同样,嗜水单气胞菌中生物膜的形成也会受到c-di-GMP 的调控:当胞内c-di-GMP 浓度较高时,会导致生物膜转录调节因子VpsT 基因的表达,促使生物膜(胞外多糖)的产生。此外,还会结合转录因子FleQ 以致鞭毛基因的转录受到抑制,使得菌体处于生物膜状态。相反,胞内低浓度的c-di-GMP 也会从运动性和胞外多糖方面来使菌体处于浮游状态[48](图4)。然而,在早期,菌毛和甘露糖敏感血凝素(MSHA)菌毛的存在有助于生物膜的形成,因为鞭毛和MSHA 菌毛增加了菌体和基质的接触机会[24]。嗜水单气胞菌受到的QS 有LuxR 型和LuxS/AI-2 型两种信号系统,其中LuxR型占多数。当嗜水单气胞菌受到QS 调控时,细菌形成的生物膜和毒性都会增强[49]。Khajanchi 等[50]研究了鱼源腐败菌嗜水单气胞菌的LuxI/R 型QS,发现QS 的阻断并没有显著影响菌体的运动性,但导致了生物膜的缺陷。在另一项研究中则发现从生病的鱼分离出的嗜水单气胞菌长来影响生物膜的合成[51]。TCS 在嗜水单气胞中生物膜的调控机制少有研究。
嗜水单气胞菌生物膜调控的大致机制可用图4表示。
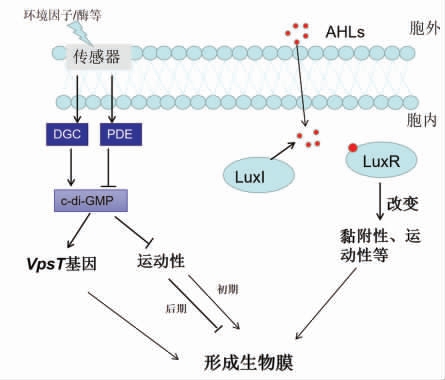
图4 嗜水气胞菌生物膜的调控机制
Fig.4 Regulation mechanism of Aeromonas hydrophila biofilm
3 控制水产品中腐败菌生物膜的新方法
在水产品加工过程中,腐败菌通常会黏附在食品加工设备的表面(如不锈钢、玻璃、塑料等)形成生物膜,不仅会对设备造成腐蚀,而且会使水产品交叉污染,造成品质损失[52]。成熟的生物膜含有多层细胞和胞外聚合物的结构,使得灭菌剂难以渗透到生物膜的内层,尤其是混合生物膜[53]。因此传统的杀菌方法可能不能满足杀菌的要求,所以有必要采取新的且有效的措施控制去除水产品加工过程有害菌的生物膜。通常可以分为物理法、化学法和生物法。
3.1 物理法
去除生物膜的传统物理方法主要有机械清除、超高压、超声波等。这些物理方法已经在铜绿假单胞菌、大肠杆菌和金黄色葡萄球菌等致病菌中有了广泛的应用[54]。低温等离子体是近几年兴起的一种抗菌方法,其主要原理是通过加热或强电磁场氏气体发生电离,产生多种活性成分(超氧化物和光子等),这些活性成分可以协同工作清除细菌的生物膜[55]。Zhou 等[56]利用大气等离子体对水下金鱼表面腐败和致病微生物的生物膜进行处理,结果表明等离子能够有效的降低鱼体表面微生物的生物膜并阻碍了新生物膜的形成。Angarano 等[57]研究了光照对水产品分离出来的荧光假单胞菌生物膜的抑制作用,结果表明紫外光和蓝光对生物膜有清除作用,绿光、黄光和红光对生物膜没有影响,印证了一些可见光可能作为抗生物膜的新策略。单一的物理法可能对细菌生物膜的清除效果欠佳,还应寻找新型的物理方法或者结合多种方法进行尝试。
3.2 化学法
新型的化学法主要是利用天然抗菌剂(植物精油、茶多酚、壳聚糖等一些动植物提取物)。Wang 等[58]研究了从养心草中提取的黄酮对海产品分离出来的腐败希瓦氏菌的抗生物膜活性,发现黄酮可破坏生物膜并导致细菌细胞的死亡。Santhakumari 等[59]利用大叶红球藻的提取物2,6-二叔丁基-4-甲基苯酚(DTBMP)对海产品弧菌科生物膜的抑制效果,结果表明DTBMP 阻碍了细菌最初黏附和生物膜的形成,并且干扰了细菌对海产品的黏附。还有研究表明苯甲酸盐和山梨酸盐对鱼源腐败菌荧光假单胞菌生物膜的抗性,同样地,对浮游细菌的效果要比已形成成熟生物膜的细菌抗菌效果显著[60]。此外,纳米级大小的苯甲酸和山梨酸有更显著的抗生物膜特性,这是因为更微小的抗菌剂颗粒更易进入生物膜与细菌直接接触[60]。
3.3 生物法
去除细菌生物膜新的生物方法有:噬菌体、乳酸菌细菌素、酶和群体感应抑制剂等。噬菌体法是一种高度特异性的方法,噬菌体能够产生解聚酶去破坏生物膜中的胞外多糖,在破坏细菌生物膜方面有着良好的研究前景,但其高度特异性在面对混合生物膜时也是一个致命的缺点。Han 等[61]发现一种新型噬菌体Spp001 对牙鲆的腐败菌腐败希瓦氏菌生物膜有显著的抑制作用。从副溶血性弧菌分离的新型噬菌体可以作为鱼体分离的副溶血性弧菌生物膜的抑制剂,但并未破坏现有的生物膜[62]。
乳酸菌细菌素和酶因其安全性广泛应用于食品行业,目前,已被用作抑制细菌生物膜的形成。Puga 等[63]使用多种商业酶对来自海鲜、肉类和乳制品中常见细菌的生物膜的抑制效果进行了研究,发现DNA 酶Ⅰ、链酶蛋白酶和果胶酶可以显著破坏双种生物膜的结构,但是经过酶处理的细菌细胞提取后仍能存活。乳杆菌的代谢产物能够有效抑制水产品分离的单核细胞增生李斯特菌生物膜的形成,能够降低菌体的运动性、胞外蛋白和胞外多糖来干扰生物膜的形成[64]。
群体感应抑制剂(QSIs)能阻断细菌间的信息交流,使QS 信号分子失活从而抑制细菌的群体感应现象。而生物膜的形成往往依赖于群体感应,因此QSIs 能够有效地抑制生物膜的形成。研究表明邻苯二甲酸甲酯可作为QSIs 抑制大菱鲆腐败菌气单胞菌属的生物膜的形成,结果表明该抑制剂可显著降低气单胞菌生物膜的形成、运动性、蛋白酶活性以及AHLs 的产生[65]。肉桂醛也可作为大菱鲆腐败菌荧光假单胞菌的QSIs,但肉桂醛没有破坏菌体的QS 信号分子AHLs,而是通过破坏菌体的LuxR 型蛋白从而破坏QS 系统[66]。白藜芦醇可通过破坏波罗的海希瓦氏菌群体感应中的二酮哌嗪类化合物DKPs 对生物膜产生抑制作用,延缓大黄鱼在冷藏过程的腐败[67]。水产品中的腐败菌大多依赖QS 形成生物膜,QSIs 则是通过破坏QS系统而抑制生物膜形成,目前,已有越来越多的研究致力于发现新型绿色的QSIs 以用作水产品的防腐剂和保鲜剂。
3.4 潜在的新方法
鉴于生物膜形成过程有高度的一致性,因此可以借鉴和尝试一些应用于抑制其它食品中的菌种生物膜的新方法,一些去除或抑制生物膜的新方法见表1。
表1 抑制其它微生物生物膜的新方法
Table 1 Novel methods of inhibiting microbial biofilm

方法 菌种 抑制方式 效果接触面的改良 牛奶中的嗜温、嗜热菌 聚四氟乙烯涂覆不锈钢板 嗜温、嗜热菌数量减少[68]金黄色葡萄球菌 甘露聚糖脂降低生物表面疏水性 生物膜和金黄色葡萄球菌遭到破坏[69]靶向c-di-GMP途径铜绿假单胞菌 通过降低DGC 来抑制c-di-GMP的产生生物膜遭到破坏,毒力因子下降[70]枯草芽孢杆菌 含EAL 结构域的蛋白质降低c-di-GMP 的水平不能形成生物膜[71]纳米技术 金黄色葡萄球菌、大肠杆菌姜黄素-聚乳酸-乙醇酸纳米粒 抗菌并抑制生物膜的形成[72]变形链球菌 芒果素纳米粒 减少生物膜的生长量[73]生物表面活性剂致病念珠菌 乳酸杆菌分离的表面活性剂 不同菌株分离的活性剂对念珠菌生物膜的抑制率在65.6%~74.4%之间[74]金黄色葡萄球菌 瑞士乳杆菌提取的表面活性剂 抗黏附、阻止金黄色葡萄球菌侵入宿主细胞、抑制生物膜形成[75]栅栏技术 金黄色葡萄球菌 含银羟基磷灰石涂层和万古霉素联合处理联合处理比单一手段处理细菌形成的生物膜薄且小[76]大肠杆菌/铜绿假单胞菌磷霉素、环丙沙星和庆大霉素联用 磷霉素/庆大霉素、庆大霉素/环丙沙星组合分别对大肠杆菌和铜绿假单胞菌生物膜的协同作用较高[77]
4 结语
水产品腐败菌生物膜广泛分布在腐败的水产品和水产品加工设备的表面,生物为腐败菌提供了保护,使得菌体的清除和消灭成为难题。为预防形成生物膜和彻底清除已经形成的生物膜,必须深入认识生物膜形成和调控机制。目前,对水产品中几种常见的腐败菌(腐败希瓦氏菌属、荧光假单胞菌和嗜水单气胞菌) 生物膜的调控机制的认识还不够深入,已经发现的调控生物膜的信号分子较少,还需要积极寻找更多的调控方式和了解诱导生物膜形成的环境因子,为控制生物膜形成提供新的思路。此外,随着蛋白质组学、基因组学和转录组学等技术的兴起,可利用这些手段更全面地揭示生物膜形成的调控机制。
目前,已有一些新的控制方法用于去除水产品腐败菌的生物膜,如噬菌体、精油和QS 抑制剂等,这些方法可能成为主流的方法。天然或合成抗菌剂的纳米粒子可能是未来研究的热点。此外,还有很多已经应用于其它菌种的新的方法可以为腐败菌生物膜的防治提供新的思路,例如在水产品加工过程中使用抗生物膜形成的改造的新型材料。此外,阻断QS 系统和减少c-di-GMP 的形成的控制方法都是从生物膜形成的调控机制出发的,从这个思路出发,可能会寻找出一些新型的抑制剂或控制方法,从根源上防止生物膜的形成。
[1]FLEMMING H C,WINGENDER J.The biofilm matrix[J].Nature Reviews Microbiology,2010,8(9):623-633.
[2]COUGHLAN L M,COTTER P D,HILL C,et al.New weapons to fight old enemies:novel strategies for the (bio)control of bacterial biofilms in the food industry [J].Frontiers in Microbiology,2016,7:1641.
[3]ANDERSON M J,SCHAAF E,BRESHERS L M,et al.Alpha-toxin contributes to biofilm formation among Staphylococcus aureus wound isolates[J].Toxins,2018,10(4):157.
[4]BERLANGA M,GUERRERO R.Living together in biofilms:the microbial cell factory and its biotechnological implications[J].Microbial Cell Factories,2016,15(1):165.
[5]ZHAO J,LI J,WANG J,et al.Applying different methods to evaluate the freshness of large yellow croacker (Pseudosciaena crocea) fillets during chilled storage[J].Journal of Agricultural and Food Chemistry,2012,60(45):11387-11394.
[6]SILBANDE A,ADENET S,SMITH J,et al.Quality assessment of ice-stored tropical yellowfin tuna(Thunnus albacares) and influence of vacuum and modified atmosphere packaging[J].Food Microbiology,2016,60:62-72.
[7]JIA S,HUANG Z,LEI Y,et al.Application of Illumina-MiSeq high throughput sequencing and culturedependent techniques for the identification of microbiota of silver carp (Hypophthalmichthys molitrix) treated by tea polyphenols[J].Food Microbiology,2018,76:52-61.
[8]PANG X,YUK H G.Effects of the colonization sequence of Listeria monocytogenes and Pseudomonas fluorescens on survival of biofilm cells under foodrelated stresses and transfer to salmon[J].Food Microbiology,2019,82:142-150.
[9]BOUGHATTAS F,FUR B L,KAROUI R.Identification and quantification of tuna species in canned tunas with sunflower medium by means of a technique based on front face fluorescence spectroscopy(FFFS)[J].Food Control,2019,101:17-23.
[10]励建荣,李婷婷,李学鹏.水产品鲜度品质评价方法研究进展[J].北京工商大学学报 (自然科学版),2010,28(6):1-8.
LI J R,LI T T,LI X P.Advances in methods for evaluating freshness of aquatic products[J].Journal of Beijing Technology and Business University,2010,28(6):1-8.
[11]赵宏强,蓝蔚青,孙晓红,等.冷藏鲈鱼片优势腐败菌的分离鉴定及致腐能力分析[J].中国食品学报,2019,19(8):208-215.
ZHAO H Q,LAN W Q,SUN X H,et al.Isolation and identification of dominant spoilage bacteria in Lateolabrax japonicus fillets during chilled storage and their spoilage capability[J].Journal of Chinese Institute of Food Science and Technology,2019,19(8):208-215.
[12]WANG X Y,XIE J.Growth kinetics and spoilage potential of co-culturing Acinetobacter johnsonii and Pseudomonas fluorescens from bigeye tuna (Thunnus obesus) During Refrigerated Storage[J].Current Microbiology,2020,7(8):1637-1646.
[13]WANG Y Y,HONG X L,LIU J C,et al.Interactions between fish isolates Pseudomonas fluorescens and Staphylococcus aureus in dual-species biofilms and sensitivity to carvacrol[J].Food Microbiology,2020,91:103506.
[14]DESMOND P,BEST J P,MORGENROTH E,et al.Linking composition of extracellular polymeric substances (EPS) to the physical structure and hydraulic resistance of membrane biofilms[J].Water Research,2018,132:211-221.
[15]STERNISA,KLANCNIK A,MOZINA S S.Spoilage pseudomonas biofilm with Escherichia coli protection in fish meat at 5 degrees C[J].Journal of the Science of Food and Agriculture,2019,99(10):4635-4641.
[16]GODEKE J,PAUL K,LASSAK J,et al.Phageinduced lysis enhances biofilm formation in Shewanella oneidensis MR-1[J].Isme Journal,2011,5(4):613-626.
[17]LI J P,YU H L,YANG X Y,et al.Complete genome sequence provides insights into the quorum sensing-related spoilage potential of Shewanella baltica 128 isolated from spoiled shrimp [J].Genomics,2020,112(1):736-748.
[18]ZHANG C,ZHU F,JATT A N,et al.Characterization of co-culture of Aeromonasand Pseudomonas bacterial biofilm and spoilage potential on refrigerated grass carp (Ctenopharyngodon idellus)[J].Letters in Applied Microbiology,2020,71(4):337-344.
[19]JAHID I K,MIZAN M F R,MYOUNG J,et al.Aeromonas hydrophila biofilm,exoprotease,and quorum sensing responses to co-cultivation with diverse foodborne pathogens and food spoilage bacteria on crab surfaces [J].Biofouling,2018,34 (10):1079-1092.
[20]BOYD C D,SMITH T J,El-KIRAT-CHATEL S,et al.Structural features of the Pseudomonas fluorescens biofilm adhesin LapA required for LapG-dependent cleavage,biofilm formation,and cell surface localization[J].Journal of Bacteriology,2014,196(15):2775-2788.
[21]El-KIRAT-CHATEL S,BEAUSSART A,BOYD C D,et al.Single-cell and single-molecule analysis deciphers the localization,adhesion,and mechanics of the biofilm adhesin LapA[J].ACS Chemical Biology,2014,9(2):485-494.
[22]ZHAO K,TAENG B S,BECKERMAN B,et al.Psl trails guide exploration and microcolony formation in Pseudomonas aeruginosa biofilms[J].Nature,2013,497(7449):388-391.
[23]DENG Q,PU Y H,SUN L J,et al.Antimicrobial peptide AMPNT-6 from Bacillus subtilis inhibits biofilm formation by Shewanella putrefaciens and disrupts its preformed biofilms on both abiotic and shrimp shell surfaces[J].Food Research International,2017,102:8-13.
[24]QIN Y X,YAN Q P,MAO X X,et al.Role of MshQ in MSHA pili biosynthesis and biofilm formation of Aeromonas hydrophila[J].Genetics and Molecular Research,2014,13(4):8982-8996.
[25]GJERMANSEN M,NILSSON M,YANG L,et al.Characterization of starvation-induced dispersion in Pseudomonas putida biofilms:genetic elements and molecular mechanisms[J].Molecular Microbiology,2010,75(4):815-826.
[26]YAN J,XIE J.Comparative Proteome Analysis of Shewanella putrefaciens WS13 mature biofilm under cold stress[J].Frontiers in Microbiology,2020,11:1225.
[27]KASAI T,TOMIOKA Y,KOUZUMA A,et al.Overexpression of the adenylate cyclase gene cyaC facilitates current generation by Shewanella oneidensis in bioelectrochemical systems[J].Bioelectrochemistry,2019,129:100-105.
[28]WANG F F,WANG Y Z,CEN C N,et al.A tandem GGDEF-EAL domain protein-regulated c-di-GMP signal contributes to spoilage-related activities of Shewanella baltica OS155[J].Applied Microbiology and Biotechnology,2020,104(5):2205-2216.
[29]DAHLSTROM K M,O'TOOLE G A.A symphony of cyclases:specificity in diguanylate cyclase signaling[J].Annual Review of Microbiology,2017,71:179-195.
[30]WU C,CHENG Y Y,YIN H,et al.Oxygen promotes biofilm formation of Shewanella putrefaciens CN32 through a diguanylate cyclase and an adhesin[J].Scientific Reports,2013,3:1945.
[31]GAO T,SHI M,GAO H.Partially reciprocal replacement of FlrA and FlrC in regulation of Shewanella oneidensis flagellar biosynthesis[J].Journal of Bacteriology,2018,200(7):e00796-17.
[32]KAI P,SILPE J E,SCHRAMMA K R,et al.A Vibrio cholerae autoinducer-receptor pair that controls biofilm formation[J].Nature Chemical Biology,2017,13(5):551-557.
[33]ZHAO A F,ZHU J L,YE X F,et al.Inhibition of biofilm development and spoilage potential of Shewanella baltica by quorum sensing signal in cellfree supernatant from Pseudomonas fluorescens[J].International Journal of Food Microbiology,2016,230:73-80.
[34]JIE J,YU H,HAN Y,et al.Acyl-homoserinelactones receptor LuxR of Shewanella baltica involved in the development of microbiota and spoilage of refrigerated shrimp[J].Journal of Food Science and Technology-Mysore,2018,55(7):2795-2800.
[35]WANG Y,WANG F,WANG C,et al.Positive regulation of spoilage potential and biofilm formation in Shewanella baltica OS155 via quorum sensing system composed of DKP and orphan LuxRs [J].Frontiers in Microbiology,2019,10:135.
[36]ZHU S,WU H,ZENG M,et al.Regulation of spoilage-related activities of Shewanella putrefaciens and Shewanella baltica by an autoinducer-2 analogue,(Z)-5-(bromomethylene)furan-2(5H)-One[J].Journal of Food Processing and Preservation,2015,39(6):719-728.
[37]张笑笑.大黄鱼腐败希瓦氏菌群体感应信号分子AHLs 对其致腐性的影响及机制研究[D].杭州:浙江工商大学,2017:47-48.
ZHANG X X.The effect and mechanism of antoinducer AHLs in regulating spoilage ability of Shewanella baltica isolated from large yellow croaker[D].Hangzhou:Zhejiang Gongshang University,2017:47-48.
[38]ZHU J L,HUANG X Z,ZHANG F,et al.Inhibition of quorum sensing,biofilm,and spoilage potential in Shewanella baltica by green tea polyphenols[J].Journal of Microbiology,2015,53 (12):829-836.
[39]PANG X Y,YUK H G.Effects of the colonization sequence of Listeria monocytogenes and Pseudomonas fluorescens on survival of biofilm cells under foodrelated stresses and transfer to salmon[J].Food Microbiology,2019,82:142-150.
[40]MCDONALD M J,GEHRIG S M,MEINTJES P L,et al.Adaptive divergence in experimental populations of Pseudomonas fluorescens.IV.Genetic constraints guide evolutionary trajectories in a parallel adaptive radiation[J].Genetics,2009,183(3):1041-1053.
[41]唐蓉.鱼源致腐菌荧光假单胞菌群体感应LuxⅠ/LuxR 鉴定及生理功能研究[D].杭州:浙江工商大学,2019.
TANG R.Identification of quorum sensing system Lux Ⅰ/LuxR and its physiological function in fish spoiler Pseudomonas fluorescens[D].Hangzhou:Zhejiang Gongshang University,2019.
[42]LIU X X,JI L,WANG X,et al.Role of RpoS in stress resistance,quorum sensing and spoilage po tential of Pseudomonas fluorescens[J].International Journal of Food Microbiology,2018,270:31-38.
[43]毕伟伟.RpoS/RpoN 蛋白对两种鱼源致腐菌调控作用探究[D].杭州:浙江工商大学,2020.
BI W W.Regulation of RpoS/RpoN protein in Sheanella and Pseudomons isolated from the fish[D].Hangzhou:Zhejiang Gongshang University,2020.
[44]ZHU J,YAN Y.WANG Y,et al.Competitive interaction on dual-species biofilm formation by spoilage bacteria,Shewanella baltica and Pseudomonas fluorescens[J].Journal of Applied Microbiology,2019,126(4):1175-1186.
[45]CHENG X,DEBRUIJN I,VANDERVOORT M,et al.The Gac regulon of Pseudomonas fluorescens SBW25 [J].Environmental Miccrobiology Reports,2013,5(4):608-619.
[46]BARAHONA E,NAVAZO A,YOUSEF-CORONADO F,et al.Efficient rhizosphere colonization by Pseudomonas fluorescens f113 mutants unable to form biofilms on abiotic surfaces[J].Environmental Miccrobiology,2010,12(12):3185-3195.
[47]MARTINEZ F,NAVAZO A,BARAHONA E,et al.The gac-rsm and sadB signal transduction pathways converge on algU to downregulate motility in Pseudomonas fluorescens[J].Plos One,2012,7(2):e31765.
[48]JAHID I K,MIZAN M F R,HA A J,et al.Effect of salinity and incubation time of planktonic cells on biofilm formation,motility,exoprotease production,and quorum sensing of Aeromonas hydrophila[J].Food Microbiology,2015,49:142-151.
[49]JIN L,ZHANG X,SHI H,et al.Identification of a novel N-acyl homoserine lactone synthase,ahyI,in Aeromonas hydrophila and structural basis for its substrate specificity[J].Journal of Agricultural and Food Chemistry,2020,38(8):2516-2527.
[50]KHAJANCHI B,SHA J,KOZLOVA E V,et al.N-acylhomoserine lactones involved in quorum sensing control the type VI secretion system,biofilm formation,protease production,and in vivo virulence in a clinical isolate of Aeromonas hydrophila[J].MicrobiologyI-Sgm,2009,155:3518-3531.
[51]MAO L L,QIN Y X,KANG J P,et al.Role of LuxR-type regulators in fish pathogenic Aeromonas hydrophila[J].Journal of Fish Diseaes,2019,43(2):215-225.
[52]ZHU S Q,WU H H,ZENG M Y,et al.The involvement of bacterial quorum sensing in the spoilage of refrigerated Litopenaeus vannamei[J].International Journal of Food Microbiology,2015,192:26-33.
[53]TOUSHIK S,MIZAN M,HOSSAIN M,et al.Fighting with old foes:The pledge of microbe-derived biological agents to defeat mono-and mixedbacterial biofilms concerning food industries [J].Trends in Food Science & Technology,2020,99:413-425.
[54]PANG X,WONG C,CHUNG H,et al.Biofilm formation of Listeria monocytogenes and its resistance to quaternary ammonium compounds in a simulated salmon processing environment[J].Food Control,2019,98:200-208.
[55]JIAO Y,TAY F,NIU L,et al.Advancing antimicrobial strategies for managing oral biofilm infections[J].International Journal of Oral Science,2019,11(3):28.
[56]ZHOU R W,ZHOU R S,WANG P Y,et al.Microplasma bubbles:Reactive vehicles for biofilm dispersal[J].ACS Applied Material A & Interfaces,2019,11(23):20660-20669.
[57]ANGARANO V,SMET C,AKKERMANS S,et al.Visible light as an antimicrobial strategy for inactivation of Pseudomonas fluorescens and Staphylococcus epidermidis biofilms[J].Antibiotics-Basel,2020,9(4):171.
[58]WANG J,CHI Z,ZHAO K,et al.A transcriptome analysis of the antibacterial mechanism of flavonoids from Sedum aizoon L.against Shewanella putrefaciens [J].World Journal of Microbiology & Biotech nology,2020,36(7):94.
[59]SANTHAKUMARI S,JAYAKUMAR R,LOGALAKSHMI R,et al.In vitro and in vivo effect of 2,6-Di-tert-butyl-4-methylphenol as an antibiofilm agent against quorum sensing mediated biofilm formation of Vibrio spp.[J].International Journal of Food Microbiology,2018,281:60-71.
[60]SULLIVAN D J,AZLIN-HASIM S,CRUZ-ROMER M,et al.Antimicrobial effect of benzoic and sorbic acid salts and nano-solubilisates against Staphylococcus aureus,Pseudomonas fluorescens and chicken microbiota biofilms[J].Food Control,2020,107.
[61]HAN F,LI M,LIN H,et al.The novel Shewanella putrefaciens-infecting bacteriophage Spp001 :genome sequence and lytic enzymes[J].Journal of Industrial Microbiology & Biotechnology,2014,41(6):1017-1026.
[62]YIN Y J,NI P,LIU D L,et al.Bacteriophage potential against Vibrio parahaemolyticus biofilms[J].Food Control,2019,98:156-163.
[63]PUGA C,RODRIGUEZ-LOPEZ P,CABO M,et al.Enzymatic dispersal of dual-species biofilms carrying Listeria monocytogenes and other associated food industry bacteria[J].Food Control,2018,94:222-228.
[64]王佳琪.Lactobacillus plantarum Y42 所产蛋白抑制Listeria monocytogenes 生物膜形成的研究[D].大连:大连工业大学,2019.
WANG J Q.Study on inhibition of the protein produced by Lactobacillus plantarum Y42 against biofilm formation of Listeria monocytogenes [D].Dalian:Dalian Polytechnic University,2019.
[65]LI T T,SUN X J,CHEN H T,et al.Methyl anthranilate:A novel quorum sensing inhibitor and anti-biofilm agent against Aeromonas sobria[J].Food Microbiology,2020,86:103356.
[66]LI T,WANG D,LIU N,et al.Inhibition of quorum sensing-controlled virulence factors and biofilm formation in Pseudomonas fluorescens by cinnamaldehyde[J].International Journa of Food Microbiology,2018,269:98-106.
[67]ZHU J,ZHANG Y,DENG J,et al.Diketopiperazines synthesis gene in Shewanella baltica and roles of diketopiperazines and resveratrol in quorum sensing[J].Journal of Agricultural and Food Chemistry,2019,67(43):12013-12025.
[68]JINDAL S,ANAND S,METZGER L A,et al.Short communication:A comparison of biofilm development on stainless steel and modified-surface plate heat exchangers during a 17-h milk pasteurization run[J].Journal of Dairy Science,2018,101(4):2921-2926.
[69]SHU Q,WEI T,LU H,et al.Mannosylerythritol lipids:dual inhibitory modes against Staphylococcus aureus through membrane-mediated apoptosis and biofilm disruption[J].Applied Microbiology and Biotechnology,2020,104(11):5053-5064.
[70]KIM B,PARK J,CHOI H,et al.Terrein is an inhibitor of quorum sensing and c-di-GMP in Pseudomonas aeruginosa:a connection between quorum sensing and c-di-GMP[J].Scientific Reports,2018,8:8617.
[71]ORR M,WEISS C,SEVERIN G,et al.A subset of exoribonucleases serve as degradative enzymes for pGpG in c-di-GMP signaling[J].Journal of Bacteriology,2018,200(24):e00300.
[72]KUMARI A,GULIANI A,SHUKLA A,et al.Green surfactant based synthesis of curcumin loaded poly lactic-co-glycolic acid nanoparticles with enhanced solubility,photo-stability and anti-biofilm activity[J].Journal of Drug Delivery Science and Technology,2020,59:101884.
[73]NGUYEN P,NGUYEN M,QUACH L,et al.Antibiofilm activity of alpha-mangostin loaded nanopar ticles against Streptococcus mutans[J].Asian Pacific Journal of Tropical Biomedicine,2020,10 (7):325-332.
[74]NELSON J,EL-GENDY A,MANSY M,et al.The biosurfactants iturin,lichenysin and surfactin,from vaginally isolated lactobacilli,prevent biofilm formation by pathogenic Candida[J].FEMS Microbiology Letters,2020,367:15.
[75]JIANG X,YAN X,GU S,et al.Biosurfactants of Lactobacillus helveticus for biodiversity inhibit the biofilm formation of Staphylococcus aureus and cell invasion[J].Future Microbiology,2019,14 (13):1133-1146.
[76]HASHIMOTO A,MIYAMOTO H,KOBATAKE T,et al.The combination of silver-containing hydroxyapatite coating and vancomycin has a synergistic antibacterial effect on methicillin-resistant Staphylococcus aureus biofilm formation[J].Bone & Joint Research,2020,9(5):211-218.
[77]WANG L,DI L,TKHILAISHVILI T,et al.Synergistic activity of fosfomycin,ciprofloxacin,and gentamicin against Escherichia coli and Pseudomonas aeruginosa biofilms [J].Frontiers in Microbiology,2019,10:2522.