溃疡性结肠炎(ulcerative colitis,UC)是一种局限于结肠、直肠黏膜以及黏膜下层的炎症性肠道疾病,病程时间跨度长、易反复发作,多见于青壮年群体,被世界卫生组织认定为当代难治疾病之一[1]。由于饮食习惯等方面的因素,UC 在北美和欧洲的发病率较高,约为15/100 000 至20/100 000。随着我国国际化程度的不断提高,我国居民传统的饮食生活习惯受到巨大冲击,UC 在我国的发病率持续走高,2017年的数据显示,我国UC 的发病率约10/100 000[2-3]。目前,用于控制UC的药物主要有抗生素、免疫抑制剂、糖皮质激素等,这些药物虽然可以缓解UC 患者的临床症状,但是这些药物存在副作用大、复发率高、价格昂贵等问题。开发安全且行之有效的替代品成为当下的研究热点。
n-3 多不饱和脂肪酸(n-3 polyunstatured fatty acids,n-3PUFAs)是存在于生物体内的天然物质,具有多种生物活性,深受人们的青睐。有研究证实:高n-3PUFAs 饮食结构的人群患UC 的风险明显低于n-3PUFAs 摄取不足的人群,此外,提高患者膳食中n-3PUFAs 的比重亦可以有效缓解患者的临床症状,这表明n-3PUFAs 对UC 的发生和发展具有抑制作用[4-7]。n-3PUFAs 在替代传统UC治疗药物方面很有潜力。关于其作用机制,目前的研究主要体现在调节炎症反应,影响氧化应激,调节免疫反应和调节肠道菌群等几个方面。本文就n-3PUFAs 干预UC 作用机制的研究进展作一综述,以丰富n-3PUFAs 的药理功能,为n-3PUFAs用于UC 的管控提供参考。
1 n-3PUFAs 对炎症反应的调节作用
炎症,即人们平时所说的“发炎”,是生物组织在受到外伤、感染等刺激所发生的一种防御型的基础生理过程。炎症的局部表现为红、肿、热、痛和功能障碍,有时也会伴有发热、白细胞数目改变等全身性反应。通常情况下,适度的炎症反应对人体是有益的,是人体免疫系统自动防御的表现,但是当防御过度时,炎症就会对人体产生难以修复的损伤,严重可导致细胞因子风暴、全身性炎症反应综合征等。UC 就是炎症反应在结肠组织中持续发展,最终导致了恶性的病变。研究表明,n-3PUFAs可以通过一些代谢路径生成一系列的特殊介质,这些介质可以通过促进巨噬细胞对中性粒细胞的吞噬,发挥抗炎作用[8-11]。付元庆[12]以LPS 诱导的RAW264.7 细胞为炎症的体外模型,采用富含n-3PUFAs 的脂质提取物对模型进行干预,结果表明该脂质提取物可以促进细胞中抗炎因子的分泌并抑制促炎因子的分泌,发挥了较好的抗炎作用,机制的研究表明该提取物的抗炎作用是通过调整TLR4/NF-κB 信号通路中关键信号分子的传导来实现的。Wang 等[13]以葡聚糖硫酸钠盐(dextran sulpahte sodium,DSS) 诱导的C57/BL6 小鼠为UC 模型,采用富含EPA 和DHA 的海洋脂质提取物对模型小鼠进行干预,并以柳氮磺胺吡啶作为对照,评价了提取物的抗炎效果,结果表明该提取物与柳氮磺胺吡啶都可以显著地抑制模型小鼠体内炎症的发展,并且该提取物在抑制促炎因子分泌方面发挥了更好的作用。Augimeri 等[14]以LPS诱导的THP-1 巨噬细胞为模型,评价了EPA 的抗炎功效。结果表明EPA 可以显著下调促炎介质MCP-1、IL-6 和IL-1β 的表达,发挥了较强的抗炎功效。这些研究都是n-3PUFAs 具备抗炎功效的有力证据。关于n-3PUFAs 抗炎作用的潜在机制,目前主要体现在调节类花生酸代谢、提供抗炎脂类的初始物、改变脂筏途径等方面。
1.1 调节类花生酸代谢
类花生酸是花生四烯酸氧化产生的一大类具有生物活性的物质,主要包括前列腺素类、凝血噁烷类和白细胞三烯类等。类花生酸在正常人体中的含量是处在一个动态平衡的状态,保持在一个较低的水平。当受到外界刺激,发生炎症反应时,细胞的状态发生变化,类花生酸的前体物质-花生四烯酸会在酶的作用下从膜磷脂中脱落,变成易发生氧化反应的游离状态,游离的花生四烯酸在环氧合酶(COX)和脂氧合酶(LOX)的作用下,生成二十碳的类花生酸物质,这些物质主要包括前列腺素类(PGD2、PGE2、PGF2、PGF2α、PGJ2)、前列腺环素 (PGI2)、血栓素 (TXA2) 和白细胞三烯类(LTC4、LTB4、LTD4、LTE4)[15]。这些花生四烯酸的衍生物在炎症反应中发挥了“推波助澜”的作用,如:白细胞三烯C4、D4 和E4 可以加剧血管的收缩,同时改变血管壁的特性,使其通透性增加,严重时甚至会导致支气管的痉挛,前列腺素E2 可以触发中性粒细胞的趋化反应,激活白细胞的免疫功能,前列腺素F2 和前列腺素F2α 可诱发水肿等。n-3PUFAs 的化学结构和代谢途径与花生四烯酸类似,它们都可以与COX 和LOX 发生反应,这样一来,就减少了花生四烯酸来源衍生物的产量,此外,n-3PUFAs 与COX 和LOX 结合生成的物质的致炎能力也大不如花生四烯酸源的衍生物。例如,EPA 与COX 和5-LOX 结合最终生成了TXA3、LTB5 和PGI3 等物质,这些源自EPA 的衍生物的促炎能力远不及类花生酸,如LTB5 的中性粒细胞趋化活性仅为LTB4 的1/100,PGE3 促进COX-2基因表达及IL-6 生成的能力远低于PGE2[16]。
1.2 提供抗炎脂类的初始物
研究表明,n-3PUFAs 在代谢过程中可以产生消退素、保护素等特殊的消退介质(specialized pro-resolution mediators,SPMs),这些介质可以通过促进单核巨噬细胞对凋亡细胞的清除,抑制中性粒细胞的转移以及促炎因子的过量分泌等而发挥抗炎功效[8]。不同n-3PUFAs 的代谢产生SPMs 的途径如图1和图2所示。研究证实这些SPMs 在炎症消退及组织修复过程中发挥了重要的作用。Arita 等[18]以大鼠为实验动物,采用DSS对其进行结肠炎的诱导,并采用源自于EPA 的消退素E1 对其进行干预,以动物的存活率、体重变化、结肠切片的病理评分、炎症因子变化及一氧化氮合成酶基因的表达为指标,研究了消退素E1 的干预效果,结果表明,消退素E1 可以显著改善大鼠的结肠炎症状,抑制其发生恶变。Victor 等[19]以中风小鼠为模型,研究了消退素D1 对模型体内炎症的干预效果,结果表明消退素D1 可以显著抑制TNF-α 和IL-1β 转录,限制中性粒细胞在体内的蔓延。Janakiram 等[20]查阅并总结了大量的关于这些介质干预结肠癌和胰腺癌的研究成果,指出消退素和保护素可以通过调节上皮细胞和β 细胞的免疫状态,有效地化解炎症的触发物质,抑制由慢性炎症向癌症的转变。

图1 EPA 和DHA 源SPMs 的合成途径[17]
Fig.1 The pathway outline of SPMs from EPA and DHA[17]
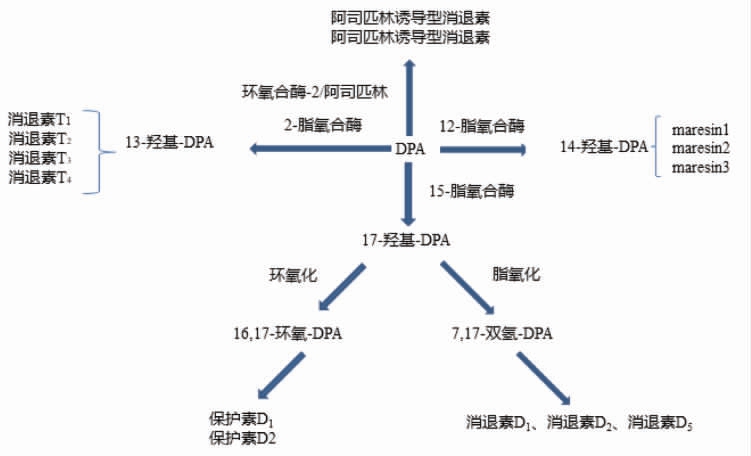
图2 DPA 源SPMs 的合成[17]
Fig.2 The pathway outline of SPMs from DPA[17]
1.3 改变脂筏途径
液态镶嵌模型理论认为生物膜的分子结构是以液态的类脂双分子层为基架,其中镶嵌着多种具有不同生理功能的球状蛋白质。该学说认为生物膜是一个均一的二维液相,脂质均匀地分布在膜上。然而脂筏的发现对这一学说带来了冲击。脂筏是质膜上富含胆固醇和鞘磷脂的微结构域,大小在70 μm 左右,是一种动态结构,这些结构随机分布于质膜的外小页上。脂筏结构像蛋白质动态停泊一个的平台,与膜的信号转导、蛋白分拣密切相关。有研究表明n-3PUFAs 可以调控脂筏结构中炎症因子与其蛋白受体的结合,阻断炎症信号的转导,抑制炎症反应。Li 等[21]的研究表明n-3PUFAs 能使脂筏中部分炎症因子受体发生位移,从而阻断炎症的级联反应,此外,n-3PUFAs 还可以调节脂筏中信号因子的转导,切断促炎信号通路,抑制炎症的发展。另有研究证实,n-3PUFAs 可以通过影响存在于脂筏中的T 细胞受体蛋白从而抑制T 细胞增殖分化,减轻T 细胞介导的炎症反应[22]。
2 调节氧化应激反应
氧化应激是指机体在遭受各种有害刺激时,体内产生了过多的具有高度活跃功能的分子如活性氧和活性氮,这些高活物质的产量如果突破了机体对他们清除的极限,机体内的氧化还原系统不能够及时回复到静息状态,长此以往,导致组织损伤的一种现象。氧化应激的过程中会产生许多氧化分子如自由基和活性氧 (reactive oxygen species,ROS),与多种疾病和人体的衰老关系密切。自由基通常带有未配对的电子,这使得它们非常不稳定,具有高度化学活性。为了变得更加稳定,自由基会破坏DNA、蛋白质和脂质,导致组织损伤[23-26]。
研究表明,肠道炎症与过量的ROS 及其诱发的氧化应激和细胞氧化还原状态的变化密切相关。消化系统作为人体的一个重要组成,其实是“暴露”在体外的,尤其是在人们进食、消化、吸收的过程中,形式多样的食物由口腔咀嚼送入胃中,在胃中经过多重消化后送至肠道,由肠道吸收并将养分送入循环系统。食物经过胃的多重消化后,往往会携带大量的ROS,肠道在吸收营养物质的同时,处在高浓度的ROS 环境中,使肠道内发生氧化应激损伤的概率大幅提升[27-28]。活性氧主要包括超氧阴离子(O2·-)、过氧化氢(H2O2)、羟基自由基(OH·)等,其中H2O2 在机体内的浓度要远远高于O2·-和OH·,因此,一般来说,如果不特别声明,ROS 就是指过氧化氢。活性氧在体内的产生场所是线粒体,机体内部90%的氧是在线粒体中被利用的,在此过程中2%的氧会在线粒体内膜和基质中被转化成为活性氧,也就是说机体在正常的代谢状况下,也会产生部分ROS。适量的活性氧对人体具有积极作用,比如,机体内吞噬细胞在细胞膜受到刺激时,通过呼吸暴发机制,可以产生ROS,此时ROS 是吞噬细胞发挥吞噬和杀伤作用的主要介质。但病理条件下,由于ROS 产生和清除的原有平衡被打破,常常会造成ROS 对人体的损伤。在疾病过程中,部分以结合状态存在于蛋白质中的金属离子会在某些酶的作用下从母体中游离,产生游离的金属离子,这些游离的金属离子能够和过氧化氢结合,发生芬顿反应,产生大量的OH·,OH·是自然界中氧化作用最强的物质之一,在生物体系中的半衰期为1 ns,一旦产生,就会和蛋白质、核酸和脂类物质结合造成损伤,当这一过程发生在肠道中时,会引发肠道黏膜损伤,久而久之,就会形成UC(图3)。
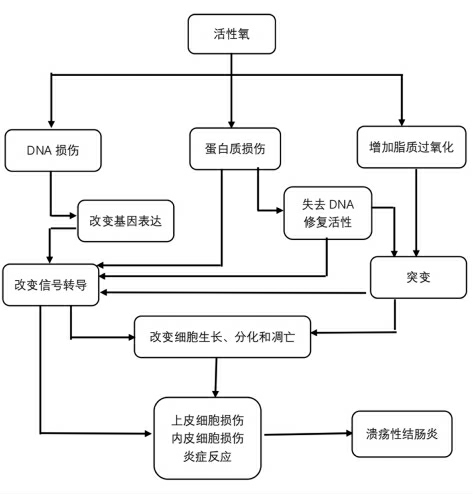
图3 氧化应激在UC 中的病理生理影响
Fig.3 Pathophysiological effects of oxidative stress in UC
n-3PUFAs 的结构中含有多个不饱和键,这样的结构决定了其具有强的抗氧化能力。司天雷[29]以氧化应激损伤的小鼠为动物模型,以小鼠血清、肝脏和脾脏中NADH 氧化酶(NOX)活力和肝脏中的还原性谷胱甘肽(GSH)含量为指标,研究了DHA 对小鼠体内氧化应激反应的调节作用,结果表明,DHA 可以显著降低小鼠体内NOX 的活力,促进GSH 的分泌,抑制氧化应激反应。Chen 等[30]以D-半乳糖为诱导剂构建了氧化应激损伤的小鼠模型,采用n-3PUFAs 脂质混合物对模型小鼠进行干预。结果表明,该脂质混合物可显著提高小鼠肝脏 (5%~50%)、心脏 (20%~60%) 和大脑(30%) 中的超氧化物歧化酶的活力。此外,n-3PUFAs 还可以降低血浆中PGF2 的含量,提高肝脏和血清中过氧化氢酶和谷胱甘肽过氧化物酶的活力,进而对小鼠体内的氧化应激损伤进行修复。Dasilva 等[31]以氧化损伤的大鼠为对象,以氧化自由基吸收能力、超氧化物歧化酶、谷胱甘肽氧化酶和过氧化氢酶酶活为指标,研究了不同比例EPA和DHA 对大鼠体内氧化应激损伤的影响,结果表明,EPA 和DHA 均可以有效抑制大鼠体内的氧化应激反应,且当EPA 与DHA 的比例为1∶1 或2∶1时,展现出的调节效果较好。
3 对免疫系统的调节作用
免疫系统是机体抵御外来侵犯的最为重要的保卫系统。这个系统是执行人体保卫的最后一道防线,它能发现并平复异物、外来病原体等引起的内环境波动,对人体正常的功能至关重要,然而,其功能亢进也会对自身器官或组织产生伤害。肠道作为食物消化和营养吸收的重要场所,直接面对着来自食物、药物中异物的各种刺激,这样的特性使肠道成为人体最大的免疫器官,承担了约80%的免疫任务。当人体摄取营养物质的同时,也面临着外界异物的侵袭,面对这些外界异物的侵袭,人体会激发肠道免疫系统对这些异物进行监控和清除,从而保障人体的正常功能。肠道免疫系统分为肠道先天免疫和肠道适应性免疫。肠道先天免疫是机体在长期进化中形成的、与生俱来的抵抗病原微生物入侵和清除病原微生物的能力,是保卫人体的重要防线,同时也是启动适应性免疫的基础,由免疫细胞和免疫分子组成。肠道适应性免疫是指肠道在抵御以往刺激的过程中针对某些特定的异物而形成的抵御感染的能力,能与相对应抗原发生特异性免疫反应。研究表明UC 患者通常会伴随肠道免疫系统的异常。Takayama 等[32]以炎症性肠炎的病人为研究对象,探究了肠炎对肠道免疫系统的影响,结果表明,肠炎病人的免疫功能出现了较大的紊乱,具体表现为肠道黏膜固有层中自然杀伤细胞平衡失调。Ermann 等[33]以Tbet-/-.Rag2-/-(TRUC)小鼠为UC 模型,研究了慢性肠炎的免疫驱动机制。结果表明,免疫信号通路Nod/Ripk2 的阻断可以减少小鼠发生肠炎的概率,并且由IL-17A 诱导的淋巴细胞在肠炎的发生机制中发挥了重要的作用。此外,研究证实辅助性T淋巴细胞可以产生诸多细胞因子,这些细胞因子通过参与免疫反应,参与到UC 的诱发过程[34-35]。
n-3PUFAs 具有调节免疫活性的功能,它们能提高细胞免疫应答的阈值,增强自身免疫疾病动物模型抵抗内毒素的能力和延长移植器官的存活时间,长期服用n-3PUFAs 的人群免疫性疾病的发生率大大低于其他人群,原因是n-3PUFAs 可以有效抑制T 细胞的自身激活或过度激活,降低自体免疫性疾病的患病率。Ergas 等[36]总结前人的研究成果,指出n-3PUFAs 可以有效控制人体内免疫系统的变态反应,对于由免疫失调引起的疾病有明显的预防作用。贺敏等[37]采用皮下注射氢化可的松的方法建立免疫紊乱的小鼠模型,之后,采用高纯度的EPA/DHA 甘油酯对其进行干预,研究了n-3PUFAs 的免疫调节作用。结果表明,n-3PUFAs 可显著改善模型小鼠的血清溶血素水平及抗体生成细胞数,提高迟发性变态反应水平和脾淋巴细胞转化能力,促进腹腔巨噬细胞的吞噬能力和碳廓清能力,提高IFN-γ/IL-4 比值,改善小鼠免疫系统的紊乱。
4 对肠道菌群的调节作用
人体是宿主和微生物共同组成的超级生物体,人体体表和体腔中的菌群种类高达500 多种,数量达到约100 万亿个,肠道菌群具有促进食物的消化吸收,给机体提供能量,调节人体内环境等作用,在维持人体正常功能方面发挥了重要的作用。正常情况下,肠道内菌群间维持着共生或拮抗的关系,这是肠道菌群能够处于微生态均衡的主要原因。当人体处于健康状态时,肠道中拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)处于优势地位,占菌群数量的90%以上,其中包括拟杆菌属(Bacteroides)、梭状芽孢杆菌属(Clostridium)、普氏菌属(Prevotella)、真杆菌属(Eubacterium)、瘤胃球菌属(Ruminiclostridium)和乳酸杆菌属(Lactobacillus)等。而当菌群的平衡被打破后,一些病原菌就会大量繁殖,与其它菌群争夺生存空间,并分泌大量肠毒素,最终导致许多疾病的发生[38-40]。
近年来,随着人们对肠道微生物研究的不断深入,越来越多的证据显示,UC 的发生通常伴有肠道微生物种类及代谢产物的异常,这为UC 的靶向干预提供了可能。虽然当前尚未确定导致UC发病的特异性菌属或明确其影响机制,但肠道菌群失衡在UC 发病中起到的重要作用已获得学者们的广泛认同[41]。目前的研究认为,肠道细菌可能通过以下一种或多种途径或机制来参与UC。①损伤肠黏膜屏障:当肠道内致病菌增多,使肠黏膜通透性增高,直接侵袭、损伤肠上皮细胞,黏膜免疫失调,损伤或破坏肠黏膜屏障;②破坏肠道免疫平衡:致病菌可分泌免疫抑制性蛋白,致黏膜免疫失调或失衡;③导致能量代谢异常:肠道细菌的数量、种类和功能发生变化时,可改变肠上皮细胞的能量代谢,导致上皮细胞损伤,从而诱发肠道炎症反应[42-43]。有研究者通过对UC 患者的活检样本、粪便样本进行16S rDNA 检测和代谢通路的分析,发现仅2%的肠道菌群属的改变,却造成了12%的代谢通路的变化,指出肠道微生态的改变对UC 发病具有重要作用[3]。另有一项研究通过对比UC 患者与健康人的肠道菌群,发现UC 患者肠道菌群中梭状芽孢杆菌属、乳酸杆菌属、双歧杆菌属(Bifidobacterium)、拟杆菌属(Bacteroides)的比例显著下降,而肠球菌属(Enterococcus)、埃希菌属(Esherichia)的比例显著升高,这进一步说明了肠道菌群失衡对UC 发病的显著影响[44]。n-3PUFAs 可以被肠道菌群利用,产生特殊的代谢物质,这些代谢产物可以调节肠道菌群的种类及分泌物。Li 等[45]采用富含n-3PUFAs 的脂质提取物对高脂大鼠进行干预,发现该提取物可以显著降低大鼠的血脂水平,进一步的研究表明,这种下调作用与肠道中有益菌如普氏菌属、紫单胞菌(Porphyromonas)、巴恩斯氏菌(Barnesiella)等的增加和有害菌如Turicibacter、罗姆布茨菌(Romboutsia)、Phascolarctterium、欧陆森氏菌属(Olsenella)、梭状芽孢杆菌属的减少密切相关。诺丁汉大学Menni等[46]对876 名女性志愿者血清中n-3PUFAs 的水平、肠道菌群的多样性及丰度进行检测,发现n-3PUFAs 的摄入量与肠道益生菌的多样性和丰度关联密切,且n-3PUFAs 摄入量高的人群中肠道疾病的发病率远低于n-3PUFAs 摄入不足的人群。Miyamoto 等[47]的研究表明,n-3PUFAs 在肠道中可以被某些细菌利用,产生了积极的代谢产物,这些代谢产物具有抗炎、清除有害菌的作用,反过来又会影响肠道菌群的结构,抵消肠道菌群的紊乱。
5 结语
综上所述,研究证据表明n-3PUFAs 在UC 的预防和治疗中发挥着积极的作用,将n-3PUFAs应用于UC 的管控是一种有效且可行的方案。然而,现有的研究仍不能完全解释n-3PUFAs 干预UC 的作用机制,并且多数研究结果是基于短期试验的数据所得,缺少建立在长期干预基础上的安全性和有效性的评估。因此,要明确n-3PUFAs 干预UC 作用机制,还需要大规模中心临床及对照试验进一步验证。
[1]崔畅婉,孙峥嵘.溃疡性结肠炎发病机制研究进展[J].现代免疫学,2019,39(1):77-81.
CUI C W,SUN Z R.Research Progress on pathogenesis of ulcerative colitis[J].Current Immunology,2019,39(1):77-81.
[2]ROCCO S,VINCENZO D,LUCIA D.Deregulation of sgk1 in ulcerative colitis:aparadoxicalrelationship between immune cells and colonic epithelial cells[J].Inflammatory Bowel Diseases,2018,24(9):1967-1977.
[3]孙平良.基于代谢组学的溃疡性结肠炎大鼠肠道微生态变化及安肠汤干预机制研究[D].南宁:广西医科大学,2017.SUN P L.Study on the mechanism and change to intestinal microflora and metabonomics of the ulcerative colitis rat treated with anchang decoction[D].Nanning:Guangxi Medical University,2017.
[4]ANANTHAKRISHNAN A N,BERNSTEIN C N,ILIOPOULOS D A,et al.Environmental triggers in IBD:a review of progress and evidence[J].Nature Reviews Gastroenterology & Hepatology,2018,15(1):39-49.
[5]DE P,JING K,ANANTHAKRISHNAN A,et al.Higher serum n-6/n-3 PUFA ratios in patients with mild to moderate IBD are associated with an increased rate of flare[J].Inflammatory Bowel Diseases,2014,20(S1):5-6.
[6]LI N,YUE H,JIA M,et al.Effect of low-ratio n-6/n-3 PUFA on blood glucose:a meta-analysis[J].Food & Function,2019,10(8):4557-4565.
[7]MIKOCKA W A,ANDREWS J M.It is high time to examine the psyche while treating IBD[J].Nature Reviews Gastroenterology & Hepatology,2018,15(6):329-330.
[8]SERHAN C N.Pro-resolving lipid mediators are leads for resolution physiology[J].Nature,2014,510(7503):92-101.
[9]WANG X,ZHU M,HJORTH E,et al.Resolution of inflammation is altered in Alzheimer's disease[J].Alzheimer's & Dementia,2015,11(1):40-50.
[10]SERHAN C N,CHIANG N.Resolution phase lipid mediators of inflammation:agonists of resolution[J].Current Opinion in Pharmacology,2013,13(4):632-640.
[11]ALEXANDER V S,ZHI H Y,BORIS L V,et al.Addition of aspirin to a fish oil-rich diet decreases inflammation and atherosclerosis in ApoE-null mice[J].The Journal of Nutritional Biochemistry,2016,35(1):58-65.
[12]付元庆.厚壳贻贝脂质提取物对肠道损伤、溃疡性结肠炎以及类风湿性关节炎的影响和其机理研究[D].杭州:浙江大学,2015.
FU Y Q.The effects of hard-shelled mussel lipid extract on intestinal injury,ulcerative colitis and rheumatoid arthritis and its mechanism[D].Hangzhou:Zhejiang University,2015.
[13]WANG F,FU Y,CAI W,et al.Anti-inflammatory activity and mechanisms of a lipid extract from hard-shelled mussel (Mytilus coruscus) in mice with dextran sulphate sodium-induced colitis[J].Journal of Functional Foods,2016,23(1):389-399.
[14]AUGIMERI G,PLASTINA P,GIONFRIDDO G,et al.N-eicosapentaenoyl dopamine,a conjugate of dopamine and eicosapentaenoic acid (EPA),exerts anti-inflammatory properties in mouse and human macrophages[J].Nutrients,2019,11(9):2247-2259.
[15]扶志敏,王正.ω-3 多不饱和脂肪酸抗炎机制研究进展[J].医药导报,2009,28(9):1174-1176.
FU Z M,WANG Z.Research progress on anti-inflammatory mechanism of ω-3 polyunsaturated fatty acids[J].Herald of Medicine,2009,28(9):1174-1176.
[16]蒋朱明.鱼油基础与临床[M].北京:人民卫生出版社,2014:86-88.
JIANG Z M.Fish oil basic and clinical[M].Beijing:People's Medical Publishing House,2014:86-88.
[17]ZHENG Z,DAI Z,CAO Y,et al.Docosapentaenoic acid (DPA,22:5n-3)ameliorates inflammation in an ulcerative colitis model[J].Food & Function,2019,10(7):4199-4209.
[18]ARITA M,YOSHIDA M,HONG S,et al.Resolvin E1,an endogenous lipid mediator derived from omega-3 eicosapentaenoic acid,protects against 2,4,6-trinitrobenzene sulfonic acid-induced colitis[J].Proceedings of the National Academy of Sciences,2005,102(21):7671-7676.
[19]VICTOR L,SONG H,WALTER J,et al.Novel docosanoids inhibit brain ischemia-reperfusion-mediated leukocyte infiltration and pro-inflammatory gene expression[J].The Journal of biological chemistry,2003,278(44):43807-43817.
[20]JANAKIRAM N B,MOHAMMED A,RAO C V.Role of lipoxins,resolvins,and other bioactive lipids in colon and pancreatic cancer[J].Cancer &Metastasis Reviews,2011,30(4):507-523.
[21]LI Q,WANG M,TAN L,et al.Docosahexaenoic acid changes lipid composition and interleukin-2 receptor signaling in membrane rafts [J].Journal of Lipid Research,2005,46(9):1904-1913.
[22]李秋荣,马健,谭力,等.二十二碳六烯酸改变脂筏脂肪环境调节白细胞介素2 受体信号通路[J].中国科学,2005,35(4):373-382.
LI Q R,MA J,TAN L,et al.Docosahexaenoic acid alters lipid raft adipose environment and regulates interleukin-2 receptor signaling pathway[J].Science in China,2005,35(4):373-382.
[23]SORG O.Oxidative stress:a theoretical model or a biological reality? [J].Comptes Rendus Biologies,2004,327(7):649-662.
[24]CERUTTI P,SHAH G,PESKIN A,et al.Oxidant carcinogenesis and antioxidant defensea[J].Annals of the New York Academy of Sciences,1992,663(1):158-166.
[25]BIRBEN E,SAHINER U M,SACKESEN C,et al.Oxidative stress and antioxidant defense[J].World Allergy Organ J,2012,5(1):9-19.
[26]VALKO M,RHODES C J,MONCOL J,et al.Free radicals,metals and antioxidants in oxidative stressinduced cancer[J].Chemico-Biological Interactions,2006,160(1):1-40.
[27]VALKO M,LEIBFRITZ D,MONCOL J,et al.Free radicals and antioxidants in normal physiological functions and human disease[J].The International Journal of Biochemistry & Cell Biology,2007,39(1):44-84.
[28]BHATTACHARYYA A,CHATTOPADHYAY R,MITRA S,et al.Oxidative stress:an essential factor in the pathogenesis of gastrointestinal mucosal diseases[J].Physiological Reviews,2014,94 (2):329-354.
[29]司天雷.DHA 与槲皮素的抗炎作用及其对NF-κB、MAPK 信号通路影响的研究[D].武汉:华中农业大学,2015.
SI T L.Anti-inflammatory effect of DHA and quercetin and their role in NF-κB and MAPK signaling pathway[D].Wuhan:Huazhong Agricultural University,2015.
[30]CHEN J,WEI Y,CHEN X,et al.Polyunsaturated fatty acids ameliorate aging via redox-telomere-antioncogene axis[J].Oncotarget,2017,8(5):7301-7314.
[31]DASILVA G,PAZOS M,EDUARDO G E,et al.Healthy effect of different proportions of marine ω-3 PUFAs EPA and DHA supplementation in wistar rats:Lipidomic biomarkers of oxidative stress and inflammation[J].Journal of Nutritional Biochemistry,2015,26(11):1385-1392.
[32]TAKAYAMA T,KAMADA N,CHINEN H,et al.Imbalance of NKp44 +NKp46 and NKp44NKp46 +natural killer cells in the intestinal mucosa of pa tients with crohn's disease[J].Gastroenterology,2010,139(3):882-892.
[33]ERMANN J,STATON T,GLICKMAN J N,et al.Nod/Ripk2 signaling in dendritic cells activates IL-17A-secreting innate lymphoid cells and drives colitis in T-bet(-/-).Rag2(-/-) (TRUC) mice[J].Proceedings of the National Academy of Sciences of the United States of America,2014,111(25):2559-2566.
[34]王岭玉,吴瑾.炎症性肠病发病机制的研究进展[J].胃肠病学,2018,23(10):60-63.
WANG L Y,WU J.Advances in research on pathogenesis of inflammatory bowel disease [J].Chi nese Journal of Gastroenterology,2018,23 (10):60-63.
[35]杨勇,张巍,王丽英.炎症性肠病免疫发病机制的研究进展[J].中国实验诊断学,2012,16(1):181-183.
YANG Y,ZHANG W,WANG L Y.Research progress on immune pathogenesis of inflammatory bowel disease[J].Chinese Journal of Laboratory Diagnosis,2012,16(1):181-183.
[36]ERGAS D,EILAT E,MENDLOVIC S,et al.N-3 fatty acids and the immune system in autoimmunity[J].The Israel Medical Association Journal:IMAJ,2002,4(1):34-38.
[37]贺敏,胡世伟,吴胜强.高含量EPA/DHA 甘油三酯型鱼油对小鼠的免疫调节作用[J].中国海洋药物,2013,32(4):43-48.
HE M,HU S W,WU S Q.Effects of the high levels of EPA/DHA triglyceride-type fish oil on immune regulation in mice[J].Chinese Journal of Marine Drugs,2013,32(4):43-48.
[38]VOREADES N,KOZIL A,WEIR T L.Diet and the development of the human intestinal microbiome[J].Frontiers in Microbiology,2014,5(494):1-10.
[39]ROWLAND I,GIBSON G,HEINKEN A,et al.Gut microbiota functions:metabolism of nutrients and other food components[J].European Journal of Nutrition,2018,57(1):1-24.
[40]NISHIDA A,INOUE R,INATOMI O,et al.Gut microbiota in the pathogenesis of inflammatory bowel disease[J].Clinical Journal of Gastroenterology,2018,11(1):1-10.
[41]ZHU W,WINTER M G,BYNDLOSS M X,et al.Precision editing of the gut microbiota ameliorates colitis[J].Nature,2018,553(7687):208-212.
[42]BULL M J,PLUMMER N T.The human gut microbiome in health and disease [J].Integr Med,2014,13(6):17-22.
[43]张超.基于高通量测序研究肉桂精油对肠炎小鼠肠道菌群的影响[D].哈尔滨:东北农业大学,2017.
ZHANG C.Effects of cinnamon essential oil on intestinal microflora in enteritis mice based on highthroughput sequencing[D].Harbin:Northeast Agricultural University,2017.
[44]COMITO D,CASCIO A,ROMANO C.Microbiota biodiversity in inflammatory bowel disease[J].Italian Journal of Pediatrics,2014,40(1):32-37.
[45]LI T T,LIU Y Y,WAN X Z,et al.Regulatory efficacy of the polyunsaturated fatty acids from microalgae spirulina platensis on lipid metabolism and gut microbiota in high-fat diet rats[J].International Journal of Molecular Sciences,2018,19(10):3075-3090.
[46]MENNI C,ZIERER J,PALLISTER T,et al.Omega-3 fatty acids correlate with gut microbiome diversity and production of N-carbamylglutamate in middle aged and elderly women[J].Scientific Report,2017,7(1):11079.
[47]MIYAMOTO J,IGARASHI M,WATANABE K,et al.Gut microbiota confers host resistance to obesity by metabolizing dietary polyunsaturated fatty acids[J].Nature Communications,2019,10(1):4007-4021.