酸枣(Ziziphus jujuba Mill.var.spinosa(Bunge) Hu ex H.F.Chou)又名山枣、葛针、野枣、棘,鼠李科枣属野生灌木或小乔木[1]。栽培历史悠久,适应性强,主要分布在我国北方地区,是重要的传统野生植物资源之一,已被卫生部列为药食同源两用品[2]。野生酸枣营养价值极高,现有研究表明,酸枣果肉中富含多种营养成分,主要包括多种矿物质、可溶性糖、有机酸[3]、多酚[4]、甾醇、黄酮以及多种微量元素和大量维生素等[5-6],具有抗氧化、免疫调节、抗癌、助眠及降血脂等功效[7-9]。此外,酸枣仁还有抗抑郁、补脑安神等特性[10]。有研究表明,枣多糖还具有重要的生理保健功能和生物活性,包括抗衰老、改善心血管及增强免疫功能等[11]。
多糖又称多聚糖,是由10 多种单糖通过糖苷键连接而成的天然高分子化合物[12]。根据多糖来源的不同,可将其分为植物多糖、动物多糖和微生物多糖[13],不仅具有降血糖、抗病毒、抗增殖、抗氧化、免疫调节等作用,还可以降低合成药物的毒性和副作用[14-15]。多糖的生物活性受其分子结构的影响,应用现代化学技术对天然多糖进行化学结构修饰,可提高其生物活性[16]。常用的化学修饰方法有羧甲基化、硫酸化、乙酰化、磷酸化等[17]。
本课题组前期研究发现修饰后的枣多糖的抗氧化活性及多糖性质都发生改变。本研究从酸枣果实中提取多糖,对羧甲基化基团修饰工艺进行研究,以期获得高取代度羧甲基化修饰多糖样品。此外,对酸枣多糖基团修饰前、后的性质和功能进行研究,为酸枣资源的利用提供参考。
1 材料与方法
1.1 材料与试剂
“酸枣”成熟果实,采自河北省赞皇县;嗜酸乳杆菌(Lactobacillus acidophilus,CGMCC 1.2919)、鼠李糖乳杆菌 (Lactobacillus rhamnosus,CGMCC 1.576),中国普通微生物菌种保藏管理中心(CGMCC);透析袋(8 000~14 000 u);超纯水;所有有机溶剂均为国产分析纯级。
1.2 仪器与设备
SYG-2 数显恒温水浴锅,常州朗越仪器制造有限公司;旋转蒸发仪,德国IKA 公司;气相色谱仪,美国Agilent 科技有限公司;紫外可见分光光度计,北京普析通用仪器有限责任公司;CP224C电子天平,奥豪斯仪器(上海)有限公司;TESCAN VEGA3 扫描电镜,捷克TESCAN 公司;红外分光光度计,美国Spectrum 公司。
1.3 方法
1.3.1 酸枣多糖的提取 采用水提醇沉法提取酸枣多糖。称取2.5 kg 酸枣果实,洗净、去核,加入3倍体积的95%乙醇醇沉,每隔24 h 重复1 次,共重复3 次,去除单糖和脂类,向过滤和干燥的滤渣中加入水0.05 g/mL。用沸水萃取2 h,重复3 次,再将滤液抽滤浓缩,浓缩后与95%乙醇混合醇沉,使酒精度达到80 度,搅拌后在4 ℃下过夜沉淀聚合物,然后过滤,收集多糖并用95%乙醇洗涤,60℃烘干打粉。采用Sevage 法脱蛋白。
1.3.2 酸枣多糖羧甲基化修饰工艺研究
1)酸枣多糖羧甲基化修饰工艺单因素实验以酸枣羧甲基化多糖取代度为参考指标,分别比较反应温度、氯乙酸添加量、氢氧化钠浓度3 个因素对酸枣羧甲基化多糖取代度的影响。称取酸枣多糖500 mg 于烧杯中,固定反应温度60 ℃,加入浓度分别为1,1.5,2,2.5,3,3.5 mol/L 的氢氧化钠溶液50 mL,搅拌60 min 至充分混匀,然后再加入质量分数为2%的氯乙酸;固定氢氧化钠溶液浓度为2.5 mol/L,在不同温度(50,60,70,80,90 ℃)下,加入质量分数为2 %的氯乙酸;固定反应温度80℃,氢氧化钠溶液浓度为2.5 mol/L,加入不同质量分数(1%,2%,3%,4%,5%)的氯乙酸,水浴反应5 h 后,冷却至室温,调节溶液pH=7,装入透析袋(8 000~14 000 u)于蒸馏水中透析72 h,将袋内溶液旋蒸干燥即获得羧甲基化酸枣多糖。
羧甲基化酸枣多糖取代度的测定:称取羧甲基化酸枣多糖样品20 mg 至50 mL 容量瓶中,加入20 mL 0.01 mol/L 氢氧化钠标准溶液,40 ℃水浴30 min,冷却至室温,再用0.01 mol/L 盐酸标准溶液反滴定过剩氢氧化钠,至刚好褪去酚酞指示剂颜色。测定前,应对氢氧化钠和盐酸溶液进行标定[18]。取代度(DS)计算公式为:
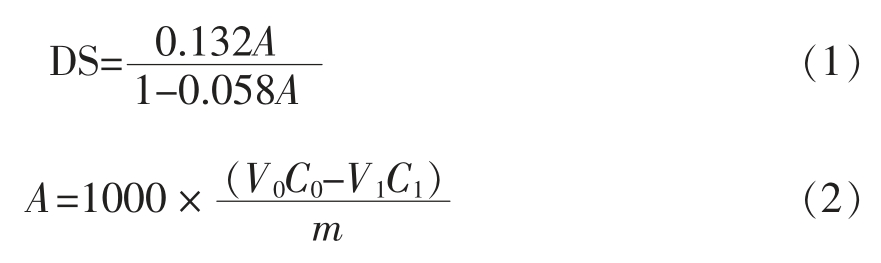
式中,A——每克样品消耗氢氧化钠物质的量,mmol;V0——所消耗的氢氧化钠溶液的体积,mL;C0——所消耗的氢氧化钠溶液的浓度,mol/L;V1——所消耗的盐酸溶液的体积,mL;C1——所消耗的盐酸溶液的浓度,mol/L;m——酸枣羧甲基化多糖样品质量,g。
2)响应面优化试验 在单因素实验的基础上,采用Box-Behnken 的中心组合原理为依据,以反应温度(A)、氢氧化钠浓度(B)和氯乙酸添加量(C)为自变量,取代度为因变量,采用响应面优化方法,利用统计学分析软件Design Expert 11 建立数字回归模型,确定酸枣多糖羧甲基化修饰的最佳条件。
1.3.3 酸枣羧甲基化多糖的性质测定
1)酸枣多糖的溶解度及黏度测定 水溶性测定:将酸枣多糖配制成20 mg/mL 溶液,采用平衡法[19]测定其溶解度。
黏度测定:取0.5 g 酸枣多糖样品溶于300 mL 蒸馏水中,使其没过转子,打开粘度计测定,待屏幕上数字稳定后记录读数,每个样品重复测定3 次。
2)单糖组成测定 称取单糖标品,包括鼠李糖、木糖、阿拉伯糖、果糖、葡萄糖、甘露糖、半乳糖各10 mg 于试管中,各加入12 mg 盐酸羟胺和0.5 mL 吡啶,置于干燥箱中,90 ℃反应30 min,取出冷却至室温后,加入0.5 mL 醋酐,90 ℃反应30 min,氮气吹干后,加入1 mL 氯仿溶解,备用。按照标品处理方法制备待测样品。气相色谱条件:载气为氮气(纯度99.999%),氢气流速50.0 mL/min,空气流速400 mL/min,恒定压力8.79 psi,平均线速度34 cm/s;气化室温度240 ℃,检测温度260 ℃,色谱柱起始温度140 ℃,维持3 min,以10 ℃/min 升至240 ℃,保持11 min,分流比为20∶1,进样量1 μL。
3)紫外扫描分析 称取多糖样品5 mg,加入50 mL 超纯水溶解,配成0.1 mg/mL 样品溶液,在紫外分光光度计下190~900 nm 范围内扫描,得到紫外扫描光谱图。
4)红外光谱扫描 采用KBr 压缩法,用FTIR 分光光度计测定枣多糖的红外光谱。将1 mg枣多糖与200 mg KBr 粉末(100°C 下完全干燥)研磨并压入1 mm 玛瑙砂浆中,经压片机压成1 mm 厚片,放置于红外光谱仪中检测,频率分辨率1 cm-1,在400~4 000 cm-1 范围内扫描。
5)扫描电镜及电镜能谱观察 将充分干燥的酸枣多糖用离子溅射镀膜法制备电镜样品,置于扫描电镜的样品室中扫描分析,调节加速电压10 kV,放大5 000 倍,观察酸枣多糖的表面的形态及组成元素。同时,采用EDS 模式进行枣多糖样品元素分析。
1.3.4 酸枣羧甲基化多糖体外抗氧化活性研究
1)DPPH 清除能力测定 将多糖样品配制成不同浓度的溶液各2 mL,加入浓度为2×10-4 mol/L 的DPPH 乙醇溶液混匀,室温避光静置30 min,测定吸光值A1,同时,取2 mL 乙醇和2 mL 样品溶液混匀,测定吸光值A2,再取2 mL 乙醇,2 mL DPPH 溶液混匀,测得吸光值A3,于517 nm 波长处测定吸光值,每个浓度重复测定3 次[20-21]。按式(3)计算:
2)羟基自由基的清除能力测定 依次加入4.5 mmol/L FeSO4 溶液、4.5 mmol/L 水杨酸-乙醇溶液和不同浓度待测溶液各1 mL,充分摇匀,再加 入1 mL 4.4 mmol/L H2O2,37 ℃水 浴0.5 h,于510 nm 波长处测定吸光值,每个浓度重复测定3次,取平均值[22]。按式(4)计算:
式中,A1——FeSO4+水杨酸-乙醇溶液+蒸馏水+H2O2;A2——FeSO4+水杨酸-乙醇溶液+样品+H2O2;A3——FeSO4+水杨酸-乙醇溶液+样品+蒸馏水。
3)还原力测定 准确移取不同浓度的多糖样品溶液各2.5 mL,依次加入浓度为0.2 mol/L,pH=6.6 的磷酸盐缓冲液2.5 mL 和质量分数为1%的K3Fe(CN)6 溶液2.5 mL 混匀,50 ℃水浴20 min,快速冷却后,加入三氯乙酸溶液2.5 mL 混匀,3 000 r/min 离心10 min,取5 mL 上清液,加入5 mL 蒸馏水和1 mL 1 mg/mL 的FeCl3 溶液混匀,静置10 min,于700 nm 波长处测定吸光值,每个浓度重复测定3 次[23-24]。
1.3.5 酸枣羧甲基化多糖对益生菌生长的影响将LR 鼠李糖乳杆菌、LB 嗜酸乳杆菌在MRS 液体培养基上活化48 h 后,接入MRS 液体培养基,制备种子液。
将酸枣多糖加入液体培养基中,使其质量分数分别为0%,0.5%,1%,1.5%,菌液在37 ℃恒温箱中培养32 h,每隔2 h 取出发酵液采用分光光度计在600 nm 波长处测定其吸光值,每个时间点重复测定3 次。以培养时间为横坐标,OD 值为纵坐标,以未加入酸枣多糖的培养基作为空白对照,绘制生长曲线。
1.4 数据处理与分析
所有测定的样品均一式3 份,用“平均值±标准偏差” 表示。采用Spss17.0 软件进行多因素比较,采用单因素方差分析(ANOVA)和邓肯多区间检验。P<0.05 表示“具有显著差异”,P<0.01 表示“具有极显著差异”。
2 结果与分析
2.1 酸枣多糖羧甲基化修饰工艺
2.1.1 单因素实验结果
1)反应温度对酸枣羧甲基化多糖取代度的影响 单因素筛选反应温度结果表明,酸枣羧甲基化多糖的取代度随反应温度升高呈先升高后下降的趋势(图1a)。当温度为40~80 ℃时,羧甲基化取代度逐渐升高,当温度为80 ℃时,羧甲基化取代度达到最大值为0.7268±0.0540。当温度高于80 ℃,羧甲基化取代度显著下降,这是因为升高温度可以提高羧甲基化的反应速率,而温度过高,会破坏酸枣多糖结构,不利于取代反应的进行[25]。因此确定酸枣多糖羧甲基化修饰的温度为80 ℃。
2)氯乙酸添加量对酸枣羧甲基化多糖取代度的影响 氯乙酸添加量对酸枣羧甲基化多糖取代度的影响如图1b 所示。随着氯乙酸添加量的增加,酸枣羧甲基化取代度呈先上升后下降的趋势,当氯乙酸添加量为1%~3%时,羧甲基化取代度逐渐升高,当氯乙酸添加量为3%时,取代度达到最大值为0.74,当氯乙酸添加量增加到4%和5%时,羧甲基化取代度呈下降趋势,这主要是由于氯乙酸添加量的增加影响反应体系的pH 值,氯乙酸添加量增加,可提供更多的CH2COO-,使得多糖反应的几率增大,而氯乙酸的添加量过大,会使整个反应体系的pH 值降低,不利于取代反应的进行[26]。因此确定酸枣多糖羧甲基化修饰的氯乙酸添加量为3%。
3)NaOH 浓度对酸枣羧甲基化多糖取代度的影响 NaOH 浓度对酸枣羧甲基化多糖取代度的影响如图1c 所示。随着NaOH 浓度的增加,酸枣羧甲基化取代度呈先上升后下降的趋势,当NaOH 浓度为1~2.5 mmol/L 时,羧甲基化取代度逐渐升高,当NaOH 浓度为2.5 mol/L 时,取代度达到最大值为0.7477±0.0496。当NaOH 浓度再升高,酸枣羧甲基化取代度下降,这是因为在强碱条件下,多糖易降解,而当氯乙酸和NaOH 达到一定浓度时会发生副反应,从而降低取代速率[27]。因此确定酸枣多糖羧甲基化修饰的NaOH 浓度为2.5 mmol/L。

图1 处理温度(a)、氯乙酸添加量(b)、NaOH 浓度(c)对酸枣多糖取代度的影响
Fig.1 Effect of treatment temperature (a),chloroacetic acid (b),NaOH concentration (c) on the degree of substitution of wild jujube
2.1.2 酸枣多糖羧甲基化修饰方法优化
1)因变量与自变量关系的统计分析 采用响应面法对反应温度(℃)、氯乙酸添加量(%)、NaOH 浓度(mol/L)3 个自变量进行优化。17 项试验设计及结果见表1。
表1 酸枣多糖羧甲基化方法优化响应面试验设计及结果
Table 1 Method and results of response surface test for carboxymethylation of wild jujube polysaccharides

序号 反应温度/℃NaOH 浓度/mol·L-1氯乙酸添加量/% DS 序号 反应温度/℃NaOH 浓度/mol·L-1氯乙酸添加量/% DS 1 80 3 2 0.5 10 90 2.5 2 0.65 2 70 2.5 4 0.56 11 80 2 4 0.55 3 80 2.5 3 0.81 12 90 3 3 0.44 4 80 2.5 3 0.74 13 90 2 3 0.64 5 80 2 2 0.44 14 80 2.5 3 0.72 6 80 3 4 0.53 15 90 2.5 4 0.65 7 70 2.5 2 0.58 16 70 3 3 0.57 8 70 2 3 0.55 17 80 2.5 3 0.79 9 80 2.5 3 0.74
2)模型的建立及方差分析 用Design-Expert 11 软件将模型进行分析,得到酸枣多糖羧甲基化取代度(DS)以及所选3 个因素编码值的回归方程为:Y=0.76-0.0212A-0.0175B-0.0212C-0.055AB-0.0675AC-0.02BC-0.0888A2-0.1212B2-0.1338C2。
再对回归模型进行方差分析,并对模型系数进行显著性测验,如表2所示,该试验模型中,P<0.0001,即为极显著,模型的失拟项P=0.5781>0.05,说明相对于纯误差失拟不显著,获得模型决定系数R2=0.8583,说明该模型86%的数据可用此方程解释。模型的一次项A 对酸枣多糖羧甲基化的取代度影响极显著(P<0.01),而一次项B、C 和交互项AB、AC、BC 对酸枣多糖羧甲基化的取代度影响不显著;模型的二次项A2、B2 及C2 的P 值都小于0.01,均为极显著。综上所述,该模型拟合度符合数理统计学原则,酸枣羧甲基化条件可以用此方程预测。
表2 回归模型方差分析
Table 2 Variance analysis of regression model
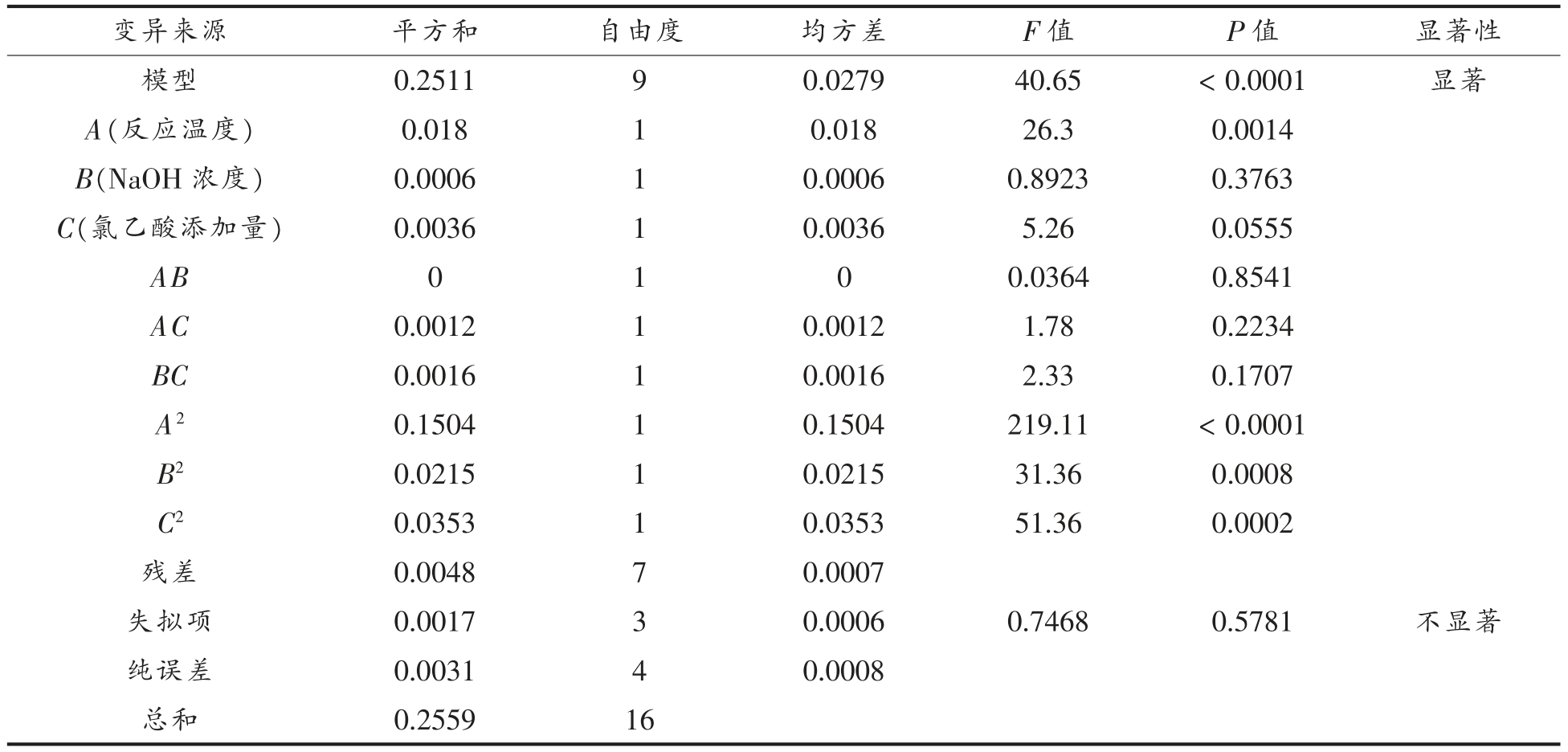
变异来源 平方和 自由度 均方差 F 值 P 值 显著性模型 0.2511 9 0.0279 40.65<0.0001 显著A(反应NaOH温度) 0.018 1 0.018 26.3 0.0014 B( 浓度) 0.0006 1 0.0006 0.8923 0.3763 C(氯乙酸添加量) 0.0036 1 0.0036 5.26 0.0555 AB 0 1 0 0.0364 0.8541 AC 0.0012 1 0.0012 1.78 0.2234 BC 0.0016 1 0.0016 2.33 0.1707 A2 0.1504 1 0.1504 219.11<0.0001 B2 0.0215 1 0.0215 31.36 0.0008 C2 0.0353 1 0.0353 51.36 0.0002残差 0.0048 7 0.0007失拟项 0.0017 3 0.0006 0.7468 0.5781 不显著纯误差 0.0031 4 0.0008总和 0.2559 16
3)响应面分析与最优方法验证 利用Design-Expert 11 软件,做出以酸枣羧甲基化条件为响应值的各因素的响应曲面图,并分析各因素的交互作用,结果见图2。由图2可知,反应温度(A)对酸枣多糖羧甲基化取代度的影响大于NaOH 浓度(B);氯乙酸添加量(C)对酸枣多糖羧甲基化取代度的影响大于反应温度(A)。综合分析发现,NaOH 浓度(B)与氯乙酸添加量(C)的交互影响最显著。根据响应面软件分析可得出羧甲基化最佳条件为反应温度为80 ℃,NaOH 浓度为2.5 mol/L,氯乙酸添加量为3%。在该条件下进行3 次重复试验,其取代度结果分别为0.74,0.74,0.81,平均值为0.76,均优于其它组合,表面最优方法组合合理可用。
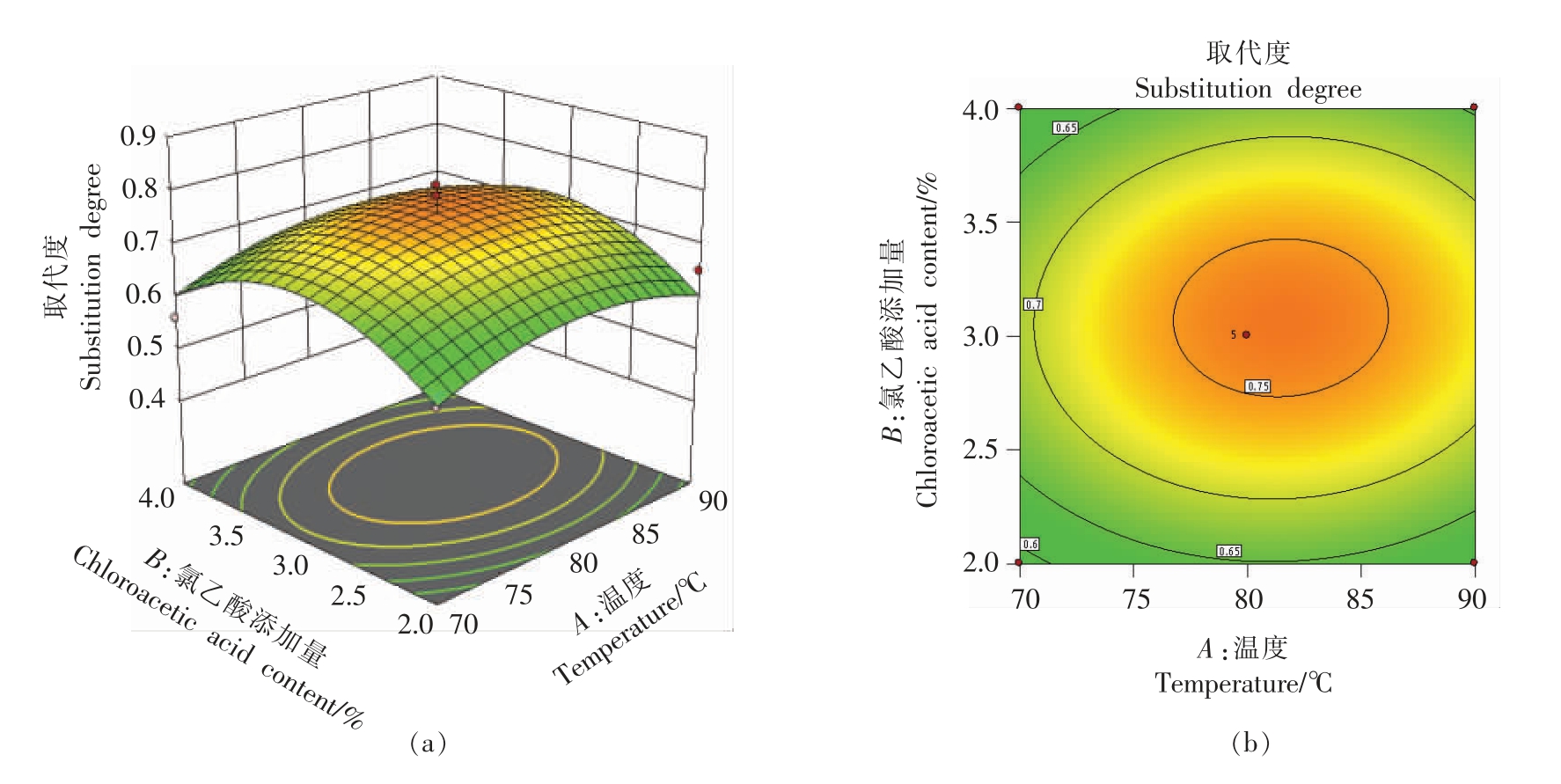

图2 各因素交互作用对酸枣羧甲基化最佳条件影响的响应面图
Fig.2 Response surface plots and contour lines of effects of various factors interaction on the wild jujube polysaccharides
2.2 酸枣羧甲基化多糖性质研究
2.2.1 酸枣溶解度和黏度测定 多糖经羧甲基化修饰后,可解决其因黏度高、溶解性低而不利于活性发挥的问题。由表3可知,酸枣多糖经羧甲基化修饰后,水溶性提高,黏度降低。
表3 酸枣多糖的水溶性和黏性
Table 3 Water solubility and viscosity of wild jujube polysaccharide

?
2.2.2 酸枣羧甲基化多糖单糖组成测定 图3为单糖混合标准品(A)和酸枣粗多糖(B)及羧甲基化多糖(C)的气相色谱图,由图可知,酸枣粗多糖是杂多糖,主要由Rha、Ara、Xyl、Man、Glc 和Gal共6 种单糖组成,经计算物质的量比(%)为0.26∶4.42∶0.35∶0.14∶0.16∶1。酸枣羧甲基化多糖也由Rha、Ara、Xyl、Man、Glc 和Gal 共6 种单糖组成,其物质的量比(%)为0.93∶23.09∶1.08∶2.17∶0.68∶1,Ara 是主要的单糖。羧甲基化后,单糖类型无变化,单糖组成的比例发生变化,结果表明,羧甲基化修饰影响酸枣多糖的理化特性,然而不改变其主要成分。

图3 单糖混合标准品(a)、酸枣粗多糖(b)和酸枣羧甲基化多糖(c)的气相色谱图
Fig.3 GC chromatography of monosaccharide standard GC (a),wild jujube crude polysaccharide (b),carboxymethylated wild jujube polysaccharide (c)
2.2.3 酸枣羧甲基化多糖紫外扫描分析 图4为酸枣多糖及酸枣羧甲基化多糖水溶液的紫外全波长扫描图,酸枣未除蛋白粗多糖在260~280 nm 波长处有强吸收峰,这表明多糖中存在蛋白结构。而酸枣除蛋白多糖和羧甲基化多糖在260~280 nm波长处均未检测到吸收峰,表明多糖中蛋白均被去除。
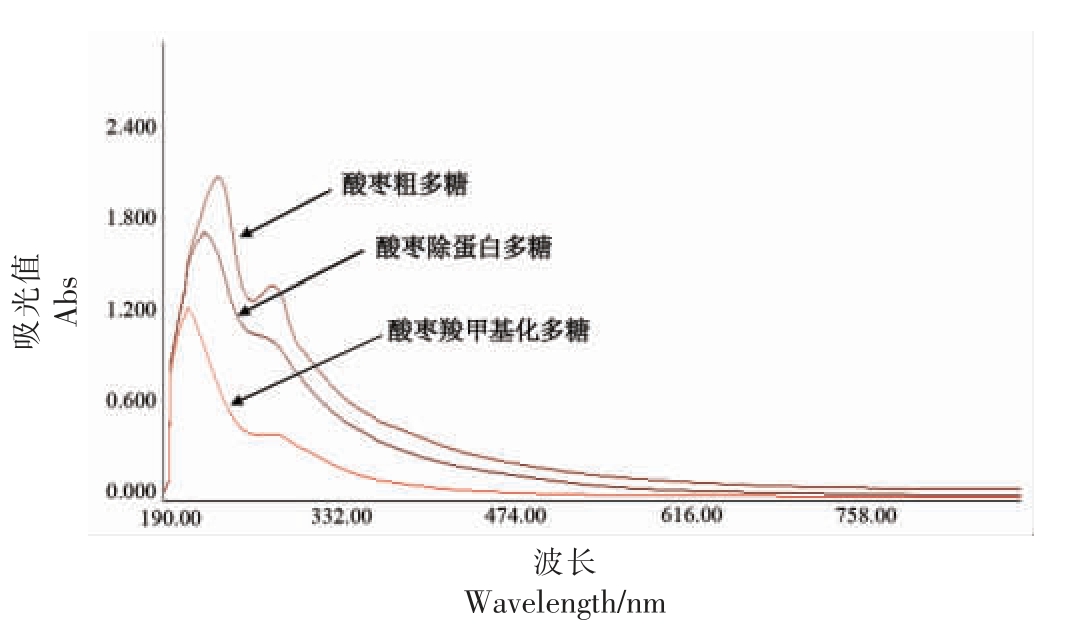
图4 酸枣多糖紫外光谱图
Fig.4 UV-visible spectrogram of wild jujube polysaccharide
2.2.4 酸枣羧甲基化多糖红外光谱分析 图5为酸枣多糖和酸枣羧甲基化多糖的红外光谱图,以KBr 为背景对照,在400~4 000 cm-1 红外光谱区域内进行扫描,由图可知,酸枣多糖羧甲基化修饰前、后都具有多糖的特征吸收峰,3 364 cm-1 处的吸收峰为多糖分子中的-OH 振动吸收峰,2 931 cm-1 为糖类C-H 键的伸缩振动峰,1 732 cm-1 和1 602 cm-1 的振动吸收峰是由于多糖中糖醛酸的存在,1 017 cm-1 处的吸收峰表明存在C-O-C 和C-O-H。酸枣多糖经羧甲基修饰后,出现了新的吸收峰。1 407.78 cm-1 处是羧甲基中COO-峰的拉伸振动,是羧甲基化的特征峰,羧甲基化多糖羧甲基特征峰的羧基振动加强,表明酸枣多糖分子中引入了COO-基团。
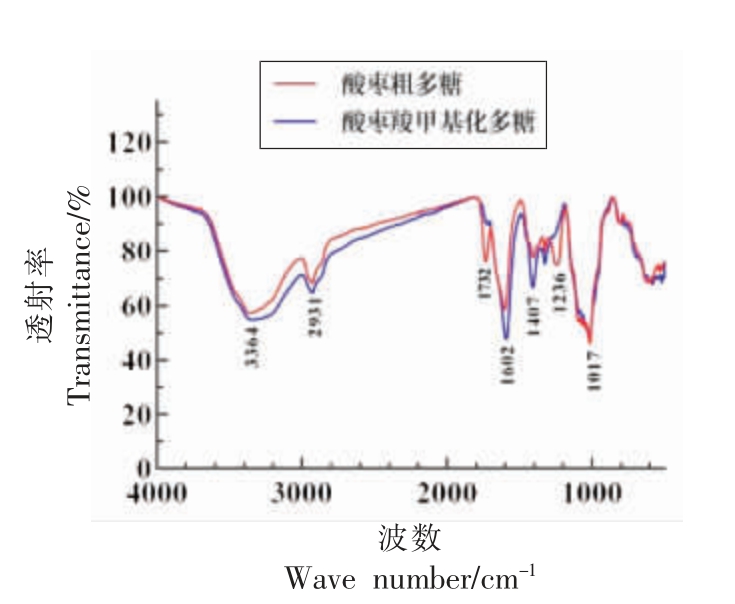
图5 酸枣多糖红外光谱图
Fig.5 HPLC chromatogram of wild jujube polysaccharide
2.2.5 扫描电镜观察分析 取酸枣粗多糖与酸枣羧甲基化多糖分别粘于样品台上,置于真空溅射仪内镀一层导电金膜,进行扫描电镜观察,并在5 000 倍下拍照分析。电镜结果如图6所示。由图6a 可知,酸枣粗多糖结构呈团状聚集,表面凹凸不平,而从图6b 可以看出,酸枣羧甲基化多糖表面光滑,呈层状堆积,同时,酸枣羧甲基化多糖晶体间呈现微小空隙,多糖并未完全集合,说明多糖分子间存在相互排斥力,分子间吸引力较弱。

图6 酸枣粗多糖(a)和酸枣羧甲基化多糖(b)扫描电镜图(5 000×)
Fig.6 SEM analysis of wild jujube crude polysaccharide (a) and carboxymethylated polysaccharide (b) (5 000×)
图7为酸枣多糖电镜能谱图,由图可知,羧甲基化酸枣多糖O 所占比例有所增加,可能是因为有-CH2-COO 的引入,出现Na 是由于酸枣多糖在进行羧甲基化修饰时采用的是氢氧化钠-氯乙酸反应体系。
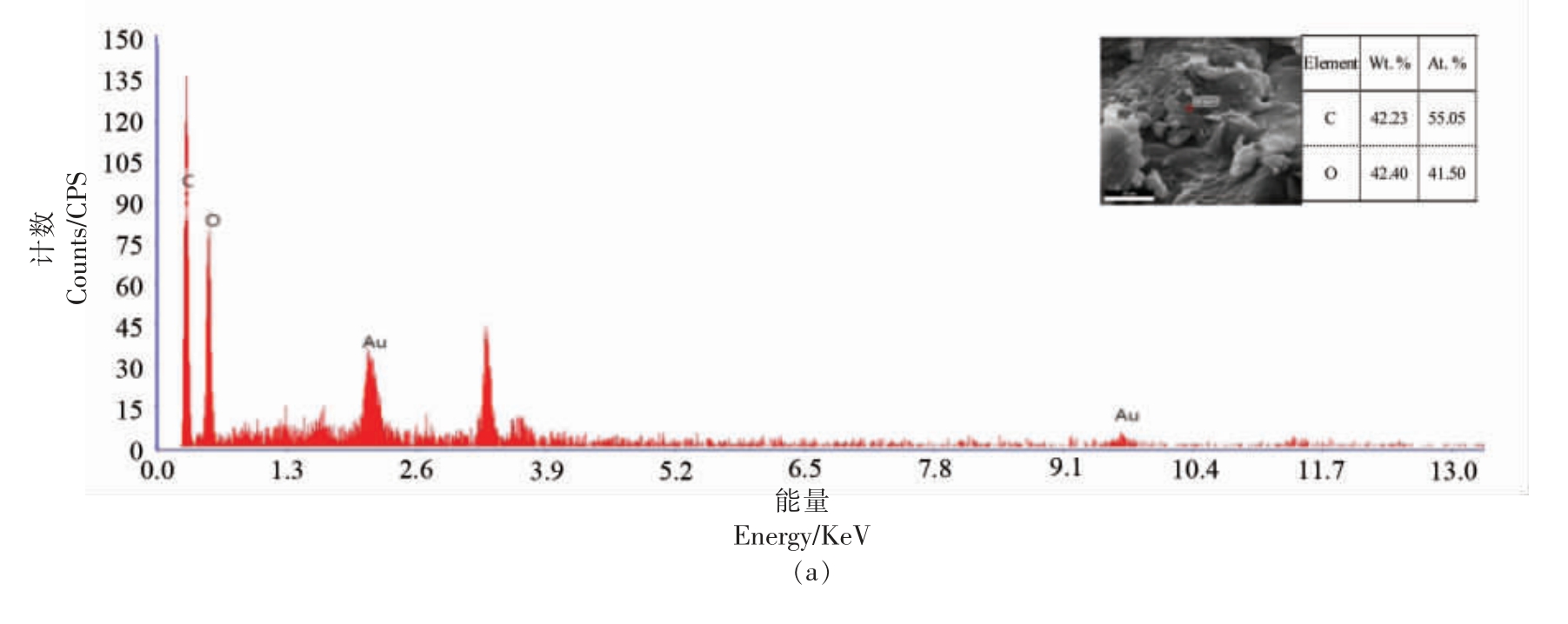

图7 酸枣粗多糖(a)和酸枣羧甲基化多糖(b)的电镜能谱分析图
Fig.7 EDS analysis of wild crude jujube polysaccharide (a) and carboxymethylated polysaccharide (b)
2.3 酸枣羧甲基化多糖的活性研究
2.3.1 酸枣羧甲基化多糖的抗氧化活性 酸枣多糖对羟基自由基的清除能力如图8a 所示,酸枣多糖对羟基自由基的清除能力随浓度的增加整体呈上升趋势,酸枣羧甲基化多糖对羟基自由基的清除能力明显优于酸枣粗多糖,当酸枣羧甲基化多糖质量浓度为2 mg/mL 时,清除率仅为74.1%,而当质量浓度增加到5 mg/mL 时,清除率显著提高到95.8%,接近于VC 对羟基自由基的清除率99.5%,表现出良好的清除能力。
酸枣羧甲基化多糖对DPPH 的清除效果如图8b 所示,可知酸枣粗多糖和酸枣羧甲基化多糖都具有一定的清除DPPH 自由基的能力。随着酸枣羧甲基化浓度增加,对DPPH 自由基的清除能力逐渐提高,当质量浓度达到5 mg/mL 时,清除率最高为81.9%,而相同浓度的酸枣粗多糖的清除率为87.4%,相对于酸枣粗多糖,酸枣羧甲基化多糖对DPPH 自由基的清除率较低,然而与阳性对照VC 相比,酸枣羧甲基化多糖对DPPH 自由基的清除能力可达到VC 对DPPH 自由基的清除能力的4/5 以上,表明酸枣羧甲基化多糖具有良好的清除DPPH 自由基的能力。
随着质量浓度的增加,酸枣多糖的总还原力逐渐增强,如图8c 所示。当酸枣羧甲基化多糖质量浓度为1 mg/mL 时,其吸光值为0.516 A,为对照组VC 吸光值的15%;当质量浓度为5 mg/mL时,吸光值为1.295 A,较酸枣粗多糖的总还原力(1.639 A)弱。
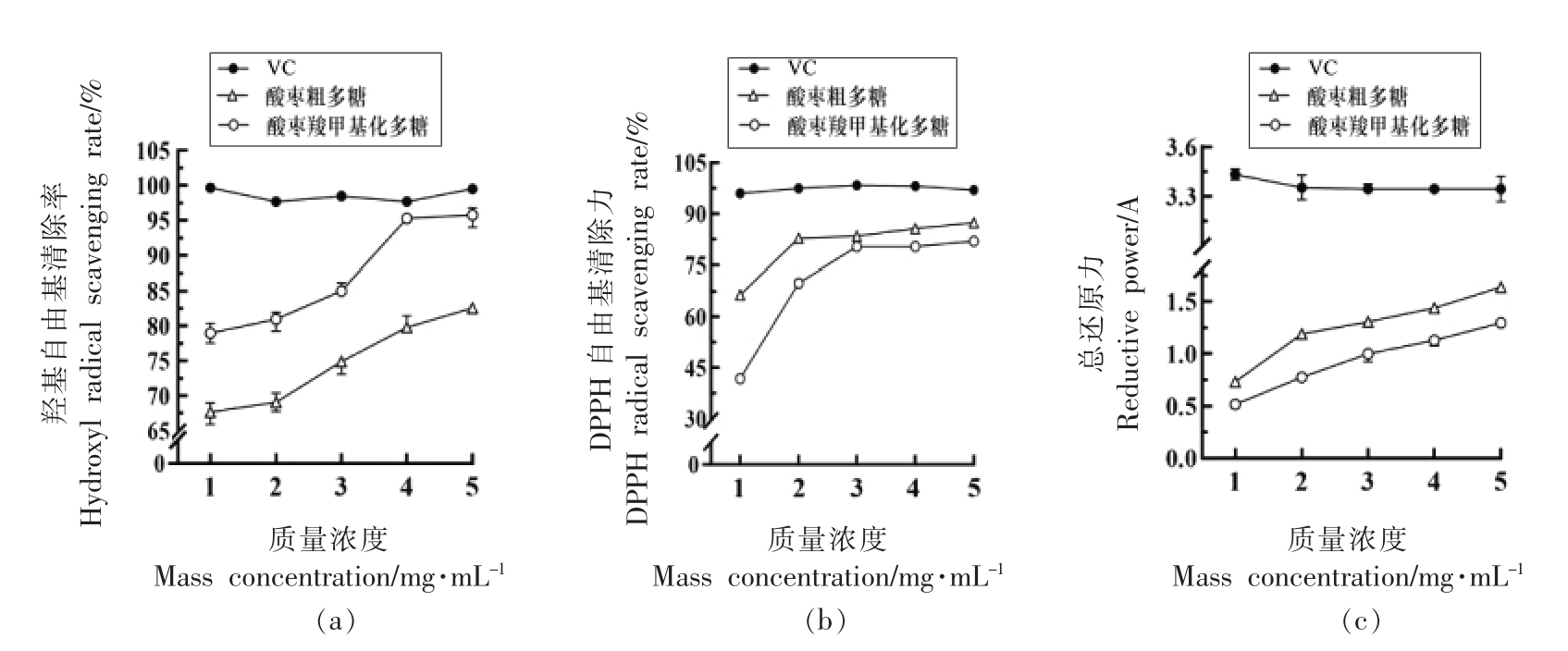
图8 酸枣羧甲基化多糖的羟基自由基清除率(a)、DPPH 自由基清除率(b)和还原力(c)
Fig.8 Hydroxyl radical scavenging rate (a),DPPH radical scavenging rate (b) and Reductive power (c)of carboxymethylated of wild jujube polysaccharide
2.3.2 酸枣羧甲基化多糖对益生菌生长的影响 图9显示了2 株乳酸菌在pH 值为5.7±0.2 时的生长曲线。2 株乳酸杆菌在培养24 h 后均达到稳定期。
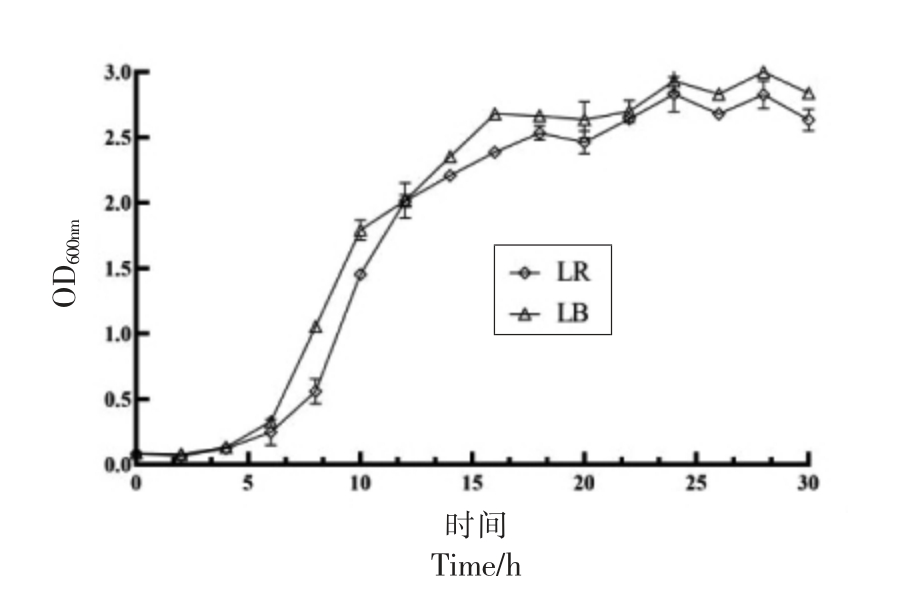
图9 益生菌生长曲线
Fig.9 Growth curve of probiotics
添加酸枣多糖对嗜酸乳杆菌LB 表现出促进作用。如图10所示,酸枣多糖的添加对嗜酸乳杆菌LB 的菌量生长整体表现出一定的促进作用,并且随着酸枣多糖浓度的升高,OD 值呈上升趋势。由图可知,酸枣羧甲基化多糖对促进嗜酸乳杆菌LB 的生长优于粗多糖。

图10 酸枣多糖对嗜酸乳杆菌生长规律的影响
Fig.10 The effect of wild jujube polysaccharide on the growth of LB
注:小写字母为同组内显著性分析结果。
如图11所示,酸枣粗多糖和酸枣羧甲基化多糖对鼠李糖乳杆菌LR 的生长都表现出促进作用,在4~16 h,菌株的生长量呈上升趋势,然后逐渐下降。质量分数为1.5%的酸枣羧甲基化多糖对鼠李糖乳杆菌LR 的生长表现出最佳的促进作用,在同质量分数下,显著优于酸枣粗多糖(P<0.05)。
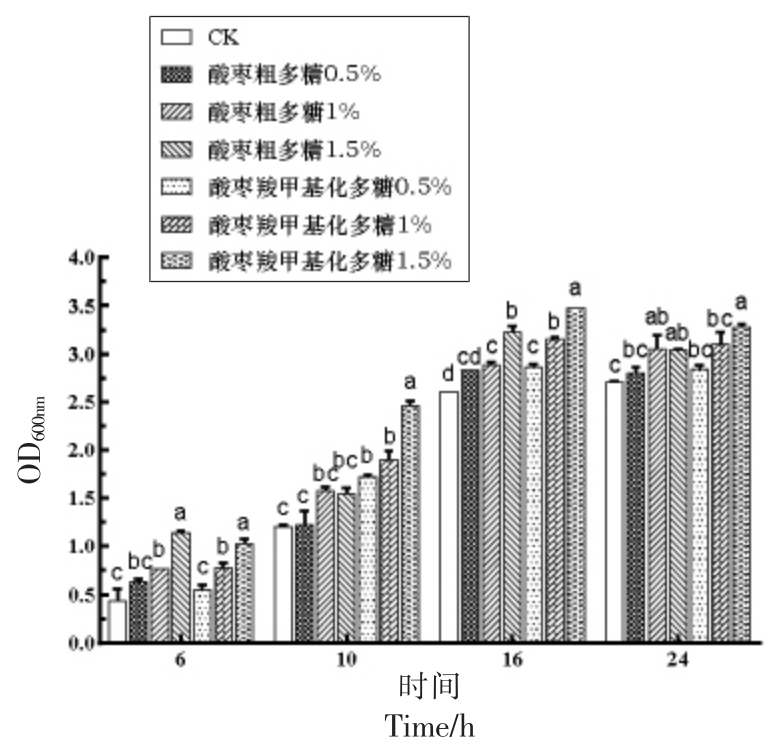
图11 酸枣多糖对鼠李糖杆菌生长规律的影响
Fig.11 The effect of wild jujube polysaccharide on the growth of LR
注:小写字母为同组内显著性分析结果。
3 结论
本研究获得酸枣多糖羧甲基化修饰工艺最佳条件为:反应温度为80 ℃,NaOH 浓度为2.5 mol/L,氯乙酸添加量为3%,在该条件下,酸枣多糖羧甲基化的取代度为0.76。酸枣多糖经羧甲基化修饰后可使其溶解度提高,黏度降低。通过扫描电镜对酸枣多糖进行结构分析,酸枣羧甲基化多糖表面表现更光滑,多糖分子由于衬度低,利用电镜观察其超微结构存在一定难度,关于酸枣羧甲基化多糖的结构还需进一步分析,修饰后酸枣多糖电镜能谱图中由于-CH2-COO 的引入,使得O 的原子比例有所增加。酸枣羧甲基化多糖主要由Rha、Ara、Xyl、Man、Glc 和Gal 6 种单糖组成,修饰前、后物质的量比(%)分别为0.26∶4.42∶0.35∶0.14∶0.16∶1 和0.93∶23.09∶1.08∶2.17∶0.68∶1,羧甲基化前、后,单糖类型无变化,表明羧甲基化修饰影响酸枣多糖的理化特性,然而并不改变其主要成分。通过对酸枣多糖进行紫外全波长扫描,发现酸枣多糖在进行羧甲基化修饰后,可去除多糖中杂质。酸枣羧甲基化多糖的红外光谱图中除多糖特征峰外,在1 407.78 cm-1 处还出现羧甲基化的特征吸收峰,表明羧甲基取代成功。通过测定酸枣多糖的总还原力、DPPH 自由基、羧甲基化自由基的清除能力,结果表明酸枣羧甲基化多糖具有良好的抗氧化能力。酸枣羧甲基化多糖还对益生菌(包括嗜酸乳杆菌和鼠李糖乳杆菌) 的生长有明显的促进作用。
[1]刘孟军,诚静容.枣和酸枣的分类学研究[J].河北农业大学学报,1994(4):1-10.
LIU M J,CHENG J R.A taxonomic study on Chinese jujube and wild jujube[J].Journal of Hebei Agricultural University,1994(4):1-10.
[2]李小梅,叶群丽,韦婷.野生酸枣化学成分含量的研究进展[J].中医药学报,2018,46(6):123-126.
LI X M,YE Q L,WEI T.Research progress on the content of chemical composition in wild jujube[J].Acta Chinese Medicine and Pharmacology,2018,46(6):123-126.
[3]赵爱玲,薛晓芳,王永康,等.枣和酸枣果实糖酸组分及含量特征分析[J].塔里木大学学报,2016,28(3):29-36.
ZHAO A L,XUE X F,WANG Y K,et al.Characteristic analysis of sugars and organic acids components and contents of Chinese jujube and wild jujube fruits[J].Journal of Tarim University,2016,28(3):29-36.
[4]WANG B,LIU L,HUANG Q,et al.Quantitative assessment of phenolic acids,flavonoids and antioxidant activities of sixteen jujube cultivars from China[J].Plant Foods for Human Nutrition,2020,75(7):154-160.
[5]薛晓芳,弓桂花,赵爱玲,等.枣和酸枣不同器官黄酮含量比较及抗氧化能力分析[J].中国果树,2020(1):59-63.
XUE X F,GONG G H,ZHAO A L,et al.Comparison of flavonoid contents and antioxidant capacities in different organs of Chinese jujube and wild jujube[J].China Fruits,2020(1):59-63.
[6]李小梅,章斌,叶群丽.紫外分光光度法测定野生酸枣中维生素C 的含量[J].山西化工,2018,38(4):56-57.
LI X M,ZHANG B,YE Q L.Determination of vitamin C in wild jujube by ultraviolet spectrophotom etry[J].Shanxi Chemical Industry,2018,38(4):56-57.
[7]蔡美丽,葛慧,李慧娟,等.酸枣仁产品的研究与应用[J].粮食与食品工业,2021,28(5):22-25.
CAI M L,GE H,LI H J,et al.Research on biological activity and development progress of semen ziziphi spinosae[J].Cereal and Food Industry,2021,28(5):22-25.
[8]徐蕊,李祥,王慧,等.酸枣浓缩汁抗氧化和血脂调控的功能评价[J].食品研究与开发,2018,39(2):192-197.
XU R,LI X,WANG H,et al.Effect of wild jujube concentrate on antioxidant and lipid metabolism[J].Food Research and Development,2018,39(2):192-197.
[9]JI X,HOU C,YAN Y,et al.Comparison of structural characterization and antioxidant activity of polysaccharides from jujube (Ziziphus jujuba Mill.)fruit[J].International Journal of Biological Macromolecules,2020,149:1008-1018.
[10]杨楠,叶晓川.酸枣仁汤的神经药理作用及分子机制研究进展[J].湖北中医药大学学报,2017,19(3):114-117.
YANG N,YE X C.Research progress of nerve pharmacological effects and molecular mechanism of Suanzaoren decoction[J].Journal of Hubei University of Chinese medicine,2017,19(3):114-117.
[11]郎杰,崔娜,张立斌.酸枣果肉多糖保健功能的初步研究[J].西北农林科技大学学报 (自然科学版),2014,42(2):162-166.
LANG J,CUI N,ZHANG L B,et al.Preliminary study on healthcare effects of wild jujube pulp polysaccharides[J].Journal of Northwest A&F University(Nat.Sci.Ed.),2014,42(2):162-166.
[12]CHEN S H,HUANG H L,HUANG G L,et al.Extraction,derivatization and antioxidant activity of cucumber polysaccharide[J].International Journal of Biological Macromolecules,2019,140:1047-1053.
[13]CHEN F,HUANG G L.Preparation and immunological activity of polysaccharides and their derivatives[J].International Journal of Biological Macromolecules,2018,112:211-216.
[14]CHEN L,HUANG G.The antiviral activity of polysaccharides and their derivatives[J].International Journal of Biological Macromolecules,2018,115:77.
[15]任二芳,牛德宝,刘功德,等.水果多糖的开发及应用进展[J].农业研究与应用,2017(2):66-70.
REN E F,NIU D B,LIU G D,et al.Development and application of fruit polysaccharide[J].Agricultural Research and Application,2017(2):66-70.
[16]YUE Y,WU S C,LI Z K,et al.Wild jujube polysaccharides protect against experimental inflammatory bowel disease by enabling enhanced intestinal barrier function[J].Food Function,2015,6(8):2568-2577.
[17]张占军,张艳艳.多糖分子修饰研究进展[J].食品工业,2017,38(5):253-257.
ZHANG Z J,ZHANG Y Y.Advances in molecular modification of polysaccharides[J].The Food Chemistry,2017,38(5):253-257.
[18]郑峰,王忠明,王迪,等.基于变异系数权重法评价干燥无花果多糖品质[J].保鲜与加工,2019,19(4):119-124.
ZHENG F,WANG Z M,WANG D,et al.Quality evaluation of drying Ficus carica polysaccharides based on variation coefficient weight method[J].Storage and Process,2019,19(4):119-124.
[19]谢建华.青钱柳多糖的分子修饰及其生物活性研究[D].南昌:南昌大学,2014.
XIE J H.Modification of polysaccharides from Cyclocarya paliurus and their biological activities[D].Nanchang:Nanchang University,2014.
[20]商佳琦,邹丹阳,滕翔宇,等.5 种食用菌多糖的结构特征及抗氧化活性对比[J].食品工业科技,2020,41(15):77-83.
SHANG J Q,ZOU D Y,TENG X Y,et al.Structural characterization and antioxidant activity of five kinds of edible fungus polysaccharides[J].Science and Technology of Food Industry,2020,41(15):77-83.
[21]南海娟,李全亮,张浩,等.2 种枣多糖的抗氧化活性比较[J].现代农业科技,2016(12):287-288.
NAN H J,LI Q L,ZHANG H,et al.Research on antioxidant activity of two kinds of jujube polysaccharide[J].Modern Agricultural Science and Technology,2016(12):287-288.
[22]帅良,廖玲燕,段振华,等.百香果果皮多糖提取工艺优化及其抗氧化活性研究[J].食品工业科技,2020,41(18):150-156.
SHUAI L,LIAO L Y,DUAN Z H,et al.Optimization of extraction technology of polysaccharides from passion fruit peel and its antioxidant activity[J].Science and Technology of Food Industry,2020,41(18):150-156.
[23]张洋婷,韩丽琴,郗艳丽,等.红景天多糖羧甲基化修饰及其抗氧化活性[J].中国公共卫生,2017,33(10):1462-1465.
ZHANG Y T,HAN L Q,XI Y L,et al.Carboxymethylation and antioxidant activity of rhodiola polysaccharide[J].Chinese Journal of Public Health,2017,33(10):1462-1465.
[24]李霞,熊峰,覃献杏,等.西番莲果皮多糖微波辅助提取工艺优化及其体外抗氧化性[J].食品工业科技,2018,39(15):141-146.
LI X,XIONG F,QIN X X,et al.Optimization of microwave-assisted extraction process of polysaccharide from Passiflora edulis sims peel and evaluation of antioxidant activity in vitro[J].Science and Technology of Food Industry,2018,39(15):141-146.
[25]房斐,陈雪峰,刘宁,等.羧甲基化苹果渣多糖的制备及其表征[J].食品科技,2019,44(9):289-294.
FANG F,CHEN X F,LIU N,et al.Preparation and characterization of carboxymethylated apple pomace polysaccharide[J].Food Science and Technology,2019,44(9):289-294.
[26]ZHOU R,TIAN C R,ZHANG J,et al.Carboxymethylation and antioxidant activity of Coprinus comatus polysaccharide[J].Food Science,2010,31(13):10-15.
[27]张金萍,王敬文.一步法制备羧甲基茯苓多糖的工艺研究[J].天然产物研究与开发,2006(2):291-294.
ZHANG J P,WANG J W.Preparation of carboxymethyl pachmaran in one step[J].Natural Product Research and Development,2006(2):291-294.