油脂是人体必不可少的营养成分,为人体提供能量,有效促进脂溶性维生素的吸收,确保各项生命活动的正常进行,是人类生命不可或缺的能源物质[1]。当今生活水平大幅提高,高血压、高血脂、肥胖症等相关疾病不断威胁人们日常生活健康,其中高脂类制品或成罪魁祸首,因此新型功能性油脂的研究开发已成目前的热点课题[2-3]。先前研究表明,结构脂质是指通过改变油脂甘油三酯支链上脂肪酸的碳链长度和在支链上的位置来改变油脂的营养功能性质,从而影响人类的新陈代谢和健康。脂肪一般在人体内需要经过3~4 h 才可完成消化,而中链脂肪酸只需几分钟就能直接从肠道上皮细胞吸收,再通过肝门静脉进入血液循环加以利用[4-5]。Gruczynska 等[6]以菜籽油为底物,加入抗坏血酸和酚酸,研究最终酯交换生成的新型结构脂质的理化特性,结果表明,与菜籽油相比,合成的结构脂质的油炸性能得到改善,同时氧化稳定性提高,从而直接影响脂质的营养特性。Akanbi 等[7]使用Lipozyme RM IM 作为催化剂,将二十碳五烯酸(EPA)插入鸸鹋油中,以合成富含EPA 的结构脂质,其试验结果证实异辛烷作为反应溶剂可提高EPA 的插入水平,并且生成的结构脂质与鸸鹋油相比具有更高的氧化稳定性。Pande等[8]使用Lipozyme TL IM 脂肪酶在65 ℃下反应24 h,通过促酸解反应合成含有棕榈酸、油酸和二十二碳六烯酸的结构脂质,新合成的结构脂质具有理想脂肪酸分布,适用于婴儿配方食品。据Moreira 等[9]报道,摄入含完全氢化蛤蟆油的结构脂质的C57BL/6 小鼠,与摄入普通未加工油脂的小鼠相比体重增加较小,表明添加的结构脂质具有抑制肥胖的作用。Kanjilal 等[10]报道,给大鼠和兔子饲喂含有山嵛酸乙酯的低热量结构脂质,其血清和肝脏脂质指标明显低于只摄入普通油脂饮食的对照组。Zhao 等[11]以高度氢化的大豆油、樟树籽油和紫苏油为底物,通过酯交换反应合成结构脂质,获得的产物中不含有反式脂肪酸,该低-反式或无-反式工艺可大大降低反式脂肪酸的摄入,从而达到降低冠心病的风险。月桂酸为中链脂肪酸,与长链脂肪酸相比更易溶解,在体内具有优先吸收和代谢的途径。通过研究摄入含月桂酸的结构脂质对小鼠血清生化指标和粪便脂质特性的影响,分析其控制肥胖的可能性。为此,通过酶促酯交换反应制备由大豆油和月桂酸配制的新型结构脂质,并向C57BL/6 小鼠饲喂不同量的结构脂质,监测1 个月内小鼠体重的变化,观察血清生化指标。最后通过评估大豆油-月桂酸结构脂质对C57BL/6 小鼠的脂质代谢水平,为依据消费者特殊需求和油脂的自身特性来“量身定做”有益的功能性食品和营养食品提供理论依据。
1 材料与方法
1.1 材料与试剂
特异性脂肪酶Lipozyme RM IM,丹麦Novozyme 公司;精炼大豆油,镇江中储粮油脂有限公司;月桂酸(>98%),麦克林生化科技有限公司;乙醚、异丙醇、氯仿、甲醇等有机试剂,国药集团化学试剂有限公司;总胆固醇(TC)含量检测试剂盒、甘油三酯(TG)含量检测试剂盒,北京索莱宝科技有限公司;高密度脂蛋白胆固醇(HDL-C)测定试剂盒、低密度脂蛋白胆固醇(LDL-C)测定试剂盒,南京建成生物工程研究所;丙氨酸氨基转移酶(ALT)试剂盒、天门冬氨酸氨基转移酶(AST)试剂盒,上海聚创医药科技有限公司。
1.2 仪器与设备
恒温水浴锅(HS-3001),太仓市科教器材厂;分光光度计(UVmini-1240),日本岛津公司;全自动生化分析仪(BS-350E),迈瑞公司;冰冻切片机(CM1520),德国Leica 公司;超低温冰箱,美国Thermo 公司;高速冷冻离心机 (Micro centrifuge 5415),德国Eppendorf 公司;显微镜(Bx51),日本olympus 公司。
1.3 结构脂质的制备
取质量比为1∶1 的大豆油和月桂酸于25 mL锥形瓶中,在45 ℃下加入12%(按底物质量计)Lipozyme RM IM 脂肪酶,以及8%(按底物质量计)的水,摇晃均匀,制备22 h 进行酯化,4 000 r/min 离心10 min 除去脂肪酶,并将反应产物进行旋转蒸发以除去溶液中的正己烷,得到MLM 型结构脂质的混合物,然后采用碱性萃取脱酸来去除结构脂质中的游离脂肪酸。
1.4 结构脂质的表征
1.4.1 结构脂质的分离纯化 参照Shimada 等[12]和潘向昆等[13]的碱性萃取脱酸法,除去制备结构脂质中的游离脂肪酸。
1.4.2 Sn-2 位置脂肪酸测定 参照Speranza 等[14]的方法采用猪胰脂肪酶水解方法测定油脂的Sn-2 位置脂肪酸组成。
1.4.3 结构脂质甘油三酯组成的测定 甘油三酯的组成变化参照Jennings 等[15]的方法用液相色谱方法测定。
1.5 动物实验
1.5.1 实验小鼠 C57BL/6J 小鼠广泛用于心血管
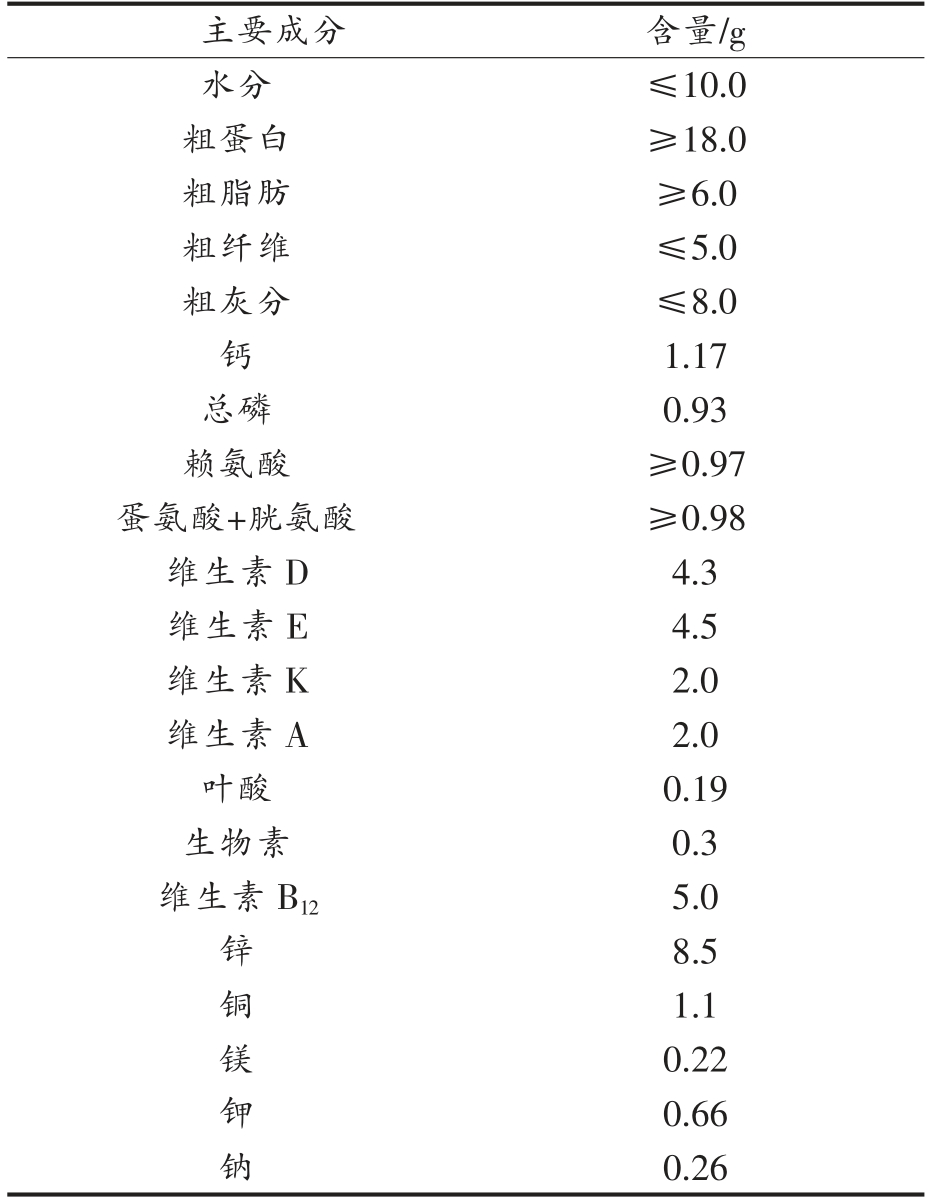
生物学、发育生物学、糖尿病和肥胖症、遗传学、免疫学、神经生物学和感觉神经研究。实验选用C57BL/6J 型小鼠购自北京维通利华实验动物有限公司,在无特定病原体(SPF)条件下繁殖。表1和表2列出了实验中喂养小鼠的普通日常饲料和高脂饲料的组成情况,其中高脂饲料所包含的热量明显高于日常饲料。
表1 实验小鼠日常饲料成分组成(每100 g 含量)
Table 1 Composition of experimental daily feed(100 g basis)
?
表2 实验小鼠高脂饲料成分组成(每100 g 含量)
Table 2 Composition of high-fat feed ingredients for experimental mice (w/w,100 g basis)
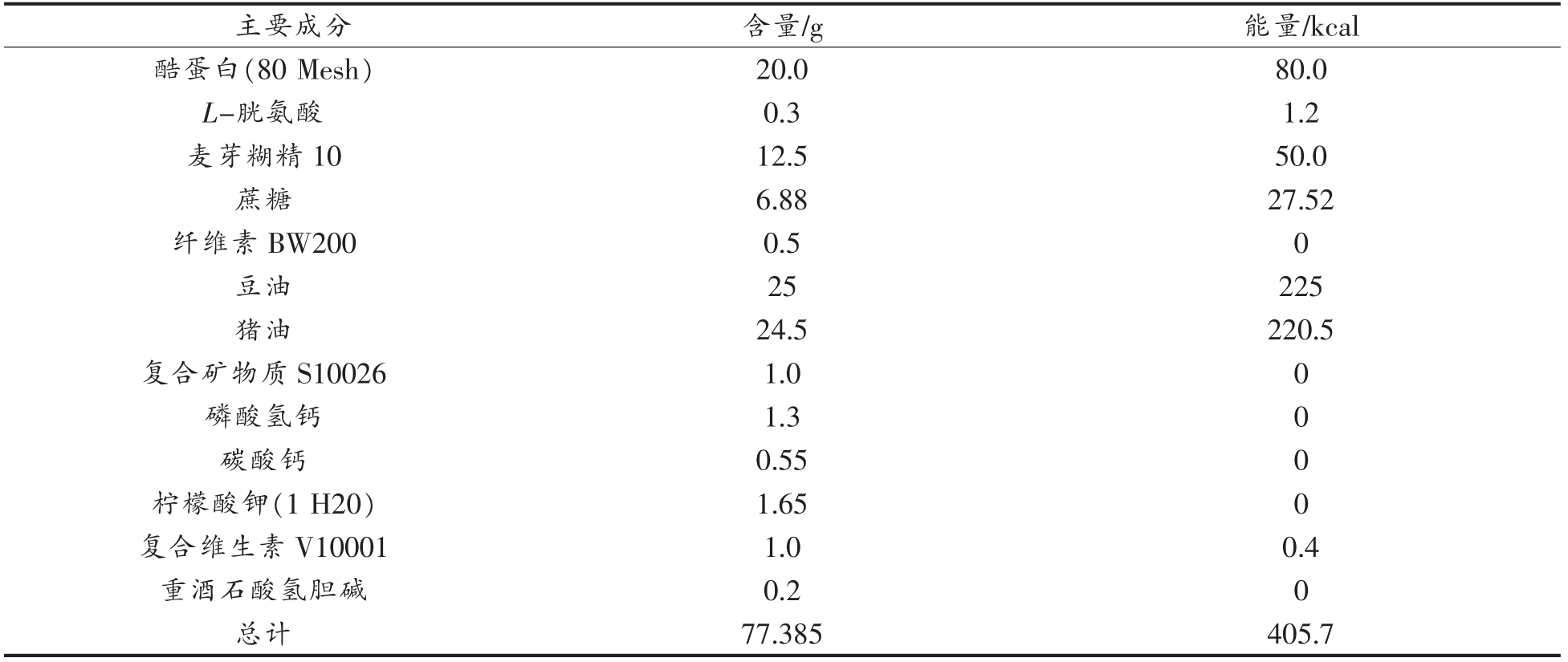
?主要成分 含量/g 能量/kcal酷蛋白(80 Mesh) 20.0 80.0 L-胱氨酸 0.3 1.2麦芽糊精10 12.5 50.0蔗糖 6.88 27.52纤维素BW200 0.5 0豆油 25 225猪油 24.5 220.5复合矿物质S10026 1.0 0磷酸氢钙 1.3 0碳酸钙 0.55 0柠檬酸钾(1 H20) 1.65 0复合维生素V10001 1.0 0.4重酒石酸氢胆碱 0.2 0总计 77.385 405.7
1.5.2 实验设计 在饲养期间,饲养环境为温度18~22 ℃,湿度50%~60%,小鼠自由饮水,另外每隔2 d 灌胃取样1 次。每次灌胃,普通大豆油和改良大豆油的量100 μL/10 g(油体积/小鼠体重)。实验中,将小鼠分为4 组,每组5 只,观察相关指标的变化。分组情况如表3所示。
表3 实验小鼠分组
Table 3 Grouping of experimental mice

组名 动物数/只 喂食饲料 灌胃样品普通饲料+生理盐水组(DF+NS) 5 普通饲料 生理盐水高脂饲料+结构脂质组(HF+LaSLs) 5 高脂饲料 改良大豆油(月桂酸型结构脂质)普通饲料+大豆油组(DF+SO) 5 普通饲料 普通大豆油普通饲料+结构脂质组(DF+LaSLs) 5 普通饲料 改良大豆油(月桂酸型结构脂质)
1.5.3 脏器指数计算 实验周期结束后,所有饲养实验小鼠禁食24 h,用乙醚麻醉摘取其肝脏、肾脏、心脏和胰脏并按照公式(1)计算脏器指数。
式中,VI——脏器指数,%;M1——小鼠内脏质量,g;M2——小鼠体重,g。
1.5.4 小鼠体重和粪便质量的测量 在第1 次喂养小鼠当天以及最后1 d 分别测量小鼠体重,并在饲养期间每隔2 d 测量1 次体重,以便观察变化。
1.5.5 血清指标及ALT、AST 酶活测定 摘眼球取血,4 000 r/min 离心5 min 分离血清,按测定试剂盒使用说明书测定血清中的总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)含量和丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)酶活。
1.5.6 肝脏和粪便中脂质的提取方法 根据Folch 等[16]描述的方法提取小鼠肝脏和粪便中的脂质。首先,取0.1 g 肝脏,剪碎组织,并转移至装有1.5 mL 氯仿/甲醇(2∶1,体积比)的试管中;将该混合物在4 ℃下匀浆5 min,室温1 500 r/min 离心10 min,得到两相液面,用甲醇和水(1∶1,体积比)清洗两相液交界面1~2 次;取下氯仿相,用氮气吹干氯仿,称量脂质质量。
粪便中脂质提取方法:将冰箱中冷冻保存的小鼠粪便,高温烘干,研磨成粉末,取0.1 g,其余步骤同上节肝脏中脂质的提取方法。
1.5.7 小鼠肝脏组织HE 染色 为了防止细胞在坏死后自溶或细菌分解,固定小鼠肝脏组织,使用4%多聚甲醛,使组织中蛋白质变性凝固,脱水剂为低浓度到高浓度的乙醇。将小鼠肝脏皮肤完全浸入石蜡,进行包埋,并将包埋好的蜡块固定于切片机上切片。切好的组织薄片置于载玻片上,最后放在烘箱中烘干。HE 染色前,先使用二甲苯处理脱去石蜡,然后放入高浓度乙醇和低浓度乙醇溶液中,最后用苏木精-伊红(H&E)染色,树脂封片。
1.6 数据分析
实验结果表示为“平均值±标准偏差”,每组实验重复3 次。数据处理及方差分析采用GraphPad Prism 5(GraphPad Software,La Jolla,CA,USA)以及SPSS 19.0 统计分析软件包,图中不同字母表示具有显著性差异(P<0.05)。
2 结果与分析
2.1 结构脂质的脂肪酸组成分析
表4显示了大豆油和合成的新型结构脂质中的脂肪酸组成。大豆油中含有大量不饱和脂肪酸,其中含量最高的是亚油酸(C18∶2),约占54.51%±1.12%,其次是油酸(C18∶1),约占26.43%±0.56%,亚麻酸(C18∶3),约占7.61%±0.06%,而合成的结构脂质中主要脂肪酸为亚油酸 (C18∶2),约占40.71%±0.44%,月桂酸(C12∶0)约占29.17%±0.57%,油酸(C18∶1),约占15.79%±0.41%。此外,一些脂肪酸仅在结构脂质中的Sn-2 位置被检出,包括硬脂酸(C18∶0),约占5.23%±0.10%,月桂酸(C12∶0),约占4.89%±0.79%,以及山嵛酸(C22∶0),约占2.92%±0.06%。
表4 结构脂质中总脂肪酸含量以及Sn-2 位置上脂肪酸的分布(%)
Table 4 Regiospecific distribution of the fatty acids at the Sn-2 position and total fatty acids of structured lipids (%)
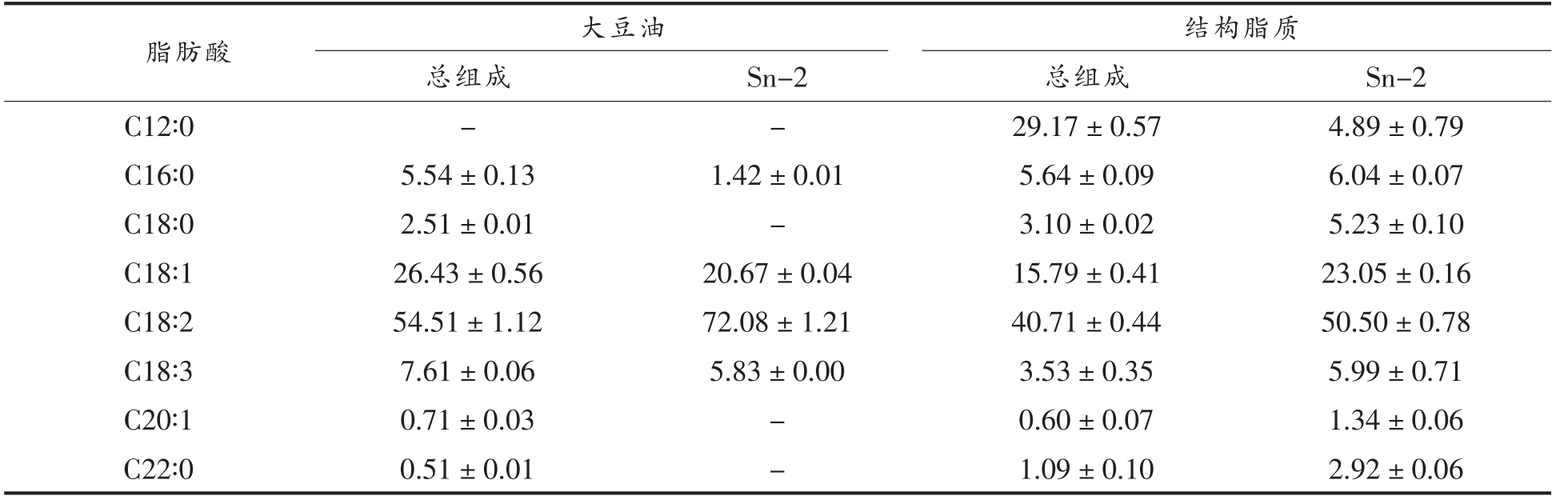
注:-.表示未检出。
?
2.2 结构脂质的甘油三酯组成分析
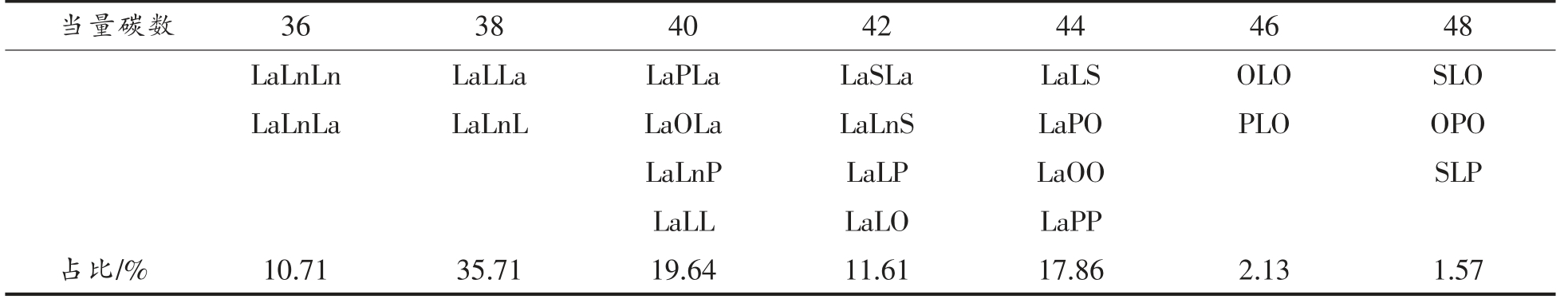
图1a 和1b 分别显示了大豆油和结构脂质中甘油三酯组成的液相色谱图,具体甘油三酯组成显示在表5和表6中。在液相色谱图中,按照当量碳数色谱峰从左到右分别代表不同的甘油三脂种类,其保留时间与其所含碳原子数以及双键数成线性关系。这是由于甘油三酯在液相色谱柱中按照一定的出峰规律被洗脱分离。其中,当量碳数ECN=CN-2n(CN 为碳原子数量,n 为不饱和键数量)。当量碳数小的先被洗脱出来,当量碳数大的后被洗脱出来。当量碳数相同的时候,双键数量高的在前面出峰,双键数量低的在后面出峰。根据在甘油三酯标准品的出峰顺序规律可以得到甘油三脂的组成。其中大豆油中甘油三酯含量最高的为三亚油酸酯,然后是一亚麻酸二亚油酸甘油三酯、一油酸二亚油酸、一棕榈酸二亚油酸甘油三酯。大豆油-月桂酸合成的结构脂质被分成7 组甘油三酯种类,ECN 从36~48 之间。双取代的甘油三酯占总含量的66.06%,单取代甘油三酯占总含量的29.47%。
表5 大豆油甘油三酯组成
Table 5 Triglyceride composition of soybean oil
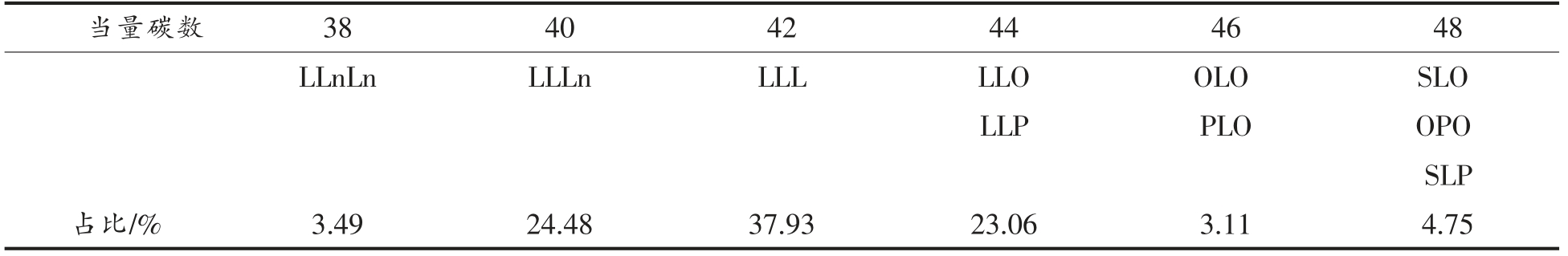
注:P.棕榈酸,S.硬脂酸,O.油酸,L.亚油酸,Ln.亚麻酸。
?
表6 大豆油-月桂酸结构脂质甘油三酯组成
Table 6 Triglyceride composition of structural lipids
注:La.月桂酸,P.棕榈酸,S.硬脂酸,O.油酸,L.亚油酸,Ln.亚麻酸。
?
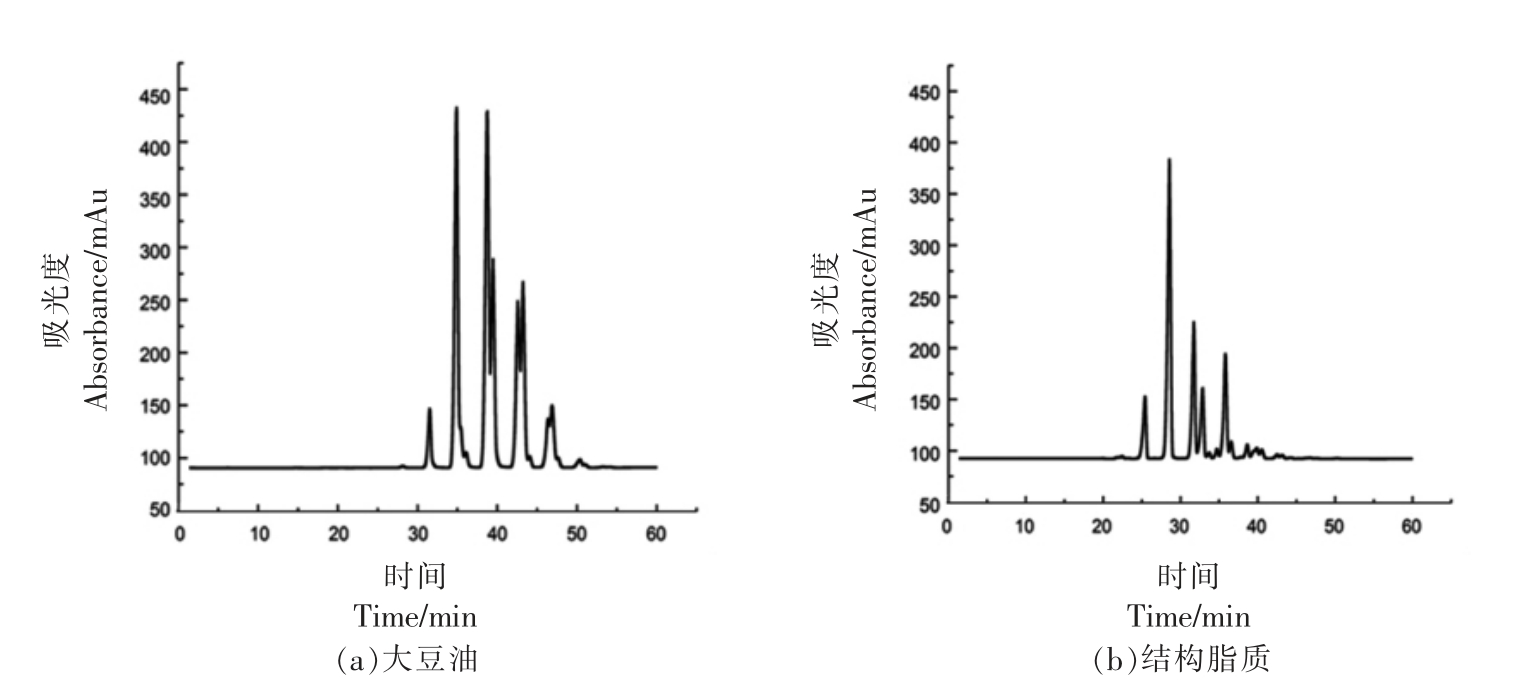
图1 甘油三酯的液相色谱图
Fig.1 Liquid chromatogram of TAG
2.3 结构脂质对小鼠体重变化的影响
图2a 表现出30 d 中每组小鼠的饮食量情况,可以看出彼此之间饮食量没有明显差异,说明小鼠体重的变化没有受到饮食量不同的影响。图2b反应了30 d 不同饲料喂养期间小鼠体重的变化情况,对DF+NS、HF+LaSLs、DF+SO、DF+LaSLs 4组喂养的小鼠进行对比,发现在饲养小鼠的1~10 d,4 组小鼠体重的增长趋势基本一致。而10~30 d 时小鼠体重变化趋势出现了偏离,其中,DF+NS 组小鼠体重增长最为平缓,而DF+SO 组小鼠体重增长最快。HF+LaSLs 组小鼠的体重在16 d增长达到最大值后开始变缓,DF+LaSLs 组小鼠的体重增长一直保持比较平缓的趋势。综上所述,通过4 组小鼠体重的对比发现,月桂酸型结构脂质可以有效的控制小鼠体重的增加,对肥胖的抑制起到了一定的作用。这可能是由于饮食中补充的中链脂肪酸相比于长链脂肪酸,可以增加能量消耗,减少脂肪的堆积,从而起到控制体重的效果。
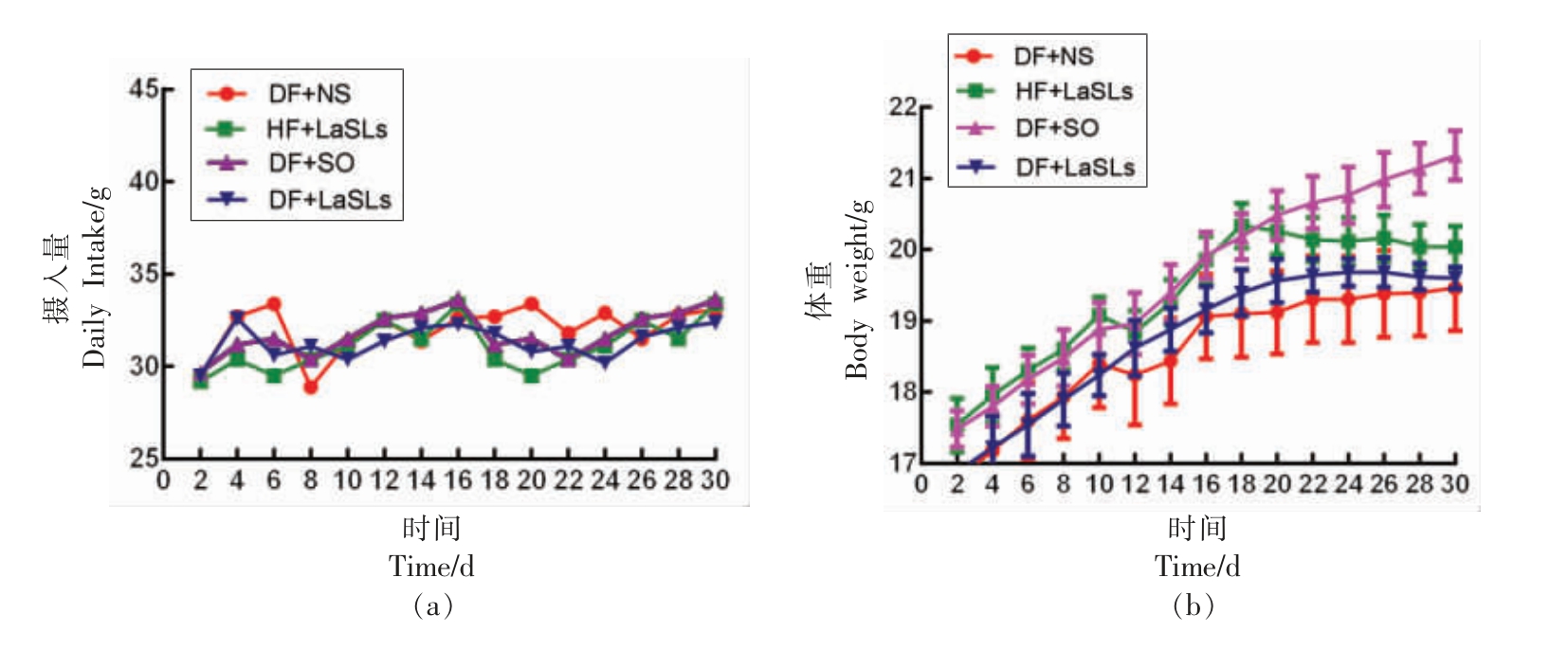
图2 不同饲料喂养30 d 内小鼠饮食量和体重的变化
Fig.2 Dietary intake per mouse and body weight changes of mice eating different feed during 30 days
2.4 结构脂质对甘油三酯、总胆固醇、高密度胆固醇和低密度胆固醇水平的影响
如图3所示,小鼠喂养30 d 后,饮食中含有结构脂质的小鼠组(HF+LaSLs 和DF+LaSLs 组)的血清胆固醇和甘油三酯水平显著低于DF+SO组的小鼠,后者的TG 水平达到了 (108.2±3.82)mg/dL,TC 水平达到了(87.92±1.65)mg/dL。所有4个组的HDL-C 水平均存在显著差异,其中DF+SO 组的HDL-C 水平最高,达到了(72.14±1.13)mg/dL。上述观察结果表明,LaSLs 可以有效改善C57BL/6J 小鼠的脂质代谢(P<0.05)。
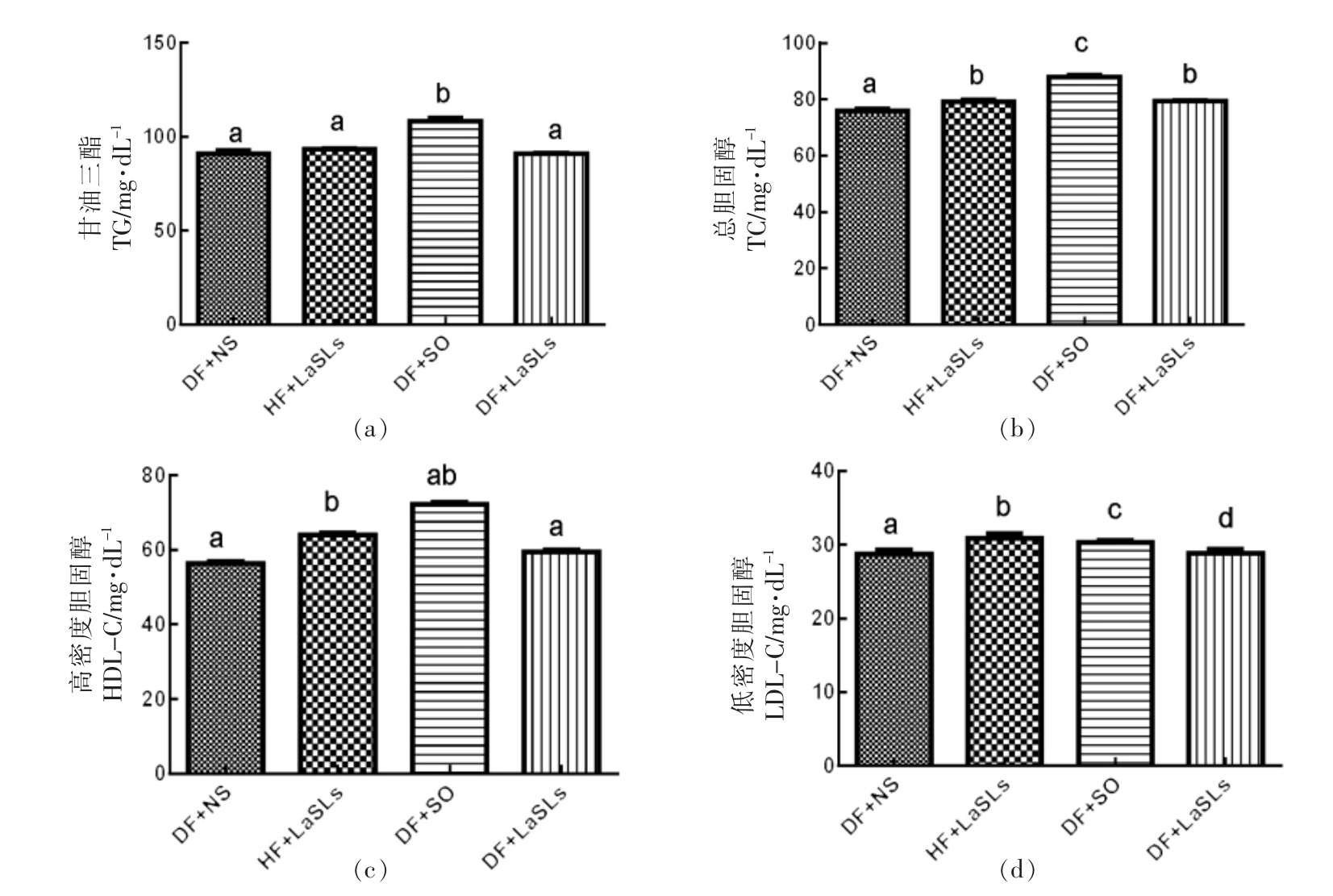
图3 结构脂质对甘油三酯(a)、总胆固醇(b)、高密度胆固醇(c)和低密度胆固醇(d)水平的影响
Fig.3 Effect of structural lipid on the level of TG (a),TC (b),HDL-C (c) and LDL-C (d) in mice
注:小鼠体内各脂质代谢水平显著差异用不同字母表示。
2.5 结构脂质对小鼠肝功能的影响
4 组的ALT 和AST 活性如图4所示。DF+NS,HF+LaSLs 和DF+LaSLs 组之间的血清ALT浓度没有显著差异,从(23.24±3.58)U/L 到(26.46±1.82)U/L,然而比DF+SO 组的平均水平(29.03±3.31)U/L 低15%。同样,DF+SO 组的AST 值最高,为(126.14±4.25)U/L,其次是HF+LaSLs 组,为(109.59±5.12)U/L。接受正常喂养的小鼠组,即DF+NS 组和DF+LaSLs 组均未观察到显著差异,二者均显示AST 的最低值为(104.47±4.28)U/L 和(101.82±4.69)U/L,分别比DF+SO 组低5%和19.27%(P<0.05)。
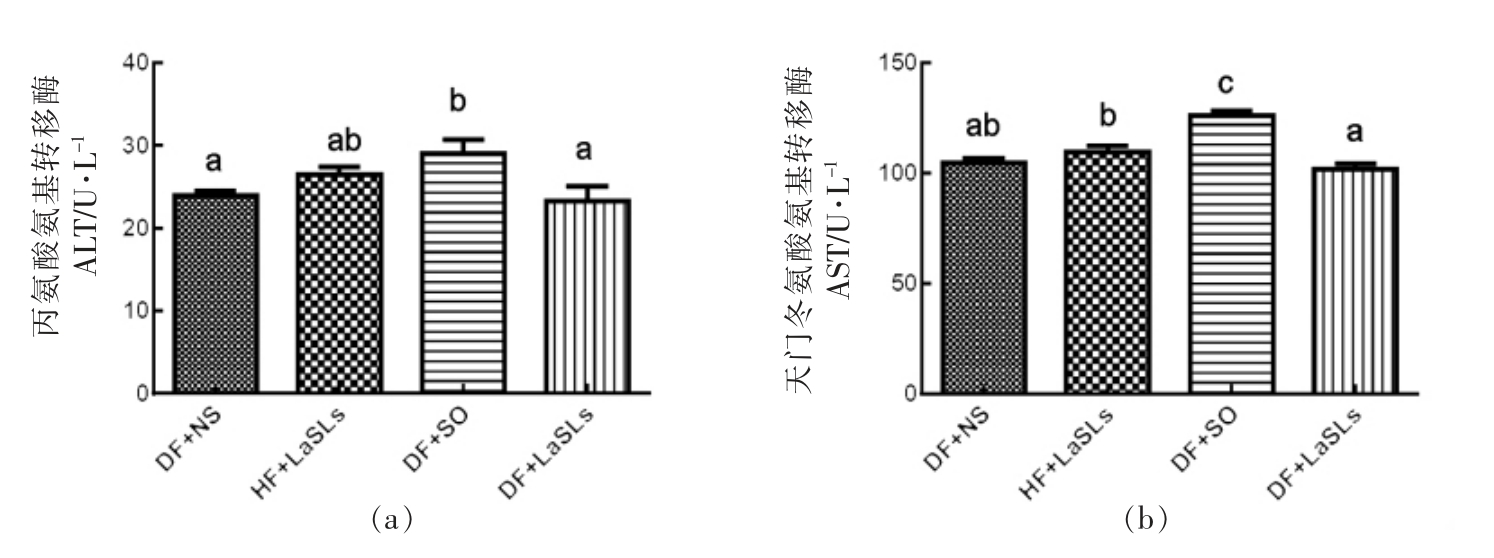
图4 结构脂质对小鼠体内ALT(a)和AST(b)水平的影响
Fig.4 Effect of structural lipid on the level of ALT (a) and AST (b) in mice
注:小鼠体内ALT、AST 水平显著差异用不同字母表示。
2.6 结构脂质对小鼠肝脏和粪便中总脂肪含量水平的影响
图5显示了4 组饲喂不同饮食的小鼠肝脏和粪便中的总脂肪含量。与3 个实验组 (DF+NS,DF+SO,DF+LaSLs)相比较时,大豆油喂养的小鼠的肝脏中总脂肪含量最高,为17.78%±0.48%,分别显著高于DF+NS 组(14.3%±0.37%)和DF+LaSLs 组(14.42%±0.41%)(图5a)。相反,饲喂大豆油的小鼠粪便中的总脂肪含量最低(9.3%±0.1%),与DF+NS 组无显著差异(图5b)。在4 组中,DF+LaSLs 组的粪便中脂肪含量最高(12.2%±0.19%),其次是HF+LaSLs 组(11.48%±0.44%),两者均显著高于其它两组(P<0.05)。
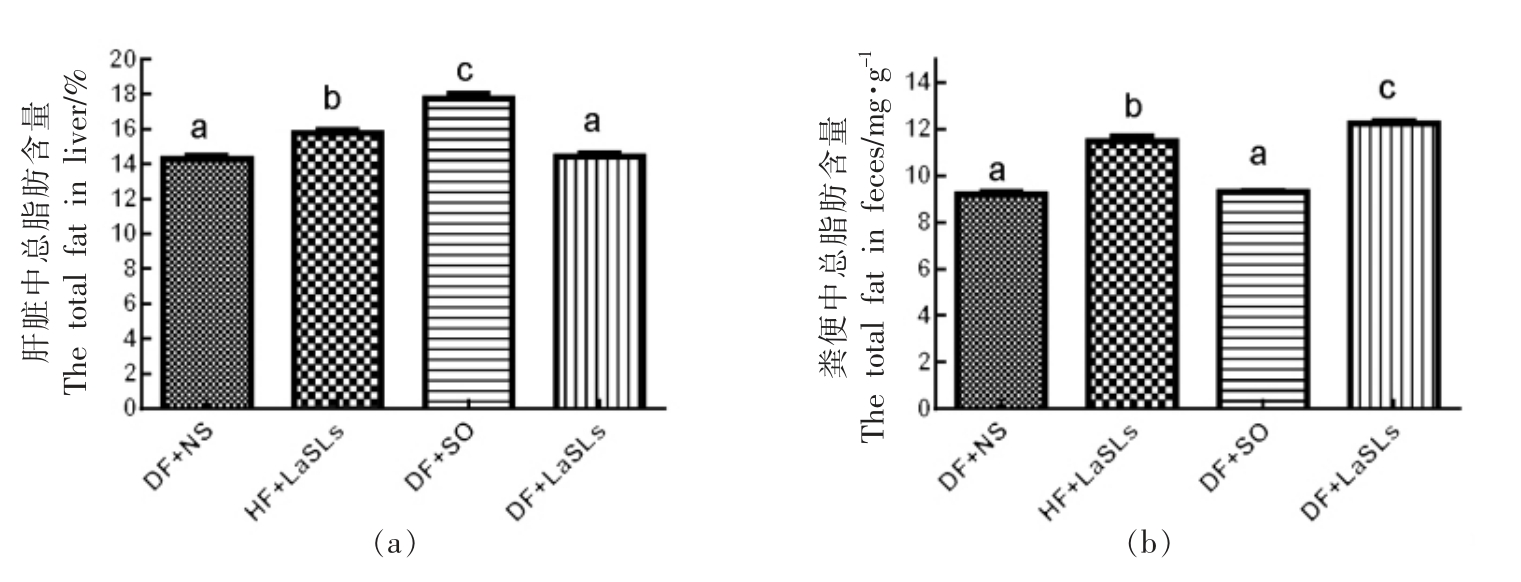
图5 结构脂质对小鼠肝脏(a)和粪便(b)中总脂肪含量水平的影响
Fig.5 Effect of structural lipid on the level of the total fat in liver (a) and in feces (b) of mice
注:小鼠体内肝脏及粪便中总脂肪含量显著差异用不同字母表示。
2.7 结构脂质对小鼠脏器指数的影响
4 个实验组的胰腺指数、心脏指数、肾脏指数和肝脏指数水平分别如图6a~6d 所示。在1 个月的治疗中,饲喂结构脂质的小鼠组的脏器指数水平与其它组之间没有观察到显著差异。值得注意的是,除心脏指数外,DF+SO 组的胰腺指数和肝脏指数均高于其它组,而肾脏指数则较低(P<0.05)。
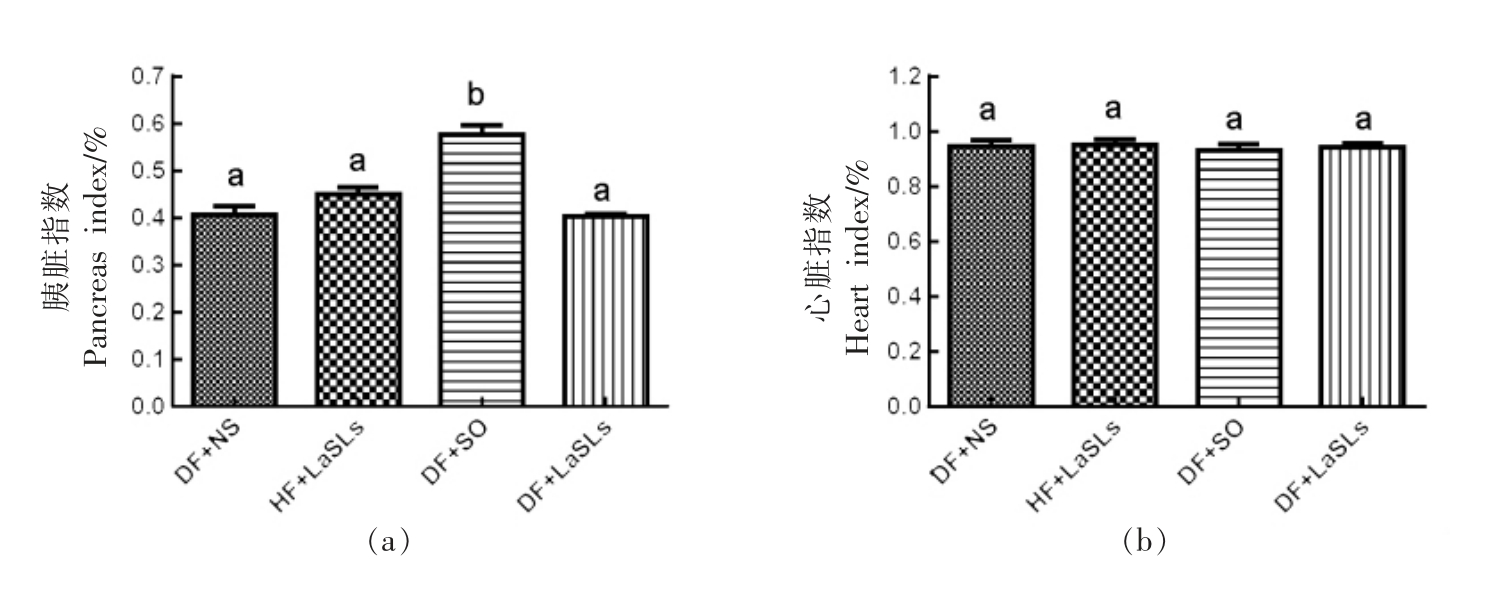
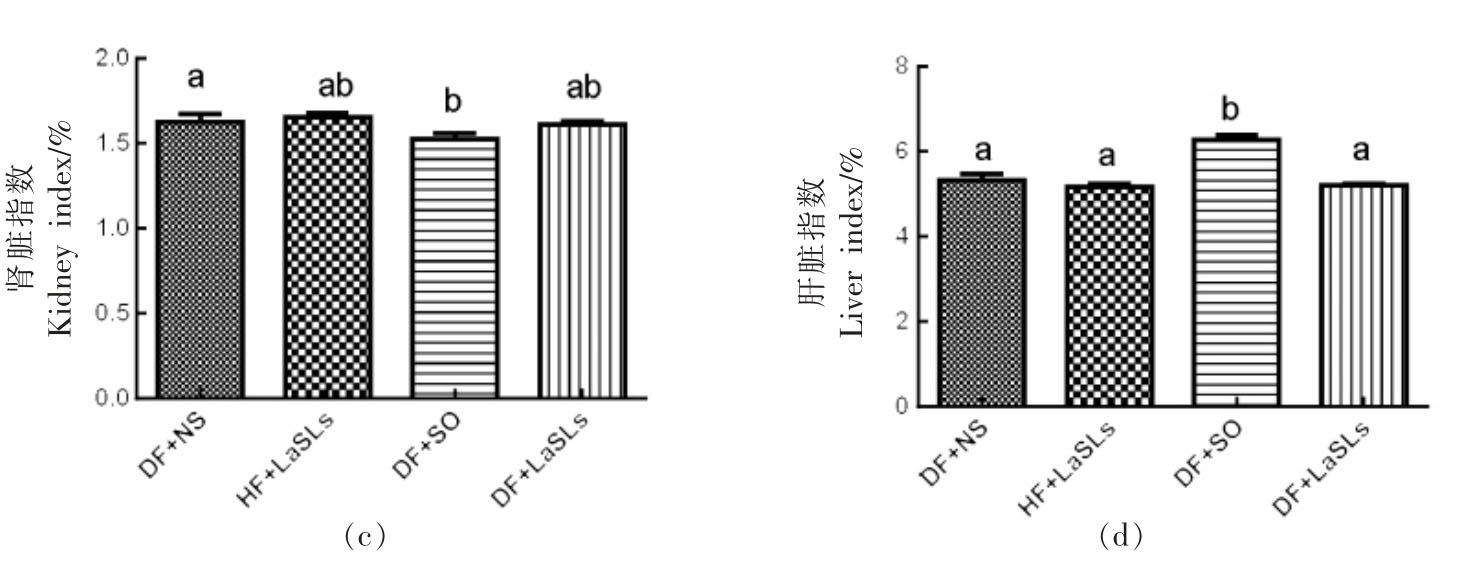
图6 结构脂质对小鼠体内脏器指数水平的影响
Fig.6 Effect of structural lipid on the level of the visceral index in mice
注:小鼠体内脏器指数水平显著差异用不同字母表示。
2.8 结构脂质对小鼠肝脏切片的影响
图7显示的是不同饲料喂养情况下小鼠肝脏病理学切片HE 染色后的对比图。与DF+NS 组相比,DF+SO 组中出现大量的脂肪空泡,肝细胞排列紊乱,说明肝脏中脂肪含量升高。与DF+SO 组相比,HF+LaSLs 组中脂肪空泡减少,肝细胞排列有一定的规律,DF+LaSLs 组的肝脏中脂肪空泡较少,细胞形态稳定,排列有序,说明大豆油-月桂酸结构脂质能够有效减少肝脏中脂肪的含量。
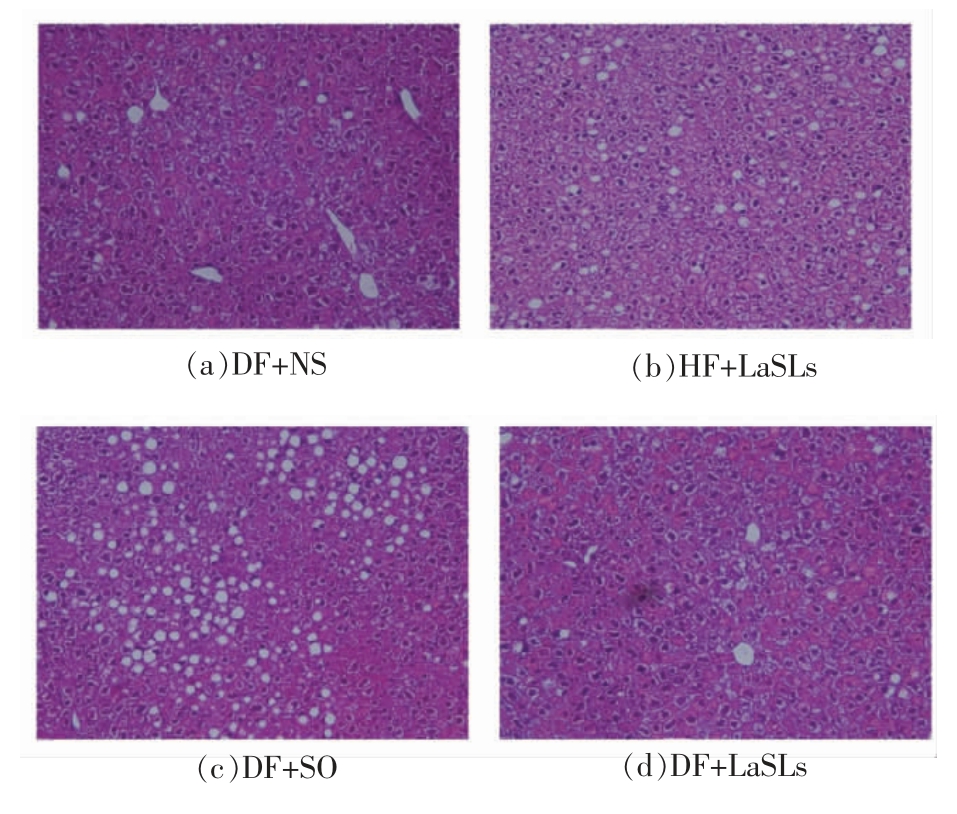
图7 小鼠肝脏病理学切片图(200×)
Fig.7 Pathologica change of mice liver (200×)
3 讨论
在这项研究中,通过比较4 组实验小鼠的体重,可以合理地推测饮食中的大豆油-月桂酸结构脂质,可以增加能量消耗,减少脂肪积累,抑制体重增加。甘油三酯和胆固醇都是中性脂肪,由3 分子脂肪酸和1 分子甘油酯组成,它们是体内能量的主要来源。TG 处于脂蛋白的核心,在血液中以脂蛋白形式运输。甘油三酯过量囤积就会产生肥胖。胆固醇在体内有着广泛的生理作用,然而当其过量时便会导致高胆固醇血症,对机体产生不利影响[17-19]。中链脂肪酸具有较高的水溶性,较小的分子大小和较短的链长,因此中链脂肪酸也比长链脂肪酸在胃中更易挥发和吸收[4,20]。同样灌胃结构脂质的小鼠中,HF+LaSLs 组的小鼠并没有因为饲料中高脂含量而增加胆固醇以及甘油三酯含量。研究表明,这些结果可能是由于胆固醇合成中的重要酶(3-羟基-3-甲基戊二酰-CoA) 活性降低。接受SL 饮食的小鼠 (HF+LaSLs 和DF+LaSLs) 的血清胆固醇和甘油三酯水平低于DF+SO 组的小鼠。可能是与LCT 相比,MLCT 具有更低的热利用率,更高的水溶性,更小的分子质量和更短的链长[17,21-24]。此外,虽然HF+LaSLs 组的小鼠在日常饮食中脂肪含量更高,但其胆固醇和甘油三酯水平没有显著增加,这表明MLCTs 比LCTs在胃中的挥发性和吸收性更高。
有研究表明高密度胆固醇具有预防动脉粥样硬化,降低冠心病病死率的作用。而L-DLC 是“有害”的胆固醇,可引起脂肪堆积并损害血管壁[1,25-26]。如图3所示,在实验中后2 个喂食普通饲料组(DF+LaSLs 和DF+SO)与DF+NS 组相比,高密度胆固醇含量没有显著性差异(P>0.05),就LDL-C水平而言,饲喂结构脂质的小鼠 (DF+LaSLs 和DF+SO)与DF+NS 组之间无显著差异,而与DF+LaSLs 组相比,DF+SO 组中的LDL-c 含量显著增加,表明LaSLs 可以有效抑制机体内低密度胆固醇的增加。据报道,短链脂肪酸(SCFA)通过刺激胆汁酸分泌来抑制小肠和肝脏中的胆固醇合成[27]。然而,中链脂肪酸(MCFA)对血清胆固醇的作用机制是否相似,尚待进一步研究。
实验中还考察了结构脂质对小鼠肝功能的影响,其中丙氨酸氨基转移酶(ALT)和天门冬氨酸氨基转移酶(AST),是肝功能检测里的重要指标,ALT 存在于肝细胞胞浆内,而AST 主要存在于肝细胞线粒体里。在肝组织出现坏死或者损伤情况时,肝细胞内的酶会被释放到血液中,导致血液中酶活力升高[22,28-30]。在研究中,排除肝外脏器官病变,如心肌炎、心肌梗塞的情况下,可以通过观察氨基转移酶活性的高低来判断肝脏的健康情况[31]。本研究表明,在喂食LaSLs 的小鼠中,ALT和AST 的水平没有显著差异。
大部分脂质代谢、吸收、分解和合成都在肝脏中完成[32]。在这项研究中,虽然高脂饮食含有更多的脂质,但是HF+LaSLs 组小鼠肝脏的总脂肪含量明显低于正常饮食的大豆油组。另外,DF+SO组和DF+NS 组的粪便中脂肪含量没有显著差异,二者均高于DF+LaSLs 组,表明大豆油-月桂酸结构脂质有促进脂质消化,减少脂质堆积的效果。与长链脂肪酸(LCFA)不同,MCFA 不需要在运输过程中与其它甘油或甘油单酸酯形成乳糜微粒,同时它们也难以与蛋白质形成脂蛋白,因此可以直接被肠上皮组织吸收,然后通过门静脉迅速进入血液,从而节省了大量的消化时间。因此,MLM 型结构脂质具有减少脂质堆积,抑制肥胖症及相关疾病的潜力[33-35]。
胰脏、心脏、肾脏和肝脏在人体内扮演着很重要的角色,发挥着重要作用。肝脏在血浆脂蛋白和内源性脂质的生产和分解代谢中起到非常重要的作用,在脂质代谢紊乱时,脂质会在肝脏中堆积造成肝脏质量的增加[20,36-37]。以肝脏指数为例,虽然HF+LaSLs 组的小鼠饮食中含有大量的脂质成分,但是由于存在大豆油-月桂酸结构脂质,肝脏中不会积累过多的脂质。Takeuchi 等[38]研究了含有中链和长链脂肪酸的流质饮食对6 名年轻男子的影响,未发现肝指数有明显变化。另外,与DF+NS组和DF+LaSLs 组,DF+NS 组和DF+SO 组,DF+LaSLs 组和DF+SO 组相比,大豆油喂养的小鼠组的肝脏指数明显增加,而饮食中摄入结构脂质和生理盐水的小鼠组之间无明显差异(P<0.05),由此表明大豆油-月桂酸结构脂质不会影响器官的正常形态,同时还可促进脂质的消化和代谢从而达到控制体重的效果。
4 结论
通过动物实验研究表明,大豆油-月桂酸结构脂质可以通过调节脂质代谢,从而达到抑制肥胖的作用。在不损害器官组织的情况下,不仅可以抑制小鼠体重的增长,还能有效调节小鼠体内血清理化指标以及肝脏和粪便中脂肪总含量水平,同时肝脏组织也未发生病变。因此,本研究为大豆油-月桂酸结构脂质在减少体内脂质堆积,促进脂质代谢和抑制肥胖而不引起副作用的新型食品开发应用提供理论依据。
[1]孙静,邓斌,凌文华,等.中链甘油三酯干预对2型糖尿病血脂和血浆游离脂肪酸的影响[J].中华临床营养杂志,2007,15(5):289-294.
SUN J,DENG B,LING W H,et al.Effect of medium chain triglyceride on blood lipids and free fatty acid in patients with type 2 diabetes[J].Chinese Journal of Clinical Nutrition,2007,15(5):289-294.
[2]熊霜,肖美添,叶静.复合型海藻膳食纤维功能食品的降血脂作用[J].食品科学,2014,35(17):220-225.
XIONG S,XIAO M T,YE J.Hypolipidemic effect of functional foods containing dietary fiber from edible seaweeds[J].Food Science,2014,35(17):220-225.
[3]杨丽睿,张慧敏.肥胖高血压发病机制研究现状[J].心血管病学进展,2013,34(2):182-185.
YANG L R,ZHANG H M.The blood pressure control of obesity-related hypertension[J].Advances in Cardiovascular Diseases[J].2013,34(2):182-185.
[4]MUMME K,STONEHOUSE W.Effects of mediumchain triglycerides on weight loss and body composition:A meta-analysis of randomized controlled trials[J].Journal of the Academy of Nutrition and Dietetics,2015,115(2):249-263.
[5]KHALESI S,JAMALUDDIN R,ISMAIL A.Effect of raw and heated flaxseed (Linum usitatissimum L.) on blood lipid profiles in rats[J].International Journal of Applied Science and Technology,2011,1(4):84-89.
[6]GRUCZYNSKA E,PRZYBYLSKI R,ALADEDUNYE F.Performance of structured lipids incorporating selected phenolic and ascorbic acids[J].Food Chemistry,2015,173:778-783.
[7]AKANBI T O,BARROW C J.Lipase-catalysed incorporation of EPA into emu oil:Formation and characterisation of new structured lipids[J].Journal of Functional Foods,2015,19:801-809.
[8]PANDE G,SABIR J S M,BAESHEN N A,et al.Synthesis of infant formula fat analogs enriched with DHA from extra virgin olive oil and tripalmitin[J].Journal of the American Oil Chemists' Society,2013,90(9):1311-1318.
[9]MOREIRA D K,SANTOS P S,GAMBERO A,et al.Evaluation of structured lipids with behenic acid in the prevention of obesity[J].Food Research International,2017,95:52-58.
[10]KANJILAL S,KAKI S S,RAO B V,et al.Hypocholesterolemic effects of low calorie structured lipids on rats and rabbits fed on normal and atherogenic diet[J].Food Chemistry,2013,136(1):259-265.
[11]ZHAO M L,TANG L,ZHU X M,et al.Enzymatic production of zero-trans plastic fat rich in αlinolenic acid and medium-chain fatty acids from highly hydrogenated soybean oil,Cinnamomum camphora seed oil,and perilla oil by lipozyme TL IM[J].Journal of Agricultural and Food Chemistry,2013,61(6):1189-1195.
[12]SHIMADA Y,MARUYAMA K,SUGIHARA A,et al.Purification of docosahexaenoic acid from tuna oil by a two-step enzymatic method:Hydrolysis and selective esterification[J].Journal of the American Oil Chemists Society,1997,74(11):1441-1446.
[13]潘向昆,王瑛瑶,刘建学,等.KOH 醇水溶液分离纯化结构脂质条件研究 [J].中国油脂,2012,37(8):39-42.
PAN X K,WANG Y Y,LIU J X,et al.Purification of structured lipids by KOH-hydroalcoholic solution[J].China Oils and Fats,2012,37(8):39-42.
[14]SPERANZA P,MACEDO G A.Lipase-mediated production of specific lipids with improved biological and physicochemical properties[J].Process Biochemistry,2012,47(12):1699-1706.
[15]JENNINGS B H,AKOH C C.Characterization of a rice bran oil structured lipid[J].Journal of Agricultural and Food Chemistry,2009,57(8):3346-3350.
[16]FOLCH J,LEES M,STANLEY G H S.A simple method for the isolation and purification of total lipides from animal tissues[J].Journal of Biological Chemistry,1957,226(1):495-509.
[17]LIU J,LI Y,SHI H,et al.Components characterization of total tetraploid jiaogulan (Gynostemma pentaphyllum) saponin and its cholesterol-lowering properties[J].Journal of Functional Foods,2016,23:542-555.
[18]HOFFMAN D R,BOETTCHER J A,DIERSENSCHADE D A.Toward optimizing vision and cognition in term infants by dietary docosahexaenoic and arachidonic acid supplementation:A review of randomized controlled trials[J].Prostaglandins Leukotrienes& Essential Fatty Acids,2009,81(2):151-158.
[19]张月红,刘英华,王觐,等.中长链脂肪酸食用油降低超重高甘油三酯患者血脂和低密度脂蛋白胆固醇水平的研究[J].中国食品学报,2010,10(2):20-27.
ZHANG Y H,LIU Y H,WANG J,et al.Study on the medium-and long-chain fatty acid in dietary oil decrease blood triglyceride and LDL-C in overweight and primary hypertriglyceridemic chinese subjects[J].Journal of Chinese Institute of Food Science and Technology,2010,10(2):20-27.
[20]WIRKOWSKA-WOJDYŁA M,BRY S J,GÓRSKA A,et al.Oxidation kinetics and melting profiles of the structured lipids used in infant cookies[J].European Journal of Lipid Science & Technology,2015,116(11):1546-1552.
[21]STAMATIS H,XENAKIS A,PROVELEGIOU M,et al.Esterification reactions catalyzed by lipases in microemulsions:The role of enzyme localization in relation to its selectivity[J].Biotechnology & Bioengineering,1993,42(1):103.
[22]BOMSCHEUER U T.Enzymes in lipid modification[J].Annual Review of Food Science and Technology,2018,9:85-103.
[23]张永,刘英华,王觐,等.中长链脂肪酸食用油对不同BMI 男性高甘油三酯血症体脂肪的影响[J].实用预防医学,2008,15(5):1395-1398.
ZHANG Y,LIU Y H,WANG J,et al.Effects of medium-and long-chain fatty acids edible oil on body fat composition in male hypertriglycerideamic subjects with different BMI[J].Practical Preventive Medicine,2008,15(5):1395-1398.
[24]MATSUO T,MATSUO M,TAGUCHI N,et al.The thermic effect is greater for structured medium-and long-chain triacylglycerols versus long-chain triacylglycerols in healthy young women[J].Metabolismclinical & Experimental,2001,50(1):125-130.
[25]ZHOU S,WANG Y,JACOBY J J,et al.Effects of medium-and long-chain triacylglycerols on lipid metabolism and gut microbiota composition in C57BL/6J mice[J].Journal of Agricultural and Food Chemistry,2017,65(31):6599-6607.
[26]李金华.高密度胆固醇对心脏的影响[J].心血管病防治知识(科普版),2013(2):60.
LI J H.Effects of HDL-C on the heart[J].Prevention and Treatment of Cardiovascular Disease,2013(2):60.
[27]LONG Z,PANDE G,AKOH C C.Infant formula fat analogs and human milk fat:New focus on infant developmental needs[J].Annual Review of Food Science and Technology,2016,7(1):139-165.
[28]LI X,CHEN J F,YANG B,et al.Production of structured phosphatidylcholine with high content of DHA/EPA by immobilized phospholipase A1-catalyzed transesterification[J].International Journal of Molecular Sciences,2014,15(9):15244-15258.
[29]WANG B,FU J,LI L,et al.Medium-chain fatty acid reduces lipid accumulation by regulating expression of lipid-sensing genes in human liver cells with steatosis[J].International Journal of Food Sciences & Nutrition,2016,67(3):288-297.
[30]BROWN J M,RUDEL L L.Stearoyl-coenzyme A desaturase 1 inhibition and the metabolic syndrome:Considerations for future drug discovery[J].Current Opinion in Lipidology,2010,21(3):192.
[31]AKOH C C,YEE L N.Enzymatic synthesis of position-specific low-calorie structured lipids[J].Journal of the American Oil Chemists Society,1997,74(11):1409-1413.
[32]YANXIN W,BRYNN J V,SUMITHRA U,et al.The human fatty acid synthase gene and de novo lipogenesis are coordinately regulated in human adipose tissue[J].The Journal of Nutrition,2004,134(5):1032-1038.
[33]TUCCI S,BEHRINGER S,SPIEKERKOETTER U.De novo fatty acid biosynthesis and elongation in very long-chain acyl-CoA dehydrogenase-(VLCAD-/-) deficient mice supplemented with odd or even medium-chain fatty acids[J].The FEBS Journal,2015,282(21):4242-4253.
[34]SHINOHARA H,WU J,KASAI M,et al.Randomly interesterified triacylglycerol containing medium-and long-chain fatty acids stimulates fatty acid metabolism in white adipose tissue of rats[J].Bioscience,Biotechnology and Biochemistry,2006,70(12):2919-2926.
[35]PAULAUSKIS J D,SUL H S.Hormonal regulation of mouse fatty acid synthase gene transcription in liver[J].Journal of Biological Chemistry,1989,264(1):574-577.
[36]NUGRAHINI A D,SOERAWIDJAJA T H.Directed interesterification of coconut oil to produce structured lipid[J].Agriculture and Agricultural Science Procedia,2015,3:248-254.
[37]SALIE M J,THELEN J J.Regulation and structure of the heteromeric acetyl-CoA carboxylase[J].BBA-Molecular and Cell Biology of Lipids,2016,1861(9):1207-1213.
[38]TAKEUCHI H,KASAI M,TAGUCHI N,et al.Effect of triacylglycerols containing medium-and long-chain fatty acids on serum triacylglycerol levels and body fat in college athletes[J].Journal of Nutritional Science & Vitaminology,2002,48(2):109.