皇冠梨果皮洁净,呈黄色,果肉雪白,石细胞小,味美多汁,营养丰富,近年来深受广大消费者喜爱。皇冠梨主产于山东、河北等地,每年6、7月份收获,时值夏季,气温高,严重影响了果品贮藏品质[1]。低温(0 ℃)是皇冠梨最常见的贮藏手段,然而,在低温贮藏过程中果皮表面往往表现出不规则的淡褐色斑纹,呈半圆状,随着此症状的发展,淡褐色病斑逐步扩大,颜色加深且出现凹陷[2]。病果外观差,严重影响了果实的商品价值,该病症已成为制约黄冠梨产业发展的瓶颈问题。黄冠梨果皮褐变与组织中酚类物质代谢密切相关,商业上常用缓慢降温的方式来延缓病症的发生,可是该操作繁琐,不易控制,且控制效果不稳定,故而开发稳定、简易、高效的果皮褐变控制新技术成为黄冠梨产业发展的重要方向。
壳寡糖(Chitosan oligosaccharides,COS)是一种低聚合度水溶性的糖类,由2~10 个氨基葡萄糖通过β-l,4 糖苷键相连而成[3]。它具有分子质量小、水溶性好的特点。COS 价廉、无毒、可降解,可诱导植物产生抗病性。壳寡糖作为一种天然无毒的生物保鲜剂,在农业可持续发展过程中起着至关重要的作用。COS 对提高植物自身抗性,减少化学药品残留有巨大的应用价值[3]。
果蔬在逆境环境中会积累大量的活性氧,为避免活性氧的过度积累对质膜系统造成的破坏,果蔬会通过自身调节以减少活性氧对组织的破坏程度。壳寡糖处理可显著提高柑橘果皮中SOD、APX、POD、PPO、CAT 活性[4]。罗小芬等[5]研究发现壳聚糖涂膜处理番茄,可维持CAT、SOD 等保护酶较高的活性。陈喜文等[6]研究发现壳寡糖处理使得烟草叶片和黄瓜叶片中POD、CAT、SOD 等防御酶活性有所提高。Lin 等[7]研究发现采用0.5%浓度的壳寡糖处理后,杏梅果实的品质能够较好维持,且减缓了杏果实冷害的发生。
本课题组前期研究发现,COS 处理采后皇冠梨果实能有效抑制长期低温贮藏中果皮褐变症状的出现,然而对其抑制机理尚不清楚。本研究采用不同浓度的壳寡糖溶液处理皇冠梨果实,检测果皮中活性氧相关代谢变化,从活性氧代谢角度揭示低温下COS 抑制果皮褐变的机理。
1 材料与方法
1.1 材料与试剂
试验用皇冠梨采收自河北辛集李庄果园,采收时选择成熟度一致,大小均一、无伤,表皮无褐变的果实,果实用单果网套包裹,装入内衬保鲜袋的纸箱中。立即常温运至齐鲁工业大学果蔬贮藏与保鲜实验室。
试剂:食品级壳寡糖(平均分子量1 500~2 000,脱乙酰度95%),青岛红海生物技术有限公司;三氯乙酸、硫代巴比妥酸、氢氧化钠、愈创木酚、聚乙烯吡咯烷酮,上海泰坦科技股份有限公司;丙酮、无水乙醇、二硫酥糖醇、愈创木酚、30%H2O2、冰醋酸、浓硫酸,国药集团化学试剂有限公司。试验所用试剂均为分析纯级。
分别配制质量分数为0.25%,0.5%和1%的COS 水溶液,将预冷过后的梨果实完全置于上述常温溶液中,浸泡5 min,取出风干表面水分,经过商品化包装后置于0 ℃冷库中贮藏。每6 箱皇冠梨为一组处理,每箱32 个果实。空白对照果实用清水浸泡5 min,每组处理3 个重复。在贮藏的0,10,20,30,40 d 每组分别取出16 个梨测定果实硬度、果肉中可溶性固形物和可滴定酸的含量,称取上述样品的果皮测定果皮中丙二醛、过氧化氢、抗坏血酸总酚含量,同时测定果皮多酚氧化酶(Polyxidase oxidase,PPO)、脂氧合酶 (Lipoxygenase,LOX)、过氧化氢酶(Catalase,CAT)、抗坏血酸过氧化物酶(Ascorbate peroxidase,APX)、超氧化物歧化酶 (Superoxide dismutase,SOD)、苯丙氨酸解氨酶(Phenylalanineammonialyase,PAL)的活性。在贮藏的0,10,20,30,40 d 每组分别另外取出16 个皇冠梨果实置于室温(25 ℃)下3 d,模拟货架期试验,统计果皮褐变发病情况和褐变指数。
1.2 仪器与设备
GY-1 硬度计,浙江托普仪器有限公司;Pocket refractometer PAL-1 手持糖度计,日本ATAGO;V-1100D 型可见分光光度计,上海美谱达仪器有限公司;2006-11 恒温水浴锅,国华仪器有限公司;高速冷冻离心机(Allegra 64R),美菱科技有限公司;超声波清洗仪(GD0101),冠博科技实业有限公司;微型冷库,烟台睿加节能有限公司。
1.3 试验方法
1.3.1 果皮褐变发病率及褐变指数的测定
1)果品褐变发病率=(果皮褐变果实数/总果实数)×100%。
2)依据梨果皮表面褐变面积划分为5 个级别。0 级:果皮表面无褐色斑点;1 级:果实表面褐色斑点面积小于果实总表面积的10%;2 级:褐色斑点面积为果实总表面积的10%~20%;3 级:褐色斑点面积为果实总表面积的20%~40%;4 级:褐色斑点面积为果实总表面积的40%以上。果皮褐变指数=∑(褐变级别×该级别果实数)/(总果实数×最高褐变级数)×100%。
1.3.2 果实硬度、可溶性固形物和可滴定酸的测定 利用GY-1 硬度计(8 mm 探头)测定果实硬度,在每个梨果赤道线处对称选取两点去皮,压头与果肉切面垂直接触,用硬度计测定果肉硬度,单位为kg/cm2。
利用糖度计测定果实中可溶性固形物含量,将测定过硬度的梨果挤取适量皇冠梨汁液滴在PAL-1 手持糖度计上,读取数值并做好记录,单位为%。
利用氢氧化钠溶液滴定法测定果实可滴定酸含量[8]。精确称量10.0 g 样品并研磨成匀浆。之后,将样品放入100 mL 容量瓶中,加入蒸馏水定容。将样品溶液充分摇动并放置30 min,过滤。以1%酚酞指示剂,将20 mL 滤液转移至锥形瓶,再用标定过的氢氧化钠溶液滴定,记录用量并重复3 次。
1.3.3 多酚及丙二醛含量的测定 利用福林酚法测定果皮中总酚含量[8]。称取2 g 皇冠梨果皮样品,加入10 mL 70%丙酮,匀浆后避光提取2 h,4℃,10 000×g 离心15 min,取上清液。5 倍稀释的福林酚试剂与0.1 mL 提取液混合,静置5 min,与1 mL 质量分数6%的Na2CO3 溶液混合75 ℃水浴10 min,立即冰浴冷却至室温(20 ℃)。用没食子酸作为标准计样品总酚含量,单位为mg/g。
取1 g 新鲜果皮样品利用硫代巴比妥酸法测定果皮中丙二醛含量[8]。丙二醛含量=6.45×(A532nm-A600nm)-0.56×A450nm,单位为μmol/L。
1.3.4 抗坏血酸及过氧化氢含量的测定 利用高效液相色谱法测定果皮中抗坏血酸的含量[8]。称取1 g 果皮组织,加入体积为5 mL,浓度为20 mmol/L pH=2.1 的磷酸缓冲溶液(含1 mmol/L EDTA)研磨匀浆后4 ℃,10 000×g 离心15 min。提取液与二硫酥糖醇按4∶1 的体积比加入2 g/L 二硫苏糖醇,混匀,静置2 h,即为抗坏血酸待测液。过0.22 μm的水系滤膜后,进行HPLC-DAD 测定,检测波长为280 nm。根据抗化血酸标准品保留时间及色谱图峰面积确定样品中抗坏血酸含量。
果皮中过氧化氢含量测定方法如下,取4.0 g果皮样品与3 mL 冷的丙酮研磨匀浆。4 ℃10 000×g 离心10 min 取上清,1 mL 上清液与5%的硫酸钛及浓氨水混匀,10 000×g 离心15 min 后去除上清,加入硫酸使管底沉淀完全溶解,在波长410 nm 处测定吸光值,根据结果制作标准曲线,计算果皮中过氧化氢的含量。
1.3.5 LOX 与抗氧化体系相关酶活性的测定 称取2 g 梨果皮样品与4 ℃5 mL 磷酸缓冲液(pH=7.8,含有0.1 mol/L PMSF,0.5 mmol/L 乙二胺四乙酸,5%聚乙烯吡咯烷酮和1 mmol/L 二硫苏糖醇)研磨混匀后4 ℃,10 000×g 离心30 min,取上清分装,-80 ℃保存备用[8]。
1)LOX 活性测定 采用Todd 等[9]的方法测定LOX 活性,将每分钟吸光值上升0.01 定义为1个酶活性单位(U),结果以U/mg 表示。
2)SOD 活性测定[10] 50 mmol/L 磷酸缓冲液(pH=7.8 含130 mmol/L 蛋氨酸,0.75 mmol/L 氯化硝基四氮唑蓝和0.1 mmol/L 乙二胺四乙酸二钠)与酶提取液混合,加一定量0.02 mmol/L 核黄素混合,光照5 min,测定光照下反应液的吸光值。将每克果皮样品每分钟抑制50%氯化硝基四氮唑蓝光还原反应作为1 个SOD 酶活性单位(U),结果用U/mg 表示。
3)CAT 活性测定[11] 酶提取液与pH 7.0,50 mmol/L 的磷酸缓冲液和3%的过氧化氢混合。以每分钟内吸光值降低0.1 为1 个CAT 活性单位(U),单位为U/mg。
4)APX 活性测定 适量的酶粗提液与pH 7.0 的3 mL 反应液 (50 mmol/L 磷酸缓冲液,15 mmol/L 抗坏血酸及15 mmol/L 过氧化氢)。以每分钟吸光值变化0.01 作为1 个酶活单位(U),单位用U/mg 表示[9]。
5)PPO 活性测定 参考Kumar 等[12]的方法,测定果皮中PPO 酶活性,以15 s 时波长420 nm处吸光值为初始值,每隔1 min 记录1 次,吸光值每增加0.01 为1 个酶活单位,单位以U/mg 表示。
1.3.6 PAL 酶活性测定 称量1.0 g 果皮样品,根据Assis 等[13]的方法测定皇冠梨果皮中PAL 酶的活性。以反应体系在波长290 nm 处每小时吸光度值增加0.01 所需酶量作为1 个PAL 活性单位。
1.4 数据统计分析
用SPSS 17.0 软件对试验数据进行统计及分析,采用Origin 9.0 软件作图,P<0.05 表示差异显著。
2 结果与分析
2.1 COS 处理抑制皇冠梨果皮褐变的产生
由图1可知,与对照组相比,COS 处理的皇冠梨果实在贮藏期间果皮褐变发病情况均受到显著抑制(P<0.05)。未经COS 处理组果皮褐变发病率在贮藏40 d 时高达93%,发病指数约40%。在COS 处理组中,0.5%COS 处理组发病率和发病指数均在最低水平;1%COS 组和0.5%COS 组对发病率的抑制效果无显著差异,均有很好的抑制效果,相比于0.5%COS 组,1%COS 组的发病指数是0.5%COS 组的2 倍以上。以上结果说明,0.25%COS 处理对皇冠梨果皮褐变的抑制效果较弱,COS 的质量分数在0.5%时对果皮褐变发病情况抑制较好,然而COS 含量过高时会减弱对发病情况的抑制效果。刘幸海等[14]认为不同浓度的COS可能会启动植物体内不同的信号途径,只有适宜的壳寡糖浓度才能诱导启动植物的防御途径,壳寡糖浓度过高,可能会加强溶液的成膜性,造成壳寡糖溶液附着在果实表面形成致密薄膜,进而影响果实的正常代谢。
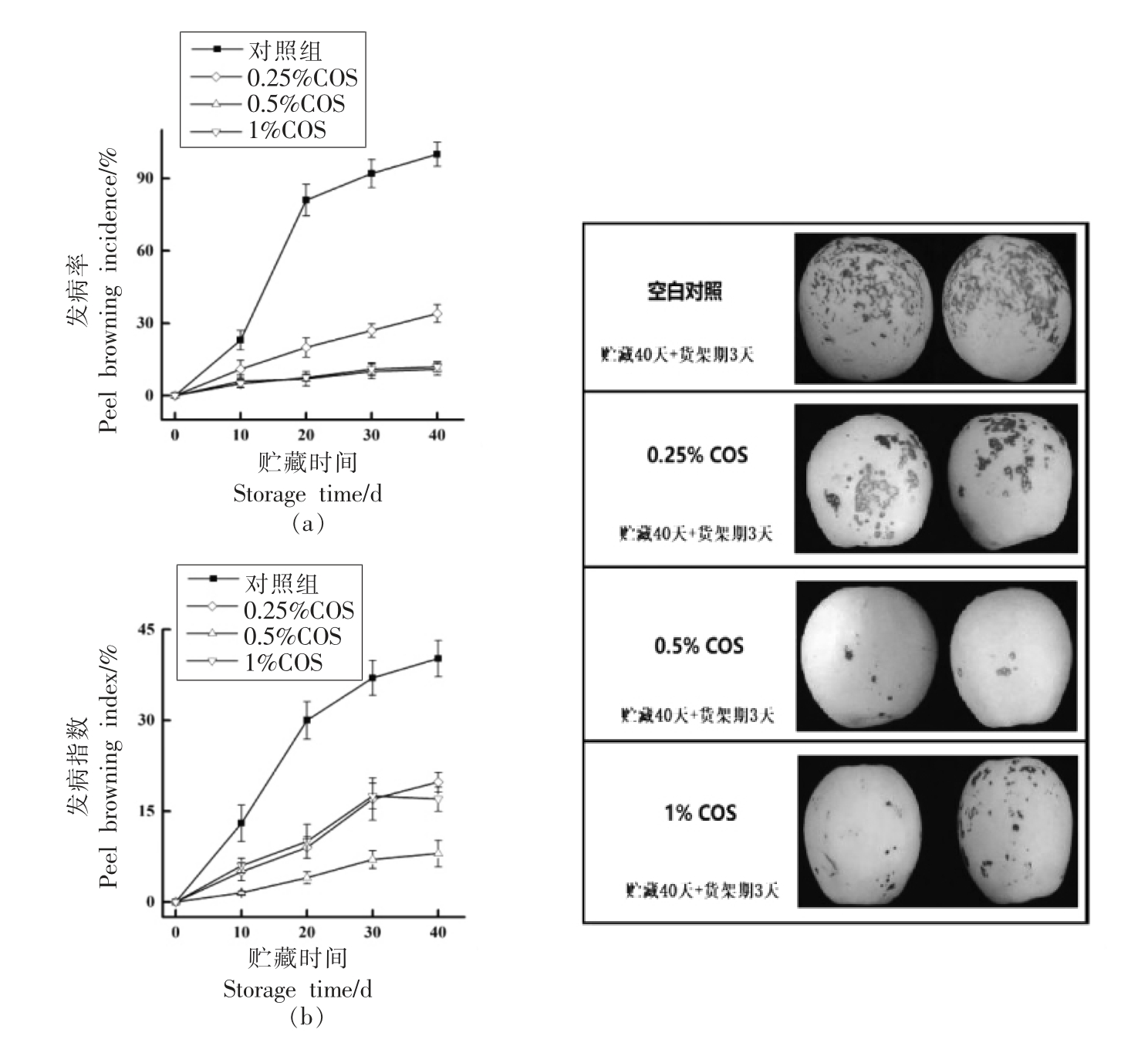
图1 壳寡糖处理对皇冠梨果实褐变发病率(a)和发病指数(b)的影响
Fig.1 Effects of COS treatment inhibits the peel browning incidence (a) and index (b) of Huangguan pear
2.2 COS 处理对皇冠梨果实可溶性固形物、可滴定酸和硬度的影响
如图2a 所示,不同处理组别中皇冠梨果实的可溶性固形物含量变化不大,总体呈下降趋势。在贮藏末期,对照组果实的可溶性固形物下降幅度最大,然而与COS 处理组相比变化不显著。COS处理均对皇冠梨果实中可溶性固形含量的下降均有抑制作用。
如图2b 所示,COS 处理对果实中可滴定酸含量的下降有显著抑制作用(P<0.05),贮藏40 d时,0.25%,0.5%及1.0%COS 处理组TA 含量分别为1.41%,1.71%与1.60%,而对照组仅为1.2%;其中以0.5%COS 处理对可滴定酸含量的下降抑制效果最好,在40 d 时,0.5%COS 组果实中可滴定酸的含量是对照组的1.4 倍;COS 处理对梨果中可滴定酸含量的下降均有一定的抑制作用(P>0.05)。果实中的可滴定酸主要以有机酸的形式出现,果实的生理代谢活动以酸为底物,这是可滴定酸含量下降的主要原因。由此可知,COS 处理可以较好的调节果实代谢,改善果实的贮藏品质。
硬度,是评价果实品质的重要指标之一。由图2c 可以看出,贮藏期间果实硬度呈现逐渐下降的趋势,COS 处理对延缓果实硬度的下降均有一定的作用,然而在贮藏末期各组别硬度相差不大。
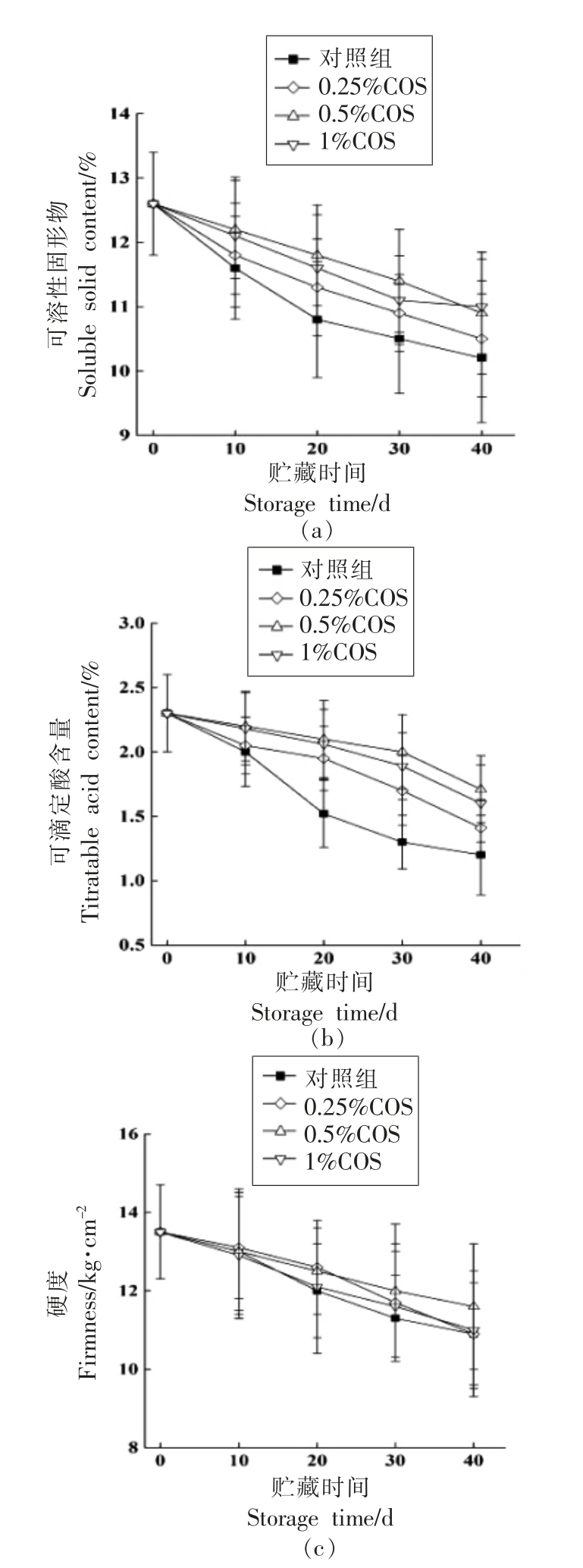
图2 壳寡糖处理对皇冠梨果实可溶性固形物(a)、可滴定酸含量(b)和硬度(c)的影响
Fig.2 Effects of COS treatment on soluble solids content (a),titratable acid content (b)and firmness (c) of Huangguan pear
2.3 COS 处理对果皮中PPO 酶活性和多酚含量的影响
由图3a 可知,贮藏过程中果皮中对照组和0.25%COS 组的PPO 酶活性呈先上升后下降的趋势,在贮藏20 d 时PPO 活性达到最高;0.5%COS组和10%COS 组的PPO 酶活性呈现缓慢上升的趋势,然而在整个贮藏中期对照组和0.25%COS组中PPO 酶的活性显著(P<0.05)高于0.5%COS和1%COS 组,在贮藏20 d 时,对照组PPO 酶活性是0.5%COS 组的1.3 倍。
从图3b 可以看出,果皮中总酚含量在整个贮藏期间呈现逐步下降的趋势,其中对照组和0.25%COS 处理组中的多酚含量下降最为显著,而0.5%COS 和1%COS 可以较好地抑制果皮中总酚含量的下降,在贮藏40 d 时,0.5%COS 组中多酚含量比对照组高出20%。有研究表明,低温贮藏过程中果皮中酚类含量的大幅度下降和PPO 酶活力的增强是引发皇冠梨果实果皮褐变的直接原因[15]。本研究发现,0.5%COS 处理可以较好的抑制果实中多酚含量的下降和PPO 酶活性的上升。
2.4 COS 处理对果皮中LOX 酶活性和丙二醛含量的影响
从图3c 可以看出,果皮中LOX 酶活性在皇冠梨贮藏过程中呈现持续上升的趋势,而0.5%COS 处理和1%COS 处理可以明显(P<0.05)抑制LOX 酶活性的上升,在贮藏到40 d 时,对照组的LOX 酶活性比0.5%COS 处理高出约16%。由图3d 可知,所有处理组别的丙二醛含量在贮藏期间均呈现持续上升的趋势,然而0.5%COS 处理组和1%COS 处理组的果皮中丙二醛含量显著低于0.25%COS 组和对照组,在贮藏末期,0.5%COS 处理组的丙二醛含量比对照组高出近40%。
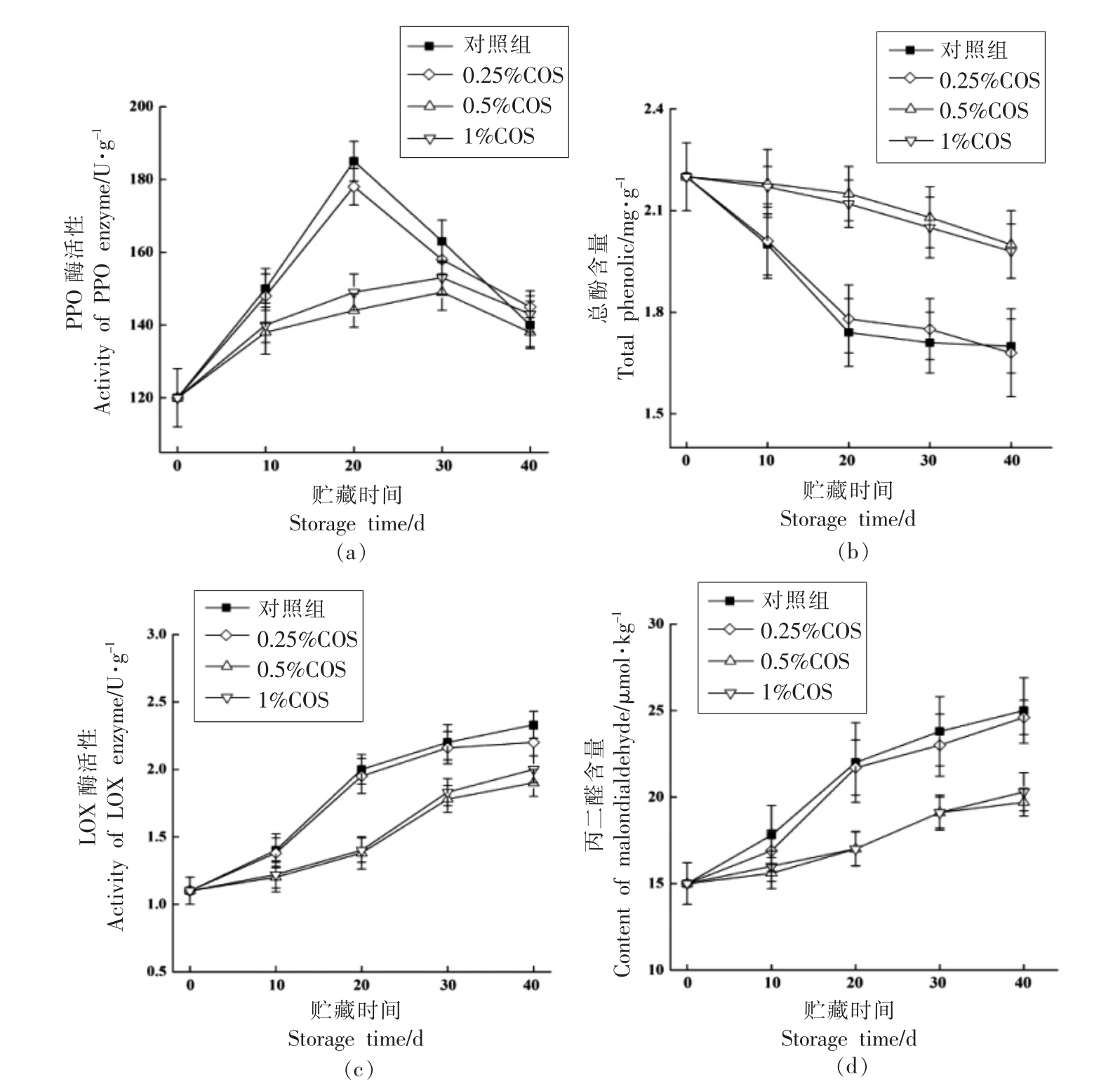
图3 壳寡糖处理对皇冠梨果皮中PPO 酶活性(a)、总酚含量(b)、LOX 酶活性(c)和丙二醛含量(d)的影响
Fig.3 Effects of COS treatment on PPO activity (a),total phenolic content (b),LOX activity (c)and malonaldehyde content (d) of Huangguan pear
果实在低温条件下,冷害所引发的褐变通常认为是由细胞膜氧化损伤所致。LOX 酶可以氧化细胞膜中的膜脂,在果实冷害发生和组织的褐变过程中发挥着重要作用,丙二醛对细胞膜有严重的破坏作用,同时丙二醛也可以反映细胞对外界胁迫的反映,多数研究认为组织中丙二醛的含量与果实的冷害程度呈负相关[16]。本研究表明,COS处理可以明显抑制低温贮藏中皇冠梨果皮中LOX酶的上升和丙二醛含量的下降,尤其是0.5%COS处理效果最为明显。
2.5 COS 处理对果皮中CAT 酶活性、APX 酶活性和过氧化氢及抗坏血酸含量的影响
由图4a 可知,果皮中的CAT 活性整体呈先上升后下降的趋势,到贮藏终点时,0.5%COS 处理和1%COS 处理的果皮中CAT 酶的活性明显高于0.25%COS 处理和对照组。与贮藏开始时相比,0.25%COS 处理组的CAT 酶活性上升了33%,是贮藏40 d 时对照组CAT 酶活性的1.47 倍。由图4b 可知,对照组和0.25%COS 处理组果皮中过氧化氢含量在贮藏期呈迅速上升的趋势,且二者明显(P<0.05)高于同期的0.5%和1%COS 处理组。COS 处理均可以抑制果皮中过氧化氢的积累,在贮藏40 d 时,对照组果皮中的过氧化氢含量是0.5%COS 处理组的近3 倍。
APX 酶能催化抗坏血酸与过氧化氢反应,其对清除过氧化氢起着重要的作用[17]。从图4c 中可以看出,对照组和0.25%COS 处理组皇冠梨果皮中APX 酶活性呈先上升后下降的趋势,在贮藏20 d 时达到最大值,然而这两组APX 酶的活性差异不显著。0.5%和1%COS 处理组果皮中APX 酶活性在贮藏20 d 时,未呈现下降反而呈现持续上升的趋势,在贮藏30 d 后上升趋势减缓,在贮藏40 d 时,0.5%COS 处理组的APX 酶活性是对照组的1.6 倍,同时0.5%COS 组果皮中APX 酶活性显著(P<0.05)高于1%COS 处理组。由图4d 可知,果皮中抗坏血酸含量在整个贮藏期呈缓慢下降的趋势,COS 处理可抑制果皮中抗坏血酸含量的下降,在贮藏40 d 时,0.5%COS 处理组中的抗坏血酸含量显著(P<0.05)高于对照组,而0.25%和1%COS处理组以及对照组果皮中抗坏血酸含量无显著差别(P>0.05)。
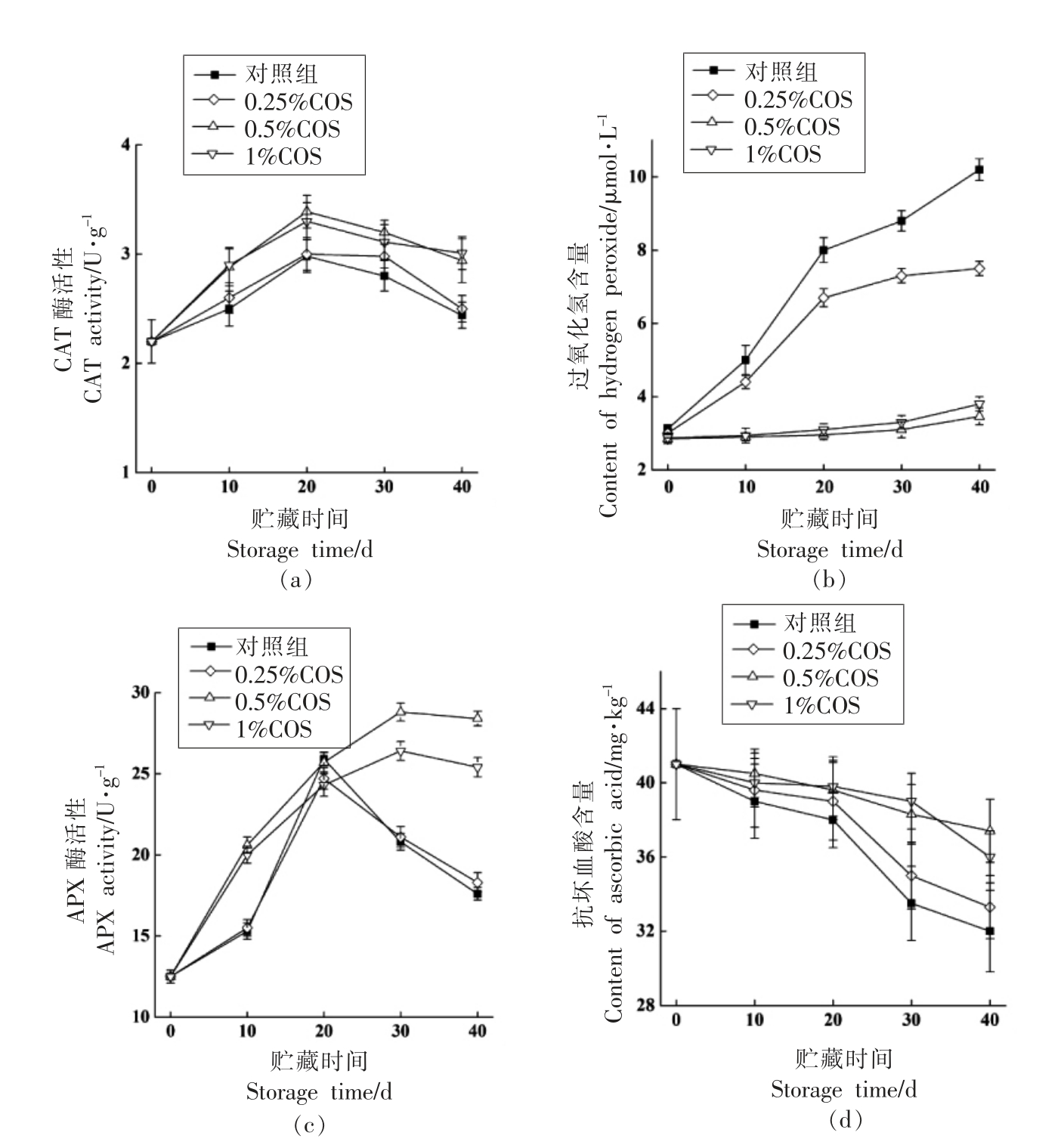
图4 壳寡糖处理对皇冠梨果皮中CAT 酶活性(a)、过氧化氢含量(b)、APX 酶活性(c)和抗坏血酸含量(d)的影响
Fig.4 Effects of COS treatment on CAT activity (a),the content of hydrogen peroxide (b),APX activity (c)and the content of ascorbic acid (d) of Huangguan pear
2.6 COS 处理对果皮中SOD 酶活性和PAL 酶活性的影响
由图5a 可知,SOD 酶的活性整体呈先上升后下降的变化趋势。各处理组相比较,0.5%和1%COS 处理组延缓了果皮中SOD 酶活性的下降。在贮藏40 d 时,0.5%和1%COS 处理组果皮中SOD酶的活性是同期0.25%COS 处理组和对照组的1.8~2 倍。果皮中PAL 酶的活性在贮藏期表现为整体上升的趋势,且上升幅度明显(图5b)。COS处理提高了PAL 酶的活性,0.5%和1%COS 处理组效果显著(P<0.05),而0.5%和1%COS 处理组的PAL 酶活性差异不显著。在贮藏终点,0.5%COS处理组PAL 酶活性是对照组的1.3 倍,而0.25%COS 处理组的PAL 酶活性与对照组相比差异不显著(P>0.05)。
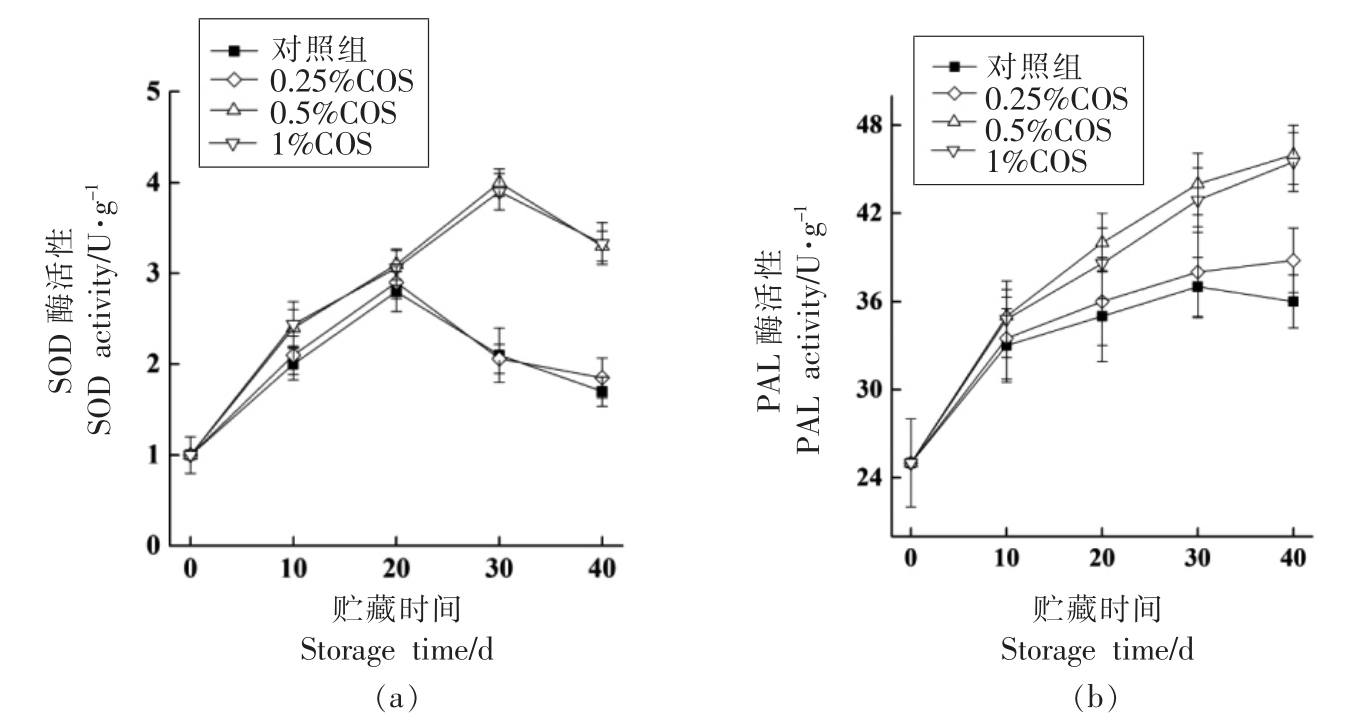
图5 壳寡糖处理对皇冠梨果皮中SOD 酶活性(a)和PAL 酶活性(b)的影响
Fig.5 Effects of COS treatment on SOD (a) and PAL (b) activity of Huangguan pear
植物组织中活性氧代谢的酶主要有SOD、CAT、PPO、LOX 和APX 等,它们与植物的逆境反映相关[17]。SOD 活性氧将超氧阴离子自由基歧化为O2 和H2O2,随后POD、CAT 和APX 等酶类共同将H2O2 降解成为H2O 和O2,进而减轻活性氧对植物细胞的伤害[18]。
本试验发现COS 处理能显著降低皇冠梨贮藏期间果皮中H2O2 含量,提高SOD、POD、CAT、LOX 及APX 等活性氧清除酶类的活性。黄艳等[4]发现COS 处理可诱导CAT 等酶的产生,减少果实中活性氧含量,降低酚类物质的转化。也有研究发现COS 处理后的杏和草莓果实中H2O2 含量急剧积累[19]。PAL 是苯丙烷类代谢的限速酶,间接参与酚类化合物的合成,与植物抗性密切相关[19]。弓德强等[20]认为PPO 是使酚类氧化为醌进而发生褐变的关键酶,而多酚是合成木质素等抗病物质的前体。本试验发现COS 可抑制皇冠梨果皮中PPO 酶的活性上升,促进PAL 酶活性的上升。
3 结论
COS 可以改善低温贮藏过程中的皇冠梨果皮活性氧的代谢情况,进而抑制果皮褐变症状的出现。0.5%和1%COS 处理均可抑制果皮中PPO 酶和LOX 酶活性的上升,并可使CAT、APX、SOD 和PAL 等酶的活性维持在较高水平;同时,0.5%和1%COS 处理可以维持果皮中总酚和抗坏血酸的含量在较高水平,并降低过氧化氢和丙二醛的积累。同时,研究还发现,COS 处理组可较好的改善皇冠梨果实品质,使可溶性固形物、可滴定酸和硬度维持在较高水平,并且0.5%的COS 处理对果实品质保持最好。研究表明,在贮藏前采用0.5%的COS 处理皇冠梨,可以通过影响活性氧代谢和抗氧化物质积累,来减少其在低温贮藏期间果皮褐变的发生,以达到保持贮藏期间皇冠梨品质的目的。
[1]刘佩,徐欣欣,刘同信,等.过氧化氢处理对采后‘黄冠’梨果皮褐变及果实品质的影响[J].食品科学,2017,38(19):241-247.
LIU P,XU X X,LIU T X,et al.Effects of H2O2 treatment on postharvest quality and skin browning of ‘Huangguan’ pears[J].Food Science,2017,38(19):241-247.
[2]刘佩,王璇,王庆国,等.脱落酸处理对采后 ‘黄冠’梨品质及果皮褐变的影响[J].农学学报,2017,7(2):84-90.
LIU P,WANG X,WANG Q G,et al.Effects of ABA treatment on postharvest quality and skin browning of ‘Huangguan’ pear[J].Journal of Agriculture,2017,7(2):84-90.
[3]BOSE S K,HOWLADER P,WANG W,et al.Oligosaccharide is a promising natural preservative for improving postharvest preservation of fruit:A review[J].Food Chemistry,2021,341:128178.
[4]黄艳,明建,邓雨艳,等.壳寡糖诱导柑橘果实抗病作用中的活性氧变化[J].食品科学,2009,30(22):344-349.
HUANG Y,MING J,DENG Y Y,et al.Induction of Colletotrichum gloeosporioides Penz.resistance through oligochitosan treatment and active oxygen change in citrus fruits[J].Food Science,2009,30(22):344-349.
[5]罗小芬,颜海燕,苑国旭.壳聚糖处理对加工番茄活性氧代谢的影响[J].食品工业,2011 32(2):26-28.
LUO X F,YAN H Y,YUAN G X.Effects of chitosan treatment on the active oxygen metabolism of processing tomatoes[J].The Food Industry,2011,32(2):26-28.
[6]陈喜文,郝友进,陈德富,等.含氮杂环化合物对黄瓜白粉病抗性的诱导作用及其与防御酶系统的关系[J].植物病理学报,2003,33(6):535-540.
CHEN X W,HAO Y J,CHEN D F,et al.Induced-resistance of cucumber by nitrogen containing heterocycles to powdery mildew (Spaerotheca fuliginea)[J].Acta Phytopathologica Sintca,2003,33(6):535-540.
[7]LIN M,CAO J,XU L,et al.Effects of 1-methylcyclopropene in combination with chitosan oligosaccharides on post-harvest quality of aprium fruits[J].Scientia Horticulturae,2014,179(179):301-305.
[8]ZHAO H,SHU C,FAN X,et al.Near-freezing temperature storage prolongs storage period and improves quality and antioxidant capacity of nectarines[J].Scientia Horticulturae,2018,228:196-203.
[9]TODD J F,PALIYATH G,THOMPSON J E.Characteristics of a membrane-associated lipoxygenase in tomato fruit[J].Plant Physiology,1990,94(3):1225-1232.
[10]ZHAO H,LIU B,ZHANG W,et al.Enhancement of quality and antioxidant metabolism of sweet cherry fruit by near-freezing temperature storage[J].Postharvest Biology & Technology,2019,147:113-122.
[11]SGHERRI C,SCATTINO C,PINZINO C,et al.Ultraviolet-B radiation applied to detached peach fruit:A study of free radical generation by EPR spin trapping[J].Plant Physiology & Biochemistry,2015,96:124-131.
[12]KUMAR V,MOHAN T,MURUGAN K.Purification and kinetic characterization of polyphenol oxidase from Barbados cherry (Malpighia glabra L.)[J].Food Chemistry,2008,110(2):328-333.
[13]ASSIS J S,MALDONADO R,MUOZ T,et al.Effect of high carbon dioxide concentration on PAL activity and phenolic contents in ripening cherimoya fruit[J].Postharvest Biology and Technology,2001,23(1):33-39.
[14]刘幸海,李正名,王宝雷.具有农业生物活性壳寡糖的研究进展[J].农药学学报,2006,8(1):1-7.
LIU X H,LI Z M,WANG B L.Progress in pesticidal bioactivities for chitosan oligosaccharide[J].Chinese Journal of Pesticide Science,2006,8(1):1-7.
[15]MA Y,YANG M,WANG J,et al.Application of exogenous ethylene inhibits postharvest peel browning of ‘Huangguan’ pear[J].Frontiers in Plant Science,2017,7:20-29.
[16]ZHU Y,WANG K,WU C,et al.Effect of ethylene on cell wall and lipid metabolism during alleviation of postharvest chilling injury in peach [J].Cells,2019,8(12):1612.
[17]MATHEWS D,SABINA J M,TURNER D.Expanded sequence dependence of thermodynamic parameters improves prediction of RNA secondary structure[J].Journal of Molecular Biology,1999,288(5):911-940.
[18]AHMAD A,ALI A.Improvement of postharvest quality,regulation of antioxidants capacity and softening enzymes activity of cold-stored carambola in response to polyamines application[J].Postharvest Biology and Technology,2019,148:208-217.
[19]YAHRAUS T,CHANDRA S,LEGENDRE L,et al.Evidence for a mechanically induced oxidative burst[J].Plant Physiology,1995,109(4):1259-1266.
[20]弓德强,谷会,张鲁斌,等.苯并噻重氮对采后杧果抗病性及相关酶活性的影响[J].果树学报,2010,27(4):585-590.
GONG D Q,GU H,ZHANG L B,et al.Effects of benzothiadiazole on disease resistance and related defense enzyme activity of harvested mango fruits[J].Journal of Fruit Science,2010,27(4):585-590.