苹果浊汁营养丰富,深受消费者喜爱,然而其在加工和贮藏过程中不稳定,易产生沉淀[1]。苹果浊汁在贮藏期内沉淀的重要原因之一是云状颗粒中酚类化合物与富含脯氨酸的蛋白质发生相互作用[2]。苹果汁中的酚类化合物主要包括酸性酚(绿原酸、咖啡酸等)和中性酚(表儿茶素、芦丁、根皮素等)[3-4]。多酚具有较强的亲水能力,可与苹果浊汁中的活性蛋白通过疏水相互作用与氢键缔合[5]。不同品种苹果浊汁中酚类化合物的种类和含量有一定差别,然而,与果汁稳定性相关的酚类化合物的种类尚不明确。
苹果浊汁沉积物中的蛋白质含量约为11.5%~29%,其中脯氨酸含量约为5%~16%[6]。对苹果汁中蛋白质进行电泳分析,与浑浊度相关的蛋白质分子质量分别为28,15,12 ku[7]。麦醇溶蛋白的分子质量为25~100 ku,与苹果浊汁中的活性蛋白的分子质量接近,且麦醇溶蛋白为小分子单肽链蛋白,其脯氨酸容易与酚类相互作用导致浑浊[8],因此麦醇溶蛋白可作为苹果浊汁中与酚类化合物互作的模式蛋白。苹果汁在加工过程中发生的重要温度变化主要为室温(298 K)、酶解温度(318 K)和巴氏杀菌温度(358 K),这些温度条件是影响苹果汁稳定性的重要环境条件。
本文采用高效液相色谱(HPLC)分析6 个典型品种苹果浊汁中的酚类物质,探究苹果浊汁的特征酚类化合物,并与麦醇溶蛋白建立模拟体系,研究苹果浊汁加工过程中温度对多酚-蛋白互作的影响,为工业化生产过程中提高其稳定性提供参考。
1 材料与方法
1.1 材料与试剂
原料:试验所选取的“国光”、“乔纳金”、“蛇果”、“金冠”、“王林”和“寒富”苹果,产自辽宁锦州,于2020年10月收获,挑选成熟度相同,大小一致,无病虫害、无腐败的新鲜果实作为试验材料。
试剂:绿原酸、表儿茶素、没食子酸、单宁酸、根皮素、芦丁、甲醇、乙腈、乙酸乙酯、甲酸均为色谱纯级(≥98%),上海阿拉丁生化科技股份有限公司;磷酸氢二钠、氢氧化钠、无水乙醇、磷酸均为国产分析纯级试剂。
1.2 仪器与设备
SRQ-7315 多功能料理机,佛山市艾尼诗登电器有限公司;Agilent-1260 液相色谱仪、Zorbax Eclipse Plus C18 色谱柱,美国安捷伦科技公司;RE-2000B 旋转蒸发仪,成都康宁仪器有限公司;TS-200DC 恒温振荡箱,上海天呈实验仪器制造有限公司;F-7000 荧光分光光度计,日本日立;FDA10N-50 冷冻干燥器,上海皓庄仪器有限公司。
1.3 试验方法
1.3.1 苹果浊汁酚类物质的提取 苹果经清洗、去核、切分、打浆后用300 目滤布过滤后得到苹果浊汁。取50 mL 不同品种的苹果浊汁分别加入25 mL 的乙酸乙酯。样品在室温下振荡10 min 后用分离漏斗分离。重复上述操作,共萃取3 次后混合。-18 ℃冷冻2 h 后用脱脂棉过滤,旋转蒸发5~10 min 后用甲醇溶解蒸发物并定容到10 mL 容量瓶中。样品和多酚标准品经0.45 μm 滤膜过滤至样品瓶中,保存于4 ℃冰箱中,备用[9]。
1.3.2 酚类物质的定性和定量分析 采用高效液相色谱法对苹果浊汁中的酚类物质进行定性和定量分析,分析方法参考Rajauria[10]与Robu 等[11]研究,并优化同时分析多种酚类化合物的色谱条件。流动相分别为超纯水(A)、乙腈(B)、甲醇(C)和2%甲酸水溶液 (D)。梯度洗脱条件如下:0~30 min:5%B 和95%D,30~45 min:25%B 和75%D,45~50 min:40%B 和60%D,50~51 min:40%B 和60%D,51~60 min:5%B 和95%D,60~65 min:5%B和95%D。设置仪器柱温:25 ℃,流速:0.6 mL/min,检测波长:280 nm。
1.3.3 特征酚类化合物与麦醇溶蛋白互作的研究 麦醇溶蛋白与特征酚类化合物(表儿茶素、绿原酸和没食子酸)在pH 值为3.8(苹果汁pH=3.8)的磷酸盐缓冲液中完全溶解。在室温下,取蛋白溶液(10 μmol/L)与0,2.5,5,10,20,40,60,80 μmol/L 的酚类化合物按体积比1∶1 混合。将蛋白质-多酚复合物在不同温度下 (室温298 K,酶解温度318 K,巴氏杀菌温度358 K)进行相互作用,以研究不同工艺温度对蛋白质与酚类化合物相互作用的影响。
1.3.4 荧光光谱分析 荧光光谱分析参考Kosinska 等[12]的研究方法。利用日立F-7000 荧光光谱仪进行测定,测定条件如下:激发波长λex=280 nm,发射光谱波长λem 范围290~450 nm,激发狭缝为5.0 nm,发射狭缝为2.5 nm。
1.3.5 荧光猝灭类型分析 采用Stern-Volme 方程[13]探讨特征酚类对麦醇溶蛋白的荧光猝灭类型。
式中,F0 和F 分别为——添加淬灭剂前、后的荧光强度;Kq——双分子猝灭常数,动态扩散的Kq最大值为2.0×1010 L·mol-1·s-1[14];[P]——淬灭剂(酚类物质) 的浓度,mol/L;τ0——无荧光猝灭剂状态下荧光寿命,平均荧光寿命一般为10-8 s[15];KSV——Stern-Volme 方程猝灭常数,L/mol,通过F0/F 对[P]的曲线斜率计算获得。
1.3.6 结合常数和结合位点数分析 酚类化合物与蛋白的结合常数(K)和结合位点数(n)计算公式如下[16]:
式中,F0 和F——淬灭剂加入前、后的荧光强度;[P]——淬灭剂 (酚类物质) 的浓度,mol/L;n——可用结合位点的数量;Ka (表观结合常数)——通过lg[(F0-F)/F]得到的截距,L/mol。
1.3.7 热力学分析 在不同反应温度下,酚类化合物与蛋白的分子间作用力通过Van't Hoff 方程推测,计算公式如下:
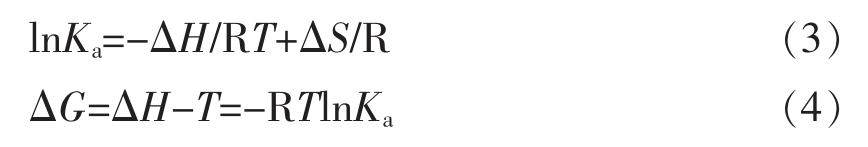
式中,R——理想气体常数,R=8.314 J·mol-1·K-1;T——反应温度,K[17];Ka——特定温度下的结合常数;ΔG——吉布斯自由能,kJ/mol;以lnKa 对1/T 作图由直线的斜率和截距分别得到ΔH 和ΔS;ΔH——焓变,kJ/mol;ΔS——熵变,J·mol-1·K-1。
1.3.8 数据统计分析 液相色谱图由液相色谱仪Agilent 1260 离线软件进行分析。利用SPSS 22.0进行方差分析和显著性检验(P<0.05),采用Origin 2017 软件作图。
2 结果与分析
2.1 苹果浊汁中特征酚类化合物的分析
利用高效液相色谱法对6 种成熟苹果 (“国光”、“乔纳金”、“蛇果”、“金冠”、“王林”和“寒富”)浊汁中酚类化合物进行分析。绿原酸等标准品出峰时间如图1a 所示,制备标准曲线对酚类物质进行定量分析。以“寒富”果汁作为典型,其浊汁中酚类化合物色谱图如图1b 所示。液相分析结果表明,所有6 种苹果汁中3 种酚类化合物(绿原酸、表儿茶素、没食子酸)相对较高,可作为苹果浊汁中的特征酚类物质进行后续研究。绿原酸标准曲线为:Y=4471.5X-1419.9,R2=0.9934;表儿茶素标准曲线为:Y=1130.5X-34.539,R2=0.9995;没食子酸标准曲线为:Y=38.403X+1.7487,R2=0.9716。对不同混浊苹果汁中3 种酚类化合物的定量分析表明(图1c),“国光”苹果浊汁中绿原酸含量为1.74 mg/L,“国光”苹果浊汁中表儿茶素含量最高,其次是“蛇果”苹果浊汁。没食子酸在“金冠”苹果浊汁中含量最高,达到0.99 mg/L,“寒富”苹果浊汁中没食子酸含量最少,仅有0.14 mg/L。

图1 利用高效液相色谱法分析6 种苹果浊汁中的酚类化合物
Fig.1 Analysis of the phenolic compounds in six kinds of cloudy apple juice using HPLC
2.2 温度对酚类化合物与麦醇溶蛋白荧光猝灭作用的影响
蛋白质分子中含有发荧光的色氨酸(Trp)、酪氨酸(Tyr)和苯丙氨酸(Phe)等生色氨基酸残基[18]。酚类化合物加入到麦醇溶蛋白溶液形成复合物后,蛋白内源性荧光强度降低的现象称作荧光猝灭[19]。将不同温度、不同浓度的3 种酚类化合物与麦醇溶蛋白形成的复合物进行荧光光谱分析,结果如图2所示。麦醇溶蛋白具有内源性荧光,在λex=280 nm 条件下,麦醇溶蛋白在波长320~360 nm 范围内荧光强度最强,其中Trp 残基贡献最大。不同温度下,随着酚类化合物浓度的增加,荧光强度逐渐降低,发生荧光猝灭现象,对应于该峰的波长显著蓝移或红移,且温度越高对蛋白质散发荧光的影响越大。绿原酸-麦醇溶蛋白复合物在波长340 nm 处的荧光强度随多酚浓度的增加而降低,并伴随着红移现象,说明绿原酸-麦醇溶蛋白复合物的结构较为松散,色氨酸残基暴露在水中,复合物的疏水性增强。表儿茶素-麦醇溶蛋白复合物与没食子酸-麦醇溶蛋白复合物分别在波长320 nm 和340 nm 处有最大荧光强度,且都伴随着多酚浓度的升高而降低,并发生蓝移现象,此时,麦醇溶蛋白分子聚集,疏水性减弱。

图2 不同温度下酚类化合物与麦醇溶蛋白互作的荧光光谱图
Fig.2 Fluorescence spectra of interactions of phenolic compounds with gliadin at different temperatures
2.3 酚类化合物对麦醇溶蛋白的荧光猝灭类型
荧光猝灭机制主要包括静态猝灭、动态猝灭以及静态猝灭和动态猝灭两者共存[20]。图3为3种酚类化合物与蛋白在298,318,358 K 3 个温度下反应的Stern-Volmer 曲线。结果表明,表儿茶素-麦醇溶蛋白、绿原酸-麦醇溶蛋白、没食子酸-麦醇溶蛋白复合物的拟合曲线都呈现出良好的线性关系。根据各条曲线的斜率计算求得相应温度下的Ksv、Kq 值(见表1)。随着温度的升高,多酚-蛋白复合物的稳定性下降,表儿茶素、绿原酸、没食子酸对蛋白Kq 值降低,且Kq 值远大于扩散碰撞淬灭常数,表明荧光猝灭机制为静态猝灭类型。在相同温度下,Ksv 数值分析表明,酚类化合物与麦醇溶蛋白结合能力强弱的顺序为:表儿茶素-麦醇溶蛋白>绿原酸-麦醇溶蛋白>没食子酸-麦醇溶蛋白。
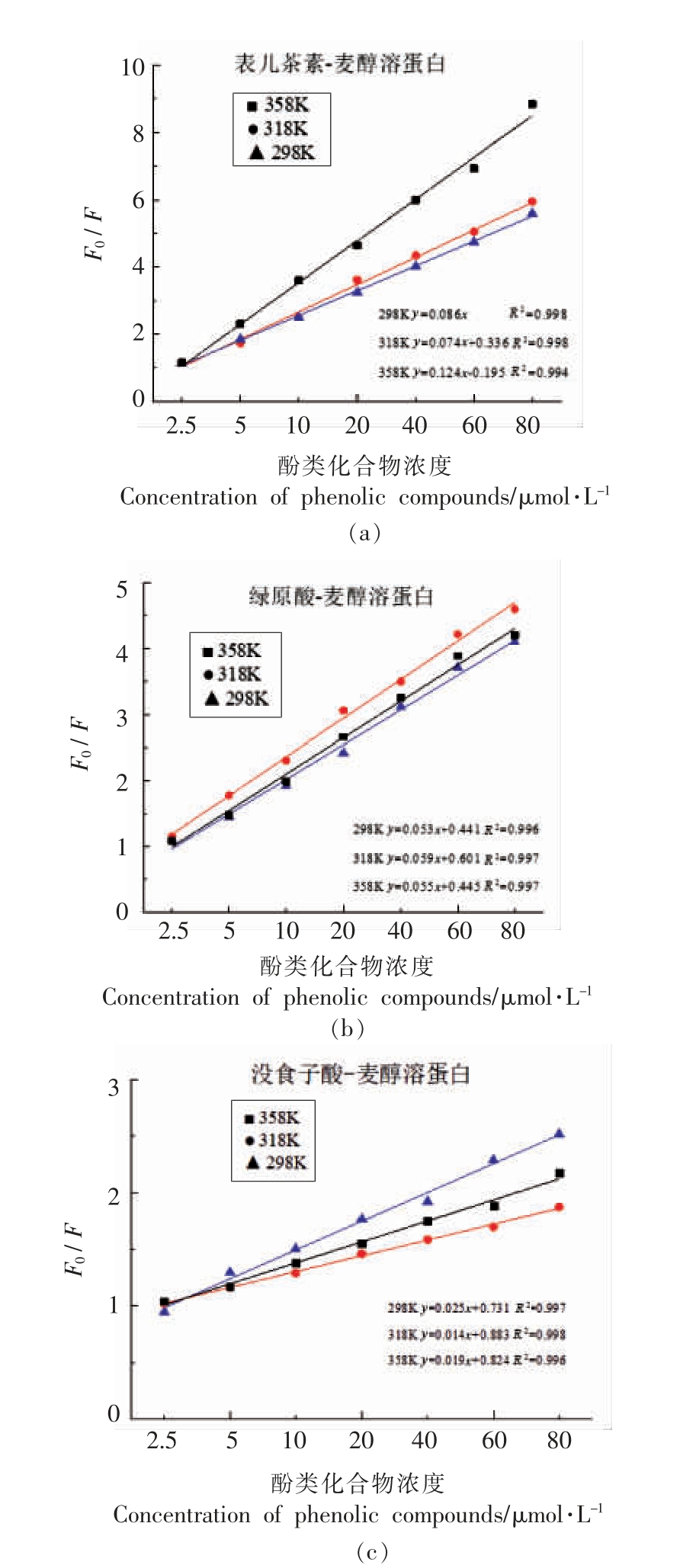
图3 不同温度下酚类化合物与麦醇溶蛋白互作的Stern-Volmer 曲线
Fig.3 Stern-Volmer curves on the interaction of phenolic compounds with gliadin at different temperatures
表1 不同温度下酚类化合物与麦醇溶蛋白互作的猝灭参数
Table 1 Quenching parameters of the reaction between three polyphenols with gliadin at three temperatures
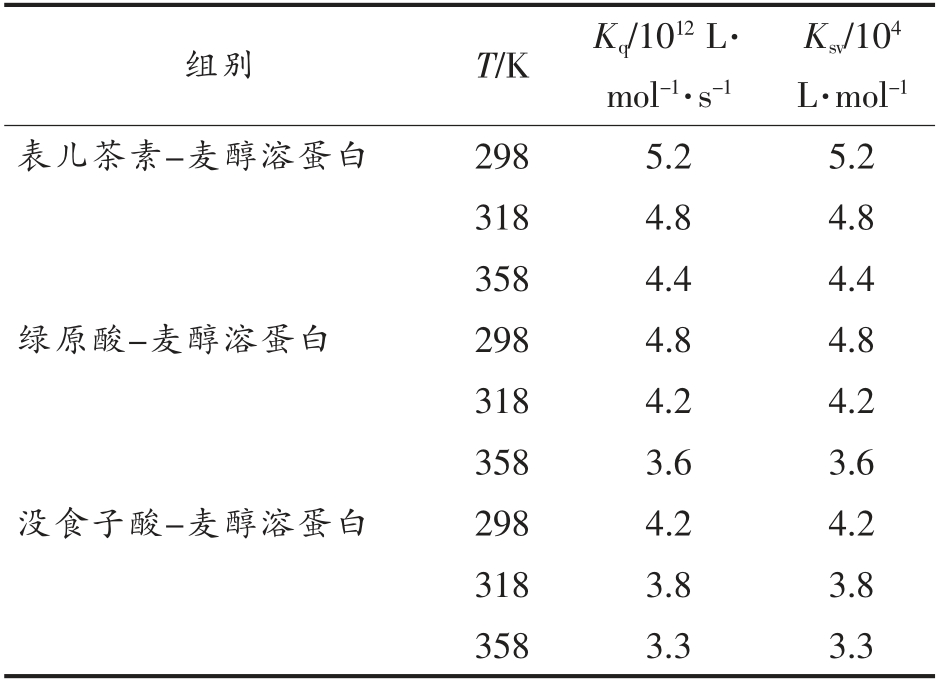
Ksv/104 L·mol-1表儿茶素-麦醇溶蛋白 298 5.2 5.2 318 4.8 4.8 358 4.4 4.4绿原酸-麦醇溶蛋白 298 4.8 4.8 318 4.2 4.2 358 3.6 3.6没食子酸-麦醇溶蛋白 298 4.2 4.2 318 3.8 3.8 358 3.3 3.3组别 T/K Kq/1012 L·mol-1·s-1
2.4 酚类化合物与麦醇溶蛋白结合常数和结合位点数分析
荧光猝灭是确定酚类与蛋白质相互作用的结合位点和结合常数的一种合适而简单的方法[21]。3种酚类化合物-蛋白质复合物在不同温度下的结合常数约等于1(表2),说明在多酚浓度在0~80 μmol/L 范围内,表儿茶素、绿原酸和没食子酸至少与麦醇溶蛋白有1 个结合位点。随着温度的升高,多酚与蛋白质的结合常数发生了不同程度的降低,表明猝灭机制为静态猝灭,且结合常数都较大,特征酚类化合物与蛋白质之间的结合能力较强。Ka 的大小在一定程度上反应了复合物稳定性的大小,因此随温度升高3 种酚类化合物与麦醇溶蛋白的结合稳定性均呈下降趋势。同一温度条件下,3 种特征酚类化合物与麦醇溶蛋白结合稳定性大小为:绿原酸-麦醇溶蛋白>没食子酸-麦醇溶蛋白>表儿茶素-麦醇溶蛋白。
表2 不同温度下3 种酚类化合物与麦醇溶蛋白反映的结合位点数(n)与结合常数(Ka)
Table 2 Number of binding sites (n) and binding constants (Ka) reflected by three polyphenols with gliadin at three temperatures

组别 T/K n Ka/104 L·mol-1表儿茶素-麦醇溶蛋白298 0.90526 4.81 318 0.93616 4.03 358 0.97638 3.27绿原酸-麦醇溶蛋白298 1.01396 6.83 318 1.27036 5.29 358 1.30925 5.10没食子酸-麦醇溶蛋白298 0.94838 6.30 318 0.96103 4.77 358 0.99115 3.92
2.5 酚类化合物与麦醇溶蛋白相互作用的热力学分析
在多酚与麦醇溶蛋白结合的相互作用过程中,通常存在氢键、疏水相互作用、范德华力和离子键等非共价结合作用[22]。这会引起焓变(ΔH)、熵变(ΔS)、吉布斯自由能(ΔG)的改变,当ΔG<0时,则反应能够自发进行,也可以通过ΔH 和ΔS来判断反应是否可以自发进行。表3为不同温度下的ΔH、ΔS、ΔG 值,可以推测特征酚类化合物与麦醇溶蛋白的相互类型。由表3可知,ΔH 和ΔG都小于0,说明反应是能够自发进行的放热反应。表4为基于热力学分析的ΔH、ΔS 与分子间相互作用力的关系,表儿茶素、绿原酸和没食子酸-麦醇溶蛋白复合物中ΔH<0,ΔS>0,说明苹果浊汁中的3 种特征酚类化合物与麦醇溶蛋白之间由氢键相连接,并发生了疏水相互作用。酚类化合物分子结构不同,导致ΔG 的数值不同,其绝对值越小,说明反应越容易进行,形成的复合物越稳定。ΔG 的结果也表明,随着反应温度升高,结合物的稳定性逐渐减弱。
表3 不同酚类化合物与麦醇溶蛋白结合热力学参数
Table 3 Thermodynamic parameters of the combination of three polyphenols and gliadin

ΔG/kJ·mol-1表儿茶素-麦醇溶蛋白组别 T/K ΔH/kJ·mol-1 ΔS/J·mol-1·K-1 298-5.63 70.64-26.71 318-28.04 358-30.94绿原酸-麦醇溶蛋白298-3.97 78.74-27.58 318-28.76 358-32.26没食子酸-麦醇溶蛋白298-6.77 68.81-27.38 318-28.48 358-31.48
表4 基于热力学分析的分子间相互作用力[23]
Table 4 Relationship between ΔH and ΔS and intermolecular interaction forces[23]

?
3 结论
通过高效液相色谱对6 种苹果浊汁中酚类化合物进行分析,得到苹果浊汁中特征酚类化合物为绿原酸、表儿茶素和没食子酸。3 种酚类化合物对麦醇溶蛋白有较强的荧光猝灭作用,猝灭方式为静态猝灭。猝灭常数结果表明,特征酚类化合物与麦醇溶蛋白结合能力强弱的顺序为:表儿茶素-麦醇溶蛋白>绿原酸-麦醇溶蛋白>没食子酸-麦醇溶蛋白。特征酚类化合物与麦醇溶蛋白结合稳定性大小为:绿原酸-麦醇溶蛋白>没食子酸-麦醇溶蛋白>表儿茶素-麦醇溶蛋白。苹果浊汁中的3 种特征酚类化合物与麦醇溶蛋白之间由氢键相连接,并发生了疏水相互作用。随着温度升高,苹果浊汁中特征酚类化合物与麦醇溶蛋白的结合稳定性呈下降趋势。
[1]MA S,NEILSON A,LAHNE J,et al.Juice clarification with pectinase reduces yeast assimilable nitrogen in apple juice without affecting the polyphenol composition in cider[J].Journal of Food Science,2018,83(11):2772-2781.
[2]JOHNSON G,DONNELLY B J,JOHNSON D K.The chemical nature and precursors of clarified apple juice sediment[J].Journal of Food Science,2010,33(3):254-257.
[3]王洪言,董文宾,修秀红.浓缩苹果汁中多酚的大孔吸附树脂吸附及其HPLC 检测[J].食品工业,2014,35(6):269-272.
WANG H Y,DONG W B,XIU X H.Macroporous adsorption resin for apple polyphenols in apple juice concentrate and HPLC detection[J].The Food Industry,2014,35(6):269-272.
[4]李涛.苹果渣中多酚的提取分离技术研究[D].咸阳:西北农林科技大学,2007.
LI T.Research of extraction and isolation of polyphenol from apple pomace[D].Xianyang:Northwest A&F University,2007.
[5]ZHAO D J,LAU E,PADILLA-ZAKOUR O I,et al.Role of pectin and haze particles in membrane fouling during cold microfiltration of apple cider[J].Journal of Food Engineering,2017,200(4):47-58.
[6]BEVERIDGE T,VETO L,HARRISON J E.Formation of chain-like structures in apple juice haze[J].LWT-Food Science and Technology,1998,31(1):74-77.
[7]WU L C,SIEBERT K J.Characterization of hazeactive proteins in apple juice[J].Journal of Agricultural and Food Chemistry,2002,50(13):3828-3834.
[8]WATRELOT A A,SCHULZ D L,KENNEDY J A.Wine polysaccharides influence tannin-protein interactions[J].Food Hydrocolloids,2017,63(1):571-579.
[9]ZHU D S,FU H,SHEN Y S,et al.Simultaneous analysis on phenolic substance in cloudy apple juice by HPLC[J].IOP Conference Series:Materials Science and Engineering,2020,711(1):012094.
[10]RAJAURIA G.Optimization and validation of reverse phase HPLC method for qualitative and quantitative assessment of polyphenols in seaweed[J].Journal of Pharmaceutical and Biomedical Analysis,2018,148(4):230-237.
[11]ROBU T,LEONTE C,GILE E,et al.Impact of chemicals on derivatives with important therapeutic activity in Calendula officinalis L.flores[J].Environmental Engineering and Management Journal,2010,9(1):33-37.
[12]KOSINSKA A,KARAMAC M,PENKACIK K,et al.Interactions between tannins and proteins isolated from broad bean seeds (Vicia faba Major) yield soluble and non-soluble complexes[J].European Food Research and Technology,2011,233(2):213-222.
[13]LAKOWICZ J R.Principles of fluorescence spectroscopy[M].Berlin:Springer,2006:277-330.
[14]BOSE A.Interaction of tea polyphenols with serum albumins:A fluorescence spectroscopic analysis[J].Journal of Luminescence,2016,169(1):220-226.
[15]CHEN J,XIN Y J,XIAO Q C,et al.Effect of temperature on the metronidazole-BSA interaction:Multi-spectroscopic method[J].Journal of Molecular Structure,2008,876(1/2/3):121-126.
[16]HASNI I,BOURASSA P,HAMDANI S,et al.Interaction of milk α-and β-caseins with tea polyphenols[J].Food Chemistry,2011,126(2):630-639.
[17]李爽.金属有机骨架材料的制备及其在污染物去除和分析中的应用[D].青岛:青岛理工大学,2018.
LI S.Prepapation of metal-organic frameworks and theirapplications in pollutant removal and analysis[D].Qingdao:Qingdao University of Technology,2018.
[18]李从虎,吴彦,马兴红,等.基于荧光光谱技术研究胶原蛋白溶液中分子的聚集行为[J].光谱学与光谱分析,2019,39(7):2023-2028.
LI C H,WU Y,MA X H,et al.Aggregation behavior of collagen molecules in aqueous solution based on fluorescence spectroscopy tecchnology [J].Spectroscopy and Spectral Analysis,2019,39(7):2023-2028.
[19]XI P S,ZHU D S,SHEN Y S,et al.Effect of pH on the interaction of major phenolic compounds in apple juice with gliadin[J].IOP Conference Series:Earth and Environmental Science,2021,692(3):032078.
[20]GEETHANJALI H S,NAGARAJA D,MELAVANKI R M.Exploring the mechanism of fluorescence quenching in two biologically active boronic acid derivatives using Stern-Volmer kinetics[J].Journal of Molecular Liquids,2015,209(1):669-675.
[21]向云亚,徐晶晶.荧光光谱法研究6-姜酚与牛血清蛋白的相互作用[J].贵州医药,2019,43(4):17-19.
XIANG Y Y,XU J J.Interaction effects between 6-gingerol and bovine serum albumin by fluores cence spectroscopy [J].Guizhou Medical Journal,2019,43(4):17-19.
[22]VON STASZEWSKI M,JARA F L,RUIZ A,et al.Nanocomplex formation between beta-lactoglobulin or caseinomacropeptide and green tea polyphenols:Impact on protein gelation and polyphenols antiproliferative activity[J].Journal of Functional Foods,2012,4(4):800-809.
[23]BOU-ABDALLAH F,SPRAGUE S E,SMITH B M,et al.Binding thermodynamics of diclofenac and naproxen with human and bovine serum albumins:A calorimetric and spectroscopic study[J].Journal of Chemical Thermodynamics,2016,103(1):299-309.